中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 施鑫磊, 方韵颖, 尉俏女, 王佳堃, 斯越秀, 陈忠法, 钱国英, 尹尚军, 王谦. 2021
- Xinlei Shi, Yunying Fang, Qiaonü Wei, Jiakun Wang, Yuexiu Si, Zhongfa Chen, Guoying Qian, Shangjun Yin, Qian Wang. 2021
- 一种来源于喜热梭孢壳的耐热型β-甘露聚糖酶
- Characterization of a hyperthermostable β-mannanase from Thermothelomyces thermophilus
- 微生物学报, 61(9): 2815-2828
- Acta Microbiologica Sinica, 61(9): 2815-2828
-
文章历史
- 收稿日期:2020-11-11
- 修回日期:2021-02-06
- 网络出版日期:2021-06-11
2. 浙江大学动物科学学院, 浙江 杭州 310058;
3. 浙江中医药大学基础医学院, 浙江 杭州 310053
2. College of Animal Sciences, Zhejiang University, Hangzhou 310058, Zhejiang Province, China;
3. School of Basic Medical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, Zhejiang Province, China
甘露聚糖是植物细胞壁中的一种半纤维素组分,由于消化道中缺乏有效的消化酶,猪、鸡等单胃动物或人类难以将其降解或利用。甘露聚糖酶是一类具有半纤维素酶活性或兼具半纤维素酶和纤维素酶活性的糖苷水解酶(glycoside hydrolase,GH),能够水解甘露聚糖、葡萄甘露聚糖、半乳甘露聚糖或半乳葡萄甘露聚糖。根据序列、结构和功能特征,碳水化合物活性酶数据库(http://www.cazy.org/)[1]将甘露聚糖酶主要分为β-甘露聚糖酶(β-mannanase,EC3.2.1.78)和β-甘露糖苷酶(β-mannosidase,EC3.2.1.23)。此外,β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21)、乙酰甘露聚糖酯酶(acetyl mannan esterase, EC3.1.1.6)和α-半乳糖苷酶(α-galactohydrolase,EC3.1.1.22)等也能参与甘露聚糖侧链基团的降解[2]。其中,β-甘露聚糖酶是最关键的一种水解酶,它以内切方式打断多聚糖主链上的β-1, 4-糖苷键,使其降解成为低聚糖或单糖,在饲料和食品领域应用广泛[2-3]。例如,在饲粮中添加甘露聚糖酶能有效消除甘露聚糖的抗营养作用,且生成的低聚糖能有效促进动物消化道中双歧杆菌、乳酸菌等有益菌的增殖,具有调节肠道菌群平衡、提高机体免疫力等生理特性[4-5]。
β-甘露聚糖酶来源众多,广泛存在于微生物、植物甚至动物中。早期的研究主要集中在产酶菌株的筛选和发酵条件的优化、酶的分离纯化和性质的研究、酶水解作用机理以及酶基因克隆和外源表达等方面。国内外对于甘露聚糖酶及其生产菌的研究开始于20世纪70年代末,初步统计已发现100余种微生物能够产生甘露聚糖酶,包括细菌、真菌和放线菌等。其中研究较多的是细菌中的枯草芽孢杆菌(Bacillus subtilis)、铜绿假单胞菌(Pseudomonas aeruginosa),真菌中的曲霉菌(Aspergillus spp.)、里氏木霉(Trichoderma reesei)及放线菌中的链霉菌(Streptomyces spp.)等[6-7]。然而,目前已报道的甘露聚糖酶往往难以同时满足工业生产对酶活性、反应温度和pH等多方面的要求,不能满足实践工业生产的实际需求。因此,获取满足工业生产和应用需求的高活性或良好稳定性的酶长期以来是研究人员关注的焦点。
喜热梭孢壳(Thermothelomyces thermophilus),旧称嗜热毁丝霉(Myceliophthora thermophila),是一种丝状子囊真菌,其最适生长温度约为45 ℃,且具备较强的纤维素降解能力,可用于挖掘优良耐热碳水化合物活性酶基因[8-9]。因此,本研究从喜热梭孢壳中克隆甘露聚糖酶基因Mtman1,利用毕赤酵母表达系统进行异源表达,分析重组蛋白的酶学性质和热处理过程中蛋白构象变化情况,为耐热型酶制剂的研发建立基础。
1 材料和方法 1.1 实验材料 1.1.1 菌种与试剂:喜热梭孢壳即嗜热毁丝霉(M. thermophila,CICC2441)购于CICC菌种保藏中心;大肠杆菌(Escherichia coli) TOP 10F’本实验室保存;表达载体pET30a(+)购于Novagen公司;穿梭载体pPIC9K和表达宿主Pichia pastoris GS115 (his4)购自Invitrogen公司。真菌RNA提取和反转录试剂盒购自北京全式金公司;T4 DNA连接酶购自TaKaRa公司;2×Super Pfx Mastermix DNA聚合酶购自康为世纪公司;限制性核酸内切酶和PNGase F购自NEB公司。卡那霉素(kanamycin,Kan)、质粒提取试剂盒和40%丙烯酰胺/甲叉双丙烯酰胺(29:1)溶液购自上海生工公司;PCR产物纯化试剂盒、割胶回收试剂盒购自Axygen公司;多聚糖底物购自Sigma公司。LB (Luria-Bertani)、YPD (yeast extract peptone dextrose)、BMGY和BMMY培养基配制参照文献[10]的方法。其他化学试剂为分析纯,购自上海生工公司。
1.1.2 主要仪器:Mastercycler Pros PCR仪(Eppendorf)、Centrifuge5417R (Eppendorf)、DYY-12核酸电泳仪(北京六一公司)、PowerPacTM Basic蛋白电泳仪(BIO-RAD)、NanoDrop 2000超微量分光光度计(Thermo Scientific)、BioLogic LP层析仪(BIO-RAD)等。
1.2 基因克隆与序列分析参照试剂盒说明提取喜热梭孢壳总RNA,之后反转录获得cDNA。根据NCBI数据库报道的喜热梭孢壳GH5基因序列(GenBank No. XM_003667358)设计引物(表 1)。以喜热梭孢壳cDNA为模板,利用MtMAN1-EcoRⅠ/MtMAN1- Hind Ⅲ引物扩增获得该基因开放阅读框(open reading frame,ORF)序列,命名为Mtman1。扩增产物纯化后进行双酶切,连接pET-30a(+)载体后,热激转化TOP 10F′感受态菌体细胞。利用T7-F和T7-R引物进行菌落PCR筛选阳性转化子。提取pET30a(+)/Mtman1质粒,送上海生工公司测序验证。
| Primer name | Primer sequence (5′→3′)a | Purpose |
| MtMAN1-EcoR Ⅰ | CGAATTCATGCGCTGTTTAACTTCAAGG | Full-length cloning of Mtman1 |
| MtMAN1-Hind Ⅲ | CAAGCTTCTTCCGACCACGGTGATG | |
| T7-F | GGGAATTGTGAGCGGATAAC | Validation of E. coli recombinants |
| T7-R | CCCCTCAAGACCCGTTTAGA | |
| mMtMAN1-EcoR Ⅰ | CGAATTCGCCCCTGGCCGTTCCAA | Amplification of Mtman1 mature peptide |
| mMtMAN1-Not Ⅰ | CGCGGCCGC |
|
| α-factor | TACTATTGCCAGCATTGCTGC | Validation of yeast transformants |
| 3′AOX | GCAAATGGCATTCTGACATCC | |
| a: restriction sites were underlined and 6×His tag was boxed. | ||
利用SignalP5.0 (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽,采用DNAStar Lasergene 7、MEGA 7.0软件和在线工具ClusterW (https://www.genome.jp/tools-bin/clustalw)进行氨基酸比对和进化树分析,利用Pfam (http://pfam.sanger.ac.uk/search)分析蛋白结构域,利用Swiss-Model (https://www.swissmodel.expasy.org/interactive)对蛋白进行同源建模,利用NetNGlyc 1.0 (http://www.cbs.dtu.dk/services/NetNGlyc/)分析蛋白N-糖基化。
1.3 Mtman1在毕赤酵母中的表达利用mMtMAN1-EcoRⅠ和mMtMAN1-NotⅠ引物扩增pET30a(+)/Mtman1质粒获得成熟肽序列mMtman1,经EcoRⅠ和NotⅠ双酶切,连接至pPIC9K中,亚克隆及鉴定方法同上。利用BglⅡ对重组质粒pPIC9K/mMtman1进行线性化,电击(1800 V,4.5 ms)转化毕赤酵母GS115,利用MD培养基(1.34% YNB,4×10–5%生物素,2%葡萄糖)筛选重组转化子。采用氯化苄法提取酵母基因组,分别利用α-factor/3′AOX和mMtMAN1- EcoRⅠ/mMtMAN1-NotⅠ引物验证重组转化子。参照冯玉和等[10]的方法,利用0.5%甲醇诱导重组酵母工程菌GS115/pPIC9K/mMtman1 96 h分泌表达重组蛋白,每24 h取发酵上清液用于SDS-PAGE分析及蛋白浓度检测。
1.4 蛋白纯化与去糖基化分析将诱导后的发酵上清液于4 ℃、8000×g离心15 min。取上清用于HisTrapTM FF柱(GE Health. Bio-Sciences)进行亲和层析,20–500 mmol/L咪唑梯度洗脱目标蛋白。之后,利用Millipore Amicon® Ultra超滤除去咪唑,纯化蛋白用于后续试验。利用去糖基化酶PNGase F (1 U)处理MtMAN1蛋白(10 μg),30 ℃孵育1 h后用于SDS-PAGE分析。
1.5 酶学性质分析(1) 活性测定:以刺槐豆胶为底物,采用DNS定糖法[11]测定甘露聚糖酶活性。反应体系包含15 μL酶液(0.2 μg,下同)和60 μL 0.5%刺槐豆胶,70 ℃反应10 min后,加入75 μL DNS试剂,立即置于99 ℃孵育10 min。待冷却至室温后,测定OD540吸光值,设4组平行试验。同时,以99 ℃加热失活的酶蛋白为对照。将在最适反应条件下,每min降解底物生成1 μmol还原糖所需要的酶量定义为一个酶活单位(U)。采用Bradford法测定蛋白浓度[12]。
(2) 最适pH:分别用pH 2.2–10.0的缓冲液(柠檬酸/磷酸缓冲液pH 2.2–8.0;Tris-HCl缓冲液pH 8.0–9.0;甘氨酸/氢氧化钠缓冲液pH 9.0–10.0)配制0.5%刺槐豆胶底物,按上述反应体系在最适反应温度下反应10 min,测定甘露聚糖酶活性。以最适pH下的活性为100%,计算各pH条件下的相对活性。
(3) 最适温度:将最适反应pH配制的底物与MtMAN1蛋白混合,按上述反应体系分别置于40–100 ℃,pH 6.0下反应10 min,测定甘露聚糖酶活性。以最适温度下的活性为100%,计算不同温度下的相对活性。
(4) pH稳定性:分别将15 μL用pH 2.2–10.0的缓冲液配制的酶蛋白在25 ℃下孵育1 h,之后分别加入60 μL 0.5%刺槐豆胶,在最适反应条件下测定甘露聚糖酶活性。以处理前的酶活为100%,计算各pH条件处理后的残余活性。
(5) 热稳定性:将400 μL用pH 6.0缓冲液配制的酶蛋白分别置于60–100 ℃下孵育1 h,于0、5、10、20、30、60 min取样15 μL。之后,分别加入60 μL 0.5%刺槐豆胶,在最适反应条件下测定甘露聚糖酶活性。以处理前的酶活为100%,计算不同温度处理后的残余活性。
1.6 底物专一性与动力学参数测定分别配制0.1–15.0 mg/mL的甘露聚糖(刺槐豆胶、魔芋胶、黄原胶、瓜尔胶)、山毛榉木聚糖和纤维素(羧甲基纤维素、微晶纤维素)底物,在70 ℃、pH 6.0下反应10 min,测定甘露聚糖酶活性。利用GraphPad Prism 8计算Km及Vmax。
1.7 热聚沉和构象分析将纯化后的MtMAN1 (约30 μg)分别于60、70、80、90 ℃下孵育0.5 h或100 ℃下孵育1-24 h。4 ℃、10000×g离心10 min,SDS-PAGE检测上清中的可溶蛋白。同时,采用圆二色谱法(circular dichroism,CD)和内源荧光法分析热处理过程中蛋白构象的变化情况。使用MOS-500圆二色谱仪(BioLogic Science Instruments,Claix,France),将溶于2 mmol/L HEPES缓冲液的MtMAN1(约0.1 mg/mL)在波长为190-250 nm条件下分析蛋白二级结构。以未经热处理的蛋白为阳性对照。利用Dicroprot (https://dicroprot-prabi.ibcp.fr/)计算α-螺旋、β-折叠链和无规则卷曲的比例。利用荧光分光光度计F-2500 (Hitachi,Japan)在激发波长277 nm、发射波长300-400 nm范围内测定各处理条件下MtMAN1蛋白的荧光光谱和最大发射波长变化。
1.8 金属离子对MtMAN1活性的影响将不同浓度的(0.05、0.10、0.50、1.00 mmol/L)的金属离子(Fe2+、Ni2+、Cu2+、Ca2+、Mg2+和Zn2+)与MtMAN1在37 ℃下孵育1 h,测定甘露聚糖酶活性。以处理前的酶活为100%,计算离子处理后的残余活性。
2 结果和分析 2.1 Mtman1基因克隆与序列分析从喜热梭孢壳cDNA扩增获得一个ORF长度为1230 bp的Mtman1基因(GenBank No. QMV47764.1),编码409个氨基酸,其中前20个氨基酸为信号肽序列。利用Pfam和Swiss-Model在线工具分析发现该蛋白属于糖苷水解酶GH5家族,呈现该家族典型的(β/α)8桶状结构特征,潜在催化残基为Glu203位和Glu320 (图 1)。MtMAN1与Berka等[8]采用比较基因组学方法获得喜热梭孢壳(T. thermophilus ATCC42464)的GH5蛋白(GenBank No. XP_003667406)相似度达98.54%,但该蛋白功能未被研究。此外,MtMAN1与来自腐质霉(Humicola insolens) Y1的甘露聚糖酶Man5A (GenBank No. ADZ99301)[13]相似度为83.82%,且亲缘关系最近(图 2)。
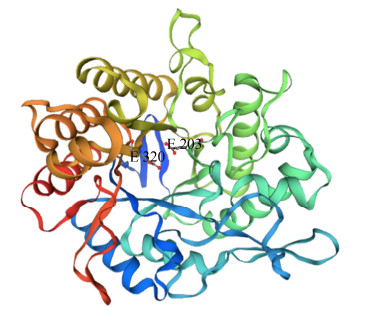
|
| 图 1 MtMAN1三维结构分析 Figure 1 Three-dimensional structure prediction of MtMAN1. Three-dimensional structure of MtMAN1 was established using SWISS-MODEL and poteintial catalytic residues were predicted using CLUSTALW align to the Humicola sp. Y1 β-mannanase (GenBank No. ADZ99301). |

|
| 图 2 MtMAN1系统发育树分析 Figure 2 Phylogenetic tree analysis of MtMAN1. Phylogenetic analysis of the amino acid sequence of MtMAN1 and β-mannanase from different family sources. The phylogenetic tree analysis was constructed using the Neighbor-Joining (NJ) method using MEGA X. The number near the branch line indicates the percentage of reliability of the branch in the test (Sequences were all from GenBank). |
2.2 MtMAN1的重组表达
SDS-PAGE分析显示,随着甲醇诱导时间增加,发酵上清液中MtMAN1蛋白浓度逐渐上升。经0.5%甲醇诱导72 h后,上清液中重组蛋白的浓度为0.15 mg/mL。重组MtMAN1蛋白的分子量约为60 kDa,较之理论分子量44.1 kDa有所增加,推测酵母表达的重组MtMAN1蛋白发生翻译后修饰所致(图 3-A)。利用去糖基化酶PNGase F处理后,蛋白分子量降低至约50 kDa (图 3-B),表明该蛋白存在N-糖基化。在线工具分析显示,Asn114/337/368符合N-糖基化位点(N-X-S/T)特征,可能发生N-糖基化修饰。

|
| 图 3 重组MtMAN1蛋白表达与去糖基化分析 Figure 3 Expression and deglycosylation of recombinant MtMAN1. A: MtMAN1 in culture supernatant of recombinant Pichia pastoris. Lanes 1–5: samples obtained at 0, 24, 48, 72. 96 h. B: deglycosylation of MtMAN1. Lane 1: MtMAN1; lane 2: deglycosylated MtMAN1; M: marker. |
2.3 MtMAN1酶学性质分析
酶学性质分析表明(图 4),MtMAN1的最适反应pH和温度分别为6.0和70 ℃。该酶在80、90、100 ℃下的酶活性分别是70 ℃的(81.01±2.60)%、(74.03±6.94)%和(46.60±1.75)%;在pH 5.0–8.0下处理1 h仍能保持78%以上残余活性;此外,MtMAN1在60 ℃下十分稳定,处理1 h后几乎能保持100%活性。值得注意的是,在80、90、100 ℃下处理10 min后,MtMAN1仍能维持(68.23±7.47)%、(56.01±5.69)% 和(14.91±2.92)%残余活性,提示MtMAN1是一种pH中性的耐热酶。
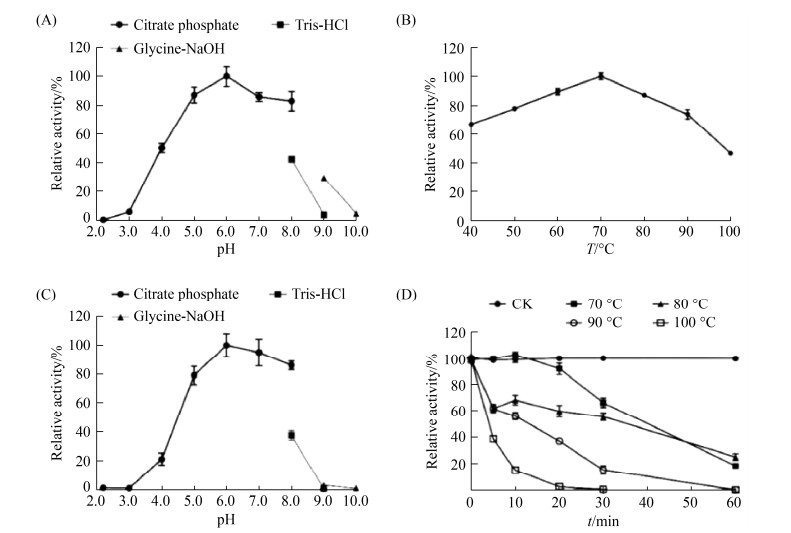
|
| 图 4 MtMAN1酶学性质分析 Figure 4 Enzymatic characterization of MtMAN1. A: optimal pH; B: optimal temperature; C: pH stability; D: thermostability. Data represent the mean±SD (n=4). |
底物特异性分析显示(表 2),MtMAN1催化刺槐豆胶底物的Km和Vmax分别为4.28±0.73 mg/mL和203.9±14.61 μmol/(s·mg)。同时,MtMAN1对魔芋胶也有一定的降解能力,然而对黄原胶、瓜尔胶、木聚糖和纤维素则没有催化作用。
| Substrates | Vmax/[μmol/(min·mg protein)] | Km/(mg/mL) | kcat/(1/s) | kcat/Km/ [m/(mg·s)] | |
| Mannan | Locust bean gum | 203.9±14.61 | 4.28±0.73 | 150.2±10.76 | 35.07±2.51 |
| Konjac gum | 49.45±5.04 | 3.94±0.47 | 36.41±3.71 | 9.24±0.94 | |
| Xanthan gum | ND | ND | ND | ND | |
| Guar gum | ND | ND | ND | ND | |
| Xylan | Beechwood xylan | ND | ND | ND | ND |
| Cellulose | Carboxyl methyl cellulose | ND | ND | ND | ND |
| Microcrystalline cellulose | ND | ND | ND | ND | |
| a: kinetic parameters of MtMAN1 were determined using 0.1–15.0 mg/mL various mannan substrates. Data represent the mean±SD (n=4). ND: not detected. | |||||
2.4 热聚沉和构象分析
通过热聚沉试验分析MtMAN1的热稳定性可以发现,经60–100 ℃处理0.5 h后,绝大多数MtMAN1仍处于可溶状态(图 5-A)。在60–90 ℃下处理0.5 h后荧光强度减小(图 5-B),提示蛋白逐渐变性、发生去折叠,Trp残基等生色基团从疏水内部向外部移动,逐渐暴露在极性水环境中。然而,该条件下蛋白的最大发射波长没有改变,仍为340 nm。MtMAN1呈现GH5家族典型的(β/α)8桶状结构特征,其二级结构主要为α-螺旋(图 1)。经热处理后,蛋白的α-螺旋比例[对照组为(27±3)%,60-90 ℃处理组分别为(25±1)%、(24±1)%、(25±1)%和(22±2)%]也没有发生显著变化(图 5-C和5D),提示蛋白分子整体仍处于较为紧密的结构状态。这与前文热稳定性试验结果相一致,即经70、80、90 ℃处理0.5 h后,MtMAN1仍可保留(66.29±7.35)%、(55.59±5.85)%和(15.15±6.20)%的留活性(图 4-D)。当温度升高至100 ℃时,α-螺旋比例显著下降(P < 0.05) (图 5-D),表明结构遭到严重破坏,活性完全丧失(图 4-D)。

|
| 图 5 MtMAN1在不同温度下处理后的蛋白聚沉和构象分析 Figure 5 Aggregation and conformational analysis of MtMAN1 treated at different temperatures. A: SDS-PAGE analysis of protein aggregation. M: marker; lane 1: control; lanes 2–6: incubated at 60–100 ℃ for 0.5 h. B: intrinsic fluorescence emission spectra. The inset plot shows the maximum fluorescens intensity of MtMAN1 boiled for indicated time. Statistical significance was analyzed using a two-tailed Student's t-test and indicated by asterisks. C: CD analysis. D: secondary structure composition. *: P < 0.05. Data represent the mean±SD (n=4). |
进一步延长MtMAN1蛋白在100 ℃下孵育的时间发现,经100 ℃处理1–6 h后,MtMAN1逐渐发生聚沉(图 6-A)。虽然最大发射波长仍为340 nm (图 6-B),但荧光强度下降并伴随着中α-螺旋的比例显著下降(P < 0.01) (图 6-C–6-D),提示蛋白结构遭到严重破坏,活性完全丧失。经100 ℃处理24 h后,利用考马斯亮蓝G250染色法在上清中几乎检测不到可溶蛋白。同时,MTMAN1的荧光强度大幅度下降,蛋白中α-螺旋的比例下降至15%±1% (P < 0.01) (图 6-D),且最大发射波长发生红移,增加至344 nm (P < 0.01) (图 6-B)。以上结果提示MtMAN1结构遭到严重破坏,在发生蛋白去折叠的同时,疏水表面过多暴露在环境中,最终引起严重的聚沉现象。

|
| 图 6 MtMAN1在100 ℃下处理不同时间后的蛋白聚沉和构象分析 Figure 6 Time-course aggregation and conformational changes of MtMAN1 treated at 100 ℃. A: SDS-PAGE analysis of protein aggregation. M: marker; lane 1: control; lanes 2–6: boiled at 100 ℃ for 1, 2, 4, 6, 24 h. B: Intrinsic fluorescence emission spectra. The inset plot shows the maximum fluorescens intensity of MtMAN1 boiled for indicated time. Statistical significance was analyzed using a two-tailed Student's t-test and indicated by asterisks. C: CD analysis. D: secondary structure composition. *: P < 0.05; **: P < 0.01. Data represent the mean±SD (n=4). |
2.5 金属离子对MtMAN1活性的影响
分析金属离子对MtMAN1酶活的影响结果显示(图 7),0.05–1.00 mmol/L Ni2+对MtMAN1活性均表现出强烈的抑制作用(P < 0.05);较低浓度的Fe2+ (< 0.1 mmol/L)、Cu2+ (< 0.1 mmol/L)、Ca2+ (< 0.5 mmol/L)、Mg2+ (< 0.1 mmol/L) 或Zn2+ (< 0.1 mmol/L)没有表现出MTMAN1活性的抑制作用,仅在高浓度(0.5或1.0 mmol/L)下表现出抑制活性;然而,0.1 mmol/L Ca2+ (P < 0.01)、0.05 mmol/L Cu2+或Mg2+ (P < 0.05)却能促进MtMAN1的催化作用。
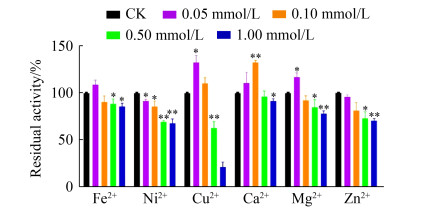
|
| 图 7 金属离子对MtMAN1活性的影响 Figure 7 Effect of metal ions on MtMAN1 activity. The initial activities before preincubation were taken as 100%. Data represent the mean±SD (n=4). Statistical significance was analyzed using a two-tailed Student's t-test and indicated by asterisks. *: P < 0.05; **: P < 0.01. |
3 讨论
绝大多数酶的化学本质是蛋白质,在高温条件下易发生构象改变从而失去活性,因此如何获取良好热稳定性的酶蛋白长期以来一直是研究人员关注的焦点。20世纪70年代,Chien等[14]从来自黄石公园温泉的嗜热细菌水生栖热菌(Thermus aquaticus)中分离获得耐热的Taq DNA聚合酶,使得PCR热循环过程中不需要因DNA聚合酶失活而重新添加该酶,大大推动了PCR技术和现代分子生物学的发展。
天然多糖刺槐豆胶和魔芋胶的主要成分为甘露聚糖,常用作甘露聚糖酶的反应底物。甘露聚糖酶是一种重要的饲用酶制剂,饲料制粒工艺的温度通常达85 ℃甚至100 ℃以上,因而对酶蛋白的热稳定性要求较高。表 3列举了近年来研究报道的甘露聚糖酶的基本性质,从中可以得知多数环境微生物来源的甘露聚糖酶属于中温酶,最适反应温度为30–60 ℃。来自米曲霉(Aspergillus oryzae)的AoMan134A[15]和枯草芽孢杆菌(B. subtilis) G1的ManA[16]的最适温度分别仅为30 ℃和45 ℃,热纤梭菌(Clostridium thermocellum)来源的CtManT和CtManF[17]、枯草芽孢杆菌(B. subtilis)来源的ReTMan26[18]、芽孢杆菌(Bacillus sp.) SWU60来源的ManS2[19]及Enterobacter ludwigii来源[20]的甘露聚糖最佳反应温度均为50–60 ℃。本研究获得的喜热梭孢壳甘露聚糖酶MtMAN1最适反应温度为70 ℃ (图 4-B)。并且,该酶在80、90、100 ℃下的酶活性分别是70 ℃的(81.01±2.60)%、(74.03±6.94)%和(46.60±1.75)%,可见其具有良好的耐热性能,与中温酶相比具有更好的工业化应用前景。
| Classification | Enzymes | Substrates | Vmax/(U/mg)a | Optimum temperature/ ℃ | Thermostabilitiy/ (℃/min/%) b | References | |
| Mesophilic mannanases | Aspergillus oryzae Man134A | Locust bean gum | 1170 | 30 | 60/60/–60 | [15] | |
| Bacillus subtilis ManA | Locust bean gum | 2718 | 45 | 60/120/–40 | [16] | ||
| Clostridium thermocellum CtManT | Locust bean gum | 97.0 | 50 | 70/60/–40 | [17] | ||
| Clostridium thermocellum CtManF | Locust bean gum | 91.0 | 60 | 70/60/–75 | [17] | ||
| Enterobacter ludwigii mannanase | Konjac gum locust bean gum |
4510 58.0%a |
55 | 60/60/–60 | [18] | ||
| Bacillus sp. ManS2 | Locust bean gum konjac gum |
14.0 179% |
60 | 70/60/–40 | [19] | ||
| Bacillus subtilis ReTMan26 | Locust bean gum | 1653 | 60 | 70/60/–75 | [20] | ||
| Thermophilic mannanases | Rhizomucor miehei mRmMan5A | Locust bean gum konjac gum guar gum |
10755 53.6% 16.0% |
65 | 70/30/–50 | [21] | |
| Bacillus pumilus mannanase | Locust bean gum konjac gum |
2778 89.7%a |
65 | 70/60/ < 10 | [22] | ||
| Thermothelomyces thermophilus MTMAN1 | Locust bean gum konjac gum |
203.9 24.3% |
70 | 70/60/18 70/30/66 80/30/56 |
This study | ||
| Thielavia arenaria Man5XZ7 | Locust bean gum konjac gum guar gum |
730.4 60.5%a 28.6%a |
75 | 70/60/ < 10 | [23] | ||
| Aspergillus nidulans Man5XZ3 | Locust bean gum konjac gum guar gum |
270.2 61.5%a 41.2%a |
80 | 60/240/48 | [24] | ||
| Neosartorya fischeri rMan5P1 | Locust bean gum | 1937 | 80 | 70/30/–35 | [25] | ||
| Talaromyces leycettanu Man5A2 | Locust bean gum | 3501 | 85 | 70/60/–40 80/10/ < 10 |
[26] | ||
| Talaromyces leycettanu Man5A1 | Locust bean gum | 3092 | 90 | 70/60/–100 80/10/–75 |
[26] | ||
| a: percentage to activity against its optimal substrate; b: percentage to the initial activity before heat challenge. | |||||||
从表 3可以得知,近年来报道的多数耐热甘露聚糖酶的最适反应温度为60–80 ℃[21-25]。其中,米黑根毛霉(Rhizomucor miehei)[21]来源的mRmMan5A、短小芽孢杆菌(B. pumilu)来源的甘露聚糖酶[22]、Thielavia arenaria XZ7来源的Man5XZ7[23]和费氏新萨托菌(Neosartorya fischer)来源的rMan5P1[25]虽然最适反应温度较高,但耐热性能并不理想,在70 ℃下反应60 min后残余活性均小于50%,限制了其在饲料制粒等工艺过程中的应用。本研究中获得的MtMAN1经80 ℃处理30 min后,仍能保持(55.59±5.85)%残余活性(图 4-D),热稳定性明显优于上述报道。值得一提的是,中国农业科学研究院姚斌院士团队从嗜热真菌Talaromyces leycettanus JCM12802中克隆获得的Man5A1的最适反应温度可达90 ℃,在70 ℃下处理60 min或80 ℃下处理2 min活性几乎不丧失(~100%)[26]。该酶热稳定性优良且催化活性较高,因而具有广阔的应用前景。
荧光光谱法可以通过测定荧光物质或受激发光激发后的氨基酸残基(如Trp、Tyr、Phe等芳香族氨基酸)在吸收特定频率辐射能量后,由基态跃迁至激发态过程中产生荧光来分析蛋白质的结构。本研究分析MtMAN1在热聚沉过程的活性与蛋白结构变化情况时发现,MtMAN1在60 ℃处理0.5 h后,酶活性基本不损失(图 4-D),蛋白处于可溶状态,荧光强度、最大发射波长及二级结构基本没有变化(图 5),表明该酶在60 ℃下比较稳定;在70 ℃下处理0.5 h后,MtMAN1仍能保持较高活性,随着孵育时间继续延长,活性迅速下降;在80–90 ℃下处理0.5 h后,MtMAN1活性迅速降低甚至失活。分析60–90 ℃热处理结果可以发现,虽然MtMAN1的荧光强度下降,但部分蛋白仍处于可溶状态,且最大发射波长及二级结构也没有明显变化,提示蛋白的基本构象总体保持稳定,在底物催化中心等关键位点可能发生构象改变,影响了酶的催化活性。将MtMAN1在100 ℃处理1–24 h后,蛋白荧光强度进一步下降,甚至发生最大发射波长红移4 nm (P < 0.01),推测长时间高温处理引起蛋白中芳香族氨基酸残基所处的微环境发生改变,芳香族氨基酸残基逐渐从疏水环境暴露到亲水环境中,从而导致荧光淬灭[27]。同时,α-螺旋、β-折叠等二级结构明显发生改变,表明该蛋白构象剧烈变化、结构发生崩塌,直至形成聚沉(图 6)。与已报道的微生物来源甘露聚糖酶相比,本研究所获得的MtMAN1的耐热性能具有一定优势,但催化活性相对较低。因此,后续可以采用对关键催化位点进行定点突变、化学修饰或基于高通量文库筛选的定向进化技术进一步提升其催化能力。
综上所述,本研究克隆并异源表达一种来自喜热梭孢壳的甘露聚糖酶MtMAN1。该酶对刺槐豆胶和魔芋胶具有较强的催化能力,且热稳定性良好,具有较好的工业应用前景。
| [1] | Lombard V, Golaconda Ramulu H, Drula E, Coutinho PM, Henrissat B. The carbohydrate-active enzymes database (CAZy) in 2013. Nucleic Acids Research, 2014, 42(D1): D490-D495. DOI:10.1093/nar/gkt1178 |
| [2] | Moreira LRS, Filho EXF. An overview of mannan structure and mannan-degrading enzyme systems. Applied Microbiology and Biotechnology, 2008, 79(2): 165-178. DOI:10.1007/s00253-008-1423-4 |
| [3] | Zhou C, Xue YF, Ma YH. Characterization and high-efficiency secreted expression in Bacillus subtilis of a thermo-alkaline β-mannanase from an alkaliphilic Bacillus clausii strain S10. Microbial Cell Factories, 2018, 17(1): 1-19. DOI:10.1186/s12934-017-0850-2 |
| [4] | Lei Z, Shao YX, Yin XN, Yin DF, Guo YM, Yuan JM. Combination of xylanase and debranching enzymes specific to wheat Arabinoxylan improve the growth performance and gut health of broilers. Journal of Agricultural and Food Chemistry, 2016, 64(24): 4932-4942. DOI:10.1021/acs.jafc.6b01272 |
| [5] | Kalidas NR, Saminathan M, Ismail IS, Abas F, Maity P, Islam SS, Manshoor N, Shaari K. Structural characterization and evaluation of prebiotic activity of oil palm kernel cake mannanoligosaccharides. Food Chemistry, 2017, 234: 348-355. DOI:10.1016/j.foodchem.2017.04.159 |
| [6] | Hägglund P, Eriksson T, Collén A, Nerinckx W, Claeyssens M, Stålbrand H. A cellulose-binding module of the Trichoderma reesei β-mannanase Man5A increases the mannan-hydrolysis of complex substrates. Journal of Biotechnology, 2003, 101(1): 37-48. DOI:10.1016/S0168-1656(02)00290-0 |
| [7] | Ma YH, Xue YF, Dou YT, Xu ZH, Tao WY, Zhou PJ. Characterization and gene cloning of a novel beta-mannanase from alkaliphilic Bacillus sp. N16-5. Extremophiles, 2004, 8(6): 447-454. DOI:10.1007/s00792-004-0405-4 |
| [8] | Berka RM, Grigoriev IV, Otillar R, Salamov A, Grimwood J, Reid I, Ishmael N, John T, Darmond C, Moisan MC, Henrissat B, Coutinho PM, Lombard V, Natvig DO, Lindquist E, Schmutz J, Lucas S, Harris P, Powlowski J, Bellemare A, Taylor D, Butler G, de Vries RP, Allijn IE, van den Brink J, Ushinsky S, Storms R, Powell AJ, Paulsen IT, Elbourne LDH, Baker SE, Magnuson J, LaBoissiere S, John Clutterbuck A, Martinez D, Wogulis M, de Leon AL, Rey MW, Tsang A. Comparative genomic analysis of the thermophilic biomass-degrading fungi Myceliophthora thermophila and Thielavia terrestris. Nature Biotechnology, 2011, 29(10): 922-927. DOI:10.1038/nbt.1976 |
| [9] | Matsakas L, Antonopoulou I, Christakopoulos P. Evaluation of myceliopthora thermophila as an enzyme factory for the production of thermophilic cellulolytic enzymes. BioResources, 2015, 10(3): 5140-5158. |
| [10] |
Feng YH, Sun XB, Chen SX, Zhang HE, Shi XL, Zhou YB, Qian GY, Yin SJ, Wang Q. Heterologous expression and characterization of Aspergillus oryzae lytic polysaccharide monooxygenases. Acta Microbiologica Sinica, 2020, 60(1): 183-199.
(in Chinese) 冯玉和, 孙小宝, 陈书昕, 张慧恩, 施鑫磊, 周叶波, 钱国英, 尹尚军, 王谦. 米曲霉裂解性多糖单加氧酶的异源表达与性质分析. 微生物学报, 2020, 60(1): 183-199. |
| [11] | Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, 1959, 31(3): 426-428. DOI:10.1021/ac60147a030 |
| [12] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [13] | Luo HY, Wang K, Huang HQ, Shi PJ, Yang PL, Yao B. Gene cloning, expression, and biochemical characterization of an alkali-tolerant β-mannanase from Humicola insolens Y1. Journal of Industrial Microbiology & Biotechnology, 2012, 39(4): 547-555. |
| [14] | Chien A, Edgar DB, Trela JM. Deoxyribonucleic acid polymerase from the extreme thermophile Thermus aquaticus. Journal of Bacteriology, 1976, 127(3): 1550-1557. DOI:10.1128/jb.127.3.1550-1557.1976 |
| [15] | Sakai K, Mochizuki M, Yamada M, Shinzawa Y, Minezawa M, Kimoto S, Murata S, Kaneko Y, Ishihara S, Jindou S, Kobayashi T, Kato M, Shimizu M. Biochemical characterization of thermostable β-1, 4-mannanase belonging to the glycoside hydrolase family 134 from Aspergillus oryzae. Applied Microbiology and Biotechnology, 2017, 101(8): 3237-3245. DOI:10.1007/s00253-017-8107-x |
| [16] | Vu TTH, Quyen DT, Dao TT, Nguyen SLT. Cloning, high-level expression, purification, and properties of a novel endo-beta-1, 4-mannanase from Bacillus subtilis G1 in Pichia pastoris. Journal of Microbiology and Biotechnology, 2012, 22(3): 331-338. DOI:10.4014/jmb.1106.06052 |
| [17] | Ghosh A, Luís AS, Brás JLA, Fontes CMGA, Goyal A. Thermostable recombinant β-(1→4)-mannanase from C. thermocellum: biochemical characterization and manno-oligosaccharides production. Journal of Agricultural and Food Chemistry, 2013, 61(50): 12333-12344. DOI:10.1021/jf403111g |
| [18] | Yang M, Cai J, Wang CG, Du X, Lin JG. Characterization of endo-β-mannanase from Enterobacter ludwigii MY271 and application in pulp industry. Bioprocess and Biosystems Engineering, 2017, 40(1): 35-43. DOI:10.1007/s00449-016-1672-z |
| [19] | Seesom W, Thongket P, Yamamoto T, Takenaka S, Sakamoto T, Sukhumsirichart W. Purification, characterization, and overexpression of an endo-1, 4-β-mannanase from thermotolerant Bacillus sp. SWU60. World Journal of Microbiology and Biotechnology, 2017, 33(3): 1-12. |
| [20] | Luo ZC, Miao J, Li GY, Du Y, Yu XB. A recombinant highly thermostable β-mannanase (ReTMan26) from thermophilic Bacillus subtilis (TBS2) expressed in Pichia pastoris and its pH and temperature stability. Applied Biochemistry and Biotechnology, 2017, 182(4): 1259-1275. DOI:10.1007/s12010-017-2397-4 |
| [21] | Li YX, Yi P, Liu J, Yan QJ, Jiang ZQ. High-level expression of an engineered β-mannanase (mRmMan5A) in Pichia pastoris for manno-oligosaccharide production using steam explosion pretreated palm kernel cake. Bioresource Technology, 2018, 256: 30-37. DOI:10.1016/j.biortech.2018.01.138 |
| [22] | Zang HY, Xie SS, Wu HJ, Wang WD, Shao XK, Wu LM, Rajer FU, Gao XW. A novel thermostable GH5_7β-mannanase from Bacillus pumilus GBSW19 and its application in manno-oligosaccharides (MOS) production. Enzyme and Microbial Technology, 2015, 78: 1-9. DOI:10.1016/j.enzmictec.2015.06.007 |
| [23] | Lu HQ, Zhang HT, Shi PJ, Luo HY, Wang YR, Yang PL, Yao B. A family 5β-mannanase from the thermophilic fungus Thielavia arenaria XZ7 with typical thermophilic enzyme features. Applied Microbiology and Biotechnology, 2013, 97(18): 8121-8128. DOI:10.1007/s00253-012-4656-1 |
| [24] | Lu HQ, Luo HY, Shi PJ, Huang HQ, Meng K, Yang PL, Yao B. A novel thermophilic endo-β-1, 4-mannanase from Aspergillus nidulans XZ3:functional roles of carbohydrate-binding module and Thr/Ser-rich linker region. Applied Microbiology and Biotechnology, 2014, 98(5): 2155-2163. DOI:10.1007/s00253-013-5112-6 |
| [25] | Yang H, Shi PJ, Lu HQ, Wang HM, Luo HY, Huang HQ, Yang PL, Yao B. A thermophilic β-mannanase from Neosartorya fischeri P1 with broad pH stability and significant hydrolysis ability of various mannan polymers. Food Chemistry, 2015, 173: 283-289. DOI:10.1016/j.foodchem.2014.10.022 |
| [26] | Wang CH, Luo HY, Niu CF, Shi PJ, Huang HQ, Meng K, Bai YG, Wang K, Hua HF, Yao B. Biochemical characterization of a thermophilic β-mannanase from Talaromyces leycettanus JCM12802 with high specific activity. Applied Microbiology and Biotechnology, 2015, 99(3): 1217-1228. DOI:10.1007/s00253-014-5979-x |
| [27] | Huang JH, Xu YF, Qian XH. A red-shift colorimetric and fluorescent sensor for Cu2+ in aqueous solution: unsymmetrical 4, 5-diaminonaphthalimide with N-H deprotonation induced by metal ions. Organic & Biomolecular Chemistry, 2009, 7(7): 1299-1303. |
 2021, Vol. 61
2021, Vol. 61




