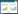中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王晟旭, 曹禹琪, 财音青格乐, 乔建军, 杨静华. 2021
- Chengxu Wang, Yuqi Cao, Qinggele Caiyin, Jianjun Qiao, Jinghua Yang. 2021
- 肺炎链球菌荚膜多糖O-乙酰化修饰的研究进展
- Research progress in O-acetylation of capsular polysaccharide of Streptococcus pneumoniae
- 微生物学报, 61(8): 2316-2337
- Acta Microbiologica Sinica, 61(8): 2316-2337
-
文章历史
- 收稿日期:2021-04-08
- 修回日期:2021-04-21
- 网络出版日期:2021-04-27
2. 内蒙古大学生命科学学院, 内蒙古 呼和浩特 010000;
3. 中国科学院微生物研究所真菌学国家重点实验室, 北京 100101
2. School of Life Science, Inner Mongolia University, Hohhot 010000, Inner Mongolia Autonomous Region, China;
3. State Key Laboratory of Mycology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
肺炎链球菌(Streptococcus pneumoniae)是人类重要致病菌,能引起严重的侵袭性疾病(invasive pneumococcal disease,IPD)如菌血症性肺炎、化脓性脑膜炎、脓胸、心包炎和腹膜炎等;也引起非侵袭性疾病如中耳炎、扁桃体炎和鼻窦炎等[1-2]。感染的高危人群包括5岁以下儿童、65岁以上老人以及存在基础疾病的患者。据世界卫生组织(WHO)估计,全球每年有超过160万人死于肺炎链球菌感染,其中约70–100万为婴幼儿[3]。在我国,5岁以下儿童死亡的首要原因是重症肺炎,其中侵袭性肺炎链球菌感染在重症肺炎儿童中的比例高达50%[4-5]。因此,肺炎链球菌严重威胁人类的健康。肺炎链球菌通过空气传播,首先在鼻咽部定植(colonization),粘附在粘膜上逃避宿主免疫系统的攻击和粘液的清理,形成生物膜(biofilm)并大量繁殖。在一定条件下,如流感病毒感染时生物膜破裂,肺炎链球菌从上呼吸道扩散到下呼吸道,到达肺泡表面并侵入肺组织引起肺炎,继而扩散到血液中引起菌血症和脓毒症,甚至穿过血脑屏障进入脑脊液引起脑膜炎[6-7]。
肺炎链球菌的致病因子包括荚膜多糖(capsular polysaccharide,CPS)、溶血素和表面蛋白[8],其中荚膜多糖是关键的致病因子[9]。覆盖于细菌表面的荚膜多糖不仅可以保护细菌不被鼻腔的粘液清除, 在营养缺陷时延长细菌的生存[10-11],还可屏蔽细菌表面的结构,抑制补体、免疫球蛋白和C反应蛋白的结合,保护细菌不被中性粒细胞、巨噬细胞和抗体等攻击[12]。更为重要的是,荚膜多糖作为抗原能够刺激宿主产生保护性抗体[13-14],因此强毒血清型的荚膜多糖被制成糖疫苗在临床上广泛应用[15]。早在1983年实施的23价荚膜多糖疫苗(PPV23)包括23个血清型的荚膜多糖,能覆盖几乎90%的肺炎链球菌引起的感染,对成人起到很好的保护作用,但是对儿童和老年人的免疫原性低。于是,2000年实施的7价多糖蛋白结合疫苗(PCV7)将7个血清型的荚膜多糖偶联到蛋白载体上以增强疫苗的免疫原性。疫苗实施3年,婴幼儿对这7个血清型引起的感染下降了94%[16]。但是随着PCV7的广泛应用,出现了血清型替换(serotype replacement)的问题[17-18],即非疫苗血清型的定植和致病增多,在临床分离株中所占的比例明显上升,如抗多种抗生素的血清型19A,血清群15和33中的血清型[19-20]。可能是PCV7疫苗带来的选择压力,使非疫苗血清型得以逃避宿主免疫系统的识别而成为新的临床流行株[18]。随后,13价疫苗(PCV13)被研发,在PCV7的基础上加入新的感染力强的血清型,以提高疫苗的效率。但是,血清型替换仍然是影响疫苗效率的一个潜在挑战。
1 荚膜多糖的血清学研究目前发现肺炎链球菌有100个血清型(serotype)[21-22]。每个血清型具有独一无二的荚膜多糖结构和血清学特征以及稳定的遗传基础。血清型可通过细菌荚膜和抗血清的肿胀反应(quellung reaction)来鉴定。抗血清是肺炎链球菌免疫兔子得到的血清。由于荚膜多糖上不同的结构都可以作为抗原表位(epitope)刺激机体产生不同的抗体,所以抗血清是多克隆抗体。在血清学研究中,与同一抗体有交叉反应的血清型被归为一个血清群(serogroup),表明它们的荚膜多糖中有部分化学结构是相同的,也即拥有部分相同的抗原表位。能特异识别抗原表位的抗体被称为抗血清因子(factor serum)。血清型与多个抗血清因子的Quellung反应的结果用抗原公式(antigenic formula)表示,反映了该血清型的血清学特征(serological profile)。另外,单克隆抗体也被用于鉴定血清型。美国阿拉巴马大学的Moon H. Nahm用单克隆抗体发现了血清群6和11中浮现的新的血清型[22-27]。我们也发现血清型10A的β1-6连接的吡喃半乳糖支链可被单克隆抗体识别,失去支链的血清型10B不与单克隆抗体反应[28]。因此,单克隆抗体可以鉴定多糖结构十分相似而难以用Quellung反应区分的血清型。此外,也可通过分子分型(genotyping)的方法鉴定血清型,该方法也有不足之处,因为我们发现血清型42中wciG基因的核苷酸序列是完整的,但是并没有产生相应的O-乙酰基转移酶,多糖结构中也没有相应的O-乙酰化修饰,因此这个基因没有表达[29]。
2 荚膜多糖的遗传基础、化学结构和合成途径20世纪80–90年代,随着遗传转化、荚膜替换、DNA杂交等方法的应用,人们发现合成荚膜多糖的基因在基因组上成簇排列,都位于基因组的dexB和aliA基因之间,被称为多糖合成位点(cps locus)[30-34]。如图 1-A所示,每个血清型的基因簇都含有4个调控基因(wzg、wzh、wzd、wze)、几个糖基转移酶基因、一个聚合酶基因(wzy)和一个转位酶基因(wzx);有的还含有合成酶基因用于合成荚膜多糖中的非管家单糖(non-housekeeping sugar),如血清型1基因簇的基因ugd、gla负责合成UDP-半乳糖醛酸(UDP-GalpA),基因rmlA、rmlB、rmlC、rmlD负责合成dTDP-L-rhamnose;有的还含有O-乙酰基转移酶基因以及醇磷酸转移酶基因用于修饰多糖。这些基因受共同的启动子调控,但是每个基因都有各自的核糖体结合位点,推测基因的翻译水平可能不同。管家单糖如葡萄糖(Glc)、半乳糖(Gal)、N-乙酰葡萄糖胺(GlcNAc)、N-乙酰半乳糖胺(GalNAc)、AAT-半乳糖(AATGal)都是由基因组上的管家基因合成,不需要多糖合成基因簇来合成。随着测序技术的迅猛发展,2006年Sanger研究所破译了90个血清型的荚膜多糖合成序列,并用生物信息学方法对每个基因做了注释[34]。据统计,有2000多个基因负责这些多糖的合成,其中包括342个糖基转移酶基因、78个O-乙酰基转移酶基因、69个磷酸转移酶基因、90个聚合酶基因和88个转位酶基因,还有一些合成酶基因以及功能未知的基因[28]。结合已知的多糖结构,这些酶的具体功能被预测[35];同时这些多糖合成位点被比较,血清型之间的亲缘关系被分析[36]。这些研究为深入了解肺炎链球菌荚膜多糖奠定了基础。多种多样的酶是肺炎链球菌血清型多样性的分子基础,但是鉴定这些酶的具体功能比如糖基转移酶的供体糖、受体糖和连接键一直是个难点。我们通过糖工程技术敲除或替换糖基转移酶基因,并解析遗传改造后的多糖结构,最终鉴定了血清群10中的糖基转移酶WcrD是将呋喃半乳糖(Galf)以β1-3糖苷键连接到双糖(GalNAcβ1-3Galα)上,而糖基转移酶WcrG是将Galf以β1-6糖苷键连接到这个双糖上[37]。通过检测不同多糖与抗血清因子的免疫反应,我们首次阐明了血清群10中的所有糖基转移酶负责合成的多糖结构及其对应的血清学特征[28]。

|
| 图 1 肺炎链球菌血清型1的荚膜多糖合成基因簇(A)、荚膜多糖的化学结构(B)、Wzy依赖的多糖合成途径(C) Figure 1 The cps locus of Streptococcus pneumoniae serotype 1 and putative functions of the gene products (A); the chemical structure of Streptococcus pneumoniae serotype 1 capsular polysaccharide (CPS1) consisting of three sugars and O-acetylation (OAc) in the repeat unit (B); the putative biosynthesis steps for CPS1 via Wzy-dependent biosynthesis pathway (C). Synthesis begins with the transfer of AAT-Gal-1-phosphate to Undecaprenyl phosphate (UndP) acceptor ①, and the repeat unit is sequentially assembled by glycosyltransferases ② and O-acetylated by O-acetyltransferase ③. The completed unit is then translocated to outside of membrane by Wzx ④ and polymerized by Wzy ⑤. Capsular polysaccharide is finally translocated to peptidoglycan by the protein complex ⑥. |
目前已经有77个血清型的荚膜多糖的化学结构被报道[21, 38-42]。它们是由2–8个单糖组成的重复单位聚合而成的线性多糖。以血清型1的荚膜多糖为例(图 1-B),它的重复单位由3个单糖组成,单糖之间通过不同的糖苷键连接,而且在半乳糖醛酸(GalpA)的第2、3位碳原子上还有30%的O-乙酰化修饰[21]。尽管多糖结构复杂,但是不同细菌的多糖合成途径是保守的。2011年,Janet Yother总结了肺炎链球菌荚膜多糖的生物合成途径[43]。除了结构最简单的血清型3和37是通过合成酶依赖途径合成荚膜多糖外[44-45],其他血清型的荚膜多糖都是通过聚合酶(Wzy)依赖途径合成[34, 43]。如图 1-C所示,该途径是在插入细胞膜内侧的十一异戊烯醇磷酸(UndP)受体上开始合成,需要核苷二磷酸-单糖(NDP-单糖)作为供体糖。首先,起始的糖基转移酶将第一个NDP-单糖中的1-磷酸-单糖连接到UndP上合成十一异戊烯醇焦磷酸(UndPP)-单糖。然后,在不同糖基转移酶的作用下将其他单糖依次连接到UndPP-单糖上合成寡糖重复单位。重复单位中的每个单糖均需要一个相应的糖基转移酶负责转移。有的单糖被O-乙酰化修饰(O-acetylation,O-Ac),由细胞内的O-乙酰基转移酶负责合成,乙酰辅酶A (Acetyl-CoA)作为供体。随后,寡糖单位被跨膜的转位酶(Wzx)翻转到细胞膜外侧,在聚合酶(Wzy)的作用下重复单位被连接在一起形成线性多糖长链,同时释放出UndP返回细胞内被循环利用。有的多糖的O-乙酰化修饰发生在细胞膜外侧,由跨膜的O-乙酰基转移酶对荚膜多糖进行修饰。多糖的合成和长度被基因簇5′端的4个调控基因调控,删除任何一个基因都会影响多糖的合成[8, 46],它们也组成磷酸化系统参与转录后的调控,但是确切机制还不清楚[47]。最后,多糖被跨膜蛋白复合物转运到细胞壁肽聚糖上,类似于大肠杆菌荚膜多糖的转运[48]。
多糖的结构远比蛋白质及核酸的结构复杂,多糖中单糖的连接顺序、单糖之间的连接键及连接位点、支链结构、化学修饰等都导致多糖结构多种多样,很难被鉴定。解析多糖的结构需要鉴定几个参数,一是单糖的组成和数量,二是单糖之间的连接顺序,三是单糖之间的糖苷键类型,四是非糖类组成成分。最早多糖的结构只能用普通的化学方法来鉴定。由于技术的限制,早期发表的荚膜多糖的结构不完全准确,有的不能确定O-乙酰化修饰的位点。直到1965年之后,随着气相色谱(GC)、液相色谱(LC)、质谱(MS)和核磁共振(NMR)等化学分析技术的发展,加快了多糖结构的解析,也提高了被报道的结构的准确性。其中,NMR技术包括一维色谱如氢谱(1H)、碳谱(13C)和磷谱(31P),二维色谱如COSY、TOCSY、HMBC、HSQC、NOESY、ROESY的结果是解析多糖结构的关键所在。而单糖组成和单糖之间的连接键可在多糖被降解成片段后用GC和MS分析。我们通过NMR和GC-MS解析了血清型10B、10C、10F、35F、35C、39、42、47F的荚膜多糖的化学结构[28, 37, 49-50],也解析了几个口腔链球菌表面受体多糖的化学结构[51-52]。我们发现有的肺炎链球菌的荚膜多糖和口腔链球菌的受体多糖结构很相似,并拥有功能一样的糖基转移酶,尽管这些酶在不同细菌中命名不同[37];同时我们也预测肺炎链球菌是从口腔链球菌进化而来,而最近的报道也证实了我们的预测,如肺炎链球菌血清型5是从口腔链球菌的SK95菌株进化而来[53-54]。
我们发现,在已知的多糖结构中,有38个多糖都被O-乙酰化修饰,这些多糖的基因簇中共有54个O-乙酰基转移酶负责完成这些化学修饰。多变的O-乙酰化修饰影响着多糖的物理化学特征,具有重要的生物学功能,并在细菌的进化中扮演着重要角色。因此,本文总结了肺炎链球菌荚膜多糖的O-乙酰化修饰的研究进展,并对今后的研究进行了展望。
3 O-乙酰化修饰的多糖结构及其相应的O-乙酰基转移酶O-乙酰基转移酶是荚膜多糖O-乙酰化修饰的分子基础。目前3个转移酶WcjE、WciZ、WciG的具体功能已经被报道。WcjE负责α-吡喃糖上第4位和6位碳原子的O-乙酰化修饰,如血清型9V/9A的α-ManpNAc4, 6Ac2和血清型11A/11D/ 11E/11F的β-Galp4, 6Ac2;WcjE也负责β-呋喃糖上第5位和6位碳原子的O-乙酰化修饰,如血清型20A/20B/33A/33F中的β-Galf5, 6Ac2;WcjE还负责第3位和5位碳原子的O-乙酰化修饰,如血清型47F/47A中的β-Galf3, 5Ac2。但是,在不同的血清型中以及不同位点上WcjE修饰的水平是不同的[55-59]。另一个O-乙酰基转移酶WciZ负责血清型15B中α-吡喃半乳糖的O-乙酰化修饰,在第2、3、4、6位碳原子上分别有6%、12%、12%和55%的乙酰基团[60]。我们鉴定了O-乙酰基转移酶WciG的功能,发现结构相似的血清型35F/35C/42的多糖中β-呋喃半乳糖(β-Galf)的第2位碳原子上都有O-乙酰化修饰[49]。随后,通过对临床菌株和模式菌株基因簇的对比,我们发现在血清型42的临床菌株中,wciG基因内部发生终止密码子突变,解析其结构发现荚膜多糖失去了第2位O-乙酰基团,因此揭示WciG负责β-呋喃半乳糖的第2位碳原子的O-乙酰化修饰(β-Galf2Ac)[29]。虽然其他O-乙酰基转移酶的具体功能还没有被证实,但是有的功能已经被预测[35]。在此基础上,我们对相关血清型的多糖合成基因簇和多糖结构以及血清学特征进行分析和比对,预测了其他O-乙酰基转移酶负责的结构。这些信息都总结在表 1中。

|
我们发现这些O-乙酰基转移酶可分为两大类。一类分子量小,含有156–233个氨基酸,如WchC、WcjD、WcwC、WcwR、WcwT、WcxM、WcrU、WcyI、WcrX。通过TMHMM分析表明,这些酶不含有跨膜区,不是跨膜蛋白。另一类分子量大,含有332–368个氨基酸,除了上述9个转移酶外,表 1中的其他转移酶都属于这一类。它们都含有10个跨膜区,属于膜结合O-乙酰基转移酶(membrane-bound O-acetyltransferase,MOAT)。我们推测,分子量小的O-乙酰基转移酶位于细胞质中,对细胞膜内侧合成的寡糖进行O-乙酰化修饰;而分子量大的O-乙酰基转移酶跨在细胞膜上,对细胞膜外侧已经聚合的多糖链进行O-乙酰化修饰,如同其他细菌中的MOATs一样[61-62]。另外,尽管这些酶和它们作用的O-乙酰模式没有明显的关联可循,但是WcjE都是将乙酰基团转移到两个碳原子上;而转移酶WcwC、WcxM、WcrU、WcyI、WcrX都负责鼠李糖的第2位碳原子的O-乙酰化修饰(Rhap2Ac)。最近对脑膜炎奈瑟氏球菌血清群A的O-乙酰基转移酶的蛋白晶体结构的研究表明,该酶有严格的位点选择性,只将乙酰辅酶A的乙酰基团连接到N-乙酰甘露糖胺的第3位碳原子上,随后乙酰基团再自发地漂移到第4位碳原子上[63]。大肠杆菌K1荚膜多聚唾液酸的O-乙酰化修饰也具有这个特点,在碱性条件下从第7位漂移到第8位和第9位[64]。可能肺炎链球菌的O-乙酰基转移酶也作用于某个特定位点,乙酰基团再漂移到其他碳原子上,这也解释了多糖的O-乙酰化修饰总是呈现出部分修饰的特点。
4 荚膜多糖O-乙酰化修饰的鉴定多糖的O-乙酰化修饰主要是用核磁共振(NMR)技术鉴定。NMR的特点是不破坏样品,是一种无损的检测技术。NMR可以直接检测多糖的结构,不需要将多糖降解为寡糖片段再进行检测,这对O-乙酰化修饰的鉴定很重要。因为O-乙酰基团不稳定,在多糖纯化的过程中尤其是碱性条件下很容易丢失或漂移。核磁信号用化学位移(ppm)表示。通常乙酰基团氢谱(1H)的核磁信号位于2 ppm处,碳谱(13C)的核磁信号位于21 ppm处,通过这些信号可以鉴定O-乙酰化修饰。一般通过三步来分析。首先,碱处理移走所有O-乙酰基团,然后分析去乙酰多糖的结构。其次,分析原始多糖的结构,并比较这两个多糖结构以确定O-乙酰化修饰的有无和位点。不同位点的O-乙酰基团的核磁信号不同。我们鉴定呋喃半乳糖的第2位碳原子上O-乙酰基团的1H/13C信号在2.140 ppm/21.12 ppm,第5位碳原子上O-乙酰基团的1H/13C信号在2.156 ppm/21.18 ppm,第6位碳原子上O-乙酰基团的1H/13C信号在2.096 ppm/21.03 ppm[22]。最后,每个位点O-乙酰含量可以通过相对谱峰强度(peak intensity)来计算。除了NMR技术外,高效阴离子交换色谱结合电导率检测(HPAEC-CD)和比色测定也可以测定总的O-乙酰基团的含量[65]。
尽管化学分析技术不断提高,但是对肺炎链球菌荚膜多糖O-乙酰化修饰的鉴定仍然很困难。一个原因是,有的O-乙酰基转移酶基因的表达水平很低,O-乙酰基团含量也很低,所以对其修饰位点和水平很难准确鉴定。另一个原因是,细胞壁中的C-多糖通过肽聚糖连接在荚膜多糖上,C-多糖也含有乙酰基团和磷酸基团,也带有负电荷[66-67],因此在纯化多糖时,不管是用阴离子交换柱层析还是用分子筛都很难将C-多糖除去,最后得到的荚膜多糖总是含有C-多糖,从而影响了荚膜多糖结构和O-乙酰化修饰的鉴定。我们的解决方法是用变溶菌素彻底消化粗多糖样品,尽量切开荚膜多糖和C-多糖之间的连接,使C-多糖的污染低于5%[37]。此外,通过使用高分辨率(500 Hz)的NMR仪器,以及延长共振谱的累积时间来提高对微量乙酰含量的检测。
5 荚膜多糖O-乙酰化修饰的生物学功能 5.1 O-乙酰化修饰影响多糖的抗原性和免疫原性O-乙酰化修饰是多糖的重要修饰,它们在许多细菌多糖中普遍存在,在细菌引起的免疫反应中有重要功能[68]。目前发现,O-乙酰化修饰增加了大肠杆菌K1荚膜表面的疏水性,影响了多糖的物理和化学特征,改变了荚膜多糖的抗原性和免疫原性[69-70]。鼠伤寒沙门氏菌的Vi荚膜多糖失去O-乙酰基团后,多糖的构型和动力学特征改变,从刚性螺旋变为柔性线圈,并暴露出隐藏的抗原表位,导致去O-乙酰化的多糖被Vi抗血清识别[71]。脑膜炎奈瑟氏球菌血清群A的荚膜多糖的O-乙酰基团作为保护性的抗原表位,对细菌的免疫原性至关重要,因为分别用乙酰化和去乙酰化的糖蛋白结合疫苗免疫小鼠后,前者产生的血清的杀菌滴度至少比后者的高32倍,表明O-乙酰化修饰的抗原产生了保护性抗体[72]。另外,金黄色葡萄球菌荚膜多糖的O-乙酰化修饰对于产生功能抗体也是关键的[73]。而O-乙酰化的大肠杆菌比去O-乙酰化的大肠杆菌毒力更强[74]。同样,肺炎链球菌荚膜多糖的O-乙酰化修饰也影响了多糖的抗原性。研究揭示血清型9V/9A和11A/11E的荚膜多糖中的O-乙酰基团是抗原决定簇。当乙酰基转移酶基因突变,多糖失去O-乙酰基团后,肺炎链球菌不再与相应的抗血清因子以及单克隆抗体反应[26-27, 55-56]。通过免疫杂交反应和流式细胞仪分析,我们也揭示血清型35C和42荚膜多糖的呋喃半乳糖第2位碳原子的O-乙酰基团(Galf-2OAc)可被抗血清因子35a特异识别,也即Galf-2OAc作为抗原表位刺激机体产生了抗体[29]。表 1中的多个血清型都含有WcjE,其负责合成的Galf-5, 6OAc2能够被抗血清因子20b识别,因此这些血清型拥有一个共同的抗原表位[59]。而最近的研究显示,血清型28F和28A的多糖O-乙酰化修饰影响了肺炎链球菌与抗血清因子23d的亲和力,去O-乙酰化的荚膜多糖与抗体的反应减弱了,但并不是完全失去了反应[41]。此外,肺炎链球菌血清型18C荚膜多糖的支链葡萄糖的第6位碳原子上有30%的O-乙酰化修饰,用化学方法除去O-乙酰基团后,多糖的抗原性没有变化,O-乙酰化的多糖和去O-乙酰化的多糖结合类毒素佐剂注射小鼠和兔子后,它们的免疫原性也没有区别,因此血清型18C荚膜多糖的O-乙酰化修饰并不影响该菌的抗原性和免疫原性[75]。这些研究表明,在肺炎链球菌中,有些血清型荚膜多糖的O-乙酰化修饰是重要的抗原表位,有些血清型的O-乙酰化修饰不具备抗原功能或者抗原性很弱。我们推测,O-乙酰基团在多糖立体结构中的分布可能决定其是否影响多糖的抗原性。位于多糖表面的O-乙酰基团接触到宿主的免疫系统更容易成为靶点,而位于多糖立体结构内部的O-乙酰基团难以刺激机体产生抗体。
5.2 O-乙酰化修饰影响细菌生物膜的形成肺炎链球菌在鼻咽道中形成复杂的生物膜,保护细菌不被粘液中的溶菌酶和抗菌肽等抗菌物质杀死,也避免了补体介导的对细菌的清除和免疫细胞的吞噬,帮助细菌在鼻咽道中繁殖[76-78]。多糖在建立生物膜结构中是重要的,它作为分子胶合剂使细菌粘附到固相支持物表面,也促使细菌之间粘附;另外,多糖提供营养,保护细菌适应干燥和营养匮乏的环境[10, 79-80]。荚膜多糖的单糖组成、电荷以及厚度都影响肺炎链球菌生物膜的形成[81-82]。Moscoso等通过GC-MS技术在生物膜中鉴定到葡萄糖和N-乙酰葡萄糖胺,它们都是以去O-乙酰化的形式存在[78],暗示多糖的O-乙酰化修饰也影响生物膜的形成。近年对血清群33的研究发现,失去WciG介导的呋喃半乳糖的第2位碳原子上的O-乙酰基团增强了细菌生物膜的形成,增加了细菌对鼻咽道上皮细胞的粘附。但是失去WcjE介导的第5位和6位碳原子上O-乙酰基团对生物膜的形成和细胞的粘附都没有影响。也即,只有第2位碳原子上的O-乙酰化修饰对于血清型33A荚膜的保护作用是显著的[58]。因此,只有某些位点的O-乙酰化修饰才能影响细菌生物膜的形成和对宿主细胞的粘附。对血清型15B/15C的研究进一步说明,并不是所有位点的O-乙酰化修饰都改变了多糖的性状和生物学功能。血清型15B中的wciZ基因突变后,多糖支链上的吡喃半乳糖失去O-乙酰基团,并没有影响细菌生物膜的形成和对鼻咽细胞的粘附以及在小鼠中的繁殖[83]。因此,O-乙酰化修饰是否影响多糖的生物学功能是依赖于血清型的,我们推测是依赖于O-乙酰基团在多糖空间结构上的分布。
5.3 O-乙酰化修饰影响细菌的致病性荚膜多糖的结构影响肺炎链球菌的生长表型、毒力和传播。荚膜覆盖着细菌,阻止免疫球蛋白、补体和C-反应蛋白等结合到细菌表面的受体上,从而抵抗宿主免疫系统的攻击,起重要防御功能[12]。如前所述,有些O-乙酰化修饰影响了多糖的抗原性、免疫原性及其他生物学性状,因此和细菌的致病性是密切相关的。我们注意到,除了O-乙酰化修饰外,肺炎链球菌血清型对9V/9A、18B/18C、15B/15C的多糖结构完全相同[21]。有O-乙酰化修饰的血清型9V、18C和15B都是侵袭力强的疫苗血清型,而没有O-乙酰化修饰的血清型9A、18B和15C都是侵袭力弱的非疫苗血清型[56, 75, 83-84]。此外,毒力最强的血清型1的荚膜多糖的半乳糖醛酸也被O-乙酰化修饰[21]。因此,在这些血清型中,荚膜多糖的O-乙酰化修饰可能与肺炎链球菌的毒力呈正相关。我们正在对这些血清型的O-乙酰化修饰的分子基础、抗原特征,生物膜形成,与宿主的相互作用,对小鼠的致病力以及作用机制进行深入研究。
肺炎链球菌引起侵袭性疾病的关键是能够抑制补体系统介导的对细菌的吞噬。在凝集素补体途径中,荚膜多糖的O-乙酰基团能够被凝集素Ficolin-2识别[85]。Ficolin-2在人肝脏中表达并释放到循环系统中,是一类先天的血清蛋白,作为调理素(opsonins)能够特异识别许多人类病原菌中乙酰化的配体[86-88]。Ficolin-2类似于结合甘露糖的凝集素(MBL),能联合丝氨酸蛋白酶(MASP)激活凝集素补体途径[88-89]。最近的研究表明,Ficolin-2在肺炎链球菌的致病中是重要的[85, 90]。Ficolin-2能结合肺炎链球菌血清型11A中WcjE合成的Galf-5, 6OAc2,并引起免疫反应。但是血清型11A在儿童中仅仅导致低的侵袭率,相反在老年人中的侵袭率高[85]。随后发现,血清型35B中WciG负责的Galf-2OAc也是Ficolin-2的配体[91]。Ficolin-2介导的补体沉积在血清型11A和35B的表面,激发了先天免疫以抵抗侵袭性肺炎链球菌疾病(IPD)。而在老年人中,Ficolin-2的先天免疫减弱了,因此更容易感染血清型11A和35B。
6 荚膜多糖的O-乙酰化修饰与细菌的进化越来越多的研究表明,O-乙酰化修饰的改变是肺炎链球菌血清型微进化(microevolution)的一种重要方式。O-乙酰转移酶基因突变导致多糖失去乙酰基团,成为一个新的多糖结构,是一个新的血清型。以血清群18为例,它含有4个血清型18F、18C、18B和18A,我们比较了它们的多糖合成基因簇[34]和多糖结构[21, 38] (图 2)。其中血清型18F最早出现,它的基因簇中有2个O-乙酰基转移酶基因wcxM和wciX (图 2-A)。我们预测WcxM对荚膜多糖18F (CPS18F)主链上的鼠李糖(Rhap)的第2位碳原子进行O-乙酰化修饰(Rhap2Ac),同时WciX对CPS18F支链葡萄糖的第6位碳原子进行O-乙酰化修饰(Glcp6Ac) (图 2B)。由于cps18C中完全失去了wcxM基因(ΔwcxM),致使CPS18C多糖主链上的鼠李糖(Rhap)失去O-乙酰基团,同时其他基因都没有改变,其余的化学结构都一样,因此血清型18C可能是从18F进化而来。由于环境的选择压力,wciX的第169个碱基发生终止密码子突变,不再合成O-乙酰基转移酶WciX,导致支链葡萄糖失去O-乙酰基团,产生CPS18B多糖,因此血清型18B可能是从18C进化而来。在18A的基因簇(cps18A)中,wciX基因完全消失(ΔwciX),CPS18A多糖完全失去O-乙酰化修饰;同时wciU基因序列发生28个碱基的改变(图 2-A),导致WciU不再转移葡萄糖(Glcp)而是转移N-乙酰葡萄糖胺(GlcpNAc),从而产生新的血清型18A,是从18B进化而来。由此可见,肺炎链球菌通过改变O-乙酰基转移酶基因,如点突变,碱基缺失或插入突变,或移走整个基因,不断改变荚膜多糖的乙酰化修饰以产生新的血清型,但是多糖结构并没有发生大的变动。这种微进化对于细菌来说是经济省力的。细菌的微进化可能是由于抗生素和糖蛋白结合疫苗的广泛应用带来的选择压力和免疫压力迫使细菌改变以适应环境的变化。

|
| 图 2 血清群18的4个血清型的多糖合成基因簇(A)和多糖结构的比较(B) Figure 2 Comparison of cps loci of four serotypes in S. pneumoniae serogroup 18 (A) and their CPS structures (B). The wcrM gene was missing in cps18C locus thus CPS18C lost O-acetyl group at carbon 2 position of rhamnose, suggesting that serotype 18C might evolve from serotype 18F. The wciX gene of cps18B contained a stop codon mutation thus CPS18B lost O-acetyl group at carbon 6 position of the branched glucose, suggesting that serotype 18B might evolve from serotype 18C. There were 28 bp difference between wciU genes of cps18A and cps18B. WciU in CPS18A transferred GlcNAc instead of Glc into the main chain, therefore, serotype 18A might evolve from serotype 18B. |
另一个典型例子是血清群11,也是通过O-乙酰基团的丢失或改变乙酰化修饰位点来产生新的血清型。在侵袭性肺炎链球菌感染期间,血清型11A从人鼻咽道扩散到深部组织如无菌的血液中,为了应对新环境的免疫压力,wcjE基因突变失去O-乙酰基团从而逃避了Ficolin-2介导的免疫攻击,产生的血清型11E能够在血液环境中更好地生存繁殖[57]。2018年报道的全球分布的新的血清型35D也是由于血清型35B的wciG基因突变使荚膜多糖失去O-乙酰基团而产生的[92–93]。分析表明,在444个35B的临床分离株中有23个菌株的wciG基因发生部分突变或完全突变。Quellung反应表明大部分分离株是血清型35D,25%的分离株是血清型35B和35D的混合物。其中15个分离株是在PCV13疫苗广泛应用后产生的,而且预测血清型35D比35B的侵袭力更强[93]。
还有一个独特的例子是血清型15B和15C。血清型15B是23价糖疫苗中的一个血清型,它含有wciZ基因,当基因内部有8个TA重复时,基因完全表达,使半乳糖的4个位点被O-乙酰化修饰;当基因含有7或9个TA重复时,基因部分表达,半乳糖被部分修饰;当基因含有6个TA重复时,基因不再表达,多糖完全失去O-乙酰化修饰,出现血清型15C。这种移框突变导致多糖的乙酰化修饰呈动态变化[83],可能是为了应对糖疫苗带来的免疫压力。血清型15B和抗血清因子15b反应,但是血清型15C不再与该抗体反应,表明15C也失去了相应的抗原表位。除此之外,血清型对9A/9V、33F/33A、41F/41A、32F/32A、35C/42、41F/41A中,每对之间也只有O-乙酰化修饰不同,通过得到O-乙酰基团或者失去O-乙酰基团,产生不同的血清型[21, 29, 55-56, 94]。由此可见,肺炎链球菌改变荚膜多糖的O-乙酰化修饰是其微进化的常用策略。
7 讨论与展望对肺炎链球菌的研究有100多年的历史,尽管有疫苗和各种抗生素的广泛使用,但是,时至今日肺炎链球菌都难以被根除,其中的主要原因是肺炎链球菌具有极强的环境适应能力。它能够克服多重抗生素带来的选择压力和疫苗带来的免疫压力,产生多种多样的多糖结构和血清型。肺炎链球菌能合成大量的糖基转移酶和O-乙酰基转移酶是其血清型多样性的分子基础,也是肺炎链球菌惊人的环境适应力的关键所在。O-乙酰基转移酶修饰的单糖不同、修饰的位点不同、修饰的水平不同都导致多糖结构不同,因此,O-乙酰化修饰能够赋予多糖更多的变化。在有些血清型中,O-乙酰化修饰的改变影响了多糖的抗原性、免疫原性和生物学功能,使细菌逃避了宿主免疫系统的攻击,得以在改变的环境中生存。通过突变使O-乙酰基转移酶基因失活,多糖失去乙酰化修饰,或者通过获得新的乙酰基转移酶基因,产生新的修饰特征,这些都是肺炎链球菌抵抗环境压力并产生新的血清型的常见方式。O-乙酰化修饰的结构能够被Ficolin-2识别,通过它介导的凝集素补体途径激发了宿主的免疫防御。除此之外,对于O-乙酰化修饰影响肺炎链球菌致病性的机制并不很清楚。
多个疫苗血清型都含有O-乙酰化修饰,而在疫苗的制备过程中,O-乙酰基团可能由于多种原因发生变化。因为O-乙酰基团在某些碱性环境中或者反复冻融过程中存在不稳定性,比如含量降低、修饰位点自发漂移等,而且疫苗不同的设计条件和制造过程甚至不同生产批次,也会导致O-乙酰基团的不确定性。鉴于多糖O-乙酰化修饰的抗原性和在宿主免疫应答中的作用,在糖疫苗质控中应该充分考虑多糖结构中的O-乙酰基团的位置和含量。WHO生物制品标准化委员会也建议对肺炎链球菌糖蛋白结合疫苗中的O-乙酰基团的含量进行质控,并给出了标准[95]。而目前的NMR技术可以准确鉴定荚膜多糖O-乙酰化修饰的特征。此外,在制备糖蛋白结合疫苗时,肺炎链球菌血清型1的O-乙酰化修饰影响了高碘酸盐的氧化作用,影响了通过还原胺化法将多糖偶联到蛋白上[68],因此也是设计和生产疫苗过程中需要考虑的。
总之,荚膜多糖作为肺炎链球菌最关键的致病因子,其O-乙酰化修饰的生物学功能及分子机制都需要进一步深入研究。在未来,对多糖立体结构的研究也是紧迫的,以期揭示O-乙酰基团在多糖空间的分布与多糖功能的关系。而最近对脑膜炎奈瑟氏球菌O-乙酰基转移酶晶体结构的研究表明,乙酰化修饰位点和对抗体的结合都有严格的区域要求[63, 72]。肺炎链球菌有许多O-乙酰基转移酶包括跨膜的和不跨膜的转移酶,对它们的晶体结构和催化机制的研究也是十分重要的,势必将阐明O-乙酰基团影响荚膜多糖的抗原性和补体沉积的机制,为合理设计疫苗和提高疫苗的效率奠定基础。
| [1] | Henriques-Normark B, Tuomanen EI. The pneumococcus: epidemiology, microbiology, and pathogenesis. Cold Spring Harbor Perspectives in Medicine, 2013, 3(7): a010215. |
| [2] |
Meng QH, Yao KH. The clinical spectrum of Streptococcus pneumoniae infections. Chinese Journal of General Practice, 2018, 16(9): 1535-1539, 1544.
(in Chinese) 孟庆红, 姚开虎. 肺炎链球菌临床感染疾病谱. 中华全科医学, 2018, 16(9): 1535-1539, 1544. |
| [3] | World Health Organization. Estimates of disease burden and cost-effectiveness. http://www.who.int/immunization/monitoringsurveillance/burden/estimates/en/. |
| [4] | Rudan I, Chan KY, Zhang JS, Theodoratou E, Feng XL, Salomon JA, Lawn JE, Cousens S, Black RE, Guo Y, Campbell H. Causes of deaths in children younger than5 years in China in 2008. The Lancet, 2010, 375(9720): 1083-1089. DOI:10.1016/S0140-6736(10)60060-8 |
| [5] |
Liu LP, Wang XC. Immune response to Streptococcus pneumonia infection. Chinese Journal of General Practice, 2018, 16(9): 1540-1544.
(in Chinese) 刘俐嫔, 王晓川. 肺炎链球菌感染的免疫应答. 中华全科医学, 2018, 16(9): 1540-1544. |
| [6] | Weiser JN, Ferreira DM, Paton JC. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology, 2018, 16(6): 355-367. DOI:10.1038/s41579-018-0001-8 |
| [7] | Wilson R, Cohen JM, Jose RJ, de Vogel C, Baxendale H, Brown JS. Protection against Streptococcus pneumoniae lung infection after nasopharyngeal colonization requires both humoral and cellular immune responses. Mucosal Immunology, 2015, 8(3): 627-639. DOI:10.1038/mi.2014.95 |
| [8] | Kadioglu A, Weiser JN, Paton JC, Andrew PW. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology, 2008, 6(4): 288-301. DOI:10.1038/nrmicro1871 |
| [9] | Griffith F. The significance of pneumococcal types. Journal of Hygiene, 1928, 27(2): 113-159. DOI:10.1017/S0022172400031879 |
| [10] | Hamaguchi S, Zafar MA, Cammer M, Weiser JN. Capsule prolongs survival of Streptococcus pneumoniae during starvation. Infection and Immunity, 2018, 86(3): e00802-e00817. |
| [11] | Nelson AL, Roche AM, Gould JM, Chim K, Ratner AJ, Weiser JN. Capsule enhances pneumococcal colonization by limiting mucus-mediated clearance. Infection and Immunity, 2007, 75(1): 83-90. DOI:10.1128/IAI.01475-06 |
| [12] | Hyams C, Camberlein E, Cohen JM, Bax K, Brown JS. The Streptococcus pneumoniae capsule inhibits complement activity and neutrophil phagocytosis by multiple mechanisms. Infection and Immunity, 2010, 78(2): 704-715. DOI:10.1128/IAI.00881-09 |
| [13] | Avery OT, Heidelberger M. Immunological relationships of cell constituents of pneumococcus: second paper. The Journal of Experimental Medicine, 1925, 42(3): 367-376. DOI:10.1084/jem.42.3.367 |
| [14] | Avery OT, Heidelberger M, Goebel WF. The soluble specific substance of Friedlander's bacillus: paper Ii. Chemical and immunological relationships of pneumococcus type Ii and of a strain of Friedlander's bacillus. The Journal of Experimental Medicine, 1925, 42: 709-725. DOI:10.1084/jem.42.5.709 |
| [15] | Robbins JB, Austrian R, Lee CJ, Rastogi SC, Schiffman G, Henrichsen J, Makela PH, Broome CV, Facklam RR, Tiesjema RH, Parke Jr. JC. Considerations for formulating the second-generation pneumococcal capsular polysaccharide vaccine with emphasis on the cross-reactive types within groups. Journal of Infectious Diseases, 1983, 148(6): 1136-1159. DOI:10.1093/infdis/148.6.1136 |
| [16] | Whitney CG, Pilishvili T, Farley MM, Schaffner W, Craig AS, Lynfield R, Nyquist AC, Gershman KA, Vazquez M, Bennett NM, Reingold A, Thomas A, Glode MP, Zell ER, Jorgensen JH, Beall B, Schuchat A. Effectiveness of seven-valent pneumococcal conjugate vaccine against invasive pneumococcal disease: a matched case-control study. The Lancet, 2006, 368(9546): 1495-1502. DOI:10.1016/S0140-6736(06)69637-2 |
| [17] | Moore MR, Whitney CG. Emergence of nonvaccine serotypes following introduction of pneumococcal conjugate vaccine: cause and effect?. Clinical Infectious Diseases, 2008, 46(2): 183-185. DOI:10.1086/524661 |
| [18] | Daniel Weinbergera M, Malley R, Lipsitch M. Serotype replacement in disease following pneumococcal vaccination: a discussion of the evidence. The Lancet, 2012, 378(9807): 1962-1973. |
| [19] | Hicks LA, Harrison LH, Flannery B, Hadler JL, Schaffner W, Craig AS, Jackson D, Thomas A, Beall B, Lynfield R, Reingold A, Farley MM, Whitney CG. Incidence of pneumococcal disease due to non-pneumococcal conjugate vaccine (PCV7) serotypes in the United States during the era of widespread PCV7 vaccination, 1998-2004. The Journal of Infectious Diseases, 2007, 196(9): 1346-1354. DOI:10.1086/521626 |
| [20] | Gonzalez BE, Hulten KG, Lamberth L, Kaplan SL, Mason EO, Pediatric Multicenter Pneumococcal Surveillance Group US. Streptococcus pneumoniae serogroups 15 and 33:an increasing cause of pneumococcal infections in children in the United States after the introduction of the pneumococcal 7-valent conjugate vaccine. The Pediatric Infectious Disease Journal, 2006, 25(4): 301-305. DOI:10.1097/01.inf.0000207484.52850.38 |
| [21] | Geno KA, Gilbert GL, Song JY, Skovsted IC, Klugman KP, Jones C, Konradsen HB, Nahm MH. Pneumococcal capsules and their types: past, present, and future. Clinical Microbiology Reviews, 2015, 28(3): 871-899. DOI:10.1128/CMR.00024-15 |
| [22] | Ganaie F, Saad JS, McGee L, van Tonder AJ, Bentley SD, Lo SW, Gladstone RA, Turner P, Keenan JD, Breiman RF, Nahm MH. A new pneumococcal capsule type, 10D, is the 100th serotype and has a large cps fragment from an oral streptococcus. mBio, 2020, 11(3): e00937-e00920. |
| [23] | Park IH, Pritchard DG, Cartee R, Brandao A, Brandileone MCC, Nahm MH. Discovery of a new capsular serotype (6C) within serogroup 6 of Streptococcus pneumoniae. Journal of Clinical Microbiology, 2007, 45(4): 1225-1233. DOI:10.1128/JCM.02199-06 |
| [24] | Bratcher PE, Kim KH, Kang JH, Hong JY, Nahm MH. Identification of natural pneumococcal isolates expressing serotype 6D by genetic, biochemical and serological characterization. Microbiology: Reading, England, 2010, 156(Pt 2): 555-560. |
| [25] | Park IH, Geno KA, Yu JG, Oliver MB, Kim KH, Nahm MH. Genetic, biochemical, and serological characterization of a new pneumococcal serotype, 6H, and generation of a pneumococcal strain producing three different capsular repeat units. Clinical and Vaccine Immunology, 2015, 22(3): 313-318. DOI:10.1128/CVI.00647-14 |
| [26] | Calix JJ, Nahm MH, Zartler ER. Elucidation of structural and antigenic properties of pneumococcal serotype 11A, 11B, 11C, and 11F polysaccharide capsules. Journal of Bacteriology, 2011, 193(19): 5271-5278. DOI:10.1128/JB.05034-11 |
| [27] | Camilli R, Spencer BL, Moschioni M, Pinto V, Berti F, Nahm MH, Pantosti A. Identification of Streptococcus pneumoniae serotype 11E, serovariant 11Av and mixed populations by high-resolution magic angle spinning nuclear magnetic resonance (HR-MAS NMR) spectroscopy and flow cytometric serotyping assay (FCSA). PLoS ONE, 2014, 9(6): e100722. DOI:10.1371/journal.pone.0100722 |
| [28] | Yang JH, Nahm MH, Bush CA, Cisar JO. Comparative structural and molecular characterization of Streptococcus pneumoniae capsular polysaccharide serogroup 10. The Journal of Biological Chemistry, 2011, 286(41): 35813-35822. DOI:10.1074/jbc.M111.255422 |
| [29] | Geno KA, Bush CA, Wang MN, Jin C, Nahm MH, Yang JH. WciG O-acetyltransferase functionality differentiates pneumococcal serotypes 35C and 42. Journal of Clinical Microbiology, 2017, 55(9): 2775-2784. DOI:10.1128/JCM.00822-17 |
| [30] | Garcı́a E, López R. Molecular biology of the capsular genes of Streptococcus pneumoniae. FEMS Microbiology Letters, 1997, 149(1): 1-10. DOI:10.1016/S0378-1097(97)00026-8 |
| [31] | Kolkman MA, van der Zeijst BA, Nuijten PJ. Diversity of capsular polysaccharide synthesis gene clusters in Streptococcus pneumoniae. Journal of Biochemistry, 1998, 123(5): 937-945. DOI:10.1093/oxfordjournals.jbchem.a022028 |
| [32] | Guidolin A, Morona JK, Morona R, Hansman D, Paton JC. Nucleotide sequence analysis of genes essential for capsular polysaccharide biosynthesis in Streptococcus pneumoniae type 19F. Infection and Immunity, 1994, 62(12): 5384-5396. DOI:10.1128/iai.62.12.5384-5396.1994 |
| [33] | Paton JC, Morona JK, Morona R. Characterization of the capsular polysaccharide biosynthesis locus of Streptococcus pneumoniae type 19F. Microbial Drug Resistance, 1997, 3(1): 89-99. DOI:10.1089/mdr.1997.3.89 |
| [34] | Bentley SD, Aanensen DM, Mavroidi A, Saunders D, Rabbinowitsch E, Collins M, Donohoe K, Harris D, Murphy L, Quail MA, Samuel G, Skovsted IC, Kaltoft MS, Barrell B, Reeves PR, Parkhill J, Spratt BG. Genetic analysis of the capsular biosynthetic locus from all 90 pneumococcal serotypes. PLoS Genetics, 2006, 2(3): e31. DOI:10.1371/journal.pgen.0020031 |
| [35] | Aanensen DM, Mavroidi A, Bentley SD, Reeves PR, Spratt BG. Predicted functions and linkage specificities of the products of the Streptococcus pneumoniae capsular biosynthetic loci. Journal of Bacteriology, 2007, 189(21): 7856-7876. DOI:10.1128/JB.00837-07 |
| [36] | Mavroidi A, Aanensen DM, Godoy D, Skovsted IC, Kaltoft MS, Reeves PR, Bentley SD, Spratt BG. Genetic relatedness of the Streptococcus pneumoniae capsular biosynthetic loci. Journal of Bacteriology, 2007, 189(21): 7841-7855. DOI:10.1128/JB.00836-07 |
| [37] | Yang JH, Shelat NY, Bush CA, Cisar JO. Structure and molecular characterization of Streptococcus pneumoniae capsular polysaccharide 10F by carbohydrate engineering in Streptococcus oralis. The Journal of Biological Chemistry, 2010, 285(31): 24217-24227. DOI:10.1074/jbc.M110.123562 |
| [38] | Kamerling JP. Pneumococcal polysaccharides: a chemical view. In Tomasz A (ed), Streptococcus pneumoniae molecular biology & mechanisms of disease. Mary Ann Lievert, Inc., Larchmont, NY, 81-114. |
| [39] | Li CX, Duda KA, Elverdal PL, Skovsted IC, Kjeldsen C, Duus JØ. Structural, biosynthetic, and serological cross-reactive elucidation of capsular polysaccharides from Streptococcus pneumoniae serogroup 16. Journal of Bacteriology, 2019, 201(20): e00453-19. |
| [40] | Ravenscroft N, Omar A, Hlozek J, Edmonds-Smith C, Follador R, Serventi F, Lipowsky G, Kuttel MM, Cescutti P, Faridmoayer A. Genetic and structural elucidation of capsular polysaccharides from Streptococcus pneumoniae serotype 23A and 23B, and comparison to serotype 23F. Carbohydrate Research, 2017, 450: 19-29. DOI:10.1016/j.carres.2017.08.006 |
| [41] | Li CX, Duda KA, Elverdal PL, Skovsted IC, Kjeldsen C, Teze D, Duus JØ. Structural, biosynthetic and serological cross-reactive elucidation of capsular polysaccharides from Streptococcus pneumoniae serogroup 28. Carbohydrate Polymers, 2021, 254: 117323. DOI:10.1016/j.carbpol.2020.117323 |
| [42] | Kjeldsen C, Slott S, Elverdal PL, Sheppard CL, Kapatai G, Fry NK, Skovsted IC, Duus JØ. Discovery and description of a new serogroup 7Streptococcus pneumoniae serotype, 7D, and structural analysis of 7C and 7D. Carbohydrate Research, 2018, 463: 24-31. DOI:10.1016/j.carres.2018.04.011 |
| [43] | Yother J. Capsules of Streptococcus pneumoniae and other bacteria: paradigms for polysaccharide biosynthesis and regulation. Annual Review of Microbiology, 2011, 65: 563-581. DOI:10.1146/annurev.micro.62.081307.162944 |
| [44] | Llull D, Muñoz R, López R, García E. A single gene (tts) located outside the cap locus directs the formation of Streptococcus pneumoniae type 37 capsular polysaccharide. Type 37 pneumococci are natural, genetically binary strains. The Journal of Experimental Medicine, 1999, 190(2): 241-252. DOI:10.1084/jem.190.2.241 |
| [45] | Dillard JP, Vandersea MW, Yother J. Characterization of the cassette containing genes for type 3 capsular polysaccharide biosynthesis in Streptococcus pneumoniae. The Journal of Experimental Medicine, 1995, 181(3): 973-983. DOI:10.1084/jem.181.3.973 |
| [46] | Morona JK, Paton JC, Miller DC, Morona R. Tyrosine phosphorylation of CpsD negatively regulates capsular polysaccharide biosynthesis in Streptococcus pneumoniae. Molecular Microbiology, 2000, 35(6): 1431-1442. |
| [47] | Paton JC, Trappetti C. Streptococcus pneumoniae capsular polysaccharide. Microbiology Spectrum, 2019, 7(2). DOI:10.1128/microbiolspec.gpp3-0019-2018 |
| [48] | Whitfield C, Paiment A. Biosynthesis and assembly of Group 1 capsular polysaccharides in Escherichia coli and related extracellular polysaccharides in other bacteria. Carbohydrate Research, 2003, 338(23): 2491-2502. DOI:10.1016/j.carres.2003.08.010 |
| [49] | Bush CA, Cisar JO, Yang JH. Structures of capsular polysaccharide serotypes 35F and 35C of Streptococcus pneumoniae determined by nuclear magnetic resonance and their relation to other cross-reactive serotypes. Journal of Bacteriology, 2015, 197(17): 2762-2769. DOI:10.1128/JB.00207-15 |
| [50] | Bush CA, Yang JH, Yu BW, Cisar JO. Chemical structures of Streptococcus pneumoniae capsular polysaccharide type 39(CPS39), CPS47F, and CPS34 characterized by nuclear magnetic resonance spectroscopy and their relation to CPS10A. Journal of Bacteriology, 2014, 196(18): 3271-3278. DOI:10.1128/JB.01731-14 |
| [51] | Yang JH, Ritchey M, Yoshida Y, Bush CA, Cisar JO. Comparative structural and molecular characterization of ribitol-5-phosphate-containing Streptococcus oralis coaggregation receptor polysaccharides. Journal of Bacteriology, 2009, 191(6): 1891-1900. DOI:10.1128/JB.01532-08 |
| [52] | Yang JH, Cisar JO, Bush CA. Structure of type 3Gn coaggregation receptor polysaccharide from Streptococcus cristatus LS4. Carbohydrate Research, 2011, 346(11): 1342-1346. DOI:10.1016/j.carres.2011.04.035 |
| [53] | Nahm MH, Brissac T, Kilian M, Vlach J, Orihuela CJ, Saad JS, Ganaie F. Pneumococci can become virulent by acquiring a new capsule from oral streptococci. The Journal of Infectious Diseases, 2020, 222(3): 372-380. DOI:10.1093/infdis/jiz456 |
| [54] | Pimenta F, Gertz RE Jr, Park SH, Kim E, Moura I, Milucky J, Rouphael N, Farley MM, Harrison LH, Bennett NM, Bigogo G, Feikin DR, Breiman R, Lessa FC, Whitney CG, Rajam G, Schiffer J, da Gloria Carvalho M, Beall B. Streptococcus infantis, Streptococcus mitis, and Streptococcus oralis strains with highly similar cps5 loci and antigenic relatedness to serotype 5 pneumococci. Frontiers in Microbiology, 2019, 9: 3199. DOI:10.3389/fmicb.2018.03199 |
| [55] | Calix JJ, Oliver MB, Sherwood LK, Beall BW, Hollingshead SK, Nahm MH. Streptococcus pneumoniae serotype 9A isolates contain diverse mutations to wcjE that result in variable expression of serotype 9V-specific epitope. The Journal of Infectious Diseases, 2011, 204(10): 1585-1595. DOI:10.1093/infdis/jir593 |
| [56] | Calix JJ, Saad JS, Brady AM, Nahm MH. Structural characterization of Streptococcus pneumoniae serotype 9A capsule polysaccharide reveals role of glycosyl 6-O-acetyltransferase wcjE in serotype 9V capsule biosynthesis and immunogenicity. The Journal of Biological Chemistry, 2012, 287(17): 13996-14003. DOI:10.1074/jbc.M112.346924 |
| [57] | Calix JJ, Dagan R, Pelton SI, Porat N, Nahm MH. Differential occurrence of Streptococcus pneumoniae serotype 11E between asymptomatic carriage and invasive pneumococcal disease isolates reflects a unique model of pathogen microevolution. Clinical Infectious Diseases, 2012, 54(6): 794-799. DOI:10.1093/cid/cir953 |
| [58] | Spencer BL, Saad JS, Shenoy AT, Orihuela CJ, Nahm MH. Position of O-acetylation within the capsular repeat unit impacts the biological properties of pneumococcal serotypes 33A and 33F. Infection and Immunity, 2017, 85(7): e00132-17. DOI:10.1128/iai.00132-17 |
| [59] | Lin FL, Vinogradov E, Deng CH, Zeller S, Green BA, Jansen KU, Pavliak V. Identification of the common antigenic determinant shared by Streptococcus pneumoniae serotypes 33A, 35A, and 20 capsular polysaccharides. Carbohydrate Research, 2013, 380: 101-107. DOI:10.1016/j.carres.2013.08.001 |
| [60] | Rajam G, Carlone GM, Romero-Steiner S. Functional antibodies to the O-acetylated pneumococcal serotype 15B capsular polysaccharide have low cross-reactivities with serotype 15C. Clinical and Vaccine Immunology, 2007, 14(9): 1223-1227. DOI:10.1128/CVI.00184-07 |
| [61] | Vann WF, Liu TY, Robbins JB. Cell-free biosynthesis of the O-acetylated N-acetylneuraminic acid capsular polysaccharide of group C meningococci. Journal of Bacteriology, 1978, 133(3): 1300-1306. DOI:10.1128/jb.133.3.1300-1306.1978 |
| [62] | Gudlavalleti SK, Datta AK, Tzeng YL, Noble C, Carlson RW, Stephens DS. The Neisseria meningitidis serogroup A capsular polysaccharide O-3 and O-4 acetyltransferase. The Journal of Biological Chemistry, 2004, 279(41): 42765-42773. DOI:10.1074/jbc.M313552200 |
| [63] | Fiebig T, Cramer JT, Bethe A, Baruch P, Curth U, Führing JI, Buettner FFR, Vogel U, Schubert M, Fedorov R, Mühlenhoff M. Structural and mechanistic basis of capsule O-acetylation in Neisseria meningitidis serogroup A. Nature Communications, 2020, 11(1): 1-12. DOI:10.1038/s41467-019-13993-7 |
| [64] | King MR, Vimr RP, Steenbergen SM, Spanjaard L, Plunkett G III, Blattner FR, Vimr ER. Escherichia coli K1-specific bacteriophage CUS-3 distribution and function in phase-variable capsular polysialic acid O-acetylation. Journal of Bacteriology, 2007, 189(17): 6447-6456. DOI:10.1128/JB.00657-07 |
| [65] | Kao G, Tsai CM. Quantification of O-acetyl, N-acetyl and phosphate groups and determination of the extent of O-acetylation in bacterial vaccine polysaccharides by high-performance anion-exchange chromatography with conductivity detection (HPAEC-CD). Vaccine, 2004, 22(3/4): 335-344. |
| [66] | Xu QW, Abeygunawardana C, Ng AS, Sturgess AW, Harmon BJ, Hennessey JP Jr. Characterization and quantification of C-polysaccharide in Streptococcus pneumoniae capsular polysaccharide preparations. Analytical Biochemistry, 2005, 336(2): 262-272. DOI:10.1016/j.ab.2004.10.019 |
| [67] | Garrido R, BaróB, Soubal JP, Santana D. Quantitative assessment of C-polysaccharide in capsular polysaccharides of Streptococcus pneumoniae by 31PNMR. Journal of Pharmaceutical and Biomedical Analysis, 2021, 192: 113670. DOI:10.1016/j.jpba.2020.113670 |
| [68] | Berti F, de Ricco R, Rappuoli R. Role of O-acetylation in the immunogenicity of bacterial polysaccharide vaccines. Molecules, 2018, 23(6): 1340. DOI:10.3390/molecules23061340 |
| [69] | Angata T, Varki A. Chemical diversity in the sialic acids and related alpha-keto acids: an evolutionary perspective. Chemical Reviews, 2002, 102(2): 439-469. |
| [70] | Klein A, Roussel P. O-acetylation of sialic acids. Biochimie, 1998, 80(1): 49-57. DOI:10.1016/S0300-9084(98)80056-4 |
| [71] | Hitri K, Kuttel MM, De Benedetto G, Lockyer K, Gao F, Hansal P, Rudd TR, Beamish E, Rijpkema S, Ravenscroft N, Bolgiano B. O-acetylation of typhoid capsular polysaccharide confers polysaccharide rigidity and immunodominance by masking additional epitopes. Vaccine, 2019, 37(29): 3866-3875. DOI:10.1016/j.vaccine.2019.05.050 |
| [72] | Henriques P, Dello Iacono L, Gimeno A, Biolchi A, Romano MR, Arda A, Bernardes GJL, Jimenez-Barbero J, Berti F, Rappuoli R, Adamo R. Structure of a protective epitope reveals the importance of acetylation of Neisseria meningitidis serogroup A capsular polysaccharide. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(47): 29795-29802. DOI:10.1073/pnas.2011385117 |
| [73] | Scully IL, Pavliak V, Timofeyeva Y, Liu YD, Singer C, Anderson AS. O-acetylation is essential for functional antibody generation against Staphylococcus aureus capsular polysaccharide. Human Vaccines & Immunotherapeutics, 2018, 14(1): 81-84. |
| [74] | Frasa H, Procee J, Torensma R, Verbruggen A, Algra A, Rozenberg-Arska M, Kraaijeveld K, Verhoef J. Escherichia coli in bacteremia: O-acetylated K1 strains appear to be more virulent than non-O-acetylated K1 strains. Journal of Clinical Microbiology, 1993, 31(12): 3174-3178. DOI:10.1128/jcm.31.12.3174-3178.1993 |
| [75] | Chang J, Serrano Y, Garrido R, Rodríguez LM, Pedroso J, Cardoso F, Valdés Y, García D, Fernández-Santana V, Verez-Bencomo V. Relevance of O-acetyl and phosphoglycerol groups for the antigenicity of Streptococcus pneumoniae serotype 18C capsular polysaccharide. Vaccine, 2012, 30(49): 7090-7096. DOI:10.1016/j.vaccine.2012.09.047 |
| [76] | Chao YS, Marks LR, Pettigrew MM, Hakansson AP. Streptococcus pneumoniae biofilm formation and dispersion during colonization and disease. Frontiers in Cellular and Infection Microbiology, 2014, 4: 194. |
| [77] | Domenech M, García E, Prieto A, Moscoso M. Insight into the composition of the intercellular matrix of Streptococcus pneumoniae biofilms. Environmental Microbiology, 2013, 15(2): 502-516. DOI:10.1111/j.1462-2920.2012.02853.x |
| [78] | Domenech M, Ramos-Sevillano E, García E, Moscoso M, Yuste J. Biofilm formation avoids complement immunity and phagocytosis of Streptococcus pneumoniae. Infection and Immunity, 2013, 81(7): 2606-2615. DOI:10.1128/IAI.00491-13 |
| [79] | Limoli DH, Jones CJ, Wozniak DJ. Bacterial extracellular polysaccharides in biofilm formation and function. Microbiology Spectrum, 2015, 3(3). DOI:10.1128/microbiolspec.mb-0011-2014 |
| [80] | Bechon N, Mihajlovic J, Vendrell-Fernandez S, Chain F, Langella P, Beloin C, Ghigo JM. Capsular polysaccharide cross-regulation modulates bacteroides thetaiotaomicron biofilm formation. mBio, 2020, 11(3): e00729-20. |
| [81] | Moscoso M, García E, López R. Biofilm formation by Streptococcus pneumoniae: role of choline, extracellular DNA, and capsular polysaccharide in microbial accretion. Journal of Bacteriology, 2006, 188(22): 7785-7795. DOI:10.1128/JB.00673-06 |
| [82] | Allegrucci M, Sauer K. Characterization of colony morphology variants isolated from Streptococcus pneumoniae biofilms. Journal of Bacteriology, 2007, 189(5): 2030-2038. DOI:10.1128/JB.01369-06 |
| [83] | Spencer BL, Shenoy AT, Orihuela CJ, Nahm MH. The pneumococcal serotype 15C capsule is partially O-acetylated and allows for limited evasion of 23-valent pneumococcal polysaccharide vaccine-elicited anti-serotype 15B antibodies. Clinical and Vaccine Immunology, 2017, 24(8): e00099-17. DOI:10.1128/cvi.00099-17 |
| [84] | Van Selm S, Van Cann LM, Kolkman MAB, Van Der Zeijst BAM, Van Putten JPM. Genetic basis for the structural difference between Streptococcus pneumoniae serotype 15B and 15C capsular polysaccharides. Infection and Immunity, 2003, 71(11): 6192-6198. DOI:10.1128/IAI.71.11.6192-6198.2003 |
| [85] | Brady AM, Calix JJ, Yu JG, Geno KA, Cutter GR, Nahm MH. Low invasiveness of pneumococcal serotype 11A is linked to ficolin-2 recognition of O-acetylated capsule epitopes and lectin complement pathway activation. The Journal of Infectious Diseases, 2014, 210(7): 1155-1165. DOI:10.1093/infdis/jiu195 |
| [86] | Matsushita M. Ficolins: complement-activating lectins involved in innate immunity. Journal of Innate Immunity, 2010, 2(1): 24-32. DOI:10.1159/000228160 |
| [87] | Aoyagi Y, Adderson EE, Rubens CE, Bohnsack JF, Min JG, Matsushita M, Fujita T, Okuwaki Y, Takahashi S. L-ficolin/mannose-binding lectin-associated serine protease complexes bind to group B streptococci primarily through N-acetylneuraminic acid of capsular polysaccharide and activate the complement pathway. Infection and Immunity, 2008, 76(1): 179-188. DOI:10.1128/IAI.00837-07 |
| [88] | Kilpatrick DC, Chalmers JD. Human L-ficolin (ficolin-2) and its clinical significance. Journal of Biomedicine & Biotechnology, 2012, 2012: 138797. |
| [89] | Krarup A, Sørensen UBS, Matsushita M, Jensenius JC, Thiel S. Effect of capsulation of opportunistic pathogenic bacteria on binding of the pattern recognition molecules mannan-binding lectin, L-ficolin, and H-ficolin. Infection and Immunity, 2005, 73(2): 1052-1060. DOI:10.1128/IAI.73.2.1052-1060.2005 |
| [90] | Ali YM, Lynch NJ, Haleem KS, Fujita T, Endo Y, Hansen S, Holmskov U, Takahashi K, Stahl GL, Dudler T, Girija UV, Wallis R, Kadioglu A, Stover CM, Andrew PW, Schwaeble WJ. The lectin pathway of complement activation is a critical component of the innate immune response to pneumococcal infection. PLoS Pathogens, 2012, 8(7): e1002793. DOI:10.1371/journal.ppat.1002793 |
| [91] | Geno KA, Spencer BL, Bae S, Nahm MH. Ficolin-2 binds to serotype 35B pneumococcus as it does to serotypes 11A and 31, and these serotypes cause more infections in older adults than in children. PLoS ONE, 2018, 13(12): e0209657. DOI:10.1371/journal.pone.0209657 |
| [92] | Geno KA, Saad JS, Nahm MH. Discovery of novel pneumococcal serotype 35D, a natural WciG-deficient variant of serotype 35B. Journal of Clinical Microbiology, 2017, 55(5): 1416-1425. DOI:10.1128/JCM.00054-17 |
| [93] | Lo SW, Gladstone RA, Tonder A, Bently SD. Global distribution of invasive serotype 35D Streptococcus pneumoniae isolates following introduction of 13-valent pneumococcal conjugate vaccine. Journal of Clinical Microbiology, 2018, 56(7): e00228-18. |
| [94] | Llull D, López R, Garcı́a E, Muñoz R. Molecular structure of the gene cluster responsible for the synthesis of the polysaccharide capsule of Streptococcus pneumoniae type 33F. Biochimica et Biophysica Acta: BBA-Gene Structure and Expression, 1998, 1443(1/2): 217-224. |
| [95] | Organization WH. Recommendations to assure the quality, safety and efficacy of pneumococcal conjugate vaccines. WHO Technical Report Series, 2013: 977. |
 2021, Vol. 61
2021, Vol. 61