中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 陈想, 赵思捷, 梁婷婷, 张继冉, 陈红歌, 杨森. 2021
- Chen Xiang, Zhao Sijie, Liang Tingting, Zhang Jiran, Chen Hongge, Yang Sen. 2021
- 亮斑扁角水虻卵共生菌Bacillus velezensis的鉴定和产酶特征及其对幼虫分解餐厨垃圾效率的影响
- Identification and enzyme profiling of black soldier fly egg commensal Bacillus velezensis and its effect on food waste bioconversion
- 微生物学报, 61(7): 2121-2135
- Acta Microbiologica Sinica, 61(7): 2121-2135
-
文章历史
- 收稿日期:2020-11-06
- 修回日期:2021-02-08
- 网络出版日期:2021-05-07
亮斑扁角水虻(Hermetia illucens L.),属于双翅目水虻科昆虫(Diptera: Stratiomyidae),又称黑水虻。幼虫能够以畜禽粪便、餐厨垃圾和动物尸体等多种有机固体废弃物为食,并将之生物转化为价值较高的昆虫生物资源[1-3]。干燥亮斑扁角水虻幼虫含有近40%蛋白质和约30%油脂,是一种新型替代性饲料原料,已经被应用于水产动物、家禽和宠物等全价饲料中[4]。2017年,欧盟官方授权亮斑扁角水虻可以作为水产动物饲料使用;2018年美国FDA也提倡亮斑扁角水虻虫干在蛋鸡和肉鸡饲料中使用,上述措施有力地促进了亮斑扁角水虻幼虫终端市场的形成,也为亮斑扁角水虻行业发展奠定了经济基础[5]。亮斑扁角水虻处理有机固体废弃物技术具有速度快、彻底性强和高附加值等特点,兼有环保和经济两大特征,所以近年来得到快速发展。其中,如何工业化实现亮斑扁角水虻幼虫对各种成分复杂的有机固体废弃物的快速分解和生物转化成为研究关键。而解决这个问题的有效途径之一在于对亮斑扁角水虻降解废弃物功能相关共生微生物的开发和研究,实现固体有机废弃物的亮斑扁角水虻“虫-菌”互作生物转化。
亮斑扁角水虻共生微生物对促进有机废弃物分解利用和亮斑扁角水虻幼虫生长发育具有重要的作用。亮斑扁角水虻幼虫分解食物的主要酶类如淀粉酶、蛋白酶和脂肪酶等活性调查研究中,来自幼虫唾液腺分泌酶活性不到10%,主要是靠幼虫肠道中产生酶的活性,这与肠道中的共生功能微生物种群具有密切联系[6]。借助宏基因组学等技术手段,一些新的由亮斑扁角水虻共生微生物产生的酶类也在近期的研究中不断地被发掘出来。如亮斑扁角水虻肠道微生物区系中发现新型的纤维素酶CS10,与现有常见纤维素酶相比具有更宽范围的温度耐受性(20–50 ℃)、pH范围(4.0–10.0)和化学溶剂耐受性,具有一定的工业应用潜力;发现的新型碱性普鲁兰酶PulSS4,最适反应温度为40 ℃,最适pH为9.0,基因序列与已知普鲁兰酶的相似性仅为51%[7-8]。另外,在亮斑扁角水虻肠道不可培养的微生物区系中,还发现了一种能够抗抑制剂的1, 4-β甘露聚糖内切酶ManEM17,对蛋白质变性剂和有机溶剂都有很好的耐受性[9]。上述酶类对于亮斑扁角水虻幼虫的杂食性适应特征和对食物的快速降解利用具有关键作用,也是协助昆虫利用食物的重要补充工具。但是,对于亮斑扁角水虻共生微生物分解利用食物相关功能区系的研究和种群变化调控研究,绝大部分仍处于调查描述阶段。
虽然不同生长阶段或取食不同种类废弃物的亮斑扁角水虻共生微生物区系变化差异较大,但是仍能发现一些具有促使食物分解功能的微生物种群。有研究通过分析比较采食餐厨垃圾、鸡粪、牛粪和猪粪四种食物的亮斑扁角水虻幼虫中肠的微生物区系,发现厚壁菌门(Firmicutes)为优势种群,并且在促进食物的分解利用、抵抗粪便等废弃物中致病微生物方面具有重要的功能。进一步研究表明,厚壁菌门中的芽胞杆菌属Bacillus和梭菌属Clostridia又占据主导地位[10]。这预示着上述两个属中存在某种有益于亮斑扁角水虻分解食物和生长发育的细菌种类。除了亮斑扁角水虻肠道,喻国辉等使用纯培养的手段也在亮斑扁角水虻幼虫的体表或卵表面分别筛选到了大量的芽胞杆菌属微生物,具体包括枯草芽胞杆菌Bacillus subtilis、巨大芽胞杆菌Bacillus megaterium、甲基营养型芽胞杆菌Bacillus methylotrophic等[11-13]。其中,枯草芽胞杆菌B. subtilis既可以在亮斑扁角水虻肠道中共生,也可以在卵表面共生。文献曾明确报道枯草芽胞杆菌可以有效促进亮斑扁角水虻幼虫对鸡粪和猪粪的分解效率,同时能够分泌纤维素酶、蛋白酶和抗病原微生物物质[14-15]。值得关注的是,多篇文献报道亮斑扁角水虻虫卵共生的芽胞杆菌不仅对亮斑扁角水虻成虫的产卵行为有一引诱作用,而且具有促进亮斑扁角水虻幼虫生长发育的功能;甚至来源于亮斑扁角水虻幼虫食物猪粪中的芽胞杆菌也有促进猪粪分解和幼虫生长的作用[16-17]。此外,作为厚壁菌门的芽胞杆菌具有生物学背景清楚,具有较强的抗逆性,可以通过喷雾干燥等工艺制成高活性菌剂,便于运输和保存等优点。所以,芽胞杆菌属在亮斑扁角水虻“虫-菌互作”生物转化固体有机废弃物技术体系中具有潜在应用价值。
本课题组在前期研究中发现并初步鉴定一株共生于亮斑扁角水虻卵表面的甲基营养型芽胞杆菌B. methylotrophicus,也是贝莱斯芽胞杆菌B. velezensis的同物异名菌,已经证实其具有引诱成虫产卵的生物学作用[13, 18]。本研究对上述菌株进行进一步详细的研究,主要包括详细鉴定、生长发酵特征和产酶特征,为下一步芽胞杆菌在亮斑扁角水虻“虫-菌互作”生物转化固体有机废弃物中的应用提供资源菌种和基础数据。
1 材料和方法 1.1 菌株与培养基B. velezensis EEAM 10B菌株[13],由河南农业大学生命科学学院实验室保存,菌种保藏编号CGMCC No.14202。LB培养基(g/L):胰蛋白胨10.0、酵母浸粉5.0、氯化钠10.0、蒸馏水补充至1 L,pH 7.0,固体培养基添加1.5%的琼脂粉;基本培养基(g/L):干酪素4.0、CaCl2 0.002、FeSO4·6H2O 0.002、MgSO4·7H2O 0.5、KH2PO4 0.36、Na2HPO4·10H2O 1.07、ZnCl2 0.014、NaCl 0.16、pH 7.0–7.2[19]。
1.2 菌株鉴定 1.2.1 菌株形态及生理生化鉴定:使用固体的LB培养基对B. velezensis EEAM 10B菌株进行划线纯培养,观察菌落生长特征并记录。挑取具有代表性的单菌落,接种于不同的培养基中,观察培养基颜色的变化。生理生化指标包括革兰氏染色、VP试验、淀粉水解试验和甲基红试验等[20]。
1.2.2 菌株16S rDNA和gyrA分子鉴定:取200 μL对数生长期B. velezensis EEAM 10B菌液,12000 r/min离心5 min,弃上清;加入100 μL Tris-HCl (10 mmol/L,pH 7.5),和0.1 mg/mL溶菌酶,室温静止30 min,100 ℃水浴5 min,12000 r/min离心5 min,取上清液做模板。16S rDNA引物如下:27F:5′-AGAGTTTGATCCTGG CTCAG-3′,1492R:5′-TACGGYTACCTTGTTACG ACTT-3′。PCR条件:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min[21]。gyrA基因引物如下:gyrA-F:5′-CAGTCAGGAA ATGCGTACGTCCTT-3′;gyrA-R:5′-CAAGGTAA TGCTCCAGGCATTGCT-3′。PCR条件:94 ℃ 10 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min[22]。将PCR产物测序获得16S rDNA序列上传至NCBI中与已知菌株的16S rDNA比对,使用MEGA 7软件构建系统进化树。
1.3 最适生长条件确定挑取菌株B. velezensis EEAM 10B单菌落,接种于100 mL LB培养基中,37 ℃、200 r/min培养12 h。将菌液于6000 r/min离心10 min,用无菌水洗涤菌体,再用无菌水重悬至菌液OD600值为1。该溶液作为菌株B. velezensis EEAM 10B种子菌液备用,并统一采取1%的接种量应用于后续实验中。
1.3.1 氮源对菌株B. velezensis EEAM 10B生长影响:分别将胰蛋白胨、酵母浸粉、NaNO2、KNO3、NHCl4、尿素和NH4NO3按1% (W/V)加到基础培养基里。将菌株B. velezensis EEAM 10B接种于上述7种培养基(pH 7.0)中,于30 ℃、200 r/min培养24 h后测定OD600。
1.3.2 碳源对菌株B. velezensis EEAM 10B生长影响:选用确定的最佳氮源,加至基础培养基中以替代干酪素。分别将葡萄糖、蔗糖、乳糖、麦芽糖、海藻糖、D-木糖和D-纤维二糖按1% (W/V)加到基础培养基里。将菌株B. velezensis EEAM 10B接种于上述8种培养基(pH 7.0)中,于30 ℃、200 r/min培养24 h后测定OD600。
1.3.3 温度和培养基起始pH对菌株B. velezensis EEAM 10B生长影响:选用最适氮源和碳源,加至基础培养基(pH 7.0)中,将菌株B. velezensis EEAM 10B接种至培养基中,分别于25、30、35、40、45、50 ℃,200 r/min培养24 h后测定OD600。使用最佳氮源和碳源添加的基础培养基,调节培养基初始pH值为4、5、6、7、8、9和10,于最适温度、200 r/min培养24 h后测定OD600。
1.3.4 菌株生长曲线测定:按1%接种率,将菌株B. velezensis EEAM 10B种子菌液接种于含最佳氮源、最佳碳源、最佳pH的基础培养基里,于200 r/min、最适温度下培养48 h,每4 h取样测定菌液的OD600。
1.4 产酶特征 1.4.1 淀粉酶:淀粉酶筛选培养基(g/L):淀粉20.0、酵母提取物5.0、蛋白胨10.0、Na2HPO4 5.0、MgSO4·7H2O 0.1、NaCl 0.1、琼脂20.0、pH 7.0–7.4,1.0×102 Pa灭菌20 min[23]。初筛方法:将活化后菌株用灭过菌的牙签点种于相应的筛选培养基上(平板均分3个区域,每个区域点3个点),37 ℃,倒置培养48 h。在菌落周围滴加卢戈氏碘液(先在容量瓶中加入10 mL蒸馏水,加入10 g碘化钾并用搅拌棒使之溶解,然后再加入5 g碘并搅拌一段时间使之完全溶解(不易溶解)。加蒸馏水至容量瓶中100 mL刻度处并搅拌混匀,移至洁净瓶中并贴上标签),显色反应之后,使用游标卡尺分别测定透明圈直径(H)和菌落直径(C),计算H/C值,并对平板进行拍照记录[20]。
1.4.2 蛋白酶:蛋白酶筛选培养基(g/L):酵母提取物10.0、NaCl 5.0、蛋白胨5.0、干酪素5.0、KH2PO4 1.0、K2HPO4 1.0、琼脂17.0、pH 7.2–7.4[24]。初筛方法:将活化后菌株用灭过菌的牙签点种于相应的筛选培养基上(平板均分3个区域,每个区域点3个点),37 ℃倒置培养48 h。在菌落周围滴加5%的三氯乙酸(5 g TCA加入到100 mL水中),显色反应之后,使用游标卡尺分别测定透明圈直径(H)和菌落直径(C),计算H/C值,并对平板进行拍照记录。
1.4.3 纤维素酶:羧甲基纤维素钠培养基(CMC-Na,g/L):CMC-Na 10.0、酵母提取物10.0、NaCl 5.0、胰蛋白胨5.0、KH2PO4 1.0、琼脂17.0、pH 7.0。初筛方法:将活化后菌株用灭过菌的牙签点种于相应的筛选培养基上(平板均分3个区域,每个区域点3个点),30 ℃倒置培养3–4 d。在平板中加入适量1 mg/mL的刚果红染液,染色10 min,弃去染液,加入适量的1 mol/L的NaCl溶液,洗涤10 min,观察并测量使用游标卡尺分别测定透明圈直径(H)和菌落直径(C),计算H/C值,并对平板进行拍照记录。
1.4.4 木聚糖酶:木聚糖酶筛选培养基(g/L):木聚糖4.0、酵母提取物5.0、NaCl 3.0、NH4NO3 2.0、K2HPO4 1.0、MgSO4·7H2O 0.5、琼脂17.0、pH 7.0。初筛方法:将活化后菌株用灭过菌的牙签点种于相应的筛选培养基上(平板均分3个区域,每个区域点3个点),37 ℃倒置培养48 h。在平板中加入无水乙醇,静止2–3 h,观察并测量使用游标卡尺分别测定透明圈直径(H)和菌落直径(C),计算H/C值,并对平板进行拍照记录。
1.4.5 果胶酶:果胶酶筛选培养基(g/L):果胶10.0、酵母提取物10.0、NaCl 5.0、蛋白胨10.0、琼脂17.0、pH 7.0。初筛方法:将活化后菌株用灭过菌的牙签点种于相应的筛选培养基上(平板均分3个区域,每个区域点3个点),30 ℃倒置培养48 h。在平板上滴加0.5%刚果红染色液染色0.5 h,然后将染液倾掉,并加入1 mol/L的氯化钠脱色液脱10 min,脱色2–3次。观察并测量使用游标卡尺分别测定透明圈直径(H)和菌落直径(C),计算H/C值,并对平板进行拍照记录。
1.4.6 植酸酶:初筛植酸钙选择培养基(g/L):植酸钙5.0、葡萄糖10.0、NH4SO4 0.3、MgSO4 0.5、CaCl 0.1、MnSO4 0.01、FeSO4 0.01、琼脂18.0、pH 7.0。初筛方法:将活化后菌株用灭过菌的牙签点种于相应的筛选培养基上(平板均分3个区域,每个区域点3个点),37 ℃倒置培养48 h。观察菌落周围的植酸钙是否被分解而形成透明圈。并使用游标卡尺分别测定透明圈直径(H)和菌落直径(C),计算H/C值,并对平板进行拍照记录。
1.5 B. velezensis EEAM 10B菌株对亮斑扁角水虻幼虫生长的影响餐厨垃圾由河南省郑州市新密市餐厨废弃物处理中心提供,经过三相分离处理以后的浆料物质(细渣),含水率大约90%。将含水量约90%的新鲜餐厨垃圾和花生壳粉按质量比1:3的比例混匀后配制成含水量约70%的幼虫饲料,每150 g分装到500 mL大小的组培瓶中,盖子具有透气性,覆盖灭菌纱布,具体分组为:对照1 (121 ℃灭菌30 min);S1组,对照1+芽胞菌剂(接种量1×108 CFU/g);对照2 (不灭菌);S2组,对照2+芽胞菌剂(接种量1×10 8 CFU/g),一共4组,每组6个重复。在各处理组中接入150头大小一致的4日龄水虻幼虫,30 ℃饲养12 d,观察到50%以上幼虫变为预蛹后,将幼虫与基质残渣分离,统计并记录不同处理的水虻转化率、餐厨垃圾减少率、幼虫存活率,一部分幼虫进行随机抽样,继续在30 ℃条件下避光放置10 d,统计化蛹率;另一部分幼虫和虫粪80 ℃烘干后,统计虫体总干重以及基质残渣总干重。相关指标计算方式如下:水虻转化率(%)=(转化后水虻干重–转化前水虻干重)/转化前餐厨垃圾干重×100%;餐厨垃圾减少率(%)=(转化前餐厨垃圾干重–转化后餐厨垃圾干重)/转化前餐厨垃圾干重×100%;水虻幼虫存活率(%)=转化后水虻数量/转化前加入的水虻数量×100%;化蛹率(%)=水虻蛹的数量/转化后水虻幼虫数量[14]。
2 结果和分析 2.1 菌株鉴定结果由图 1-A可知,B. velezensis EEAM 10B单个菌体为杆状,属于革兰氏阳性菌,常见单个或链状排列,单端可形成芽胞;在LB固体培养基上生长24 h之后,形成白色不透明水滴样菌落,中间突起,起初边缘整齐,24 h后菌落向四周呈云雾状扩散,再继续培养至48 h之后,形成扁平状,边缘不规则,且表面有褶皱的较大菌落(图 1-B)。由图 1-C可知,我们采用Sporgon消毒剂对卵表除菌后,进行16S rDNA PCR验证,发现无16S rDNA条带(泳道5–7),而未除菌组显示16S rDNA条带(泳道3),表明B. velezensis EEAM 10B是其卵表共生菌。生理生化实验如表 1所示,在已经鉴定的14项实验指标内,B. velezensis EEAM 10B菌株除了过氧化氢酶反应、淀粉水解反应、硝酸盐还原反应和明胶液化4项反应阳性之外,其余10项均为阴性,这与文献已报到的B. velezensis FJAT-8788菌株差异较大,指标相似度仅为50%;与它的近亲B. amyloliquefaciens FJAT-8754相比,指标相似度为64.3%,但是与B. Clausii FJAT-8762的生化特征表型相比,指标相似度为85.7%,只有氧化酶反应和M.R反应2项结果不同,其余完全一致。细菌生化特征是细菌经典分类学的典型特征,检测的数量越多,聚类分析也具有一定的参考意义,但因为偏重于细菌表型的分类,不同菌株之间仍有可能存在较大差异。

|
| 图 1 B. velezensis EEAM 10B菌体形态和卵表除菌前后16S rDNA PCR扩增结果 Figure 1 B. velezensis EEAM 10B mycelial morphology and 16S rDNA PCR products of the sterilized and unsterilized egg surface groups. A: Morphology of B. velezensis EEAM 10B by gram staining (LB broth, 37 ℃, 150 r/min, culturing 24 h); B: Colony morphology (LB solid medium, culturing 24 h); C: 16S rDNA PCR products of unsterilized and sterilized egg surface groups. Lane 1: DL2000 DNA marker; lane 2: 16S rDNA products of E. coli; lane 3: 16S rDNA PCR product of unsterilized egg surface group; lane 4: Control (without template); lane 5–7: 16S rDNA PCR products of sterilized egg surface group. |
| Characteristic | B. velezensis EEAM 10B | B. velezensis
FJAT-8788* |
B. amyloliquefaciens
FJAT-8754* |
B. Clausii
FJAT-8762* |
| Catalase reaction | + | + | + | + |
| Oxydase reaction | – | + | + | + |
| Starch hydrolysis reaction | + | + | + | + |
| Nitrate reduction reaction | + | – | + | + |
| Indole reaction | – | – | – | – |
| Citric acid reaction | – | – | – | – |
| Gelatin Liquefaction reaction | + | + | + | + |
| Arginine dihydrolase | – | + | + | – |
| Sucrose fermentation reaction | – | + | + | – |
| Glucose fermentation | – | + | – | – |
| M.R reaction | – | + | – | + |
| V.P reaction | – | + | + | – |
| Hydrogen sulfide reaction | – | – | – | – |
| Urease reaction | – | – | + | – |
| +: positive reaction; –: negative reaction. *: data were cited from the reference book Biology of Bacillus[20]. | ||||
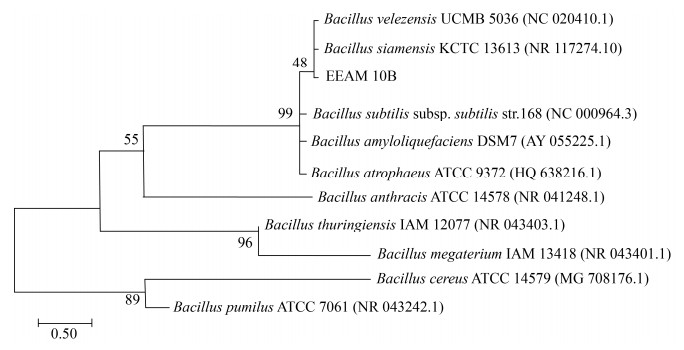
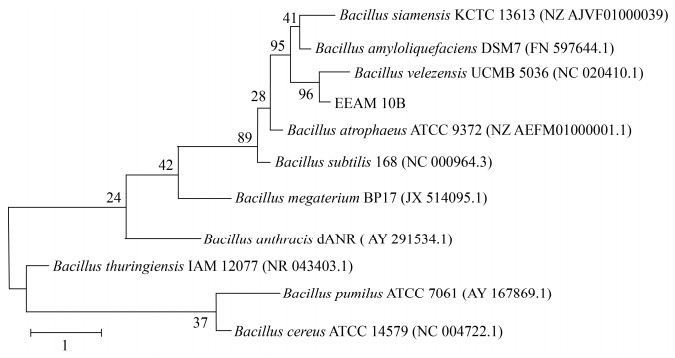
B. velezensis EEAM 10B菌株的16S rDNA和gryA基因测序后与现在已经公布的芽胞杆菌序列进行聚类分析结果如图 2和图 3所示。依据16S rDNA比对结果,与B. velezensis EEAM 10B亲缘关系最近的菌株为B. siamensis KCTC 13613和B. velezensis UCMB 5036;依据gyrA基因[25]序列比对结果,与B. velezensis EEAM 10B亲缘关系最近的菌株为B. velezensis UCMB 5036。且通过使用DNAMAN比对B. velezensis EEAM 10B gyrA基因序列与B.velezensis SBG9、B. velezensis UCMB5036、B. velezensis WLYS23、B. velezensis UB2017、B. velezensis FJAT 52631序列一致性,结果分别为99.47%、92.96%、99.58%、99.58%和99.58%;最终确定EEAM 10B为贝莱斯芽胞杆菌B. velezensis种。
|
| 图 2 B. velezensis EEAM 10B菌株16S rDNA基因序列最大似然法分子进化树 Figure 2 Phylogenetic tree of B. velezensis EEAM 10B and 10 Bacillus strains using maximum likelihood analysis based on 16S rRNA. Numbers at nodes represent the percentages of occurrence of nodes in 1000 bootstrap trials. The scale bar represents 0.50 substitution per nucleotide position. |
|
| 图 3 B. velezensis EEAM 10B菌株gyrA基因序列最大似然法分子进化树 Figure 3 Phylogenetic tree of B. velezensis EEAM 10B and 10 Bacillus strains using maximum likelihood analysis based on gyrA. Numbers at nodes represent the percentages of occurrence of nodes in 1000 bootstrap trials. The scale bar represents 1 substitution per nucleotide position. |
2.2 B. velezensis EEAM 10B菌株最适生长条件
如图 4-A所示,菌株B. velezensis EEAM 10B在含有酵母浸出物为氮源的培养基中生长极显著优于其他6种氮源培养基(P < 0.0001)。菌株B. velezensis EEAM 10B在这7种培养基里的生长顺序如下:酵母浸粉 > 胰蛋白胨 > NH4Cl > NH4NO3 > 干酪素 > KNO3 > 尿素。菌株B. velezensis EEAM 10B在含尿素和KNO3培养基中几乎不生长,但可以利用NH4Cl或NH4NO3无机氮源。菌株B. velezensis EEAM 10B利用有机氮源的能力大于无机氮源,在这7种氮源中,酵母浸粉最适合菌株B. velezensis EEAM 10B菌体的生长。如图 4-B所示,菌株B. velezensis EEAM 10B在含葡萄糖、乳糖、木糖和海藻糖培养基中的生长显著高于在含麦芽糖、纤维二糖和蔗糖培养基中的生长(P < 0.01)。并且,含葡萄糖培养基中的生长量最高,但是与乳糖、木糖和海藻糖相比无显著差异(P > 0.05),葡萄糖是菌株B. velezensis EEAM 10B生长的最佳碳源。由图 4-C可知,菌株B. velezensis EEAM 10B在pH 6、7和8生长得较好,在pH 5、9和10的生长明显较差(P < 0.01),在pH 4条件下不生长。因此,pH 7为菌株B. velezensis EEAM 10B培养基最佳生长的pH值。由图 4-D可知,菌株B. velezensis EEAM 10B能够在较宽温度范围内生长且呈现出不同的生物量。菌株在40 ℃培养条件下生长得最好,明显优于在35 ℃或45 ℃ (P < 0.01),25 ℃或30 ℃菌株能够生长,但生物量不稳定,当培养温度为50 ℃,菌株几乎不生长。由此可见,菌株B. velezensis EEAM 10B是一种嗜中温的细菌,40 ℃可作为其生长的最佳温度。

|
| 图 4 菌株B. velezensis EEAM 10B在不同培养条件下的生物量 Figure 4 Biomass of B. velezensis EEAM 10B in different conditions. A: The effect of nitrogen source on the growth of B. velezensis EEAM 10B; B: The effect of carbon source on the growth of B. velezensis EEAM 10B; C: The effect of pH on the growth of B. velezensis EEAM 10B; D: The effect of temperature on the growth of B. velezensis EEAM 10B. Values with different letters mean significant differences at P < 0.05 (n=3), as determined by Tukery's test. |
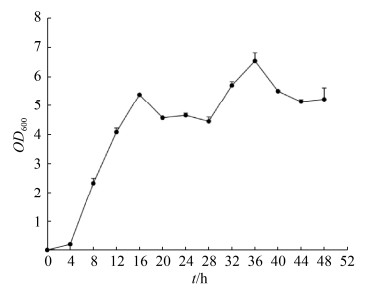
菌株B. velezensis EEAM 10B在含酵母浸粉和葡萄糖的基础培养基(pH 7.0)中40 ℃的生长曲线如图 5所示,菌株B. velezensis EEAM 10B经过4 h迟缓期后,其逐渐进入对数生长期(4–16 h),随后菌株的生长速率降低而进入稳定期。而根据显微镜检查结果发现,在培养12 h之后,已经有菌体开始少量形成芽胞,24 h之后培养基中芽胞形成率在90%以上,所以根据菌株B. velezensis EEAM 10B的生长曲线和镜检结果,建议培养12 h后的菌株可以作为起始菌株进行扩大培养。
|
| 图 5 B. velezensis EEAM 10B菌株在最适培养条件下的生长曲线 Figure 5 The growth curve of B. velezensis EEAM 10B under the optimal culture conditions. |
2.3 产酶特征分析
菌株B. velezensis EEAM 10B在鉴别培养基上的产酶特征分析初步鉴定结果如表 2所示。B. velezensis EEAM 10B能够产生淀粉酶、纤维素酶、木聚糖酶、果胶酶、蛋白酶和植酸酶6种常见酶。从H/C比较结果可知,这几种酶的活性依次为木聚糖酶 > 蛋白酶 > 纤维素酶 > 果胶酶 > 淀粉酶 > 植酸酶;与已知的菌株B. velezensis FJAT-8788产酶种类和活性比较结果表明,除了B. velezensis EEAM 10B菌株产生的淀粉酶活性稍低之外,木聚糖酶和果胶酶都明显高于已报到的菌株。而值得注意的是,B. velezensis EEAM 10B菌株产生的纤维素酶、蛋白酶和植酸酶是菌株B. velezensis FJAT-8788所没有的。综上所述,B. velezensis EEAM 10B菌株能够产多种常见酶类,特别是木聚糖酶、蛋白酶和纤维素酶,并且这几种酶都是胞外分泌型,在亮斑扁角水虻“虫-菌互作”生物转化固体有机废弃物的过程中具有一定的潜在应用价值。
| Enzyme profiles | B. velezensis EEAM 10B, H/C | B. velezensis FJAT-8788, H/C* |
| Amylase | 2.26±0.23 | 3.20 |
| Cellulase | 2.72±0.76 | 0 |
| Xylanase | 5.75±0.71 | 3.10 |
| Pectinase | 2.61±0.16 | 1.67 |
| Protease | 3.64±0.09 | 0 |
| Phytase | 1.46±0.08 | 0 |
| Results are all indicated as means±SEM (n=3). *: data were cited from the reference book Biology of Bacillus[20]. | ||
2.4 B. velezensis EEAM 10B对亮斑扁角水虻幼虫分解餐厨垃圾效率的影响
将B. velezensis EEAM 10B的芽胞粉制剂和水虻幼虫同时接入以餐厨垃圾为主的固体有机废弃物,进行10 d处理之后,结果如表 3和表 4所述。从表 3中得出,S1和S2的幼虫转化率有明显提高,其增长率分别为10.02%和10.56%,而物料减少率并无显著性差异,但是整体来说,添加菌剂,其物料减少率都要高于对照组。从表 4中得出,S1和S2的幼虫存活率和化蛹率均高于各自的Control 1和Control 2。且S1幼虫存活率和化蛹率最高,分别为95%和93.28%。S1处理对其幼虫转化率有明显提高,S2处理作用并不明显,但均高于对照组,可能是餐厨垃圾里有一些有害微生物,灭菌杀死以后,添加菌剂,作用明显。添加菌剂对其蛹重并没有明显影响,对其预蛹重来说,除Control 2外,其他处理并无明显差异。综上所述,B. velezensis EEAM 10B的芽胞粉制剂作为一种微生物制剂添加,对于提高亮斑扁角水虻幼虫转化率和幼虫存活率均有显著性作用,对蛹重的增加没有明显的效果。
| Groups | Conversion rate of BSFL/% | Incremental rate/%a | Material reduction rate/% | Incremental rate/%b |
| Control 1 (Sterilization) | 12.18±0.43a | – | 39.54±0.18a | – |
| S1 (Sterilization+Spore) | 13.40±0.05b | 10.02±0.07 | 41.38±2.80a | 4.65±0.10 |
| Control 2 (Unsterilization) | 12.11±0.57a | – | 46.12±0.34b | – |
| S2 (Unsterilization+Spore) | 13.54±0.60b | 10.56±0.03 | 47.15±1.30b | 2.23±0.96 |
| Results are all indicated as means±SEM (n=3). The values with different superscript letters in the same column are significantly different (P < 0.05). a: conversion rate of BSFL group compared with the control; b: material reduction rate of BSFL group compared with the control. | ||||
| Groups | Larvae survival/% | Prepupae weight/(g/piece) | Pupation rate/% | Pupae weight/(g/piece) |
| Control 1 (Sterilization) | 82.20±3.11a | 0.13±0.01a | 92.65±0.01a | 0.12±0.00a |
| S1 (Sterilization+Spore) | 95.00±2.55b | 0.13±0.00a | 93.28±0.03a | 0.12±0.01a |
| Control 2 (Unsterilization) | 85.50±1.41a | 0.10±0.00b | 84.28±0.02b | 0.13±0.01a |
| S2 (Unsterilization+Spore) | 89.00±0.47ab | 0.14±0.00a | 92.57±0.02a | 0.11±0.01a |
| Results are all indicated as means±SEM (n=3). The values with different superscript letters in the same column are significantly different (P < 0.05). | ||||
3 讨论 3.1 菌株鉴定与生长特征
贝莱斯芽胞杆菌B. velezensis是芽胞杆菌属一个新种,将B. methylotrophicus、B. amyloliquefaciens subsp. plantarum和B. oryzicola都归类为B. velezensis。虽然与枯草芽胞杆菌(B. subtilis)和解淀粉芽胞杆菌(B. amyloliquefaciens)亲缘关系非常近,但其生化特性差别明显[26]。本文分离获得的B. velezensis EEAM 10B菌株从菌体形态、芽胞形成位置和在营养肉汤平板上菌落生长形态等基本特征与最初发现的B. velezensis具有较高的一致性, 但生化特征中的氧化酶、蔗糖发酵反应、葡萄糖发酵、M.R反应、V.P反应和硫化氢反应等结果均为阴性,与已报道的菌株指标差异明显,如UIZ-GARCIA等鉴定的B. velezensis能产生氧化酶,可以发酵蔗糖和葡萄糖产酸;连彩等分离的B. velezensis可以产生H2S和吲哚;但王伟等分离的B. velezensis不产生H2S;刘程程等分离的菌株M.R反应和V.P反应均为阴性,由此可见,B. velezensis不同菌株生理和生化反应不尽相同[24, 26-27]。B. velezensis EEAM 10B菌株的16S rDNA和gryA进化树分析结果一致,表明亲缘关系最近的是B. velezensis UCMB 5036菌株。据报道,最初被命名为B. amyloliquefaciens subsp. plantarum UCMB 5036的菌,分离自一种棉花植物的组织内生菌(Gossypium barbadense),进一步研究表明此菌株具有促进植物生长和防止多种植物病害的功能[28]。B. velezensis EEAM 10B菌株是否有植物促生和防止病害的功能有待进一步研究,如果被证实将会明显提升亮斑扁角水虻“虫菌互作”生物转化固体有机废弃物的潜在价值,因为该菌株的使用会增加亮斑扁角水虻虫粪作为有机肥使用的功能性价值。
B. velezensis EEAM 10B菌株对培养基中的N源有较强的选择性,对尿素和KNO3几乎不利用,而在有机氮源特别是酵母浸粉中生长良好,这一结果与前人研究结果一致,使用有机氮源对B. velezensis进行培养还能够增加其抑真菌物质的产生量[29]。值得注意的是B. velezensis EEAM 10B菌株对不同来源碳源都有着较强的利用能力,其中特别是对海藻糖的利用。
3.2 产酶特征B. velezensis EEAM 10B能够产生淀粉酶、纤维素酶、木聚糖酶、果胶酶、蛋白酶和植酸酶6种常见酶。这几种酶的活性依次为木聚糖酶 > 蛋白酶 > 纤维素酶 > 果胶酶 > 淀粉酶 > 植酸酶;与已知的菌株B. velezensis FJAT-8788产酶种类和活性比较结果表明[20],B. velezensis EEAM 10B菌株产生的木聚糖酶和果胶酶都明显高于B. velezensis FJAT-8788菌株。而且B. velezensis EEAM 10B菌株产生的纤维素酶、蛋白酶和植酸酶是菌株B. velezensis FJAT-8788所没有的。B. velezensis EEAM 10B可以作为一株产多种酶菌株使用。有研究表明,在肉雏鸡日粮基础饲料中添加1‰的木聚糖酶,平均日增重提高4.81% (P < 0.01),料重比下降5.00% (P < 0.05)[30]。果胶酶和纤维素酶对桃果实成熟和败絮起重要作用[31],这对于B. velezensis EEAM 10B来说,也许可用于肉雏鸡增重和桃果成熟。
3.3 B. velezensis EEAM 10B对亮斑扁角水虻幼虫分解餐厨垃圾效率的影响添加B. velezensis EEAM 10B菌粉制剂,能明显提高幼虫转化率,与曹露[32]添加肠道微生物HNB-3处理猪粪结果一致,均能提高其转化率,而且添加B. velezensis EEAM 10B能提高其存活率,这对于工厂规模化饲养有很大意义。对其物料减少率来说,非灭菌处理组明显高于灭菌处理组,说明影响物料的消耗并不是一种微生物的作用,而是多种微生物的共同作用。从灭菌和非灭菌处理来看,非灭菌处理其化蛹率和预蛹重明显低于灭菌处理,说明B. velezensis EEAM 10B需要和其他微生物共同作用才能提高亮斑扁角水虻的化蛹率和预蛹重,且餐厨垃圾某些有害微生物可能不利于其化蛹,对于这些微生物有待进一步研究。在我们后续的单菌培养(同时对除菌幼虫和经灭菌的底物中添加B. velezensis EEAM 10B)研究发现,在培养10 d后,其肠道活菌数能达到2.5×106 CFU/g,确定B. velezensis EEAM 10B能在其肠道内定殖,说明该菌对亮斑扁角水虻有很重要的作用。芽胞杆菌还可以提高动物的生产性能[33-34],B. velezensis EEAM 10B在此方面有很大的应用潜力。
4 结论确定亮斑扁角水虻卵表共生菌为贝莱斯芽胞杆菌,命名为B. velezensis EEAM 10B,能够产生芽胞和多种酶类,通过培养条件优化,证实本菌株能够通过液体发酵的方式进行规模化生产;添加餐厨垃圾培养亮斑扁角水虻结果显示,B. velezensis EEAM 10B有效促进可亮斑扁角水虻幼虫对餐厨垃圾的转化效率,具有在亮斑扁角水虻处理餐厨废弃物领域的潜在应用价值。
| [1] | Beskin KV, Holcomb CD, Cammack JA, Crippen TL, Knap AH, Sweet ST, Tomberlin JK. Larval digestion of different manure types by the black soldier fly (Diptera: Stratiomyidae) impacts associated volatile emissions. Waste Management: New York, N Y, 2018(74): 213-220. |
| [2] | Nguyen TTX, Tomberlin JK, Vanlaerhoven S. Ability of black soldier fly (Diptera: Stratiomyidae) larvae to recycle food waste. Environmental Entomology, 2015, 44(2): 406-410. DOI:10.1093/ee/nvv002 |
| [3] | Gunawan A, Erlina S, Samudera R, Syarif DM, Noor MY, Lantu AX. Effect of supplement Maggot Black Soldier Fly live on the percentage of carcass and weight of carcass of male Alabio ducks. IOP Conference Series Earth and Environmental Science, 2018, 207(1): 12-21. DOI:10.1088/1755-1315/207/1/012021 |
| [4] | Wang YS, Matan S. Review of Black Soldier Fly (Hermetia illucens) as Animal Feed and Human Food. Foods (Basel, Switzerland), 2017, 6(10): 91. |
| [5] | Yang BR, Vivek, Nemane, Nicole, Grmelova, Zhao A, Anu LU, Louise HE, Deschamps MH, Vandenberg GW, Zhang YM. Insects as Food and Feed: Laws of the European Union, United States, Canada, Mexico, Australia, and China. European Food and Feed Law Review, 2017, 12(1): 22-36. |
| [6] | Kim W, Bae S, Park K, Lee S, Choi Y, Han S, Koh Y. Biochemical characterization of digestive enzymes in the black soldier fly, Hermetia illucens (Diptera: Stratiomyidae). Journal of Asia-Pacific Entomology, 2011, 14(1): 11-14. DOI:10.1016/j.aspen.2010.11.003 |
| [7] | Lee CM, Lee YS, Seo SH, Yoon SH, Kim SJ, Hahn BS, Sim JS, Koo BS. Screening and characterization of a novel cellulase gene from the gut microflora of Hermetia illucens using metagenomic library. Journal of Microbiology and Biotechnology, 2014, 24(9): 1196-1206. DOI:10.4014/jmb.1405.05001 |
| [8] | Lee YS, Seo SH, Yoon SH, Kim SY, Hahn BS, Sim JS, Koo BS, Lee CM. Identification of a novel alkaline amylopullulanase from a gut metagenome of Hermetia illucens. International Journal of Biological Macromolecules, 2016(82): 514-521. |
| [9] | Song J, Kim SY, Kim DH, Lee YS, Sim JS, Hahn BS, Lee CM. Characterization of an inhibitor-resistant endo-1, 4-β-mannanase from the gut microflora metagenome of Hermetia illucens. Biotechnology Letters, 2018, 40(9/10): 1377-1387. DOI:10.1007/s10529-018-2596-2 |
| [10] | Zhan S, Fang GQ, Cai MM, Kou ZQ, Xu J, Cao YH, Bai L, Zhang YX, Jiang YG, Luo XY, Xu J, Xu X, Zheng LY, Yu ZN, Yang H, Zhang ZJ, Wang SB, Tomberlin JK, Zhang JB, Huang YP. Genomic landscape and genetic manipulation of the black soldier fly Hermetia illucens, a natural waste recycler. Cell Research, 2020, 30(1): 50-60. DOI:10.1038/s41422-019-0252-6 |
| [11] |
Yu GH, Yang ZH, Xia Q, Chen YF, Cheng P. Effect of chicken manure treated by gut symbiotic bacteria on the growth and development of black solder fly Hermetia illucens. Chinese Bulletin of Entomology, 2010, 47(6): 1123-1127.
(in Chinese) 喻国辉, 杨紫红, 夏嫱, 陈远凤, 程萍. 肠道共生细菌预发酵鸡粪对黑水虻生长发育的影响. 昆虫知识, 2010, 47(6): 1123-1127. |
| [12] | 郭凤达. 亮斑扁角水虻生物学及其幼虫肠道细菌的研究. 山东农业大学硕士学位论文, 2012. |
| [13] |
Yang S, Li Y, Mai YN, Ruan RT, Song AD, Wang FQ, Chen HG. Isolation and identification of egg-associated bacteria of Hermetia illucens (Diptera: Stratiomyidae) and their effects on its adult oviposition behavior. Acta Entomologica Sinica, 2017, 60(2): 163-172.
(in Chinese) 杨森, 李严, 麦艳娜, 阮润田, 宋安东, 王风芹, 陈红歌. 亮斑扁角水虻卵携带细菌的分离鉴定及其对成虫产卵行为影响. 昆虫学报, 2017, 60(2): 163-172. |
| [14] |
Xiao XP, Jin P, Cai MM, Zheng LY, Li W, Yu ZN, Zhang JB. Chicken manure co-conversion by Hermetia illucens larvae with non-associated microorganism. Acta Microbiologica Sinica, 2018, 58(6): 1116-1125.
(in Chinese) 肖小朋, 靳鹏, 蔡珉敏, 郑龙玉, 李武, 喻子牛, 张吉斌. 非水虻源微生物与武汉亮斑水虻幼虫联合转化鸡粪的研究. 微生物学报, 2018, 58(6): 1116-1125. |
| [15] | 谢久凤. 亮斑扁角水虻(Hermetia illucens L. )幼虫肠道内纤维素酶活性菌株的筛选与鉴定. 华中农业大学硕士学位论文, 2010. |
| [16] | 郑龙玉. 卵携带的微生物对亮斑扁角水虻产卵行为和生长发育的影响. 华中农业大学博士学位论文, 2012. |
| [17] | Rehman KU, Rehman RU, Somroo AA, Cai MM, Zheng LY, Xiao XP, Rehman AU, Rehman A, Tomberlin JK, Yu ZN, Zhang JB. Enhanced bioconversion of dairy and chicken manure by the interaction of exogenous bacteria and black soldier fly larvae. Journal of Environmental Management, 2019, 237: 75-83. |
| [18] |
Zhang CW, Cheng K, Zhang X, Liu B, Du HB, Yao S. Taxonomy and functions of Bacillus velezensis a review. Food and Fermentation Industries, 2019, 45(17): 258-265.
(in Chinese) 张彩文, 程坤, 张欣, 刘波, 都海渤, 姚粟. 贝莱斯芽胞杆菌(Bacillus velezensis)分类学及功能研究进展. 食品与发酵工业, 2019, 45(17): 258-265. |
| [19] |
Wan WJ, Xue ZY, Zhang ZW, Li XH, Cheng GJ, He DL. Isolation and identification of an alkaline protease producing strain and study on enzymatic properties. Acta Microbiologica Sinica, 2017, 57(5): 737-747.
(in Chinese) 万文结, 薛芷筠, 张泽文, 李晓华, 程国军, 何冬兰. 一株产碱性蛋白酶菌株的筛选鉴定及酶学特性研究. 微生物学报, 2017, 57(5): 737-747. |
| [20] | 刘波. 芽胞杆菌第三卷芽胞杆菌生物学. 北京: 科学出版社, 2016. |
| [21] | Yu J, Zhou XF, Yang SJ, Liu WH, Hu XF. Design and application of specific 16S rDNA-targeted primers for assessing endophytic diversity in Dendrobium officinale using nested PCR-DGGE. Applied Microbiology and Biotechnology, 2013, 97(22): 9825-9836. DOI:10.1007/s00253-013-5294-y |
| [22] | Roberts MS, Nakamura LK, Cohan FM. Bacillus mojavensis sp. nov. Distinguishable from Bacillus subtilis by Sexual Isolation, Divergence in DNA Sequence, and Differences in Fatty Acid Composition. International Journal of Systematic Bacteriology, 1994, 44(2): 256-264. DOI:10.1099/00207713-44-2-256 |
| [23] |
Wang L, Chen YF, Yang L. Isolation and identification of amylase-producing Bacillus. Food Research and Development, 2017, 38(6): 175-178.
(in Chinese) 王磊, 陈宇飞, 杨柳. 产淀粉酶芽胞杆菌的分离和鉴定. 食品研究与开发, 2017, 38(6): 175-178. DOI:10.3969/j.issn.1005-6521.2017.06.039 |
| [24] | 刘程程. 芽胞杆菌几种重要酶的酶学特性分析. 福建农林大学硕士学位论文, 2014. |
| [25] |
Zhang DF, Gao YX, Wang YJ, Liu C, Shi CB. Advances in taxonomy, antagonistic function and application of Bacillus velezensis. Microbiology China, 2020, 47(11): 3634-3649.
(in Chinese) 张德锋, 高艳侠, 王亚军, 刘春, 石存斌. 贝莱斯芽胞杆菌的分类、拮抗功能及其应用研究进展. 微生物学通报, 2020, 47(11): 3634-3649. |
| [26] |
Cai GL, Zhang F, Ouyang YX, Zhao CS, Peng XH, Jiang AM. Research progress on Bacillus velezensis. Northern Horticulture, 2018(12): 162-167.
(in Chinese) 蔡高磊, 张凡, 欧阳友香, 赵昌松, 彭宣和, 江爱明. 贝莱斯芽胞杆菌(Bacillus velezensis)研究进展. 北方园艺, 2018(12): 162-167. |
| [27] | Ruiz GC. Bacillus velezensis sp. nov. a surfactant-producing bacterium isolated from the river Velez in Malaga, southern Spain. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1): 191-195. DOI:10.1099/ijs.0.63310-0 |
| [28] | Shahid M, Adnan N, Sarosh B, Johan M, Erik BR. Genome sequence of a plant-associated bacterium, Bacillus amyloliquefaciens strain UCMB5036. Genome Announcements, 2013, 1(2): 111-113. |
| [29] |
Yang K, Si W, Lin H, Lin FR, Yuan J, Chen J. Fermentation condition optimization of Bacillus velezensis TCS001 using response surface methodology. Chinese Journal of Pesticide Science, 2019, 21(4): 444-452.
(in Chinese) 杨可, 司文, 林海, 林方锐, 袁静, 陈杰. 利用响应面分析法优化贝莱斯芽胞杆菌TCS00发酵条件. 农药学学报, 2019, 21(4): 444-452. |
| [30] | 王修启. 木聚糖酶作用的分子营养及内分泌机理初探. 第五届饲料安全与生物技术委员会大会暨第二届全国酶制剂在饲料工业中应用学术与技术研讨会. 2005. |
| [31] |
Mao LC, Zhang SL. Role of pectolytic enzymes and cellulase during ripening and woolly breakdown in peaches. Acta Horticulturae Sinica, 2001, 28(2): 107-111.
(in Chinese) 茅林春, 张上隆. 果胶酶和纤维素酶在桃果实成熟和絮败中的作用. 园艺学报, 2001, 28(2): 107-111. DOI:10.3321/j.issn:0513-353X.2001.02.003 |
| [32] | 曹露. 利用亮斑扁角水虻和微生物联合转化处理畜禽粪便的研究. 华中农业大学硕士学位论文, 2011. |
| [33] |
Chen XD, Ma QG, Ji C, Li MJ. Effect of Bacillus preparation on performance of piglets. China Feed, 2003(16): 12-13.
(in Chinese) 陈旭东, 马秋刚, 计成, 李敏俊. 芽胞杆菌制剂对仔猪生产性能的影响. 中国饲料, 2003(16): 12-13. DOI:10.3969/j.issn.1004-3314.2003.16.007 |
| [34] |
Li JB, Cheng TS, Lü WX, Peng P. Effect of dried Bacillus subtilis culture on production performance, egg quality and nutrient digestibility of layers. China Poultry, 2009, 31(4): 15-17.
(in Chinese) 李俊波, 成廷水, 吕武兴, 彭鹏. 枯草芽孢杆菌制剂对蛋鸡生产性能、蛋品质和养分消化率的影响. 中国家禽, 2009, 31(4): 15-17. |
 2021, Vol. 61
2021, Vol. 61




