中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 蒋长军, 管翠翠, 胡小敏, 姚伦广, 阚云超, 邱礽. 2021
- Jiang Changjun, Guan Cuicui, Hu Xiaomin, Yao Lunguang, Kan Yunchao, Qiu Reng. 2021
- 黄芩苷对嗜水气单胞菌生物膜形成的影响及体内外的抑菌作用
- Bacteriostatic and antibiofilm effects of baicalin on Aeromonas hydrophila: in vitro and in vivo evaluation
- 微生物学报, 61(7): 2112-2120
- Acta Microbiologica Sinica, 61(7): 2112-2120
-
文章历史
- 收稿日期:2020-10-19
- 修回日期:2020-12-22
- 网络出版日期:2021-02-24
2. 河南省伏牛山昆虫生物重点实验室, 河南省昆虫生物反应器工程实验室, 河南 南阳 473061;
3. 南阳师范学院生命科学与农业工程学院, 河南 南阳 473061
2. Henan Provincial Engineering Laboratory of Insects Bio-reactor, Henan Key Laboratory of Insect Biology in Funiu Mountain, Nanyang 473061, Henan Province, China;
3. College of Life Science and Agricultural Engineering, Nanyang Normal University, Nanyang 473061, Henan Province, China
嗜水气单胞菌(Aeromonas hydrophila)是一种常见的原发性条件致病菌,广泛分布于自然界的各种水体,是典型的人-兽-鱼共患病病原菌。在水产上,是鱼类最常见的致病菌[1],目前我国防治嗜水气单胞菌病害主要采用抗生素的方法,但是,长期使用抗生素造成耐药性增强,不仅让鱼类治疗更加困难,药物残留对人体也造成巨大的危害[2-3]。中药是我国自古以来用于治疗人类和动物疾病的传统药物。中药因其疗效确切、毒副作用小、成本低、资源丰富、不易形成抗药性和在动物体内残留少等优点而日渐受到人们的关注。从中草药中研制开发新型渔药已成为水产养殖过程中防治疾病的新方向,具有重要的经济价值、社会价值及生态价值[4]。
黄芩苷(Baicalin)来自唇形科植物黄芩(Scutellaria baicalensis Georgi),化学式为C21H18O11,分子量为446.35,黄芩苷的结构式如图 1所示。黄芩苷除了通过破坏细胞膜提高膜通透性和抑制DNA合成、抑制生物膜等方式对细菌进行直接作用外[5-6],还可以通过激活免疫反应来促进细菌的清除[7],之前研究对象都是针对高等哺乳动物病原菌和模型,目前还没有黄芩苷针对嗜水气单胞菌的抑菌报道。

|
| 图 1 黄芩苷化学结构式 Figure 1 The chemical structure of baicalin. |
本研究的目标是观察黄芩苷在体外对水产动物主要病原菌嗜水气单胞菌的抑菌活性及机制,还利用草鱼模型,检测了黄芩苷对嗜水气单胞菌在体内生长的作用。
1 材料和方法 1.1 实验菌株和培养条件实验所用的嗜水气单胞菌(Aeromonas hydrophila),由本实验室分离。菌株保存于–80 ℃甘油管中,使用前在LB平板上划线,挑取单克隆菌株,28 ℃过夜培养。
1.2 试剂和主要设备 1.2.1 主要试剂:黄芩苷购自上海阿拉丁生化科技股份有限公司;二甲基亚砜(DMSO)购自天津市科密欧化学试剂有限公司;草酸铵结晶紫溶液、琼脂、无菌磷酸盐缓冲液(PBS)购自北京索莱宝科技有限公司;酵母、胰蛋白胨购自北京拜尔迪生物技术有限公司;氯化钠购自天津市风船化学试剂科技有限公司。
1.2.2 主要仪器:全波长扫描式多功能微孔板读数仪购自郑州赛诺仪器设备有限公司;数显游标卡尺购自宁波得力工具有限公司;Millipore超纯水仪购自美国Millipore (0.22 μm)公司;–80 ℃超低温冰箱购自中国中科美菱公司;ZSD-1160生化培养箱购自上海智城分析仪器制造有限公司;高压灭菌锅(MC-40型)购自日本ALP集团;SW-CJ-IB型单人单面净化工作台购自苏州净化设备有限公司;紫外可见分光光度计购自北京普析通用仪器有限责任公司;5471C离心机购自德国Eppendorf公司;GFL3031空气浴培养摇床购自德国艾利特国际贸易有限公司。
1.3 黄芩苷对嗜水气单胞菌的抑菌作用利用牛津杯打孔法[8]分析黄芩苷对嗜水气单胞菌的抑菌作用。分别配置溶解于DMSO,浓度为10 mg/mL和5 mg/mL的黄芩苷备用。取活化后的嗜水气单胞菌,用PBS调整浓度至1×107 CFU/mL,取100 μL均匀涂布于LB固体培养基上。用镊子将无菌的牛津杯放置于培养基表面打孔,然后用移液枪分别加100 μL 10 mg/mL、5 mg/mL的黄芩苷溶液、PBS和DMSO,作为实验组和对照组。在28 ℃培养12–16 h后用游标卡尺测定抑菌圈直径大小,以抑菌圈直径评价黄芩苷的抑菌作用。
1.4 黄芩苷对嗜水气单胞菌体外生长曲线的影响将培养至对数期的嗜水气单胞菌用PBS稀释至1×108 CFU/mL,按1% (V/V)的接种量将嗜水气单胞菌菌悬液接种至LB培养基中,并加入黄芩苷使其终浓度为2.00、1.00、0.50、0.25 mg/mL,以PBS和DMSO为空白和阴性对照,放置于28 ℃、150 r/min的恒温摇床中培养,每隔2 h取菌液,检测600 nm波长下的吸光值(OD600),并绘制生长曲线。
1.5 黄芩苷对嗜水气单胞菌生物膜的影响采用结晶紫染色法测定生物膜,收集对数生长期嗜水气单胞菌,PBS洗涤3次,以2×105 CFU/孔的接种量转接至含2.00、1.00、0.50、0.25 mg/mL黄芩苷的LB培养基中,以DMSO溶剂为对照组。28 ℃静置培养72 h,检测OD600吸光值, 吸出菌液,PBS清洗培养孔后,以结晶紫染色法测定生物被膜形成量,具体为200 μL 99%甲醇固定15 min,1%结晶紫溶液染色20 min,干燥后加入200 μL 30%冰醋酸溶解结晶紫。测定培养孔中溶液在570 nm波长下的吸光值(OD570)。由于不同试验组细菌生长存在差异,每个样品孔测得的OD570值需消除细菌浓度造成的差异,生物膜OD570 (相对值)=OD570(测量值)/OD600 (细菌浓度值)[9]。
1.6 黄芩苷对嗜水气单胞菌运动性的影响配置含0.3%琼脂粉的固体LB培养基,121 ℃灭菌30 min,待培养基冷却至55 ℃左右,加黄芩甘溶液调整LB浓度为2.00、1.00、0.50、0.25 mg/mL,倒平板,以等量DMSO为空白对照。取活化至对数期嗜水气单胞菌,PBS洗涤调整浓度为107 CUF/mL,点种2 μL菌悬液至平板上,24 h后用游标卡尺测菌落直径取平均值并记录[10]。
1.7 细菌渗透性检测取活化后的嗜水气单胞菌,PBS洗涤3次,用PBS稀释至106 CFU/mL,加入终浓度分别为0.5、1.0、2.0 mg/mL的黄芩苷到菌悬液中,28 ℃、150 r/min培养3 h,8000 r/min离心5 min取上清液测定OD260值。重复实验3次,每次设置3个平行。以OD260值为纵坐标,进行柱状图分析。
1.8 透射电镜分析黄芩苷对嗜水气单胞菌的影响嗜水气单胞菌接种至LB培养基中,调整菌液浓度为107 CFU/mL,加黄芩苷溶液,使黄芩苷终浓度为1 mg/mL,空白对照组加同体积的DMSO,置28 ℃、150 r/min摇床中培养8 h。取菌液离心,去上清,无菌PBS洗涤至上清无色透明为止,弃上清。以2.5%的戊二醛溶液固定2 h,然后再用1%的磷钨酸钠缓冲液混合,用无菌毛细吸管吸取混合菌悬液滴在铜网膜上,样品干燥后,通过透射电子显微镜观察黄芩苷对细菌形态的影响。
1.9 黄芩苷对嗜水气单胞菌在草鱼体内增殖的抑制作用取对数生长期的嗜水气单胞菌菌悬液离心,弃上清,用PBS洗涤3遍,然后用PBS调菌悬液终浓度为1×106 CFU/mL。取草鱼幼苗25条,腹腔注射菌液100 μL/条,2 h后针对草鱼进行黄芩苷给药,给药浓度分别为10.0、5.0、2.5 mg/kg,分别以PBS、DMSO为对照,每个浓度5条。4 h后取草鱼肝、脾组织研磨涂板,28 ℃过夜培养,统计菌落数。
1.10 数据分析实验数据采用SPSS 16.0和Origin 8进行统计分析和图标制作。计量资料采用x±s表示。多组间比较用单因素方差分析,P < 0.05表示差异具有统计学意义。
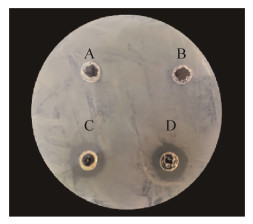
2 结果和分析 2.1 黄芩苷对嗜水气单胞菌的抑制作用由图 2可以看出,DMSO、PBS孔周围无抑菌圈,实验组浓度为10 mg/mL和5 mg/mL的黄芩苷的抑菌圈直径分别为14.32 mm和13.21 mm,表明黄芩苷对嗜水气单胞菌有明显的抑菌作用。进而研究黄芩苷对嗜水气单胞菌体外生长曲线的影响,结果发现(图 3),和DMSO对照组相比,作用浓度分别为2.00、1.00、0.50 mg/mL的黄芩苷的菌液生长速度显著降低,并且对数生长期未达到正常生长高峰。0.25 mg/mL的浓度则对嗜水气单胞菌的抑制作用不明显,这些结果表明黄芩苷对嗜水气单胞菌有抑制作用且具有浓度依赖性。
|
| 图 2 黄芩苷对嗜水气单胞菌的抑菌效果 Figure 2 Inhibitory effect of baicalin on A. hydrophila. A: DMSO; B: PBS; C: 5 mg/mL baicalin; D: 10 mg/mL baicalin. |

|
| 图 3 不同浓度黄芩苷(mg/mL)作用下嗜水气单胞菌的生长曲线 Figure 3 The growth curves of A. hydrophila at different concentrations of baicalin (mg/mL). |
2.2 黄芩苷对嗜水气单胞菌生物膜的影响
为探讨黄芩苷对嗜水气单胞菌生物膜形成的影响,将菌株置于96孔板于浓度分别为2.00、1.00、0.50、0.25 mg/mL的黄芩苷中进行培养。采用结晶紫染色对生物被膜生物量进行定量,结果可见,黄芩苷处理组的生物膜OD570 (相对值)明显低于DMSO处理组(图 4),这些数据表明黄芩苷可以抑制生物膜的形成。

|
| 图 4 黄芩苷对嗜水气单胞菌生物膜形成的影响 Figure 4 Effect of baicalin on the formation of A. hydrophila biofilm. 0.25, 0.50, 1.00, 2.00 mg/mL of baicalin were incubated with A. hydrophila for 72 h, the biofilm formation was tested through a crystal violet straining method. The data are shown as the mean values and standard deviation of three independent experiments. Values are the mean±standard deviation. **: P < 0.01; ***: P < 0.001. |
2.3 黄芩苷对嗜水气单胞菌泳动的影响
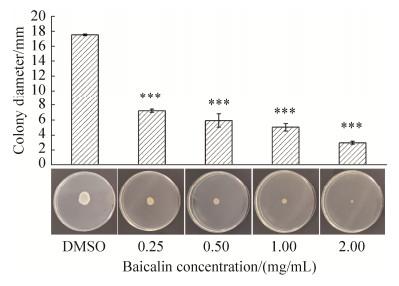
图 5为不同浓度黄芩苷对嗜水气单胞菌泳动能力的影响,结果表明,对照组的运动性明显高于黄芩苷处理组,黄芩苷浓度为2 mg/mL时,菌落运动直径仅为2.96 mm,浓度为1 mg/mL时菌落运动直径为5.04 mm,浓度为0.5 mg/mL时菌落运动直径为5.94 mm,尤其是浓度为0.25 mg/mL时,该浓度对细菌的生长没有抑制作用,但其运动直径为7.25 mm,这些结果同DMSO处理的对照(菌落运动直径为17.52 mm)相比有着显著差异性,说明黄芩苷可以显著抑制嗜水气单胞菌的泳动性,阻碍细菌的迁移能力。
|
| 图 5 黄芩苷对嗜水气单胞菌泳动能力的影响 Figure 5 Effect of baicalin on the swimming ability of A. hydrophila. The swimming assays were conducted on plates containing 0.3% of agar in the absence of different concentrations of baicalin (0.25, 0.50, 1.00, 2.00 mg/mL) or DMSO as control. The A. hydrophila was incubated for 24 h. Swimming diameters were measured using a caliper. The data represent the average values from three independent experiments performed in duplicate. Values are the mean±standard deviation. **: P < 0.01, ***: P < 0.001 compared with the DMSO treated group. |
2.4 黄芩苷对嗜水气单胞菌结构的影响
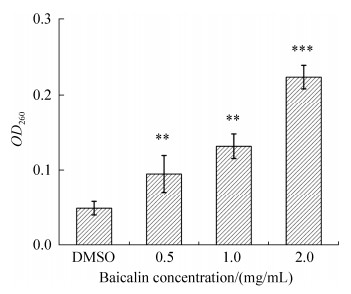
为了检测黄芩苷对细菌渗透性的影响,采用紫外可见分光光度计检测黄芩苷处理后嗜水气单胞菌上清液的260 nm (OD260)吸光值。结果表明,处理3 h后,黄芩苷可以显著提高嗜水气单胞菌上清液DNA总浓度(图 6),提示黄芩苷可能破坏细菌细胞结构,导致DNA泄漏。为了进一步证实黄芩苷对细胞结构的影响,利用透射电镜分析了黄芩苷对嗜水气单胞菌形态的影响。1 mg/mL黄芩苷处理8 h后,细菌的正常形态结构消失了,明显看到结构被破坏,菌体表面无光泽而且表面有明显凹陷,细胞壁明显褶皱(图 7),对照组嗜水气单胞菌菌体细胞壁和细胞膜连续完整,表面光滑,细胞结构完整,没有损伤。这些数据表明黄芩苷通过破坏细胞完整性抑制嗜水气单胞菌的生长。
|
| 图 6 黄芩苷处理嗜水气单胞菌后260 nm紫外吸收 Figure 6 OD260 values of supernatant from A. hydrophila after treatment with baicalin for 3 h. The data represent the average values from three independent experiments performed in duplicate. Values are the mean±standard deviation. **: P < 0.01; ***: P < 0.001. |

|
| 图 7 黄芩苷处理前后嗜水气单胞菌透射电镜图 Figure 7 TEM results of A. hydrophila after treatment with baicalin. A: DMSO treatment control; B: baicalin treatment group. |
2.5 黄芩苷对草鱼清除嗜水气单胞菌的影响
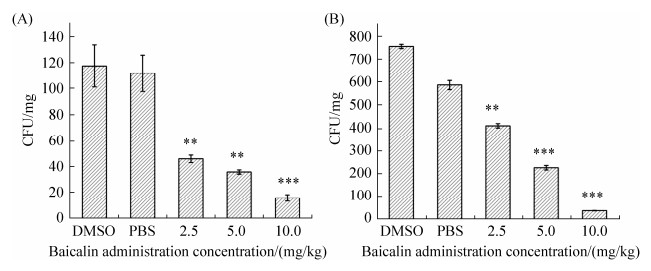
为了检测黄芩苷在体内对细菌增殖的影响,草鱼在感染嗜水气单胞菌2 h后,进行黄芩苷治疗实验,4 h后对草鱼各个组织的细菌菌量进行计算,结果显示对照组处理的嗜水气单胞菌在肝、脾的细菌数量明显高于黄芩苷处理组,肝脏中,DMSO对照组的细菌数量分别是10.0、5.0、2.5 mg/kg处理组的7.29、3.25和2.53倍(图 8-A),脾脏中,DMSO对照组的细菌数量分别是10.0、5.0、2.5 mg/kg处理组的19.26、3.31和1.83倍(图 8-B)。
|
| 图 8 嗜水气单胞菌攻毒后草鱼肝脾的菌落数 Figure 8 The number of colonies in the liver (A) and spleen (B) of grass carp after the challenge of A. hydrophila. |
3 讨论
近年来,由于抗生素的滥用等因素,尤其是生物膜为细菌提供了很好的保护作用,造成细菌耐药问题越来越严重。生物膜也称为生物被膜,是细菌粘附在一些组织表面的聚集体,防止细菌生物膜的形成,可以在一定程度上解决细菌耐药性愈演愈烈的问题。黄芩苷作为中医传统药用植物黄芩的主要有效成分,具有保肝、利胆、抗肿瘤、抗菌、抗病毒、抗氧化和调节免疫系统等多种药理作用[11-12],尤其是抗菌活性方面,对大肠杆菌[13]、耐甲氧西林金黄色葡萄球菌[5]、幽门螺杆菌[14]、单核细胞增生李斯特氏菌[15]和牙周炎病菌[16]等都有较好的抑菌作用,本研究也发现黄芩苷对嗜水气单胞菌具有良好的抗菌活性。并可以抑制嗜水气单胞菌生物膜的形成和泳动能力,且浓度越大,抑制作用越明显。之前研究发现黄芩苷可以抑制多种细菌生物膜的形成[17-20]。生物膜在形成和发展过程中需要附着和定殖,这些主要是由鞭毛运动介导的,也就是说细菌的运动性是形成生物膜必需的[10],泳动是细菌运动的一种重要方式,在铜绿假单胞菌中,黄芩苷可以抑制细菌的泳动性并抑制生物膜的形成[20]。这些结果说明黄芩苷通过抑制嗜水气单胞菌的泳动性来抑制生物被膜的形成。同时有研究显示黄芩苷可以破坏菌体细胞膜,抑制细菌DNA、RNA、蛋白质的生物合成和降解内毒素等[21]。细菌的细胞膜具有选择性渗透屏障的作用,控制胞内外物质交换和运输,同时也是细菌的重要代谢活动中心。本研究中,黄芩苷处理后菌液上清中OD260大量提高,说明黄芩苷增加了嗜水气单胞菌细胞膜的通透性,造成菌体DNA的逸出。进而通过透射电镜分析,黄芩苷处理后嗜水气单胞菌结构变形扭曲,皱缩凹陷。之前研究报道中黄芩苷可以抑制大肠杆菌活性,也是通过破坏细胞结构和增强其通透性来实现的[6]。
在体内研究中,我们以四大家鱼中的草鱼为模型研究黄芩苷对体内感染实验的影响,结果发现黄芩苷可以显著提高草鱼对嗜水气单胞菌的清除作用,本研究结果和之前研究结果具有一致性,如黄芩苷可以增强小鼠清除铜绿假单胞菌的能力[20],降低伤寒沙门氏菌感染小鼠后鼠盲肠细菌负荷[22],抑制幽门螺杆菌在小鼠体内生长[23],并对金黄色葡萄球菌肺炎小鼠具有保护作用[24], 降低耐甲氧西林金黄色葡萄球菌在体内的细菌负荷,保护小鼠病理组织损伤[5]。在家兔中通过抑制NF-kB和JNK信号通路来降低大肠杆菌和金黄色葡萄球菌引起的炎症反应[25]等。结合黄芩苷对其他细菌在体内外的作用,说明黄芩苷具有广谱抗菌性。
总之,本研究证明了中药单体黄芩苷通过抑制细胞泳动能力来抑制其生物膜的形成,并破坏细胞膜提高其渗透性,从而直接在体外杀死细菌,同时提高宿主对嗜水气单胞菌的清除作用,为黄芩苷在水产养殖病害防治中的应用提供了依据。
| [1] | Beaz-Hidalgo R, Figueras MJ. Aeromonas spp. whole genomes and virulence factors implicated in fish disease. Journal of Fish Diseases, 2013, 36(4): 317-388. |
| [2] | Bywater RJ. Veterinary use of antimicrobials and emergence of resistance in zoonotic and sentinel bacteria in the EU. Journal of Veterinary Medicine, Series B, 2004, 51(8/9): 361-363. |
| [3] | Novita H, Rusmana I, Yuhana M, Pasaribu FH, Lusiastuti AM. Uji in vitro bakteri anti quorum sensing pendegradasi acyl homoserine lactone Aeromonas hydrophila. Jurnal Riset Akuakultur, 2017, 11(3): 291. DOI:10.15578/jra.11.3.2016.291-296 |
| [4] |
Han F, Xing RH, Chen LQ, Chen L, Xiong W, Yang M, Zhao ZD. Research progress of anti-drug resistance in traditional Chinese medicine. China Journal of Chinese Materia Medica, 2016, 41(5): 813-817.
(in Chinese) 韩飞, 幸仁汇, 陈琳琦, 陈来, 熊魏, 杨明, 赵志冬. 中药抗细菌耐药性的研究进展. 中国中药杂志, 2016, 41(5): 813-817. |
| [5] | Zhang SP, Hu B, Xu JF, Ren QX, Wang ZC, Wang SH, Dong YJ, Yang GY. Baicalin suppress growth and virulence-related factors of methicillin-resistant Staphylococcus aureus in vitro and vivo. Microbial Pathogenesis, 2020(139): 103899. |
| [6] | Zhao QY, Yuan FW, Liang T, Liang XC, Luo YR, Jiang M, Qing SZ, Zhang WM. Baicalin inhibits Escherichia coli isolates in bovine mastitic milk and reduces antimicrobial resistance. Journal of Dairy Science, 2018, 101(3): 2415-2422. DOI:10.3168/jds.2017-13349 |
| [7] | Fu SL, Zhao WH, Xiong CH, Guo L, Guo J, Qiu YS, Hu CAA, Ye C, Liu Y, Wu ZY, Hou YQ. Baicalin modulates apoptosis via RAGE, MAPK, and AP-1 in vascular endothelial cells during Haemophilus parasuis invasion. Innate Immunity, 2019, 25(7): 420-432. DOI:10.1177/1753425919856078 |
| [8] |
Tan CD, Zhu MJ, Du SX, Yao YF. Study on the inhibition zone method in antimicrobial test. The Food Industry, 2016, 37(11): 122-125.
(in Chinese) 谭才邓, 朱美娟, 杜淑霞, 姚勇芳. 抑菌试验中抑菌圈法的比较研究. 食品工业, 2016, 37(11): 122-125. |
| [9] | Vasudevan P, Nair MKM, Annamalai T, Venkitanarayanan KS. Phenotypic and genotypic characterization of bovine mastitis isolates of Staphylococcus aureus for biofilm formation. Veterinary Microbiology, 2003, 92(1/2): 179-185. |
| [10] | Dressaire C, Moreira RN, Barahona S, Alves de Matos AP, Arraiano CM. BolA is a transcriptional switch that turns off motility and turns on biofilm development. mBio, 2015, 6(1): e02352-e02314. |
| [11] |
Zhu YN, Yang QM, Zhang S, Zhang M, Gao XL. Advances in pharmacological effects and mechanisms of baicalin and baicalein. Lishizhen Medicine and Materia Medica Research, 2020, 31(4): 921-925.
(in Chinese) 朱亚南, 杨七妹, 张硕, 张敏, 高秀丽. 黄芩苷与黄芩素药理作用及机制研究进展. 时珍国医国药, 2020, 31(4): 921-925. DOI:10.3969/j.issn.1008-0805.2020.04.048 |
| [12] | Song JW, Long JY, Xie L, Zhang LL, Xie QX, Chen HJ, Deng M, Li XF. Applications, phytochemistry, pharmacological effects, pharmacokinetics, toxicity of Scutellaria baicalensis Georgi. and its probably potential therapeutic effects on COVID-19:a review. Chinese Medicine, 2020(15): 102. |
| [13] |
Liu H, Zhao ZB, Wang X. Antimicrobial activity of baicalin to E. coli and relevant mechanism. Chinese Journal of Biologicals, 2019, 32(9): 983-986.
(in Chinese) 刘昊, 赵自冰, 王新. 黄芩苷对大肠埃希菌的抗菌活性及其作用机制. 中国生物制品学杂志, 2019, 32(9): 983-986. |
| [14] |
Wu J, Hu D, Wang KX. Study of Scutellaria baicalensis and baicalin against antimicrobial susceptibility of Helicobacter pylori strains in vitro. Journal of Chinese Medicinal Materials, 2008, 31(5): 707-710.
(in Chinese) 吴静, 胡东, 王克霞. 黄芩和黄芩苷对幽门螺杆菌的体外抗菌活性研究. 中药材, 2008, 31(5): 707-710. DOI:10.3321/j.issn:1001-4454.2008.05.028 |
| [15] |
Liu B, Lu J. Inhibitory effect of baicalin on Listeria monocytogenes in vitro. Anhui Medical and Pharmaceutical Journal, 2016, 20(2): 244-246.
(in Chinese) 刘彬, 卢军. 黄芩苷对单核细胞增生李斯特氏菌的体外抑菌作用研究. 安徽医药, 2016, 20(2): 244-246. DOI:10.3969/j.issn.1009-6469.2016.02.010 |
| [16] | Jiang M, Li ZN, Zhu GX. Protective role of flavonoid baicalin from Scutellaria baicalensis in periodontal disease pathogenesis: a literature review. Complementary Therapies in Medicine, 2018(38): 11-18. |
| [17] | Slachmuylders L, van Acker H, Brackman G, Sass A, van Nieuwerburgh F, Coenye T. Elucidation of the mechanism behind the potentiating activity of baicalin against Burkholderia cenocepacia biofilms. PLoS ONE, 2018, 13(1): e0190533. DOI:10.1371/journal.pone.0190533 |
| [18] | Wang JL, Jiao HH, Meng JW, Qiao MY, Du HX, He M, Ming K, Liu JG, Wang DY, Wu Y. Baicalin inhibits biofilm formation and the quorum-sensing system by regulating the MsrA drug efflux pump in Staphylococcus saprophyticus. Frontiers in Microbiology, 2019(10): 2800. |
| [19] |
Liu L, Lin H, Huang RS, Sun PH, Guo JL. Study on inhibitory effect of baicalin and baicalein on the formation of Streptococcus mutans biofilm. Traditional Chinese Drug Research & Clinical Pharmacology, 2017, 28(4): 464-467.
(in Chinese) 刘连, 林航, 黄若诗, 孙平华, 郭嘉亮. 黄芩苷、黄芩素对变形链球菌生物膜抑制作用的研究. 中药新药与临床药理, 2017, 28(4): 464-467. |
| [20] | Luo J, Dong BY, Wang K, Cai SQ, Liu TJ, Cheng XJ, Lei DQ, Chen YL, Li YN, Kong JL, Chen YQ. Baicalin inhibits biofilm formation, attenuates the quorum sensing-controlled virulence and enhances Pseudomonas aeruginosa clearance in a mouse peritoneal implant infection model. PLoS ONE, 2017, 12(4): e0176883. DOI:10.1371/journal.pone.0176883 |
| [21] | Huang YQ, Huang GR, Wu MH, Tang HY, Huang ZS, Zhou XH, Yu WQ, Su JW, Mo XQ, Chen BP, Zhao LJ, Huang XF, Wei HY, Wei LD. Inhibitory effects of emodin, baicalin, schizandrin and berberine on hefA gene: treatment of Helicobacter pylori-induced multidrug resistance. World Journal of Gastroenterology, 2015, 21(14): 4225-4231. DOI:10.3748/wjg.v21.i14.4225 |
| [22] | Wu SC, Chu XL, Su JQ, Cui ZQ, Zhang LY, Yu ZJ, Wu ZM, Cai ML, Li HX, Zhang ZJ. Baicalin protects mice against Salmonella typhimurium infection via the modulation of both bacterial virulence and host response. Phytomedicine, 2018(48): 21-31. |
| [23] | Chen ME, Su CH, Yang JS, Lu CC, Hou YC, Wu JB, Hsu YM. Baicalin, baicalein, and Lactobacillus rhamnosus JB3 alleviated Helicobacter pylori infections in vitro and in vivo. Journal of Food Science, 2018, 83(12): 3118-3125. DOI:10.1111/1750-3841.14372 |
| [24] | Qiu JZ, Niu XD, Dong J, Wang DC, Wang JF, Li H, Luo MJ, Li ST, Feng HH, Deng XM. Baicalin protects mice from Staphylococcus aureus pneumonia via inhibition of the cytolytic activity of α-hemolysin. The Journal of Infectious Diseases, 2012, 206(2): 292-301. DOI:10.1093/infdis/jis336 |
| [25] | Miao Y, Ishfaq M, Liu Y, Wu Z, Wang J, Li R, Qian F, Ding L, Li J. Baicalin attenuates endometritis in a rabbit model induced by infection with Escherichia coli and Staphylococcus aureus via NF-κB and JNK signaling pathways. Domestic Animal Endocrinology, 2021(74): 106508. |
 2021, Vol. 61
2021, Vol. 61




