中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张志宏, 杨娇, 张海鹏, 钟佑宏, 王鹏. 2021
- Zhihong Zhang, Jiao Yang, Haipeng Zhang, Youhong Zhong, Peng Wang. 2021
- 一株金黄色葡萄球菌噬菌体的裂解谱特异性和分子分类研究
- Host range and molecular classification of a Staphylococcus aureus bacteriophage
- 微生物学报, 61(7): 2043-2052
- Acta Microbiologica Sinica, 61(7): 2043-2052
-
文章历史
- 收稿日期:2020-07-31
- 修回日期:2020-09-29
- 网络出版日期:2020-12-14
2. 大理大学公共卫生学院, 云南 大理 671000;
3. 云南省地方病防治所, 云南省自然疫源性疾病防控技术重点实验室, 云南 大理 671000
2. School of Public Health, Dali University, Dali 671000, Yunnan Province, China;
3. Yunnan Provincial Key Laboratory of Natural Epidemic Disease Prevention and Control Technology, Yunnan Institute for Endemic Disease Control, Dali 671000, Yunnan Province, China
金黄色葡萄球菌(S. aureus)属于葡萄球菌属,广泛分布于自然界,是一种条件致病菌,可以引起人和动物感染[1]。该菌也是引起细菌性食物中毒和院内感染常见的病原体之一[2]。目前抗生素是金黄色葡萄球菌感染性疾病的主要治疗药物,但由于抗生素的滥用,细菌耐药问题越来越严重,特别是耐甲氧西林金黄色葡萄球菌(MRSA)菌株和耐万古霉素金黄色葡萄球菌(VRSA)菌株的出现[3],使治疗金黄色葡萄球菌的方法变的有限,促使我们寻找新的抗菌制剂。
噬菌体(bacteriophage,phage)是一类微生物病毒,因其能够特异性感染细菌、放线菌、真菌、支原体和螺旋体等微生物,从而具有用作抗菌剂的潜力[4]。噬菌体在治疗感染方面具有许多优点,如特异性高、作用机制独特等[5]。目前国内外已有将噬菌体用于疾病治疗的报道,Petrovic等[6]给13例严重金黄色葡萄球菌感染患者静脉注射噬菌体作为辅助治疗,未见不良反应;上海市公共卫生临床中心的团队通过噬菌体与抗生素联用成功治愈了1例泛耐药肺炎克雷伯菌感染患者[7];台湾莲花医院的一项研究表明噬菌体在院感防控方面也有良好前景[8]。
根据PATRIC (弗吉尼亚生物信息研究所)数据库显示,目前有超过390株金黄色葡萄球菌噬菌体被分离测序[9]。先前的一些动物实验和临床试验表明,金黄色葡萄球菌噬菌体在局部和全身感染中均有较好的保护效果,且安全性高[1, 10]。美国、印度等国家开发的金黄色葡萄球菌噬菌体裂解酶制剂正在进行2期临床试验,用以确定其在人体中的药代动力学、耐受性和安全性[11]。然而,噬菌体的高宿主特异性既是其优势,也是其在治疗过程中面临的弊端,关于噬菌体的宿主识别机制还需在蛋白质水平进行深入研究[9],因此,需要广泛分离、鉴定不同特性的噬菌体用于科研和应用。本研究在大理市几所医院内污水中进行金黄色葡萄球噬菌体分离,并进行系统鉴定。
1 材料和方法 1.1 菌株及来源涉及的菌株包括作为宿主的金黄色葡萄球菌ATCC25923,以及用于裂解谱分析的111株菌株,具体为葡萄球菌属37株(包括4株MRSA)、志贺菌属14株、棒状杆菌属5株、沙门菌属3株、耶尔森菌属5株、沙雷菌属7株、假单胞菌属3株、克雷伯菌属2株、肠杆菌属7株、柠檬酸杆菌属3株、变形杆菌属2株、念珠菌属9株、链球菌属3株、肠球菌属4株,埃希菌属、摩根菌属、伯霍尔德杆菌属、伯德特菌属、李斯特菌属、苍白杆菌属和产碱菌属各1株。
金黄色葡萄球菌ATCC25923以及4株MRSA由大理州中医院检验科惠赠;107株裂解谱分析菌株由云南省地方病防治所中心实验室保存。
1.2 污水采集及处理采集大理白族自治州人民医院(2份)、大理大学附属医院(1份)和大理市第一人民医院(1份)污水处理站处污水各1000 mL,用纱布过滤除去杂质,置于4 ℃冰箱中待检。
1.3 噬菌体的分离与纯化取20 mL污水处理样品,加入1 mL宿主菌、10 mL SM液(NaCl、MgSO4·7H2O、Tris-Cl、2%明胶)和10 mL LB液体培养基,37 ℃振荡培养18 h,混合培养液用细菌滤膜过滤后双层琼脂平板法铺板观察是否出现噬斑。对有噬斑的平板,挑取透亮、边缘清晰的单斑进行增殖纯化。重复纯化5次。
1.4 电镜观察通过SM液富集噬菌体,取20 μL样品滴到铜网上,沉淀15 min,向铜网中加入1滴2%的磷钨酸(PTA),10 min后,在日立HT7700透射电镜下观察噬菌体的形态。
1.5 裂解谱分析采用点滴法对111株菌株进行裂解谱测试,对裂解的菌株采用双层琼脂平板法进行确证实验。
1.6 最佳感染复数及一步生长曲线测定调整噬菌体滴度(PFU/mL),将不同MOI (0.001、0.01、0.1、1、10、100)的噬菌体与宿主菌混合液培养6 h,测定滴度。以MOI=1的比例在菌液中加入噬菌体,吸附5 min后取细菌沉淀,清洗2次移至LB液体培养基中在37 ℃下振荡培养。0-30 min内每5 min取1次样,30-60 min每10 min取1次样,测定噬菌体滴度。
1.7 基因组测序及分析按λ噬菌体DNA抽提试剂盒(北京艾比根生物技术有限公司)说明书进行噬菌体DNA抽提。提取的DNA送至中国军事科学院,使用Illumina HiSeq 2500测序并用Newbler 3.0进行拼接。全基因组序列通过在线Blast N进行比对,用RAST 2.0进行基因预测,预测的基因用在线PSI-BLAST进行手动验证。通过ICEberg 2.0在线数据库、抗生素耐药性数据库(CARD)和病原菌毒力因子数据库(VFDB)[12]检测基因组中是否含有已知的抗性基因和毒力基因。用CLC Genomics Workbench 12.02绘制基因图谱,用Easyfig 2.2[13]绘制vB_SauH_SAP1的全基因组比对图。用MEGA 7.0软件[14]通过邻接法(bootstrap设为1000)构建系统发育树。
2 结果和分析 2.1 噬菌体的分离鉴定从医院污水中分离得到1株金黄色葡萄球菌噬菌体,命名为vB_SauH_SAP1。5次纯化后可见噬斑边缘光滑、大小较均一,直径约为1.5-2.5 mm。透射电镜下vB_SauH_SAP1具有典型的正20面体结构和收缩性尾部,头部直径为(60±1) nm,尾部长度为(180±2) nm,根据其形态分类[15],该噬菌体属于肌尾噬菌体(图 1)。
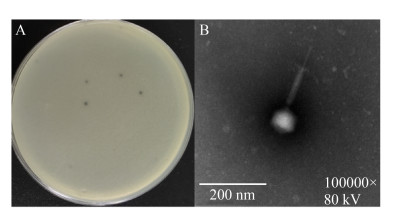
|
| 图 1 vB_SauH_SAP1形态 Figure 1 Morphology of vB_SauH_SAP1. A: plaque morphology; B: morphology by TEM. |
2.2 裂解谱
通过111株菌株进行裂解谱分析,结果有10株临床分离的葡萄球菌属细菌在一定温度下出现了噬斑,裂解情况如表 1所示。其余菌株未观察到裂解现象,表明vB_SauH_SAP1宿主特异性高,仅对部分葡萄球菌属菌株敏感。
| Strains | RT* | 28 ℃ | 37 ℃ |
| Staphylococcus aureus 98 | + | + | + |
| Staphylococcus aureus 109 | + | + | + |
| Staphylococcus aureus 138 | + | - | - |
| MRSA 3377 | + | + | + |
| Staphylococcus epidermidis 2 | + | + | + |
| Staphylococcus epidermidis 4 | + | + | + |
| Staphylococcus simulans 1 | + | + | + |
| Staphylococcus epidermidis 1 | + | + | + |
| Staphylococcus epidermidis 5 | + | + | + |
| Staphylococcus saprophyticus 2 | - | - | + |
| RT: room temperature (6-12 ℃). | |||
2.3 最佳感染复数及一步生长曲线
用不同MOI的vB_SauH_SAP1感染宿主菌ATCC25923,培养6 h后测定噬菌体滴度。当MOI=0.1时噬菌体滴度最高,因此,最佳感染复数为0.1。以取样时间为横坐标,vB_SauH_SAP1滴度的对数为纵坐标,绘制一步生长曲线[16] (图 2)。可见vB_SauH_SAP1在37 ℃感染ATCC25923后,10 min内滴度无明显变化,潜伏期约为10 min;在10-30 min内噬菌体滴度快速增加,表明裂解期约为20 min;30 min后噬菌体滴度趋于稳定,进入平台期。
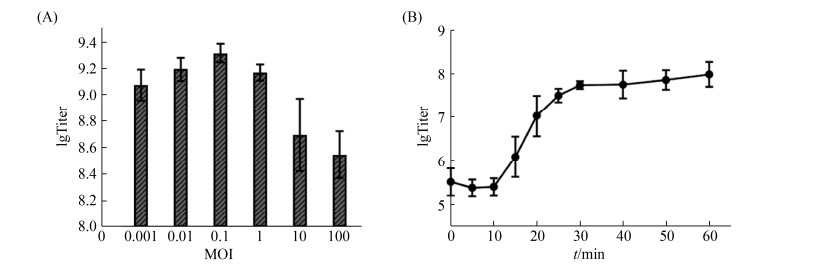
|
| 图 2 vB_SauH_SAP1的生物学特性 Figure 2 Biological characteristics of vB_SauH_SAP1. A: optimal MOI; B: one-step growth curve. The values indicate the means and standard deviations (SD) (n=3). |
2.4 基因组测序及结果分析
测序结果表明vB_SauH_SAP1基因组为双链DNA,全长143375 bp,G+C含量为30.2%,预测编码226个ORF,起始密码子包括ATG (209)、GTG (6)、TTG (11),全基因组的基因编码潜力为90.11%,平均每1 kb编码1.58个基因,多数基因为反向转录(73.1%,166个ORF) (图 3)。发现4个tRNA基因,未发现毒力基因和抗生素抗性基因。72个基因与已知功能的蛋白质具有显著相似性并推定了相应功能,其余基因注释为假定蛋白。基因序列NCBI登录号为:MT786458。

|
| 图 3 vB_SauH_SAP1基因结构图 Figure 3 Genome structure diagram of vB_SauH_ SAP1. |
vB_SauH_SAP1的功能预测基因分为5个模块:核苷酸代谢和复制、结构、裂解、DNA包装以及代谢,基因图谱如图 4所示。核酸代谢模块主要分布于13300-41238 bp和71857-100662 bp两个区域。其中DNA修复核酸外切酶(ORF154)、重组核酸内切酶(ORF179)以及重组核酸外切酶(ORF181)能够水解宿主核酸[17],核糖核苷酸还原酶(ORF172、173)将核糖核苷酸转化为脱氧核苷酸,二者共同提供合成噬菌体基因组的原材料;预测的DNA连接酶(ORF26)、DNA聚合酶(ORF166)、DNA引物酶(ORF177)以及DNA解旋酶(ORF185)催化合成噬菌体DNA[18];RNA聚合酶σ因子(ORF160)可以修饰宿主RNA聚合酶并识别噬菌体基因组启动子区域,实现噬菌体基因表达[19]。DNA包装模块中ORF2、ORF4预测为末端酶大亚基,ORF221预测为门蛋白。末端酶大亚基具有核酸内切酶和ATPase活性,能够切割DNA链形成噬菌体基因组并提供DNA链单向移动的能量;门蛋白是具有中央通道的环状同源寡聚体,通过与支架蛋白结合提供DNA装配的通道。末端酶和门蛋白结合形成强大的分子马达将DNA泵入病毒衣壳内[20]。发现3个裂解模块相关基因,穿孔素(ORF13)和裂解酶(ORF14)形成二元裂解系统发挥裂解宿主菌的作用。尾部裂解酶(ORF199)在噬菌体吸附之后引起细胞壁的局部溶解,有利于核酸注射[21]。结构模块主要包括散在的膜相关蛋白、衣壳相关蛋白(ORF215、218)以及尾部相关蛋白(ORF157、158、186、190、193、194、200、201、210、211),其中,尾部卷尺蛋白(ORF200)不仅与基因组注射有关,而且在噬菌体尾部组装和尾部长度测定中起重要作用[22-23]。
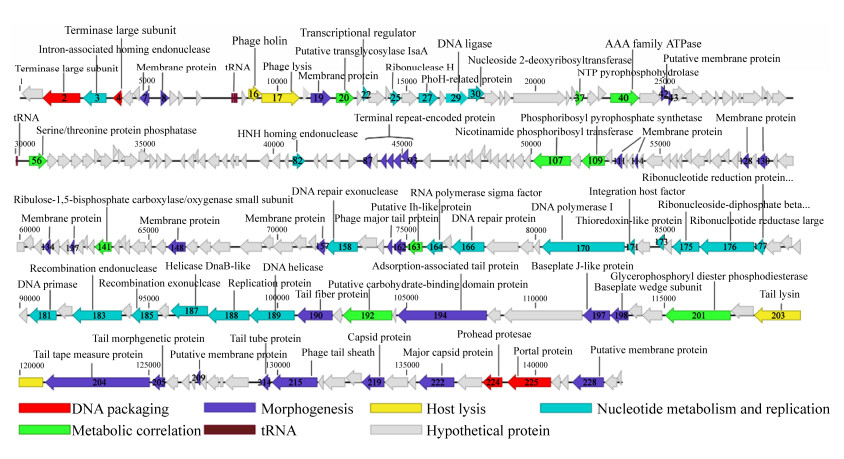
|
| 图 4 vB_SauH_SAP1基因功能注释 Figure 4 Genes function annotation of vB_SauH_SAP1. |
全基因组比对发现vB_SauH_SAP1与GeneBank中Kayvirus属葡萄球菌噬菌体同源性较高,覆盖率和相似性都在90%以上。选取同源性最高的4株噬菌体(表 2),将基因组进行共线性比较(图 5),显示vB_SauH_SAP1局部基因与其他4株噬菌体存在差异,且整体基因排布不同,是1株新的噬菌体。
| Phages | Time/Location | Coverage/% | Identity/% |
| Staphylococcus phage vB_SauH_IME522 | 2019/China | 96 | 99.91 |
| Staphylococcus phage HSA30 | 2017/South Korea | 96 | 98.78 |
| Staphylococcus phage VB_SavM_JYL01 | 2018/China | 95 | 98.79 |
| Staphylococcus phage P108 | 2014/China | 95 | 98.56 |

|
| 图 5 vB_SauH_SAP1与4株葡萄球菌噬菌体全基因序列比对 Figure 5 Genome comparison of vB_SauH_SAP1 with 4 Staphylococcus phages. |
2.5 系统发育树分析
通过在NCBI数据库中下载与vB_SauH_ SAP1末端酶大亚基同源性较高的氨基酸序列来构建系统发育树。结果表明vB_SauH_SAP1与GH15、P108、phiSA12等Kayvirus属葡萄球菌噬菌体关系更为密切(图 6)。

|
| 图 6 基于噬菌体末端酶大亚基氨基酸序列的系统发育树 Figure 6 Phylogenetic tree based on the terminase large subunit amino acid sequences of phages. Numbers on branch indicate bootstrap support values (1000 pseudo-replicates). The scale bar represents 0.01 sequence divergence (percent nucleotide substitutions). |
3 讨论
如今细菌耐药问题越来越突出,特别是多耐药(MDR)菌株的出现,逐渐缩小了某些病原体的可选药物范围[24],这对医护人员来说是一个巨大的挑战。噬菌体在对抗细菌方面的独特优势使其重新回到研究人员的视野。本研究分离到1株命名为vB_SauH_SAP1的金黄色葡萄球菌噬菌体,根据电镜下形态及基因组特征,该噬菌体属于Twortvirinae亚科Kayvirus属。先前研究中描述的Twort样噬菌体和国际病毒分类委员会(ICTV)最新分类的Twortvirinae亚科噬菌体是相同的[25],Twort样噬菌体被认为可能是最具有治疗应用前景的噬菌体之一[26]。
Twort样噬菌体的一个特征是编码裂解酶、DNA聚合酶等产物的基因被I组内含子打断[27],vB_SauH_SAP1末端酶大亚基基因中也发现类似的结构,且插入的序列中存在编码归巢核酸内切酶的基因,该基因能够使内含子具有移动性从而参与各个感染时期不同的转录类别[27]。此外,基因组中发现了4个tRNA基因,可能在一定程度上弥补噬菌体与宿主之间因G+C含量差异(vB_SauH_SAP1:30.2%,金黄色葡萄球菌:32.9%)导致的密码子使用问题,更有利于噬菌体生存[28]。
此次分离的噬菌体对部分葡萄球菌属菌株具有较高的裂解效率,特别是能够裂解MSRA菌株,但不能裂解其他种属细菌,充分验证了噬菌体裂解的种属特异性和种内有限性。噬菌体基因组中未检测到耐药基因或抗生素抗性基因,也未发现金黄色葡萄球菌Sau3AI限制性修饰系统识别序列(5′-GATC-3′)以及特异性核酸内切酶识别序列(5′-GGNCC-3′),对宿主的核酸酶切防御机制可能具有一定的抵抗能力[27]。T4样噬菌体侵染细菌时,首先需要尾丝蛋白与特定受体结合,其氨基酸序列的差异可能会导致不同的裂解范围[29]。vB_SauH_SAP1的尾丝蛋白氨基酸序列与葡萄球菌噬菌体vB_SauH_IME522和VB_SavM_JYL01仅有2个差异位点,裂解酶氨基酸序列则完全相同,但vB_SauH_SAP1对葡萄球菌的裂解能力(10/37)与vB_SauH_IME522 (4/10)[17]无差异而远小于VB_SavM_JYL01 (50/66)[30],其基因组中未发现编码RNA聚合酶的基因,需要借助宿主的转录系统,因此裂解谱差异可能来自对宿主菌转录翻译系统的利用能力[27]。
广泛分离、鉴定从而建立丰富的噬菌体库是将噬菌体用于防治病原菌感染的基础,而充分确证新噬菌体的裂解谱,确定分类地位,在挖掘噬菌体阶段至关重要。本研究分离的噬菌体vB_SauH_SAP1通过裂解谱分析以及生物学和基因组特性研究,具有一定的应用价值,但其基因组中还有许多编码功能未知蛋白质的基因,使其在实际应用中存在潜在的风险,因此还应进行更加深入、全面的研究。
| [1] | 郑盼盼. 金黄色葡萄球菌广谱噬菌体的分离及其体外裂菌活性研究. 上海交通大学硕士学位论文, 2015. |
| [2] |
Li XL, Feng HL, Li XP, Huang YM, Liang QW, Deng LQ. Isolation and screening of Staphylococcus aureus phage. Science and Technology of Food Industry, 2013, 34(15): 158-161, 165.
(in Chinese) 李雪玲, 冯惠玲, 李锡平, 黄玉敏, 梁庆文, 邓丽卿. 金黄色葡萄球菌噬菌体的分离筛选. 食品工业科技, 2013, 34(15): 158-161, 165. |
| [3] | Deen J, Seidlein LV, Andersen F, Elle N, White NJ, Lubell Y. Community-acquired bacterial bloodstream infections in developing countries in south and southeast Asia: a systematic review. Lancet Infectious Diseases, 2012, 12(6): 480-487. DOI:10.1016/S1473-3099(12)70028-2 |
| [4] |
Zhang LL, Li N, Zhao XY. Research progress of phage therapy. Beijing Medical Journal, 2011, 33(3): 232-235.
(in Chinese) 张立丽, 李宁, 赵秀英. 噬菌体治疗研究进展. 北京医学, 2011, 33(3): 232-235. |
| [5] | 郭棵棵. 一株铜绿假单胞菌RNA噬菌体的分离和鉴定. 第三军医大学硕士学位论文, 2016. |
| [6] | Fabijan AP, Lin RCY, Ho J, Maddocks S, Ben Zakour NL, Iredell JR, Westmead Bacteriophage Therapy Team. Safety of bacteriophage therapy in severe Staphylococcus aureus infection. Nature Microbiology, 2020, 5(3): 465-472. DOI:10.1038/s41564-019-0634-z |
| [7] | Bao J, Wu NN, Zeng YG, Chen LG, Li LL, Yang L, Zhang YY, Guo MQ, Li LS, Li J, Tan DM, Cheng MJ, Gu JM, Qin JH, Liu JZ, Li SR, Pan GQ, Jin X, Yao BX, Guo XK, Zhu TY, Le S. Non-active antibiotic and bacteriophage synergism to successfully treat recurrent urinary tract infection caused by extensively drug-resistant Klebsiella pneumoniae. Emerging Microbes & Infections, 2020, 9(1): 771-774. |
| [8] | Ho YH, Tseng CC, Wang LS, Chen YT, Ho GJ, Lin TY, Wang LY, Chen LK. Application of bacteriophage-containing aerosol against nosocomial transmission of carbapenem-resistant Acinetobacter baumannii in an intensive care unit. PLoS ONE, 2016, 11(12): e168380. |
| [9] | Azam AH, Tanji Y. Peculiarities of Staphylococcus aureus phages and their possible application in phage therapy. Applied Microbiology and Biotechnology, 2019, 103(11): 4279-4289. DOI:10.1007/s00253-019-09810-2 |
| [10] | Álvarez A, Fernández L, Gutiérrez D, Iglesias B, Rodríguez A, García P. Methicillin-resistant Staphylococcus aureus in hospitals: latest trends and treatments based on bacteriophages. Journal of Clinical Microbiology, 2019, 57(12): e1006-19. |
| [11] |
Wang ZF, Shan WY, Sun JH. Phage lysin: a new line of defense against drug-resistant Staphylococcus aureus. Chinese Journal of Antibiotics, 2018, 43(8): 958-965.
(in Chinese) 王兆飞, 单文雅, 孙建和. 治疗耐药金黄色葡萄球菌感染的新策略——噬菌体裂解酶. 中国抗生素杂志, 2018, 43(8): 958-965. DOI:10.3969/j.issn.1001-8689.2018.08.006 |
| [12] | Domingo-Calap P, Beamud B, Mora-Quilis L, González-Candelas F, Sanjuán R. Isolation and characterization of two Klebsiella pneumoniae phages encoding divergent depolymerases. International Journal of Molecular Sciences, 2020, 21(9): 3160. DOI:10.3390/ijms21093160 |
| [13] | Yazdi M, Bouzari M, Ghaemi EA, Shahin K. Isolation, characterization and genomic analysis of a novel bacteriophage VB_EcoS-Golestan infecting multidrug-resistant Escherichia coli isolated from urinary tract infection. Scientific Reports, 2020, 10(1): 7690. DOI:10.1038/s41598-020-63048-x |
| [14] | Yuan Y, Xi HY, Dai JX, Zhong YH, Lu SG, Wang TQ, Yang LH, Guan Y, Wang P. The characteristics and genome analysis of the novel Y. pestis phage JC221. Virus Research, 2020(283): 197982. |
| [15] |
Feng Y, Liu J, Sun Y, Feng SZ. An introduction to current classification and nomenclature of bacterial viruses. Chinese Journal of Veterinary Science, 2013, 33(12): 1954-1958.
(in Chinese) 冯烨, 刘军, 孙洋, 冯书章. 噬菌体最新分类与命名. 中国兽医学报, 2013, 33(12): 1954-1958. |
| [16] |
Li M, Han F, Lin H, Wang JX. Isolation, identification and physiological characterization of lytic phage against bacterium Salmonella sp.. Fisheries Science, 2013, 32(9): 531-535.
(in Chinese) 李萌, 韩峰, 林洪, 王静雪. 一株沙门氏菌烈性噬菌体的分离纯化与生理特性研究. 水产科学, 2013, 32(9): 531-535. DOI:10.3969/j.issn.1003-1111.2013.09.006 |
| [17] |
Gao MM, Liu HY, Li PY, Zhang ZH, Qin YH, Huang Y, Cui YJ, Pei GQ, Tong YG, Bai CQ. Isolation and complete genome analysis of Staphylococcus aureus bacteriophage vB_SauH_IME522. Journal of Third Military Medical University, 2020, 42(3): 229-240.
(in Chinese) 高明明, 刘慧莹, 李璞媛, 张志华, 秦艳红, 黄勇, 崔玉军, 裴广倩, 童贻刚, 柏长青. 金黄色葡萄球菌噬菌体vB_SauH_IME522的分离鉴定及全基因组分析. 第三军医大学学报, 2020, 42(3): 229-240. |
| [18] | Kropinski AM, Waddell T, Meng JC, Franklin K, Ackermann HW, Ahmed R, Mazzocco A, Yates J, Lingohr EJ, Johnson RP. The host-range, genomics and proteomics of Escherichia coli O157: h7 bacteriophage rV5. Virology Journal, 2013(10): 76. |
| [19] | O'Flaherty S, Coffey A, Edwards R, Meaney W, Fitzgerald GF, Ross RP. Genome of staphylococcal phage K: a new lineage of Myoviridae infecting gram-positive bacteria with a low G+C content. Journal of Bacteriology, 2004, 186(9): 2862-2871. DOI:10.1128/JB.186.9.2862-2871.2004 |
| [20] | Isidro A, Henriques AO, Tavares P. The portal protein plays essential roles at different steps of the SPP1 DNA packaging process. Virology, 2004, 322(2): 253-263. DOI:10.1016/j.virol.2004.02.012 |
| [21] | Hiromoto T, Meilleur F, Shimizu R, Shibazaki C, Adachi M, Tamada T, Kuroki R. Neutron structure of the T26H mutant of T4 phage lysozyme provides insight into the catalytic activity of the mutant enzyme and how it differs from that of wild type. Protein Science, 2017, 26(10): 1953-1963. DOI:10.1002/pro.3230 |
| [22] | Hsieh SE, Tseng YH, Lo HH, Chen ST, Wu CN. Genomic analysis of Staphylococcus phage Stau2 isolated from medical specimen. Virus Genes, 2016, 52(1): 107-116. DOI:10.1007/s11262-015-1276-8 |
| [23] | Cumby N, Reimer K, Mengin-Lecreulx D, Davidson AR, Maxwell KL. The phage tail tape measure protein, an inner membrane protein and a periplasmic chaperone play connected roles in the genome injection process of E. coli phage HK97. Molecular Microbiology, 2015, 96(3): 437-447. DOI:10.1111/mmi.12918 |
| [24] | Rossolini GM, Arena F, Pecile P, Pollini S. Update on the antibiotic resistance crisis. Current Opinion in Pharmacology, 2014(18): 56-60. |
| [25] | Barylski J, Enault F, Dutilh BE, Schuller MBP, Edwards RA, Gillis A, Klumpp J, Knezevic P, Krupovic M, Kuhn JH, Lavigne R, Oksanen HM, Sullivan MB, Jang HB, Simmonds P, Aiewsakun P, Wittmann J, Tolstoy I, Brister JR, Kropinski AM, Adriaenssens EM. Analysis of spounaviruses as a case study for the overdue reclassification of tailed phages. Systematic Biology, 2020, 69(1): 110-123. DOI:10.1093/sysbio/syz036 |
| [26] | Łobocka M, Hejnowicz MS, Dąbrowski K, Gozdek A, Kosakowski J, Witkowska M, Ulatowska MI, Weber-Dąbrowska B, Kwiatek M, Parasion S, Gawor J, Kosowska H, Głowacka A. Chapter 5-genomics of staphylococcal twort-like phages-potential therapeutics of the post-antibiotic era. Advances in Virus Research, 2012(83): 143-216. |
| [27] | Gu JM, Liu XH, Yang M, Li Y, Sun CJ, Lu R, Song J, Zhang QM, Lei LC, Feng X, Du CT, Yu H, Yang YJ, Han WY. Genomic characterization of lytic Staphylococcus aureus phage GH15: providing new clues to intron shift in phages. Journal of General Virology, 2013, 94(4): 906-915. DOI:10.1099/vir.0.049197-0 |
| [28] | Bailly-Bechet M, Vergassola M, Rocha E. Causes for the intriguing presence of tRNAs in phages. Genome Research, 2007, 17(10): 1486-1495. DOI:10.1101/gr.6649807 |
| [29] | Le S, He XS, Tan YL, Huang GT, Zhang L, Lux R, Shi WY, Hu FQ. Mapping the tail fiber as the receptor binding protein responsible for differential host specificity of Pseudomonas aeruginosa bacteriophages PaP1 and JG004. PLoS ONE, 2013, 8(7): e68562. |
| [30] | 冀亚路. 金黄色葡萄球菌噬菌体VB-SavM-JYL01的生物学特性及其对兔坏死性肺炎实验治疗的研究. 吉林大学硕士学位论文, 2019. |
 2021, Vol. 61
2021, Vol. 61




