中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王磊, 曹锡, 吴国芳, 陈永忠, 孟茹, 吴英, 王淑琴, 严德青, 张科, 张成图. 2021
- Lei Wang, Xi Cao, Guofang Wu, Yongzhong Chen, Ru Meng, Ying Wu, Shuqin Wang, Deqing Yan, Ke Zhang, Chengtu Zhang. 2021
- 日粮添加复合饲用益生菌对肉牛生长性能及肠道微生物的影响
- Effects of probiotics supplementation in feed on cattle growth and gut microbiota
- 微生物学报, 61(7): 2031-2042
- Acta Microbiologica Sinica, 61(7): 2031-2042
-
文章历史
- 收稿日期:2020-07-29
- 修回日期:2020-10-14
- 网络出版日期:2020-10-22
2. 西北农林科技大学动物科技学院, 陕西 杨凌 712100;
3. 西宁市动物疫病预防控制中心, 西宁 青海 810016
2. College of Animal Science and Technology, Northwest A & F University, Yangling 712100, Shaanxi Province, China;
3. Xining Animal Disease Prevention and Control Center, Xining 810016, Qinghai Province, China
反刍动物的前胃含有多种多样的原核(细菌、古菌和病毒)和真核微生物(原生动物及真菌[1]),其共同分解和发酵宿主动物摄入的饲料,为宿主提供能量物质。在反刍动物生产中,应用有益微生物或益生菌来帮助宿主平衡肠道菌群,改善肠道健康,从而尽可能地替代抗生素的使用,正在引起越来越多地研究兴趣。后肠微生物对于反刍动物至关重要,尤其是在幼龄阶段,后肠的微生物组成受pH、肠道蠕动、氧化还原电势及宿主分泌物等的影响[2],其与宿主之间存在很强的免疫互作[3]。目前,反刍动物营养干预的方式主要包括直接接种特定微生物和使用抑制或促进某些微生物定殖的添加剂[4]。已有研究表明,添加厌氧瘤胃真菌Neocallimastix sp. 增加了断奶仔犊的采食量和活体重[5];饮食添加2%的酵母可以增加牛犊干物质的摄入和生长,并略微改善瘤胃组织的发育[6]。本研究采用复合益生菌饮食干预肉牛,旨在评估益生菌对肉牛生长表型及后肠微生物组成的影响,从而寻找靶向调控表型生长的潜在有益微生物。
枯草芽孢杆菌(Bacillus subtilis)是生产中常用的可饲用益生菌,属于革兰氏阳性菌,在酸性、碱性或高温环境中可存活一定时间,具有良好的稳定性[8],其能够分泌诸多有益代谢物(粘菌素、过氧化氢、短杆肽和有机酸)[7],这些代谢物可以抑制有害细菌生长繁殖,调节肠道微生态的稳定,提高动物的抗病能力[9-10]。B. subtilis也可以分泌多种胞外酶,如淀粉酶、纤维酶和蛋白酶等酶,能够提高饲料利用率,促进动物生长[11]。地衣芽孢杆菌(Bacillus licheniformis)是一种在土壤中常见的革兰氏阳性嗜热细菌,其可通过促使机体产生抗菌活性物质来抑制病原菌的生长及繁殖[12]。酿酒酵母菌(Saccharomyces cerevisiae)属真菌类,属兼性厌氧菌。S. cerevisiae可以维持宿主胃肠道环境稳态,提高肠道抗病能力,分泌纤维素酶(纤维素酶,β-葡聚糖酶,木聚糖酶和β-葡糖苷酶)[13],调节上皮细胞防御素的表达水平,抑制有害微生物的繁殖[14]。
为进一步评估复合益生菌的潜在有益功能和替抗性能,为肉牛健康养殖提供合适的理论依据。本试验以枯草芽孢杆菌、地衣芽孢杆菌及酿酒酵母菌的复合菌剂进行肉牛饲喂试验,系统评估肉牛的生长性能、血液生理生化指标以及肠道微生物组成,为开发复合菌剂在肉牛健康绿色高效养殖上提供理论依据。
1 材料和方法 1.1 试验动物试验肉牛选自青海省西宁市大通回族土族自治县严忠合作社繁育的西门塔尔牛与荷斯坦牛的杂交1代,对42头22月龄左右的子1代称重、测量体尺后选取18头健康牛,按每组平均体重相近的原则,调整大小分为2组,每组9头,每3头一个圈舍进行饲喂,试验组为Y1组,对照组为Y2组。
1.2 试验动物饲喂及管理Y1组饲喂基础日粮和复合菌剂,采用的复合菌剂(反刍先锋,陕西杨凌富仕特生物科技有限公司)主要由枯草芽孢杆菌(≥5.0×107 CFU/g)、地衣芽孢杆菌(≥5.0×107 CFU/g)以及酿酒酵母(≥1.0× 108 CFU/g)按1︰1︰1的添加量复合而成,3株菌从山羊瘤胃和皱胃中分离所得。复合菌剂以豆粕为载体,豆粕的含量不超过5%。复合菌剂的添加量为50 kg/吨饲料。Y2组只饲喂基础日粮。各组饲喂的精料、粗料(燕麦干草与全株青贮玉米按4:6混合)均为定量饲喂(精料7.5 kg、粗料7.5 kg),每天按照定量分上午、下午2次平均饲喂,自由饮水。饲喂期内肉牛场内其他管理按常规管理程序进行。两组的精料组成及营养水平见表 1。共饲喂60 d。试验结束后,对试验肉牛进行空腹称重,体尺测定,计算相关指标日增长量;并静脉采血,离心收集血清,测定血液生理生化指标;肛门采粪,液氮冻存备用。
| Compositions | Content/% |
| Secondary corn | 56.00 |
| Soybean meal (43%) | 11.00 |
| Rapeseed meal (35%) | 8.00 |
| Wheat bran | 20.00 |
| Premix | 5.00 |
| Nutrient level | |
| Digestive energy (kcal/kg) | 3483 |
| Crude protein (CP, %) | 17.3 |
| Calcium (Ca, %) | 0.79 |
| Total phosphorus (%) | 0.67 |
1.3 体尺测量
体尺指标的测量参照常育贤(阿克苏市农区)等的方法[14],在试验开始前与饲喂期结束后分别测量了18头牛的体重、体斜长、体高、管围和胸围等数据。
1.4 血清样品的采集及指标测定于试验期结束后当天,上午饲喂前颈静脉采血10 mL,以3000 r/min转速于普通离心机上离心10 min,收集上清液于1.5 mL洁净且灭菌的离心管中,用液氮速冷后于-20 ℃下储存于低温冰箱中待测。血清中的总胆固醇(TC)采用Cholesterol Kit (HY-50061,北京华英生物技术研究所),甘油三脂(TG)采用Triglycerides Kit (HY-50062,北京华英生物技术研究所),尿素(Urea)采用Urea Kit (HY-N0015,北京华英生物技术研究所),血糖(GLU)采用Glucose Kit (HY-50063,北京华英生物技术研究所),尿酸(UA)采用Uric Acid Kit (HY-50064,北京华英生物技术研究所),以上指标用对应试剂做前期处理后,采用罗氏Cobas501全自动生化分析仪上机测定。三碘甲状原氨酸(T3)测定采用三碘甲状原氨酸(T3)测定试剂盒(酶联免疫法,HY-402,北京华英生物技术研究所),甲状腺素(T4)采用甲状腺素(T4)试剂盒(酶联免疫法,HY-10002,北京华英生物技术研究所),皮质酮(CORT)采用CORT ELISH KIT酶联免疫法测定(HY-10063,北京华英生物技术研究所)。其中,高密度脂蛋白胆固醇(HDL-CH)采用Direct HDL-Cholesterol Kit (HY-2372,北京华英生物技术研究所);低密度脂蛋白胆固醇(LDL-CH)采用Direct LDL-Cholesterol Kit(HY-N0033,北京华英生物技术研究所),肌酐(CRE)采用Creatinine Kit苦味酸法(HY-N0017,北京华英生物技术研究所),以上3个指标分别用对应试剂盒试剂前处理后采用分光光度计(ZG-EU-2200R,卓光,上海)进行测定。所有指标操作步骤参照试剂盒说明书进行。
1.5 粪便样品收集及DNA提取、建库和测序分析 1.5.1 样本收集:于试验期结束后当天,上午饲喂前逐头收集粪样于1.5 mL洁净无菌的离心管中,经液氮速冷后保存于-80 ℃冰箱中待进一步分析。
1.5.2 DNA提取与PCR扩增:使用E.Z.N.A.® soil试剂盒(Omega Bio-tek,Norcross,GA,USA)进行肉牛粪便样品总DNA的抽提,抽提步骤严格按照试剂盒说明书进行。使用NanoDrop2000检测所抽提的DNA浓度和纯度,并使用1%琼脂糖凝胶电泳检测提取的DNA的质量。对V3-V4可变区进行PCR扩增,采用的引物为338F (5ʹ-ACTCCTA CGGGAGGCAGCAG-3ʹ)和806R (5ʹ-GGACTACH VGGGTWTCTAAT-3ʹ)。扩增程序如下:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,27个循环;72 ℃ 10 min (ABI GeneAmp® 9700型)。扩增体系为20 μL,包括4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,10 ng DNA模板,其余用ddH2O补齐。
1.5.3 Illumina MiSeq测序:使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction试剂盒(Axygen Biosciences,Union City,CA,USA)进行DNA纯化,依次进行Tris-HCl洗脱及2%琼脂糖电泳检测。之后利用Quant Fluor TM-ST (Promega,USA)进行检测定量。根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。利用Illumina公司的MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司,上海)。
1.5.4 数据处理与统计分析:原始测序序列使用Trimmomatic软件质控,使用FLASH[15]软件进行拼接。使用UPARSE软件[16],根据97%的序列相似度将序列进行OTU聚类,并在聚类的过程中去除单序列和嵌合体,得到OTU的代表序列,将所有优化序列map至OTU代表序列,选出与代表序列相似性在97%以上的序列,生成OTU表格。利用RDP classifier[17]对每条序列进行物种分类注释,细菌的序列比对用Silva数据库[18],默认置信度阈值为0.7。最后对各样本的数据进行均一化处理,以样本中数据量最少的为标准进行均一化处理,后续的Alpha多样性分析和Beta多样性分析基于均一化后的数据。
使用QIIME软件(Version 1.9.1)计算Shannon、Simpson指数、UniFrac距离和构建UPGMA样本聚类树,使用R软件(Version 2.15.3)绘制稀释曲线和Venn图,并进行Alpha多样性指数组间差异分析。PCoA分析使用R软件的WGCNA,统计学分析采用Wilcox检验。LEfSe分析使用LEfSe软件,默认设置LDA Score的筛选值为4。进行Spearman相关性分析时,首先用R中psych包的corr.test函数计算物种和环境因子的Spearman相关系数值并检验其显著性,然后用pheatmap包中的pheatmap函数进行可视化。Simper (similarity percentage)分析使用R软件vegan包simper函数[19]。试验中的生长指标及血清数据采用SPSS 19.0进行One-way ANOVA的Duncan分析,P < 0.05为差异显著。生长指标用平均值±标准差表示。
2 结果和分析 2.1 日粮添加复合饲用益生菌对肉牛生长性能的影响为评估饲喂复合饲用益生菌对肉牛生长性能的影响,在试验结束后测量肉牛体斜长、体高、管围、胸围和体重。比较分析发现,Y1组显著的提高了肉牛胸围的日增量,但日增重两组之间没有显著差异(表 2)。
| Items | Y1 group | Y2 group | P value |
| Volume oblique growth rate/% | 12.95±3.155 | 9.034±5.138 | 0.069 |
| Average daily increment of body slant length/cm | 0.32±0.36 | 0.21±0.04 | 0.076 |
| Average daily gain in height/cm | 0.14±0.02 | 0.13±0.01 | 0.870 |
| Average daily increment of tube circumference/cm | 0.02±0.07 | 0.04±0.01 | 0.385 |
| Average daily increase in chest circumference/cm | 0.21±0.01 | 0.13±0.02 | 0.029 |
| Average daily weight/kg | 1.43±0.08 | 1.28±0.10 | 0.248 |
2.2 日粮添加复合饲用益生菌对肉牛血清生理生化指标的影响
测定Y1组和Y2组肉牛的血清生理生化指标发现:Y1组皮质酮含量显著高于Y2组(P < 0.05),血清低密度脂蛋白胆固醇、血清高密度脂蛋白胆固醇和血清总胆固醇含量均显著低于Y2组(P < 0.05),而尿素和空腹血糖、血清甘油三酯、肌酐、甲状腺素、尿酸、三碘甲状原氨酸,2组间差异不显著(P > 0.05)。具体结果见表 3。
| Items | Y1 group | Y2 group | P value |
| Urea/(mmol/L) | 3.68±0.5267 | 3.82±1.04 | 0.725 |
| GLU/(mmol/L) | 4.30±0.3100 | 4.42±0.19 | 0.331 |
| CORT/(μg/L) | 12.87±8.3066 | 5.57±1.51 | 0.021 |
| LDL-CH/(mmol/L) | 0.67±0.19 | 0.93±00.05 | 0.026 |
| TG/(mmol/L) | 0.21±0.0591 | 0.18±0.04 | 0.349 |
| HDL-CH/(mmol/L) | 1.60±0.21 | 2.14±0.43 | 0.040 |
| CRE/(μmol/L) | 101.11±17.11 | 108.44±27.21 | 0.503 |
| T4/(nmol/L) | 120.66±10.45 | 123.06±30.25 | 0.795 |
| UA/(μmol/L) | 37.33±15.76 | 27.44±5.790 | 0.096 |
| T3/(nmol/L) | 4.06±0.5462 | 3.73±0.93 | 0.332 |
| TC/(mmol/L) | 2.37±0.3919 | 3.16±0.68 | 0.008 |
2.3 日粮添加复合饲用益生菌对肉牛肠道细菌群落多样性的影响
对18个样品进行16S rRNA基因测序分析,总共生成1431025条clean reads,为研究各样本的物种组成,对所有样本的有效tags,以97%的一致性(identity)进行OTUs (operational taxonomic units)聚类,然后对OTUs的序列进行物种注释,共划分出2570个OTU,注释了36门,44个纲,99个目,175个科,391个属,238个种。将2570个OTU进行分析,发现如图 1-A所示,Y1组与Y2组两组间共有OTU数为1968,而Y1组特有的OTU数为428,Y2组则为159。

|
| 图 1 Y1和Y2两组中细菌群落的α多样性分析 Figure 1 α diversity analysis of bacterial community in feces samples. A: Venn diagram of bacteria at OTU level; B: Shannon index; C: Simpson index. |
为反映样本内的微生物群落的多样性,计算两组的Alpha Diversity指数中的Shannon指数(图 1-B)与Simpson多样性指数(图 1-C)。Y1和Y2组间的Shannon指数(P=0.26)与Simpson指数(P=0.33)均差异不显著。
在OTU水平,基于Unweighted Unifrac距离进行主坐标分析,结果表明,Y1组与Y2组两组间样品明显分组聚类,使用Mothur软件AMOVA函数进行组间差异分析发现,两组之间存在显著差异(R=0.238,P=0.001)(图 2)。

|
| 图 2 Y1、Y2两组细菌基于unweighted Unifrac的PCOA分析 Figure 2 PCOA analysis of two groups of bacteria Y1 and Y2 based on unweighted Unifrac. |
2.4 日粮添加复合饲用益生菌对肉牛肠道细菌群落组成的影响
对所有的样品进行不同分类水平分析,从图 3-A中可以发现:在门水平上,硬壁菌门(Firmicutes) (Y1=59.6%,Y2=57.9%),拟杆菌门(Bacteroidetes) (Y1=29.1%,Y2=28.1%),毛螺菌门(Spirochaetes) (Y1=6.9%,Y2=4.1%)和变形菌门(Proteobacteria) (Y1=2.3%,Y2=8.3%)为优势菌门,4种菌的相对丰度之和约占总体的97%-98%。对两组在门水平上Top10微生物相对丰度进行分析,发现Tenericutes的相对丰度在两组间均显著差异(P=0.026)。在科水平上,Ruminococcaceae在Y1组的相对丰度显著高于Y2组(P < 0.05)。

|
| 图 3 Y1、Y2两组中TOP10的肠道细菌在门(A)和属水平上(B)的组成及差异 Figure 3 The composition gut bacteria of Y1 and Y2 groups at phylum (A) and genus (B) level. |
在属水平上,如图 3-B所示,Y1、Y2组相对丰度位于Top10的菌属为Bacteroides、unidentified_Enterobacteriaceae等,分别占总丰度的11.5%及21.2%。其中Y1组Roseburia、Alistipes、Bacteroides为丰度较高的前3个属,总丰度约占7.1%,Y2组Bacteroides、Atopostipes、unidentified Enterobacteriaceae、Roseburia为丰度较高的前4个属,总丰度约占12.6%。Y1和Y2组的Alistipes (P=0.026)和Alloprevotella (P=0.034)相对丰度存在显著差异。
采用LEfSe (LDA Effect Size)分析鉴定益生菌添加2个组中的差异性标志微生物,由LDA值分布柱状图(图 4)发现,Y1组主要以Ruminococcaceae、Clostridiales和Clostridia为主,而Y2组主要以Bacilli和Lactobacillus和Prevotellaceae为主。

|
| 图 4 Y1、Y2两组中肠道细菌LEfSe分析图 Figure 4 The LEfSe analysis of gut bacteria in Y1 and Y2 groups. |
在种水平上,使用R软件vegan包Simper函数量化每个物种对两组之间差异的贡献度,分析两组间差异贡献度排名前10的物种,如图 5所示,结果发现Escherichia coli,Proteiniphilum_sp.,Veillonella_atypica,Petrimonas_mucosa,Clostridium_disporicum,Roseburia_inulinivora,Lactobacillus_amylovorus,Treponema_porcinum,Megasphaera_elsdenii,Alloprevotella_sp. 差异贡献度最高,特别是Y1组肉牛肠道中大肠杆菌(Escherichia coli)的丰度较低。

|
| 图 5 Simper量化微生物在种水平上对两组之间差异的贡献度 Figure 5 Simper quantifies the contribution of microbial to the difference between the two groups at the species level. The vertical axis represents the species, the horizontal axis is the sample, the bubble size represents the relative abundance of the species, and contribution is the contribution of the species to the differences between the two groups. |
|
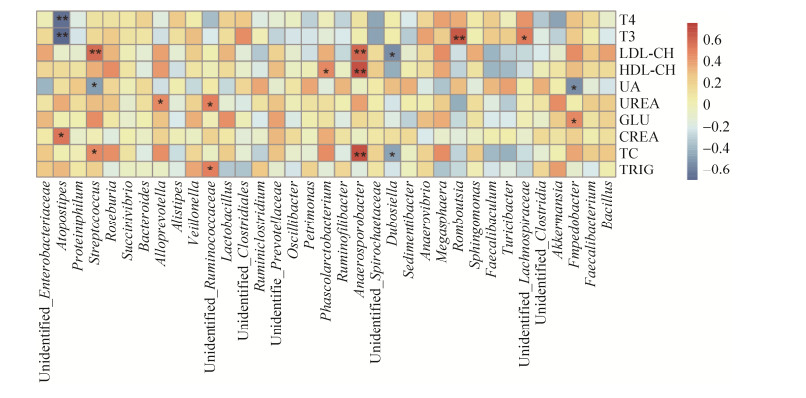
| 图 6 Y1、Y2两组中肠道细菌与血清生理生化指标关联分析 Figure 6 The correlation analysis between gut bacteria and serum physiological and biochemical indicators in Y1 and Y2 groups. |
2.5 肠道微生物与血清生理生化指标的关联性分析
以Spearman相关系数作为量度,对血清中的T4、T3、LDL、CH、HDL、CH、UA、UREA、GLU、CREA、TC、Trig指标与微生物在门水平上的物种进行关联性分析,发现Verrucomicrobia与T4呈显著的负相关,Spirochaetes与UA呈显著的正相关,增重与Proteobacteria呈显著的正相关。在属水平上分析发现,T3与Romboutsia呈现显著的正相关,LDL-CH、TC和HDL-CH与Anaerosporobacter呈现显著的正相关,另外LDL-CH与Streptococcus也呈显著的正相关,T4和T3与Atopostipes呈显著的负相关,如图 6所示。
3 讨论本试验对肉牛饲喂复合益生菌制剂,测定分析生长性能、血清生理生化指标及肠道微生物组成,发现复合益生菌制剂不会显著影响肉牛的日增重,显著地降低血清高密度胆固醇脂蛋白、低密度胆固醇脂蛋白与总胆固醇浓度,且显著影响肠道微生物的组成。
在肠道微生物层面,Y1组与Y2组相比,Atopostipes存在显著差异。Atopostipes最先在2004年于猪粪储藏坑中被分离出来,目前关于该菌研究相对较少,研究发现该菌在肠道内属于稀有微生物(即相对丰度很低),但其对动物的生殖功能有一定调节功能[20]。进行相关性分析发现该菌与T3、T4含量呈显著负相关(P < 0.05)。本实验饲喂期仅为60 d,相较于杨春涛[21]饲喂肉牛地衣芽孢杆菌改善了瘤胃发酵环境,其饲喂期为44周;汪丽芬[22]饲喂牛蜡样芽孢杆菌,其饲喂期为90 d,结果发现没有引起牛微生物区系的显著变化(P > 0.05),王一成[23]对小鼠进行益生菌饲喂实验(饲喂期为90 d),发现益生菌的饲喂引起了体重、脂肪含量等一系列指标的显著变化(P < 0.05)。由此可以判断,对于小型单胃动物,其体内微生物区系简单,饲喂益生菌60-90 d可以引起体尺等指标的较显著的变化,而对于牛羊等大型反刍动物,饲喂期较短时则较难引起生长指标的改变。
益生菌可降低体内胆固醇含量的研究较多。从1974年开始,MANN等便发现含L. acidophilus的酸奶对非洲男性的胆固醇含量有调节作用。在此后针对人类的研究中,人们发现通过口服等方法可以直接降低胆固醇的菌主要为乳杆菌属、双歧杆菌属,发现只有少数乳杆菌有类似的功能[24]。Anaerosporobacter (厌氧杆菌属)属于梭菌目,通过Spearman相关分析表明,该菌与血浆HDL-CH、LDL-CH、TC呈显著正相关(P < 0.01),该种菌最早于2007年从森林土壤中分离出来[25]。目前针对该种菌的研究已有很多,且大多与人类疾病相关。如王珊[26]发现由于该种菌含有氧化三甲胺(TMAO)代谢基因CutC/D,因而该菌丰度与TMAO含量呈正相关,而体内高TMAO含量的人群患慢性心血管疾病的概率更高。
Alistipes(另枝菌属)属理研菌科,在Y1组中的相对丰度显著高于Y2组(P < 0.05)。针对该菌的研究十分复杂,关于该菌对于个体是有害或是有益的相关研究有很多,但无论是何种研究,都肯定了该菌是生物肠道内常见的优势菌。认为该菌为有益菌的研究表明:应用三叶鬼针草作为益生元,提高了该菌的相对丰度,改善了鸡群健康;应用壳寡糖提高了该菌相对丰度[27],改善了抗生素处理导致的肠道微生物区系紊乱;森林姬鼠采食食物由昆虫转变为以植物的种子时,该菌相对丰度显著升高,帮助其更好地分解纤维素以利用能量。另一方面,针对雏鹅[28]研究发现,该菌相对丰度最高的组增重最低;综合来看,一定丰度的该菌能将乳酸转换生成挥发性脂肪酸,为动物体供能。
Alloprevotella (拟普雷沃氏菌属)的相关研究与上文提到的Alistipes类似,关于该菌的评价褒贬不一。它属于革兰阴性杆菌,专性厌氧菌。该菌可以利用碳水化合物,经过发酵作用产生乙酸和琥珀酸这两种主要的终末代谢产物[29]。研究发现具有高心血管风险的患者体内,Alloprevotella和Catenibacterium基本上是不存在的,这说明了拟普雷沃氏菌属具有降低患心血管风险的作用[30]。而在本实验的对照组中,添加复合菌剂后,该菌属相对丰度显著高于对照组,一定程度上可以论证添加复合菌剂有利于改善肉牛健康状况,实现健康福利养殖的目标。
在对比瘤胃球菌科时发现Y1组显著提高。反刍动物能够高效利用纤维性饲料作为其主要能量来源,主要的原因是通过瘤胃微生物对纤维性饲料进行降解与转化,其中最主要的纤维分解菌之一就是瘤胃球菌科。Wanapat等[31]使用定量PCR和Akin等[32]利用电子显微镜充分地论证了黄色瘤胃球菌(Ruminococcus flavefaciens)、白色瘤胃球菌(Ruminococcus albus)及产琥珀酸丝状杆菌(Fibrobacter succinogenes)是瘤胃内3种主要的纤维分解菌,白色瘤胃球菌和黄色瘤胃球菌是瘤胃中主要的纤维分解菌。这2种瘤胃球菌都属于严格厌氧型革兰氏阳性球菌,合成分泌出活性更高的纤维素酶和半纤维素酶,将结构复杂而且动物难以消化利用的纤维物质降解成纤维二糖、戊糖和挥发性脂肪酸,同时也具有溶解微晶纤维素的功能。它们在纤维的降解过程中起到非常重要的作用,是可以作为反刍动物消化利用纤维饲料的指标之一。例如白色瘤胃球菌,通过白色瘤胃球菌产生分泌的纤维素酶多酶复合体,从而实现对纤维饲料的高效降解,达到有效利用粗纤维的目的[33]。白色瘤胃球菌可以将葡萄糖和纤维二糖通过代谢作用,转化为琥珀酸、乙酸和甲酸,还有少量氢气、乙醇和乳酸等产物[34]。研究发现瘤胃中瘤胃球菌的相对丰度降低,则说明植物多糖的利用出现问题[35]。Y1组瘤胃球菌显著性提高,则表示肉牛对植物多糖的利用效率随之提高。在本试验中,经过饲喂Y1饲料后,瘤胃球菌科的丰度显著高于对照组,这表明通过添加复合菌剂后,明显改善了肠道微生物的组成,显著提高了瘤胃球菌的丰度,从而使反刍动物对纤维性饲料的利用效率大大提高,为畜牧生产节约成本、增加经济效益提供新方法。
本试验通过对试验组基础日粮中添加复合菌剂,测定试验组(Y1组)和对照组(Y2组)的生长性能、血液生理生化指标以及肠道微生物多样性,试验结果发现饲喂添加复合菌剂日粮后,肉牛的生长性能无显著差异,但改善了血液胆固醇和甘油三酯指标,饲喂复合菌剂也改变了肠道微生物区系的健康状态。饲喂复合益生菌后,益生菌通过其代谢产物直接或间接抑制了肠道有害微生物(如:大肠杆菌)的生长繁殖。综上所述,本试验为无抗养殖背景下的养殖方案提供一定思路,为促进经济、绿色、健康养殖提供理论依据。
| [1] | Flachowsky G. Rumen microbiology: burk a dehority (Ed.), Nottingham University Press, Nottingham, NG11 OAX, UK, 2003, hardcover, ISBN 1-897676-99-9, £ 40, 372 pp. Animal Feed Science and Technology, 2004, 113(1/4): 253-254. |
| [2] | Meale SJ, Li SC, Azevedo P, Derakhshani H, Devries TJ, Plaizier JC, Steele MA, Khafipour E. Weaning age influences the severity of gastrointestinal microbiome shifts in dairy calves. Scientific Reports, 2017, 7(1): 198. DOI:10.1038/s41598-017-00223-7 |
| [3] | Lyte M, Villageliú DN, Crooker BA, Brown DR. Symposium review: microbial endocrinology-why the integration of microbes, epithelial cells, and neurochemical signals in the digestive tract matters to ruminant health. Journal of Dairy Scienc, 2018, 101(6): 5619-5628. DOI:10.3168/jds.2017-13589 |
| [4] | Jeyanathan J, Martin C, Morgavi DP. The use of direct-fed microbials for mitigation of ruminant methane emissions: a review. Animal, 2013, 8(2): 250-261. |
| [5] | Theodorou MB. The effect of a fungal probiotic on intake and performance of early weaned calves. Animal Production, 1990, 50(5): 557. |
| [6] | Lesmeister KE, Heinrichs AJ, Gabler MT. Effects of supplemental yeast (Saccharomyces cerevisiae) culture on rumen development, growth characteristics, and blood parameters in neonatal dairy calves. Journal of Dairy Science, 2004, 87(6): 1832-1839. DOI:10.3168/jds.S0022-0302(04)73340-8 |
| [7] |
Yan Y, Liu YJ, Chen F. Overview of the application status of Bacillus subtilis. Biology Teaching, 2019, 44(2): 2-3.
(in Chinese) 闫杨, 刘月静, 陈芳. 枯草芽孢杆菌的应用现状概述. 生物学教学, 2019, 44(2): 2-3. DOI:10.3969/j.issn.1004-7549.2019.02.001 |
| [8] |
Cao Y. Research progress on the application of Bacillus subtilis in pig production. Chinese Journal of Animal Science, 2019, 55(9): 38-41.
(in Chinese) 曹阳. 枯草芽孢杆菌在养猪生产中的应用研究进展. 中国畜牧杂志, 2019, 55(9): 38-41. |
| [9] |
Cheng Y, Huang K, Huang XY, Zhong LX, Wu LH, Huang Q, Tang LN. Effects of dietary Bacillus subtilis on growth performance, immunity and anti-oxidation function of juvenile genetic improvement of farmed tilapia (GIFT, Oreochromis niloticus). Chinese Journal of Animal Nutrition, 2014, 26(6): 1503-1512.
(in Chinese) 程远, 黄凯, 黄秀芸, 钟灵香, 武林华, 黄清, 唐丽宁. 饲料中添加枯草芽孢杆菌对吉富罗非鱼幼鱼生长性能、免疫力和抗氧化功能的影响. 动物营养学报, 2014, 26(6): 1503-1512. DOI:10.3969/j.issn.1006-267x.2014.06.010 |
| [10] |
Li CF, Lin XH, Gu W. Application of Bacillus subtilis in feed production and environmental control. China Feed, 2013(1): 10-12, 17.
(in Chinese) 李春凤, 林显华, 谷巍. 枯草芽孢杆菌在饲料生产及环境防治中的应用. 中国饲料, 2013(1): 10-12, 17. DOI:10.3969/j.issn.1004-3314.2013.01.004 |
| [11] |
Liu X, Yao J, Xia YJ. Research progress on the application of Bacillus subtilis in solid-state fermented feed. Feed Research, 2020, 43(2): 113-116.
(in Chinese) 刘兴, 姚晶, 夏元军. 枯草芽孢杆菌在固态发酵饲料中的应用研究进展. 饲料研究, 2020, 43(2): 113-116. |
| [12] | Shafi J, Tian H, Ji MS. Bacillus species as versatile weapons for plant pathogens: a review. Biotechnology & Biotechnological Equipment, 2017, 31(3): 446-459. |
| [13] | Chuang WY, Hsieh YC, Lee TT. The effects of fungal feed additives in animals: a review. Animals, 2020, 10(5): 805. DOI:10.3390/ani10050805 |
| [14] |
Tian QZ, Jin X, Zhang M, Zhang ZY, Wang YH, Yang YF. Effects of cell wall of Saccharomyces cerevisiae on the expression of SBD-1 in cultured ruminal epithelial cells of sheep. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 927-934.
(in Chinese) 田巧珍, 金鑫, 张曼, 张召议, 王云鹤, 杨银凤. 酿酒酵母细胞壁诱导体外培养绵羊瘤胃上皮细胞表达SBD-1的研究. 畜牧兽医学报, 2018, 49(5): 927-934. |
| [15] | Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [16] | Cotta MA, Whitehead TR, Collins MD, Lawson PA. Atopostipes suicloacale gen. nov., sp. nov., isolated from an underground swine manure storage pit. Anaerobe, 2004, 10(3): 191-195. DOI:10.1016/j.anaerobe.2004.04.001 |
| [17] | Chen XB, Di PP, Wang HM, Li BL, Pan YJ, Yan SL, Wang YJ. Bacterial community associated with the intestinal tract of Chinese mitten crab (Eriocheir sinensis) farmed in Lake Tai, China. PLoS ONE, 2015, 10(4): e123990. |
| [18] | Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P, Peplies J, Glöckner FO. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools. Nucleic Acids Research, 2012, 41(D1): D590-D596. DOI:10.1093/nar/gks1219 |
| [19] | Clarke KR. Non-parametric multivariate analyses of changes in community structure. Austral Ecology, 2010, 18(1): 117-143. |
| [20] | Antwis RE, Edwards KL, Unwin B, Walker, S L, Shultz S. Rare gut microbiota associated with breeding success, hormone metabolites and ovarian cycle phase in the critically endangered eastern black rhino. Microbiome, 2019(7): 27. DOI:10.1186/s40168-019-0639-0/fulltext.html |
| [21] | 杨春涛, 刁其玉, 符运勤, 张乃锋, 屠焰. 不同益生菌组合对852周龄后备牛瘤胃发酵和细菌多样性的影响//第七届中国饲料营养学术研讨会论文集. 郑州: 中国畜牧兽医学会动物营养学分会, 2014: 479. |
| [22] |
Wang LF, Jiang JF, Ye HW, Tao X, Zhou WD. Effect of Bacillus cereus on the growth and intestinal microflora in weaning calves. Chinese Herbivore Science, 2010, 30(5): 16-19.
(in Chinese) 汪丽芬, 姜俊芳, 叶宏伟, 陶新, 周卫东. 蜡样芽孢杆菌对断奶犊牛生长及肠道菌群的影响. 中国草食动物科学, 2010, 30(5): 16-19. DOI:10.3969/j.issn.2095-3887.2010.05.004 |
| [23] |
Wang YC, Li Yan, Zhang J, Wei CL. Effects of different probiotics on mice obesity induced by high-fat diet. Acta Microbiology Sinica, 2018, 58(7): 1287-1297.
(in Chinese) 王一成, 李燕, 张晶, 魏长龙. 不同配方益生菌在高脂饮食诱导小鼠肥胖发生中的差异化作用. 微生物学报, 2018, 58(7): 1287-1297. |
| [24] | De Roos NM, Schouten G, Katan MB. Yoghurt enriched with Lactobacillus acidophilus does not lower blood lipids in healthy men and women with normal to borderline high serum cholesterol levels. European Journal of Clinical Nutrition, 1999, 53(4): 277-280. DOI:10.1038/sj.ejcn.1600722 |
| [25] | Jeong H, Lim YW, Yi HN, Sekiguchi Y, Kamagata Y, Chun J. Anaerosporobacter mobilis gen. nov., sp. nov., isolated from forest soil. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(8): 1784-1787. DOI:10.1099/ijs.0.63283-0 |
| [26] | 王珊. 不同人群血液氧化三甲胺水平与肠道菌群关联分析. 南方医科大学硕士学位论文, 2016. |
| [27] |
Zhao DL, Xie MJ. Effect of chitosan oligosaccharide on intestinal flora in mice using illumina-miseq high-throughput sequencing platform. Acta Nutrimenta Sinica, 2018, 40(5): 449-453.
(in Chinese) 赵丹莉, 谢明杰. 高通量测序技术分析壳寡糖对小鼠肠道菌群的影响. 营养学报, 2018, 40(5): 449-453. DOI:10.3969/j.issn.0512-7955.2018.05.008 |
| [28] |
Cheng MM, Zhang TR, Wang BW, Kong M, Zhang MA, Yue B, Ge WH. Effects of folic acid and vitamin B12 supplementations on caecal microflora structure of gosling. Chinese Journal of Animal Nutrition, 2018, 30(8): 2987-2996.
(in Chinese) 程漫漫, 张廷荣, 王宝维, 孔敏, 张名爱, 岳斌, 葛文华. 饲粮中添加叶酸和维生素B12对雏鹅盲肠菌群结构的影响. 动物营养学报, 2018, 30(8): 2987-2996. DOI:10.3969/j.issn.1006-267x.2018.08.015 |
| [29] |
Xiao XR, Li Y, Xiao LY. The novel species and genus discovered and nominated from the human oral cavity in 2009—2012. West China Journal of Stomatology, 2013, 31(2): 217-220.
(in Chinese) 肖晓蓉, 李燕, 肖丽英. 2009-2012年发现的人口腔细菌新种属简介. 华西口腔医学杂志, 2013, 31(2): 217-220. |
| [30] | Kong C, Gao RY, Yan XB, Huang LS, Qin HL. Probiotics improve gut microbiota dysbiosis in obese mice fed a high-fat or high-sucrose diet. Nutrition, 2019(60): 175-184. |
| [31] | Wanapat M, Cherdthong A. Use of real-time PCR technique in studying rumen cellulolytic bacteria population as affected by level of roughage in swamp buffalo. Current Microbiology, 2009, 58(4): 294-299. DOI:10.1007/s00284-008-9322-6 |
| [32] | Akin DE, Amos HE. Rumen bacterial degradation of forage cell walls investigated by electron microscopy. Applied and Environmental Microbiology, 1975, 29(5): 692-701. DOI:10.1128/am.29.5.692-701.1975 |
| [33] |
Cheng C, Hao YQ, Zhang LC. The improvement of DNA extract method for R. albus. Feed Industry, 2009, 30(2): 29-30.
(in Chinese) 程超, 郝永清, 张林冲. 白色瘤胃球菌DNA提取的优化试验. 饲料工业, 2009, 30(2): 29-30. |
| [34] |
Jiao WH, Li L. The structure and function of main bacteria in the rumen of cattle. The Chinese Livestock and Poultry Breeding, 2016, 12(2): 84.
(in Chinese) 焦万洪, 李莉. 牛瘤胃内主要细菌结构与功能探查. 中国畜禽种业, 2016, 12(2): 84. DOI:10.3969/j.issn.1673-4556.2016.02.063 |
| [35] | Flint HJ, Scott KP, Duncan SH, Louis P, Forano E. Microbial degradation of complex carbohydrates in the gut. Gut Microbes, 2012, 3(4): 289-306. DOI:10.4161/gmic.19897 |
 2021, Vol. 61
2021, Vol. 61




