中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 黄天晨, 杨建花, 唐梓静, 高乐, 张东远, 侯颖, 朱蕾蕾. 2021
- Tianchen Huang, Jianhua Yang, Zijing Tang, Le Gao, Dongyuan Zhang, Ying Hou, Leilei Zhu. 2021
- 裂解性多糖单加氧酶HcLPMO与纤维素酶协同降解纤维素
- Synergistic degradation of cellulose by lytic polysaccharides monooxygenase HcLPMO and cellulase
- 微生物学报, 61(7): 1971-1982
- Acta Microbiologica Sinica, 61(7): 1971-1982
-
文章历史
- 收稿日期:2020-07-10
- 修回日期:2020-10-20
- 网络出版日期:2020-11-05
2. 中国科学院天津工业生物技术研究所, 天津 300308;
3. 国家合成生物技术创新中心, 天津 300308
2. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China;
3. National Technology Innovation Center of Synthetic Biology, Tianjin 300308, China
纤维素是地球上重要的可再生资源,可被降解为可溶性可发酵糖,但其复杂的晶体结构阻碍了纤维素酶促水解的效率[1]。传统纤维素酶法降解对于底物结晶区域的降解效率低,需要对多糖底物进行预处理以提高糖苷水解酶的降解效率[2]。2010年Vaaje-Kolstad研究组首次发现裂解性多糖单加氧酶(lytic polysaccharide monooxygenases,LPMOs)是一类可以作用于多糖的氧化酶,能够通过氧化作用来断裂纤维素的糖苷键,使得结晶底物的结构趋于松散,为后续水解酶的进一步降解作用提供更多作用位点[3]。
LPMOs是一类铜依赖性加氧酶[4],在氧和外部电子供体存在下催化多糖中糖苷键的氧化裂解[5-6]。LPMOs主要通过位于保守的末端酪氨酸残基轴线上的关键残基和铜离子与相邻的两条纤维素链的相互作用,稳定地结合在纤维素的平坦疏水表面上[7-8]。迄今为止共发现约68种LPMOs,CAZy数据库基于序列相似性将LPMOs归类为辅助酶类家族[9] (auxiliary activity,AA),包括AA9、AA10、AA11、AA13[10-12]、AA14、AA15[13-14]及AA16[15]家族,主要作用于几丁质、淀粉和纤维素,能够有效协助几丁质酶、淀粉酶或纤维素酶对几丁质、淀粉和纤维素的降解[16]。
近年来,国内外对于LPMOs的应用研究着重于对预处理尤其是蒸汽爆破底物的协同降解。如Filiatrault-Chastel等发现Aspergillus japonicus BRFM 1487和1490在木质纤维素底物(蒸汽爆破麦秸和芒草)上产生的分泌蛋白组将葡萄糖产量提高了9%至16%[15]。Zhu等发现Schizophyllum commune(1种LPMO与纤维素酶混合酶)可以从预处理的生物质中获得更高的木聚糖水解效率。水解72 h后,此混合酶在预处理的柳枝中木聚糖转化率为75.9%,而市售来自于Trichoderma longibrachiatum的酶制剂在相同底物中仅水解19.1%的木聚糖[7];Petrovi等使用含LPMO的纤维素酶混合物Cellic® CTec2在抗坏血酸存在下比85% Novozym188 (C/N188)和15% BSA的混合物处理蒸汽爆破桦树96 h葡萄糖产率增加25%[17]。
HcLPMO是1种来源于Hahella chejuensis的LPMO[18],其具有1662bp的开放阅读框,编码554个氨基酸。HcLPMO蛋白具有3个不同的模块,AA10(最初被划分到碳水化合物结合域33家族carbohydrate-binding module family 33,CBM33;203个残基)和CBM2 (106个残基),由222个未知功能残基的区域连接。HcLPMO主要作用于纤维素,对于羧甲基纤维素和纤维低聚糖类具有弱内葡聚糖酶活性。HcLPMO在大肠杆菌中的表达量比较高,热稳定性较好,最适反应温度为45 ℃[18],是一个比较好的研究对象,可以用作纤维素酶的协同增效剂,以有效地降解纤维素晶体。本研究测定了其与纤维素酶协同降解微晶纤维素、碱处理玉米芯、汽爆玉米秸秆和木薯渣等不同多糖底物的降解效率,并研究了HcLPMO与纤维素酶降解微晶纤维素的最优配比。本研究为应用LPMOs与纤维素酶协同降解多糖物质提供了基础。
1 材料和方法 1.1 材料 1.1.1 菌株和质粒:大肠杆菌E. coli BL21 Gold (DE3)、pET-28a空载质粒及pET-28a-HcLPMO质粒均来自于课题组保存。HcLPMO的GenBank Accession No. ABC27701。
1.1.2 培养基和主要试剂:(1) LB培养基:Yeast Extract,5 g/L;Tryptone,10 g/L;NaCl,10 g/L。(2) LB固体培养基:在上述培养基中加入18 g/L的琼脂粉。(3) 主要试剂:10-乙酰基-3, 7-二羟基吩噁嗪(AmplexTM Ultra Red)购自美国Life Technologies公司;辣根过氧化物酶(HRP)购自上海艾研生物科技有限公司;纤维素酶(绿色木霉)购于绿源生物有限公司;异丙基硫代-β-D-半乳糖苷(IPTG)购于Sigma公司;质粒提取试剂盒购于天根生化科技有限公司,BCA蛋白浓度测定试剂盒购于Sangon biotech,Ni Sepharose 6 Fast Flow His标签蛋白纯化填料购于瑞典GE公司。超滤管购于德国Merck KGaA darmstadt;微晶纤维素(avicel)购于国药集团化学试剂有限公司,碱处理玉米芯、木薯渣和汽爆玉米秸秆(40-60目)均由中科院天津工业生物技术研究所工业生物系统工程研究组赠予。
1.2 HcLPMO的诱导表达和分离纯化首先将pET28a-HcLPMO重组质粒转化到表达宿主E. coli BL21 Gold (DE3)中,利用质粒提取试剂盒提取表达菌株的质粒并测序验证后,挑选阳性重组菌单菌落至含LB (50 μg/mL Kan)试管中过夜培养后,接种1%到400 mL LB培养基(50 μg/mL Kan)的2 L锥形瓶中培养(37 ℃,220 r/min)培养至OD600值为0.6左右,加入IPTG (终浓度为0.4 mmol/L)进行诱导表达(20 ℃,220 r/min,24 h)。6000 r/min离心15 min收集菌体,并将菌体重悬于20 mmol/L,pH 6.0磷酸钠缓冲液中。冰浴条件下超声破碎细胞,12000 r/min离心30 min,收集上清液并于0.22 μm膜过滤。使用Ni Sepharose 6 Fast Flow His标签蛋白纯化填料自填装镍柱纯化HcLPMO蛋白,用15倍柱体积含有20 mmol/L咪唑的washing buffer进行洗脱以除去杂蛋白,再用10倍柱体积250 mmol/L咪唑浓度洗脱液elution buffer洗脱得到HcLPMO纯酶。然后利用30 kDa超滤管除去咪唑后,用SDS-PAGE检测蛋白纯度,并用BCA蛋白浓度测定试剂盒测定蛋白浓度。
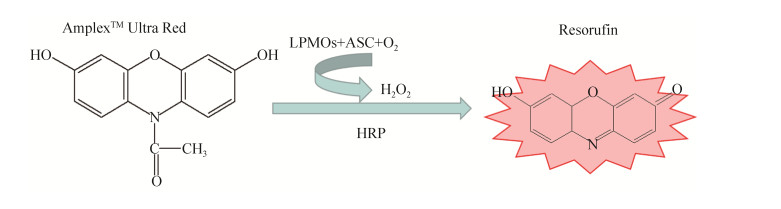
1.3 HcLPMO活性检测由于LPMOs酶活性检测复杂,Kittl等发现了一种新的检测方法,基于AmplexTM Ultra Red试剂为底物的荧光检测法[19]。AmplexTM Ultra Red是一种过氧化物酶荧光底物,通常用作H2O2探针,具有高灵敏度和稳定性。溶解性多糖单加氧酶能与电子供体在氧气存在的条件下反应生成过氧化氢,过氧化氢在辣根过氧化物酶的作用下,能够和AmplexTM Ultra Red反应生成具有荧光效应的试卤灵。试卤灵在激发波长560 nm,发射波长590 nm的条件下能够被检测,通过连续测定,以斜率(slope,RFU/s)反映LPMOs的相关氧化性质(图 1)。
|
| 图 1 LPMOs荧光分光光度法活性测定原理 Figure 1 Principle of LPMO activity determination based on AmplexTM Ultra Red. HRP: horseradish peroxidase; ASC: ascorbic acid sodium salt. |
HcLPMO氧化活性测定体系:HcLPMO 1 mg/mL,HRP 7.5 U/mL,抗坏血酸钠(ASC) 100 μmol/L,AmplexTM Ultra Red 50 μmol/L。
检测条件:激发波长560 nm,发射波长590 nm,通过连续测定,以斜率(slope,RFU/s)反映HcLPMO氧化活性,检测温度30 ℃。
1.4 HcLPMO诱导条件优化 1.4.1 装载量条件优化:100 mL锥形瓶分别装载为10-50 mL LB液体培养基(Kan 50 μg/mL),接种1%新鲜的pET-28a-HcLPMO培养液;培养1.5-2.0 h后,测OD600,接近0.6后向其中加入终浓度0.4 mmol/L IPTG,置于20 ℃,220 r/min诱导24 h;诱导完毕后,测量OD600,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)检测目的蛋白诱导表达量。
1.4.2 诱导表达温度条件优化:100 mL锥形瓶确定相关装载20 mL LB液体培养基(50 μg/mL Kan),接种1%新鲜的pET-28a-HcLPMO培养液,培养1.5-2.0 h后,测OD600,接近0.6后向其中加入终浓度0.4 mmol/L IPTG,分别置于10、20、30 ℃,220 r/min诱导24 h;诱导完毕后,测量OD600,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)检测目的蛋白诱导表达量。
1.5 HcLPMO活性检测条件优化 1.5.1 铜离子对HcLPMO活性测定的影响:镍柱纯化后,用pH 8.0的Tris-HCL缓冲液溶解目标蛋白,BCA法测蛋白浓度,按1:5比例加入CuSO4,在室温下放置30 min后,再除去游离Cu2+,用pH 6.0的磷酸钠缓冲液置换2-3遍后测定活性,与未加Cu2+比较[20],空白对照为pH 6.0磷酸钠缓冲液添加同量Cu2+,再通过超滤管除去游离Cu2+样品,其他条件与1.3中测定体系一致。
1.5.2 抗坏血酸盐对HcLPMO活性测定的影响:用已结合铜离子的HcLPMO为样品测定,终浓度为1 mg/mL;其中抗坏血酸盐终浓度选定10-1、10-2、10-3、10-4、10-5 mol/L;空白对照为pH 6.0磷酸钠缓冲液添加同量Cu2+,再通过超滤管除去游离Cu2+样品,其他条件与1.3中测定体系一致。
1.5.3 AmplexTM Ultra Red浓度对HcLPMO活性测定的影响:用已结合铜离子的HcLPMO为样品测定;其中AmplexTM Ultra Red终浓度选定为0.250、0.050、0.005 mmol/L;空白对照为pH 6.0磷酸钠缓冲液添加同量Cu2+,再通过超滤管除去游离Cu2+样品,其他条件与1.3中测定体系一致。
1.5.4 辣根过氧化物酶浓度对HcLPMO活性测定的影响:用已结合铜离子的HcLPMO纯酶为样品测定;其中辣根过氧化物酶HRP终浓度选定为75.00、37.50、7.50、3.75 U/mL;空白对照为pH 6.0磷酸钠缓冲液添加同量Cu2+,再通过超滤管除去游离Cu2+样品,其他条件与1.3中测定体系一致。
1.6 HcLPMO与纤维素酶协同降解微晶纤维素最优组合比例测定 1.6.1 反应体系:微晶纤维素4% (W/V),抗坏血酸钠2 mmol/L,20 mmol/L磷酸缓冲液(pH 6.0),总体积10 mL。反应温度45 ℃,220 r/min振荡反应72 h。取样2 mL,12000 r/min离心15 min,收取上清,上清液用0.22 μm滤膜除菌,液相测定葡萄糖含量。设定HcLPMO和纤维素酶总蛋白量0.5 mg/mL,共5组平行实验,其中HcLPMO和纤维素酶比值分别为0:5,1:4,2:3,3:2,4:1,5:0。
1.6.2 色谱条件:在柱温35 ℃下使用Bio-Rad Aminex HPX-87H柱。流动相为5 mmol/L硫酸溶液,流速为0.6 mL/min,进样量20 μL。通过折光指数检测器(refractive index detector,RID)又称示差折光检测器恒温35℃检测样品。
1.7 HcLPMO与纤维素酶对不同底物的协同降解为探究HcLPMO与纤维素酶对不同多糖底物的协同降解效果,分别选用碱处理玉米芯、木薯渣、汽爆玉米秸秆和微晶纤维素作为底物,反应
体系:底物4% (W/V),HcLPMO 0.1 mg/mL,纤维素酶0.4 mg/mL,ASC 2 mmol/L,Cu2+ 0.1 mmol/L用20 mmol/L磷酸缓冲液(pH 6.0)补足至10 mL,空白对照组不加HcLPMO、ASC和Cu2+,纤维素酶浓度为0.5 mg/mL,其他条件一致。45 ℃,220 r/min振荡反应72 h。反应结束后,取适量反应液,12000 r/min离心15 min,收取上清,上清液用0.22 μm滤膜除菌,液相检测葡萄糖产量。
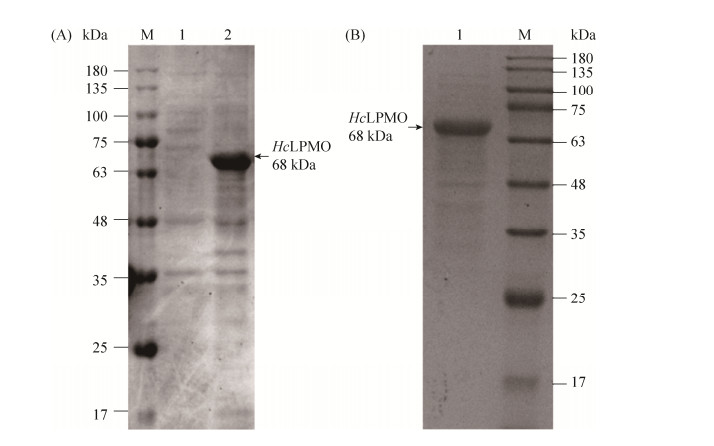
2 结果和分析 2.1 HcLPMO的表达和纯化对含pET28a-HcLPMO质粒的E. coli BL21(DE3)细胞用终浓度0.4 mmol/L的IPTG进行诱导表达,然后利用SDS-PAGE检测HcLPMO表达情况。结果如图 2-A所示,由图 2-A可以看出,HcLPMO经IPTG诱导后,在E. coli BL21(DE3)中能够大量地表达;蛋白质实际分子量约为68 kDa。采用镍柱亲和层析纯化HcLPMO蛋白,其SDS-PAGE结果如图 2-B所示,证明在目的基因后添加的组氨酸标签起到亲和层析的作用,保证目的蛋白能够通过镍柱进行纯化。
|
| 图 2 诱导表达及纯化后HcLPMO SDS-PAGE Figure 2 SDS-PAGE of HcLPMO after induced expression and purification. A: SDS-PAGE of HcLPMO after induced expression. M: protein marker; lane 1: uninduced HcLPMO; lane 2: induced HcLPMO. B: SDS-PAGE of purified HcLPMO. M: protein marker; lane 1: purified HcLPMO. |
2.2 HcAA10-2氧化活性测定
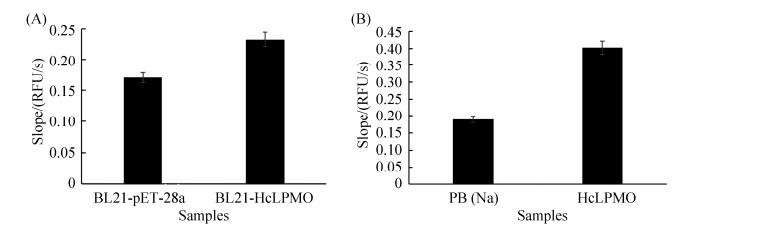
测定HcLPMO的氧化活性表明:诱导表达的HcLPMO的大肠杆菌细胞破碎液的荧光强度明显高于含空载pET-28a的大肠杆菌细胞破碎液的荧光强度(图 3-A)。将HcLPMO进行纯化后,纯酶表现出较高的LPMO酶氧化活性(图 3-B),验证了AmplexTM Ultra Red试剂为荧光底物的荧光检测法测定HcLPMO活性的可行性。
|
| 图 3 全细胞及纯酶HcLPMO氧化活性测定 Figure 3 Activity determination of HcLPMO in whole cell and purified HcLPMO. A: activity determination of HcLPMO in whole cell; B: activity determination of purified HcLPMO. PB(Na): pH 6.0 sodium phosphate buffer. Data were represented as mean±SD (n=2). |
2.3 HcLPMO诱导条件优化 2.3.1 装液量条件优化:
结合图 4可得知:在不同装液量条件下,宿主细胞大肠杆菌生长OD600相差不大,但在20%装液量时所产HcLPMO活性较高,因此较优装液量为20%。

|
| 图 4 不同装液量菌体OD600及全细胞活性 Figure 4 OD600 and activity of whole cell at different culture volumes. A: OD600 at different culture volumes; B: activity of whole cell at different culture volumes. Data were represented as mean±SD (n=2). |
2.3.2 诱导温度条件优化:
结合图 5-A可得知,在10 ℃诱导温度下大肠杆菌OD600明显偏低,生长缓慢,20 ℃、30 ℃诱导温度下OD600相差不大,但从图 5-B中可以看到20 ℃诱导温度下所产HcLPMO活性较高,因此较优诱导温度为20 ℃。

|
| 图 5 不同诱导温度条件下菌体OD600及全细胞活性 Figure 5 OD600 and activity of whole cell at different induction temperature. A: OD600 at different induction temperature; B: activity of whole cell at different induction temperature. Data were represented as mean±SD (n=2). |
2.4 HcLPMO活性检测条件优化
基于AmplexTM Ultra Red试剂为荧光底物的荧光检测法测定HcLPMO活性时,探究抗坏血酸盐、环境温度、铜离子、AmplexTM Ultra Red浓度以及辣根过氧化物酶浓度等条件对活性测定产生的影响,结果如图 6,发现HcLPMO与铜离子结合以及ASC浓度对于HcLPMO的活性影响较大;在HcLPMO与铜离子结合后,活性测定时提高较多(图 6-A);HcLPMO活性测定时,在高ASC浓度情况下,HcLPMO活性测定较高,但此为ASC本身带来的背景,空白对照在相同条件下测出来相当高的值,而当ASC浓度降低到10-4 mol/L时,活性测定的背景趋于稳定为0.17左右,ASC浓度再降低时,无法为HcLPMO活性测定提供足够的电子,因此最终选择ASC终浓度为10-4 mol/L (图 6-B);AmplexTM Ultra Red浓度以及辣根过氧化物酶浓度对活性测定影响较小,考虑到经济性与操作性,故AmplexTM Ultra Red终浓度为0.05 mmol/L (图 6-C);辣根过氧化氢酶终浓度为7.5 U/mL (图 6-D)。

|
| 图 6 不同因素对HcLPMO活性测定的影响 Figure 6 Effect of different factors on the determination of HcLPMO activity. A: effect of copper ions on the determination of HcLPMO activity; B: determination of HcLPMO enzyme activity under different ascorbate concentrations; C: determination of HcLPMO activity at different AmplexTM Ultra Red concentrations; D: determination of HcLPMO activity at different horseradish peroxidase concentrations. Data were represented as mean±SD (n=2). |
2.5 HcLPMO与纤维素酶协同降解微晶纤维素的最优组合比例
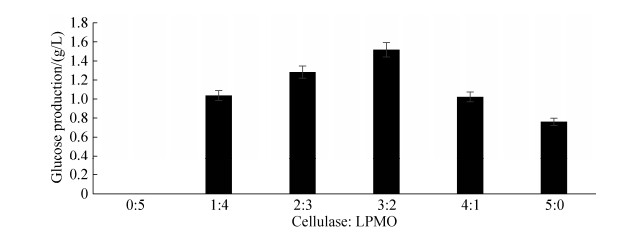
本研究在酶蛋白总载量为0.5 mg/mL条件下,将HcLPMO与纤维素酶按不同比例组合协同降解微晶纤维素,结果如图 7所示。在纤维素酶用量为0 mg/mL时,即单独使用0.5 mg/mL的HcLPMO纯酶处理微晶纤维素时,无葡萄糖产生,证明HcLPMO无纤维素酶活性。随着纤维素酶含量逐步增加,即HcLPMO与纤维素酶比例的降低,葡萄糖的产量也逐步增加。当HcLPMO与纤维素酶比例为2:3时,水解反应72 h后,若排除抗坏血酸和Cu2+对纤维素酶的影响,与0.5 mg/mL纯纤维素酶降解效率相比,葡萄糖产量从0.76 g/L提升到1.52 g/L,即微晶纤维素的降解率提高了99.38%;若不排除抗坏血酸和Cu2+对纤维素酶的影响,微晶纤维素的降解效率更高。当纤维素酶用量为0.4 mg/mL时,即HcLPMO与纤维素酶比例为1:4时,与单独使用0.5 mg/mL纤维素酶处理微晶纤维素相比,其葡萄糖产生率仅提高了34.29%,与最优比例下葡萄糖产量差距明显。
|
| 图 7 不同比例HcLPMO与纤维素酶组合对微晶纤维素协同降解 Figure 7 Synergistic degradation of avicel by HcLPMO and cellulase with different proportions. Data were represented as mean±SD (n=2). |
2.6 HcLPMO与纤维素酶对不同底物的协同降解
本研究用HcLPMO与纤维素酶协同处理不同底物如微晶纤维素、汽爆玉米秸秆、碱处理玉米芯和木薯渣时发现,针对前处理过如蒸汽爆破或碱处理的底物,LPMO与纤维素酶协同效果更好,其中汽爆玉米秸秆的降解效果提升最为明显,相比于0.5 mg/mL纤维素酶单独处理,用HcLPMO替换其中20%蛋白时,葡萄糖产量提高了63.81%;微晶纤维素的葡萄糖产量相对提高了59.43%;相同条件下,碱处理玉米芯葡萄糖产量提高了35.41%;而未经前处理的木薯渣仅提高了11.06% (图 8)。Sanhueza等用GtLPMO取代Celluclast 1.5 L (一种商业纤维素酶)10%情况下水解用碱处理的小麦秸秆时,还原糖产量提高35%[8],与本研究用HcLPMO替代纤维素酶处理碱处理的玉米芯效果相近。

|
| 图 8 HcLPMO与纤维素酶协同降解不同底物 Figure 8 Synergistic degradation of different substrates by HcLPMO and cellulase. Data were represented as mean±SD (n=2). |
3 讨论
本研究利用大肠杆菌成功实现了HcLPMO的异源表达,优化诱导表达条件,确定较优诱导装液量为20%,较优诱导温度为20 ℃,并利用镍柱获得了HcLPMO的纯酶。实验发现,离子结合以及ASC浓度对HcLPMO的活性影响较大,应注意比例。采用AmplexTM Ultra Red试剂为底物的荧光光度法检测到该酶的氧化活性,并优化了此检测方法的条件,发现此检测方法中的各组分应合理配比,减小背景荧光,从而反映HcLPMO真实活性。本研究HcLPMO活性测定条件的优化为使用AmplexTM Ultra Red为荧光底物使用荧光分光光度法进行稳定有效的LPMOs活性检测奠定了基础。
本研究对LPMOs与纤维素酶协同降解微晶纤维素的组合比例进行了优化,结果表明LPMOs与纤维素酶比例不同,协同降解效果也不相同。在相同酶载量情况下,HcLPMO与纤维素酶比例对其降解微晶纤维素的效果有显著影响,当HcLPMO与纤维素酶组合比例为2:3时,其降解微晶纤维素的效果最好,葡萄糖产量比0.5 mg/mL纤维素酶单独处理微晶纤维素时提高了99.38%。Du等研究纤维素酶和AnLPMO15g不同用量协同作用时,最高能提高93%,与本研究提高效率相近[4];Zhang等研究重组PMO9A_MALCI和纤维素酶制剂CellicCtec2以9:1的比例相对于8:2比例作用于酸、碱处理的稻草和桦树的水解水平都有所提高[21],与本研究中最优比例不同,原因可能是不同种类LPMOs作用于不同底物时具有不同的合适配比。但这进一步证明合适的LPMOs与纤维素酶比例或许是帮助酶法降解纤维素实际应用过程中提高效率不可或缺的一方面。
针对不同底物,LPMOs与纤维素酶降解效率也都不相同。本研究用HcLPMO与纤维素酶协同作用处理4种不可溶多糖底物,即用20% HcLPMO代替纤维素酶,发现4种多糖的降解效率均有所提升;但经过前处理的底物汽爆玉米秸秆、微晶纤维素和碱处理玉米芯的降解效率提升明显,葡萄糖产量分别提升了63.81%、59.43%和35.41%;而未经前处理的木薯渣葡萄糖产量仅提高了11.06%。Du等研究发现来源于Aspergillus niger的AnLPMO15g和纤维素酶对不同底物水解过程中的协同活性也有很大区别,预处理过的秸秆协同度(1.27)相比于微晶纤维素(1.182)、羧甲基纤维素(0.993)效果都有所提升[4]。而本研究进一步验证了底物前处理对于木质纤维素降解应用的帮助,也为LPMOs应用效率的提高提供了参考。
| [1] |
Li YH, Zhao FK. Advances in cellulase research. Chinese Bulletin of Life Sciences, 2005, 17(5): 392-397.
(in Chinese) 李燕红, 赵辅昆. 纤维素酶的研究进展. 生命科学, 2005, 17(5): 392-397. DOI:10.3969/j.issn.1004-0374.2005.05.005 |
| [2] |
Shi XW, Zhang WT, Zhang XF, Yang GY, Feng Y. The heterologous expression and characterization of lytic polysaccharide monooxygenase from Actinosynnema mirum DSM 43827. China Biotechnology, 2014, 34(7): 17-23.
(in Chinese) 施贤卫, 张伟涛, 张小飞, 杨广宇, 冯雁. Actinosynnema mirum DSM43827溶解性多糖单加氧酶的异源表达和酶学性质表征. 中国生物工程杂志, 2014, 34(7): 17-23. |
| [3] | Hemsworth GR, Davies GJ, Walton PH. Recent insights into copper-containing lytic polysaccharide mono-oxygenases. Current Opinion in Structural Biology, 2013, 23(5): 660-668. DOI:10.1016/j.sbi.2013.05.006 |
| [4] | Du LP, Ma LJ, Ma Q, Guo GJ, Han XX, Xiao DG. Hydrolytic boosting of lignocellulosic biomass by a fungal lytic polysaccharide monooxygenase, AnLPMO15g from Aspergillus niger. Industrial Crops and Products, 2018(126): 309-315. |
| [5] | Kuusk S, Kont R, Kuusk P, Heering A, Sørlie M, Bissaro B, Eijsink VGH, Väljamäe P. Kinetic insights into the role of the reductant in H2O2-driven degradation of chitin by a bacterial lytic polysaccharide monooxygenase. Journal of Biological Chemistry, 2018, 294(5): 1516-1528. |
| [6] | Wu M, Beckham GT, Larsson AM, Ishida T, Kim S, Payne CM, Himmel ME, Crowley MF, Horn SJ, Westereng B, Igarashi K, Samejima M, Ståhlberg J, Eijsink VGH, Sandgren M. Crystal structure and computational characterization of the lytic polysaccharide monooxygenase GH61D from the basidiomycota fungus phanerochaete chrysosporium. Journal of Biological Chemistry, 2013, 288(18): 12828-12839. DOI:10.1074/jbc.M113.459396 |
| [7] | Zhu N, Liu J, Yang J, Lin Y, Yang Y, Ji L, Li M, Yuan H. Comparative analysis of the secretomes of Schizophyllum commune and other wood-decay basidiomycetes during solid-state fermentation reveals its unique lignocellulose- degrading enzyme system. Biotechnology for Biofuels, 2016(9): 42. |
| [8] | Sanhueza C, Carvajal G, Soto-Aguilar J, Lienqueo ME, Salazar O. The effect of a lytic polysaccharide monooxygenase and a xylanase from Gloeophyllum trabeum on the enzymatic hydrolysis of lignocellulosic residues using a commercial cellulase. Enzyme and Microbial Technology, 2017(113): 75-82. |
| [9] | Levasseur A, Drula E, Lombard V, Coutinho PM, Henrissat B. Expansion of the enzymatic repertoire of the CAZy database to integrate auxiliary redox enzymes. Biotechnology for Biofuels, 2013(6): 41. |
| [10] | Liu B, Kognole AA, Wu M, Westereng B, Crowley MF, Kim S, Dimarogona M, Payne CM, Sandgren M. Structural and molecular dynamics studies of a C1‐oxidizing lytic polysaccharide monooxygenase from Heterobasidion irregulare reveal amino acids important for substrate recognition. The FEBS Journal, 2018, 285(12): 2225-2242. DOI:10.1111/febs.14472 |
| [11] | Hemsworth GR, Taylor EJ, Kim RQ, Gregory RC, Lewis SJ, Turkenburg JP, Parkin A, Davies GJ, Walton PH. The copper active site of CBM33 polysaccharide oxygenases. Journal of the American Chemical Society, 2013, 135(16): 6069-6077. DOI:10.1021/ja402106e |
| [12] | Lombard V, Ramulu GH, Drula E, Coutinho PM, Henrissat B. The carbohydrate-active enzymes database (CAZy) in 2013. Nucleic Acids Research, 2013(42): D490-D495. |
| [13] | Couturier M, Ladevèze S, Sulzenbacher G, Ciano L, Fanuel M, Moreau C, Villares A, Cathala B, Chaspoul F, Frandsen KE, Labourel A, Herpoël-Gimbert I, Grisel S, Haon M, Lenfant N, Rogniaux H, Ropartz D, Davies GJ, Rosso MN, Walton PH, Henrissat B, Berrin JG. Lytic xylan oxidases from wood-decay fungi unlock biomass degradation. Nature Chemical Biology, 2018, 14(3): 306-310. DOI:10.1038/nchembio.2558 |
| [14] | Tandrup T, Frandsen KEH, Johansen KS, Berrin JG, Lo Leggio L. Recent insights into lytic polysaccharide monooxygenases (LPMOs). Biochemical Society Transactions, 2018, 46(6): 1431-1447. DOI:10.1042/BST20170549 |
| [15] | Filiatrault-Chastel C, Navarro D, Haon M, Grisel S, Herpoël-Gimbert I, Chevret D, Fanuel M, Henrissat B, Heiss-Blanquet S, Margeot A, Berrin JG. AA16, a new lytic polysaccharide monooxygenase family identified in fungal secretomes. Biotechnology for Biofuels, 2019(12): 55. DOI:10.1186/s13068-019-1394-y |
| [16] | Forsberg Z, Sørlie M, Petrović D, Courtade G, Aachmann FL, Vaaje-Kolstad G, Bissaro B, Røhr ÅK, Eijsink VGH. Polysaccharide degradation by lytic polysaccharide monooxygenases. Current Opinion in Structural Biology, 2019(59): 54-64. |
| [17] | Petrović DM, Bissaro B, Chylenski P, Skaugen M, Sørlie M, Jensen MS, Aachmann FL, Courtade G, Várnai A, Eijsink VGH. Methylation of the N‐terminal histidine protects a lytic polysaccharide monooxygenase from auto‐oxidative inactivation. Protein Science, 2018, 27(9): 1636-1650. DOI:10.1002/pro.3451 |
| [18] | Ghatge SS, Telke AA, Waghmode TR, Lee Y, Lee KW, Oh DB, Shin HD, Kim SW. Multifunctional cellulolytic auxiliary activity protein HcAA10-2 from Hahella chejuensis enhances enzymatic hydrolysis of crystalline cellulose. Applied Microbiology and Biotechnology, 2015, 99(7): 3041-3055. DOI:10.1007/s00253-014-6116-6 |
| [19] | Kittl R, Kracher D, Burgstaller D, Haltrich D, Ludwig R. Production of four Neurospora crassa lytic polysaccharide monooxygenases in Pichia pastoris monitored by a fluorimetric assay. Biotechnology for Biofuels, 2012, 5(1): 79. DOI:10.1186/1754-6834-5-79 |
| [20] | Loose JSM, Forsberg Z, Fraaije MW, Eijsink VGH, Vaaje-Kolstad G. A rapid quantitative activity assay shows that the Vibrio cholerae colonization factor GbpA is an active lytic polysaccharide monooxygenase. FEBS Letters, 2014, 588(18): 3435-3440. DOI:10.1016/j.febslet.2014.07.036 |
| [21] | Zhang RQ, Liu YC, Zhang Y, Feng D, Hou SL, Guo W, Niu KL, Jiang Y, Han LJ, Sindhu L, Fang X. Identification of a thermostable fungal lytic polysaccharide monooxygenase and evaluation of its effect on lignocellulosic degradation. Applied Microbiology and Biotechnology, 2019, 103(14): 5739-5750. DOI:10.1007/s00253-019-09928-3 |
 2021, Vol. 61
2021, Vol. 61




