中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 牛艳婷, 王帅涛, 成娟丽, 林金水. 2021
- Yanting Niu, Shuaitao Wang, Juanli Cheng, Jinshui Lin. 2021
- 铜绿假单胞菌锌离子摄取系统的研究进展
- Zinc uptake systems in Pseudomonas aeruginosa
- 微生物学报, 61(7): 1856-1872
- Acta Microbiologica Sinica, 61(7): 1856-1872
-
文章历史
- 收稿日期:2020-08-06
- 修回日期:2020-10-06
- 网络出版日期:2020-11-09
2. 陕西省红枣重点实验室(延安大学), 陕西 延安 716000
2. Shaanxi Key Laboratory of Chinese Jujube(Yan'an University), Yan'an 716000, Shaanxi Province, China
锌是生物体中仅次于铁的第二丰富的过渡金属元素,是几乎所有生物体生命活动中的一种关键微量元素,尤其是微生物生长所必需的[1]。胞内游离锌离子可以通过与亚铁离子竞争而抑制芬顿反应(即H2O2与亚铁离子反应产生活性氧自由基)以阻止活性氧自由基的产生,从而降低活性氧自由基对细胞产生的毒性作用[2]。然而,细胞中存在的大多数锌不是游离的,而是与蛋白质结合在一起的。例如,在大肠杆菌中,锌的总量被认为大约在毫摩尔范围内,而游离Zn2+的浓度维持在一个非常低的微摩尔到皮摩尔的浓度[3]。依赖锌离子的蛋白质在细胞内扮演着许多不可或缺的角色,如DNA修复、凋亡、代谢过程、胞外基质调控和抗氧化防御,还参与生长激素的代谢调节,在基因表达调控和免疫系统中起着关键作用[4-5]。当锌在细胞中过量存在时,往往占据非特异性的结合位点,与其他基本微量金属元素竞争或破坏呼吸电子传递系统,从而中断重要的代谢和细胞通路[6]。因此,维持锌的体内平衡是所有生物系统正常运作的一个重要前提。哺乳动物宿主和病原菌之间对必需金属元素(包括锌离子等金属离子)的竞争发生在感染期间。为了抵御致病入侵者,宿主通过营养免疫机制有效地隔离金属离子,试图造成病原菌金属离子饥饿,从而限制它们的生长增殖[7]。而细菌在该过程中除了周围环境中缺少可接触的金属离子之外,其自身缺乏储存金属元素的细胞空间也是导致细菌金属离子饥饿的一个重要因素[8]。因此,细菌进化出多种金属缺乏防御机制,使它们能够在金属限制条件下正常成长,尤其对感染哺乳动物至关重要[9]。
铜绿假单胞菌(Pseudomonas aeruginosa)于1882年由Gessard首次分离,1890年被Charrin首次确认为病原体,于2017年2月被世界卫生组织列为急需开发新抗菌治疗药物的病原菌之一,是目前最受人类关注的条件性致病菌之一[8]。铜绿假单胞菌引起的疾病种类繁多,从表面的伤口感染、烧伤和尿路感染,到内部播散性感染,如菌血症、心内膜炎、脑膜炎和骨髓炎,甚至恶性肿瘤中都可以分离出相应临床菌株[8]。铜绿假单胞菌对多种抗生素具有耐药性,可以直接将毒素、胞外酶、铁载体、脂多糖等大量的毒力因子分泌到宿主细胞,并且能够感知和适应不断变化的环境,这使得其能够同时造成急性感染和慢性感染[10]。当人体受到铜绿假单胞菌侵染时,体内的锌被转运和储藏起来,或与钙网蛋白和牛皮癣素等紧密结合,通过这种营养免疫反应的激活可以有效抑制铜绿假单胞菌对锌的摄取,从而降低其在人体内的定殖和持久感染[8, 11]。因此,铜绿假单胞菌逃避人体免疫反应和在感染期间繁殖的能力,很大程度上取决于它们摄取锌等金属离子的能力[7, 9]。
本文重点介绍了铜绿假单胞菌的已知的3种主要锌离子摄取系统(ZnuABC摄取系统、HmtA摄取系统和CntRLMN摄取系统)和锌离子调控蛋白Zur,并进一步阐述了其他潜在的锌离子摄取途径。这些锌离子摄取系统不仅是维持细胞锌离子稳态的重要部分,而且通过复杂的基因表达调控对毒力和宿主营养免疫有直接影响,这将成为开发抗铜绿假单胞菌药物的潜在靶点。
1 铜绿假单胞菌中已知的锌离子摄取系统 1.1 ZnuABC锌离子摄取系统特异性的高亲和锌离子摄取系统首先在大肠杆菌中被鉴定,即由ATP结合盒(ATP binding cassette,ABC)转运蛋白ZnuABC所介导的锌离子摄取系统[12]。对铜绿假单胞菌PAO1基因组的生物信息学分析同样发现了3个与大肠杆菌znuABC同源的基因:PA5498 (znuA)、PA5500 (znuC)和PA5501 (znuB)。ZnuA是一个高亲和力的锌离子特异的可溶性结合蛋白,存在于细胞周质空间[12]。ZnuB是内膜透性酶,ZnuC是ATP酶,这两者构成内膜上的转运蛋白复合体ZnuBC[12]。铜绿假单胞菌ZnuA有2个锌离子结合位点,一个是由His60、His140和His204等3个组氨酸残基组成的高亲和位点,它对锌离子的结合常数Kd为22.6±6.4 nmol/L,另一个是结合常数为微摩尔级的低亲和位点[3]。在脑膜炎奈瑟氏菌中,ZnuABC与一个TonB依赖的外膜转运蛋白ZnuD相偶联,ZnuD负责转运胞外Zn2+穿过外膜[13]。铜绿假单胞菌基因组中也编码一个氨基酸序列与脑膜炎奈瑟氏菌ZnuD达27%一致性的蛋白PA0781,在限锌培养条件下znuA缺失突变显著诱导PA0781的表达,暗示PA0781可能是ZnuD的同源蛋白[3]。综上,在铜绿假单胞菌中可能由ZnuD同源蛋白(PA0781)负责将Zn2+从胞外转运至周质空间,周质空间蛋白ZnuA则将其传递给内膜上ZnuBC转运蛋白复合体并进一步转运至细胞质,从而完成Zn2+从胞外到细胞质的转运过程(图 1)。虽然ZnuABC在铜绿假单胞菌的锌离子摄取过程中起作用,但是znuA、znuB和znuC基因缺失突变仅微弱影响铜绿假单胞菌在限锌培养基中的生长[3, 14],这表明铜绿假单胞菌中还存在其他的锌离子摄取系统。

|
| 图 1 铜绿假单胞菌ZnuABC摄取锌离子模型图 Figure 1 The model of zinc uptake by P. aeruginosa ZnuABC. OM: outer membrane; IM: inner membrane. |
1.2 HmtA锌离子摄取系统
除ZnuABC锌离子摄取系统外,HmtA (PA2435)也是铜绿假单胞菌已知的锌离子摄取系统之一(图 2)。铜绿假单胞菌中HmtA是一种定位于内膜上的P型ATP酶[15]。P型ATP酶是一种通过水解ATP提供能量的转运蛋白超家族,这类转运蛋白的特点是通过将来自ATP的γ-磷酸转移到高度保守的DKTGT基序上而形成一种磷酸酶中间体[16]。其中,催化过渡金属转运的P型ATP酶家族也称为重金属ATP酶或P1B型ATP酶,在其第六跨膜螺旋(TM6)中含有一个转运活性所必需的Cys-Pro-Xaa (或Xaa-Pro-Cys)基序,Xaa可以是Cys、Ser或His残基[17]。不同的P型ATP酶转运蛋白具有不同的底物专一性,但它们中的大多数负责Ag+/Cu+或Zn2+/Cd2+/Pb2+的外排。然而与大多数作为外排泵的P型ATP酶不同,HmtA是一种金属离子输入蛋白,它对底物有高度选择性,仅介导铜绿假单胞菌对Cu2+和Zn2+的摄取,而不介导其对其他金属离子如Ag+和Cd2+的摄取[15]。

|
| 图 2 铜绿假单胞菌HmtA摄取锌离子模型图 Figure 2 The model of zinc uptake by P. aeruginosa HmtA. OM: outer membrane; IM: inner membrane. |
1.3 CntRLMN锌离子摄取系统
结合细菌其他类型的锌离子摄取系统,有科学家提出,与铁载体介导的细胞铁离子摄取过程相似,铜绿假单胞菌也可能通过分泌能够螯合锌离子的化合物或蛋白质(被称为Zincophore,锌载体)而介导细胞的锌离子摄取[18]。最近,我们课题组[19]证实铜绿假单胞菌中存在这种类型的锌离子摄取系统,即在铜绿假单胞PAO1中鉴定了一个新的锌离子摄取系统CntRLMN (PA4834–PA4837)。通过在富锌和限锌环境下的生长曲线分析表明,ZnuBC和CntL、CntR、CntN都具有参与铜绿假单胞菌锌离子摄取的功能,然而只有当znuBC和cntRLMN同时缺失时铜绿假单胞菌在限锌环境中的生长才会受到显著抑制。由于ZnuBC是已报道的锌离子摄取系统,因此CntRLMN是一种在功能上与ZnuBC互补的新型锌离子摄取系统。通过对外源添加细胞提取物的生长曲线分析以及4-(2-吡啶偶氮)-间苯二酚[4-(2-pytidylazo)resorcinol,PAR]实验表明,在cntRLMN操纵子中CntL通过控制合成某种锌载体(zincophore)参与铜绿假单胞菌的锌离子摄取;CntN作为细胞质膜转运蛋白,介导Zincophore的分泌,而CntR则作为外膜受体,介导胞外Zincophore-Zn2+复合物向胞内的转运。这与Mastropasqua和Lhospice等课题组报道的研究结果相一致[20-21]。Mastropasqua课题组[20]还发现缺失突变cntR (也称zrmA)显著降低铜绿假单胞菌在限锌培养条件下胞内锌离子的含量,从而降低了其胞外蛋白酶的产生和活性。Lhospice课题组[21]则解析了Zincophore的化学结构和生物合成途径,并将该Zincophore命名为Pseudopaline。该物质的化学结构和生物合成途径均与金黄色葡萄球菌金属载体Staphylopine[22]类似(图 3-A)。Pseudopaline的生物合成分两步:首先,在CntL的催化下,S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)对L-组氨酸(L-histidine,L-His)上的α-氨基丁酸基团进行亲核攻击,从而生成反应中间体yNA;其次,在CntM的催化下,NADH提供还原动力,yNA中间体与一分子的α-酮戊二酸(α-ketoglutaric acid,αKG)缩合形成Pseudopaline[21]。上述这些研究结果促使我们提出了铜绿假单胞菌cntRLMN操纵子的功能模型(图 3-B),限锌环境中,CntLM合成的Pseudopaline经内膜转运蛋白CntN分泌至周质空间,再经外膜一个未知的通道蛋白分泌到胞外,在胞外螯合游离锌离子形成Pseudopaline-Zn2+复合物,该复合物通过外膜受体CntR转运进入周质空间,再经由一个未知的内膜转运蛋白将其或其卸载下来的Zn2+转运进入胞内,从而完成对胞外锌离子的摄取。
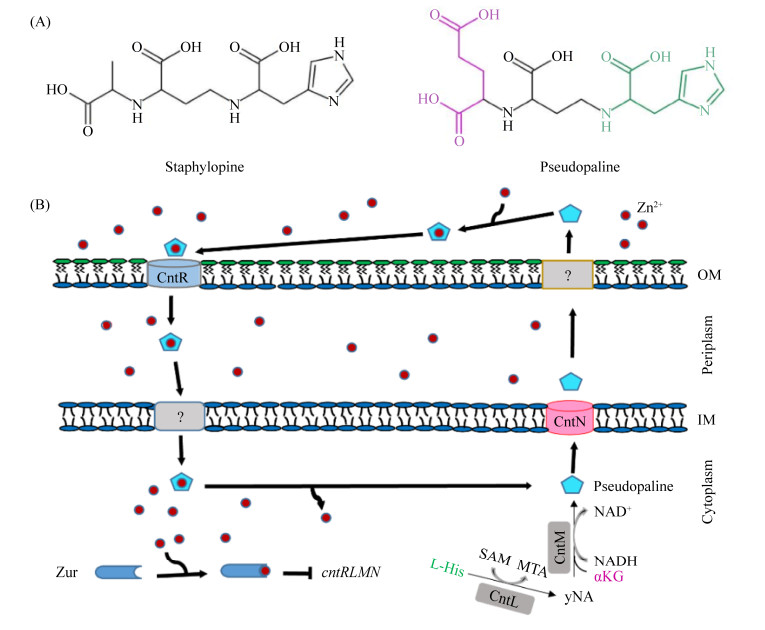
|
| 图 3 铜绿假单胞菌CntRLMN摄取锌离子模型图 Figure 3 The model of zinc uptake by P. aeruginosa CntRLMN. A: Chemical structures of staphylopine[22] and pseudopaline[21]. The purple part is α-ketoglutarate, and the green part is L-histidine. B: Model of pseudopaline synthesis, secretion and metal uptake in P. aeruginosa. OM: outer membrane; IM: inner membrane; L-His: L-histidine; SAM: S-adenosine methionine; MTA: 5-methylthioadenosine; αKG: α-ketoglutarate. |
2 锌离子摄取调控蛋白Zur的调控
原核生物的锌离子摄取系统受锌离子摄取调控蛋白(zinc uptake regulator,Zur)的直接负调控,该蛋白属于重要的铁摄取调控蛋白Fur (ferric uptake regulator)家族[23]。Zur是一种单组分调节蛋白,即输入域和输出域位于同一蛋白上,直接受锌离子可逆结合的调控。Zur在细胞质中形成二聚体,需要锌离子进行折叠和二聚化。N端含有DNA结合区,通过铰链环与C端二聚区分离。Zur至少有2个锌结合位点,一个高度保守的锌结合位点(C位点)用于维持结构稳定,另1个或2个保守的锌结合位点(M位点和/或D位点)调节DNA结合[24]。4个半胱氨酸残基(Cys4)组成的锌指结构位于C端锌结合位点即C位点。在锌充足或过量的情况下,Zur将一个额外的锌离子结合到位于铰链区的M位点,使Zur结合到DNA Zur结合位点(15–17 bp的回文序列),调控与锌稳态相关基因的表达[25]。根据细胞质内锌离子浓度的不同,Zur在M位点可以结合0、1或2个Zn2+。有趣的是,一些Zur蛋白还具有第3个锌结合位点(D位点),使Zur反应分级。研究证明Zur调控细菌中的大量基因的表达,包括锌摄取基因[14, 19-21, 26-27]、与锌外排相关的基因[28]、金属伴侣[25]、转录调节因子[29-30]、负责天蓝色链霉菌(Streptomyces coelicolor)中coelibactin产生的生物合成基因[31]和一些核糖体蛋白[3, 29]。
在铜绿假单胞菌中,Zur蛋白的编码基因zur (PA5499,也称np20)与znuC和znuB形成多顺反子操纵子[14]。铜绿假单胞菌的Zur蛋白具有2个保守的锌结合位点,见图 4-A。C118xxC121-x136- C158xxC161中包括2个CxxC基序,这里的4个半胱氨酸残基是铜绿假单胞菌Zur中一个高度保守的锌结合位点即C位点,Cys4锌指结构在所有菌种的Zur蛋白中完全保守,并且在整个Fur蛋白家族中高度保守[24]。另一个高度保守的锌结合位点即M位点是由H109 SH111基序中的2个组氨酸残基和高度保守的C104组成,该位点是锌敏感位点,在锌过量的情况下,Zur将额外的锌离子结合到M位点[24]。铜绿假单胞菌中位于Zur蛋白C端的DNA结合区结合的是一段17 bp DNA序列,该序列包含一个中心为非保守核苷酸的回文序列(图 4-B)[3]。我们课题组也证实了这一点,通过凝胶迁移实验(elecyrophoretic mobility shift assay,EMSA)鉴定了Zur蛋白在cntRLMN操纵子启动子上的结合位点为GCGTTATAGTATATCAT[19]。以ZnuABC为例,在富锌条件下,过量的锌离子与M位点相互作用,引起构象变化,使调控因子Zur与znuABC启动子结合,从而抑制其转录;在缺锌条件下,C位点和M位点未被占据,导致Zur失稳,无法抑制znuABC转录,从而允许锌离子摄取[26]。

|
| 图 4 铜绿假单胞菌的Zur蛋白[3] Figure 4 Zur protein in P. aeruginosa[3]. A: P. aeruginosa Zur protein sequence and functional domains. The DNA binding region is in blue. M site is in green and C site is in orange. Amino acid residues involved in Zn2+ interaction are indicated in bold. B: The DNA binding site sequences of P. aeruginosa Zur created by WebLogo. |
对锌缺乏的调控主要依赖于转录抑制因子Zur,敲除zur的铜绿假单胞菌突变体显示细胞质锌离子浓度更高,与Zur蛋白质的阻遏功能一致[14]。与Fur的铁浓度依赖性调控机制相似,Zur在富锌条件下起着抑制靶基因的作用。当锌离子含量丰富时,结合锌离子的Zur蛋白与靶基因上游的启动子序列结合以阻止转录,防止锌离子过剩;在锌离子限制条件下,Zur转移到无负载形式,导致Zur与靶基因启动子分离,目的基因正常进行转录,促进锌离子摄取。已有研究表明znuABC、hmtA和cntRLMN的表达受锌离子调控蛋白Zur负调控并以Zur蛋白依赖的形式受到锌离子的抑制,并且Zur抑制其自身操纵子转录以响应锌浓度增加[14-15, 19-21, 26],见图 1、图 2和图 3-B。
3 铜绿假单胞菌中其他潜在的锌离子摄取途径 3.1 PA1922-PA1925、PA2911-PA2914和PA4063-PA4066锌离子摄取系统最近,限锌培养条件下对铜绿假单胞菌znuA缺失突变株进行转录组分析的研究结果显示除了znuABC、hmtA和cntRLMN等3套已知的锌离子摄取系统的表达显著上调外,还有3个未知功能的转运器,分别为PA1922–PA1925、PA2911–PA2914和PA4063–PA4066,它们的表达也显著上调[3, 8],同时它们的启动子均存在Zur调控蛋白的结合位点,如图 5-A所示。我们课题组已进行初步实验证明PA1922–PA1925、PA2911–PA2914和PA4063–PA4066的表达受Zur蛋白的负调控(数据未发表),因此推测这3个未知的转运器可能也参与铜绿假单胞菌的锌离子摄取,然而,这一推测目前仍然没有得到实验数据的证实。首先,PA1922–PA1925中,PA1922是一种TonB依赖的外膜受体,PA1923编码一种参与钴胺素合成的钴螯合酶同源蛋白,PA1924则编码一种假定的ExbD同源蛋白,ExbD蛋白的作用是为TonB依赖外膜受体的转运功能提供能量,而PA1925是一个未知蛋白,因此PA1922和PA1924可能组成TonB依赖的外膜转运器,参与游离的锌离子从胞外向细胞质的转运。其次,铜绿假单胞菌中螯合形式的锌离子可能通过PA2912–PA2914从周质转运到细胞质[3]。Pederick等[3]预测PA2911也是一种TonB依赖的外膜受体,PA2912–2914则编码一种ABC转运器,PA2912是ATP酶,PA2913编码周质空间结合蛋白,PA2914是内膜透性酶。PA2911/PA2912–2914转运器的组织结构与ZnuD/ZnuABC转运器的组织结构相似,PA2911与PA2912–PA2914协同作用。首先,螯合形式的Zn2+通过外膜受体PA2911从胞外被转运到周质空间,然后与周质空间结合蛋白PA2913结合,并通过PA2913运载给内膜转运蛋白复合体PA2912/PA2914,进而穿过内膜进入细胞质[3]。第三,PA4063–PA4066操纵子是铜绿假单胞菌在囊性纤维化患者痰液中生长所必需的,它也编码一种ABC转运器,含有2个功能未知的周质底物结合蛋白PA4063和PA4066,而PA4064和PA4065则分别与唾液链球菌的抗菌肽抗性转运蛋白SalX和SalY同源[32-33]。PA4063和PA4066蛋白分别由196个和172个氨基酸残基组成,我们经SignalP信号肽序列在线软件分析显示它们的信号肽切割位点分别位于17–18氨基酸残基之间和23–24氨基酸残基之间(预测网站http://www.cbs.dtu.dk/services/SignalP/),即它们成熟形式的蛋白分别只有179个和149个氨基酸残基。这么小的蛋白可能达不到同时与配体和ABC转运器的跨膜结构域形成稳定相互作用所需要的蛋白尺寸[3]。PA4063蛋白存在大量螯合锌离子所需的组氨酸残基因而可能具有锌离子螯合活性,PA4066的组氨酸残基数目则比较缺乏[3],因此,二者可能构成蛋白尺寸更大的异源二聚体蛋白复合体共同执行周质锌离子结合蛋白的功能。据此,我们推测PA4063–PA4066可能利用形成异源二聚体的周质底物结合蛋白PA4063和PA4066结合周质空间的游离Zn2+,并将锌离子投递给位于内膜上的PA4064/PA4065转运蛋白复合体,而进一步完成Zn2+向细胞质的跨膜转运,其中PA4063作为锌离子螯合蛋白,而PA4066则作为接头蛋白介导PA4063与内膜透性酶PA4065之间的互作,而PA4064作为ATP酶为整个操纵子介导锌离子摄取供能。
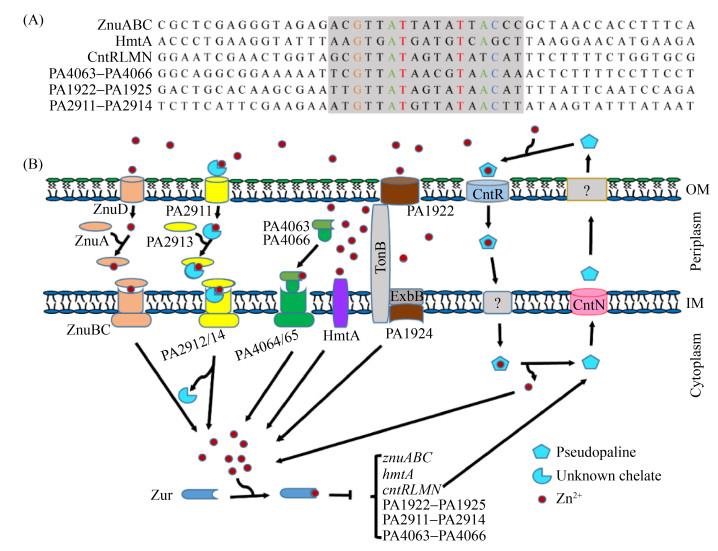
|
| 图 5 铜绿假单胞菌锌离子摄取系统的表达受锌离子调控蛋白Zur的调控 Figure 5 The expression of zinc uptake system of P. aeruginosa is regulated by zinc regulator Zur. A: DNA sequence alignments of ZnuABC, HmtA, CntRLMN, PA4063–PA4066, PA2911–PA2914 and PA1922–PA1925 promoter. The yellow region represents the zur binding site containing 17 bp base, and the red labeled base represents the conserved nucleotide in this region. B: the model of zinc uptake systems in P. aeruginosa. OM: outer membrane; IM: inner membrane. |
综上所述,铜绿假单胞菌为满足其自身Zn2+需要使用大量锌离子摄取系统,如图 5-B所示。在限锌条件下,游离的锌离子可能通过ZnuD/ZnuABC、HmtA、PA1922–PA1925和PA4063–PA4066等锌离子转运系统完成从细胞外向细胞质的跨膜转运;螯合形式的锌离子则通过CntRLMN和PA2911/PA2912–PA2914这两种锌离子转运系统进行摄取。这些转运系统的表达都受Zur蛋白的负调控并以Zur蛋白依赖的形式受到锌离子的抑制。在富锌条件下,Zur蛋白与Zn2+结合,从而抑制锌离子摄取系统的转录;限锌条件下Zur-Zn2+的抑制作用解除,从而激活锌离子摄取系统相关基因的表达。锌离子摄取是依赖能量的,需要通过内膜的TonB-ExbB-ExbD复合物将营养物质的摄取与内膜上的质子梯度结合起来。与锌离子摄取相关的部分基因及其表达的蛋白所处位置和功能见表 1。
| ID | Gene name | Localization | Function |
| PA5498 | znuA | Periplasm | Solute-binding protein (SBP) |
| PA5499 | zur | Cytoplasm | Zinc uptake regulator |
| PA5500 | znuC | Cytoplasmic membrane | ATPase |
| PA5501 | znuB | Cytoplasmic membrane | Permease of ABC transporter |
| PA0781 | znuD | Outer membrane | TonB-dependent receptor |
| PA2435 | hmtA | Cytoplasmic membrane | P-type ATPase transporter |
| PA4834 | cntN | Cytoplasmic membrane | membrane transporter |
| PA4837 | cntR | Outer membrane | TonB-dependent receptor |
| PA1922 | PA1922 | Outer membrane | TonB-dependent receptor |
| PA1924 | PA1924 | Inner membrane | ExbD protein |
| PA2911 | PA2911 | Outer membrane | TonB-dependent receptor |
| PA2912 | PA2912 | Cytoplasmic membrane | ATPase |
| PA2913 | PA2913 | Periplasm | Solute-binding protein (SBP) |
| PA2914 | PA2914 | Cytoplasmic membrane | Permease of ABC transporter |
| PA4063 | PA4063 | Periplasm | Solute-binding protein (SBP) |
| PA4064 | PA4064 | Cytoplasmic membrane | ATPase |
| PA4065 | PA4065 | Cytoplasmic membrane | Permease of ABC transporter |
| PA4066 | PA4066 | Periplasm | Solute-binding protein (SBP) |
| The bold sections represent known zinc uptake associated proteins, while the others are hypothetical zinc uptake associated proteins. | |||
3.2 铜绿假单胞菌其他锌离子摄取途径
限锌培养条件下对铜绿假单胞菌znuA缺失突变株进行转录组分析的研究结果还显示,rpmE2 (PA3600)、rpmJ2 (PA3601)和dksA2 (PA5536)等基因的表达也均显著上调。RpmE2和RpmJ2分别是50S核糖体蛋白RpmE (PA5049)和RpmJ (PA4242)在铜绿假单胞菌中的旁系同源蛋白[3]。原核生物核糖体蛋白通常有两种形式,一种是结合金属离子如Zn2+的C+亚型,另一种是由于缺乏金属结合残基而不具备与金属离子相互作用的C—亚型。正是由于C—亚型核糖体蛋白替代依赖于Zn2+的C+亚型核糖体蛋白,使细胞的核糖体功能在锌离子受限条件下得以维持,同时C+亚型核糖体蛋白中的Zn2+也可重新释放出来作为他用,使核糖体蛋白可能作为细胞的锌离子存储库[34]。RpmE和RpmJ属于C+亚型核糖体蛋白,而RpmE2和RpmJ2属于C—亚型核糖体蛋白,rpmE2-rpmJ2操纵子的启动子中存在Zur结合位点,其表达在锌饥饿条件下显著上调[3]。这些C—亚型核糖体蛋白的诱导表达是铜绿假单胞菌对锌饥饿的一种适应策略,它们在功能上取代了依赖于Zn2+的C+亚型核糖体蛋白RpmE和RpmJ[3]。这暗示铜绿假单胞菌可以通过将C+亚型核糖体蛋白转换为C—亚型核糖体蛋白而重新改变胞内锌离子的分布以适应锌饥饿的环境。另一个表达受锌饥饿诱导的基因是dksA2,与dksA (PA4723)旁系同源。DksA是铜绿假单胞菌中的一种依赖于Zn2+的转录调控蛋白,在营养缺乏期间,DksA与ppGpp (鸟苷四磷酸)/pppGpp (鸟苷五磷酸)协同作用,增强RNA聚合酶与rRNA启动子的结合,从而抑制rRNA转录[35-36]。DksA蛋白含有由2个CxxC基序组成的典型Cys4锌指结构基序CxxC-(x17)-CxxC,类似于在Zur中发现的C位点,该结构对其自身的正确折叠和蛋白活性至关重要[37]。铜绿假单胞菌基因组编码一个与DksA密切相关的旁系同源蛋白,被称为DksA2,它包含1个CxxT-(x17)-CxxA基序,相比DksA该基序缺少2个半胱氨酸残基[29, 37]。有趣的是,在低锌环境中DksA2是被诱导的,并且dksA2缺失会导致限锌环境下的生长缺陷,这表明该蛋白在缺锌时可以在功能上替代DksA的作用[37]。此外,在dksA2的启动子区发现了一个假定的Zur结合位点,事实上,Zur还可以抑制dksA2基因的表达,这与dksA2基因的表达在低锌条件下受到诱导的表型相一致[3, 29]。尽管DksA2在表型和调控上都与锌离子相关,但是至于它是否具有参与调节铜绿假单胞菌胞内锌离子稳态的功能还有待于进一步研究。
除上述胞内储锌蛋白释放锌离子供铜绿假单胞菌在限锌条件下使用外,铜绿假单胞菌中可能还存在一些非特异性转运系统参与锌离子的摄取。(1) 除了cntRLMN分泌的Pseudopaline外,铜绿假单胞菌可能也分泌其他能够螯合锌离子的化合物或蛋白质即锌载体(zincophores)参与细胞摄取锌离子。在恶臭假单胞菌中,能够结合Fe3+的铁载体吡啶-2, 6-二硫代羧酸(isopropyl-β- D-thiogalactopyranoside,PDTC)与Zn2+结合,并允许其进入细胞[38]。类似Bobrov等在鼠疫耶尔森氏菌中发现铁载体耶尔森杆菌素(yersiniabactin)结合锌离子,并通过内膜转运蛋白YbtX将其运输到胞内的过程[39]。在铜绿假单胞菌中,主要有两种铁载体,即螯铁蛋白(pyochelin)和脓青素(pyoverdine),这些分子除了参与铁的吸收外,也可以结合其他各种阳离子,包括Zn2+[8]。铜绿假单胞菌中,Zn2+和Fe3+的摄取密切相关,铁载体可能发挥锌载体的作用而参与锌离子的摄取[18]。另外,在假结核耶尔森氏菌和泰国伯克霍尔德氏菌中发现,细菌还可以利用Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)通过向胞外分泌能够结合锌离子的效应蛋白而参与细胞的锌离子摄取[40-41]。虽然目前在铜绿假单胞菌中还没有类似的介导细胞锌离子摄取的T6SS效应蛋白被鉴定出来,但是已有文献报道铜绿假单胞菌的T6SS效应蛋白具有介导细胞铁离子或铜离子摄取的功能。最近我们课题组发现铜绿假单胞菌H3-T6SS分泌的效应蛋白TseF可以结合细胞分泌的铁螯合剂2-庚基-3-羟基-4(1H)-喹诺酮(又称Pseudomonas quinolone signal,PQS),并通过与PQS-Fe3+结合而随同PQS-Fe3+一起定位在外膜囊泡上,进而通过外膜囊泡将TseF-PQS-Fe3+复合物运输到细胞表面与其外膜受体FptA或OprF结合而介导PQS-Fe3+通过外膜受体FptA或OprF进入细胞,从而完成细胞对胞外铁离子的摄取[42]。同样,铜绿假单胞菌H2-T6SS分泌一种Cu2+结合蛋白Azu,它通过与外膜受体蛋白OprC的互作而介导Cu2+通过外膜受体OprC进入细胞,从而完成细胞对胞外铜离子的摄取[43]。因此,铜绿假单胞菌T6SS也可能通过分泌能够结合锌载体或锌离子的效应蛋白而参与细胞的锌离子摄取。
(2) 低亲和力的锌离子转运蛋白介导的锌离子摄取。大肠杆菌能在较低锌离子浓度的体外环境下和宿主的体内环境中利用非特异性的低亲和力ZIP (ZRT/IRT-like protein)家族转运蛋白ZupT有效介导锌离子的摄取[44]。ZupT含8个跨膜结构域,跨膜结构域3和4之间有一个富His区,有广泛的金属结合特性,包括结合Zn2+、Fe2+、Mn2+或Cd2+,其中对Zn2+有明显的偏好性,是一种低亲和力的锌离子转运蛋白,在金属离子丰富的条件下可依靠质子动力势提供能量完成对金属离子向胞内的转运[45]。通过NCBI-BLAST同源搜索比对,我们课题组发现铜绿假单胞菌中也存在一个ZupT同源蛋白PA4467,它的氨基酸序列与大肠杆菌ZupT (b3040)的氨基酸序列一致性达到36.59%,然而它的功能到目前为止依然还未被鉴定。我们课题组的初步研究显示异源表达铜绿假单胞菌的zupT (PA4467)显著增强大肠杆菌对高浓度Zn2+、Mn2+、Ni2+、Cu2+、Mg2+和Co2+等二价金属离子的敏感性(数据未发表),这说明铜绿假单胞菌的ZupT可能参与这些二价金属离子的摄取。因此,我们推测ZupT也能够介导铜绿假单胞菌对锌离子的摄取,依靠质子动力势低亲和地转运Zn2+到胞内。
(3) 非特异的膜转运蛋白介导锌离子转运。MFS超家族(major facilitator superfamily)蛋白是一类转运膜蛋白,能够应答离子浓度梯度对次级代谢产物等进行运输[46]。MFS超家族蛋白具有多样性的转运底物,可以转运单糖、药物分子、辅酶因子、肽、寡糖、核苷酸、铁螯合物以及阴离子和阳离子等多种配体[47-49],因此推测MFS蛋白可能也参与铜绿假单胞菌锌离子的摄取。有研究发现细胞膜上的非特异性孔蛋白可能也参与锌离子从外膜向周质空间的转运。例如,OprF是铜绿假单胞菌中最丰富的非脂蛋白类的外膜孔蛋白,允许离子和低分子量糖分子通过[50]。因此预测OprF等孔蛋白也可能参与铜绿假单胞菌锌离子的摄取。
(4) 组氨酸介导的细胞锌离子摄取。越来越多的研究表明,添加组氨酸可以增加锌离子的溶解度和锌转运蛋白的有效性,或者锌离子和组氨酸可以跨膜共转运[51]。在鲍曼不动杆菌的研究中发现组氨酸分解代谢系统HutUHTIG通过水解螯合锌的L-组氨酸参与细菌锌离子的摄取。该过程中,胞外的锌离子与组氨酸螯合形成His-Zn2+复合物可被鲍曼不动杆菌外膜上的组氨酸输入蛋白HutT转运至胞内。ZigA是一种含锌的金属伴侣蛋白,其表达受锌饥饿的诱导和Zur蛋白的直接负调控,而HutH是一种以锌为辅因子的组氨酸解氨酶,其酶活受锌的激活。当菌体处于锌饥饿时ZigA能帮助HutH结合Zn2+,进而激活HutH,然后将HutT从胞外输入的His-Zn2+复合物分解,释放Zn2+并产生尿刊酸,尿刊酸再经水合酶HutU、水解酶HutI和HutG等作用最终转化成L-谷氨酸,从而完成鲍曼不动杆菌对胞外锌离子的摄取[52]。有趣的是铜绿假单胞菌中也存在该组氨酸分解代谢系统HutUHTIG[53]。上述研究结果暗示铜绿假单胞菌中HutUHTIG可能也具有与锌离子摄取有关的功能。
4 锌离子摄取与毒力通常为了确保感染成功,铜绿假单胞菌产生大量的毒力因子,包括胞外酶(LasB弹性蛋白酶、LasA蛋白酶、碱性蛋白酶)、次级代谢产物(绿脓菌素、氰化氢)、毒素(外毒素A)和凝集素(LecA)等,它们的表达受细胞密度(群体感应)调控[54]。这些毒力因子在囊性纤维化患者感染中起主要作用,其中铜绿假单胞菌可利用藻酸盐形成粘液型生物被膜以增强对抗生素的耐受性[55]。该过程中,铜绿假单胞菌利用锌离子摄取系统竞争Zn2+不但可以满足自身营养所需,而且在宿主定殖过程中对毒力因子的产生也发挥重要作用[8]。研究表明,铜绿假单胞菌znuABC的缺失显示细胞内锌离子积累减少60%,会影响藻酸盐的生成,抑制胞外含锌蛋白酶LasA、LasB和蛋白酶IV的活性,并降低铜绿假单胞菌在小鼠全身感染过程中的传播能力,说明ZnuABC对铜绿假单胞菌的感染定殖至关重要[56]。同时,cntRLMN缺失突变也显著降低了铜绿假单胞菌侵染大蜡螟幼虫后的存活率[19]和对小鼠的毒力和侵染能力[20],表明CntRLMN对铜绿假单胞菌毒力的发挥也起重要作用。此外,zur缺失突变导致绿脓菌素和群体感应信号分子PQS的产生减少[57],同时导致了铜绿假单胞菌致病性显著下降,即对小鼠的致死率显著降低100倍,对线虫则显示出无毒性作用[14],这些结果表明锌离子摄取调控蛋白Zur也对铜绿假单胞菌的毒力发挥至关重要[58]。综上所述,有效的锌离子摄取对铜绿假单胞菌毒力发挥具有非常重要的作用。
5 锌离子摄取与宿主营养免疫由于金属元素是病原菌生长过程所必需的营养辅助因子,对金属营养物质的竞争不可避免地发生在宿主和病原菌之间[18, 53]。事实上,已经有研究表明,宿主金属稳态的失调会增加病原菌的感染率[11]。为了防止病原菌的定殖,宿主生物进化出了一种名为营养免疫的防御策略[7]。这一策略包括宿主介导的对重要营养物质可及性的限制,特别是必需的金属元素,从而导致病原菌的生长受到抑制[7]。病原菌的代谢和毒力作用都需要铁,宿主蛋白质对铁的隔离作用是宿主营养免疫的一个重要分支,例如,通过分泌螯铁蛋白或能够结合铁载体的脂蛋白[42]。同样,宿主的营养免疫也被认为作用于其他金属元素,主要是对锌离子和锰离子的隔离限制[7]。在人类宿主中,Zn2+被感染部位中性粒细胞分泌的钙网蛋白(calprotectin,CP)[59]、肝脏中的金属硫蛋白[60]或皮肤上的牛皮癣蛋白[61]等各种蛋白螯合,耗尽了宿主体内环境中任何剩余的游离锌离子,从而抑制了病原菌的生长。为了保证在限锌的宿主环境中正常定殖,铜绿假单胞菌会激活高亲和力的锌离子摄取系统,如ZnuABC系统,与宿主细胞竞争锌离子,从而抵御宿主的营养免疫反应[8]。CP是一种由中性粒细胞释放的钙激活的抗菌肽,其功能是在体内隔离Mn2+和Zn2+[62]。在体外CP处理的条件下,znuABC缺失突变株生长明显受到抑制[56]。研究表明在囊性纤维化病人肺部和铜绿假单胞菌引起的烧伤创面感染中,CntRLMN的合成产物Pseudopaline会过度分泌[63],说明铜绿假单胞菌利用高亲和力的锌离子摄取系统CntRLMN摄取锌离子以适应体内CP丰富的限锌环境。综上所述,ZnuABC和CntRLMN等锌离子摄取系统是铜绿假单胞菌抵御宿主营养免疫的主要参与者。
6 展望铜绿假单胞菌在感染过程会激活宿主体内的营养免疫反应,导致锌等必需元素被多种宿主蛋白螯合。因此,为了保证感染成功,铜绿假单胞菌必须适应锌缺乏的环境,而这个过程主要由铜绿假单胞菌锌离子摄取系统所介导。通过对铜绿假单胞菌锌离子摄取系统的研究,可以为靶向锌离子摄取系统的新型抗铜绿假单胞菌药物的开发奠定基础[64]。特别是通过新的策略干扰锌载体的合成和转运来限制锌离子的摄取,将成为抗铜绿假单胞菌感染的潜在新疗法。
目前对铜绿假单胞菌锌离子摄取系统的研究已取得一定的进展,但铜绿假单胞菌锌离子摄取过程中还有许多不确定的地方。比如,未被证实的几套潜在锌离子摄取系统是否都有功能?它们的作用机制如何?已知的几套锌离子摄取系统都是独立工作的,那么它们之间是如何协调的?有无主次之分?另外,所有的这些锌离子摄取系统是否都在与宿主竞争锌离子的过程中起作用?其机制如何?这些问题都有待于进一步的研究解决。只有对铜绿假单胞菌锌离子摄取更加深入研究,才能为靶向锌离子摄取系统的新型抗铜绿假单胞菌药物的开发和铜绿假单胞菌感染的治疗提供更多新的思路和方法。
| [1] | Coverdale JPC, Khazaipoul S, Arya S, Stewart AJ, Blindauer CA. Crosstalk between zinc and free fatty acids in plasma. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2019, 1864(4): 532-542. |
| [2] | Faulkner MJ, Helmann JD. Peroxide stress elicits adaptive changes in bacterial metal ion homeostasis. Antioxidants & Redox Signaling, 2011, 15(1): 175-189. |
| [3] | Pederick VG, Eijkelkamp BA, Begg SL, Ween MP, McAllister LJ, Paton JC, Mcdevitt CA. ZnuA and zinc homeostasis in Pseudomonas aeruginosa. Scientific Reports, 2015, 5(1): 13139. DOI:10.1038/srep13139 |
| [4] | Escobedo Monge MF, Barrado E, Alonso Vicente C, Redondo del Río MP, Marugán de Miguelsanz JM. Zinc nutritional status in patients with cystic fibrosis. Nutrients, 2019, 11(1): 150. DOI:10.3390/nu11010150 |
| [5] | Ohashi W, Fukada T. Contribution of zinc and zinc transporters in the pathogenesis of inflammatory bowel diseases. Journal of Immunology Research, 2019, 2019: 8396878. |
| [6] | Foster AW, Osman D, Robinson NJ. Metal preferences and metallation. Journal of Biological Chemistry, 2014, 289(41): 28095-28103. DOI:10.1074/jbc.R114.588145 |
| [7] | Kehl-Fie TE, Skaar EP. Nutritional immunity beyond iron: a role for manganese and zinc. Current Opinion in Chemical Biology, 2010, 14(2): 218-224. DOI:10.1016/j.cbpa.2009.11.008 |
| [8] | Gonzalez MR, Ducret V, Leoni S, Perron K. Pseudomonas aeruginosa zinc homeostasis: key issues for an opportunistic pathogen. Biochimica Et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 2019, 1862(7): 722-733. DOI:10.1016/j.bbagrm.2018.01.018 |
| [9] | Chandrangsu P, Rensing C, Helmann JD. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology, 2017, 15(6): 338-350. DOI:10.1038/nrmicro.2017.15 |
| [10] | Huszczynski SM, Lam JS, Khursigara CM. The role of Pseudomonas aeruginosa lipopolysaccharide in bacterial pathogenesis and physiology. Pathogens, 2020, 9(1): 6. |
| [11] | Palmer LD, Skaar EP. Transition metals and virulence in bacteria. Annual Review of Genetics, 2016, 50: 67-91. DOI:10.1146/annurev-genet-120215-035146 |
| [12] |
Luo RX, Liu MF. The mechanism of zinc uptake in Gram-negative bacteria and strategies for resisting host nutrition immunity. Chinese Journal of Biochemistry and Molecular Biology, 2019, 35(8): 831-836.
(in Chinese) 罗睿心, 刘马峰. 革兰氏阴性菌锌摄取机制及抵抗宿主营养免疫的策略. 中国生物化学与分子生物学报, 2019, 35(8): 831-836. |
| [13] | Calmettes C, Ing C, Buckwalter CM, El Bakkouri M, Chieh-Lin Lai C, Pogoutse A, Gray-Owen SD, Pomès R, Moraes TF. The molecular mechanism of Zinc acquisition by the neisserial outer-membrane transporter ZnuD. Nature Communications, 2015, 6(1): 7996. DOI:10.1038/ncomms8996 |
| [14] | Ellison ML, Farrow ⅢI JM, Parrish W, Danell AS, Pesci EC. The transcriptional regulator Np20 is the zinc uptake regulator in Pseudomonas aeruginosa. PLoS ONE, 2013, 8(9): e75389. DOI:10.1371/journal.pone.0075389 |
| [15] | Lewinson O, Lee AT, Rees DC. A P-type ATPase importer that discriminates between essential and toxic transition metals. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(12): 4677-4682. DOI:10.1073/pnas.0900666106 |
| [16] | Dao TT, Sehgal P, Tung TT, Møller JV, Nielsen J, Palmgren M, Christensen B, Fuglsang AT. Demethoxycurcumin is a potent inhibitor of P-type ATPases from diverse kingdoms of life. PLoS ONE, 2016, 11(9): e0163260. DOI:10.1371/journal.pone.0163260 |
| [17] | Argüello JM. Identification of ion-selectivity determinants in heavy-metal transport P1B-type ATPases. The Journal of Membrane Biology, 2003, 195(2): 93-108. DOI:10.1007/s00232-003-2048-2 |
| [18] | Hood MI, Skaar EP. Nutritional immunity: transition metals at the pathogen-host interface. Nature Reviews Microbiology, 2012, 10(8): 525-537. DOI:10.1038/nrmicro2836 |
| [19] |
Lin JS, Niu YT, Wang ST, Wang GF, Tian Y, Zhang H, Zhu XF, Si QP, Cheng JL, Ai YN, Zhao WJ, Zhang XQ. Characterization of zinc ion uptake mediated by cntRLMN operon in Pseudomonas aeruginosa. Acta Microbiologica Sinica, 2020, 60(4): 789-804.
(in Chinese) 林金水, 牛艳婷, 王帅涛, 王贵锋, 田野, 张恒, 朱旭飞, 司青坡, 成娟丽, 艾亚楠, 赵文静, 张向前. 铜绿假单胞菌cntRLMN操纵子介导锌离子摄取的功能鉴定. 微生物学报, 2020, 60(4): 789-804. |
| [20] | Mastropasqua MC, D'Orazio M, Cerasi M, Pacello F, Gismondi A, Canini A, Canuti L, Consalvo A, Ciavardelli D, Chirullo B, Pasquali P, Battistoni A. Growth of Pseudomonas aeruginosa in zinc poor environments is promoted by a nicotianamine-related metallophore. Molecular Microbiology, 2017, 106(4): 543-561. DOI:10.1111/mmi.13834 |
| [21] | Lhospice S, Gomez NO, Ouerdane L, Brutesco C, Ghssein G, Hajjar C, Liratni A, Wang SL, Richaud P, Bleves S, Ball G, Borezée-Durant E, Lobinski R, Pignol D, Arnoux P, Voulhoux R. Pseudomonas aeruginosa zinc uptake in chelating environment is primarily mediated by the metallophore pseudopaline. Scientific Reports, 2017, 7(1): 17132. DOI:10.1038/s41598-017-16765-9 |
| [22] | Ghssein G, Brutesco C, Ouerdane L, Fojcik C, Izaute A, Wang SL, Hajjar C, Lobinski R, Lemaire D, Richaud P, Voulhoux R, Espaillat A, Cava F, Pignol D, Borezée-Durant E, Arnoux P. Biosynthesis of a broad-spectrum nicotianamine-like metallophore in Staphylococcus aureus. Science, 2016, 352(6289): 1105-1109. DOI:10.1126/science.aaf1018 |
| [23] | Fillat MF. The FUR (ferric uptake regulator) superfamily: Diversity and versatility of key transcriptional regulators. Archives of Biochemistry and Biophysics, 2014, 546: 41-52. DOI:10.1016/j.abb.2014.01.029 |
| [24] | Shin JH, Jung HJ, An YJ, Cho YB, Cha SS, Roe JH. Graded expression of zinc-responsive genes through two regulatory zinc-binding sites in Zur. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(12): 5045-5050. DOI:10.1073/pnas.1017744108 |
| [25] | Ulrich LE, Koonin EV, Zhulin IB. One-component systems dominate signal transduction in prokaryotes. Trends in Microbiology, 2005, 13(2): 52-56. DOI:10.1016/j.tim.2004.12.006 |
| [26] | Smith KF, Bibb LA, Schmitt MP, Oram DM. Regulation and activity of a zinc uptake regulator, Zur, in Corynebacterium diphtheriae. Journal of Bacteriology, 2009, 191(5): 1595-1603. DOI:10.1128/JB.01392-08 |
| [27] | Kandari D, Gopalani M, Gupta M, Joshi H, Bhatnagar S, Bhatnagar R. Identification, functional characterization, and regulon prediction of the zinc uptake regulator (zur) of Bacillus anthracis-An insight Into the zinc homeostasis of the pathogen. Frontiers in Microbiology, 2019, 9: 3314. DOI:10.3389/fmicb.2018.03314 |
| [28] | Ducret V, Gonzalez MR, Leoni S, Valentini M, Perron K. The CzcCBA efflux system requires the CadA P-type ATPase for timely expression upon zinc excess in Pseudomonas aeruginosa. Frontiers in Microbiology, 2020, 11: 911. DOI:10.3389/fmicb.2020.00911 |
| [29] | Blaby-Haas CE, Furman R, Rodionov DA, Artsimovitch I, de Crécy-Lagard V. Role of a Zn-independent DksA in Zn homeostasis and stringent response. Molecular Microbiology, 2011, 79(3): 700-715. DOI:10.1111/j.1365-2958.2010.07475.x |
| [30] | Zackular JP, Knippel RJ, Lopez CA, Beavers WN, Maxwell CN, Chazin WJ, Skaar EP. ZupT facilitates Clostridioides difficile resistance to host-mediated nutritional immunity. mSphere, 2020, 5(2): e00061-20. |
| [31] | Kallifidas D, Pascoe B, Owen GA, Strain-Damerell CM, Hong H J, Paget MSB. The zinc-responsive regulator Zur controls expression of the coelibactin gene cluster in Streptomyces coelicolor. Journal of Bacteriology, 2010, 192(2): 608-611. DOI:10.1128/JB.01022-09 |
| [32] | Gi M, Lee KM, Kim SC, Yoon JH, Yoon SS, Choi JY. A novel siderophore system is essential for the growth of Pseudomonas aeruginosa in airway mucus. Scientific Reports, 2015, 5(1): 14644. DOI:10.1038/srep14644 |
| [33] | Turner KH, Wessel AK, Palmer GC, Murray JL, Whiteley M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(13): 4110-4115. DOI:10.1073/pnas.1419677112 |
| [34] | Gabriel SE, Helmann JD. Contributions of Zur-controlled ribosomal proteins to growth under zinc starvation conditions. Journal of Bacteriology, 2009, 191(19): 6116-6122. DOI:10.1128/JB.00802-09 |
| [35] | Min KB, Yoon SS. Transcriptome analysis reveals that the RNA polymerase-binding protein DksA1 has pleiotropic functions in Pseudomonas aeruginosa. Journal of Biological Chemistry, 2020, 295(12): 3851-3864. DOI:10.1074/jbc.RA119.011692 |
| [36] | Gourse RL, Chen AY, Gopalkrishnan S, Sanchez-Vazquez P, Myers A, Ross W. Transcriptional responses to ppGpp and DksA. Annual Review of Microbiology, 2018, 72: 163-184. DOI:10.1146/annurev-micro-090817-062444 |
| [37] | Furman R, Biswas T, Danhart EM, Foster MP, Tsodikov OV, Artsimovitch I. DksA2, a zinc-independent structural analog of the transcription factor DksA. FEBS Letters, 2013, 587(6): 614-619. DOI:10.1016/j.febslet.2013.01.073 |
| [38] | Leach LH, Morris JC, Lewis TA. The role of the siderophore pyridine-2, 6-bis (thiocarboxylic acid) (PDTC) in zinc utilization by Pseudomonas putida DSM 3601. BioMetals, 2007, 20(5): 717-726. DOI:10.1007/s10534-006-9035-x |
| [39] | Bobrov AG, Kirillina O, Fetherston JD, Miller MC, Burlison JA, Perry RD. The Yersinia pestis siderophore, yersiniabactin, and the ZnuABC system both contribute to zinc acquisition and the development of lethal septicaemic plague in mice. Molecular Microbiology, 2014, 93(4): 759-775. DOI:10.1111/mmi.12693 |
| [40] | Wang TT, Si MR, Song YH, Zhu WH, Gao F, Wang Y, Zhang L, Zhang WP, Wei GH, Luo ZQ, Shen XH. Type Ⅵ secretion system transports Zn2+ to combat multiple stresses and host immunity. PLoS Pathogens, 2015, 11(7): e1005020. DOI:10.1371/journal.ppat.1005020 |
| [41] | Si MR, Wang Y, Zhang B, Zhao C, Kang YW, Bai HN, Wei DW, Zhu LF, Zhang L, Dong TG, Shen XH. The type Ⅵ secretion system engages a redox-regulated dual-functional heme transporter for zinc acquisition. Cell Reports, 2017, 20(4): 949-959. DOI:10.1016/j.celrep.2017.06.081 |
| [42] | Lin JS, Zhang WP, Cheng JL, Yang X, Zhu KX, Wang Y, Wei GH, Qian PY, Luo ZQ, Shen XH. A Pseudomonas T6SS effector recruits PQS-containing outer membrane vesicles for iron acquisition. Nature Communications, 2017, 8: 14888. DOI:10.1038/ncomms14888 |
| [43] | Han YY, Wang TT, Chen GK, Pu QQ, Liu Q, Zhang YN, Xu LH, Wu M, Liang HH. A Pseudomonas aeruginosa type Ⅵ secretion system regulated by CueR facilitates copper acquisition. PLoS Pathogens, 2019, 15(12): e1008198. DOI:10.1371/journal.ppat.1008198 |
| [44] | Wątly J, Potocki S, Rowińska-Żyrek M. Zinc homeostasis at the bacteria/host interface-from coordination chemistry to nutritional immunity. Chemistry - A European Journal, 2016, 22(45): 15992-16010. DOI:10.1002/chem.201602376 |
| [45] |
Li B, Li J, Shen LX. Zinc regulation system in bacteria and its relationship with infection-a review. Acta Microbiologica Sinica, 2016, 56(8): 1211-1221.
(in Chinese) 李博, 李晶, 沈立新. 细菌锌离子调控体系与感染. 微生物学报, 2016, 56(8): 1211-1221. |
| [46] | Wu HH, Symersky J, Lu M. Structure and mechanism of a redesigned multidrug transporter from the major facilitator superfamily. Scientific Reports, 2020, 10(1): 3949. DOI:10.1038/s41598-020-60332-8 |
| [47] | Saier Jr MH, Paulsen IT. Phylogeny of multidrug transporters. Seminars in Cell & Developmental Biology, 2001, 12(3): 205-213. |
| [48] | Guan L, Kaback HR. Lessons from lactose permease. Annual Review of Biophysics and Biomolecular Structure, 2006, 35: 67-91. DOI:10.1146/annurev.biophys.35.040405.102005 |
| [49] | Newstead S, Drew D, Cameron AD, Postis VLG, Xia XB, Fowler PW, Ingram JC, Carpenter EP, Sansom MSP, McPherson MJ, Baldwin SA, Iwata S. Crystal structure of a prokaryotic homologue of the mammalian oligopeptide-proton symporters, PepT1 and PepT2. EMBO Journal, 2010, 30(2): 417-426. |
| [50] | Chevalier S, Bouffartigues E, Bodilis J, Maillot O, Lesouhaitier O, Feuilloley MGJ, Orange N, Dufour A, Cornelis P. Structure, function and regulation of Pseudomonas aeruginosa porins. FEMS Microbiology Reviews, 2017, 41(5): 698-722. DOI:10.1093/femsre/fux020 |
| [51] | Murphy JT, Bruinsma JJ, Schneider DL, Collier S, Guthrie J, Chinwalla A, Robertson JD, Mardis ER, Kornfeld K. Histidine protects against zinc and nickel toxicity in Caenorhabditis elegans. PLoS Genetics, 2011, 7(3): e1002013. DOI:10.1371/journal.pgen.1002013 |
| [52] | Nairn BL, Lonergan ZR, Wang J, Braymer JJ, Zhang YF, Calcutt MW, Lisher JP, Gilston BA, Chazin WJ, De Crécy-Lagard V, Giedroc DP, Skaar EP. The response of Acinetobacter baumannii to zinc starvation. Cell Host & Microbe, 2016, 19(6): 826-836. |
| [53] | Capdevila DA, Wang JF, Giedroc DP. Bacterial strategies to maintain zinc metallostasis at the host-pathogen interface. Journal of Biological Chemistry, 2016, 291(40): 20858-20868. DOI:10.1074/jbc.R116.742023 |
| [54] | Lin JS, Cheng JL, Wang Y, Shen XH. The Pseudomonas quinolone signal (PQS): not just for quorum sensing anymore. Frontiers in Cellular and Infection Microbiology, 2018, 8: 230. DOI:10.3389/fcimb.2018.00230 |
| [55] | Lin JS, Cheng JL. Quorum sensing in Pseudomonas aeruginosa and its relationship to biofilm development//Rathinam NK, Sani RK. Introduction to Biofilm Engineering. American Chemical Society, 2019: 1-16. |
| [56] | D'Orazio M, Mastropasqua MC, Cerasi M, Pacello F, Consalvo A, Chirullo B, Mortensen B, Skaar EP, Ciavardelli D, Pasquali P, Battistoni A. The capability of Pseudomonas aeruginosa to recruit zinc under conditions of limited metal availability is affected by inactivation of the ZnuABC transporter. Metallomics, 2015, 7(6): 1023-1035. DOI:10.1039/C5MT00017C |
| [57] | Gallagher LA, McKnight SL, Kuznetsova MS, Pesci EC, Manoil C. Functions required for extracellular quinolone signaling by Pseudomonas aeruginosa. Journal of Bacteriology, 2002, 184(23): 6472-6480. DOI:10.1128/JB.184.23.6472-6480.2002 |
| [58] | Dietrich LEP, Price-Whelan A, Petersen A, Whiteley M, Newman DK. The phenazine pyocyanin is a terminal signalling factor in the quorum sensing network of Pseudomonas aeruginosa. Molecular Microbiology, 2006, 61(5): 1308-1321. DOI:10.1111/j.1365-2958.2006.05306.x |
| [59] | Correnti C, Strong RK. Mammalian siderophores, siderophore-binding lipocalins, and the labile iron pool. Journal of Biological Chemistry, 2012, 287(17): 13524-13531. DOI:10.1074/jbc.R111.311829 |
| [60] | Haase H, Rink L. Multiple impacts of zinc on immune function. Metallomics, 2014, 6(7): 1175-1180. DOI:10.1039/c3mt00353a |
| [61] | Águeda-Pinto A, Castro LFC, Esteves PJ. The evolution of S100A7:An unusual gene expansion in Myotis bats. BMC Evolutionary Biology, 2019, 19(1): 102. DOI:10.1186/s12862-019-1433-0 |
| [62] | DeShazer D. A novel contact-independent T6SS that maintains redox homeostasis via Zn2+ and Mn2+ acquisition is conserved in the Burkholderia pseudomallei complex. Microbiological Research, 2019, 226: 48-54. DOI:10.1016/j.micres.2019.05.007 |
| [63] | Bielecki P, Puchałka J, Wos-Oxley ML, Loessner H, Glik J, Kawecki M, Nowak M, Tümmler B, Weiss S, dos Santos VAPM. In-vivo expression profiling of Pseudomonas aeruginosa infections reveals niche-specific and strain-independent transcriptional programs. PLoS ONE, 2011, 6(9): e24235. DOI:10.1371/journal.pone.0024235 |
| [64] | Battistoni A, Ammendola S, Chiancone E, Ilari A. A novel antimicrobial approach based on the inhibition of zinc uptake in Salmonella enterica. Future Medicinal Chemistry, 2017, 9(9): 899-910. DOI:10.4155/fmc-2017-0042 |
 2021, Vol. 61
2021, Vol. 61




