中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 黄建蓉, 高磊, 李丽, 李文均, 蒋宏忱. 2021
- Jianrong Huang, Lei Gao, Li Li, Wenjun Li, Hongchen Jiang. 2021
- 咸海湖泊退缩对岸边土壤真菌和植物内生真菌的影响研究
- Influence of lake desiccation on the entophytic and soil fungal communities on the Aral Sea shore
- 微生物学报, 61(6): 1681-1697
- Acta Microbiologica Sinica, 61(6): 1681-1697
-
文章历史
- 收稿日期:2020-11-17
- 修回日期:2021-01-02
- 网络出版日期:2021-03-27
2. 中国科学院新疆生态与地理研究所, 荒漠与绿洲生态国家重点实验室, 新疆 乌鲁木齐 830011;
3. 中山大学生命科学学院, 广东 广州 510275
2. State Key Laboratory of Desert and Oasis Ecology, Xinjiang Institute of Ecology and Geography, Chinese Academy of Sciences, Urumqi 830011, Xinjiang Uygur Autonomous Region, China;
3. School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, Guangdong Province, China
气候干旱和人类生活生产导致表面土壤盐化程度加重[1]。盐度升高会抑制土壤中微生物与植物的生长、降低物种多样性甚至改变微生物和植物群落构成[2-3]。因此,开展土壤微生物和植物内生菌群群落组成研究,有助于我们了解它们与环境变化之间的相互关系。作为土壤微生物的重要成员,土壤真菌具有重要的生态功能,可与土壤细菌和古菌联合,共同降解有机质,推动土壤生态系统的物质循环和能量流动过程,维持生态系统稳态[4-6]。大量研究表明土壤真菌多样性与土壤理化特性存在密切关系:如土壤真菌的丰富度随着土壤有机质含量增加而降低[7];土壤真菌的丰富度随着土壤全磷含量增加而增加[8];此外,也有研究表明,真菌(如丛枝菌根真菌)与土壤磷含量和有机质含量呈现与上述发现相反的关系,即随土壤含磷量增加而降低[9]和随着有机质含量增加而升高[10]。前人研究表明盐碱土中丛枝菌根真菌种类多样性与土壤养分状况、盐度及离子含量有关[11]。土壤水分作为真菌生长繁殖的必需物质,也是影响土壤真菌群落组成的重要理化因子[12]。但有关土壤真菌(尤其是生活在具有不同盐化程度的土壤中的真菌)群落构成如何响应湖泊干涸(如盐度升高、矿物组分变化、植物种类丰富度变化等)尚缺乏足够的了解。植物在其不同组织中具有不同的微生物群落(如内生真菌)[13]。内生真菌长期寄生在植物组织内,与宿主植物共同进化,在促进宿主植物生长发育、增强宿主植物的抗逆性等方面发挥重要作用,并帮助宿主植物适应环境压力(如盐度和干燥度等)[14-16]。因此,研究植物内生真菌对环境压力的响应至关重要。有研究表明,盐分条件显著影响了定殖于根系丛枝菌根真菌的群落结构,豆科真菌(Glomeraceae)的相对丰度在盐度150 mmol/L时显著降低[17]。然而,这些研究只关注了某些特定盐度条件下植物组织内生真菌群落的变化;而对生活在具有连续盐度梯度(从淡水到超盐)土壤中的植物内生真菌群落构成及其环境响应,我们知之甚少。
咸海(Aral Sea)位于中亚西部,处于哈萨克斯坦和乌兹别克斯坦交界处,其丰富的水资源在农业和渔业等方面有巨大的经济效益[18]。然而,自1960年代以来,由于受到当地干燥气候和人为活动的影响,咸海入湖径流量小于湖水蒸发量。因而,咸海水位逐渐降低且处于长期湖泊退缩状态,湖床暴露面积增加和盐度上升[19-20]。例如,咸海水位从66 m降低至16 m、且盐度从10 g/L增加至120–130 g/L[21-22]。持续暴露的咸海湖床从湖泊近岸到湖泊远岸形成了一个连续的盐度梯度;同时,咸海裸露湖床在不同时期的土壤带上形成了各自不同的植物群落[23]。咸海在1987年形成了北部和南部区域,随后于2003年形成东咸海(EAS)和西咸海(WAS)区域,且东咸海(EAS)在2014年已处于完全干涸的状态[24]。这些水文性质变化使得咸海不断遭受湖域退缩干涸化和一系列环境污染带来的影响,从而带来一系列的生态和环境问题。例如,前人研究表明咸海地区鱼类产量明显下降,许多鱼类物种锐减或灭绝;大量的盐粒沉积于暴露的湖床;盐沙暴导致农田盐碱化加剧;危害当地居民的健康等[19, 25]。作为生态系统中的重要组成部分,咸海微生物群落多样性和种群结构引起了生态学家越来越多的关注。最近一项研究表明,咸海水体原核微生物群落主要由耐盐或嗜盐菌组成[26]。我们课题组已经就咸海岸边不同土壤带的土壤细菌和古菌及植物内生细菌和内生古菌群落多样性与理化参数和矿物特性进行探讨分析,发现土壤细菌和古菌多样性随着可溶解盐浓度增加而降低,且与矿物石膏(gypsum)和方解石(calcite)含量呈正相关关系;但植物内生细菌和古菌多样性不受理化参数变化的影响[23]。尽管如此,对咸海不同时期的裸露土壤带的土壤真菌和植物内生真菌群落多样性和群落组成及其环境响应关系,仍不明晰。
综上所述,本研究拟基于ITS基因分析,研究咸海岸边不同土壤带土壤真菌和植物内生真菌群落构成,并结合咸海岸边不同土壤带的地球化学参数和矿物学特征,来初步探讨咸海岸边不同土壤带土壤真菌和植物内生真菌对湖泊干涸的响应。该研究结果可为保护咸海土壤真菌和植物真菌多样性以及保护咸海生态系统稳定性提供科学依据。
1 材料和方法 1.1 研究区概况采样区位于西咸海(WAS) (44º29ʹ N,58º12ʹ-58º13ʹ E),采样地图如我们前期研究所示[23]。西咸海(WAS)暴露的湖床面积从北到南长约10 km,从西(远岸)至东(当前湖岸线)宽约1.5 km。在暴露的湖床上,大约每隔10年从近岸到远岸都会出现不同的土壤带,且它们具有不同的植物群落组成(即植物物种多样性和体型大小)。因此,根据卡拉卡尔帕克斯坦(Karakalpakstan)学院自然科学研究所的资料,我们以空间代替时间的方式,将最远端暴露于1970年之前的土壤区域定义成E48,表示其已经暴露48年(截止于2018年采样时间,下同)且大约距离现今湖岸线约1400–1100 m。以此类推,其余样品依次标记为E38 (暴露于1980年之前)、E28 (暴露于1990年之前)、E18 (暴露于2000年之前)、E9 (暴露于2009年之前)、E1 (暴露于2017年之前)和E0 (2018年湖岸线附近沉积物样品)。
1.2 咸海岸边不同土壤带土壤和植物样品采集本研究所使用的咸海岸边不同土壤带土壤样品和植物样品采集于2018年8月。在每一个土壤带随机选取该区域健康优势植物,并采集地上植物体(根茎叶)放入无菌采样袋中带回实验室保存备用。同时,采集植物根部附近的土壤(深度3- 10 cm),采样时尽量去除石头和根系组织等。作为比较,我们还采集了湖岸附近(E0,距离当前的湖岸线约50 m)的沉积物样品。将采集的土壤和沉积物样品一部分放入50 mL无菌离心管中用于理化参数测试,另一部分放入含有RNA-Later溶液(样品︰RNA-Later溶液体积比1:1)的15 mL无菌离心管以便后续开展DNA提取工作。采集到的植物样品被运送至中国科学院新疆生态地理研究所干旱地区生物地理与生物资源重点实验室进行植物形态分析和鉴定。土壤理化性质与真菌群落多样性分析在中国地质大学(武汉)生物地质与环境地质国家重点实验室进行。
鉴定结果表明,咸海岸边不同土壤带分布着不同的植物,比如在E48、E38、E28、E18、E9和E1区域,分别有10、8、4、1、1和0种植物。另外,在邻近的土壤区域中的优势植物物种相似。例如,梭梭(Haloxylon ammodendron)、骆驼刺(Alhagi sparsifolia)和木蓼(Atraphaxis spinosa)在E48和E38土壤区域中占优势地位;盐穗木2 (Halostachys sp.)在E38和E28区域占优势地位;滨藜(Chenopodium album)在E28、E18和E9区域占优势。而在E1和E0区域无可见植物物种分布(表 1)。经鉴定,植物样品P1、P2和P3为滨藜(Chenopodium album)、P5为猪毛菜1 (Salsola affinis)、P4和P6为梭梭(Haloxylon ammodendron) (表 1)[23]。
| Soil zones | Soil TSS/ (g/L) | Exposure time/ (year) | Number of plant species | Dominant plant | Sample ID |
| E48 | 0.5±0.5 | 48 | 10 | Haloxylon ammodendron | P6 |
| Alhagi sparsifolia | |||||
| Atraphaxis spinosa | |||||
| Capparis spinosa | |||||
| Salsola affinis | P5 | ||||
| Salsola brachiata | |||||
| Moss | |||||
| E38 | 0.4±0.2 | 38 | 8 | Halostachys sp. | |
| Haloxylon ammodendron | P4 | ||||
| Alhagi sparsifolia | |||||
| Atraphaxis spinosa | |||||
| Ferula sp. | |||||
| Moss | |||||
| E28 | 23.3±2.1 | 28 | 4 | Chenopodium album | P3 |
| Salicornia europaea | – | ||||
| Halostachys caspica | – | ||||
| Halostachys sp. | – | ||||
| E18 | 23.7±7.5 | 18 | 1 | Chenopodium album | P2 |
| E9 | 71.3±6.1 | 9 | 1 | Chenopodium album | P1 |
| E1 | 62.9±10.7 | 1 | 0 | – | – |
| E0 | 69.9±8.3 | 0 | 0 | – | – |
| *: Modified from Jiang et al. (2020). | |||||
1.3 理化参数测试和矿物学分析
参照本实验室的研究方法[27],用离子色谱仪(ICS 600, Thermo Fisher, USA)对土壤中的主要阴阳离子浓度(Na+,K+,Ca2+,Mg2+,SO42-等离子浓度)进行检测。所测主要阴阳离子浓度之和作为土壤总可溶解盐(TSS)。使用multi N/C 2100S分析仪(Analytik Jena,Germany)测量咸海岸边不同土壤带土壤样品的总有机碳(TOC)浓度。用X射线粉晶衍射(XRD)方法鉴别咸海岸边不同土壤带土壤样品的矿物成分组成[23]。
本文涉及的咸海岸边不同土壤带土壤/沉积物样品地化参数和矿物学分析结果已经发表[23]。简言之,咸海岸边不同土壤带土壤/沉积物样品的总可溶解盐(TSS)范围为0.5–69.9 g/L;总有机碳(TOC)含量为0–0.92%。TSS从样品E48的0.5 g/L (淡水盐度)增加至靠近湖岸线的样品E1 62.9 g/L (咸盐盐度)。在采集的土壤和沉积物样品中,主要矿物成分组成如下:石英(quartz);碳酸盐矿物:方解石(calcite)和白云石(dolomite)等;长石类矿物:钠长石(albite)、微斜长石(microcline),分别含有钠和钾的铝硅酸盐;粘土矿物:绿泥石(chlorite)、伊利石(illite)和高岭石(kaolinite)等;蒸发岩:石膏(gypsum)、盐岩(halite)等。这些矿物成分相对丰度随着咸海岸边不同土壤带变化而发生系统性变化。例如,粘土矿物和蒸发岩的含量从咸海湖岸远端(土壤带的暴露时间最长)到湖岸近端(土壤带的暴露时间最短)逐渐增加,而碳酸盐矿物含量逐渐减少[23](表 2)。
| Environmental factors | Fungal community of the onshore soil | Endophytic fungal community of plant | |||
| r | P value | r | P value | ||
| Soil TSS | 0.13 | 0.18 | –0.07 | 0.54 | |
| Soil TOC contents | 0.30 | 0.06 | 0.11 | 0.33 | |
| Plant species richness | 0.78 | < 0.001 | 0.52 | 0.08 | |
| Soil mineralogical composition | |||||
| Quartz | –0.03 | 0.54 | –0.19 | 0.75 | |
| Chlorite | –0.13 | 0.74 | –0.38 | 0.99 | |
| Dolomite | 0.36 | 0.03 | 0.23 | 0.21 | |
| Calcite | 0.74 | < 0.01 | 0.58 | 0.04 | |
| Illite | –0.01 | 0.45 | –0.22 | 1.00 | |
| Albite | 0.10 | 0.28 | 0.28 | 0.14 | |
| Microcline | 0.43 | < 0.01 | 0.25 | 0.20 | |
| Halite | 0.00 | 0.40 | –0.22 | 1.00 | |
| Gypsum | 0.47 | < 0.01 | 0.43 | 0.06 | |
| Kaolinite | –0.03 | 0.49 | NA | NA | |
| NA: the relative abundance is lower than the detection empirical value. | |||||
1.4 土壤和植物基因组DNA提取、PCR扩增和高通量测序
在无菌条件下称取0.5 g咸海岸边不同土壤带土壤样品,使用ALFA-SEQ Advanced Soil DNA Kit试剂盒(广州微芯生物科技有限公司,中国)进行土壤样品基因组DNA提取。在无菌条件下提取植物组织总DNA。简单而言,先用流动的自来水冲洗每个植物样品,用以充分移除其表面黏土和附着的附生植物。冲洗后,用无菌剪刀将其剪成2–3 cm的片段,随后将植物组织样品在45 kHz下超声清洗30 min,以除去沉积的土壤和有机物。紧接着依次将植物组织样品浸泡在0.1% Tween-20中几秒钟,用浓度70%乙醇进行表面消毒3 min;之后用浓度5% NaOCl进行消毒5 min,并在摇动条件下依次将它们浸泡在层流空气室中进行表面消毒。在完成每个表面消毒步骤后,均用无菌水漂洗3–4次。消毒完成后,把植物组织置于层流空气室中进行干燥24 h,最后将得到的植物无菌组织部分用于DNA提取。使用ALFA-SEQ Advanced Plant DNA Kit试剂盒(中国,广州微芯生物科技有限公司)提取岸边不同植物内生菌总DNA。之后,借助NanoDrop 2000检测所提取的DNA浓度和纯度。土壤和植物样品的总DNA被保存于–20 ℃冰箱,用于后续PCR扩增。
采用带barcode标记的高通量测序ITS1区引物ITS5-1737F (5ʹ-GGAAGTAAAAGTCGTAACA AGG-3ʹ)/ITS2-2043R (5ʹ-GCTGCGTTCTTCATCG ATGC-3ʹ)[28]对土壤和植物样品的总DNA进行扩增,一式三份,反应体系为Premix Taq 2 25 μL、ITS5-1737F (10 mmol/L) 1 μL、ITS2-2043R (10 mmol/L) 1 μL、DNA (20 ng/μL) 3 μL、共计30 μL。PCR扩增程序为94 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测其片段长度和浓度,切取目标条带(约300 bp),将3份相同摩尔浓度的PCR产物进行合并和混合。随后使用DNA Gel Extraction Kit凝胶纯化试剂盒(Axygen,美国)对最终PCR混合产物进行纯化回收,最终得到符合Illumina Hiseq测序要求的DNA样品。按照Illumina标准流程制备测序样品库。完成建库后,使用Illumina Hiseq2500平台(2× 250 bp)对构建的扩增子文库进行PE250测序(广东美格基因科技有限公司,中国)。
1.5 测序数据分析所有Illumina测序产生的双端原始序列利用Trimmomatic软件(V0.33,http://www.usadellab.org/cms/?page=trimmomatic)进行质量过滤。其中,包含如下特征的序列将被移除:(1) 含N;(2) 质量值低于20;(3) 过滤后序列长度低于100 bp。得到质控后的双端序列之后,采用FLASH (V1.2.11,https://ccb.jhu.edu/software/FLASH/)软件进行双端序列拼接[29]。根据barcode和引物信息等,利用Mothur软件(V1.35.1,http://www.mothur.org)将序列分配至对应样品;随后,去除barcode和引物得到有效拼接片段。此外,利用USEARCH软件(V10,http://www.drive5.com/usearch/)对所有样品进行物种分类单元(OTU)的聚类[30],将≥97%相似度阈值的有效拼接序列归为同一物种分类单元,并且选取丰度最高的序列作为OTU代表序列。为了避免可能的偏差,USEARCH软件在聚类的同时将会剔除嵌合体和单条序列。采用BLAST比对方法(比对设定置信度阈值默认为0.5以上)对每个OTU的代表性序列与Unite (http://unite.ut.ee/index.php)数据库进行比对,从而获得ITS基因的物种注释信息。最后对得到的数据进行均一化处理,且后续大部分统计分析将基于均一化(n=53674)的OTU表格。使用R语言“vegan”程序包来计算各个样品的Alpha多样性(97%相似度阈值),包括观察到的OTU数量、Shannon多样性指数和Simpson均匀度指数。
1.6 统计分析使用R语言(http://cran.r-project.org/,version R-3.5.2,2018-12)和PAST 3.0软件(http://folk.uio.no/ohammer/past/)进行数据统计分析。使用PAST软件对咸海岸边不同土壤带土壤真菌群落和植物内生真菌群落进行基于Bray-Curtis距离的聚类分析、主坐标分析(PCoA)和置换多因素方差分析(One-way PERMANOVA)。线性回归模型被用于评估咸海岸边不同土壤带土壤样品和植物内生真菌群落差异与暴露时间和总可溶盐差异之间的相关性。该项分析基于Bray-Curtis距离且借助R语言“vegan”和“ggplot2”程序包来进行。使用R语言“vegan”程序包进行Mantel检测(Pearson’s correlation,permutation: 9999),用于评估所测的环境因子对真菌群落结构的影响。
1.7 登录序列号本项研究所产生的测序数据已经上传至NCBI SRA数据库,项目号为PRJNA526407,登录号(Accession Number)为SRR8755239–SRR8755314。
2 结果和分析 2.1 咸海岸边不同土壤带土壤和植物内生真菌群落分布特征对于咸海岸边不同土壤带土壤和植物样品的高通量数据进行处理和分析后,在咸海岸边不同土壤带土壤样品(n=10)中,共获得1098943条高质量序列,平均每个样品含有109894序列,且这些序列可归属于1223 OTUs。这些序列分属于6个门、11个纲和26个属。在咸海岸边不同土壤带植物样品(n=6)中,共产生451334条高质量序列,平均序列75222条,共获得565个OTUs。这些序列也同样分属于6个门、11个纲和26个属。
Alpha多样性指数分析结果显示(图 1),在咸海岸边不同土壤带土壤样品中所观察到的真菌OTU数量在132–480之间、Shannon多样性指数的范围为2.20–3.69、Simpson均匀度指数的范围为0.71–0.95;在咸海岸边不同土壤带植物样品中所观察到的OTU数量范围为207–274、Shannon多样性指数的范围为0.44–0.62、Simpson均匀度指数的范围为0.13–0.22。咸海岸边不同土壤带的土壤样品真菌Shannon多样性指数(图 1-B)和Simpson均匀度指数(图 1-C)未出现明显变化规律。而对于所观察到的真菌OTU数量(图 1-A),我们发现除E1样品外,在暴露时间较短的土壤样品E18、E9和E0中所观察到的真菌OTU数量低于暴露时间较短的土壤样品E48、E38和E28。在咸海岸边不同土壤带植物样品中,同一种植物(P1、P2、P3,滨藜Chenopodium album;P4、P6,梭梭Haloxylon ammodendron)的真菌Alpha多样性指数如观察到的OTU数量(图 1-D)、Shannon多样性指数(图 1-E)和Simpson均匀度指数(图 1-F)相近;而不同种植物P5猪毛菜(Salsola affinis)的真菌群落Alpha多样性指数则略高于P1、P2与P3滨藜(Chenopodium album)和P4与P6梭梭(Haloxylon ammodendron),但相对而言波动变化不明显。另外,随着暴露时间的变化,在咸海岸边不同土壤带植物样品中的内生真菌Alpha多样性指数均波动较小(图 1-D、E、F)。
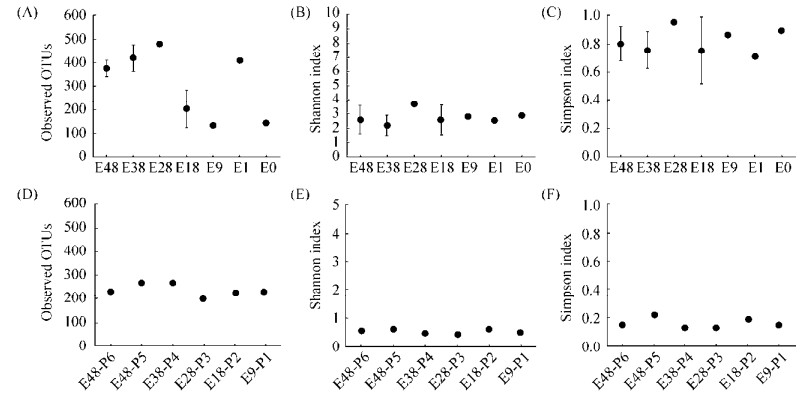
|
| 图 1 咸海岸边不同土壤带土壤真菌(A, B, C)和植物内生真菌群落(D, E, F)的Alpha多样性指数(所观察到的OTU数量、Shannon多样性指数和Simpson均匀度指数) Figure 1 Diversity indices (Observed OTUs, Shannon index and Simpson index, respectively) of the soil fungi (A, B, C) and endophytic fungi (D, E, F) of the studied soils collected from the different onshore soil zones of the Aral Sea. |
咸海岸边不同土壤带土壤样品中优势真菌群落组成有较大差异(图 2-A)。例如,土壤样品E48 (暴露于1970年之前)的真菌主要优势群落主要由锤舌菌纲(Leotiomycetes,占27%)和座囊菌纲(Dothideomycetes,占24%)组成;土壤样品E38 (暴露于1980年之前)的真菌主要群落主要是粪壳菌纲(Sordariomycetes,占48%)、散囊菌纲(Eurotiomycetes,占14%)和锤舌菌纲(Leotiomycetes,占10%);土壤样品E28 (暴露于1990年之前)的真菌主要群落主要是粪壳菌纲(Sordariomycetes,占29%)和散囊菌纲(Eurotiomycetes,占8%);土壤样品E18 (暴露于2000年之前)的真菌主要群落主要是座囊菌纲(Dothideomycetes,占4%);土壤样品E9 (暴露于2009年之前)的真菌主要群落主要是座囊菌纲(Dothideomycetes,占5%)和黑粉菌亚门(Ustilaginomycotina,占5%);土壤样品E1 (暴露于2018年之前)的真菌主要群落主要是散囊菌纲(Eurotiomycetes,占55%)和粪壳菌纲(Sordariomycetes,占4%);而湖岸沉积物样品E0的真菌主要群落主要是黑粉菌亚门(Ustilaginomycotina,占10%)、伞菌纲(Agaricomycetes,占9%)、散囊菌纲(Eurotiomycetes,占9%)和锤舌菌纲(Leotiomycetes,占9%)。值得一提的是,在土壤样品E28、E18和E0中,未知分类地位的真菌类群相对丰度均高于50%以上。
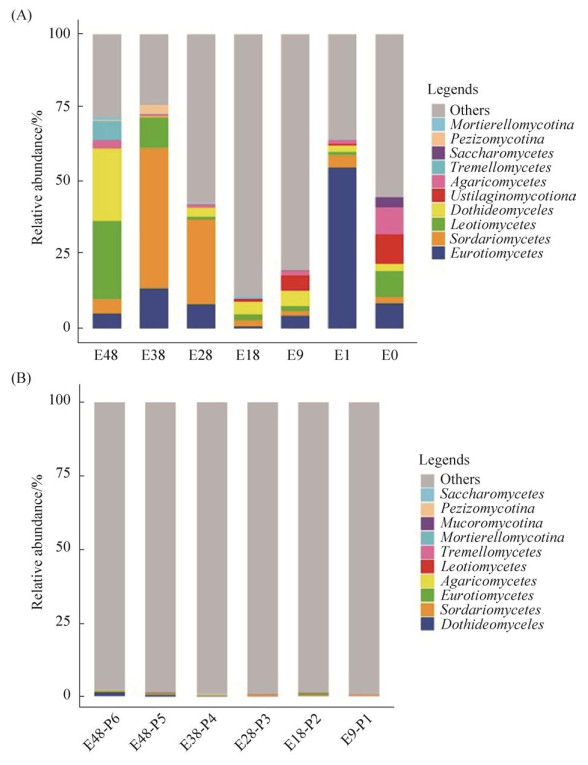
|
| 图 2 咸海岸边不同土壤带土壤真菌(A)和植物内生真菌群落(B)构成结构图 Figure 2 Community composition of the soil fungi (A) and plant endophytic fungi (B) in the different onshore soil zones of the Aral Sea. |
对采自咸海岸边不同土壤带的植物进行内生真菌群落组成分析发现,97.8%以上的真菌群落不能鉴定到任何已知的真菌进化门类。在已知真菌类群中,植物内生真菌的群落组成分布于粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotiomycetes)、伞菌纲(Agaricomycetes)、银耳纲(Tremellomycetes)和锤舌菌纲(Leotiomycetes)且相对丰度均较低(< 1.34%) (图 2-B)。
咸海岸边不同土壤带土壤真菌群落的聚类分析显示(图 3-A),7个咸海岸边不同土壤带的真菌群落按植物种类丰富度聚在一起,同一土壤带的平行样品聚在一起。E48 (有10种植物)和E38 (有8种植物)分别单独聚为一枝,而E28、E18、E9、E1和E0 (各少于5种植物)则聚为一枝。主坐标分析(PCoA) (图 4-A)表明,第一主坐标PCo1和第二主坐标PCo2分别具有26.19%和15.41%的解释量。植物种类丰富度高的土壤样品(E48和E38)与其他土壤带土壤样品中的真菌群落组成存在差异;而植物种类丰富度较低的土壤样品(E28、E18、E9、E1和E0)真菌群落组成类似。上述主坐标分析结果与咸海岸边不同土壤带土壤真菌群落聚类分析结果基本一致。另外,置换多因素方差分析(one-way PERMANOVA)结果也进一步证实咸海岸边不同土壤带土壤真菌群落存在显著差异(R2=0.76,P=0.004)。

|
| 图 3 咸海岸边不同土壤带土壤真菌(A)和植物内生真菌群落(B)的聚类分析 Figure 3 Cluster analysis of the soil fungal community (A) and plant endophytic fungal community (B) in the different onshore soil zones of the Aral Sea. Algorithm: UPGMA; Similarity index: Bray-Curtis (permutation: 9999). |

|
| 图 4 咸海岸边不同土壤带土壤真菌(A)和植物内生真菌群落(B)差异的主坐标分析(PCoA) Figure 4 PCoA plots (based on Bray-Curtis dissimilarity matrix) showing relative compositional differences among the soil fungal community (A) and plant endophytic fungal community (B) in the different onshore soil zones of the Aral Sea. Values on PCoA axes indicate the percentages of total variation explained by each axis. Fungal community dissimilarities were indicated by permutational multivariate analysis of variance (PERMANOVA) with ADONIS function (permutation: 999). |
咸海岸边不同土壤带植物内生真菌群落的聚类分析显示(图 3-B),同一种植物(滨藜Chenopodium album P1、P2与P3;梭梭Haloxylon ammodendron P4与P6)的内生真菌群落较为类似且各自聚在一枝;而不同种植物(猪毛菜Salsola affinis P5;滨藜Chenopodium album P1、P2、P3;和梭梭Haloxylon ammodendron P4、P6)的内生真菌群落相距较远,各单独聚为一枝。该结果与主坐标分析(PCoA) (图 4-B)结果相一致,且第一主坐标PCo1和第二主坐标PCo2分别具有66.43%和33.31%的解释量。同时,置换多因素方差分析(one-way PERMANOVA)也进一步证实咸海岸边不同土壤带植物内生真菌群落存在显著差异(R2=0.99,P=0.017)。
2.2 咸海岸边不同土壤带土壤和植物内生真菌群落对环境变化的响应我们通过建立线性回归模型,进一步分析咸海岸边不同土壤带土壤真菌群落和植物内生真菌群落对环境变化的响应。结果显示,咸海岸边不同土壤带土壤真菌群落差异与暴露时间距离具有显著相关性(R2=0.32,P < 0.05),其群落差异随暴露时间距离增加而增加(图 5-A);而与总可溶解盐差异则无明显相关性(R2=0.00,P=0.45;图 5-B)。而植物内生真菌群落差异与暴露时间距离(图 5-C)和总可溶解盐差异(图 5-D)之间均不存在显著差异关系(分别为R2=0.02,P=0.268;R2=–0.07,P=0.799)。
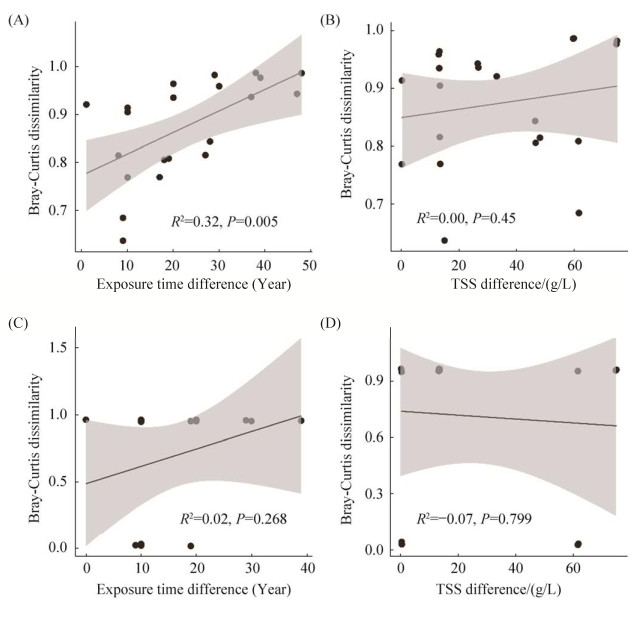
|
| 图 5 咸海岸边不同土壤带土壤真菌群落和植物内生真菌群落差异性与暴露时间距离和总可溶解盐差异的关系 Figure 5 Linear regression analysis showing correlations between the fungal community dissimilarities of the onshore soils and plants in the different Aral Sea soil zones and the exposure time distance and total soluble salts (TSS) difference (Gray shade indicates 95% confidence). A: correlation between the soil fungal community dissimilarities and the exposure time distance; B: correlation between the soil fungal community dissimilarities and the TSS difference; C: correlation between the plant endophytic fungal community dissimilarities and the exposure time distance; D: correlation between the plant endophytic fungal community dissimilarities and the TSS difference. |
2.3 环境因子和矿物对真菌群落结构的影响
Mantel检验分析显示(表 2):咸海岸边不同土壤带土壤真菌群落与植物种类丰富度、白云石(dolomite)、方解石(calcite)、微斜长石(microcline)和石膏(gypsum)之间存在显著的相关关系(P < 0.05),且植物种类丰富度和方解石(calcite)对其影响最强(植物种类丰富度,r=0.78;Calcite,r=0.74),而与土壤总可溶解盐(TSS),土壤总有机碳(TOC)含量和其余矿物成分不存在显著相关性(P < 0.05)。然而,植物内生真菌群落仅与方解石(calcite)之间存在显著相关关系(P < 0.05),而与土壤总可溶解盐(TSS)、土壤总有机碳(TOC)含量、植物种类丰富度和其余矿物成分之间不存在显著相关性(P < 0.05)。
3 讨论 3.1 咸海岸边不同土壤带土壤真菌多样性和群落组成本研究表明咸海岸边不同土壤带土壤样品中的真菌Alpha多样性随湖床暴露时间增加(盐度变化、矿物成分构成)无明显变化规律。例如,咸海岸边不同土壤带土壤样品的Shannon多样性指数(图 1-B)和Simpson均匀度指数(图 1-C)未随着暴露时间而出现明显变化规律,仅对所观察到的OTU数量有一定影响(图 1-A)。这可能是由于盐度影响了真菌繁殖体的萌发,其菌丝的生长发育受到抑制[31]。因此,虽然盐度与土壤真菌Shannon多样性和Simpson均匀度指数无关,但却影响了一些真菌的相对丰度。这一发现与前人研究不一致。已有研究证实丛枝菌根真菌的物种丰富度与土壤盐度呈现负显著相关(P < 0.01)[32]。产生这种不一致可能意味着土壤盐度不是影响咸海岸边不同土壤带土壤真菌多样性的主要因素。相反,植物种类丰富度和特定矿物组成等因素对该区域土壤真菌多样性限制作用更大。因此,咸海岸边不同土壤带土壤真菌多样性与盐度之间不存在明显相关性是合理的。
咸海岸边不同土壤带的土壤样品中优势真菌类群为座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotiomycetes)、粪壳菌纲(Sordariomycetes)、锤舌菌纲(Leotiomycetes)、黑粉菌亚门(Ustilaginomycotina)和伞菌纲(Agaricomycetes)。这种分布情况与分离自中国新疆克拉玛依盐渍农业土壤的主要真菌群落较为相似[33]。值得注意的是,咸海岸边不同土壤带的土壤样品中优势真菌群落的相对丰度有较大差异(图 2-A)。例如,土壤样品E38和E28 (总可溶解盐 < 23.3 g/L)中粪壳菌纲(Sordariomycetes)为主要类群,其相对丰度大于29%,而土壤样品E1 (总可溶解盐为62.9±10.7 g/L)中散囊菌纲(Eurotiomycetes)为优势类群,其相对丰度为55%。前人对一株生活在高盐环境中的真菌Eurotium rubrum (Eurotiomycetes)进行基因组和转录组分析,发现Eurotium rubrum可以获得与应激反应相关的基因且能有效抵消盐分胁迫压力[34]。因此具备该特性的真菌类群可以在高盐胁迫下进行生长和进化。这也解释了散囊菌纲(Eurotiomycetes)在咸海岸边高盐土壤环境中占优势地位的原因。另外,我们发现在土壤样品E28、E18和E0中的未知分类地位的类群相对丰度均高于50%以上,表明这几处土壤样品可能蕴藏着丰富的真菌多样性。
此外,本研究发现咸海岸边不同土壤带土壤真菌按植物种类丰富度进行聚类(图 3-A)。这说明植物种类丰富度是影响土壤真菌群落构成的重要因素[35]。因此,不难发现咸海岸边不同土壤带土壤样品真菌群落差异性与暴露时间距离具有显著相关性(R2=0.32,P < 0.05)。这一发现与前人研究结果一致[36]。
3.2 咸海岸边不同土壤带植物内生真菌多样性和群落组成随着暴露时间的变化,咸海岸边不同土壤带植物样品的内生真菌Alpha多样性指数均波动较小。这表明内生真菌群落Alpha多样性指数受土壤暴露时间变化(盐度变化)的影响较小。内生真菌长期寄生在植物组织内,与宿主形成复杂的共生关系。大量研究表明一些植物内生真菌有助于增强宿主植物的抗逆性[37],通过特化栖息地的方式增强植物对干旱环境和高盐环境的抗性[38-39]。另外,相较于本研究的土壤真菌,97.8%以上的植物内生真菌群落不能鉴定到任何已知的真菌门类,说明在咸海岸边植物组织具有丰富的内生真菌资源。这与前人研究相符,其研究表明水生植物内生真菌有75.1%不能鉴定到门水平,而底泥中仅有12.61%不能鉴定到已知的真菌门类,表明植物组织内拥有更多的未知真菌分类单元[40]。除此以外,本研究发现,同种植物之间的内生真菌群落较为类似,而不同植物之间的内生真菌群落差异较大(图 3-B、图 4-B)。这与前人研究一致,即内生真菌的分布受控于宿主植物的种类及其地理分布[41]。
3.3 环境因子和矿物组成对咸海岸边不同土壤带土壤和植物内生真菌群落结构的影响咸海岸边不同土壤带土壤真菌群落与植物种类丰富度和矿物组成呈显著相关。这与前人的结果一致。前人研究发现土壤真菌群落组成与植物种类组成和种类丰富度紧密相关[35]。植物可以提供有机物质[42],其更高的多样性有助于增加微气候变异性和栖息地复杂性(如土壤空隙空间、根系结构等)[43],从而使植物对不同环境压力胁迫具有较高的耐受力。此外,因为不同的矿物表面可以提供不同的微生态位和养分给特定的微生物类群[44-45],所以,矿物成分组成可影响微生物群落组成[46-47]。因此,咸海岸边不同土壤带的土壤真菌和植物内生真菌群落主要受到植物种类丰富度和/或矿物组成的影响。
咸海岸边不同土壤带土壤真菌与土壤总可溶解盐和土壤总有机碳含量相关性不显著(表 2),且土壤真菌群落差异性与总可溶解盐差异则无明显相关性(图 5-B),说明总可溶解盐与土壤总有机碳含量对土壤真菌结构组成的影响较小。在植物内生真菌中也发现其群落差异性与总可溶解盐差异之间无显著相关(图 5-D),表明植物内生真菌群落可能不易受土壤盐度变化的影响。这一发现可解释为:极端干旱地区的植物具有特殊的脱盐和保水机制,因此可以响应外部盐度变化而保持稳定的内部盐度[48]。除此之外,矿物可以提供不同的微生态位和养分[46-47],能协助真菌更好地适应盐度胁迫环境。然而上述这些结果与已经报道的研究结果略有不同。例如,前人对哥伦比亚地区半干旱红树林根际不同盐度水平下根际真菌群落的进行分析,其结果表明土壤盐度是决定红树林真菌群落组成的关键因素[49]。而此前一项研究认为土壤碳含量是驱动中国东北黑土区真菌群落生物地理分布的关键因素[50]。除此之外,相关研究进一步表明,土壤水分、盐度、总钾浓度和有机物质也是影响咸盐土壤中真菌群落分布的环境驱动因子[33]。导致上述不一致的原因可能是不同地区的土壤特性不同(如土壤有机质含量、含水量、质地等),因此在不同盐碱地区分析盐度对真菌群落的影响可能会出现相矛盾的结果[11]。
总之,本文以咸海不同暴露时期土壤带的土壤真菌和植物内生真菌作为研究对象,基于ITS基因进行高通量测序技术并结合土壤地球化学参数和矿物特性,对土壤真菌和植物内生真菌多样性和种群结构及其对湖泊干涸的响应进行了探究。研究结果表明,持续暴露的咸海湖床从湖泊远岸到湖泊近岸形成了一个连续的盐度梯度(总可溶解盐0.4–71.3 g/L),且植物分布和矿物组成存在明显差异。咸海岸边不同土壤带土壤样品优势真菌类群(> 5%)为散囊菌纲(Eurotiomycetes)、粪壳菌纲(Sordariomycetes)、锤舌菌纲(Leotiomycetes)、座囊菌纲(Dothideomycetes)、黑粉菌亚门(Ustilaginomycotina)和伞菌纲(Agaricomycetes),而植物样品优势真菌类群为未知真菌门类(> 97.8%)。土壤真菌群落组成按植物种类丰富度进行聚类,而植物内生真菌群落按植物种类进行聚类。咸海岸边不同土壤带的土壤真菌和植物内生真菌群落受到总可溶解盐变化的影响较小,主要取决于植物种类(丰富度)和特定矿物组成的变化。综上,本研究结果将有助于我们了解咸海近岸土壤真菌和植物内生真菌对湖泊干涸的响应,并为评估环境变化对湖泊近岸土壤生态系统的影响提供科学依据。
| [1] | Zhao CZ, Zhang H, Song CP, Zhu JK, Shabala S. Mechanisms of plant responses and adaptation to soil salinity. The Innovation, 2020, 1(1): 100017. DOI:10.1016/j.xinn.2020.100017 |
| [2] | Rath KM, Fierer N, Murphy DV, Rousk J. Linking bacterial community composition to soil salinity along environmental gradients. The ISME Journal, 2019, 13(3): 836-846. DOI:10.1038/s41396-018-0313-8 |
| [3] |
Yang LM, Han M, Li JD. Effect of soil salinization on the plant diversity of Leymus chinensis grassland. Acta Agrestia Sinica, 1997, 5(3): 154-160.
(in Chinese) 杨利民, 韩梅, 李建东. 土壤盐碱化对羊草草地植物多样性的影响. 草地学报, 1997, 5(3): 154-160. |
| [4] |
He JS, Wang ZQ, Fang JY. Issues and prospects of belowground ecology with special reference to global climate change. Chinese Science Bulletin, 2004, 49(13): 1226-1233.
(in Chinese) 贺金生, 王政权, 方精云. 全球变化下的地下生态学: 问题与展望. 科学通报, 2004, 49(13): 1226-1233. DOI:10.3321/j.issn:0023-074X.2004.13.002 |
| [5] | Tedersoo L, Bahram M, Põlme S, Kõljalg U, Abarenkov K. Fungal biogeography. Global diversity and geography of soil fungi. Science, 2014, 346(6213): 1256688. DOI:10.1126/science.1256688 |
| [6] | Fierer N. Embracing the unknown: disentangling the complexities of the soil microbiome. Nature Reviews Microbiology, 2017, 15(10): 579-590. DOI:10.1038/nrmicro.2017.87 |
| [7] | de Vries FT, Hoffland E, van Eekeren N, Brussaard L, Bloem J. Fungal/bacterial ratios in grasslands with contrasting nitrogen management. Soil Biology and Biochemistry, 2006, 38(8): 2092-2103. DOI:10.1016/j.soilbio.2006.01.008 |
| [8] | Yang T, Adams JM, Shi Y, He JS, Jing X, Chen LT, Tedersoo L, Chu HY. Soil fungal diversity in natural grasslands of the Tibetan Plateau: associations with plant diversity and productivity. New Phytologist, 2017, 215(2): 756-765. DOI:10.1111/nph.14606 |
| [9] |
Wu QS, Fei YJ, Wei QA. Study on the development of root arbuscular mycorrhizal of lawn grass plants and its relationship with soil available phosphorus. Hubei Agricultural Sciences, 2010, 49(9): 2101-2103.
(in Chinese) 吴强盛, 费永俊, 韦启安. 草坪草根系丛枝菌根发育及其与土壤有效磷的关系. 湖北农业科学, 2010, 49(9): 2101-2103. DOI:10.3969/j.issn.0439-8114.2010.09.018 |
| [10] | Montiel-Rozas MDM, López-García Á, Madejón P, Madejón E. Native soil organic matter as a decisive factor to determine the arbuscular mycorrhizal fungal community structure in contaminated soils. Biology and Fertility of Soils, 2017, 53(3): 327-338. DOI:10.1007/s00374-017-1181-5 |
| [11] |
Sheng M, Tang M, Zhang FF, Huang YH. Effect of soil factors on arbuscular mycorrhizal fungi in saline alkaline soils of Gansu, Inner Mongolia and Ningxia. Biodiversity Science, 2011, 19(1): 85-92.
(in Chinese) 盛敏, 唐明, 张峰峰, 黄艳辉. 土壤因子对甘肃、宁夏和内蒙古盐碱土中AM真菌的影响. 生物多样性, 2011, 19(1): 85-92. |
| [12] |
Zhang SM, Huang YM, Ni YX, Zhong QQ. Effects of artificial forest and grass on soil fungal community at southern Ningxia mountain. China Environmental Science, 2018, 38(4): 1449-1458.
(in Chinese) 张树萌, 黄懿梅, 倪银霞, 钟祺琪. 宁南山区人工林草对土壤真菌群落的影响. 中国环境科学, 2018, 38(4): 1449-1458. |
| [13] | Bulgarelli D, Schlaeppi K, Spaepen S, Ver Loren van Themaat E, Schulze-Lefert P. Structure and functions of the bacterial microbiota of plants. Annual Review of Plant Biology, 2013, 64: 807-838. DOI:10.1146/annurev-arplant-050312-120106 |
| [14] | Cordovez V, Dini-Andreote F, Carrión VJ, Raaijmakers JM. Ecology and evolution of plant microbiomes. Annual Review of Microbiology, 2019, 73: 69-88. DOI:10.1146/annurev-micro-090817-062524 |
| [15] | Müller DB, Vogel C, Bai Y, Vorholt JA. The plant microbiota: systems-level insights and perspectives. Annual Review of Genetics, 2016, 50(1): 211-234. DOI:10.1146/annurev-genet-120215-034952 |
| [16] | Vaishnav A, Shukla AK, Sharma A, Kumar R, Choudhary DK. Endophytic bacteria in plant salt stress tolerance: current and future prospects. Journal of Plant Growth Regulation, 2019, 38(2): 650-668. DOI:10.1007/s00344-018-9880-1 |
| [17] | Yang R, Qin ZF, Wang JJ, Xu S, Zhao W, Zhang XX, Huang ZY. Salinity changes root occupancy by arbuscular mycorrhizal fungal species. Pedobiologia, 2020, 81/82: 150665. DOI:10.1016/j.pedobi.2020.150665 |
| [18] | Micklin P. The past, present, and future Aral Sea. Lakes & Reservoirs: Research & Management, 2010, 15(3): 193-213. |
| [19] | Micklin P. The Aral sea disaster. Annual Review of Earth and Planetary Sciences, 2007, 35(1): 47-72. DOI:10.1146/annurev.earth.35.031306.140120 |
| [20] | Micklin PP. Desiccation of the Aral sea: a water management disaster in the soviet union. Science, 1988, 241(4870): 1170-1176. DOI:10.1126/science.241.4870.1170 |
| [21] | Gaybullaev B, Chen SC, Kuo YM. Large-scale desiccation of the Aral Sea due to over-exploitation after 1960. Journal of Mountain Science, 2012, 9(4): 538-546. DOI:10.1007/s11629-012-2273-1 |
| [22] | Rafikov V, Gulnora M. Forecasting changes of hydrological and hydrochemical conditions in the Aral Sea. Geodesy and Geodynamics, 2014, 5(3): 55-58. DOI:10.3724/SP.J.1246.2014.03055 |
| [23] | Jiang HC, Huang JR, Li L, Huang LQ, Manzoor M, Yang J, Wu G, Sun XX, Wang BC, Egamberdieva D, Panosyan H, Birkeland NK, Zhu ZH, Li WJ. Onshore soil microbes and endophytes respond differently to geochemical and mineralogical changes in the Aral Sea. Science of the Total Environment, 2021, 765: 142675. DOI:10.1016/j.scitotenv.2020.142675 |
| [24] | Izhitskiy AS, Zavialov PO, Sapozhnikov PV, Kirillin GB, Grossart HP, Kalinina OY, Zalota AK, Goncharenko IV, Kurbaniyazov AK. Present state of the Aral Sea: diverging physical and biological characteristics of the residual basins. Scientific Reports, 2016, 6: 23906. DOI:10.1038/srep23906 |
| [25] | Erdinger L, Eckl P, Ingel F, Khussainova S, Utegenova E, Mann V, Gabrio T. The Aral Sea disaster-human biomonitoring of Hg, As, HCB, DDE, and PCBs in children living in Aralsk and Akchi, Kazakhstan. International Journal of Hygiene and Environmental Health, 2004, 207(6): 541-547. DOI:10.1078/1438-4639-00325 |
| [26] | Shurigin V, Hakobyan A, Panosyan H, Egamberdieva D, Davranov K, Birkeland NK. A glimpse of the prokaryotic diversity of the Large Aral Sea reveals novel extremophilic bacterial and archaeal groups. MicrobiologyOpen, 2019, 8(9): e00850. |
| [27] |
Tang Y, Liu YC, Yang J, Jiang HC. Gene diversity involved in kalvin pathway of carbon fixation and its response to environmental variables in surface sediments of the northern Qinghai-Tibetan Plateau lakes. Earth Science, 2018, 43(S1): 19-30.
(in Chinese) 唐阳, 刘永超, 杨渐, 蒋宏忱. 青藏高原北部湖泊表层沉积物参与卡尔文循环的固碳基因多样性及其影响因素. 地球科学, 2018, 43(S1): 19-30. |
| [28] | Zhang LL, Zhang HQ, Wang ZH, Chen GJ, Wang LS. Dynamic changes of the dominant functioning microbial community in the compost of a 90-m3 aerobic solid state fermentor revealed by integrated meta-omics. Bioresource Technology, 2016, 203: 1-10. DOI:10.1016/j.biortech.2015.12.040 |
| [29] | Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [30] | Edgar RC, Haas BJ, Clemente JC, Quince C, Knight R. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [31] | Juniper S, Abbott LK. Soil salinity delays germination and limits growth of hyphae from propagules of arbuscular mycorrhizal fungi. Mycorrhiza, 2006, 16(5): 371-379. DOI:10.1007/s00572-006-0046-9 |
| [32] | Krishnamoorthy R, Kim K, Kim C, Sa TM. Changes of arbuscular mycorrhizal traits and community structure with respect to soil salinity in a coastal reclamation land. Soil Biology and Biochemistry, 2014, 72: 1-10. DOI:10.1016/j.soilbio.2014.01.017 |
| [33] | Zhao S, Liu JJ, Banerjee S, White JF, Zhou N, Zhao ZY, Zhang K, Hu MF, Kingsley K, Tian CY. Not by salinity alone: how environmental factors shape fungal communities in saline soils. Soil Science Society of America Journal, 2019, 83(5): 1387-1398. DOI:10.2136/sssaj2019.03.0082 |
| [34] | Kis-Papo T, Weig AR, Riley R, Peršoh D, Salamov A, Sun H, Lipzen A, Wasser SP, Rambold G, Grigoriev IV, Nevo E. Genomic adaptations of the halophilic Dead Sea filamentous fungus Eurotium rubrum. Nature Communications, 2014, 5: 3745. DOI:10.1038/ncomms4745 |
| [35] | Peay KG, Baraloto C, Fine PVA. Strong coupling of plant and fungal community structure across western Amazonian rainforests. The ISME Journal, 2013, 7(9): 1852-1861. DOI:10.1038/ismej.2013.66 |
| [36] |
Zhang LQ, Zhang ZM, Zhang LM, Wang JT. Succession of soil fungal and bacterial communities in a typical chronosequence of abandoned agricultural lands. Acta Ecologica Sinica, 2019, 39(8): 2715-2722.
(in Chinese) 张露琪, 张志明, 张丽梅, 王军涛. 典型农田退耕后土壤真菌与细菌群落的演替. 生态学报, 2019, 39(8): 2715-2722. |
| [37] |
Liang Y, Gao YB. Effects of endophyte infection on growth, development and stress resistance of plants. Chinese Bulletin of Botany, 2000, 35(1): 52-59.
(in Chinese) 梁宇, 高玉葆. 内生真菌对植物生长发育及抗逆性的影响. 植物学通报, 2000, 35(1): 52-59. DOI:10.3969/j.issn.1674-3466.2000.01.008 |
| [38] | Rodriguez RJ, White Jr JF, Arnold AE, Redman RS. Fungal endophytes: diversity and functional roles. New Phytologist, 2009, 182(2): 314-330. DOI:10.1111/j.1469-8137.2009.02773.x |
| [39] | Rodriguez RJ, Henson J, Van Volkenburgh E, Hoy M, Wright L, Beckwith F, Kim YO, Redman RS. Stress tolerance in plants via habitat-adapted symbiosis. The ISME Journal, 2008, 2(4): 404-416. DOI:10.1038/ismej.2007.106 |
| [40] | 王洹. |
| [41] |
Ji YL, Sun XH, Wang ZW. A survey of the gramineous plant endophytes in Huangshan Geopark. Journal of Nanjing Agricultural University, 2011, 34(1): 147-150.
(in Chinese) 纪燕玲, 孙相辉, 王志伟. 禾本科植物内生真菌研究11:黄山景区禾本科植物内生真菌的检测与分布. 南京农业大学学报, 2011, 34(1): 147-150. |
| [42] | Zak DR, Holmes WE, White DC, Peacock AD, Tilman D. Plant diversity, soil microbial communities, and ecosystem function: are there any links?. Ecology, 2003, 84(8): 2042-2050. DOI:10.1890/02-0433 |
| [43] | Waldrop MP, Zak DR, Blackwood CB, Curtis CD, Tilman D. Resource availability controls fungal diversity across a plant diversity gradient. Ecology Letters, 2006, 9(10): 1127-1135. DOI:10.1111/j.1461-0248.2006.00965.x |
| [44] | Yang J, Jiang HC, Sun XX, Chen JS, Xie ZL, Dong HL. Minerals play key roles in driving prokaryotic and fungal communities in the surface sediments of the Qinghai-Tibetan lakes. FEMS Microbiology Ecology, 2020, 96(4): fiaa035. DOI:10.1093/femsec/fiaa035 |
| [45] | Dong HL. Mineral-microbe interactions: a review. Frontiers of Earth Science in China, 2010, 4(2): 127-147. DOI:10.1007/s11707-010-0022-8 |
| [46] | Ding GC, Pronk GJ, Babin D, Heuer H, Heister K, Kögel-Knabner I, Smalla K. Mineral composition and charcoal determine the bacterial community structure in artificial soils. FEMS Microbiology Ecology, 2013, 86(1): 15-25. DOI:10.1111/1574-6941.12070 |
| [47] | Mitchell AC, Lafrenière MJ, Skidmore ML, Boyd ES. Influence of bedrock mineral composition on microbial diversity in a subglacial environment. Geology, 2013, 41(8): 855-858. DOI:10.1130/G34194.1 |
| [48] | Assouline S, Russo D, Silber A, Or D. Balancing water scarcity and quality for sustainable irrigated agriculture. Water Resources Research, 2015, 51(5): 3419-3436. DOI:10.1002/2015WR017071 |
| [49] | Vanegas J, Muñoz-García A, Pérez-Parra KA, Figueroa-Galvis I, Mestanza O, Polanía J. Effect of salinity on fungal diversity in the rhizosphere of the halophyte Avicennia germinans from a semi-arid mangrove. Fungal Ecology, 2019, 42: 100855. DOI:10.1016/j.funeco.2019.07.009 |
| [50] | Liu JJ, Sui YY, Yu ZH, Shi Y, Chu HY, Jin J, Liu XB, Wang GH. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China. Soil Biology and Biochemistry, 2015, 83: 29-39. DOI:10.1016/j.soilbio.2015.01.009 |
 2021, Vol. 61
2021, Vol. 61




