中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 赵婷, 陆现彩, 殷哲, 崔向杰, 刘欢, 李玉妹, 冯抗抗, 李娟, 张冬梅. 2021
- Ting Zhao, Xiancai Lu, Zhe Yin, Xiangjie Cui, Huan Liu, Yumei Li, Kangkang Feng, Juan Li, Dongmei Zhang. 2021
- 河南卢氏和江西宜春两处锂矿山地表微生物群落分布特征差异及成因分析
- Differences and causes of the terrestrial surface distribution of microbial communities in two lithium mines located in Lushi, Henan and Yichun, Jiangxi
- 微生物学报, 61(6): 1650-1665
- Acta Microbiologica Sinica, 61(6): 1650-1665
-
文章历史
- 收稿日期:2021-04-12
- 修回日期:2021-05-09
- 网络出版日期:2021-05-13
2. 表生地球化学教育部重点实验室, 南京大学地球科学与工程学院, 江苏 南京 210023;
3. 介观化学教育部重点实验室, 江苏省先进有机材料重点实验室, 南京大学化学化工学院, 江苏 南京 210023
2. Key Laboratory of Surficial Geochemistry, MOE, School of Earth Sciences and Engineering, Nanjing University, Nanjing 210023, Jiangsu Province, China;
3. Key Laboratory of Mesoscopic Chemistry, MOE, Key Laboratory of Advanced Organic Materials of Jiangsu Province, School of Chemistry and Chemical Engineering, Nanjing University, Nanjing 210023, Jiangsu Province, China
微生物对地表元素的赋存状态、迁移和富集过程的调控作用不可忽视[1],因此探究微生物多样性及其功能对认识地表矿化和环境演变具有重要意义。微生物生长可从矿物、环境有机质或流体中获取能量,同时也会改变环境中矿物的稳定性和元素的活动性,微生物还能通过吸附、吸收作用选择性富集某种或多种元素而聚集成矿[2];因此地质微生物研究成为地球科学的重要前沿领域之一[3]。矿物和岩石的风化作用是影响土壤形成、地表矿化和生态环境质量的重要过程。出露地表的矿石或岩石在风化过程中会释放出一种或多种元素,锂元素是近年来备受关注的经风化作用释放的重要元素之一,其示踪地表风化的功能不可替代,并作为低碳能源金属而极具研究价值[4-6]。含锂矿物的地表风化研究已多有开展[6-7],发现微生物能显著改变锂矿物风化的动力学、锂的释出速率和同位素组成[8-9],但对与锂矿物风化有关的微生物类型仍缺乏足够的认识,制约了锂矿物微生物风化机制的进一步研究。
微生物对锂矿物的分解作用已有报道[10-11],其机制涉及细胞吸附和代谢产物分泌等[12-13]。Rezza等从含锂辉石、斜长石、钠长石等的矿石中分离出黑曲霉(Aspergillus niger)、紫色曲霉(Penicillium purpurogenum)、深红酵母(Rhodotorula rubra),3种微生物分别通过菌丝渗透矿物表层、代谢产物柠檬酸分泌、增强细胞代谢活性等促进锂辉石的生物浸出[12-13]。目前对锂矿石的微生物浸出作用仅限于上述报道,尚未见锂矿石微生物群落多样性研究及其锂浸出机制的研究。利用16S rRNA高通量测序技术可以快速、准确地获得环境样本中微生物群落组成的结构信息,经生物信息学分析发现不同环境的微生物群落多样性、进化的规律,旨在揭示微生物群落及功能微生物在生物浸矿中的作用和机制[14]。
伟晶岩型和花岗岩型锂矿是两类最常见的锂矿床类型,也是我国勘探储量最大的两类矿床。河南南阳山位于河南省卢氏县官坡镇,是东秦岭地区具有代表性的伟晶岩型稀有金属矿床,锂矿石中以锂辉石、锂云母和锂电气石为主要含锂矿物[15],脉石矿物包括石英、白云母、钾长石和钠长石等。江西宜春花岗岩型锂矿具有储量大、分布广的特点[16],根据主岩类型分为风化壳型、钠化花岗岩型和细晶岩脉型3种[17],其中锂云母、铁锂云母为主要锂载体矿物,石英、钠长石、白云母和少量钾长石为主要造岩矿物[18];目前对南阳山伟晶岩型锂矿和江西花岗岩型锂矿的研究仅停留在矿石资源分布、矿床类型及矿石组成阶段,未见矿区微生物群落分布及多样性、基因功能预测等方面的相关报道。本文选择河南省卢氏县南阳山伟晶岩型锂多金属矿床和江西宜春花岗岩型锂钽矿床为研究对象,分别采取地表弱风化矿石和强风化产物样本,基于16S rRNA高通量测序技术[19],研究矿石表面和风化产物中微生物群落组成及其多样性特征,揭示不同地区锂矿石出露区细菌群落结构及其功能构成,为进一步研究微生物在矿石形成过程中的作用提供有力证据。
1 材料和方法 1.1 样本采集本次研究分别采集了河南南阳山含锂辉石粗晶的伟晶岩矿石(NK-1)及其风化产物(NK-1F)、江西宜春钠化花岗岩型矿石(YK-1、YK-2、YK-3)及其风化产物(YK-1F、YK-2F)共7件样本。
NK-1和NK-1F于2019年10月5日在河南省卢氏县官坡镇南阳山采集(GPS定位信息:33°52′23.55″ N,110°42′49.12″ E;33°51′59.03″ N,110°44′17.31″ E);YK-1、YK-2、YK-3、YK-1F、YK-2F于2020年9月5日在江西省宜春市宜丰县杨柳窝(GPS定位信息:28°36′38″ N,114°57′48″ E)、花桥乡(GPS定位信息:28°60′56.28″ N,114°99′16.54″ E)采集。风化产物样本采集地点随机选择3个样方(样方间距约0.5 m),按照“五点混合法”和“抖落法”进行采集。采集到的全部样本迅速带回实验室4 ℃保存(图 1)。

|
| 图 1 锂矿石和风化产物照片 Figure 1 Photos of the Li ores and corresponding weathering products. A: NK-1; B: NK-1F; C: YK-1; D: YK-1F; E: YK-2; F: YK-2F; G: YK-3. |
1.2 样本矿物成分构成分析
将研磨至200目以下的样本粉末装入槽压片,用DMAX多功能衍射仪(RAPID Ⅱ,日本)进行X射线衍射分析。工作电压与电流分别为50 kV和40 mA,仪器测试为Cu Kα辐射靶,2θ角的测试范围为5°-70°,测试步长为0.02 °/s,测试时长为30 min,使用JADE 9.5.1进行矿物物相分析。
1.3 测序样本预处理用经灭菌处理的刷子和50 mL纯水在超净台刷取矿石样本表面,其中YK-3样本主要刷取黑色锰质薄膜部分的表面,刷洗液作为矿石样本。风化样本各称取10 g,加入90 mL无菌水,置于30 ℃、120 r/min振摇24 h,混悬液经真空抽滤(双层0.22 μm滤膜)去除滤液后置于一次性送样袋,平均分成3等份,4 ℃备用。
1.4 DNA提取和16S rRNA扩增和测序样本基因组DNA提取、16S rRNA基因扩增和测序由北京诺禾致源科技股份有限公司完成。CTAB (溴代十六烷基三甲胺)法提取样本基因组DNA,主要步骤如下:1.5 g样本经液氮研磨成粉末,加入800 μL CTAB提取缓冲液混悬,12000 r/min离心15 min获得上清液,加入氯仿、酚各400 μL重悬变性蛋白质,重复上述步骤2-3次。在上清中加入2倍体积的95%乙醇,-20 ℃沉淀1 h,12000 r/min离心10 min弃去上清液,70%乙醇洗涤沉淀2次,室温干燥5-15 min,沉淀溶于30-50 μL DEPC去离子水中,琼脂糖凝胶电泳检测抽提的DNA纯度及浓度。
以1 ng/μL提取DNA为模板,细菌扩增引物为515F-806R,区域为16SV4,含酶缓冲液为Phusion High-Fidelity PCR Master Mix with GC Buffer (New England Biolabs);PCR反应程序为98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min;PCR产物经2%琼脂糖凝胶电泳,试剂盒(MinElute Gel Extraction Kit br) (QIAGEN)回收目的条带;TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库,构建好的文库经过Qubit和Q-PCR定量,待文库合格后,使用NovaSeq6000进行上机测序。
1.5 测序数据处理依据Barcode序列、PCR扩增引物序列,拆分得到各样本数据,同时截去Barcode及引物序列;经FLASH (V1.2.7)对Reads进行拼接得到原始Tags数据(raw tags)[20];Raw Tags经过滤处理得到高质量的分析Tags数据(clean tags),Tags质量控制流程参照Qiime (V1.9.1)。Clean Tags数据与物种注释数据库进行比对检测嵌合体序列,并最终去除其序列,得到最终有效数据(effective tags)[21]。
1.6 OTU聚类和物种注释Uparse软件(Uparse v7.0.1001)对Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs (operational taxonomic units),OTUs中出现频数最高的序列作为OTUs的代表序列[22]。Mothur方法结合SILVA138的SSU rRNA数据库对OTUs序列进行物种注释分析(设定阈值为0.8-1.0),分别在门和属水平统计各样本群落组成以及测序深度检测;最后对各样本的数据进行均一化处理,以样本中数据量最少的为标准进行均一化处理[23]。
1.7 生物信息学分析生物信息学分析包括矿区样本序列数据分析、OTUs分布韦恩图、Alpha多样性分析、微生物群落组成分析、微生物群落空间分布、样本物种丰度聚类热图及细菌功能预测分析。
2 结果和分析 2.1 样本矿物成分构成XRD矿物组分分析发现,NK-1F含有石英(quartz)、伊利石(illite)、绿泥石(chlorite)和锂辉石(spodumene);除了石英,YK-1、YK-1F、YK-2、YK-2F还含有钠长石(albite)、锂云母(lepidolite)和白云母(muscovite),YK-2F中还含有一定量的蒙脱石(montmorillonite) (图 2)。NK-1、YK-3样本XRD矿物组分分析不能真实反映矿石表面成分信息,因此肉眼观察(图 1),NK-1可见紫色锂电气石、灰白色长石、浅灰色石英和浅绿色锂辉石粗晶以及浅紫色锂云母细晶、少量锂电气石柱状晶体;YK-3矿石表面见有树枝状锰矿物微晶集合体“假化石”。整体来说NK-1矿石较新鲜,风化作用极弱,其风化产物(NK-1F)风化类型较少;YK-1、YK-2已发生弱风化作用,YK-1的风化更为显著,钠长石的泥化现象明显;YK-1、YK-2对应的风化产物(YK-1F)和(YK-2F)均为强烈的风化产物,呈土状。

|
| 图 2 矿石和风化产物的XRD图谱 Figure 2 XRD patterns of ores and weathered products. A: NK-1F; B: YK-1; C: YK-1F; D: YK-2; E: YK-2F. |
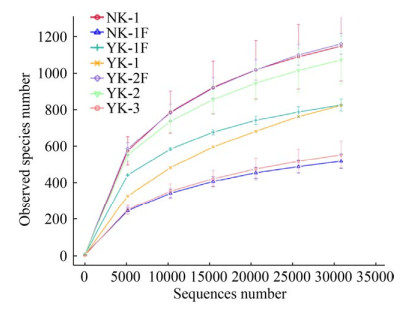
2.2 矿区微生物多样性 2.2.1 序列数据分析: 稀释曲线表明本次实验测序量合理,测序质量良好,具有一定的深度、代表性(图 3)。
|
| 图 3 矿石和风化产物的稀释曲线图 Figure 3 Dilution curve of ores and weathered product samples. |
所有样本经聚类分析共得到5908个OTUs,有效序列条数分布在48577-64420,其中YK-3、YK-1和YK-2F样本的有效序列数明显高于其他样本(表 1)。平均序列长度分别为414、427、409、412、408、411、406 bp,与16S rRNA V4区序列长度大致吻合。两矿区矿石及其对应的风化产物样本OTUs数量之间存在差异变化,NK-1的OTU数目高于NK-1F约2倍,YK-1的OTU数目略大于YK-1F,YK-2的OTU数目比YK-2F多143,YK-3富锰样本的OTU数目较低,仅为604。由此可知,3个矿石样本的OTU数目均高于所对应风化产物。同时,南阳山伟晶岩矿石(NK-1)的OTU数目高于宜春的钠化花岗岩矿石(YK-1、YK-3),略低于YK-2;两矿区风化产物样本中,宜春矿石风化产物(YK-1F、YK-2F)的OTU数目均高于南阳山风化产物(NK-1F)。
| Sample | Number of filtered tags | Average sequence length/bp | Proportion of effective sequences/% | Number of OTUs |
| NK-1 | 49961 | 414 | 58.9 | 1010 |
| NK-1F | 49265 | 427 | 60.5 | 540 |
| YK-1 | 56495 | 409 | 66.7 | 835 |
| YK-1F | 48577 | 412 | 55.9 | 828 |
| YK-2 | 51512 | 408 | 62.8 | 1117 |
| YK-2F | 55776 | 411 | 64.76 | 974 |
| YK-3 | 64420 | 406 | 77.54 | 604 |
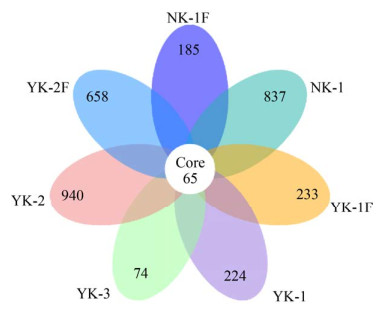
2.2.2 OTUs分布韦恩图: 分析不同样本OTUs组成的相互关系,构建韦恩图(图 4)。7个样本中共有OTUs数量为65个,分别占NK-1、NK-1F、YK-1、YK-1F、YK-2、YK-2F、YK-3各自OTUs数量的7.2%、26.0%、22.4%、21.8%、6.4%、8.9%、4.6%。
|
| 图 4 不同样本OTUs分布Venn图 Figure 4 Venn diagram of OTUs distribution of different samples. |
2.2.3 Alpha多样性分析: Alpha多样性用来分析样本内微生物群落的多样性,多样性指数是反映丰富度和均匀度的综合指标[24]。Shannon指数是用来估算样本中微生物多样性的指数之一,Shannon指数越大,说明群落多样性越高,Coverage指数是各样本文库的覆盖率,数值越高,表明样本中没有被测出的概率越低。如表 2所示,7个样本的Coverage值均在98.5%以上,反映所测结果与样本中真实菌群高度一致,统计学上具有较高的可信度[25]。相对其他样本,YK-2、YK-2F的Shannon指数较大;江西矿区矿石风化产物(YK-1F、YK-2F) Shannon指数大于南阳山矿石风化产物(NK-1F);NK-1的Shannon指数大于YK-1、YK-3。
| Samples | Number of species | Shannon index | Simpson index | Chao1 index | ACE index | Coverage index |
| NK-1F | 536 | 5.08 | 0.94 | 676 | 731 | 0.994 |
| NK-1 | 1028 | 5.83 | 0.89 | 1487 | 1219 | 0.990 |
| YK-1F | 803 | 6.48 | 0.97 | 963 | 998 | 0.993 |
| YK-1 | 823 | 3.13 | 0.54 | 1148 | 1307 | 0.988 |
| YK-2F | 1123 | 6.87 | 0.97 | 1156 | 1454 | 0.986 |
| YK-2 | 1139 | 7.04 | 0.98 | 1447 | 1507 | 0.992 |
| YK-3 | 506 | 3.50 | 0.68 | 611 | 662 | 0.994 |
2.3 微生物群落组成
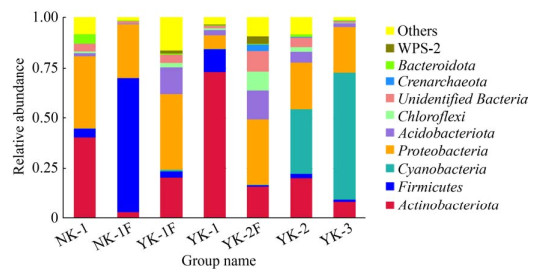
根据物种注释结果,门分类水平总丰度排名前10物种的相对丰度在样本NK-1、NK-1F、YK-1、YK-1F、YK-2、YK-2F、YK-3中占所有菌门的比例依次为91.9%、98.7%、96.5%、83.9%、91.8%、91.0%和98.8% (图 5)。NK-1包括8个细菌门,其中优势菌门(相对丰度 > 1%)为放线菌门(Actinobacteria,40.7%)、变形菌门(Proteobacteria,35.8%)、拟杆菌门(Bacteroidota,4.8%)、厚壁菌门(Firmicutes,4.3%)和酸杆菌门(Acidobacteriota,1.5%);NK-1F包括7个细菌门,优势菌门为厚壁菌门(Firmicutes,66.7%)、变形菌门(Proteobacteria,27%)、放线菌门(Actinobacteria,3.2%)。宜春钠化花岗岩型锂矿石YK-1包括9个细菌门,优势菌门为放线菌门(Actinobacteria,73.2%)、厚壁菌门(Firmicutes,11.3%)、变形菌门(Proteobacteria,6.6%)、酸杆菌门(Acidobacteriota,2.7%);YK-1F包括9个细菌门,优势菌门为变形菌门(Proteobacteria,37.6%)、放线菌门(Actinobacteria,20.5%)、酸杆菌门(Acidobacteriota,13.4%)、厚壁菌门(Firmicutes,3.0%)、绿弯菌门(Chloroflexi,2.3%)、WPS-2门(1.5%);YK-2包括10个细菌门,优势菌门为蓝菌门(Cyanobacteria,32.1%)、变形菌门(Proteobacteria,23.3%)、放线菌门(Actinobacteria,20.3%)、酸杆菌门(Acidobacteriota,5.4%)等;YK-2F包括10个细菌门,优势菌门为放线菌门(Actinobacteria,16.1%)、变形菌门(Proteobacteria,32.5%)、酸杆菌门(Acidobacteriota,14.3%)、绿弯菌门(Chloroflexi,9.6%)、泉古菌门(Crenarchaeota,3.2%);YK-3相对丰度最高的优势菌门为蓝菌门(Cyanobacteria,63.3%)、变形菌门(Proteobacteria,22.4%)。统计学分析显示,各样品微生物群落组成在门水平上具有显著差异(P < 0.05),其中NK-1F与YK-1F在酸杆菌门、厚壁菌门、放线菌门存在极其显著差异(P < 0.001);同时NK-1F与YK-2F、YK-2与YK-2F在厚壁菌门存在极其显著差异(P < 0.001)。
|
| 图 5 群落结构的优势菌门组成 Figure 5 Composition of dominant phyla community. |
2.4 微生物群落空间分布
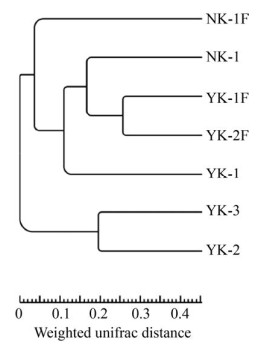
微生物聚类树状图显示,南阳山伟晶岩型锂矿NK-1和江西宜春花岗岩型锂矿YK-1、YK-2、YK-3微生物群落组成差异较大;同一地点风化物之间如YK-1F和YK-2F、同一地点矿石之间如YK-2和YK-3聚类较近,微生物的群结构相似。值得注意的是,矿石及其风化物之间,如YK-2与YK-2F、NK-1与NK-1F,微生物群落出现较大差异(图 6)。
|
| 图 6 UPGMA聚类树状图 Figure 6 UPGMA clustering dendrogram. |
2.5 锂矿物种丰度聚类热图
选取各样本丰度排名较高的35个属构建聚类关系树热图(图 7)。NK-1的优势属(相对丰度 > 1%)为芽孢杆菌属(Bacillus,1.1%)、鞘氨醇单胞菌属(Sphingomonas,8.7%)、马赛菌属(Massilia,9.0%)、芽球菌属(Blastococcus,2.5%)、Rubellimicrobium属(1.8%)、Ellin6055属(1.4%)、微枝形杆菌属(Microvirga,2.4%)、Roseisolibacte属(1.3%)、土生芽孢杆菌属(Tumebacillus,1.7%)、膜杆菌属(Hymenobacter,3.0%);NK-1F优势属为马赛菌属(Massilia,21.3%)、类芽孢杆菌属(Paenibacillus,25.3%)、杆状细菌属(Bacillus,40.2%)、鞘氨醇单胞菌属(Sphingomonas,1.2%);YK-1优势属为大芬戈尔德菌属(Finegoldia,4.3%);YK-1F优势属为马赛菌属(Massilia,4.0%)、1174-901-12属(1.7%)、鞘氨醇单胞菌属(Sphingomonas,1.7%)、芽球菌属(Blastococcus,8.4%)、念珠菌固体杆菌属(Candidatus-Solibacter,7.2%)、Noviherbaspirillum属(6.1%)、布氏菌属(Bryocella,1.5%)、不确定丛毛单胞菌属(unidentified-Comamonadaceae,1.1%)、克雷白氏杆菌属(Klebsiella,2.1%)、慢生根瘤菌属(Bradyrhizobium,1.1%)、嗜酸菌属(Acidiphilium,2.3%)、伯克霍尔德氏菌属(Burkholderia-Caballeronia-Paraburkholderia,11.49%)、单胞菌属(Sinomonas,4.4%);YK-2优势属为布氏菌属(Bryocella,2.0%)、1174-901-12属(4.6%)、鞘氨醇单胞菌属(Sphingomonas,1.4%)、甲基杆菌属(Methylobacterium,4.6%)、嗜酸菌属(Acidiphilium,1.4%)、棒状杆菌属(Corynebacterium,1.5%)、链球菌属(Streptococcus,1.0%)、罗氏菌属(Rothia,1.2%)、青枯菌属(Ralstonia,1.3%)、Jatrophihabitans属(3.5%)、unidentified-Chloroplast属(19.1%);YK-2F的优势属为马赛菌属(Massilia,11.3%)、伯克霍尔德氏菌属(Burkholderia-Caballeronia-Paraburkholderia,3.1%)、芽球菌属(Blastococcus,1.3%)、北里孢菌属(Kitasatospora,5.7%)、鞘氨醇单胞菌属(Sphingomonas,1.1%)、白念球菌属(Candidatus-Nitrosopumilus,3.0%)、念珠菌固体杆菌属(Candidatus-Solibacter,1.4%)、Noviherbaspirillum属(1.4%)、青枯菌属(Ralstonia,3.6%)、慢生根瘤菌属(Bradyrhizobium,2.1%)、单胞菌属(Sinomonas,1.23%)、不确定丛毛单胞菌属(unidentified-Comamonadaceae,2.9%)、布氏菌属(Bryocella,4.0%);YK-3的优势属为甲基杆菌属(Methylobacterium,5.2%)、1174-901-12属(12.6%)、布氏杆菌属(Bryobacter,1.17%)。统计学分析显示,各样品微生物群落组成在属水平上具有显著差异(P < 0.05),其中NK-1F与YK-1F在单胞菌属、慢生根瘤菌属、念珠菌固体杆菌属、嗜酸菌属存在极其显著差异(P < 0.001);同时NK-1与YK-2在1174-901-12属、NK-1与YK-3在嗜酸菌属、甲基杆菌属存在极其显著差异(P < 0.001)。
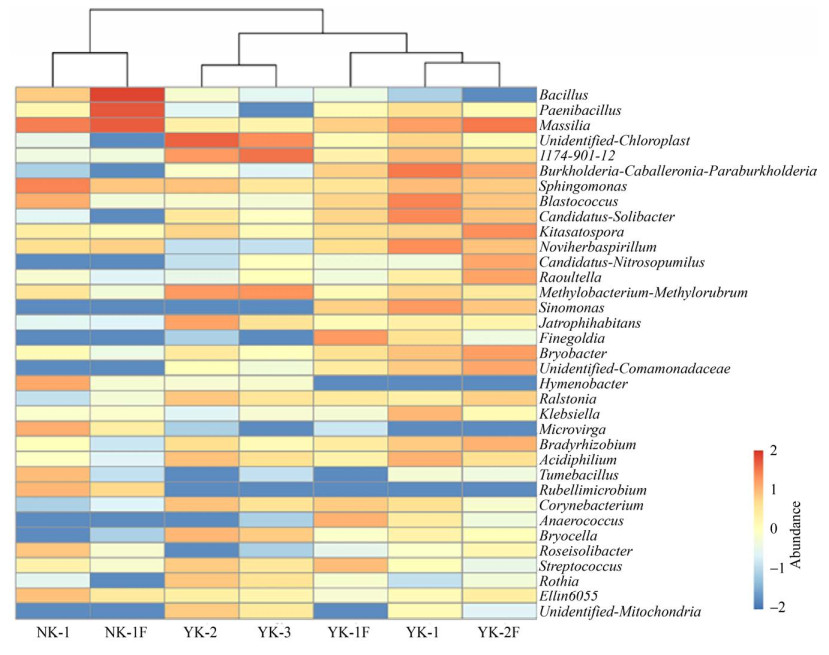
|
| 图 7 属分类水平上样本物种丰富度聚类分析 Figure 7 Cluster analysis of sample species richness at the genus taxonomic level. |
微生物群落组成聚类如图 7所示,南阳山矿石及其风化产物聚为一类,江西锂矿及其风化产物聚为一类。同一地点不同矿石YK-2、YK-3微生物群落组成相似,YK-1F居于样本YK-1与YK-2F之间,群落组成更趋近于YK-2F。
2.6 细菌功能预测分析经PICRUSt功能预测和KEGG分析,选择每个样品中最丰富的5个共11个子功能注释制作热图(图 8),11个子功能分别对应光能自养、芳香化合物降解、光合营养、木质素分解、好氧氨氧化、尿素分解、化能异养、有氧化能异氧、硝酸盐还原、发酵、动物寄生虫或共生体。结果表明,化能异养过程、有氧化能异养、尿素分解作用、发酵作用、硝酸盐还原作用在7个样品中占主导地位,不同地理位置和矿石样品的功能注释类似,均涉及代谢、遗传信息处理、环境信息处理等代谢通路。值得关注的是,不同样品间子功能丰度有明显差异,例如,化能异养作用存在于每个样本中,但样本间子功能各有特征,例如NK-1、YK-1F、YK-2F具有尿素分解作用,YK-2和YK-3具有光能自养,样品YK-2F具有好氧氨氧化、木质素分解过程。同时,YK-2和YK-3、YK-1和YK-1F、YK-1F和YK-2F功能聚类相似程度高。
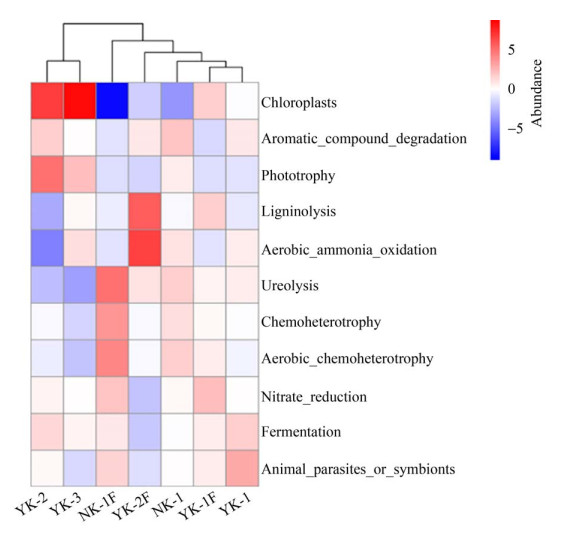
|
| 图 8 不同锂矿山微生物功能预测 Figure 8 Microbial function prediction of different lithium mines. |
3 讨论
本文基于16S rRNA高通量测序技术分析对比了两个锂矿区矿石及风化产物的微生物群落结构特征,发现不同矿石表面、矿石与其对应风化物的OTU数目、群落组成和多样性存在差异,不同样品还表现出群落生物学功能的丰富性。
3.1 锂矿物组成与微生物多样性两锂矿矿石及其风化产物的细菌群落结构特点表明样本的矿物组成与微生物多样性密切相关。对比两个矿区矿石及风化产物的OTU数目和菌群多样性特征,可以发现以下几个特点:(1) 不同矿石表面的微生物种类存在明显差异。新鲜的钠化花岗岩型矿石YK-2和伟晶岩型矿石NK-1表面的细菌多样性最显著,与其风化弱、矿物种类多有关,YK-3表面细菌多样性低与采样处主要为锰矿物有关。(2) 矿石表面OTU数目大于其对应风化产物OTU数目。新鲜矿石表面的OTU数目比风化产物的更多,这和新鲜矿石的矿物种类多、颗粒间差异大有关,如NK-1矿石较新鲜,风化作用极弱,可见紫色锂电气石、灰白色长石、浅灰色石英和浅绿色锂辉石粗晶以及浅紫色锂云母细晶、少量锂电气石柱状晶体,YK-1、YK-2均为灰白色含锂钠长石化花岗岩,肉眼可见石英、钠长石、白云母和锂云母;矿石风化产物的组成多以黏土矿物、石英、长石为主,即使存在原生锂矿物,如NK-1F肉眼可见云母、石英砂粒和风化残留的紫色粉状锂辉石,这些矿物表面也往往覆盖有多种风化成因矿物,导致矿物组成趋同,从而使微生物种类不高于新鲜矿石。(3) 同一种矿石风化形成的不同产物中细菌多样性可能存在较大的差异,可能与后期过程的影响有关,本研究取得的YK-1F和YK-2F处于不同的风化状态,YK-2F表面的植物生长强于YK-1F,可能导致了更高的微生物多样性。
3.2 矿区微生物群落组成特征分析两锂矿矿石及其风化产物群落空间分布表明采样位置差异对矿区微生物群落组成有一定的影响,两矿山既有几类共同的优势微生物,同时也存在差异。在门水平上,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝菌门(Cyanobacteria)、厚壁菌门(Firmicutes)在两地矿石及其风化产物中均为优势群类。但在属水平上,各样品优势属中相对丰度大于5%的属有所不同,南阳山伟晶岩型锂矿石NK-1表面为鞘氨醇单胞菌属(Sphingomonas)、马赛菌属(Massilia),风化物NK-1F为类芽孢杆菌属(Paenibacillus)、杆状细菌属(Bacillus)和马赛菌属(Massilia);宜春钠化花岗岩型锂矿石YK-2F为北里孢菌属(Kitasatospora)、马赛菌属(Massilia),YK-1F为芽球菌属(Blastococcus)、念珠菌固体杆菌属(Candidatus-Solibacter)、Noviherbaspirillum属、伯克霍尔德氏菌属(Burkholderia-Caballeronia-Paraburkholderia),YK-2为unidentified-Chloroplast属,YK-3为1174-901-12属、甲基杆菌属(Methylobacterium),另外YK-1相对丰度大于5%的优势属不明显。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝菌门(Cyanobacteria)、厚壁菌门(Firmicutes)可耐受较高重金属水平,并适应相对酸性的环境[26-27]。变形菌门(Proteobacteria)的生长速率与土壤养分呈正相关性[28],或为厌氧异养型或能进行光合作用[29];具有多种氮代谢能力,既能在厌氧条件下或在富硝酸盐环境中进行反硝化脱氮[30],又能在氮匮乏环境中呈现固氮能力,因此能适应水体、底泥、土壤等环境,并耐受高碱高盐环境[31]。放线菌门(Actinobacteria)能产生并分泌次级代谢产物影响其他微生物的碳循环[32]。蓝菌门(Cyanobacteria)经固氮作用、产氧光合作用和细胞间通讯等方式抵抗不良环境[33]。厚壁菌门(Firmicutes)能产生孢子抵抗适应各种环境[34]。鞘氨醇单胞菌属(Sphingomonas)有特殊的细胞膜成分鞘糖脂,可耐受贫养而获得极强的生命力,同时其能够降解高分子有机污染物,在环境污染治理与生物技术领域具有广阔的应用前景[35]。在这些样本中还存在几种特殊菌门,例如,宜春钠化花岗岩型矿石表面特有的绿弯菌门(Chloroflexi)是一个确立较晚的深度分支的细菌类群,形态多样,广泛分布于普通环境和极端环境中[36],风化产物特有的泉古菌门(Crenarchaeota)是位于系统发育树根部最原始的古菌类群,主要为嗜热菌,被冠以生存于“极端环境”的特征[37],这2个菌门均是极端环境典型微生物,其代谢属性可能与锂元素的地球化学行为有关,值得深入探讨。
3.3 PICRUSt功能预测分析不同样品表现出群落生物学功能的丰富性,除“氨基酸转运与代谢”、“碳水化合物运输与代谢”和“翻译、核糖体结构与生物发生”等与代谢功能有关的功能基因丰度较高外,化能异养代谢是7个样品中微生物偏好的能量代谢方式。功能预测聚类和微生物物种丰度聚类比对揭示锂矿微生物群落同源性较为复杂,其进化可能具有地理位置特异性,如江西宜春矿石样本YK-2和YK-3、YK-1和YK-1F在功能与微生物群落结构方面均高度同源,而南阳山矿石与其风化物NK-1和NK-1F在物种丰富度上高度同源,而功能聚类显示同源性较低,这些差异化结果提示,多因素包括矿物化学组成、地理位置及菌落结构共同影响锂矿微生物的代谢功能。
4 结论基于两地不同锂矿石及其风化产物的微生物类群分析,发现矿物组成是影响群落结构的关键因素。伟晶岩型锂矿石和钠化花岗岩型锂矿石表面的细菌种类均比其风化产物更为丰富,与矿石的矿物组成复杂有关。确认变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝菌门(Cyanobacteria)、厚壁菌门(Firmicutes)是两矿区的特征优势菌门,经功能基因预测分析,优势菌门可能依赖有机物分解代谢、次级代谢产物分泌、光能自养等机制适应并影响地质生境,主要功能基因均为代谢功能相关,如次生产物代谢、能量代谢、氨基酸代谢等。同时,发现并关注到了绿弯菌门、泉古菌门等具有适应极端环境能力的非优势菌株,为认识和理解锂的地球化学行为与微生物群落结构变化之间的关系提供了新的线索。
| [1] |
Feng WN, Peng PH, Xie CS, Luo W. Microbial effects on elements migration in rock-soil-Paeonia szechuanica system. Bulletin of Soil and Water Conservation, 2020, 40(4): 67-74.
(in Chinese) 冯玮娜, 彭培好, 谢成晟, 罗雯. 岩石-土壤-四川牡丹元素迁移体系中的微生物效应. 水土保持通报, 2020, 40(4): 67-74. |
| [2] | Min MZ, Xu HF, Chen J, Fayek M. Evidence of uranium biomineralization in sandstone-hosted roll-front uranium deposits, northwestern China. Ore Geology Reviews, 2005, 26(3/4): 198-206. |
| [3] | Ranchou-Peyruse M, Auguet JC, Mazière C, Restrepo-Ortiz CX, Guignard M, Dequidt D, Chiquet P, Cézac P, Ranchou-Peyruse A. Geological gas-storage shapes deep life. Environmental Microbiology, 2019, 21(10): 3953-3964. DOI:10.1111/1462-2920.14745 |
| [4] | Weynell M, Wiechert U, Schuessler JA. Lithium isotopes and implications on chemical weathering in the catchment of Lake Donggi Cona, northeastern Tibetan Plateau. Geochimica et Cosmochimica Acta, 2017, 213: 155-177. DOI:10.1016/j.gca.2017.06.026 |
| [5] | Pogge von Strandmann PAE, Frings PJ, Murphy MJ. Lithium isotope behaviour during weathering in the Ganges Alluvial Plain. Geochimica et Cosmochimica Acta, 2017, 198: 17-31. DOI:10.1016/j.gca.2016.11.017 |
| [6] | Garcia MG, Borda LG, Godfrey LV, López Steinmetz RL, Losada-Calderon A. Characterization of lithium cycling in the Salar De Olaroz, Central Andes, using a geochemical and isotopic approach. Chemical Geology, 2020, 531: 119340. DOI:10.1016/j.chemgeo.2019.119340 |
| [7] | Zhang HL, Bloom PR, Nater EA, Susan Erich M. Rates and stoichiometry of hornblende dissolution over 115 days of laboratory weathering at pH 3.6-4.0 and 25℃ in 0.01 M lithium acetate. Geochimica et Cosmochimica Acta, 1996, 60(6): 941-950. DOI:10.1016/0016-7037(95)00447-5 |
| [8] | Tsuruta T. Removal and recovery of lithium using various microorganisms. Journal of Bioscience and Bioengineering, 2005, 100(5): 562-566. DOI:10.1263/jbb.100.562 |
| [9] | Sethurajan M, Gaydardzhiev S. Bioprocessing of spent lithium ion batteries for critical metals recovery-A review. Resources, Conservation and Recycling, 2021, 165: 105225. DOI:10.1016/j.resconrec.2020.105225 |
| [10] | Karavaĭko GI, Krutsko VS, Mel'nikova EO, Avakian ZA, Ostroushko IuI. Rol' mikroorganizmov v razrushenii spodumena[Role of microorganisms in the destruction of spodumene]. Mikrobiologiia, 1980, 49(3): 547-551. |
| [11] | Karavaĭko GI, Avakian ZA, Krutsko VS, Mel'nikova EO, Zhdanov AV. Mikrobiologicheskie issledovaniia na spodumenovom mestorozhdenii[Microbiologic studies of a spodumene deposit]. Mikrobiologiia, 1979, 48(3): 502-508. |
| [12] | Rezza I, Salinas E, Calvente V, Benuzzi D, Tosetti MISD. Extraction of lithium from spodumene by bioleaching. Letters in Applied Microbiology, 1997, 25(3): 172-176. DOI:10.1046/j.1472-765X.1997.00199.x |
| [13] | Rezza I, Salinas E, Elorza M, Sanz de Tosetti M, Donati E. Mechanisms involved in bioleaching of an aluminosilicate by heterotrophic microorganisms. Process Biochemistry, 2001, 36(6): 495-500. DOI:10.1016/S0032-9592(00)00164-3 |
| [14] | Lundberg DS, Yourstone S, Mieczkowski P, Jones CD, Dangl JL. Practical innovations for high-throughput amplicon sequencing. Nature Methods, 2013, 10(10): 999-1002. DOI:10.1038/nmeth.2634 |
| [15] |
Zhou QF, Qin KZ, Tang DM, Wang CL, Ma LS. Mineralogical characteristics and significance of beryl from the rare-element pegmatites in the Lushi County, East Qinling, China. Acta Petrologica Sinica, 2019, 35(7): 1999-2012.
(in Chinese) 周起凤, 秦克章, 唐冬梅, 王春龙, 马留锁. 东秦岭卢氏稀有金属伟晶岩的绿柱石矿物学特征及其指示意义. 岩石学报, 2019, 35(7): 1999-2012. |
| [16] |
Liu S, Wang SL, Xing XL, Wang LF, Zhang Y. Distribution, types and prospecting potential of lithium deposits in Jiangxi Province. Resources Environment & Engineering, 2019, 33(2): 195-198, 207.
(in Chinese) 刘爽, 王水龙, 邢新龙, 汪龙飞, 张也. 江西省锂矿资源分布、矿床类型及找矿前景. 资源环境与工程, 2019, 33(2): 195-198, 207. |
| [17] |
Zhang GW, Dong YP, Yao AP. The crustal compositions, structures and tectonic evolution of the Qinling orogenic belt. Geology of Shaanxi, 1997, 15(2): 1-14.
(in Chinese) 张国伟, 董云鹏, 姚安平. 秦岭造山带基本组成与结构及其构造演化. 陕西地质, 1997, 15(2): 1-14. |
| [18] |
He MS, Huang X, Zou GS. Characteristics, utilization status and suggestions of lithium containing porcelain stone (soil) mineral resources in Jiangxi Province. China Non-Metallic Minerals Industry, 2014(6): 41-43.
(in Chinese) 贺明生, 黄迅, 邹赣生. 江西含锂瓷石(土)矿资源特征、开发利用现状及对策建议. 中国非金属矿工业导刊, 2014(6): 41-43. DOI:10.3969/j.issn.1007-9386.2014.06.014 |
| [19] | Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Lozupone CA, Turnbaugh PJ, Fierer N, Knight R. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(Suppl 1): 4516-4522. |
| [20] | Bokulich NA, Subramanian S, Faith JJ, Gevers D, Gordon JI, Knight R, Mills DA, Gregory Caporaso J. Quality-filtering vastly improves diversity estimates from illumina amplicon sequencing. Nature Methods, 2013, 10(1): 57-59. DOI:10.1038/nmeth.2276 |
| [21] | Wang Q, Garrity GM, Tiedje JM, Cole JR. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [22] | Edgar RC. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [23] | Kõljalg U, Nilsson RH, Abarenkov K, Tedersoo L, Taylor AFS, Bahram M, Bates ST, Bruns TD, Bengtsson-Palme J, Callaghan TM, Douglas B, Drenkhan T, Eberhardt U, Dueñas M, Grebenc T, Griffith GW, Hartmann M, Kirk PM, Kohout P, Larsson E, Lindahl BD, Lücking R, Martín MP, Matheny PB, Nguyen NH, Niskanen T, Oja J, Peay KG, Peintner U, Peterson M, Põldmaa K, Saag L, Saar I, Schüßler A, Scott JA, Senés C, Smith ME, Suija A, Taylor DL, Telleria MT, Weiss M, Larsson KH. Towards a unified paradigm for sequence-based identification of fungi. Molecular Ecology, 2013, 22(21): 5271-5277. DOI:10.1111/mec.12481 |
| [24] | Li B, Zhang XX, Guo F, Wu WM, Zhang T. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis. Water Research, 2013, 47(13): 4207-4216. DOI:10.1016/j.watres.2013.04.021 |
| [25] |
Zhang M, Liu YL, Wei QQ, Gou JL. Effects of short-term application of Moutai-flavor vinasse biochar on nitrogen availability and bacterial community structure diversity in yellow soil of Guizhou Province. Huan Jing Ke Xue, 2020, 41(10): 4690-4700.
(in Chinese) 张萌, 刘彦伶, 魏全全, 芶久兰. 酒糟生物炭短期施用对贵州黄壤氮素有效性及细菌群落结构多样性的影响. 环境科学, 2020, 41(10): 4690-4700. |
| [26] | Chao YQ, Liu WS, Chen YM, Chen WH, Zhao LH, Ding QB, Wang SZ, Tang YT, Zhang T, Qiu RL. Structure, variation, and Co-occurrence of soil microbial communities in abandoned sites of a rare earth elements mine. Environmental Science & Technology, 2016, 50(21): 11481-11490. |
| [27] | Liu JJ, Liu W, Zhang YB, Chen CJ, Wu WX, Zhang TC. Microbial communities in rare earth mining soil after in situ leaching mining. Science of the Total Environment, 2021, 755: 142521. DOI:10.1016/j.scitotenv.2020.142521 |
| [28] | Deng JJ, Bai XJ, Zhou YB, Zhu WX, Yin Y. Variations of soil microbial communities accompanied by different vegetation restoration in an open-cut iron mining area. Science of the Total Environment, 2020, 704: 135243. DOI:10.1016/j.scitotenv.2019.135243 |
| [29] |
Li JK, Li S, Wei YL, Lin LB, Zhang Q, Ji XL. A preliminary study on bacterial diversity from Wenshan bauxite area in Yunnan. Chinese Journal of Microecology, 2015, 27(11): 1258-1261, 1265.
(in Chinese) 李建凯, 李珊, 魏云林, 林连兵, 张琦, 季秀玲. 云南文山铝土矿区微生物多样性初步研究. 中国微生态学杂志, 2015, 27(11): 1258-1261, 1265. |
| [30] | Valášková V, de Boer W, Klein Gunnewiek PJA, Pospíšek M, Baldrian P. Phylogenetic composition and properties of bacteria coexisting with the fungus Hypholoma fasciculare in decaying wood. The ISME Journal, 2009, 3(10): 1218-1221. DOI:10.1038/ismej.2009.64 |
| [31] | 韩玉姣. 凡口铅锌尾矿酸性废水微生物宏基因组及宏转录组研究. 中山大学博士学位论文, 2013. |
| [32] | Jose PA, Maharshi A, Jha B. Actinobacteria in natural products research: Progress and prospects. Microbiological Research, 2021, 246: 126708. DOI:10.1016/j.micres.2021.126708 |
| [33] | Kieninger AK, Maldener I. Cell-cell communication through septal junctions in filamentous Cyanobacteria. Current Opinion in Microbiology, 2021, 61: 35-41. DOI:10.1016/j.mib.2021.02.002 |
| [34] | Govil T, Paste M, Samanta D, David A, Goh KM, Li XK, Salem DR, Sani RK. Metagenomics and culture dependent insights into the distribution of Firmicutes across two different sample types located in the black hills region of south Dakota, USA. Microorganisms, 2021, 9(1): 113. DOI:10.3390/microorganisms9010113 |
| [35] | Li QQ, Li JB, Jiang LF, Sun YT, Luo CL, Zhang G. Diversity and structure of phenanthrene degrading bacterial communities associated with fungal bioremediation in petroleum contaminated soil. Journal of Hazardous Materials, 2021, 403: 123895. DOI:10.1016/j.jhazmat.2020.123895 |
| [36] |
Xian WD, Zhang XT, Li WJ. Research status and prospect on bacterial Phylum Chloroflexi. Acta Microbiologica Sinica, 2020, 60(9): 1801-1820.
(in Chinese) 鲜文东, 张潇橦, 李文均. 绿弯菌的研究现状及展望. 微生物学报, 2020, 60(9): 1801-1820. |
| [37] | Lehtovirta LE, Prosser JI, Nicol GW. Soil pH regulates the abundance and diversity of Group 1.1c. Crenarchaeota. FEMS Microbiology Ecology, 2009, 70(3): 367-376. DOI:10.1111/j.1574-6941.2009.00748.x |
 2021, Vol. 61
2021, Vol. 61




