中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 卢园园, 陈龙照, 余倩怡, 程超, 程扬健. 2021
- Lu Yuanyuan, Chen Longzhao, Yu Qianyi, Cheng Chao, Cheng Yangjian. 2021
- 尖孢镰刀菌(Fusarium oxysporum)诱导矿化回收稀土离子La(Ⅲ)
- Fusarium oxysporum induces mineralization recovery rare earth ions Lanthanum (Ⅲ)
- 微生物学报, 61(6): 1621-1631
- Acta Microbiologica Sinica, 61(6): 1621-1631
-
文章历史
- 收稿日期:2021-02-18
- 修回日期:2021-03-30
- 网络出版日期:2021-04-02
2. 福州大学环境与资源学院, 福建 福州 350108;
3. 中国冶金地质总局第二地质勘查院, 福建 福州 350108
2. College of Environment and Resources, Fuzhou University, Fuzhou 350108, Fujian Province, China;
3. The Second Geological Exploration Institute of China Metallurgical Geology Bureau, Fuzhou 350108, Fujian Province, China
稀土元素因其独特的物理化学性质被广泛应用于冶金、高精尖材料、催化及医疗等领域[1-2]。随着稀土在现代社会中的应用越来越广泛,稀土开采、冶炼及应用过程中产生的稀土废水不可避免地进入到环境中[3]。稀土冶炼废水中稀土元素浓度通常在50–800 mg/L[4],尾矿中的稀土也可能在降雨及风化的作用下渗入周边的土壤及水体中[5],造成大量稀土资源的浪费和环境的污染。研究表明,稀土元素可随食物链在生物体内进行生物累积,有明显的毒物兴奋(Hormesis)效应[6-7],即低浓度的稀土可以促进生物的生长,高浓度的稀土元素则对动物、植物、微生物及人体都有毒害。稀土元素的回收可以减少处置的负面影响,改善环境的可持续性[8]。因此,急需开发绿色、经济的稀土回收技术。
传统的稀土富集和回收方法有化学沉淀、膜分离和离子交换等方法[9-11],这些方法有成本高、容易产生二次污染、流程复杂等缺点,导致应用受限;生物法相比传统方法具有无二次污染、能耗低、工艺简单等优点[12],在稀土富集及回收方面有着较大的发展前景。生物诱导矿化(BIM)[13]是指生物体通过改变胞外微环境,形成矿物相的胞外化学沉淀。其中微生物诱导碳酸盐沉淀(MICP)是一种以碳酸盐形式固定金属的先进生物处理技术[14],其优点在于MICP的主要生物矿化产物生物碳酸钙具有较强的吸附或与周围金属离子共沉淀的能力[15]。而脲酶是微生物具有诱导矿化能力的关键蛋白酶[16],可以催化尿素水解产生碳酸根、铵根和氢氧根离子,使环境中的pH升高,创造出的碱性环境更有利于微生物诱导碳酸钙的沉淀。目前,基于MICP对稀土元素回收的研究较少,且真菌比细菌生长过程中产生的生物量更多,对稀土元素的耐受性也更好,可以作为MICP回收稀土元素的潜在候选方法[17]。
红树林生长于陆地与海洋交界带的浅滩,这一陆地向海洋过度的特殊生态环境孕育了大量具有特色代谢产物的真菌类群[18]。基于此,本文从罗源湾红树林浅滩土壤中分离得到一株产脲酶且耐La(Ⅲ)真菌,通过诱导碳酸钙沉淀的方式来回收溶液中的La(Ⅲ),并对其吸附和诱导矿化机理进行探讨,以期为稀土离子La(Ⅲ)的资源回收提供菌种资源和应用技术指导。
1 材料和方法 1.1 真菌的分离和纯化2018年11月于福建省福州市罗源县罗源湾红树林浅滩采集土壤样本,装入无菌的样品管中,放入冷藏箱中,运输至实验室,于4 ℃冰箱保存备用。称取5 g土壤至45 mL无菌水中,在温度为37 ℃、转速为160 r/min的摇床内振荡30 min。采用梯度稀释法配制0、10–1–10–5稀释度的土壤悬浮液,各取0.1 mL于马铃薯葡萄糖琼脂培养基(PDA)[19]进行涂布,将平板倒置,放于37 ℃的恒温培养箱中进行培养。观察真菌的生长情况,挑取形貌、颜色不同的菌落再次进行接种培养,直至菌落形态单一。
1.2 产脲酶真菌筛选将纯化的真菌接种至尿素酶琼脂培养基(每升中:蛋白胨,1 g;氯化钠,5 g;磷酸二氢钾,2 g;酚红,0.012 g;尿素,20 g;葡萄糖,1 g;琼脂,15 g;pH为7.0±0.1),放置在37 ℃培养箱中培养3–5 d。脲酶水解尿素的产物在水解平衡时产生的铵离子和氢氧根离子会导致培养基的pH增加[20-21],使培养基中的指示剂颜色发生改变,产脲酶特性较好的真菌会使尿素酶琼脂培养基颜色由黄色变为红色。根据这一现象我们从分离的真菌中筛选出产脲酶效果好的菌株。
1.3 真菌的鉴定分离菌株物种鉴定是使用ITS rDNA作为Marker片段,通过引物扩增出基因中ITS序列,与NT数据库进行比对,获得相似序列的物种信息,借助同源比对的方法辅助判断物种信息。ITS引物序列ITS1:TCCGTAGGTGAACCTGCGG和ITS4:TCCTCCGCTTATTGATATGC,以菌株的基因组DNA为模板PCR扩增该菌株基因中的ITS序列。PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,循环25次;72 ℃ 10 min。电泳条件:1%琼脂糖凝胶,120 V电压电泳30 min。
将分离菌株的基因序列在https://blast.ncbi.nlm.nih.gov网站中与模式菌株的基因序列进行同源性比较,并使用MEGA 7.0软件构建系统发育树。
1.4 菌株对La(Ⅲ) 的耐受测定将菌株接种至PDA试管斜面培养基上,于37 ℃恒温培养箱中培养5 d后,加入经121 ℃下灭菌25 min的去离子水4 mL,制备为孢子悬液;取孢子悬液接种在La(Ⅲ)浓度分别为0、100、200、300、400、500、600、700、800 mg/L的PDA液体培养基中;在温度为37 ℃、转速为160 r/min的摇床内培养5 d,观察菌株在不同La(Ⅲ)浓度下的生长状况,以此判断菌株对La(Ⅲ)的耐受能力。
1.5 菌株对La(Ⅲ) 的回收效率将按1.4制得的孢子悬液接种在La(Ⅲ)浓度为200 mg/L、尿素浓度为2%、CaCl2浓度为40 mmol/L[22]的PDA液体培养基中,为MICP实验组;同时将孢子悬液分别接种在La(Ⅲ)浓度为0和200 mg/L的PDA液体培养基中,为空白对照组和非MICP实验组。在温度为37 ℃、转速为160 r/min的摇床内培养5 d。
菌株与La(Ⅲ)相互作用后的菌体混合液离心,收集上清液,用5%的硝酸稀释10倍,电感耦合等离子体发射光谱仪(ICP-OES)测定上清液中La(Ⅲ)的浓度,据此计算菌株与La(Ⅲ)相互作用效率。每组实验重复3次。
1.6 产脲酶菌株对La(Ⅲ) 吸附及矿化机理分析将菌株与La(Ⅲ)相互作用后的菌体混合液离心,收集沉淀物,菌体沉淀物用去离子水洗涤3次,于60 ℃下烘干48 h,用研钵充分研磨样品。用红外光谱仪(FT-IR)和X射线粉末衍射仪(XRD)对样品进行分析。
将反应后的菌体混合液离心,收集沉淀物,菌体沉淀物用去离子水洗涤3次,吸取10 μL滴于硅片上,于37 ℃真空干燥箱内干燥24 h。制得的样品喷铂(Pt)后进行扫描电镜(SEM)、能谱(EDS)和元素分布(Mapping)分析。
2 结果和分析 2.1 真菌分离 2.1.1 产脲酶真菌: 从罗源县罗源湾红树林浅滩土壤中筛选得到一株产脲酶活性高的真菌菌株,命名为FZU-07。在固体培养基上菌落颜色为肉粉色,中间有乳白色凸起,表面有白色菌丝生长,边缘不整齐,如图 1-A、B所示。菌株FZU-07分泌的脲酶可以分解培养基中的尿素,生成的NH4+使培养基的pH升高,培养基可由黄色变为红色,结果如图 1-C所示。
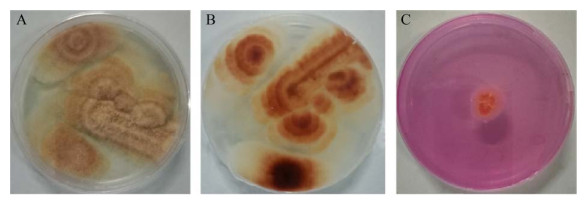
|
| 图 1 PDA平板上菌株FZU-07菌落形态 Figure 1 Morphology of strain FZU-07 on PDA Plate. A: pro; B: con; C: urease production characteristics. |
2.1.2 菌株的鉴定: 将菌株FZU-07的测序结果在NCBI数据库(近源物种NCBI登录号为KU671032.1)中与已测核酸序列进行BLAST相对性比对,结果表明菌株FZU-07与尖孢镰刀菌(Fusarium oxysporum)相似度最高,达到97%。此菌株已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:CGMCC NO.21085。用软件MEGA7.0采用邻接法(Neighbour-Joining)构建菌株的系统进化发育树,结果见图 2。

|
| 图 2 菌株FZU-07及相邻菌种构建的系统进化树 Figure 2 Phylogenetic tree of strain FZU-07 and its most closely related neighbors. |
2.2 菌株FZU-07的La(Ⅲ) 耐受能力测定
同种微生物在不同环境中,生长情况也会存在差异。La(Ⅲ)对微生物具有毒物兴奋(Hormesis)效应,低浓度La(Ⅲ)可以促进细胞增殖[23];而过量的La(Ⅲ)可使蛋白质和核酸等生物大分子降低或失去活性,抑制微生物的生长[7, 24]。为了解菌株FZU-07对稀土离子La(Ⅲ)的生物效应,进行了耐受能力测定实验。图 3为菌株FZU-07在不同La(Ⅲ)浓度的PDA液体培养基中的生长效果图。由图可知,La(Ⅲ)对分离菌株的生长产生了一定的抑制作用,随着稀土离子浓度的增加,抑制作用越明显,菌株FZU-07在La(Ⅲ)离子浓度为200 mg/L以下时生长状况较好,对La(Ⅲ)最大耐受浓度为400 mg/L。

|
| 图 3 菌株FZU-07在不同La(Ⅲ) 浓度的PDA培养基中生长效果图 Figure 3 The effect of growth of strain FZU-07 in PDA medium with different La(Ⅲ)-containing. From left to right, the concentration of La(Ⅲ) is 0, 100, 200, 300, 400, 500, 600, 700 and 800 mg/L. |
2.3 菌株FZU-07对La(Ⅲ) 的回收效率
菌株FZU-07与稀土离子La(Ⅲ)相互作用前后上清液中的浓度变化如表 1所示,在非微生物诱导矿化的条件下,La(Ⅲ)的回收率为46.19%;在微生物诱导矿化(MICP)的条件下,La(Ⅲ)的回收率有了明显的增加,可达到99.16%。表明菌株FZU-07的诱导矿化作用可以提高其对稀土离子La(Ⅲ)的回收效率。
| Samples | Initial La(Ⅲ) Concentration/(mg/L) | La(Ⅲ) concentration after 5 days/(mg/L) | Recovery rate/% |
| A Cell-La(Ⅲ) | 193.7±0.3 | 104.24±1.5 | 46.19 |
| B Cell-MICP-La(Ⅲ) | 193.7±0.3 | 1.61±0.2 | 99.16 |
2.4 SEM-EDS分析菌株FZU-07与La(Ⅲ) 相互作用
菌株FZU-07及其与La(Ⅲ)相互作用后的SEM结果如图 4所示。菌体在未与La(Ⅲ)相互作用时(图 4-A),菌丝表面较为光滑;菌体与La(Ⅲ)作用后(图 4-B),菌丝表面有许多凸起,表面不平整,菌体与La(Ⅲ)在经过MICP作用后(图 4-C),菌丝表面有许多颗粒物附着。

|
| 图 4 菌株FZU-07及其与La(Ⅲ) 相互作用的扫描电镜照片 Figure 4 SEM image of strain FZU-07 loaded with and without La(Ⅲ). A: Cell; B: Cell-La(Ⅲ); C: Cell-MICP-La(Ⅲ). |
为了确定哪些基团参与了菌株FZU-07与La(Ⅲ)相互作用过程,本实验用SEM结合EDS观察与La(Ⅲ)相互作用后的菌丝样品,并对样品进行了Mapping分析。由图 5可知,两种作用方式后,菌丝体表面的EDS分析均检测到Pt、La(Ⅲ)、C、O及P的存在。Pt的信号来自样品喷Pt处理过程;反应溶液中未添加磷源,但菌丝体表面存在P信号,且La(Ⅲ)和P在菌丝体表面的分布较为一致,这表明La(Ⅲ)可能与菌丝体表面的磷酸基团相结合[25]。菌体表面的La信号证实溶液中La(Ⅲ)浓度的降低可能是由于其被吸附于菌体表面。菌株与La(Ⅲ)在经过MICP作用后,EDS分析检测到Ca的存在,且Ca的分布与菌体表面颗粒物的分布较为一致,结合菌体的MICP作用特性,可以确定菌体表面附着的颗粒物主要成分是碳酸钙。菌株与La(Ⅲ)在经过MICP作用后菌体表面的La(Ⅲ)的信号(图 5-B)比非MICP作用后菌体表面的La(Ⅲ)信号(图 5-A)弱,可能是MICP过程中生成的碳酸钙掩盖了La(Ⅲ)的信号。
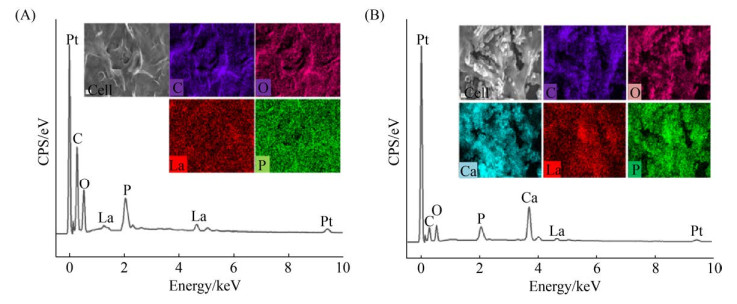
|
| 图 5 菌株FZU-07与La(Ⅲ) 相互作用元素分布及能谱图 Figure 5 Mapping and EDS spectra of FZU-07 grown in La-containing media with and without urea and CaCl2. A: Cell-La(Ⅲ); B: Cell-MICP-La(Ⅲ). |
2.5 FT-IR分析菌株FZU-07与La(Ⅲ) 相互作用
为进一步确定菌株FZU-07与La(Ⅲ)作用过程中起到主要作用的基团,对菌株FZU-07及其与La(Ⅲ)两种作用方式的红外光谱图进行比对分析,结果如图 6-A所示。图中3384 cm–1移动到3269 cm–1、3287 cm–1处,且强度有所减弱,此处主要为细胞多糖和蛋白质中O-H、N-H的伸缩振动;2925 cm–1移动到2922 cm–1,且有所增强,是细胞壁上蛋白质和糖类中烷基的C-H伸缩振动;1652 cm–1移动到1622 cm–1、1651 cm–1处,与缩氨酸中酰胺Ⅰ(CO-NH)中C=O的振动有关;1030 cm–1移动到1023 cm–1和1027 cm–1,可能是有机伯醇的振动峰[26-31]。菌株FZU-07与La(Ⅲ) 两种作用方式中氨基、羟基和羰基等官能团的类型没有发生变化,但透光率有所改变,表明这些官能团可能参与了菌株FZU-07吸附La(Ⅲ)的过程。
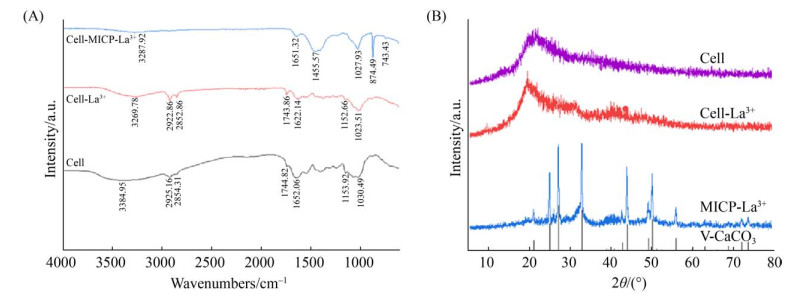
|
| 图 6 菌株FZU-07及其与La(Ⅲ) 相互作用的FT-IR (A) 和XRD (B) Figure 6 FTIR (A) or XRD (B) spectrum of FZU-07 grown in La-containing media with and without urea and CaCl2. |
经过微生物诱导矿化(MICP)作用后,菌丝体上O-H、N-H、C-H及C=O的特征峰存在微弱的变化,1455 cm–1、874 cm–1、743 cm–1的特征峰为球霰石(vaterite)的特征峰[20, 22, 28]。这些现象表明在MICP过程中存在生物吸附和碳酸钙沉淀联合回收La(Ⅲ)的现象。
2.6 XRD分析菌株FZU-07与La(Ⅲ) 相互作用产物为了确定菌株与La(Ⅲ)相互作用后的产物形态,对作用产物进行XRD测定。结果如图 6-B所示,菌株与La(Ⅲ)在非诱导矿化作用下,XRD图谱上未检测到衍射峰,表明此过程中吸附的La(Ⅲ)未形成矿物或为无定形化合物;菌株与La(Ⅲ)在MICP作用下,XRD谱图上观察到的衍射峰与球霰石-vaterite (JCPDF 33-0268)可以很好地匹配,表明菌株FZU-07可诱导矿化形成碳酸钙沉淀。MICP过程中可以提高La(Ⅲ)的回收效率是因为微生物诱导产生的生物碳酸钙是一种多孔材料[32],可以将La(Ⅲ)吸附到碳酸钙颗粒的表面并逐渐吸附到其内部,最终形成La(Ⅲ)和碳酸钙的混合固相。
3 讨论近年来,有关微生物与La(Ⅲ)的相互作用研究很多,但菌种不同,其对金属的耐受性也有所差别。陈克[33]从河南农业大学花园的表层土壤中分离出的土壤杆菌属(R8)和卡氏菌属(782)分别可耐受80 mg/L和100 mg/L的La(Ⅲ);枯草芽孢杆菌和大肠杆菌在La(Ⅲ)添加量为200 mg/L时菌株生长最好[34];Bacillus megaterium对La(Ⅲ)的最大耐受浓度为300 mg/L[35];目前已知对La(Ⅲ)耐受能力最好的菌种是黑曲霉A01,其可耐受800 mg/L的La(Ⅲ)[36]。本研究从罗源湾红树林浅滩土壤中筛选出的菌株Fusarium oxysporum FZU-07在La(Ⅲ)浓度为200 mg/L以下时生长状况较好,对La(Ⅲ)最大耐受浓度为400 mg/L。分离菌株FZU-07虽然比部分菌株对La(Ⅲ)耐受能力高,但跟黑曲霉A01相比还存在一定的差距。
生物诱导矿化(BIM)微生物诱导碳酸钙沉淀(MICP)固定金属离子可通过以下方式进行:(1) 微生物通过MICP过程使部分金属离子由可溶态转变为碳酸盐沉淀的形式。Achal等[37]的研究表明Kocuria flava的MICP作用可将土壤中的部分Pb转化为PbCO3;Kumari等[38]的研究表明Exiguobacterium undae的MICP作用可将部分Cd从可溶性交换态转化为碳酸盐结合态(CdCO3)。本研究中菌株FZU-07对La(Ⅲ)进行MICP作用后,XRD分析中未检测到La2(CO3)3的衍射峰,仅有碳酸钙的特征峰,说明菌株FZU-07在MICP过程中不能直接将La(Ⅲ)转化为碳酸盐矿物。(2) 生物诱导产生的碳酸钙颗粒是一种多孔材料,具有较强的吸附或与周围金属离子共沉淀的能力[15, 32, 39]。Qian等[22]通过从污泥中分离的青霉菌(Penicillium chrysogenum CS1)对铅和铬进行生物矿化,Pb(Ⅱ)可直接生成PbCO3,Cr(Ⅵ)与CO32–没有直接反应形成沉淀,而是通过与碳酸钙颗粒的晶格结合,以共沉淀的方式被除去。本研究中的诱导矿化过程,Ca2+被吸附在菌丝体表面形成成核位点,与溶液中的CO32-结合生成碳酸钙,La(Ⅲ)部分吸附在菌丝体表面,部分被捕获于诱导矿化生成的碳酸钙内,最终形成La(Ⅲ)和碳酸钙的混合固相,以共沉淀的形式被去除。且真菌菌丝结构的好处在于,固定化的金属离子-碳酸盐晶体附着在菌丝表面,这些真菌-生物矿物簇可以通过一个简单的过滤步骤去除[22]。
目前已有研究中采用诱导矿化作用回收La(Ⅲ)的方式较少。Kang等[40]利用Aspergillus niger产草酸的特性,将La(Ⅲ)转化为La2(C2O4)3·10H2O。本研究则是利用菌株FZU-07产脲酶的特性,通过诱导矿化生成La(Ⅲ)和碳酸钙的混合固相的方式,达到回收La(Ⅲ)的目的。且生物诱导矿化的生物碳酸钙是一种多孔材料,具有较强的吸附或与周围金属离子共沉淀的能力,具有较好的应用前景。
4 结论本研究从罗源湾红树林浅滩土壤中分离筛选出1株产脲酶及耐La(Ⅲ)真菌FZU-07,属于尖孢镰刀菌(Fusarium oxysporum),其最大La(Ⅲ)耐受浓度为400 mg/L。在非MICP条件下,菌株FZU-07对La(Ⅲ)的主要作用机制是生物吸附,菌株FZU-07吸附La(Ⅲ)与菌丝体表面的氨基、羟基、羰基和磷酸基团相关;在MICP条件下,菌株FZU-07对La(Ⅲ)的回收是生物吸附和碳酸钙沉淀联合作用的结果,脲酶分解尿素产生碳酸,与钙离子结合生成球霰石晶型的碳酸钙,La(Ⅲ)被捕获在球霰石晶格中,形成La(Ⅲ)和碳酸钙的混合固相。
| [1] | Shen YC, Zhang SR, Li S, Xu XX, Jia YX, Gong GS. Eucalyptus tolerance mechanisms to lanthanum and cerium: Subcellular distribution, antioxidant system and thiol pools. Chemosphere, 2014, 117: 567-574. DOI:10.1016/j.chemosphere.2014.09.015 |
| [2] | Jorjani E, Bagherieh AH, Mesroghli S, Chelgani SC. Prediction of yttrium, lanthanum, cerium, and neodymium leaching recovery from apatite concentrate using artificial neural networks. Journal of University of Science and Technology Beijing, Mineral, Metallurgy, Material, 2008, 15(4): 367-374. DOI:10.1016/S1005-8850(08)60070-5 |
| [3] | Malhotra N, Hsu HS, Liang ST, Roldan MJM, Lee JS, Ger TR, Hsiao CD. An updated review of toxicity effect of the rare earth elements (REEs) on aquatic organisms. Animals, 2020, 10(9): 1663. DOI:10.3390/ani10091663 |
| [4] |
Luo YZ, Shen MW. Research on recycling rare earth concentration from rare earth wastewater. Multipurpose Utilization of Mineral Resources, 2016(3): 93-96.
(in Chinese) 罗宇智, 沈明伟. 从稀土废水中回收制备氧化稀土试验研究. 矿产综合利用, 2016(3): 93-96. DOI:10.3969/j.issn.1000-6532.2016.03.022 |
| [5] |
Du Shaomei. Environmental effects and remediation measures for contaminated soils by rear earth elements. Shandong Chemical Industry, 2017, 46(14): 197-199.
(in Chinese) 杜召梅. 稀土元素的环境效应及其污染土壤的修复措施. 山东化工, 2017, 46(14): 197-199. DOI:10.3969/j.issn.1008-021X.2017.14.080 |
| [6] | Pagano G, Guida M, Tommasi F, Oral R. Health effects and toxicity mechanisms of rare earth elements-Knowledge gaps and research prospects. Ecotoxicology and Environmental Safety, 2015, 115: 40-48. DOI:10.1016/j.ecoenv.2015.01.030 |
| [7] |
Wang YB, Liu ZY, Zhang DY, Li YL, Hu JH. Research progress on effects mechanisms of rare earth ions on microbial hormesis. Journal of the Chinese Society of Rare Earths, 2019, 37(4): 402-408.
(in Chinese) 王雅波, 刘占英, 张冬艳, 李永丽, 胡建华. 稀土离子对微生物Hormesis效应机制的研究进展. 中国稀土学报, 2019, 37(4): 402-408. |
| [8] | Jin HY, Reed DW, Thompson VS, Fujita Y, Jiao YQ, Crain-Zamora M, Fisher J, Scalzone K, Griffel M, Hartley D, Sutherland JW. Sustainable bioleaching of rare earth elements from industrial waste materials using agricultural wastes. ACS Sustainable Chemistry & Engineering, 2019, 7(18): 15311-15319. |
| [9] |
Wang ZG, Wang JR, Peng WB, Yang JH. Treatment of waste water from mining process of ionic rare earth with membrane separation technology. Chinese Rare Earths, 2017, 38(1): 102-107.
(in Chinese) 王志高, 王金荣, 彭文博, 杨积衡. 膜分离技术处理离子型稀土矿稀土开采废水. 稀土, 2017, 38(1): 102-107. |
| [10] | Das N, Das D. Recovery of rare earth metals through biosorption: an overview. Journal of Rare Earths, 2013, 31(10): 933-943. DOI:10.1016/S1002-0721(13)60009-5 |
| [11] |
Luo YZ, Shen MW, Li B. Treatment of ammonia-nitrogen-bearing wastewater by chemical precipitation and break point chlorination. Nonferrous Metals: Extractive Metallurgy, 2015(7): 63-65.
(in Chinese) 罗宇智, 沈明伟, 李博. 化学沉淀-折点氯化法处理稀土氨氮废水. 有色金属: 冶炼部分, 2015(7): 63-65. DOI:10.3969/j.issn.1007-7545.2015.07.017 |
| [12] | Zheng XY, Wang XY, Shen YH, Lu X, Wang TS. Biosorption and biomineralization of uranium(Ⅵ) by Saccharomyces cerevisiae-Crystal formation of chernikovite. Chemosphere, 2017, 175: 161-169. DOI:10.1016/j.chemosphere.2017.02.035 |
| [13] | Gadd GM. Metals, minerals and microbes: geomicrobiology and bioremediation. Microbiology: Reading, England, 2010, 156(Pt 3): 609-643. |
| [14] |
Wang ML, Wu SJ, Yang YQ, Chen FR. Microbial induced carbonate precipitation and its application for immobilization of heavy metals: a review. Research of Environmental Sciences, 2018, 31(2): 206-214.
(in Chinese) 王茂林, 吴世军, 杨永强, 陈繁荣. 微生物诱导碳酸盐沉淀及其在固定重金属领域的应用进展. 环境科学研究, 2018, 31(2): 206-214. |
| [15] | Huang Z, Cui FZ, Feng QL, Guo XD. Incorporation of strontium into hydroxyapatite via biomineralization of collagen fibrils. Ceramics International, 2015, 41(7): 8773-8778. DOI:10.1016/j.ceramint.2015.03.102 |
| [16] |
Chen MJ, Li YF, Li BW, Jiang XR, Zheng CL. Effect of stabilization of Pb-pollution in soil based on microbial induced calcite precipitation. Nonferrous Metals Engineering, 2020, 10(12): 128-134.
(in Chinese) 陈敏洁, 李亚飞, 李博文, 姜晓茹, 郑春丽. 微生物诱导碳酸钙沉淀对土壤中Pb污染稳定化的效果研究. 有色金属工程, 2020, 10(12): 128-134. |
| [17] | Kumari D, Pan XL, Achal V, Zhang DY, Al-Misned FA, Golam Mortuza M. Multiple metal-resistant bacteria and fungi from acidic copper mine tailings of Xinjiang, China. Environmental Earth Sciences, 2015, 74(4): 3113-3121. DOI:10.1007/s12665-015-4349-z |
| [18] |
Zhang ZH. Advances of chemical constituents of mangrove fungi. Chinese Journal of Antibiotics, 2016, 41(4): 309-315.
(in Chinese) 张志华. 红树林真菌化学成分研究进展. 中国抗生素杂志, 2016, 41(4): 309-315. DOI:10.3969/j.issn.1001-8689.2016.04.014 |
| [19] |
Guo MJ, Zhao XY, Han JH, et al. Isolation and activity analysis of fungi from the rhizosphere of mangroves in Xinglin Bay, Xiamen. Microbiology China, 2021: 1-15.
(in Chinese) 郭梦捷, 赵箫杨, 韩佳卉, 等. 厦门杏林湾红树林根际真菌分离及活性分析. 微生物学通报, 2021: 1-15. |
| [20] | Dhami NK, Quirin MEC, Mukherjee A. Carbonate biomineralization and heavy metal remediation by calcifying fungi isolated from karstic caves. Ecological Engineering, 2017, 103: 106-117. DOI:10.1016/j.ecoleng.2017.03.007 |
| [21] | Kim G, Kim J, Youn H. Effect of temperature, pH, and reaction duration on microbially induced calcite precipitation. Applied Sciences, 2018, 8(8): 1277. DOI:10.3390/app8081277 |
| [22] | Qian XY, Fang CL, Huang MS, Achal V. Characterization of fungal-mediated carbonate precipitation in the biomineralization of chromate and lead from an aqueous solution and soil. Journal of Cleaner Production, 2017, 164: 198-208. DOI:10.1016/j.jclepro.2017.06.195 |
| [23] |
Feng ZH, Wang X, Zhang SX, An LZ, Zhang JX, Yao HY. A study of the biological effects of rare earth elements at cellular level using nuclear techniques. Chinese Journal of Nuclear Mdeicine, 2001, 21(2): 46-49.
(in Chinese) 凤志慧, 王玺, 张孙曦, 安丽芝, 章净霞, 姚惠英. 稀土元素La、Gd和Ce对培养大鼠细胞生物学效应的研究. 中华核医学杂志, 2001, 21(2): 46-49. |
| [24] |
Chen AM, Shi QS, Ouyang YS, Chen YB, Tan SZ. Progress in antimicrobial activity and application of rare earths. Microbiology, 2009, 36(1): 90-96.
(in Chinese) 陈爱美, 施庆珊, 欧阳友生, 陈仪本, 谭绍早. 稀土抗菌效应及应用的研究进展. 微生物学通报, 2009, 36(1): 90-96. |
| [25] | Cheng YJ, Zhang L, Bian XJ, Zuo HY, Dong HL. Adsorption and mineralization of REE-lanthanum onto bacterial cell surface. Environmental Science and Pollution Research, 2018, 25(23): 22334-22339. DOI:10.1007/s11356-017-9691-0 |
| [26] | Su H, Zhang DC, Antwi P, Xiao LW, Liu ZW, Deng XY, Asumadu-Sakyi AB, Li JZ. Effects of heavy rare earth element (yttrium) on partial-nitritation process, bacterial activity and structure of responsible microbial communities. Science of the Total Environment, 2020, 705: 135797. DOI:10.1016/j.scitotenv.2019.135797 |
| [27] |
Wang ZL, Luo XG, Si H, Wang Z. Effects of manganese and arsenic on uranium enrichment of Bacillus licheniformis. Biotechnology Bulletin, 2018, 34(6): 164-171.
(in Chinese) 望子龙, 罗学刚, 司慧, 王焯. 锰、砷对地衣芽孢杆菌铀富集的影响. 生物技术通报, 2018, 34(6): 164-171. |
| [28] | Govarthanan M, Mythili R, Kamala-Kannan S, Selvankumar T, Srinivasan P, Kim H. In-vitro bio-mineralization of arsenic and lead from aqueous solution and soil by wood rot fungus, Trichoderma sp. Ecotoxicology and Environmental Safety, 2019, 174: 699-705. |
| [29] | Li B, Zhang T, Yang ZG. Immobilizing unicellular microalga on pellet-forming filamentous fungus: Can this provide new insights into the remediation of arsenic from contaminated water?. Bioresource Technolog, 2019, 284: 231-239. |
| [30] |
Zhu WK, Luo XG. Optimization of calcium carbonate precipitation for carbonate mineralization bacteria. Non-Metallic Mines, 2012, 35(3): 1-4, 8.
(in Chinese) 竹文坤, 罗学刚. 碳酸盐矿化菌诱导碳酸钙沉淀条件的优化. 非金属矿, 2012, 35(3): 1-4, 8. |
| [31] |
Han R, Lin WT, Yang P, Huang Z, Liu MH, Cheng YJ. Study on the removal of Pb2+ by biomineralization media via microalgae. Geological Journal of China Universities, 2015, 21(4): 608-615.
(in Chinese) 韩冉, 林文挺, 杨鹏, 黄振, 刘明华, 程扬健. 微藻矿化去除Pb2+的研究. 高校地质学报, 2015, 21(4): 608-615. |
| [32] | Zhu XJ, Kumari D, Huang MS, Achal V. Biosynthesis of CdS nanoparticles through microbial induced calcite precipitation. Materials & Design, 2016, 98: 209-214. |
| [33] | 陈克. 稀土离子的微生物吸附及其相互作用. 郑州: 河南农业大学学位论文, 2007. |
| [34] |
Chai RJ, Wang YL. Effect of REE on growth of bacteria and fluorescence spectrum of DNA. Spectroscopy and Spectral Analysis, 2013, 33(7): 1829-1833.
(in Chinese) 柴瑞娟, 王玉良. 镧和铈对两种细菌生长的影响及胞内DNA的荧光光谱分析. 光谱学与光谱分析, 2013, 33(7): 1829-1833. |
| [35] |
Zheng CL, Wang YQ, Chen MJ, Jiang ZY, Yang LQ, Zhang XF. Interactions between Bacillus megaterium and rare earth ions. Chinese Rare Earths, 2016, 37(1): 132-136.
(in Chinese) 郑春丽, 王亚琴, 陈敏洁, 姜志艳, 杨栗清, 张雪峰. 巨大芽孢杆菌与稀土离子的相互作用研究. 稀土, 2016, 37(1): 132-136. |
| [36] | 史小利. 黑曲霉对稀土离子的生物吸附研究. 郑州: 河南农业大学学位论文, 2008. |
| [37] | Achal V, Pan XL, Zhang DY, Fu QL. Bioremediation of Pb-contaminated soil based on microbially induced calcite precipitation. Journal of Microbiology and Biotechnology, 2012, 22(2): 244-247. |
| [38] | Kumari D, Pan XL, Lee DJ, Achal V. Immobilization of cadmium in soil by microbially induced carbonate precipitation with Exiguobacterium undae at low temperature. International Biodeterioration & Biodegradation, 2014, 94: 98-102. |
| [39] | Sun JM, Zhu WT, Huang JC. Characterization of primary precipitate composition formed during co-removal of Cr(Ⅵ) with Cu(Ⅱ) in synthetic wastewater. Environmental Science and Pollution Research, 2006, 13(6): 379-385. |
| [40] | Kang X, Csetenyi L, Gadd GM. Biotransformation of lanthanum by Aspergillus niger. Applied Microbiology and Biotechnology, 2019, 103(2): 981-993. |
 2021, Vol. 61
2021, Vol. 61




