中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 郭俊琪, 王征, 张伟欣, 刘巍峰. 2021
- Junqi Guo, Zheng Wang, Weixin Zhang, Weifeng Liu. 2021
- 代谢工程改造酿酒酵母提高法尼醇产量
- Metabolic engineering of Saccharomyces cerevisiae to improve farnesol production
- 微生物学报, 61(5): 1257-1268
- Acta Microbiologica Sinica, 61(5): 1257-1268
-
文章历史
- 收稿日期:2020-06-03
- 修回日期:2020-07-29
- 网络出版日期:2020-12-11
萜类化合物,又称类异戊二烯,广泛分布于植物及微生物初级代谢物和次生代谢物中[1],根据所含异戊二烯数目分为单萜(C10)、倍半萜(C15)、二萜(C20)、三萜(C30)、四萜(C40)和多萜(C > 40)等。法尼醇(C15H26O,FOH),又名金合欢醇,是一种具有芳香气味的非环状倍半萜醇。它存在于香茅、橙花油、柠檬草、玫瑰和麝香等植物中[2],也存在于动物和微生物中,在信号转导、群体感应和细胞凋亡诱导等过程中发挥重要作用[3]。法尼醇常被用作化妆品的香味成分和抗癌药物的原料,并且由于其具有低水溶性和高能量值,被认为可作为柴油或喷气燃料等的替代品[4-5]。从植物中分离提取法尼醇步骤繁琐,且高度依赖原料的可利用性;而经化学方法合成的法尼醇,往往存在异构体混杂、毒性大等问题[3]。因此,构建定向、高效、安全的法尼醇合成细胞工厂,对其生产和应用具有重要意义。
具有食品级安全性的酿酒酵母是生产萜类化合物的优良底盘细胞,其体内天然的甲羟戊酸(Mevalonate,MVA)途径能够为萜类的合成提供直接前体[6]。法尼基焦磷酸(farnesyl pyrophosphate,FPP)是MVA途径的关键分支点,流向麦角固醇合成通路和法尼醇合成通路(图 1)。酿酒酵母内源的法尼醇是在磷酸酶的作用下由FPP脱磷酸化而形成[3]。磷酸酶DPP1 (diacylglycerol pyrophosphate phosphatase 1)和LPP1 (lipid phosphate phosphatase 1)分别定位于液泡和高尔基体细胞膜上,是胞内磷酸异戊酯磷酸酶活性的主要贡献者,二者均具有水解FPP生成法尼醇的能力[7]。碱性磷酸酶Pho8 (phosphatase 8)通过N端跨膜螺旋锚定于液泡表面,去掉N端的62个氨基酸后,定位于胞质的突变体(Pho8Δ62)能够在胞质中高效地水解FPP为法尼醇[8]。除了DPP1和LPP1,酵母中存在另外两种磷脂酰磷酸酶APP1 (actin patch protein 1)和PAH1 (phosphatidic acid phosphohydrolase 1),APP1定位于皮质肌动蛋白片(cortical actin patch)上,PAH1定位于细胞膜上,可以经由胞质易位至细胞核/内质网膜上[9-11]。APP1和PAH1在法尼醇合成中的作用目前还不清楚。与酿酒酵母中法尼醇由磷酸酶介导合成不同的是,植物中法尼醇是由法尼醇合酶催化FPP生成(图 2),目前来源于Oryza sativa L.的合酶OsTPS13和来源于Phyllostachys edulis的合酶MoTPS2被鉴定出具有体外合成法尼醇的能力[12-13]。在过去十几年里,人们对提高酿酒酵母中法尼醇产量做了一些探索工作(表 1)。Asadollahi等[14]使用甲硫氨酸抑制性MET3启动子替换鲨烯合酶编码基因ERG9的启动子,通过添加甲硫氨酸弱化麦角固醇合成来增强法尼醇合成,最终在生物反应器中获得了20.2 mg/L的法尼醇。Muramatsu等[15-16]通过外源添加角鲨烯合酶抑制剂的方式,抑制麦角固醇合成途径,同时在培养液中添加豆油和清洁剂,优化培养条件使法尼醇产量达28.0 mg/L;并进一步在中性条件下(pH 7.0)培养酵母细胞,使法尼醇产量达到102.8 mg/L。2009年,Ohto等[17]采用强化表达MVA途径中的限速酶羟基-3-甲基戊二酰辅酶A (3-hydroxy-3-methylglutaryl-CoA,HMG-CoA)的方法,强化FPP前体供应,经过7 d的分批发酵获得产量为145.7 mg/L的法尼醇。从上述结果得知,虽然法尼醇在酿酒酵母中的产量与其内源产量相比已有较大提高,但是仍然无法满足工业生产的需要,因此,需要更多研究去进一步提升产量。

|
| 图 1 本文在酿酒酵母中提高法尼醇产量的策略示意图 Figure 1 Schematic illustration of strategies used in this study to increase farnesol production in Saccharomyces cerevisiae. The strategies includes overexpressing two key enzymes in the MVA pathway, the truncated HMG-CoA reductase (tHMGR1) and the FPP synthase ERG20, replacing the native ERG9 promoter with the HXT1 promoter, and overexpressing the endogenous phosphatases DPP1/LPP1/APP1/PAH1/Pho8Δ62 and heterologous farnesol synthases OsTPS13/MoTPS2, respectively, for screening the enzyme with best performance in farnesol production. HMG-CoA: 3-hydroxy-3-methylglutaryl coenzyme A; IPP: isopentenyl pyrophosphate; DMAPP: dimethylallyl diphosphate; FPP: (E, E)-farnesyl diphosphate; FOH: (E, E)-farnesol; tHMGR1: truncated HMG-CoA reductase 1; ERG20: FPP synthase; ERG9: squalene synthase 9; DPP1: diacylglycerol pyrophosphate phosphatase 1; LPP1: lipid phosphate phosphatase 1; APP1: actin patch protein 1; PAH1: phosphatidic acid phosphohydrolase 1; Pho8Δ62: repressible vacuolar alkaline phosphatase; OsTPS13: terpene synthase of Oryza sativa L.; MoTPS2: terpene synthase of Phyllostachys edulis. |

|
| 图 2 由磷酸酶和合酶分别催化FPP生成法尼醇的反应机制[3] Figure 2 Reaction mechanisms of FOH synthesis mediated by phosphatase and synthase with FPP as substrate[3]. A: FOH is either generated from hydrolysis of FPP by phosphatases; B: FOH is either generated from addition of a hydroxyl group to FPP carbocation intermediate mediated by sesquiterpene synthases. FPP phosphoester bond is indicated in red. FMP: farnesyl monophosphate; FOH: farnesol; FPP: farnesyl diphosphate; M2+: bivalent metalion; Pi: monophosphate; PPi: diphosphate. |
| Host strains | Approaches | FOH titer/(mg/L) | References |
| CEN.PK113-5D | Replacing the native ERG9 promoter with the MET3 promoter |
20.2 (5 liter batch fermenter) | [13] |
| ATCC 64031a | Supplementing oils and detergents to the culture | 28.0 | [14] |
| ATCC 64031a | Optimization of culture condition including adjusting pH to neutral value |
102.8 (10 liter jar fermenter for 133 h) | [15] |
| AURGG101b | Overexpressing the truncated HMG-CoA reductase encoding gene (tHMGR1) |
145.7 (5 liter bench-scale jar fermenter for 7 d) | [16] |
| CEN.PK2-1D | Overexpressing the truncated HMG-CoA reductase encoding gene (tHMGR1) and farnesyl diphosphate synthase encoding gene (ERG20), replacing the native ERG9 promoter with the HXT1 promoter, and overexpressing the yeast endogenous phosphatase PAH1 |
319.1 (20 mL shake flask for 72 h) |
This study |
| aATCC 64031: a squalene synthetase-deficient mutant S. cerevisiae; bAURGG101: an ATCC 200589 recombinant strain carrying AUR1-C instead of AUR1 for resistance to aureobasidin[18]. | |||
为进一步提升酿酒酵母中法尼醇的产量,在本文中,我们通过采用强化MVA途径关键酶的表达水平和弱化麦角固醇分支途径以增加法尼醇合成直接前体FPP的供应,以及筛选高效内源磷酸酶和异源合酶促进法尼醇合成的策略(图 1),使得法尼醇在小体积摇瓶中产量达到393.13 mg/L,这是目前已知的酿酒酵母中合成法尼醇的最高产量。
1 材料和方法 1.1 主要试剂与仪器主要试剂:PrimeSTAR HS DNA聚合酶购自宝生物工程有限公司;DNA Marker D15000+2000购自北京天根生物有限公司;无缝克隆试剂盒购于北京全式金生物技术有限公司;真菌基因组提取试剂盒、质粒提取试剂盒、胶回收试剂盒购自Omega Bio-Tech公司;正十二烷购自上海麦克林生化科技有限公司;法尼醇、角鲨烯标准品购自Sigma-Aldrich公司;氨苄青霉素购自上海生工生物工程有限公司。各种化学试剂均为分析纯标准。
主要仪器:高压灭菌锅(上海中安医疗器械厂)、PCR扩增仪(BIOER)、高速冷冻离心机(Eppendorf 5804R)、Minispin离心机(Eppendorf)、电泳仪(Jun Yi JY300C)、酶标仪(Tecan)、恒温培养箱、水浴锅、电子天平(Sartorius)、pH酸度计(Sartorius)、快速核酸检测仪(Eppendorf)、组织匀浆器(Herein)以及气相色谱(GC2010,Shimadu)等。
1.2 菌株与质粒本文所用菌株及质粒如表 2所示。
| Plasmids and strains | Description | Sources |
| pRS306 | ura3, Ampr | Laboratory stock |
| pRS306-tHMGR1 | ura3, pRS306-PTPI1-tHMGR1-TCYC1 | This study |
| pRS304 | trp1, Ampr | Laboratory stock |
| pRS304-ERG20 | trp1, pRS304-PADH1-ERG20-TADH1 | This study |
| pRS425 | 2μ ori, leu2, Ampr | Laboratory stock |
| pRS425-PGAL1-TADH1 | 2μ ori, leu2, pRS425-PGAL1-TADH1 | Laboratory stock |
| pRS425-DPP1 | 2μ ori, leu2, pRS425-PGAL1-DPP1-TADH1 | This study |
| pRS425-LPP1 | 2μ ori, leu2, pRS425-PGAL1-LPP1-TADH1 | This study |
| pRS425-APP1 | 2μ ori, leu2, pRS425-PGAL1-APP1-TADH1 | This study |
| pRS425-PAH1 | 2μ ori, leu2, pRS425-PGAL1-PAH1-TADH1 | This study |
| pRS425-Pho8Δ62 | 2μ ori, leu2, pRS425-PGAL1-Pho8Δ62-TADH1 | This study |
| pRS425-MoTPS2 | 2μ ori, leu2, pRS425-PGAL1-MoTPS2-TADH1 | This study |
| pRS425-OsTPS13 | 2μ ori, leu2, pRS425-PGAL1-OsTPS13-TADH1 | This study |
| Saccharomyces cerevisiae CEN.PK2-1D | MATα; leu2-3, 112; ura3-52; his3-Δ1; trp1-289; MAL2-8C; SUC2 | Laboratory stock |
| S1 | CEN.PK2-1D, pRS306-PTPI1-tHMGR1-TCYC1 | Laboratory stock |
| S2 | S1, pRS304-PADH1-ERG20-TADH1 | This study |
| S3 | S2, PERG9: : loxP-PHXT1 | This study |
| S4 | S3, pRS425-PGAL1-TADH1 | This study |
| S5 | S3, pRS425-PGAL1-DPP1-TADH1 | This study |
| S6 | S3, pRS425-PGAL1-LPP1-TADH1 | This study |
| S7 | S3, pRS425-PGAL1-APP1-TADH1 | This study |
| S8 | S3, pRS425-PGAL1-PAH1-TADH1 | This study |
| S9 | S3, pRS425-PGAL1-Pho8Δ62-TADH1 | This study |
| S10 | S3, pRS425-PGAL1-MoTPS2-TADH1 | This study |
| S11 | S3, pRS425-PGAL1-OsTPS13-TADH1 | This study |
1.3 培养基和培养条件
LB培养基(g/L):胰蛋白胨10;酵母提取物5,氯化钠5,蒸馏水定容至1 L。固体培养基另添加1.5%琼脂粉。根据需要加入氨苄青霉素至终浓度为100 μg/mL。
YPDG培养基(g/L):蛋白胨20,酵母提取物10。根据需要加入相应的碳源。葡萄糖和半乳糖可配成20%母液,单独灭菌后加入至终浓度分别为0.2%和2%。固体培养基需添加2%琼脂粉。
SD培养基(g/L):(NH4)2SO4 5,Yeast Nitrogen Base (YNB) 1.7,葡萄糖20。根据需要选择添加遗传霉素(Geneticin,G418)、亮氨酸、组氨酸、色氨酸、尿嘧啶等,G418在培养基中终浓度为40 μg/mL,亮氨酸、组氨酸、色氨酸、尿嘧啶终浓度为50 μg/mL。固体培养基需添加2%琼脂粉。
所有培养基均经115 ℃灭菌处理30 min。
大肠杆菌在LB平板上生长于温度为37 ℃的培养箱中静置培养12–14 h,在LB液体培养基中于温度为37 ℃、转速为200 r/min的培养箱中培养12–14 h。酿酒酵母在SD平板上于温度为30 ℃的培养箱中静置培养3 d,在相应液体培养基中于温度为30 ℃、转速为200 r/min的培养箱中培养12–24 h。营养缺陷型菌株筛选采用SD培养基,摇瓶培养采用YPDG培养基。
1.4 表达载体和启动子替换盒的构建以酿酒酵母CEN.PK2-1D基因组为模板,扩增N端截短529个氨基酸的tHMGR1的编码基因片段,使用无缝克隆试剂盒连入含有TPI1启动子和CYC1终止子的pRS306载体,经筛选获得正确的表达质粒pRS306-tHMGR1同样扩增出ERG20的基因片段,利用无缝克隆试剂盒与Sma Ⅰ线性化的pRS304-PADH1-TADH1载体骨架连接,并转化进入大肠杆菌DH5α感受态细胞,经筛选验证获得正确的表达质粒pRS304-ERG20。
同样以酿酒酵母CEN.PK2-1D基因组为模板分别扩增出5种磷酸酶DPP1、LPP1、APP1、PAH1和Pho8Δ62的基因片段,连接进入Sma Ⅰ线性化的pRS425-PGAL1-TADH1载体骨架,获得重组质粒pRS425-DPP1、pRS425-LPP1、pRS425-APP1、pRS425-PAH1和pRS425-Pho8Δ62。以相同的方法,将密码子优化过的两种植物来源的倍半萜合酶的编码基因MoTPS2 (GenBank No.:KP097716.1)和OsTPS13 (GenBank No.:DQ872159.1)分别连接进入pRS425-PGAL1-TADH1载体骨架,获得重组质粒pRS425-MoTPS2和pRS425-OsTPS13。选择969 bp的HXT1启动子片段,连入EcoR V酶切的携带G418抗性的pUG6载体骨架,再利用带有ERG9两侧同源臂的巢式引物,经2次扩增得到启动子替换盒ERG9up-G418-PHXT1-ERG9orf。
1.5 重组酵母菌株构建采用醋酸锂化学转化法[19]将重组质粒或片段转入酿酒酵母中。将整合质粒pRS306-tHMGR1转入CEN.PK2-1D后获得重组菌株S1;将pRS304-ERG20转化到S1中获得重组菌株S2;将替换ERG9基因启动子的HXT1启动子盒转化进入S2中,利用获得重组菌株S3;将pRS425- PGAL1-TADH1,pRS425-DPP1、pRS425-LPP1、pRS425- APP1、pRS425-PAH1、pRS425-Pho8Δ62,pRS425- MoTPS2和pRS425-OsTPS13分别转化进入S3,获得重组菌株S4–S11。本文构建的质粒和菌株见表 2。
1.6 发酵培养及产物检测分析挑取待测菌株的3–5个单菌落分别到5 mL YNB液体培养基中,培养至对数生长期时以1%的接种量转接到含有20 mL YPDG培养基(葡萄糖和半乳糖的终浓度分别为0.2%和2%)的100 mL锥形瓶中,初始OD600为0.2左右,再加入10% (V/V)体积的十二烷(防止培养过程中目标产物挥发),于转速为200 r/min的30 ℃摇床中培养72 h。
将20 mL菌液置于100 mL离心管中,于10000 r/min离心10 min,小心吸取上层十二烷液体,于–20 ℃保存,并使用Shimadzu GC-FID气相色谱系统分析法尼醇含量[20]。使用RTX-1701色谱柱(30 m×0.25 mm×0.25 μm),程序升温条件为:初始温度40 ℃,维持1 min,以25 ℃/min的速率升温至180 ℃,维持5 min,再以15 ℃/min的速率升温至250 ℃,维持3 min,总分析时间19.27 min;进样口温度250 ℃、检测器温度270 ℃;载气(氮气)流速为2.34 mL/min;进样体积为1 μL,分流比为10。
以正十二烷为溶剂,配制一定浓度梯度的法尼醇标准品溶液,进行气相色谱分析并记录数据,以峰面积为横坐标,法尼醇浓度为纵坐标,绘制标准曲线。实验样品的法尼醇浓度根据标准曲线计算得到具体数值。
2 结果和分析 2.1 强化表达MVA途径关键酶增加前体供给是一种常用且有效的促进目标产物合成的策略。HMG-CoA还原酶(HMGR,HMG1编码)是类异戊二烯合成途径中的限速酶,催化HMG-CoA形成甲羟戊酸,其活性受到末端产物的抑制。有研究表明,相对于完整的HMGR,截短N端调控序列的HMGR1 (tHMGR1)可解除产物的负反馈调控,具有更高活性[17]。FPP合酶(FPPS,ERG20编码)作为催化两步反应的双重功能酶,可催化IPP与其异构体DMAPP结合形成GPP,并进一步催化GPP结合IPP形成FPP,在MVA代谢途径中发挥关键作用[21]。因此,表达截短形式的HMGR1和提高ERG20表达水平可以有效增强萜类前体分子IPP、DMAPP和FPP的供给,是提高倍半萜产量的通用策略[22-23]。
为了提高法尼醇产量,我们也采用了这两个通用策略,以酿酒酵母CEN.PK2-1D为底盘细胞,使用组成型启动子TPI1表达截短形式的HMGR1编码基因,获得重组菌株S1,并在菌株S1的基础上,使用组成型启动子ADH1表达FPP合酶编码基因ERG20,获得重组菌株S2 (表 2)。将上述菌株发酵培养72 h,萃取并检测发酵液中法尼醇产量。如图 3所示,未在CEN.PK2-1D菌株的发酵液中检测到法尼醇,说明其产量低于气相色谱的检测下限0.1 mg/L;过表达tHMGR1的菌株S1中法尼醇产量达到1.87 mg/L,实现从“无”到“有”的量变;在此基础上过表达ERG20的菌株S2中法尼醇产量进一步提升到5.08 mg/L,约为菌株S1中产量的2.7倍,为出发菌株CEN.PK2-1D的50.8倍。这些实验结果表明,强化表达MVA途径中的关键酶,可有效提升目标产物法尼醇的产量。

|
| 图 3 上调MVA途径关键酶的表达和下调麦角固醇分支途径合成对法尼醇产量的影响 Figure 3 The effect of up-regulating the expression of key enzymes in the MVA pathway and down-regulating the ergosterol synthesis on farnesol production of S. cerevisiae. S1: yeast cells overexpressing truncated HMGR1(tHMGR1); S2: yeast cells overexpressing tHMGR1 and ERG20; S3: yeast cells overexpressing tHMGR1 and ERG20 and carrying the ERG9 gene promoter replaced with the HXT1 promoter. Error bars represent the standard deviation of three independent experiments with at least three independent transformants. |
2.2 弱化麦角固醇分支途径
在酿酒酵母中,FPP是异戊二烯合成途径中的关键节点,流向麦角固醇合成通路和法尼醇合成通路。FPP在鲨烯合酶(Squalene synthase,ERG9编码)的催化下形成角鲨烯,再经一系列反应最终合成细胞膜的重要组分麦角固醇。由于麦角固醇在细胞生长中具有重要作用,这条途径只能下调,不能完全消除,因此,需要采用弱启动子或抑制性启动子替换内源ERG9启动子以有效改变FPP的流向。根据已有研究报道,酵母内源葡萄糖转运蛋白编码基因HXT1的启动子强度依赖于葡萄糖浓度,在高浓度葡萄糖条件下上调表达,而在低浓度葡萄糖条件下下调表达,表达水平显著低于ERG9启动子[24],是常用的替换启动子。我们在培养发酵菌株时使用的培养基中含有0.2%葡萄糖和2%半乳糖(下面2.3部分中使用GAL1启动子驱动磷酸酶或合酶表达的诱导剂),酵母细胞能够快速消耗葡萄糖,满足初始菌体的积累;在葡萄糖耗尽,利用半乳糖时,启动子替换为HXT1启动子的ERG9使转录表达水平有效降低[24],能够显著削弱角鲨烯合成途径,使前体FPP更多地流向法尼醇合成通路,进而有利于目标产物法尼醇的合成。与预期相符的是,在菌株S2基础上替换ERG9启动子获得的菌株S3中,法尼醇产量提高至239.17 mg/L,为菌株S2产量的47.1倍(图 3)。
2.3 筛选高效内源磷酸酶和异源法尼醇合酶在酿酒酵母中存在4种内源磷脂酰磷酸酶,分别是DPP1、LPP1、APP1和PAH1[9-11]。其中DPP1和LPP1已被发现在水解FPP生成法尼醇过程中发挥作用[7],而APP1和PAH1是否在该过程中发挥作用还不清楚。此外,碱性磷酸酶Pho8的N端截短形式突变体Pho8Δ62也能够在胞质中促进法尼醇生成[8]。除了上述内源五种磷酸酶,两种来源植物的倍半萜合酶OsTPS13和MoTPS2被发现能够在体外催化FPP生成法尼醇[12-13]。为了进一步增强法尼醇产量,我们将上述5种磷酸酶和两种合酶编码基因分别在酿酒酵母中表达,并检测对法尼醇产量的影响。
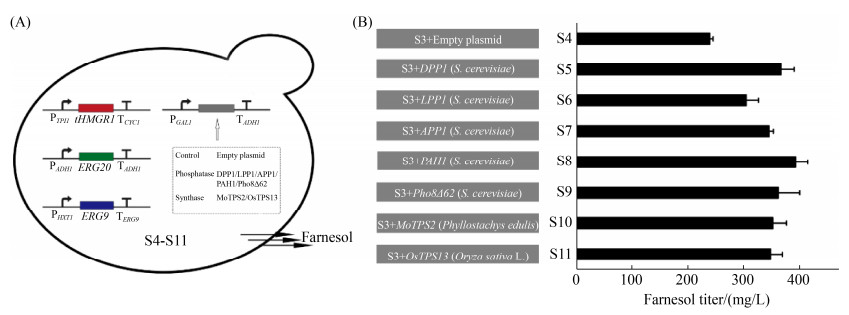
我们分别扩增了5种内源磷酸酶DPP1、LPP1、APP1、PAH1、Pho8Δ62和2种异源合酶OsTPS13、MoTPS2的编码基因片段,连接进入含有诱导型强启动子GAL1的pRS425载体骨架,并将它们分别转入上述构建的菌株S3中,获得重组菌株S5–S11;同时单独将pRS425载体骨架转入S3,获得对照菌株S4 (图 4-A,表 2)。将这些重组菌株在含有0.2%葡萄糖和2%半乳糖为碳源的摇瓶中培养72 h,并采用气相色谱检测法尼醇的产量。分析发现,表达空载质粒的菌株S4与未表达空载质粒的菌株S3的法尼醇产量相同。以S4菌株作为对照菌株,进一步分析发现重组菌株S5–S11的法尼醇产量均有所提升,其中表达磷酸酶PAH1的菌株S8的法尼醇产量最高,达到393.13 mg/L;表达磷酸酶DPP1的菌株S5次之,达到366.78 mg/L (图 4-B)。这些结果表明,在强化前体关键酶和抑制竞争途径的基础上,使用半乳糖诱导型启动子分别表达内源磷酸酶和异源法尼醇合酶,对法尼醇的合成均具有促进作用,内源性磷酸酶PAH1的强化表达对法尼醇产量的提升效果最为明显。
|
| 图 4 分别组成型过表达酵母内源磷酸酶与植物来源的法尼醇合酶对法尼醇产量的影响 Figure 4 The effect of respective constitutive overexpression of five endogenous phosphatases and two heterologous synthases on farnesol production in S. cerevisiae. A: schematic illustration of yeast strains S4–S11; B: production of farnesol in yeast strains S4–S11. Error bars represent the standard deviation of three independent experiments with at least three independent transformants. |
3 讨论
本文以酿酒酵母CEN.PK2-1D菌株为底盘细胞,以模块化的策略调控类异戊二烯合成途径和法尼醇合成途径,构建高效生产法尼醇的酿酒酵母工程菌株。在上游合成模块中,强化表达甲羟戊酸途径中的关键酶tHMGR1和ERG20,以提高前体物质FPP的供给;在下游支路模块中,利用响应葡萄糖浓度变化的HXT1启动子动态调控角鲨烯合酶编码基因ERG9的表达,减少鲨烯-麦角固醇合成通路对FPP的竞争;在产物合成模块中,筛选高效的内源磷酸酶或异源法尼醇合酶,进一步增强了目标产物法尼醇合成途径在FPP节点处的竞争力。在摇瓶培养72 h的条件下,组合模块优化得到的工程菌株的法尼醇产量最高达到393.13 mg/L,是Ohto等[17]报道在小型发酵罐中培养酿酒酵母7 d所获得的法尼醇产量的2.7倍。
法尼醇是在磷酸酶和倍半萜合酶的催化下将FPP去磷酸化形成的。本研究选取的5种酵母内源磷酸酶,其中DPP1和LPP1都是具有6个跨膜区域的膜整合蛋白,能与膜脂质亲和性的物质如FPP发生反应[7];Pho8是锚定于液泡的碱性磷酸酶,N端截短后定位在胞质内能更高效地催化FPP[8];上述这3种酶均可以顺序水解FPP为FMP并在水解过程中释放出2个磷酸[3]。此外,磷脂酰磷酸酶APP1定位于皮质肌动蛋白片上,在脂质代谢平衡和细胞生理方面是重要的调节因子[9]。磷脂酰磷酸酶PAH1根据磷脂酸的水平定位,可通过两亲螺旋经由胞质易位至细胞核/内质网膜上[10-11]。虽然之前未见APP1和PAH1在法尼醇合成中的作用的报道,但我们的结果显示,过表达APP1和PAH1均能一定程度上提高法尼醇的产量,且过表达PAH1时对产量提升作用最显著。需要注意的是,除了N端截短形式的Pho8,这些内源磷酸酶均锚定于膜上,本文中所采用的诱导性强启动子对膜蛋白的高效表达未必合适,今后仍需要探索具有合适强度的启动子,以进一步提高产量。植物倍半萜合酶OsTPS13和MoTPS2对FPP是特异性的且催化时使用与磷酸酶完全不同的机制,它们具有类似的活性位点支架,通过形成碳正离子中间体来启动催化功能,在金属离子存在下FPP被电离形成法尼基阳离子,经焦磷酸盐的去除和水的捕获以合成法尼醇[3];其中OsTPS13的产物包括84.2%的法尼醇和9.7%法尼醇结构异构体[12],据文献报道来源于Ginkgo biloba的合酶GbTPS1也具备催化FPP合成FOH的能力,且具有仅生成法尼醇的专一性[25]。日后也需要更多发现具有高催化性和高专一性的法尼醇合酶,以进一步提高法尼醇的产量。此外,对上述磷酸酶和合酶进行排列组合过表达也可能会获得法尼醇产量进一步提升的工程菌株,有待探讨。
在未来可在基因水平上通过调节启动子的强度和多拷贝高效表达的方法提高酶的表达量,进一步强化甲羟戊酸途径前体的供给[26];可通过调控和改造酵母内源代谢途径或者引入外源酶的策略,从源头上提高底物乙酰辅酶A的供应量[27];还可过量表达调节甾醇生物合成的全局转录因子UPC2或其突变体UPC2-1,从转录水平强化MVA途径中各个酶的表达水平,进而提高整个代谢途径的通量[28];也可以通过对途径中各种代谢物的动态定量和监测来动态调控生物合成途径,本文仅使用葡萄糖诱导型弱启动子HXT1和半乳糖诱导型强启动子GAL1进行初步探索,还需进一步研究在酿酒酵母生长整个阶段内中间代谢产物的积累和合成途径中各基因的协调表达,以实现产物合成和细胞生长的最佳平衡策略。此外,本研究为实验室摇瓶条件下的初步发酵培养,所用的发酵培养基比较简单,在后期的研究中还需要加强对培养基的成分、溶氧量和pH等发酵条件的优化,以及通过上述提到的多种策略进一步改造重组菌株,以期进一步增加目标产物法尼醇的产量,提高工程菌的发酵生产性能,为实现工业化生产奠定基础。
| [1] | Belcher MS, Mahinthakumar J, Keasling JD. New frontiers: harnessing pivotal advances in microbial engineering for the biosynthesis of plant-derived terpenoids. Current Opinion in Biotechnology, 2020, 65: 88-93. DOI:10.1016/j.copbio.2020.02.001 |
| [2] | Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils-A review. Food and Chemical Toxicology, 2008, 46(2): 446-475. DOI:10.1016/j.fct.2007.09.106 |
| [3] | Wang CL, Kim JY, Choi ES, Kim SW. Microbial production of farnesol (FOH): current states and beyond. Process Biochemistry, 2011, 46(6): 1221-1229. DOI:10.1016/j.procbio.2011.02.020 |
| [4] | Tippmann S, Chen Y, Siewers V, Nielsen J. From flavors and pharmaceuticals to advanced biofuels: production of isoprenoids in Saccharomyces cerevisiae. Biotechnology Journal, 2013, 8(12): 1435-1444. DOI:10.1002/biot.201300028 |
| [5] | Niu FX, Lu Q, Bu YF, Liu JZ. Metabolic engineering for the microbial production of isoprenoids: carotenoids and isoprenoid-based biofuels. Synthetic and Systems Biotechnology, 2017, 2(3): 167-175. DOI:10.1016/j.synbio.2017.08.001 |
| [6] | Misawa N. Pathway engineering for functional isoprenoids. Current Opinion in Biotechnology, 2011, 22(5): 627-633. DOI:10.1016/j.copbio.2011.01.002 |
| [7] | Faulkner A, Chen X, Rush J, Horazdovsky B, Waechter CJ, Carman GM, Sternweis PC. The LPP1 and DPP1 gene products account for most of the isoprenoid phosphate phosphatase activities in Saccharomyces cerevisiae. The Journal of Biological Chemistry, 1999, 274(21): 14831-14837. DOI:10.1074/jbc.274.21.14831 |
| [8] | Song LS. A soluble form of phosphatase in Saccharomyces cerevisiae capable of converting farnesyl diphosphate into E, E-farnesol. Applied Biochemistry and Biotechnology, 2006, 128(2): 149-157. DOI:10.1385/ABAB:128:2:149 |
| [9] | Chae M, Han GS, Carman GM. The Saccharomyces cerevisiae actin patch protein App1p is a phosphatidate phosphatase enzyme. The Journal of Biological Chemistry, 2012, 287(48): 40186-40196. DOI:10.1074/jbc.M112.421776 |
| [10] | Karanasios E, Han GS, Xu Z, Carman GM, Siniossoglou S. A phosphorylation-regulated amphipathic helix controls the membrane translocation and function of the yeast phosphatidate phosphatase. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(41): 17539-17544. DOI:10.1073/pnas.1007974107 |
| [11] | Karanasios E, Barbosa AD, Sembongi H, Mari M, Han GS, Reggiori F, Carman GM, Siniossoglou S. Regulation of lipid droplet and membrane biogenesis by the acidic tail of the phosphatidate phosphatase Pah1p. Molecular Biology of the Cell, 2013, 24(13): 2124-2133. DOI:10.1091/mbc.e13-01-0021 |
| [12] | Cheng AX, Xiang CY, Li JX, Yang CQ, Hu WL, Wang LJ, Lou YG, Chen XY. The rice (E)-β-caryophyllene synthase (OsTPS3) accounts for the major inducible volatile sesquiterpenes. Phytochemistry, 2007, 68(12): 1632-1641. DOI:10.1016/j.phytochem.2007.04.008 |
| [13] | Chen X, Wang YW, Sun J, Wang J, Xun H, Tang F. Cloning, expression and functional characterization of two sesquiterpene synthase genes from moso bamboo(Phyllostachys edulis). Protein Expression and Purification, 2016, 120: 1-6. DOI:10.1016/j.pep.2015.11.019 |
| [14] | Asadollahi MA, Maury J, Møller K, Nielsen KF, Schalk M, Clark A, Nielsen J. Production of plant sesquiterpenes in Saccharomyces cerevisiae: effect of ERG9 repression on sesquiterpene biosynthesis. Biotechnology and Bioengineering, 2008, 99(3): 666-677. DOI:10.1002/bit.21581 |
| [15] | Muramatsu M, Ohto C, Obata S, Sakuradani E, Shimizu S. Various oils and detergents enhance the microbial production of farnesol and related prenyl alcohols. Journal of Bioscience and Bioengineering, 2008, 106(3): 263-267. DOI:10.1263/jbb.106.263 |
| [16] | Muramatsu M, Ohto C, Obata S, Sakuradani E, Shimizu S. Alkaline pH enhances farnesol production by Saccharomyces cerevisiae. Journal of Bioscience and Bioengineering, 2009, 108(1): 52-55. DOI:10.1016/j.jbiosc.2009.02.012 |
| [17] | Ohto C, Muramatsu M, Obata S, Sakuradani E, Shimizu S. Overexpression of the gene encoding HMG-CoA reductase in Saccharomyces cerevisiae for production of prenyl alcohols. Applied Microbiology and Biotechnology, 2009, 82(5): 837-845. DOI:10.1007/s00253-008-1807-5 |
| [18] | Hashida-Okado T, Ogawa A, Kato I, Takesako K. Transformation system for prototrophic industrial yeasts using the AUR1 gene as a dominant selection marker. FEBS Letters, 1998, 425(1): 117-122. DOI:10.1016/S0014-5793(98)00211-7 |
| [19] | Gietz RD, Schiestl RH. Large-scale high-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nature Protocols, 2007, 2(1): 31-34. DOI:10.1038/nprot.2007.13 |
| [20] | Rodriguez S, Kirby J, Denby CM, Keasling JD. Production and quantification of sesquiterpenes in Saccharomyces cerevisiae, including extraction, detection and quantification of terpene products and key related metabolites. Nature Protocols, 2014, 9(8): 1980-1996. DOI:10.1038/nprot.2014.132 |
| [21] | Fischer MJC, Meyer S, Claudel P, Bergdoll M, Karst F. Metabolic engineering of monoterpene synthesis in yeast. Biotechnology and Bioengineering, 2011, 108(8): 1883-1892. DOI:10.1002/bit.23129 |
| [22] | Jiang GZ, Yao MD, Wang Y, Zhou L, Song TQ, Liu H, Xiao WH, Yuan YJ. Manipulation of GES and ERG20 for geraniol overproduction in Saccharomyces cerevisiae. Metabolic Engineering, 2017, 41: 57-66. DOI:10.1016/j.ymben.2017.03.005 |
| [23] | Westfall PJ, Pitera DJ, Lenihan JR, Eng D, Woolard FX, Regentin R, Horning T, Tsuruta H, Melis DJ, Owens A, Fickes S, Diola D, Benjamin KR, Keasling JD, Leavell MD, McPhee DJ, Renninger NS, Newman JD, Paddon CJ. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(3): E111-E118. DOI:10.1073/pnas.1110740109 |
| [24] | Scalcinati G, Knuf C, Partow S, Chen Y, Maury J, Schalk M, Daviet L, Nielsen J, Siewers V. Dynamic control of gene expression in Saccharomyces cerevisiae engineered for the production of plant sesquitepene α-santalene in a fed-batch mode. Metabolic Engineering, 2012, 14(2): 91-103. DOI:10.1016/j.ymben.2012.01.007 |
| [25] | Parveen I, Wang M, Zhao JP, Chittiboyina AG, Tabanca N, Ali A, Baerson SR, Techen N, Chappell J, Khan IA, Pan ZQ. Investigating sesquiterpene biosynthesis in Ginkgo biloba: molecular cloning and functional characterization of (E, E)-farnesol and α-bisabolene synthases. Plant Molecular Biology, 2015, 89(4/5): 451-462. |
| [26] | Guo R, Ding MZ, Yuan YJ. Construction of artificial yeast cell for producing amorphadiene, and optimization of fermentation. CIESC Journal, 2015, 66(1): 378-385. |
| [27] |
Guo R, Ding MZ, Yuan YJ. Construction of artificial yeast cell for producing amorphadiene, and optimization of fermentation. CIESC Journal, 2015, 66(1): 378-385.
(in Chinese) 郭睿, 丁明珠, 元英进. 产青蒿二烯的人工酵母细胞的构建及发酵优化. 化工学报, 2015, 66(1): 378-385. |
| [28] | Chen Y, Daviet L, Schalk M, Siewers V, Nielsen J. Establishing a platform cell factory through engineering of yeast acetyl-CoA metabolism. Metabolic Engineering, 2013, 15: 48-54. DOI:10.1016/j.ymben.2012.11.002 |
| [29] | Ro DK, Paradise EM, Ouellet M, Fisher KJ, Newman KL, Ndungu JM, Ho KA, Eachus RA, Ham TS, Kirby J, Chang MCY, Withers ST, Shiba Y, Sarpong R, Keasling JD. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086): 940-943. DOI:10.1038/nature04640 |
 2021, Vol. 61
2021, Vol. 61