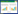中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 虞梦雪, 王教瑜, 王士臻, 李玲, 王艳丽, 孙国昌. 2021
- Mengxue Yu, Jiaoyu Wang, Shizhen Wang, Ling Li, Yanli Wang, Guochang Sun. 2021
- 灰葡萄孢菌过氧化物酶体及细胞核的荧光蛋白标记
- Fluorescent labeling of peroxisome and nucleus in Botrytis cinerea
- 微生物学报, 61(5): 1246-1256
- Acta Microbiologica Sinica, 61(5): 1246-1256
-
文章历史
- 收稿日期:2020-06-02
- 修回日期:2020-07-25
- 网络出版日期:2020-08-05
2. 浙江省农业科学院植物保护与微生物研究所, 农产品质量安全危害因子与风险防控国家重点实验室, 浙江 杭州 310021
2. State Key Laboratory for Managing Biotic and Chemical Threats to the Quality and Safety of Agro-products, Institute of Plant Protection Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, Zhejiang Province, China
灰葡萄孢菌(Botrytis cinerea)又称灰霉菌,属子囊菌门(Ascomycota)、核盘菌科(Sclerotiniaceae)、葡萄孢属(Botryotinia),引起葡萄、番茄和莴苣等1400种植物灰霉病。灰霉病在世界范围内广泛发生,严重影响作物产量和质量。在侵染过程中,灰葡萄孢菌产生各种酶类降解细胞壁等植物组织,引起植物幼苗猝倒、落叶、花腐烂,收获后还能引起果实烂窖,造成巨大的经济损失[1]。此外,灰葡萄孢菌还能产生许多有毒性的次级代谢产物,影响人畜健康。自20世纪80年代以来,我国保护地蔬菜生产大面积发展,大棚内温度较低、湿度较高,特别适合灰葡萄孢菌的快速繁殖和传播,灰霉病成为保护地常见危害严重的病害之一[1]。目前对灰霉病多采用化学农药防治,该防治方法难以彻底切断传染源和消灭病原菌[2],同时带来了严重的环境问题。灰葡萄孢菌致病过程和机理的研究是防治灰霉病和新型药剂开发的前提条件。
近年来,灰葡萄孢菌侵染的细胞学过程和致病的分子机理研究取得了较大的进展,多个致病相关的代谢途径及与寄主互作的机制得到鉴定。但相对于稻瘟病菌、禾谷镰刀菌等植物病原真菌,灰葡萄孢菌致病机理的研究仍有更长的路[3]。灰葡萄孢菌的细胞是多核的,一个菌丝和孢子细胞中含有5–6个细胞核。生长发育和致病过程中细胞核分裂、分配及动态的研究,对揭示灰葡萄孢菌致病机制具有重要意义,但至目前国内外与之相关的报道仍较少。过氧化物酶体是真核生物中普遍存在的一种代谢活跃、高度动态变化的单层膜包被的细胞器,主要参与脂肪等物质的代谢及活性氧的产生和清除。研究表明,过氧化物酶体参与稻瘟病菌、炭疽病菌和禾谷镰刀菌等多种植物病原真菌的生长发育、产孢、侵入和寄生等各个侵染环节[2]。灰葡萄孢菌中过氧化物酶体的分布、动态及与致病性的关系,至今尚未见报道。
绿色荧光蛋白(green fluorescent protein,GFP)和红色荧光蛋白(red fluorescent protein,RFP)作为荧光蛋白标记,具有安全、稳定等优点,被广泛应用研究基因表达调控及微生物定殖、侵染和植物信号转导等领域[3-10]。通过GFP、RFP (DsRED或mCherry)与过氧化物酶体定位信号融合,与核蛋白或核定为信号融合能够有效地实现多种生物细胞中过氧化物酶体或细胞核荧光标记。组蛋白(histone)是真核生物中的一种碱性蛋白,主要位于细胞核,和DNA共同组成核小体结构在基因调控中发挥作用,可被用于细胞核荧光标记研究中[11]。
为了研究灰葡萄孢菌的细胞核和细胞器的动态,本文以GFP-PTS1[12]、DsRED-PTS1[12]和mCherry-H2B[13-14]作为荧光标记,通过根癌农杆菌介导转化(Agrobacterium tumefaciens mediated transformation,AtMT)将标记载体导入灰葡萄孢菌标准菌株B05.10中,获得了3种过氧化物酶体及细胞核红色或绿色荧光标记的灰葡萄孢菌菌株,并结合化学荧光染色剂对标记菌株进行观察。同时,抽检了转化子菌株的遗传稳定性,将转化子纯化后建立了灰葡萄孢菌株AtMT转化子库。为进一步研究灰葡萄孢菌生长发育和侵染的细胞学和分子机制提供了基础和工具。
1 材料和方法 1.1 菌株及培养条件灰葡萄孢菌B05.10菌株及各转化子菌株培养在完全培养基(complete medium,CM)[15]上,在23 ℃、12 h/12 h光暗交替条件下培养8 d。供试菌株及质粒见表 1。
| Strains and plasmids | Usage | Features |
| A. tumefaciens strain AGL1 | AtMT | |
| B05.10 | Wild type strain | A standard strain for B. cinerea |
| pHMGA | Labeling peroxisome | Containing GFP-PTS1 and hygromycin resistance gene[12] |
| pHMR1 | Labeling peroxisome | Containing DsRED-PTS1 and hygromycin resistance gene[12] |
| pKD9-mCherry-H2B* | Labeling nucleus | Containing mCherry-H2B and hygromycin resistance gene |
| *: A gift from Dr. Jianping Lu in Zhejiang University[13-14]. | ||
利用脂类物质(Tween 80)诱导过氧化物酶体的增殖。将转化子接种在含有1% Tween 80的CM培养基上,在23 ℃、12 h/12 h光暗交替条件下培养5 d,挑取菌丝和孢子,在显微镜下观察转化子荧光。
1.2 AtMT与转化子筛选通过AtMT[16-17]转化将pHMGA、pHMR1和pKD9-mCherry-H2B分别导入到B05.10中。农杆菌菌株在含50 μg/mL氨苄青霉素、50 μg/mL利福平和50 μg/mL卡那霉素的YEB液体培养基中,28 ℃、180 r/min黑暗条件下培养2 d。取在CM培养基上,23 ℃、12 h/12 h光暗交替条件下培养8 d的B05.10菌落,洗取孢子,配制成1×106个/mL的孢子液,与农杆菌在IM培养基上[13]进行共培养2 d,在含250 μg/ mL潮霉素B (Roche,Mannheim,Germany)的CM培养基平板上筛选转化子。
1.3 转化子的继代稳定性以BC-HMGA转化子为例进行遗传稳定性检测(图 1)。随机选择5个经抗性筛选和荧光镜检具有明亮荧光表达的BC-HMGA转化子(T0),打取菌落边缘进行继代,各5个重复,获得25个后代转化子(T1);观察每个T1转化子的荧光,将具有荧光表达的T1转化子,各继代1个获得T2代;依次类推,继至T7代;统计丧失荧光的后代转化子个数和出现的代数。

|
| 图 1 BC-HMGA荧光转化子的稳定性检测 Figure 1 Stability of the fluorescent transformants of BC-HMGA. The BC-HMGA strains (T0 generation) expressing bright fluorescence were randomly selected and sub-cultured to produce T1 generation strains, five replicates for each T0 strain. The T1 strains that expressing fluorescence were then sub-cultured to generate T2 strains, one T2 strain for each T1. Analogously, the strains were sub-cultured up to T7 generation. The offspring stains with or without fluorescence were counted. |
1.4 单孢分离纯化与PCR验证
采用在抗性平板上单孢分离的方法对转化子进行纯化。在无菌条件下,将转化子孢子液浓度调至2×106个/mL,在含250 μg/mL潮霉素的CM培养基平板上涂布均匀,置23 ℃、12 h/12 h光暗交替条件下培养1 d后挑取50个以上的单菌落接种在新的CM平板上培养8 d,荧光显微镜下观察荧光表达,并记录可表达荧光的后代个数,分离纯化1代。
随机挑取3个经单孢纯化过的转化子菌落,采用CTAB (十六烷基三甲基溴化铵)法[18]提取基因组DNA,根据pHMGA、pHMR1和pKD9- mCherry-H2B载体上相应的基因片段设计引物(序列见表 2),进行PCR检测。以野生菌株B05.10基因组DNA为阴性对照,转化子所含质粒DNA为阳性对照。
| Names | Sequences | Amplicons and lengths |
| HPH52 | 5′-AGCTGCGCCGATGGTTTCTACAA-3′ | HPH gene fragment, 585 bp |
| HPH34 | 5′-GCGCGTCTGCTGCTCCATACAA-3′ | |
| MPG11 | 5′-TCACGACTGGGAGTAGAAAGA-3′ | Fragment of MPG1 gene promoter, 976 bp |
| MPG12 | 5′-CCAGATTCCAGGGTTGCTAAA-3′ | |
| GFP-CHK1 | 5′-GCCACCTACGGCAAGCTGACCCTG-3′ | GFP gene fragment, 502 bp |
| GFP-CHK2 | 5′-GGGTGCTCAGGTAGTGGTTGTCGG-3′ | |
| RED1 | 5′-GATGGTGTAGTCCTCGTTGTG-3′ | Fragments of DsRed or mCherry genes, 368 bp |
| RED2 | 5′-GACTACTTGAAGCTGTCCTTCC-3′ |
1.5 荧光染色与观察
挑取少量培养5 d的转化子菌丝或孢子,滴加10 μL 50 μg/mL的DAPI染色液,观察细胞核产生的蓝色荧光[14];或滴加10 μL 10 μg/mL的Calcofluor white染色液,观察细胞壁产生的蓝色荧光[10]。
利用ZEISS荧光共聚焦显微镜观察转化子荧光。观察红色荧光选择激发波长543 nm、发射波长570–630 nm;观察绿色荧光选择激发波长488 nm、发射波长495–550 nm,观察蓝色荧光选择激发波长405 nm、发射波长410–480 nm。
1.6 菌株表型比较待测菌株接种到CM培养基平板上培养3 d,在菌落生长边缘打直径0.5 cm的菌饼,转接到新的CM培养基平板上,每个处理3个重复,置23 ℃光暗交替培养,每隔12 h测量菌落直径,记录并统计生长速率差异,并比较菌核生长情况。在菌落生长边缘打直径0.5 cm的菌饼,倒扣接种到大小均匀、针头创伤的小番茄上,每个处理3个重复,置23 ℃光暗交替培养3 d,观察记录发病情况。
2 结果和分析 2.1 转化子稳定性与单孢纯化通过AtMT将pHMGA、pHMR1和pKD9- mCherry-H2B分别转导灰葡萄孢菌B05.10菌株中,利用潮霉素抗性筛选获得BC-HMGA、BC-HMR1和BC-mCherry-H2B转化子。为了明确转化子的遗传稳定性,随机选择经初步镜检能够高表达绿色荧光的5个BC-HMGA转化子(T0代)转接继代7代,观察各代转化子的荧光。结果发现,在25个T1代转化子中,有3个丧失荧光,至T2代,能发光的后代转化子还剩20个,继代至T7代,25个转化子中的7个转化子出现荧光消失。而对荧光消失的转化子另外继代,经2代后,荧光无法恢复。结果表明,按常规的方法进行灰葡萄孢菌转化子的转接继代,会导致转化子荧光标记丢失。灰葡萄孢菌转化子的遗传不稳定性可能与其多核特性有关。
为了获得稳定的转化子,在潮霉素抗性的CM培养基平板上对BC-HMGA、BC-HMR1和BC-mCherry-H2B转化子进行单孢分离1代,每个转化子挑取后代菌株50个以上,荧光镜检表明所有后代菌株均能保持荧光表达,且在CM培养基平板上重复继代过程中荧光稳定。结果表明通过抗性板上的单孢继代,能够获得稳定的荧光转化子。
2.2 转化子的PCR验证随机挑取经上述单孢继代2代的BC-HMGA、BC-HMR1和BC-mCherry-H2B后代转化子,进行PCR检测。结果显示所有转化子中均可扩增获得潮霉素抗性基因片段和MPG1启动子基因片段;BC-HMGA、BC-HMR1和BC-mCherry-H2B中可分别扩增获得GFP、DsRED和mCherry基因片段;各片段大小均与对应阳性对照相同,而野生型菌株对照中无扩增条带(图 2)。结果表明,潮霉素抗性基因和荧光标记基因均已成功整合入所检测的单孢转化子。

|
| 图 2 转化子的PCR检测 Figure 2 Confirmation of the fluorescent transformants using PCR amplification. The randomly selected BC-HMGA (A: 1-1–1-3), BC-HMR1 (B: 2-1–2-3) and BC-mCherry-H2B (C: 3-1–3-3) transformants, three for each, were checked by PCR amplification with the primer pairs HPH52/HPH34, GFP-CHK1/GFP-CHK2 and RED1/RED to detect HPH, GFP, RFP and mCherry fragments respectively. B05.10: the wild type strain; positive a, b and c: the positive controls with the plasmids pHMGA, pHMR1 and pKD9-mCherry-H2B as templates; M: marker Ⅲ. |
2.3 细胞核的荧光标记
挑取经验证的转化子,在荧光共聚焦下观察荧光表达与定位情况,可见在BC-mCherry-H2B转化子中,在H3启动子的作用下,mCherry-H2B融合蛋白呈现高亮度的红色荧光。在孢子和菌丝细胞中,mCherry-H2B融合蛋白集中分布于细胞内部3–10个大小1.0–1.5 μm的圆点上。这些圆点与细胞核DAPI染色形成的蓝色荧光重叠(图 3),表明mCherry-H2B蛋白成功标记于灰葡萄孢菌的细胞核。

|
| 图 3 mCherry-H2B荧光标记灰葡萄孢菌的细胞核 Figure 3 Fluorescent labeling of the nuclei of B. cinerea with mCherry-H2B. |
2.4 过氧化物酶体的荧光标记
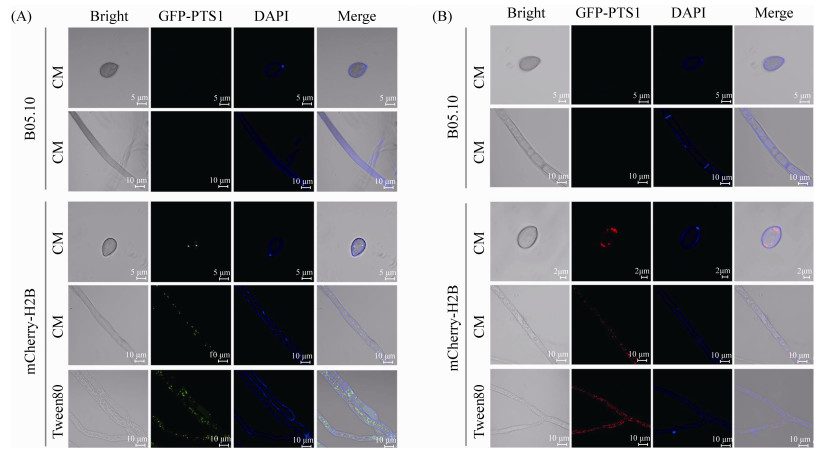
观察BC-HMGA和BC-HMR1转化子可见,在MPG1基因启动子的作用下,孢子和菌丝细胞中均能观察到GFP-PTS1的绿色荧光或DsRED-PTS1的红色荧光。荧光均呈小点状分布于细胞内部,直径0.2–1.0 μm,符合过氧化物酶体的大小和分布特征(图 4)。利用脂类物质(Tween 80)对转化子的菌丝进行诱导,可见细胞中荧光点的数量明显增加,与过氧化物酶体易被脂类物质诱导增殖的特性一致。结果表明,GFP-PTS1和DsRED-PTS1均可正确定位于灰葡萄孢菌的过氧化物酶体上。
|
| 图 4 灰葡萄孢菌过氧化物酶体的GFP-PTS1和DsRED-PTS1荧光标记 Figure 4 Fluorescent labeling of the peroxisomes with GFP-PTS1 and DsRED-PTS1 in B. cinerea. The BC-HMGA (A) and BC-HMR1 (B) transformants were stained with Calcofluor white (CFW) and microscopically detected. The GFP- or DsRED-labeled peroxisomes were increased upon induction on Tween 80 containing media. |
进一步利用Calcofluor white (CFW)对BC-HMGA和BC-HMR1转化子的细胞壁进行染色,与荧光蛋白进行共定位(图 4),发现Calcofluor white的蓝色荧光与GFP-PTS1和DsRED-PTS1的荧光无明显干扰,呈现出理想的定位效果。
2.5 转化子表型比较通过转化,在荧光定位的同时也获得了1个灰葡萄孢菌的随机插入转化子库,以便进一步研究功能基因。随机挑取BC-HMGA、BC-HMR1和BC-mCherry-H2B转化子各10个,初步观察转化子表型。结果显示,大部分参试转化子的菌落形态、生长速率、菌核生长和致病性等表型均与B05.10无明显差异;少数转化子呈现出生长速度减慢、气生菌丝减少等(图 5)。结果表明,外源基因的随机插入引起转化子表型变异是低概率事件,多数的荧光转化子可模拟野生型中的细胞器动态;同时通过筛选,可获得特定的表型变异转化子,为功能基因的鉴定和研究奠定基础。

|
| 图 5 部分转化子的表型分析 Figure 5 Phenotypes of transformants. The randomly selected BC-HMGA, BC-HMR1 and BC-mCherry-H2BA transformants were phenotypically analyzed. A: the colonies of the transformants cultured on CM and the pathogenicity of the transformants to tomato fruits. B: The radial growth of the strains cultured on CM for 3 days. The standard deviation represents the growth rate difference among the three replicates of each transformant. |
3 讨论
相对于稻瘟病菌、禾谷镰刀病菌等植物病原真菌,灰葡萄孢菌侵染分子机理的研究较少。此前,沈卫锋等[17]成功将GFP导入灰葡萄孢菌,但利用荧光蛋白标记灰葡萄孢菌细胞器的研究尚不多见[19]。本研究利用GFP和红色荧光蛋白DsRED、mCherry首次成功标记了灰葡萄孢菌的过氧化物酶体和细胞核,这也是利用红色荧光蛋白对灰葡萄孢菌进行荧光标记的首次报道。研究获得的荧光转化子,为研究灰葡萄孢菌的生长发育与致病过程及分子机制提供了参考和材料。
稻瘟病菌附着胞形成过程中,细胞核的分裂以及向子细胞的分配,存在着精准的调控。过氧化物酶体的形成与生化代谢对稻瘟病菌、炭疽病菌的侵染过程必不可少[20]。但至目前,灰葡萄孢菌过氧化物酶体的形成过程、相关基因以及与致病性的关系,尚无报道。另外,作为一种多核的真菌,其细胞核的分裂、分离和调控机制可能更加复杂。本研究获得的转化子荧光的亮度高、分散性和精细度好,能很好地对灰葡萄孢菌细胞核和过氧化物酶体的位置、大小、移动等进行示踪,为进一步研究灰葡萄孢菌的细胞和细胞核发育、过氧化物酶体形成与动态以及相关基因在灰葡萄孢菌侵染过程中的作用提供了基础和工具。
合适启动子是调控真菌蛋白表达、进行荧光蛋白标记的基础。我们的结果表明,来源于稻瘟病菌的H3、MPG1启动子除了在异源真菌西瓜枯萎病菌中得到利用,还可实现在其他异源真菌中利用[12]及其荧光蛋白在灰葡萄孢菌中的高丰度表达[13, 21]。转化子孢子和菌丝中荧光亮度高、定位准确[21]。我们的结果,也为真菌启动子的发掘利用和真菌蛋白表达的研究提供了参考。
本研究结果发现,与稻瘟病菌、禾谷镰刀病菌等转化效率大于60%的丝状真菌相比,灰葡萄孢菌的转化效率偏低[18, 22],转化子的遗传稳定性较差,原因可能是由于该菌的多核性,建议灰葡萄孢菌的转化过程中,通过在抗性平板上单孢继代获得遗传稳定的转化子[23]。本研究获得的转化子,大部分菌落形态、生长速度和产孢量等性状与野生型均无明显差异,说明在大多数的转化子中,转化过程本身以及潮霉素基因和融合蛋白基因的表达,对转化子的生长发育并没有明显影响,这样的转化子可用于进一步的分子生物学研究。少数转化子呈现出表型变异,可能是外源基因整合到受体染色体上时整合的状态以及整合的位置等均不易控制。
| [1] | 席雪丽. 灰霉菌侵染拟南芥过程中ACD5的功能分析. 中山大学硕士学位论文, 2011. |
| [2] | 冯会强. 灰葡萄孢菌隔膜蛋白septin的生物学功能解析. 吉林大学硕士学位论文, 2017. |
| [3] |
Zhao JJ, Wang S, Wang Q, Mei RH. Cloning of promoter fragment from Panebacillus polymyxa M-1 and expression of its green fluorescent protein. Journal of Agricultural Biotechnology, 2010, 18(4): 788-792.
(in Chinese) 赵婧婧, 王爽, 王琦, 梅汝鸿. 多粘类芽胞杆菌菌株M-1启动子片段的克隆及绿色荧光蛋白的表达. 农业生物技术学报, 2010, 18(4): 788-792. DOI:10.3969/j.issn.1674-7968.2010.04.026 |
| [4] |
Shen WF, Niu BL, Weng HB, Liu Y, He LH, Meng QZ. Use of green fluorescent protein gene to label Bacillus subtilis strains. Acta Agriculturae Zhejiangensis, 2009, 21(3): 202-206.
(in Chinese) 沈卫锋, 牛宝龙, 翁宏飚, 刘岩, 何丽华, 孟智启. 绿色荧光蛋白基因标记枯草芽孢杆菌研究. 浙江农业学报, 2009, 21(3): 202-206. DOI:10.3969/j.issn.1004-1524.2009.03.004 |
| [5] | Piscitelli A, Pennacchio A, Cicatiello P, Politi J, De Stefano L, Giardina P. Rapid and ultrasensitive detection of active thrombin based on the Vmh2 hydrophobin fused to a green fluorescent protein. Biosensors and Bioelectronics, 2017, 87: 816-822. DOI:10.1016/j.bios.2016.09.052 |
| [6] | Kono J, Konno K, Talukder AH, Fuse T, Abe M, Uchida K, Horio S, Sakimura K, Watanabe M, Itoi K. Distribution of corticotropin-releasing factor neurons in the mouse brain: a study using corticotropin-releasing factor-modified yellow fluorescent protein knock-in mouse. Brain Structure and Function, 2017, 222(4): 1705-1732. DOI:10.1007/s00429-016-1303-0 |
| [7] | Vieira J, O'Hearn PM. Use of the red fluorescent protein as a marker of Kaposi's sarcoma-associated herpesvirus lytic gene expression. Virology, 2004, 325(2): 225-240. DOI:10.1016/j.virol.2004.03.049 |
| [8] | Lippincott-Schwartz J, Patterson GH. Development and use of fluorescent protein markers in living cells. Science, 2003, 300(5616): 87-91. DOI:10.1126/science.1082520 |
| [9] | Martinez-Jaramillo E, Garza-Morales R, Loera-Arias MJ, Saucedo-Cardenas O, Montes-de-Oca-Luna R, McNally LR, Gomez-Gutierrez JG. Development of Lactococcus lactis encoding fluorescent protein, GFP, mCherry and iRFP regulated by the nisin-controlled gene expression system. Biotechnic and Histochemistry, 2017, 92(3): 167-174. DOI:10.1080/10520295.2017.1289554 |
| [10] | Nagata T, Takebe I. Cell wall regeneration and cell division in isolated tobacco mesophyll protoplasts. Planta, 1970, 92(4): 301-308. DOI:10.1007/BF00385097 |
| [11] | Talbot NJ, Ebbole DJ, Hamer JE. Identification and characterization of MPG1, a gene involved in pathogenicity from the rice blast fungus Magnaporthe grisea. The Plant Cell, 1993, 5(11): 1575-1590. |
| [12] |
Shi XX, Wang JY, Xiao CW, Wang YL, Li DY, Chai RY, Sun GC. Fluorescent labeling the peroxisome and nucleus in Fusarium oxysporum f. sp. niveum. Chinese Journal of Cell Biology, 2020, 42(2): 195-203.
(in Chinese) 施笑笑, 王教瑜, 肖琛闻, 王艳丽, 李大勇, 柴荣耀, 孙国昌. 利用荧光蛋白标记西瓜枯萎病菌的过氧化物酶体及细胞核. 中国细胞生物学学报, 2020, 42(2): 195-203. |
| [13] | 周庆新. 丝状真菌遗传转化系统的建立. 山东农业大学硕士学位论文, 2007. |
| [14] | Degefu Y, Hanif M. Agrobacterium-tumefaciens-mediated transformation of Helminthosporium turcicum, the maize leaf-blight fungus. Archives of Microbiology, 2003, 180(4): 279-284. DOI:10.1007/s00203-003-0589-5 |
| [15] | Rho HS, Kang S, Lee YH. Agrobacterium tumefaciens-mediated transformation of the plant pathogenic fungus, Magnaporthe grisea. Molecules and Cells, 2001, 12(3): 407-411. |
| [16] |
Shen WF, Weng HB, Niu BL, He LH, Liu Y, Qi XP, Meng ZQ. Agrobacterium tumefaciens-mediated transformation of the pathogen of Botrytis cinerea. Hereditas, 2008, 30(4): 515-520.
(in Chinese) 沈卫锋, 翁宏飚, 牛宝龙, 何丽华, 刘岩, 齐晓朋, 孟智启. 根癌农杆菌介导的灰葡萄孢菌遗传转化研究. 遗传, 2008, 30(4): 515-520. DOI:10.3321/j.issn:0253-9772.2008.04.020 |
| [17] |
Xu YP, Zheng XH, Fang CZ, Weng LB, Huang LY. A methodology study on elimination the influence of dead cells stained with DAPI. Progress in Modern Biomedicine, 2019, 19(9): 1660-1664.
(in Chinese) 许雅苹, 郑晓辉, 房纯正, 翁乐斌, 黄黎月. DAPI染色法在流式细胞术中去除死细胞影响的探讨. 现代生物医学进展, 2019, 19(9): 1660-1664. |
| [18] |
Gao BD, Zhong J, Zhao HR. Application of fluorescence protein reporter gene in research of plant parasitic fungi. Biotechnology Bulletin, 2011(9): 32-38.
(in Chinese) 高必达, 钟杰, 赵慧茹. 荧光蛋白报告基因在植物寄生真菌研究中的应用. 生物技术通报, 2011(9): 32-38. |
| [19] | Wang JY, Wu XY, Zhang Z, Du XF, Chai RY, Liu XH, Mao XQ, Qiu HP, Wang YL, Lin FC, Sun GC. Fluorescent co-localization of PTS1 and PTS2 and its application in analysis of the gene function and the peroxisomal dynamic in Magnaporthe oryzae. Journal of Zhejiang University Science B, 2008, 9(10): 802-810. DOI:10.1631/jzus.B0860001 |
| [20] | 曹胜男. 致病相关因子BcNop53和BcSnf2调控灰葡萄孢菌生长发育及致病性机理研究. 吉林大学博士学位论文, 2018. |
| [21] | 刘海青. 农杆菌介导的禾谷镰刀菌的遗传转化及转化子性质的初步研究. 浙江大学硕士学位论文, 2006. |
| [22] | 王宏宇. 稻瘟病菌T-DNA插入突变研究. 福建农林大学博士学位论文, 2003. |
| [23] |
Peng HY, Yu LJ. Integration pattern and character of exogenous genes in transgenic plants. Heilongjiang Agricultural Sciences, 2011(1): 25-27.
(in Chinese) 彭洪雨, 于丽杰. 植物转基因的整合特性及遗传分析. 黑龙江农业科学, 2011(1): 25-27. DOI:10.3969/j.issn.1002-2767.2011.01.008 |
 2021, Vol. 61
2021, Vol. 61