中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 谭格, 李天铭, 周志成, 李江舟, 张立猛, 黄智华. 2021
- Ge Tan, Tianming Li, Zhicheng Zhou, Jiangzhou Li, Limeng Zhang, Zhihua Huang. 2021
- 金龟子绿僵菌对斜纹夜蛾幼虫的生防效果、抗氧化酶活性和肠道细菌群落的影响
- Biocontrol of Spodoptera litura larvae by Metarhizium anisopliae
- 微生物学报, 61(5): 1171-1183
- Acta Microbiologica Sinica, 61(5): 1171-1183
-
文章历史
- 收稿日期:2020-05-10
- 修回日期:2020-07-27
- 网络出版日期:2020-08-06
2. 湖南省烟草科学研究所, 湖南 长沙 410004;
3. 云南省烟草公司玉溪市公司, 云南 玉溪 653100;
4. 烟草行业病虫害生物防治工程研究中心, 云南 玉溪 653100
2. Insitute of Hunan Provincial Tobacco Science Research, Changsha 410004, Hunan Province, China;
3. Yunnan Tobacco Company, Yuxi Branch, Yuxi 653100, Yunnan Province, China;
4. Biological Control for Tobacco Diseases and Insect Pests Engineering Research Center of China Tobacco, Yuxi 653100, Yunnan Province, China
斜纹夜蛾(Spodoptera litura [Fabricius])是鳞翅目(Lepidoptera)斜纹夜蛾属的一种农林业害虫,虫害在世界各地都有发生。斜纹夜蛾幼虫达到4–5龄时食量大幅提升,成为一种暴食性害虫,并且食性杂可以取食烟草等300多种植物[1]。金龟子绿僵菌(Metarhizium anisopliae)是从奥地利金龟子死虫体上分离出的一株真菌[2]。其目前比较公认的系统分类是与白僵菌同属真菌门(Eumycota),而不同的是金龟子绿僵菌属于核菌纲(Pyrenomycetes)、球壳菌目(Sphaerizles)、麦角菌科(Clavicipitetaceae)[3]。研究表明绿僵菌属广谱致病菌,可以在鳞翅目等8个目30科的昆虫体内寄生[4]。
当昆虫受到外界的刺激或者药物危害的时候,其体内存在的保护酶系统就会被激活,通过产生超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶使昆虫体内处于失衡状态的自由基浓度恢复平衡,从而使虫体免受药物以及其他逆境情况的危害[5-6]。昆虫体内的抗氧化酶活性与昆虫的代谢情况和抗逆境能力等关系密切,能够反映昆虫的抗性强弱,也是昆虫病理状态的重要指标之一[7-8]。斜纹夜蛾幼虫的肠道具有消化、防御等功能,是其体内的不可或缺的重要器官。昆虫肠道微生物组成的微系统对昆虫机体的生长发育情况、体内代谢机理都体现出十分重要的作用,同时对昆虫自身免疫系统也有着不可替代的作用。昆虫肠道有益微生物有提供营养物质,参与有害物质降解以及抵御外来寄生物以及病原菌等的入侵等功能。鉴于昆虫肠道微生物对寄主昆虫的重要作用,肠道微生物相对丰度、群落结构和功能的改变可能会导致宿主患病甚至死亡[9]。
目前关于绿僵菌对昆虫毒力和防治效果的研究较多,而对绿僵菌侵染后昆虫体内抗氧化酶活性和肠道微生物群落变化情况的报道还比较少见。为了进一步了解金龟子绿僵菌对斜纹夜蛾幼虫的生防效果和侵染后寄主体内抗氧化酶活性以及肠道内微生物群落的变化,通过测定金龟子绿僵菌对斜纹夜蛾2龄幼虫的毒力,以及侵染后SOD、CAT活性和肠道细菌群落变化,以期能为金龟子绿僵菌对斜纹夜蛾的防治和昆虫对致病菌侵染的防御机制研究提供理论指导。
1 材料和方法 1.1 供试菌株和试虫饲养金龟子绿僵菌菌株:于土壤和死虫体内使用选择培养基筛选出,筛选出的金龟子绿僵菌都采用PDA基础培养基进行保存备用。
选择培养基:选用PDA为基础培养基,以加入氯霉素(chloramphenicol) 200 mg/L和放线菌酮(actidione) 100 mg/L作为选择培养基。
斜纹夜蛾幼虫由云南省烟草公司玉溪市公司提供,在人工气候养虫室内用人工饲料继代饲养,饲料配置参照文献[10]报道的方法进行。养虫室温度(28±1) ℃,相对湿度85%,光暗比14 h: 10 h。
1.2 金龟子绿僵菌孢悬液的配制菌株的培养:将菌株接种于PDA固体培养基上,在(25±1) ℃的培养箱中培养。
孢悬液的配制:将置于培养箱中的菌株取出,取灭菌后的0.05%吐温-80以10 mL的量加入斜面中并刮取孢子粉,待混匀后将其倒入无菌的离心管中,将金龟子绿僵菌孢子悬浮液配制成浓度为1.0×109个孢子/mL后,再取1 mL配制好的金龟子绿僵菌悬浮液,加入9 mL的0.05%吐温-80以配制浓度为1.0×108个孢子/mL的孢悬液,依次类推再配制1.0×107个孢子/mL、1.0×106个孢子/mL的孢悬液,采用血球板计数确定浓度。
1.3 金龟子绿僵菌对斜纹夜蛾的毒力测定采用浸渍法接种斜纹夜蛾幼虫。将健康的2龄斜纹夜蛾幼虫放入配制好的不同浓度梯度的孢悬液中浸渍20 s,然后让其在无菌的吸水滤纸上爬行晾干,再放入培养皿内用人工饲料饲养。每个处理20头幼虫,重复3次,空白对照使用0.05% 吐温-80无菌水处理。培养皿置于人工气候养虫室中,连续7 d每天2次每次间隔12 h定时观察试虫行为、记录死亡虫数,并及时清理虫尸,将虫尸置于25 ℃下保湿培养。
1.4 斜纹夜蛾幼虫处理分组随机选取相同大小、健康的2龄斜纹夜蛾幼虫作为处理前A组;经1.0×109个孢子/mL金龟子绿僵菌侵染后死亡的作为处理后致死B组;经1.0×109个孢子/mL金龟子绿僵菌侵染后仍存活的作为处理后未致死C组;使用0.05%吐温-80无菌水处理的作为空白对照D组(图 1)。

|
| 图 1 斜纹夜蛾幼虫处理分组情况 Figure 1 Treatments of S. litura larvae. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. |
1.5 抗氧化酶活性测定 1.5.1 粗酶液的提取:
对金龟子绿僵菌孢悬液处理前和处理后第4 d时的斜纹夜蛾幼虫分别取样3条,准确称取虫重。处理后致死组的幼虫选取的是第4天当天死亡的虫体,获得虫体后立即进行粗酶液的提取。采用0.05 mol/L (pH 7.0)的磷酸缓冲液(PBS)将虫体洗净并吸干水分,然后放入研钵中加入1 mL预冷的0.05 mol/mL PBS和1滴苯基硫脲于冰浴中研磨成浆,浆液转移至离心管中,并以PBS将研钵冲洗数次后,合并洗液于离心管。按5 mL/g体重补足缓冲液,于4 ℃、15000×g离心20 min,上清液即为粗酶液[11-13]。
1.5.2 氮蓝四唑光化学还原法[14]测定SOD活性:依次加入0.05 mol/L的PBS (pH 7.0) 1.75 mL,0.13 mol/L的甲硫氨酸0.03 mL,0.75 mmol/L的氯化硝基四氮唑蓝(NBT) 0.03 mL,0.10 mmol/L的乙二胺四乙酸二钠0.03 mL,粗酶液0.05 mL,最后加入0.02 mmol/L核黄素0.03 mL (对照管中粗酶液以0.05 mol/L的PBS pH 7.0代替)。将其中一支对照管避光处理20 min后用于调零,另一只对照管与待测酶活管置于光照培养箱中25 ℃、4000 lx反应20 min后。立即避光迅速测定560 nm处吸光值,计算酶活性,以NBT被抑制50%时所需粗酶液量为一个酶活性单位[15-16]。
1.5.3 分光光度法测定CAT活性:取30% H2O2 0.5 mL,以0.05 mol/L PBS (pH 7.0)定容至50 mL后,吸取3 mL于预热至25 ℃的试管中,加入0.05 mL粗酶液(使用0.05 mol/L PBS pH 7.0代替粗酶液进行校零),迅速混匀,立即于240 nm测定每分钟内光吸收度的减少值,共测4 min,计算酶活性。以每分钟吸光度降低0.1的酶量为一个酶活性单位[17]。
1.6 肠道微生物DNA的提取与测序在无菌条件下解剖出各处理4条斜纹夜蛾幼虫中肠,将分离的肠道放入0.05 mol/L的磷酸盐缓冲液中,然后充分的漩涡振荡,再经过短暂离心后将上清液转移至无菌的离心管中。处理后致死组在观察到斜纹夜蛾幼虫死亡后的第一时间进行了样品采集和保存,采集的斜纹夜蛾中肠样品冷冻保藏在–80 ℃冰箱中以便后续分子生物学分析,尽可能地避免体内腐生性细菌大量扩增造成影响。使用天根细菌基因组DNA试剂盒(天根生化科技北京有限公司)提取肠道总DNA,用NanoDrop ND-1000紫外可见分光光度计检验DNA的质量和浓度后保存于–20 ℃待用。采用引物515F (5ʹ-GTGCCAGCMGCCGCGGTAA-3ʹ)和806R (5ʹ-GGACTACHGGGTWTCTAAT-3ʹ)对细菌16S rRNA基因的V4区进行扩增。50 μL PCR反应体系包括25 μL PCR 2×master mix,正、反向引物(10 μmol/L)各1.5 μL,2 μL DNA模板(20– 30 ng/μL)和20 μL ddH2O。扩增反应的程序为94 ℃ 1 min;94 ℃ 20 s,57 ℃ 25 s,68 ℃ 45 s,循环30次;68 ℃ 10 min;4 ℃保存。用1.5%琼脂糖凝胶电泳检测PCR产物质量,利用Gel Extraction Kit D2500 (OMEGA公司)试剂盒切胶纯化PCR产物。根据纯化PCR产物的条带亮度及浓度计算混样体积并建库,每个样品的PCR产物加入量为200 ng,并于Illumina MiSeq平台测序。
1.7 数据统计分析采用Minitab统计软件对毒力实验数据进行统计分析,使用单因素方差分析的Turkey法进行多重比较检验。半致死时间(LT50)以及半致死浓度(LC50)的计算参考文献[18]报道的方法,通过建立直线回归模型分析时间效应LT50和剂量效应LC50。
测序结果通过Galaxy平台(http://zhoulab5.rccc.ou.edu/)识别、读取样品PCR引物不同的barcode序列,去除引物和质量较差的片段及序列拼接后。采用UPARSE将相似度大于97%的序列聚类成OTU表[19],使用RDP数据库注释[20],获得OTU表在50%置信区间的分类学信息。应用R语言(v 3.3.2)的vegan包(v 2.4.2)计算多样性指数和基于原始物种组成矩阵排序的主成分分析(PCA)来分析肠道细菌群落结构。微生物群落多样性和相对丰度差异显著性分析使用agricolae(v 1.3-0)包进行,一般在P < 0.05时认为有显著性差异。不相似性分析采用基于Bray-Curtis距离的非参数和参数检验。采用Origin 2019b作图。
2 结果和分析 2.1 金龟子绿僵菌对斜纹夜蛾幼虫的防治效果测定金龟子绿僵菌可以有效地感染斜纹夜蛾2龄幼虫,并造成致死,实验过程中我们发现斜纹夜蛾幼虫死亡初期身体僵硬,在室内25 ℃保湿培养,发现虫体上长出白色菌丝并产生绿色分生孢子。由此可证明是由金龟子绿僵菌感染了斜纹夜蛾幼虫,但在浓度较低时杀虫效果不明显。不同浓度的金龟子绿僵菌孢悬液对斜纹夜蛾2龄幼虫的校正死亡率如表 1所示,结果表明随着孢悬液浓度的增加,斜纹夜蛾2龄幼虫累计死亡率升高,孢悬液浓度为1.0×109个孢子/mL时校正死亡率达最大值81.03%。孢悬液浓度为1.0×109个孢子/mL和1.0×108个孢子/mL时死亡率并无显著性差异,而孢悬液浓度为1.0×109个孢子/mL死亡率显著高于1.0×107个孢子/mL和1.0×106个孢子/mL。当孢悬液浓度较高(≥1.0×107个孢子/mL)时,累计致死率在开始阶段上升速度很慢,随后变快,最后又变慢并渐趋于平稳(图 2)。
| Inoculation density (spores/mL) | Average mortality/% | Corrected mortality/% |
| 1.0×109 | 81.67 | 81.03±5.78a |
| 1.0×108 | 65.00 | 63.79±13.2a |
| 1.0×107 | 41.66 | 39.65±11.54b |
| 1.0×106 | 3.33 | 3.33±2.89c |
| The data in the table were observed for 7 consecutive days after treatment. Each strain tested 60 2nd instar larvae of S. litura, 20 larvae per treatment, and repeated three times. The data in the table are average (±standard deviation); different lowercase letters in the same column indicate significant differences between treatments at 0.05 level. | ||

|
| 图 2 金龟子绿僵菌孢悬液对斜纹夜蛾2龄幼虫的累计致死率 Figure 2 Accumulative mortality of Metarhizium anisopliae spore suspension to the 2nd instar larvae of S. litura. The points in the figure are average (±standard deviation). |
2.2 金龟子绿僵菌对斜纹夜蛾幼虫的致死中时
不同浓度的孢悬液对斜纹夜蛾2龄幼虫的毒力统计结果如表 2所示,线性回归分析采用的数据为图 2中折线图所表示的致死率数据。在金龟子绿僵菌的孢子浓度较低的情况下,斜纹夜蛾2龄幼虫的死亡率也相对较低,且致死中时有着明显的增加;而在其孢子浓度较高的情况下,对斜纹夜蛾2龄幼虫的致死率高,致死中时短,具体表现为LT50随着孢悬液浓度的降低而升高。在浓度为1.0×106个孢子/mL时因为未达到半数致死,结果无法进行统计。而随着孢悬液浓度的增加,斜纹夜蛾2龄幼虫的死亡速度也逐渐加快,LT50变小。当浓度为1.0×109个孢子/mL时,金龟子绿僵菌对斜纹夜蛾2龄幼虫的致死速度最快,LT50为4.6 d。
| Inoculation density/(spores/mL) | Regression equation | Correlation coefficient/R | LT50/d |
| 1.0×109 | Y= –0.1828+0.1482X | 0.9807 | 4.60±0.05c |
| 1.0×108 | Y= –0.1285+0.1200X | 0.9621 | 5.23±0.13b |
| 1.0×107 | Y= –0.1114+0.0757X | 0.9607 | 8.07±0.11a |
| 1.0×106 | Y= –0.0057+0.0039X | 0.7202 | – |
| The value Y means probit (%); X means time (d); LT50 was not determined due to the low mortality. The data in the table are average (±standard deviation); different lowercase letters in the same column indicate significant differences between treatments at 0.05 level. | |||
2.3 金龟子绿僵菌对斜纹夜蛾2龄幼虫的致死中浓度
对斜纹夜蛾2龄幼虫不同处理时间的毒力统计结果如表 3所示,通过对金龟子绿僵菌孢悬液浓度与致死率进行拟合回归方程,线性回归分析采用的数据为图 2中折线图所表示的致死率数据,从而来确定LC50。结果表明,随着处理的时间的增加,斜纹夜蛾幼虫的死亡数量逐渐变多,LC50变小。金龟子绿僵菌对斜纹夜蛾2龄幼虫的LC50分别是第7天为3.944×107个孢子/mL,第6天为6.025×107个孢子/mL,第5天为1.389×108个孢子/mL,第4天时因其累计致死率过低,故未能计算出LC50的值。即金龟子绿僵菌孢悬液处理斜纹夜蛾的时间越长,所需的致死中浓度越低。
| Treatment time/d | Regression equation | Correlation coefficient/R | LC50/(spores/mL) |
| 7 | Y= –1.460+0.258X | 0.9644 | 3.944×107 |
| 6 | Y= –1.415+0.246X | 0.9679 | 6.025×107 |
| 5 | Y= –1.145+0.202X | 0.9182 | 1.389×108 |
| 4 | Y= –0.760+0.131X | 0.9380 | – |
| The value Y means probit (%); X is the logarithm of concentration; LC50 of the 4d treatment was not determined due to the low mortality. | |||
2.4 金龟子绿僵菌对斜纹夜蛾2龄幼虫超氧化物歧化酶活性的影响
处理前后幼虫体内的SOD活性变化如图 3所示,处理前A组斜纹夜蛾2龄幼虫的SOD活性为1.5665±0.2651 U/mg,而处理后致死B组的SOD活性为1.9807±0.0629 U/mg,处理后未致死C组的SOD活性为2.5484±0.24 U/mg,而空白对照D组的SOD活性为1.7257±0.1043 U/mg。表明虫体在正常的生长过程中,其SOD活性无显著性差异。而处理后致死B组显著高于处理前A组,处理未致死C组的酶活性也显著高于其他三组。总体来看,金龟子绿僵菌侵染斜纹夜蛾2龄幼虫后使其体内SOD的活性得到了一定的提升。

|
| 图 3 金龟子绿僵菌对斜纹夜蛾幼虫的超氧化物歧化酶活性的影响 Figure 3 Effects of Metarhizium anisopliae on SOD activity of S. litura larvae. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. Different lowercase letters above the columns indicate significant differences between treatments at 0.05 level. |
2.5 金龟子绿僵菌对斜纹夜蛾2龄幼虫过氧化氢酶活性的影响
金龟子绿僵菌侵染斜纹夜蛾幼虫后其体内的CAT活性发生了一定的变化(图 4),处理前A组斜纹夜蛾2龄幼虫的CAT活性为5.0033±1.5106 U/mg,而处理后致死B组的CAT活性为1.8±0.7408 U/mg,处理后未致死C组的CAT活性为13.2067± 2.1277 U/mg,而空白对照D组的CAT活性为4.0500±1.8738 U/mg。感染金龟子绿僵菌而致死的处理B组,其CAT活性较处理未致死C组有显著性的降低,同样空白对照D组的CAT活性也显著低于处理未致死C组。斜纹夜蛾幼虫自然生长的CAT活性并无显著性差异,处理致死的B组与空白对照D组同样无显著性差异。

|
| 图 4 金龟子绿僵菌对斜纹夜蛾幼虫的过氧化氢酶活性的影响 Figure 4 Effects of Metarhizium anisopliae on CAT activity of S. litura larvae. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. Different lowercase letters above the columns indicate significant differences between treatments at 0.05 level. |
2.6 金龟子绿僵菌对斜纹夜蛾肠道细菌Alpha多样性影响
斜纹夜蛾幼虫肠道细菌Alpha多样性在处理后致死B组和未致死C组的样品中都发生了改变(表 4)。处理前A组和空白对照D组的多样性指数均无显著性差异,说明在斜纹夜蛾幼虫正常生长情况下,其肠道细菌的Alpha多样性并没有改变。处理后致死B组和未致死C组的肠道细菌的Alpha多样性之间无显著差异,但是处理后致死B组和未致死C组的Shannon指数和Pielou's evenness指数均显著高于处理前A组和空白对照D组。并且处理后致死B组的Simpson指数和Inverse Simpson指数也显著高于处理前A组和空白对照D组,而未致死C组的Simpson指数和Inverse Simpson指数仅显著高于处理前A组,与空白对照D组无显著差异。
| Treatments | Shannon | Simpson | Inverse Simpson | Pielou’s evenness |
| A | 0.66±0.34b | 0.30±0.22c | 1.55±0.51c | 0.21±0.12b |
| B | 1.44±0.26a | 0.65±0.10a | 3.00±0.79a | 0.44±0.04a |
| C | 1.23±0.10a | 0.59±0.03ab | 2.43±0.15ab | 0.38±0.03a |
| D | 0.77±0.21b | 0.39±0.16bc | 1.71±0.45bc | 0.24±0.06b |
| The data in the table are average (±standard deviation), and the different lowercase letters in the same column indicate significant differences between treatments at 0.05 level. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. | ||||
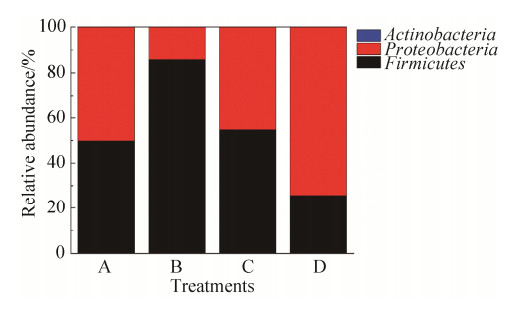
在处理前后的斜纹夜蛾幼虫肠道细菌群落中,门的分类上均表现出比较一致,优势菌都是变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),但在丰度上表现的却有所不同(图 5)。金龟子绿僵菌侵染后,Proteobacteria和Firmicutes在处理前A组、处理后致死B组与处理后未致死C组都无显著性差异,而处理后致死B组相较于空白对照D组Proteobacteria的相对丰度显著降低,Firmicutes的相对丰度显著升高(图 6)。
|
| 图 5 斜纹夜蛾幼虫肠道细菌在门水平上的相对丰度 Figure 5 Relative abundance of intestinal bacteria in the larvae of S. litura at phylum. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. |

|
| 图 6 Firmicutes与Proteobacteria门的相对丰 Figure 6 Relative abundance of Firmicutes and Proteobacteria. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. Different lowercase letters above the columns indicate significant differences between treatments at 0.05 level. |
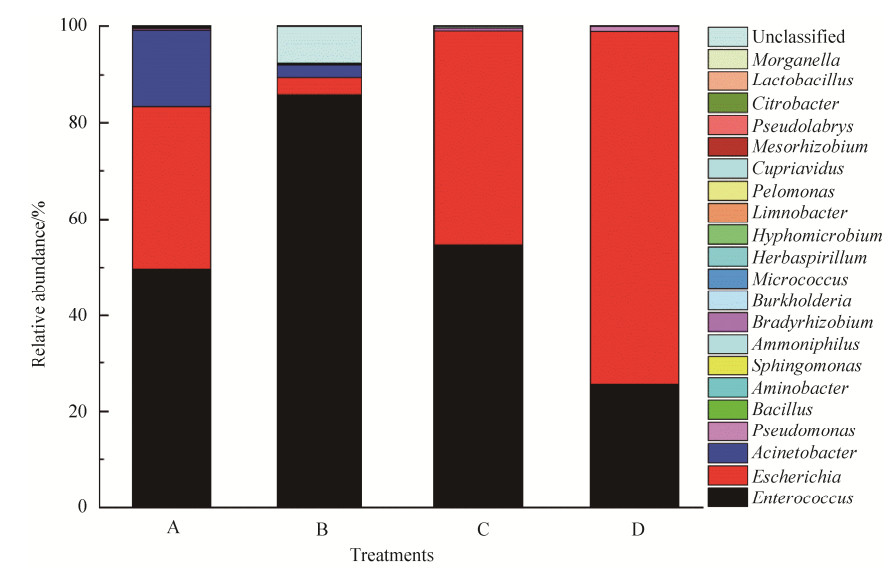
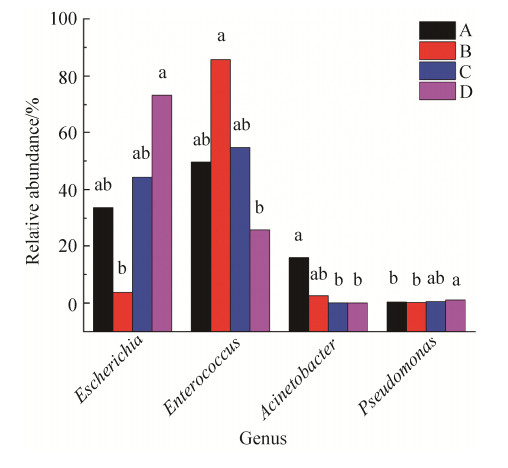
在属的分类上(图 7),斜纹夜蛾幼虫肠道细菌组成主要为埃希氏菌属Escherichia、肠球菌属Enterococcus、不动细菌属Acinetobacter和少量的假单胞菌属Pseudomonas、伯克氏菌属Burkholderia等。其中相对丰度表现出显著差异性的有Escherichia、Enterococcus、Acinetobacter和Pseudomonas (图 8)。金龟子绿僵菌侵染后致死的B组肠道细菌群落中,Enterococcus相对丰度为85.76%,显著高于空白对照D组25.58%;Escherichia和Pseudomonas在处理后致死的B组中占比分别为3.72%和0.17%,与空白对照D组的73.30%和1.05%相比相对丰度显著降低。
|
| 图 7 斜纹夜蛾幼虫肠道细菌在属水平上的相对丰度 Figure 7 Relative abundance of intestinal bacteria in the larvae of S. litura at genus. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. |
|
| 图 8 Escherichia、Enterococcus、Acinetobacter和Pseudomonas属的相对丰度 Figure 8 Relative abundance of Escherichia、Enterococcus、Acinetobacter and Pseudomonas. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. Different lowercase letters above the columns indicate significant differences between treatments at 0.05 level. |
2.7 金龟子绿僵菌对斜纹夜蛾幼虫肠道细菌Beta多样性影响
斜纹夜蛾幼虫肠道细菌在属水平上的不相似分析表明(表 5),虫体肠道细菌群落组成在正常生长情况下(A vs D)无显著性差异,说明在虫体生长发育过程中其肠道细菌群落结构没有发生明显的改变。而金龟子绿僵菌处理后致死的B组与空白对照D组的群落结构之间有显著性差异,但处理后未致死的C组群落结构与空白对照D组却无明显的差异。
| Treatments | ADONIS | ANOSIM | MRPP | |||||
| F | P | R | P | Delta | P | |||
| A vs D | 0.13 | 0.393 | 0.21 | 0.197 | 0.46 | 0.239 | ||
| B vs C | 0.50 | 0.085 | 0.48 | 0.059 | 0.24 | 0.059 | ||
| B vs D | 0.86 | 0.034* | 0.98 | 0.037* | 0.20 | 0.026* | ||
| C vs D | 0.31 | 0.178 | 0.07 | 0.269 | 0.28 | 0.216 | ||
| ADONIS: permutational multivariate analysis of variance; ANOSIM: analysis of similarity; MRPP: multiple response permutation procedure. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group; *: significant difference at 0.05 level. | ||||||||
在属水平上的PCA分析结果表明(图 9),PCA的两个主轴解释了99.38%的变异,表明它们能够较好的代表斜纹夜蛾幼虫肠道细菌群落组成的特征,其中PC1解释了93.95%的变异,PC2解释了5.43%的变异。金龟子绿僵菌侵染后致死B组的肠道细菌群落和处理后未致死C组以及空白对照D组在分布上存在较大的差异,处理后致死B组与处理前A组分布比较接近,处理后未致死C组则与空白对照D组分布比较接近。

|
| 图 9 斜纹夜蛾幼虫肠道细菌群落在属水平上的PCA分析 Figure 9 PCA analysis of intestinal bacteria community in the larvae of S. litura at genus. A: pre-treatment group; B: treated lethal group; C: treated alive group; D: control group. |
3 结论和讨论
通过毒力测定,表明金龟子绿僵菌对斜纹夜蛾2龄幼虫具备一定的致病力。金龟子绿僵菌处理后的斜纹夜蛾2龄幼虫累计死亡率与其孢悬液浓度呈现出正相关,孢悬液浓度为1.0×109个孢子/mL时致死率达最大值。致死效率上,伴随着孢悬液浓度的增加,斜纹夜蛾幼虫的死亡速度也加快,致死中时缩短。因此在斜纹夜蛾达到2龄时或之前采用109个孢子/mL金龟子绿僵菌处理便能够达到良好的防治效果。
绿僵菌侵染斜纹夜蛾幼虫后,其体内的抗氧化酶活性将有所改变,这已有所报道[21]。我们的研究结果表明,幼虫体内SOD和CAT活性均有不同程度的变化,但变化的规律有所不同。处理后致死B组活性较处理后未致死C组的SOD活性较低,可能是因为已经致死的缘故,而处理后未致死C组相比于对照D组其SOD有着显著性的提升,说明金龟子绿僵菌的侵染使得斜纹夜蛾幼虫处于一个逆境状态,体内产生了许多的超氧化物,而处理后未致死C组SOD活性显著的提升表明了斜纹夜蛾幼虫处于自由基的清除阶段,由此可以说明,SOD在斜纹夜蛾幼虫面临致病菌侵染时发挥着抵抗作用,为体内抵抗致病真菌的重要防御因子之一,是斜纹夜蛾幼虫体内酶防御体系中的重要一环。CAT为最末端氧化酶,对过氧化氢具有催化分解作用,在斜纹夜蛾幼虫受到威胁时CAT也起到了保护作用,同样是虫体的防御因子之一。SOD功能为去除超氧阴离子,金龟子绿僵菌侵染后体内的SOD活性先起作用,而CAT活性则有一定的滞后性,由此可以推断,在抵抗金龟子绿僵菌侵染过程中SOD和CAT都是起主要作用的酶,并且他们之间有着相互补充的关系。在斜纹夜蛾幼虫体内没有检测出的POD活性,这与张慧等在讨论斜纹夜蛾的防御酶体系时,得出的结论一致[22]。有文章指出,这可能与愈创木酚在作为POD活性测试底物时的专一性强弱有关,所以导致POD活性未检测出[23]。
通过对肠道细菌群落多样性分析表明,受金龟子绿僵菌侵染之后,其肠道细菌群落的物种多样性得到了一定的提升,昆虫病原真菌杀死宿主的过程中涉及了一连串的疏水相互作用、真菌释放的体壁降解酶和毒素与宿主的作用、微生物的降解等复杂的昆虫-真菌生化相互作用,可能是受到病原真菌的这些刺激导致肠道细菌群落的物种多样性的提升[24]。同时肠道细菌物种多样性的升高也会提高宿主的免疫能力,一般来说,肠道微生物物种多样性越高则抵御外来菌群的能力就会越强,其他致病菌的侵入就更加困难,以此达到免疫的功效。金龟子绿僵菌处理后,斜纹夜蛾幼虫肠道微生物群落结构发生了改变。在门水平上,处理后致死B组相较于空白对照D组Proteobacteria的相对丰度显著降低,Firmicutes的相对丰度显著升高。Proteobacteria和Firmicutes这两大细菌门类作为昆虫肠道共同进化的关键门类,它们在昆虫的肠道中都扮演着重要的角色,甚至能转化成为其必不可缺的重要细菌。而在属水平上,在处理后致死的斜纹夜蛾幼虫肠道中Enterococcus相对丰度有大幅度升高,说明Enterococcus的相对丰度改变可能与斜纹夜蛾幼虫的致死有关。据报道,Enterococcus是鳞翅目昆虫肠道的常驻细菌,能够起到缓冲肠道极端pH的作用[25];Enterococcus的存在还赋予宿主诸多优势,比如家蚕肠道的优势菌Enterococcus有抵御病原微孢子虫发芽增殖的作用[26]。Escherichia和Pseudomonas在处理后致死斜纹夜蛾肠道中丰度显著性减少,可以推测Escherichia和Pseudomonas可能与斜纹夜蛾幼虫的抗性有关。所以,金龟子绿僵菌的侵染会导致斜纹夜蛾幼虫肠道细菌群落结构的变化,其中产生显著性差异的某些属可能是导致斜纹夜蛾幼虫致死的重要因素。
与化学农药类似,微生物菌剂也会引起害虫产生抗药性。已有研究表明,用白僵菌对大蜡螟Galleria mellonella进行抗性选育,连续选育25代后表现出明显的抗药性[27]。除了增强免疫功能外,昆虫体壁屏障的加强也可能是抗药性产生的原因之一[28]。所以从可持续发展的角度考量,金龟子绿僵菌应结合其他生物农药一起交替使用,不可滥用,以避免可能产生的抗药性风险。
| [1] |
Qin HG, Wang DD, Ding J, Huang RH, Ye ZX. Host plants of Spodoptera litura. Acta Agriculturae Jiangxi, 2006, 18(5): 51-58.
(in Chinese) 秦厚国, 汪笃栋, 丁建, 黄荣华, 叶正襄. 斜纹夜蛾寄主植物名录. 江西农业学报, 2006, 18(5): 51-58. DOI:10.3969/j.issn.1001-8581.2006.05.017 |
| [2] | 齐永霞. 白僵菌和绿僵菌在植物根际的定殖及对几种土传植物病原真菌的抑制作用研究. 安徽农业大学博士学位论文, 2011. |
| [3] |
Huang B, Fan MZ, Li ZZ. A review of Metarhizium phyletic classification. Journal of Anhui Agricultural University, 2002, 19(2): 169-172.
(in Chinese) 黄勃, 樊美珍, 李增智. 绿僵菌属系统分类的研究进展. 安徽农业大学学报, 2002, 19(2): 169-172. DOI:10.3969/j.issn.1672-352X.2002.02.016 |
| [4] |
Song Z, Jing Y, Cai HQ, Chen XH. Preliminary study on using Metarhizium anisopliae to control Dendrolimus punctatus. Journal of Fujian College of Forestry, 1997, 17(2): 107-109.
(in Chinese) 宋漳, 景云, 蔡和谦, 陈锡桓. 应用绿僵菌防治马尾松毛虫初探. 福建林学院学报, 1997, 17(2): 107-109. |
| [5] | Fridovich I. Oxygen is toxic!. BioScience, 1977, 27(7): 462-466. DOI:10.2307/1297527 |
| [6] | Liochev SI, Fridovich I. The effects of superoxide dismutase on H2O2 formation. Free Radical Biology and Medicine, 2007, 42(10): 1465-1469. DOI:10.1016/j.freeradbiomed.2007.02.015 |
| [7] | Ouedraogo RM, Cusson M, Goettel MS, Brodeur J. Inhibition of fungal growth in thermoregulating locusts, Locusta migratoria, infected by the fungus Metarhizium anisopliae var acridum. Journal of Invertebrate Pathology, 2003, 82(2): 103-109. DOI:10.1016/S0022-2011(02)00185-4 |
| [8] | Boguś MI, Kędra E, Bania J, Szczepanik M, Czygier M, Jabłoński P, Pasztaleniec A, Samborski J, Mazgajska J, Polanowski A. Different defense strategies of Dendrolimus pini, Galleria mellonella, and Calliphora vicina against fungal infection. Journal of Insect Physiology, 2007, 53(9): 909-922. DOI:10.1016/j.jinsphys.2007.02.016 |
| [9] |
Yao ZC, Bai S, Zhang HY. Intestinal defense system and mechanism of maintenance of microbiota homeostasis in insects. Acta Microbiologica Sinica, 2018, 58(6): 1036-1048.
(in Chinese) 姚志超, 白帅, 张宏宇. 昆虫肠道防御及微生物稳态维持机制. 微生物学报, 2018, 58(6): 1036-1048. |
| [10] |
Sun G, Liu SW, Chang XH, Luo YM, Li KK, Song YQ. Study on effect of an improved artificial rearing technique for Spodoptera litura Fabricius. Shandong Agricultural Sciences, 2015, 47(2): 104-106.
(in Chinese) 孙庚, 刘少武, 常秀辉, 罗艳梅, 李轲轲, 宋玉泉. 一种改进的斜纹夜蛾人工饲养技术的效果研究. 山东农业科学, 2015, 47(2): 104-106. |
| [11] | 查黎春. 三种农药对天幕毛虫、舞毒蛾超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性的影响. 东北林业大学硕士学位论文, 2011. |
| [12] |
Wang N, Zhang ZC, Wang MQ, Wu SB, Zhang GA. Effect of spermidine on development and activitiy of protective enzymes of the diamondback moth, Plutella xylostella. Chinese Bulletin of Entomology, 2009, 46(3): 420-423.
(in Chinese) 王楠, 张志春, 王满囷, 吴胜兵, 张国安. 亚精胺对小菜蛾幼虫生长及保护酶活力的影响. 昆虫知识, 2009, 46(3): 420-423. |
| [13] |
Wang Y, Shen HM, Yang SY, Dong Q. The toxicity of Acremonium hansfordii to Plutella xylostella and its effect on endogenous enzymes of protective system. Journal of Gansu Agricultural University, 2010, 45(6): 105-109.
(in Chinese) 王琰, 沈慧敏, 杨顺义, 董强. 顶孢霉菌对小菜蛾的毒力及体内保护酶活力的影响. 甘肃农业大学学报, 2010, 45(6): 105-109. DOI:10.3969/j.issn.1003-4315.2010.06.021 |
| [14] |
Li ZZ, Shen HJ, Jiang QG, Ji BZ. A study on the activities of endogenous enzymes of protective system in some insects. Acta Entomologica Sinica, 1994, 37(4): 399-403.
(in Chinese) 李周直, 沈惠娟, 蒋巧根, 嵇保中. 几种昆虫体内保护酶系统活力的研究. 昆虫学报, 1994, 37(4): 399-403. DOI:10.3321/j.issn:0454-6296.1994.04.002 |
| [15] | Okado-Matsumoto A, Fridovich I. Assay of superoxide dismutase: cautions relevant to the use of cytochrome c, a sulfonated tetrazolium, and cyanide. Analytical Biochemistry, 2001, 298(2): 337-342. DOI:10.1006/abio.2001.5385 |
| [16] | 王学奎, 黄见良. 植物生理生化实验原理与技术. 第3版. 北京: 高等教育出版社, 2015. |
| [17] | 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000. |
| [18] |
Xiong HM, Wei BQ, Wei RJ, Yang NH, Qi MY, Jin J, Jin Y, He J, Dai RX. Calculation of median lethal dose (LD50) for Yersinia pestis by SPSS package. Chinese Journal of Zoonoses, 2013, 29(11): 1127-1130.
(in Chinese) 熊浩明, 魏柏青, 魏荣杰, 杨宁海, 祁美英, 靳娟, 金泳, 何建, 代瑞霞. 用SPSS软件计算鼠疫菌半数致死量(LD50). 中国人兽共患学报, 2013, 29(11): 1127-1130. |
| [19] | Edgar RC. Search and clustering orders of magnitude faster than BLAST. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [20] | Wang Q, Garrity GM, Tiedje JM, Cole JR. Naïve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [21] |
Tang WY, Xing CC, Dong YG, Wang X, Zhang YM. Changes in the activities of antioxidant enzymes in Spodoptera litura (Lepidoptera: Noctuidae) larvae infected by the fungus Nomuraea rileyi. Acta Entomologica Sinica, 2015, 58(5): 526-534.
(in Chinese) 唐维媛, 邢丛丛, 董永刚, 王啸, 张义明. 斜纹夜蛾幼虫感染莱氏野村菌后的抗氧化酶活性变化. 昆虫学报, 2015, 58(5): 526-534. |
| [22] |
Zhang H, Wang XR, Kuang SZ, Wu JF, Lv ZZ. Effect of sublethal concentration of insecticides and SINPV on the activities of SOD, CAT and POD in Spodoptera litura. Acta Entomologica Sinica, 2006, 49(5): 775-779.
(in Chinese) 张慧, 王晓容, 匡石滋, 吴洁芳, 吕作舟. 斜纹夜蛾核型多角体病毒与两种亚致死剂量的农药混用对斜纹夜蛾体内三种抗氧化酶活性的影响. 昆虫学报, 2006, 49(5): 775-779. DOI:10.3321/j.issn:0454-6296.2006.05.009 |
| [23] |
Li YP, Gong H. Research progress of antioxidant system in insects. Chinese Bulletin of Life Sciences, 1998, 10(5): 240-243, 221.
(in Chinese) 李毅平, 龚和. 昆虫体内抗氧化系统研究进展. 生命科学, 1998, 10(5): 240-243, 221. |
| [24] | 洪明生. 昆虫病原真菌对植物叶表和寄主肠道微生物群落的作用研究. 重庆大学博士学位论文, 2017. |
| [25] | Xiang H, Wei GF, Jia SH, Huang JH, Miao XX, Zhou ZH, Zhao LP, Huang YP. Microbial communities in the larval midgut of laboratory and field populations of cotton bollworm (Helicoverpa armigera). Canadian Journal of Microbiology, 2006, 52(11): 1085-1092. DOI:10.1139/w06-064 |
| [26] |
Lu XM, Wang FW. Inhibition of cultured supernatant of enterococci strains on germination of Nosema bombycis spores in vitro. Acta Sericologica Sinica, 2002, 28(2): 126-128.
(in Chinese) 鲁兴萌, 汪方炜. 家蚕肠球菌对微孢子虫体外发芽的抑制作用. 蚕业科学, 2002, 28(2): 126-128. |
| [27] | Dubovskiy IM, Whitten MMA, Yaroslavtseva ON, Greig C, Kryukov VY, Grizanova EV, Mukherjee K, Vilcinskas A, Glupov VV, Butt TM. Can insects develop resistance to insect pathogenic fungi?. PLoS One, 2013, 8(4): e60248. DOI:10.1371/journal.pone.0060248 |
| [28] | Enríquez-Vara JN, Córdoba-Aguilar A, Guzmán-Franco AW, Alatorre-Rosas R, Contreras-Garduño J. Is survival after pathogen exposure explained by host's immune strength? A test with two species of white grubs (Coleoptera: Scarabaeidae) exposed to fungal infection. Environmental Entomology, 2012, 41(4): 959-965. DOI:10.1603/EN12011 |
 2021, Vol. 61
2021, Vol. 61