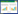中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 孙超, 曾湘, 李光玉, 杜雅萍, 王兆守, 邵宗泽. 2021
- Chao Sun, Xiang Zeng, Guangyu Li, Yaping Du, Zhaoshou Wang, Zongze Shao. 2021
- 红树林沉积物中天然多聚有机物厌氧降解菌多样性与细菌新类群分离
- Diversity of anaerobic degrading bacteria for natural organic polymers in mangrove sediments and isolation of novel groups of bacteria
- 微生物学报, 61(4): 987-1001
- Acta Microbiologica Sinica, 61(4): 987-1001
-
文章历史
- 收稿日期:2020-11-19
- 修回日期:2021-02-08
- 网络出版日期:2021-02-18
2. 厦门大学化学化工学院, 化学工程与生物工程系, 福建 厦门 361005
2. Department of Chemical and Biochemical Engineering, College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, Fujian Province, China
红树林生态系统(mangrove ecosystem)覆盖了全球约25%的海岸线和75%的热带海岸线[1],也是遍布全球的海洋四大高生产力生态系统之一[2]。红树林沉积物是该系统所有生物的基础,沉积物中的有机碳储存量占该系统碳总储量的49%–98%[3]。留在沉积物中的有机碳主要以树木枝叶、动物组织等形式存在,其分解消耗被认为是通过微生物代谢作用完成,微生物以占有机碎屑质量不到1.2%的总生物量驱动着沉积物中大部分有机碳的循环,其中细菌和真菌占沉积物总微生物量的91%,而藻类和原生动物仅占9%[4-5]。细菌是红树林生态系统功能基础,也是沉积物中碳通量的最大贡献者之一,它们处理掉沉积物中大部分的能量流和营养物质,介导了红树林系统中碳、硫、氮、磷元素的生物地球化学循环,并将自身作为“碳汇”固定在红树林沉积物[6-7]。
目前,已从中发现并分离到了参与氮固定的固氮螺旋菌属(Azospirillum)、固氮杆菌属(Azotobacter)、根瘤菌属(Rhizobium)、假单胞菌属(Pseudomonas)和克雷伯菌属(Klebsiella)[8],参与硫代谢的脱硫叠球菌属(Desulfosarcina)、脱硫球菌属(Desulfococcus)、脱硫肠状菌属(Desulfotomaculum)[9]以及能够分泌高磷酸酶活性的芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenbacillus)、Xnathobacter等[10]。目前,对红树林沉积物中参与纤维素、几丁质和木质素等动植物来源的天然多聚有机物厌氧降解微生物鲜有报道,其多样性及降解能力研究较少。
为认识红树林厌氧沉积物中难降解天然有机多聚物的微生物降解过程,本研究首先对九龙江口红树林沉积物中参与纤维素、几丁质和木质素的厌氧细菌定向富集及多样性分析,并基于厌氧平板分离方法对其进行分离纯化和鉴定,并对提高难/未培养微生物的获取有参考意义。研究结果将为认识红树林沉积物中微生物对碳循环贡献提供参考。
1 材料和方法 1.1 材料 1.1.1 沉积物采集:沉积物采自于福建省漳州市九龙江入海口的红树林保护区紫泥镇上潮带涂滩的表层以下约30 cm处。采样点样品呈黑色淤泥状且含有少量腐败木质组织,地表有大量螃蟹活动。采集样品放置于无菌塑料样品袋中并于4 ℃保存。
1.1.2 主要试剂与仪器:几丁质、碱性木质素、滤纸纤维素、3, 5-二硝基水杨酸购自上海索莱宝生物科技股份有限公司;四水合酒石酸钾钠、结晶苯酚、无水亚硫酸钠购于国药集团;BactoTM Marine Broth 2216、BactoTM Agar 2216购自美国BD公司、L-半胱氨酸盐酸盐购自Sigma公司;厌氧操作箱购自美国Coy公司;基因组DNA提取试剂盒购自赛百盛基因技术有限公司;细菌16S rRNA基因扩增引物Eubac27F/1492R由上海精聚公司合成。
1.1.3 培养基:(1) 唯一碳源液体富集培养基:用滤纸取代纤维素,富集前将滤纸裁剪成0.5 cm×5 cm片状。在装有50 mL人工海水[NaCl,23 g/L;MgCl2·6H2O,5 g/L;CaCl2,0.15 g/L;(NH4)2SO4,0.4 g/L;KCl,0.7 g/L;NaBr,50 mg/L;SrCl2·6H2O,10 mg/L;KH2PO4,10 mg/L]的厌氧瓶(体积150 mL)中分别添加4 g/L纤维素、4 g/L几丁质、4 g/L木质素,6.05 g/L PIPES缓冲剂,0.5 g/L L-半胱氨酸盐酸盐,1 mg/L刃天青,用NaOH/HCl调节培养基pH至7.3,充入纯N2曝气15 min,充气结束迅速加盖橡胶塞并用铝盖压紧胶塞,1×105 Pa灭菌20 min。培养基灭菌并冷却后用1 mL注射器接入1 mL Wolf微量元素溶液和1 mL Wolf维生素溶液,该步骤于厌氧操作箱中完成。(2) 厌氧MA固体培养基:将37.4 g固体Marine Broth 2216粉末溶解于1 L超纯水中并加入18 g固体Agar 2216粉末,溶解后调pH至7.2–7.4,加入刃天青1 mg/L,充入纯N2,15 min后迅速加盖橡胶塞并用铝盖压紧胶塞,1×105 Pa灭菌20 min,最后用1 mL注射器加入过滤除菌的L-半胱氨酸盐酸盐溶液至0.2 g/L除去剩余的氧气,以培养基由红色变为黄色为准。除氧后的培养基于厌氧操作箱中倒入一次性无菌培养皿冷却凝固,避免氧气污染。
1.2 微生物富集与纯化分离将沉积物样品重悬于无菌无氧人工海水中,取1 mL悬浮液接入富集培养基中至沉积物终浓度约为10 g/L。富集物置于黑暗环境室温富集(约25 ℃),原代富集45 d后转接至液体培养基中,传代2次,每代培养15 d。
富集完成后,用1 mL无菌注射器抽取少量的富集培养液梯度稀释至10–4、10–5和10–6倍,取100 μL稀释液均匀涂布于无氧平板,放置于含产气包的一次性厌氧培养袋后密封。在28 ℃恒温培养箱中培养7 d后划线纯化。上述实验步骤均在厌氧操作箱中完成。
纯化分离细菌,由海洋微生物菌种保藏管理中心(Marine Culture Collection of China,MCCC)保藏,获得MCCC菌种保藏号。
1.3 细菌基因组DNA提取用一次性无菌接种环挑取生长至指数期的菌落,根据基因组DNA提取试剂盒的说明书指示提取纯菌DNA用于下游PCR实验,利用Nanodrop 2000超微量核酸蛋白测定仪检测DNA浓度。
1.4 细菌16S rRNA基因扩增及菌种鉴定采用细菌16S rRNA基因扩增通用引物对Eubac27F (5′-AGAGTTTGATCCTGGCTCA-3′)和Eubac1492R (5′-ACGGCTACCTTGTTACGACT-3′)对基因组DNA进行扩增。PCR扩增体系:2×Taq Master Mix 25 μL,Eubac27F (10 μmol/L) 2 μL,Eubac1492R (10 μmol/L) 2 μL,DNA模板(> 10 ng/μL) 2 μL,补充无RNA超纯水至50 μL。PCR扩增程序:95 ℃ 5 min;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,循环30次;72 ℃ 10 min。PCR产物送至上海美吉生物医药科技有限公司完成测序。
利用软件BioEdit 7.0.5查看测序序列峰图,将无杂峰的双端序列用软件DNAMAN 7.0.2进行拼接处理得到几乎完整的16S rRNA基因序列,进一步将序列上传至EzBioCloud和NCBI database对菌株的分类学水平进行检索,确定菌株的进化关系。基于16S rRNA基因序列的可培养菌株系统进化树通过软件MEGA 7.0和ITOL 5.7构建。
1.5 还原糖含量和木质素降解率测定还原糖是纤维素和几丁质降解的降解产物,所以可以通过检测还原糖含量来间接分析可培养细菌对纤维素或几丁质的水解能力[11]。
DNS试剂:准确称取3.15 g 3, 5-二硝基水杨酸用少量去离子水溶解,加入130 mL的2 mol/L的氢氧化钠溶液,搅拌均匀后倒入溶解有92.5 g四水合酒石酸钾钠的500 mL去离子水(约50 ℃)中,最后加入2.5 g结晶苯酚,2.5 g无水亚硫酸钠搅拌溶解,冷却后定容至500 mL,避光放置2周后使用,期间每隔一天对DNS试剂摇晃,避免沉淀生成。
葡萄糖标准曲线的绘制:准确称取0.1000 g葡萄糖用去离子水溶解后定容至100 mL,将配制的1 g/L的葡萄糖标准溶液梯度稀释成0、0.2、0.4、0.6、0.8 g/L的葡萄糖标准溶液。用1000 μL量程的精密移液枪准确吸取500 μL不同浓度的葡萄糖标准溶液加入到500 μL DNS试剂中,沸水浴5 min后迅速冷却至室温,并定容至10 mL,用HALO RB-10紫外可见分光光度计在540 nm波长下测定其吸光值A540。以葡萄糖标准浓度为X轴,吸光值为Y轴绘制标准曲线见图 1-A。N-乙酰氨基葡萄糖标准曲线绘制:详细步骤参见葡萄糖标准曲线的绘制,绘制的标准曲线见图 1-B。
|
| 图 1 葡萄糖(A)和N-乙酰氨基葡萄糖(B)浓度标准曲线 Figure 1 Concentration standard curves of glucose (A) and N-acetylglucosamine (B). |
培养液还原糖含量测定:用2.5 mL注射器取1 mL纤维素或几丁质水解后的培养液,13000 r/min离心3 min,取500 μL上清液加入500 μL DNS试剂,其他操作步骤同上。
木质素降解率测定[12]:用1 mL无菌注射器取1 mL培养液用微量台式离心机13000 r/min离心5 min,上清液用PBS缓冲液稀释10倍后用HALO RB-10紫外可见分光光度计测定吸光值,检测波长280 nm,以PBS缓冲液调零,木质素降解率W=(A0–A)/A0×100%,其中A0为未接菌木质素培养基中木质素的吸光值,A代表接菌培养后木质素的吸光值。
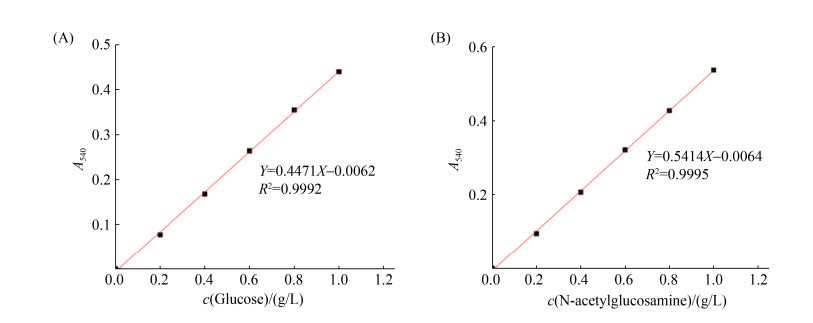
2 结果和分析 2.1 可培养细菌分离鉴定及门水平多样性分析对富集菌群进行厌氧平板涂布分离,共获得202株纯菌,细菌占比100%,且全为厌氧细菌,其中兼性厌氧细菌120株,占59.4%,专性厌氧菌82株,占40.6%。基于16S rRNA基因序列进行比对并归类发现,202株细菌分布于5个门,10个纲,12个目,18个科以及26个属。这些细菌中,68株来源于纤维素富集物,52株来源于几丁质富集物,82株来源于木质素富集物。基于门水平分类,如图 2所示,纤维素、几丁质和木质素厌氧富集菌群中的可培养细菌在变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidates)、梭杆菌门(Fusobacteria)和放线菌门(Actinobacteria)均有分布。其中,纤维素富集菌群的可培养细菌相对丰度最高的为变形菌门,其次为拟杆菌门、放线菌门、厚壁菌门和梭杆菌门,相对丰度分别为42.7%、36.0%、9.3%、8.0%和4.0%。这5个菌门的可培养细菌在几丁质富集菌群中相对丰度分别为49.1%、31.6%、1.8%、10.5%和7.0%,在木质素富集菌群中的相对丰度为20.4%、33.3%、5.4%、30.1%和10.8%。可见厚壁菌门菌群是参与木质素厌氧降解的关键菌群。
|
| 图 2 纤维素、几丁质和木质素富集菌群可培养菌株数目和门水平相对丰度 Figure 2 Number and relative population abundance at the phylum level of culturable strains in the enrichments with cellulose, chitin or lignin as sole carbon source. |
2.2 纤维素和几丁质富集菌群可培养细菌多样性分析
在属种水平上,以纤维素与以几丁质为碳源富集分离的厌氧菌多样性相似度较高,这可能与纤维素和几丁质均由β-1, 4-糖苷键连接聚合而成有关。此外,两种底物富集分离的共有可培养菌株集中在拟杆菌门。
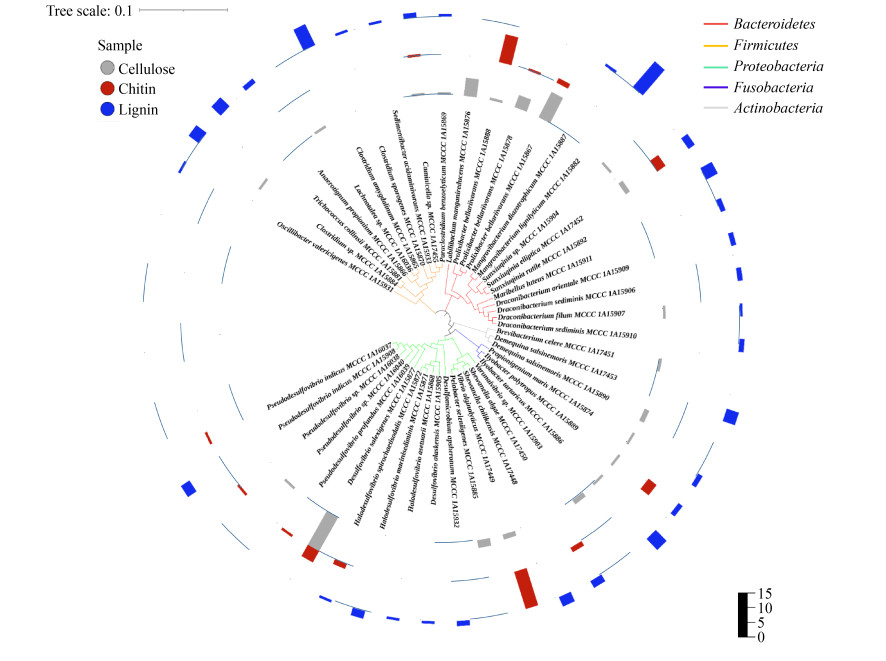
如表 1和图 3所示,68株纤维素富集菌群可培养细菌分别属于17个菌属,21个种,其中以长杆菌属(Prolixibacter)、脱硫弧菌属(Desulfovibrio)和Labilibaculum相对丰度最高,占比分别为25.0%、22.1%、10.3%。P. bellariivorans最初从燃料电池中分离,具有多种糖类发酵功能[13]。本研究共计分离到3株长杆菌属(Prolixibacter)菌株,与模式种Prolixibacter bellariivorans相似度分别为97.5%、98.0%和99.8%,入库保藏菌种分别为P. bellariivorans MCCC 1A15878、1A15888和1A15867。此外,其他各属代表性菌种及入库保藏编号如下:脱硫弧菌属(Desulfovibrio salexigenes MCCC 1A15877)、孙修勤菌属(Sunxiuqinia sp. MCCC 1A15904,Sunxiuqinia elliptica MCCC 1A17452)、龙小杆菌属(Draconibacterium filum MCCC 1A15907)、短杆菌属(Brevibacterium celere MCCC 1A17451)、脱醌菌属(Demequina salsinemoris MCCC 1A15890)、产丙酸菌属(Propionigenium maris MCCC 1A15874)、泥杆菌属(Ilyobacter polytropus MCCC 1A15889,Ilyobacter tartaricus MCCC 1A15886)、Varunaivibrio (Varunaivibrio sp. MCCC 1A15903)、弧菌属(Vibrio alginolyticus MCCC 1A17449)、暗杆菌属(Pelobacter seleniigenes MCCC 1A15885)、假脱硫弧菌属(Pseudodesulfovibrio sp. MCCC 1A16040)、梭菌属(Clostridium sp. MCCC 1A15884)、Lachnotalea (Lachnotalea sp. MCCC 1A16036)、Labilibaculum (Labilibaculum manganireducens MCCC 1A15876)、Caminicella (Caminicella sp. MCCC 1A17455)、Paraclostridium (Paraclostridium benzoelyticum MCCC 1A15876)等。
| Phylum | Genus | The sole carbon source in the medium | ||
| Cellulose | Chitin | Lignin | ||
| Proteobacteria | Desulfovibrio | 15 | 5 | 1 |
| Pseudodesulfovibrio | 1 | 3 | 4 | |
| Halodesulfovibrio | 0 | 2 | 5 | |
| Shewanella | 0 | 2 | 6 | |
| Vibrio | 3 | 15 | 0 | |
| Pelobacter | 4 | 0 | 0 | |
| Desulfomicrobium | 0 | 0 | 2 | |
| Varunaivibrio | 3 | 0 | 0 | |
| Firmicutes | Clostridium | 1 | 0 | 13 |
| Trichococcus | 0 | 0 | 5 | |
| Lachnotalea | 2 | 0 | 0 | |
| Caminicella | 2 | 1 | 2 | |
| Oscillibacter | 0 | 0 | 1 | |
| Sedimentibacter | 0 | 0 | 1 | |
| Anaerotignum | 0 | 0 | 2 | |
| Paraclostridium | 2 | 0 | 1 | |
| Bacteroidates | Labilibaculum | 7 | 0 | 0 |
| Prolixibacter | 17 | 14 | 0 | |
| Sunxiuqinia | 3 | 5 | 8 | |
| Mangrovibacterium | 0 | 0 | 12 | |
| Draconibacterium | 2 | 0 | 7 | |
| Maribellus | 0 | 0 | 2 | |
| Actinobacteria | Demequina | 2 | 0 | 5 |
| Brevibacterium | 1 | 0 | 0 | |
| Fusobacteria | Propionigenium | 1 | 0 | 1 |
| Ilyobacter | 2 | 5 | 4 | |
| Total | 68 | 52 | 82 | |
|
| 图 3 分离自3种底物富集菌群的46株海洋细菌系统进化树及其在不同富集样品中的分离次数 Figure 3 Phylogenetic trees of 46 marine strains isolated from three substrate-enriched microbial community and their isolation frequency in different enriched samples. |
几丁质富集培养物中,获得52株可培养细菌,分别属于9个菌属,13个菌种(图 3),其中优势菌属为弧菌属、长杆菌属、脱硫弧菌属、泥杆菌属和孙修勤菌属,占比分别为28.8%、26.9%、9.6%、7.7%和7.7%。已有研究报道,由于几丁质在海洋生态系统中非常丰富,一些海洋细菌如弧菌属能以几丁质为唯一能量来源迅速生长。其中有7个菌属与以纤维素为碳源获得的可培养菌共有,2个独有菌属包括希瓦氏菌属(Shewanella algae MCCC 1A17450)、盐脱硫弧菌(Halodesulfovibrio spirochaetisodalis MCCC 1A15872)。7个共有菌属分别为长杆菌属(Prolixibacter bellariivorans MCCC 1A15878/ 1A15888/1A15867)、孙修勤菌属(Sunxiuqinia elliptica MCCC 1A17452)、泥杆菌属(Ilyobacter polytropus MCCC 15889)、弧菌属(Vibrio alginolyticus MCCC 1A17449)、脱硫弧菌(Desulfovibrio salexigenes MCCC 1A15877)、假脱硫弧菌属(Pseudodesulfovibrio profundus MCCC 1A16039,Pseudodesulfovibrio indicus MCCC 1A16037,Pseudodesulfovibrio sp. MCCC 1A16038)、Caminicella (Caminicella sp. MCCC 1A17455)。
2.3 木质素富集菌群可培养细菌多样性分析木质素是一种复杂的聚合物,一般由苯丙烷单元通过碳碳键和醚键连接形成三维网状结构[14]。与纤维素和几丁质不同的是,木质素的聚合单体并不具备单一性,而是由多类单体聚合而成,常见的包括对香豆醇(p-coumaryl alcohol)、松柏醇(coniferylalcohol)、芥子醇(sinapyl alcohol)、对羟基苯酚(p-hydroxyphenyl)、愈创木酚(guaiacyl)、丁香酸(vanillic acid)、香草酸(vanillic acid)等[15-16]。这可能是赋予参与木质素降解细菌高度多样性的原因之一。木质素富集菌群结构与纤维素/几丁质富集菌群分离到的可培养细菌菌群结构存在明显差异,除拟杆菌门(33.3%)外,厚壁菌门细菌在木质素富集菌群中丰度也非常高,达30.1%。
在木质素富集菌群中共分离到厌氧细菌82株,分别属于21个属,30个种(表 1,图 3),其中相对丰度最高的属有红树林杆菌属(Mangrovibacterium)、梭菌属、泥杆菌属、龙小杆菌,其占比分别为17.1%、18.3%、9.8%和8.5%。29株拟杆菌门细菌均属于拟杆菌纲(Bacteroidia),长杆菌科(Prolixibacteraceae),包括红树林杆菌属(Mangrovibacterium diazotrophicum MCCC 1A15887,Mangrovibacterium lignilyticum MCCC 1A15882)、孙修勤菌属(Sunxiuqinia elliptica MCCC 1A17452,Sunxiuqinia rutile MCCC 1A15892)、马里贝勒斯菌属(Maribellus luteus MCCC 1A15911)、龙小杆菌属(Draconibacterium orientale MCCC 1A15909,Draconibacterium sediminis MCCC 1A15906/1A15910,Draconibacterium filum MCCC 1A15907)。25株厚壁菌门菌株中,20株属于梭菌纲(Clostridia),其中13株属于梭菌属(Clostridium sp. MCCC 1A15884,Clostridium amygdalinum MCCC 1A15865,Clostridium sporogenes MCCC 1A15870),其他分属于口腔杆菌属(Oscillibacter valericigenes MCCC 1A15931)、厌氧菌属(Anaerotignum propionicum MCCC 1A15866)、沉积物杆菌属(Sedimentibacter acidaminivorans MCCC 1A15933)、Caminicella (Caminicella sp. MCCC 1A17455)、Paraclostridium (Paraclostridium benzoelyticum MCCC 1A15869)。另外,5株属于芽孢杆菌纲(Bacilli),为毛球菌属(Trichococcus collinsii MCCC 1A15881)菌株。18株变形菌门细菌中,其中12株属于δ-变形菌纲(Deltaproteobacteria),包括脱硫微菌属(Desulfomicrobium apsheronum MCCC 1A15932)、脱硫弧菌属(Desulfovibrio alaskensis MCCC 1A15905)、盐脱硫弧菌属(Halodesulfovibrio aestuarii MCCC 1A15868,Halodesulfovibrio marinisediminis MCCC 1A15871,Halodesulfovibrio spirochaetisodalis MCCC 1A15872)、假脱硫弧菌属(Pseudodesulfovibrio indicus MCCC 1A15908);还有6株属于γ-变形菌纲(Gammaproteobacteria),包括希瓦氏菌属(Shewanella algae MCCC 1A17450,Shewanella chilikensis MCCC 1A17448)。
此外,还分离到5株Demequinales的脱醌菌属菌株(Demequina salsinemoris MCCC 1A17453)以及5株梭杆菌纲(Fusobacteria)菌株,包括1株产丙酸菌属菌株(Propionigenium maris MCCC 1A15874)以及4株泥杆菌属菌株(Ilyobacter polytropus MCCC 1A15889,Ilyobacter tartaricus MCCC 1A15886)。
2.4 富集菌群可培养细菌潜在新分类单元鉴定基于EZ Cloud database和NCBI数据库模式种16S rRNA基因序列比对发现,分离到的202株厌氧细菌中剔除序列重复菌株后,共有8株细菌与模式种最高相似度低于97% (表 2),可定义为新种,包括拟杆菌门的Mangrovibacterium sp. MCCC 1A15882 (该菌已发表论文,将其命名为Mangrovibacterium lignilyticum MCCC 1A15882[17])和Sunxiuqinia sp. MCCC 1A15904,这两株细菌与模式菌株Mangrovibacterium diazotrophicum和Sunxiuqinia elliptica的相似度分别为96.8%和97.0%;变形菌门的Pseudodesulfovibrio sp. MCCC 1A16040和Pseudodesulfovibrio sp. MCCC 1A16038与模式种Pseudodesulfovibrio indicus的相似度分别为96.4%和96.6%,并且这2个新种的16S rRNA基因序列相似度低于97.0%。其中,菌株MCCC 1A15904和MCCC 1A16040分离自纤维素富集菌群,菌株MCCC 1A15882分离自木质素富集菌群,菌株MCCC 1A16038分离自几丁质富集菌群。
| Phylum | MCCC accession number | Closest species | Similarity/% | Enrichment medium |
| Bacteroidates | MCCC 1A15882 | Mangrovibacterium diazotrophicum | 96.8 | Lignin |
| MCCC 1A15904 | Sunxiuqinia elliptica | 97.0 | Cellulose | |
| Proteobacteria | MCCC 1A16040 | Pseudodesulfovibrio indicus | 96.4 | Cellulose |
| MCCC 1A16038 | Pseudodesulfovibrio indicus | 96.5 | Chitin | |
| MCCC 1A15903 | Varunaivibrio sulfuroxidans | 90.3 | Cellulose | |
| Firmicutes | MCCC 1A15884 | Clostridium cocleatum | 92.6 | Cellulose, Chitin, Lignin |
| MCCC 1A17445 | Caminicella sporogenes | 92.8 | Cellulose, Chitin, Lignin | |
| MCCC 1A16036 | Lachnotalea glycerini | 92.6 | Cellulose |
另外,这8个新种中,有4个菌株属于疑似新属,与模式种最高相似度低于93.0%,分别为厚壁菌门的Clostridium sp. MCCC 1A15884、Caminicella sp. MCCC 1A17445、Lachnotalea sp. MCCC 1A16036和变形菌门的Varunaivibrio sp. MCCC 1A15903,其16S rRNA基因序列分别与模式种Clostridium cocleatum、Caminicella sporogenes、Lachnotalea glycerini和Varunaivibrio sulfuroxidans具有最高16S rRNA基因序列相似度,分别为92.6%、92.8%、92.6%和90.3%。其中,菌株MCCC 1A15884、MCCC 1A17445和MCCC 1A16036属于梭菌纲,为专性厌氧细菌。综上可见,红树林沉积物中的未分离的难培养细菌资源尤为丰富,亟待深入挖掘。
2.5 可培养细菌降解3种天然有机多聚物的能力鉴定从纤维素富集培养基中分离到的可培养细菌对纤维素降解能力验证结果(图 4-A)。以纤维素为碳源的富集培养基中共分离到的细菌16S rRNA序列去重复后有21株,其中有12株细菌具备纤维素降解能力。放线菌门菌株Demequina salsinemoris MCCC 1A15890和Brevibacterium celere MCCC 1A17451水解纤维素能力最强,培养14 d后积累的还原糖量分别为172 mg/L和129 mg/L。此外,拟杆菌门菌株Labilibaculum manganireducens MCCC 1A15876在纤维素降解培养基中培养14 d后,测得该菌株水解纤维素生成的还原糖含量为90.7 mg/L,对纤维素的水解效果较好。值得注意的是,Desulfovibrio salexigenes MCCC 1A15877虽然是富集菌群可培养细菌的优势菌株,纤维素水解验证发现该菌株对纤维素水解能力很差,推测该菌株在富集体系中可能主要利用纤维素的水解产物进行生长。另外,Sunxiuqinia sp. MCCC 1A15904、Prolixibacter bellariivorans MCCC 1A15878和Vibrio alginolyticus MCCC 1A17449等富集菌群可培养优势细菌都具有纤维素水解能力。
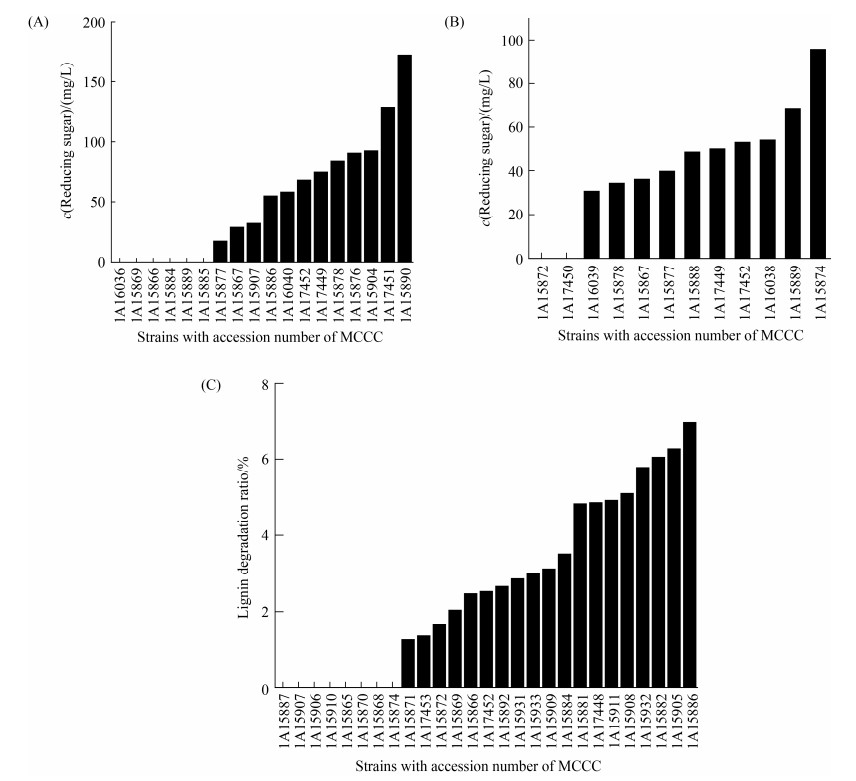
|
| 图 4 可培养细菌水解纤维素(A)、几丁质(B)还原糖浓度和对木质素(C)降解率 Figure 4 The concentration of cellulose (A), chitin (B) reducing sugar and the degradation rate of lignin (C) by culturable bacteria. |
以几丁质为碳源的富集培养基中分离到的细菌16S rRNA序列去重复后有13株,有10株细菌具有几丁质降解潜力(图 4-B)。相比于纤维素,几丁质的糖单体比葡萄糖多连接了一个乙酰氨基,且结合在氢连接的键位,导致几丁质的强度提高,所以对微生物水解的拮抗作用更显著,生成的还原糖含量比纤维素水解生成的还原糖含量低。梭杆菌门的Propionigenium maris MCCC 1A15874和Ilyobacter polytropus MCCC 1A15889水解几丁质生成的还原糖含量最高,水解14 d后培养基中的还原糖含量分别为95.7 mg/L和68.6 mg/L。其次,变形菌门的Pseudodesulfovibrio sp. MCCC 1A16038、拟杆菌门的Sunxiuqinia elliptica MCCC 1A17452和Prolixibacter bellariivorans MCCC 1A15888等也具有较好的几丁质水解能力。
相比于纤维素和几丁质,木质素富集物中分离到的细菌多样性更高,分离到的细菌16S rRNA序列去重复后有30株,通过木质素降解验证发现有19株细菌具有潜在木质素厌氧降解能力(图 4-C)。其中Ilyobacter tartaricus MCCC 1A15886对木质素的降解能力最强,培养14 d对木质素降解率接近7.00%,Ilyobacter tartaricus最初被发现具有发酵酒石酸对映体的能力[18]。此外,Mangrovibacterium lignilyticum MCCC 1A15882对木质素的14 d降解率高达6.05%。变形菌门的Desulfovibrio alaskensis MCCC 1A15905和Desulfomicrobium apsheronum MCCC 1A15932对木质素也具有较强的降解潜力,14 d降解率为6.27%和5.78%。
其中菌株Sunxiuqinia elliptica MCCC 1A17452具有降解纤维素、几丁质和木质素降解能力,其在纤维素和几丁质降解培养基中还原糖产生量分别为67.9 mg/L和53.2 mg/L,木质素降解率可达2.50%,具有较高的应用前景。Ilyobacter tartaricus MCCC 1A15886既具有木质素降解能力,又具有较高的纤维素降解能力。长杆菌属Prolixibacter bellariivorans MCCC 1A15878/1A15867,脱硫弧菌属Desulfovibrio salexigenes MCCC 1A15877,弧菌属Vibrio alginolyticus MCCC 1A17449均具有降解纤维素和几丁质的能力。鉴于这些菌株具有降解多种有机物的能力,均具有进一步应用开发的潜力。
3 讨论厌氧微生物是红树林沉积物中天然有机多聚物碳循环的主导者,尽管目前已经通过高通量测序技术发现了原位沉积物环境存在着大量厌氧微生物是潜在的天然有机多聚物降解功能菌群,但对于关键细菌的生态功能和代谢机制研究欠缺,主要原因是缺少沉积物中难培养菌的纯培养物。本研究基于厌氧定向富集和平板分离等手段对原位沉积物环境中参与纤维素、几丁质和木质素降解的厌氧可培养菌群进行了富集分离,共获得202株厌氧细菌,兼性和专性厌氧细菌分别占59.4%和40.6%,它们可能在原位沉积物环境中参与了天然有机多聚物的降解。
从纤维素和几丁质富集菌群中共分离68株和52株细菌,以变形菌门、拟杆菌门和厚壁菌门为主,在种水平上,Prolixibacter bellariivorans、Sunxiuqinia elliptica和Desulfovibrio salexigenes是从2个富集菌群中分离到的共有菌株,且都是优势菌。说明这些菌具有丰富的纤维素和几丁质降解能力。在纤维素富集菌群可培养细菌中,Labilibaculum manganireducens MCCC 1A15876分离频次较高,在其基因组序列注释到参与纤维素降解的内切葡聚糖酶基因(未发表数据)。该菌株最初被报道是一株高价铁锰还原菌[19],并未发现其具备纤维素降解能力。我们推测,该菌株可能是原位环境中一类以厌氧铁锰呼吸氧化纤维素的重要菌群。从几丁质富集菌群分离最多的是弧菌属(Vibrio),代表性菌株是MCCC 1A17449,与模式种Vibrio alginolyticus具有最高相似度为99.5%。前人已报道该菌种具有几丁质水解能力[20]。
此外,有研究报道,红树林缺氧层沉积物中的有机质是通过硫酸盐还原菌还原硫酸盐进行厌氧呼吸氧化分解,且这一过程几乎占沉积物中有机质矿化总量的75%[21-22]。Zhang等[23]基于16S rRNA基因序列对红树林泥潭中的微生物多样性分析发现,测序序列注释到高丰度的脱硫杆菌科(Desulfobacterace)和脱硫球茎菌科(Desulfobulbaceae)。本研究也证实了这些异养硫酸盐还原菌可能为重要的有机物降解菌株。从纤维素和几丁质富集培养物中共筛选分离16和10株属于δ-变形菌纲的硫酸盐还原菌,以Desulfovibrio salexigenes MCCC 1A15877相对丰度最高,其次为Halodesulfovibrio spirochaetisodalis MCCC 1A15872、Pseudodesulfovibrio profundus MCCC 1A16039、Pseudodesulfovibrio sp. MCCC 1A16040/1A16038、Pseudodesulfovibrio indicus MCCC 1A16037。
对可培养细菌降解3种天然有机多聚物降解能力分析发现,放线菌门菌株表现出优异的纤维素水解能力,梭杆菌门菌株对几丁质降解能力最佳,其次为拟杆菌门菌株。其中,拟杆菌门的Labilibaculum manganireducens MCCC 1A15876对纤维素降解能力较强;此外,Sunxiuqinia elliptica MCCC 1A17452和Prolixibacter bellariivorans MCCC 1A15888对几丁质的降解能力与较强,有意思的是,这3株菌均属于拟杆菌纲海洋滑动菌目(Marinilabiliales)的长杆菌科(Prolixibacteraceae)。海洋滑动菌目的共同特征是均为兼性厌氧菌,能发酵多种类的糖类化合物。我们推测它们在红树林原位沉积物参与了纤维素或几丁质等多糖类物质的厌氧发酵降解。
相比于纤维素和几丁质,木质素富集菌群中分离到的可培养细菌多样性更高,共分离82株厌氧细菌,其中16S rRNA基因序列不同的细菌有30株。拟杆菌门的Mangrovibacterium lignilyticum MCCC 1A15882在分离菌种中占比较高,且发现其具木质素降解能力[17]。目前鲜有关于拟杆菌门菌株降解木质素的报道。值得注意的是,从木质素富集菌群中分离了27株厚壁菌门菌株,数量显著高于纤维素和几丁质富集菌群,并且有3株细菌(Clostridium sp. MCCC 1A15884、Caminicella sp. MCCC 1A17445、Lachnotalea sp. MCCC 1A16036)与模式种最高相似度低于93.0%,低于界定新属的临界阈值。可见,原位沉积物环境仍存在许多潜在参与木质素降解代谢的厚壁菌门微生物,其分类地位较新颖,其对木质素的降解机制也有待进一步研究。此外,变形菌门的Desulfomicrobium apsheronum MCCC1A15932对木质素的降解能力较高,Desulfomicrobium在早先的研究中就已经发现具有木质素的厌氧降解能力[24]。
总之,本文通过对九龙江口红树林沉积物中纤维素、几丁质和木质素厌氧降解菌的富集、分离鉴定,获得了一批未培养厌氧降解菌,其中包含降解木质素的可能新属,为进一步研究红树林沉积物厌氧环境中微生物参与的有机物降解及海洋碳循环提供了相关参考和特殊菌种资源。
| [1] | Ghizelini AM, Mendonça-Hagler LCS, MacRae A. Microbial diversity in Brazilian mangrove sediments-a mini review. Brazilian Journal of Microbiology, 2012, 43(4): 1242-1254. DOI:10.1590/S1517-83822012000400002 |
| [2] | Breithaupt JL, Smoak JM, Smith Ⅲ TJ, Sanders CJ, Hoare A. Organic carbon burial rates in mangrove sediments: Strengthening the global budget. Global Biogeochemical Cycles, 2012, 26(3): GB3011. |
| [3] | Liu HX, Ren H, Hui DF, Wang WQ, Liao BW, Cao QX. Carbon stocks and potential carbon storage in the mangrove forests of China. Journal of Environmental Management, 2014, 133: 86-93. |
| [4] | Alongi DM. Bacterial productivity and microbial biomass in tropical mangrove sediments. Microbial Ecology, 1988, 15(1): 59-79. DOI:10.1007/BF02012952 |
| [5] | Behera P, Mohapatra M, Kim JY, Adhya TK, Pattnaik AK, Rastogi G. Spatial and temporal heterogeneity in the structure and function of sediment bacterial communities of a tropical mangrove forest. Environmental Science and Pollution Research, 2019, 26(4): 3893-3908. DOI:10.1007/s11356-018-3927-5 |
| [6] | Perera KARS, de Silva KHWL, Amarasinghe MD. Potential impact of predicted sea level rise on carbon sink function of mangrove ecosystems with special reference to Negombo estuary, Sri Lanka. Global and Planetary Change, 2018, 161: 162-171. DOI:10.1016/j.gloplacha.2017.12.016 |
| [7] | Bhattacharyya A, Majumder NS, Basak P, Mukherji S, Roy D, Nag S, Haldar A, Chattopadhyay D, Mitra S, Bhattacharyya M, Ghosh A. Diversity and distribution of Archaea in the mangrove sediment of sundarbans. Archaea, 2015: 1-14. |
| [8] | Dhal NK, Sahoo K. Potential microbial diversity in mangrove ecosystems: a review. Indian Journal of Geo-Marine Sciences, 2009, 38(2): 249-256. |
| [9] | Lyimo TJ, Pol A, Harhangi HR, Jetten MSM, Op den Camp HJM. Anaerobic oxidation of dimethylsulfide and methanethiol in mangrove sediments is dominated by sulfate-reducing bacteria. FEMS Microbiology Ecology, 2009, 70(3): 483-492. DOI:10.1111/j.1574-6941.2009.00765.x |
| [10] | Castro RA, Dourado MN, de Almeida JR, Lacava PT, Nave A, de Melo IS, de Azevedo JL, Quecine MC. Mangrove endophyte promotes reforestation tree (Acacia polyphylla) growth. Brazilian Journal of Microbiology, 2018, 49(1): 59-66. DOI:10.1016/j.bjm.2017.04.002 |
| [11] |
Zhao K, Xu PJ, Gu GY. Study on determination of reducing sugar content using 3, 5-dinitrosalicylic acid method. Food Science, 2008, 29(8): 534-536.
(in Chinese) 赵凯, 许鹏举, 谷广烨. 3, 5-二硝基水杨酸比色法测定还原糖含量的研究. 食品科学, 2008, 29(8): 534-536. DOI:10.3321/j.issn:1002-6630.2008.08.127 |
| [12] | Lara MA, Rodrı́guez-Malaver AJ, Rojas OJ, Holmquist O, González AM, Bullón J, Peñaloza N, Araujo E. Black liquor lignin biodegradation by Trametes elegans. International Biodeterioration & Biodegradation, 2003, 52(3): 167-173. |
| [13] | Holmes DE, Nevin KP, Woodard TL, Peacock AD, Lovley DR. Prolixibacter bellariivorans gen. nov., sp. nov., a sugar-fermenting, psychrotolerant anaerobe of the phylum Bacteroidetes, isolated from a marine-sediment fuel cell. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(4): 701-707. DOI:10.1099/ijs.0.64296-0 |
| [14] | Chen F, Dixon RA. Lignin modification improves fermentable sugar yields for biofuel production. Nature Biotechnology, 2007, 25(7): 759-761. DOI:10.1038/nbt1316 |
| [15] | Pérez J, Muñoz-Dorado J, de la Rubia T, Martínez J. Biodegradation and biological treatments of cellulose, hemicellulose and lignin: an overview. International Microbiology, 2002, 5(2): 53-63. DOI:10.1007/s10123-002-0062-3 |
| [16] | Wang JX, Liang JD, Gao S. Biodegradation of lignin monomers vanillic, p-coumaric, and syringic acid by the bacterial strain, Sphingobacterium sp. HY-H. Current Microbiology, 2018, 75(9): 1156-1164. DOI:10.1007/s00284-018-1504-2 |
| [17] | Sun C, Zeng X, Lai QL, Wang ZS, Shao ZZ. Mangrovibacterium lignilyticum sp. nov., a facultatively anaerobic lignin-degrading bacterium isolated from mangrove sediment. International Journal of Systematic and Evolutionary Microbiology, 2020, 70(8): 4502-4507. DOI:10.1099/ijsem.0.004305 |
| [18] | Schink B. Fermentation of tartrate enantiomers by anaerobic bacteria, and description of two new species of strict anaerobes, Ruminococcus pasteurii and Ilyobacter tartaricus. Archives of Microbiology, 1984, 139(4): 409-414. DOI:10.1007/BF00408388 |
| [19] | Vandieken V, Marshall IPG, Niemann H, Engelen B, Cypionka H. Labilibaculum manganireducens gen. nov., sp. nov. and Labilibaculum filiforme sp. nov., novel Bacteroidetes isolated from subsurface sediments of the Baltic Sea. Frontiers in Microbiology, 2017, 8: 2614. |
| [20] | Li XH, Xiao H, Zhang WJ, Li YQ, Tang XX, Duan JZ, Yang ZB, Wang J, Guan F, Ding GQ. Analysis of cultivable aerobic bacterial community composition and screening for facultative sulfate-reducing bacteria in marine corrosive steel. Journal of Oceanology and Limnology, 2019, 37(2): 600-614. DOI:10.1007/s00343-019-7400-1 |
| [21] | Kristensen E, Holmer M, Bussarawit N. Benthic metabolism and sulfate reduction in a Southeast Asian mangrove swamp. Marine Ecology Progress Series, 1991, 73: 93-103. DOI:10.3354/meps073093 |
| [22] | Crémière A, Strauss H, Sebilo M, Hong WL, Gros O, Schmidt S, Tocny J, Henry F, Gontharet S, Laverman AM. Sulfur diagenesis under rapid accumulation of organic-rich sediments in a marine mangrove from Guadeloupe (French West Indies). Chemical Geology, 2017, 454: 67-79. DOI:10.1016/j.chemgeo.2017.02.017 |
| [23] | Zhang XY, Hu BX, Ren HJ, Zhang J. Composition and functional diversity of microbial community across a mangrove-inhabited mudflat as revealed by 16S rDNA gene sequences. Science of the Total Environment, 2018, 633: 518-528. DOI:10.1016/j.scitotenv.2018.03.158 |
| [24] | Wang YX, Liu Q, Yan L, Gao YM, Wang YJ, Wang WD. A novel lignin degradation bacterial consortium for efficient pulping. Bioresource Technology, 2013, 139: 113-119. DOI:10.1016/j.biortech.2013.04.033 |
 2021, Vol. 61
2021, Vol. 61