中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 陈婉婷, 周明忠, 陈斌, 张鹏飞, 姜睿姣, 曾红梅, 涂藤, 陈弟诗, 杨泽晓, 罗燕, 姚学萍, 王印. 2021
- Wanting Chen, Mingzhong Zhou, Bin Chen, Pengfei Zhang, Ruijiao Jiang, Hongmei Zeng, Teng Tu, Dishi Chen, Zexiao Yang, Yan Luo, Xueping Yao, Yin Wang. 2021
- 兔出血症病毒2型理化特性研究
- Physicochemical properties of rabbit hemorrhagic disease virus type 2
- 微生物学报, 61(3): 707-713
- Acta Microbiologica Sinica, 61(3): 707-713
-
文章历史
- 收稿日期:2020-05-28
- 修回日期:2020-08-11
- 网络出版日期:2020-12-11
2. 四川省动物疫病预防控制中心, 四川 成都 610041;
3. 动物疫病与人类健康四川省重点实验室, 四川 成都 611130
2. Sichuan Center for Disease Control and Prevention, Chengdu 610041, Sichuan Province, China;
3. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Chengdu 611130, Sichuan Province, China
兔出血症病(rabbit hemorrhagic disease,RHD),又称兔瘟、兔出血症、兔出血性肺炎,是由嵌杯病毒科(Caliciviridae)兔病毒属(Lagovirus)兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)引起兔的一种急性、败血性、高度致死性传染病。经典RHDV呈二十面体对称球形,是一种无囊膜的单股正链RNA病毒[1-2]。该病毒于1984年首次在我国江苏无锡等地暴发[3],2月龄以下的吮乳兔或幼兔对本病有较强的抵抗力,不表现出临床症状,而2月龄以上的亚成年兔或成年兔对经典RHDV易感,发病率达100%,病死率达90%,病死兔以肝、脾、肾等器官出血、肿大,鼻腔、气管淤血等为特征[4-5]。该病潜伏期短、发病急、传播快,给全国养兔业造成了巨大的经济损失。
2020年4月,我国四川省某养兔场发生疑似RHD疫情,感染率为42.86%,死亡率高达为100%。经红细胞凝集试验、RT-PCR及测序分析等,确定该病原为兔出血症病毒2型(RHDV2),这是我国首次发现RHDV2型毒株。不同于经典RHDV[5-6],除成年兔外,RHDV2也可感染致死幼兔与亚成年兔[7-8],病死兔病理变化主要表现为气管充盈血色泡沫,肝脏肿大、边缘梗死,脾脏淤血、边缘钝圆,肺脏弥漫性出血等。RHDV2的感染病例由法国于2010年4月首次报道[9],导致家养和野生兔群的大面积感染和死亡。在不到一年的时间内,RHDV2迅速席卷南欧(葡萄牙、意大利和西班牙等),北欧和一些岛屿如亚速尔群岛。2015年,RHDV2在澳大利亚、非洲与其他欧洲国家被发现,次年在加拿大被发现,并继续在欧洲传播。6年后,RHDV2在美洲和大洋洲相继出现[10]。严重影响世界各国养兔业发展,同时导致全球野兔种群数量的急剧减少,给生态平衡带来严重的负面影响。
经典RHDV组织灭活疫苗对RHDV2的感染仅有有限保护作用[11],目前尚无有效防制措施。可通过发病兔群日龄、病死率与临床表现作出初步判断,经实验室检测确诊。应立即扑杀发病兔群,阻止感染面积的扩大,同时对养殖场环境、圈舍、物料等进行全面消毒处理。本研究拟对四川省某兔场疑似RHDV2感染病死兔进行RT-PCR检测及测序分析。并结合PMA-RT-qPCR探究RHDV2理化特性。叠氮溴化丙锭(PMA)是一种与核酸具有高度亲和性的光反应染料[12],可嵌入核酸分子并被强可见光激活修饰核酸,进而阻断目的基因的PCR扩增。由于PMA不能穿透病毒衣壳,因此以其处理含有失活病毒和仍具复制能力病毒的样品时,可修饰失活病毒(衣壳结构破坏)核酸,结合PCR可实现对样品中具有复制能力病毒的定性定量检测[13]。本研究结论可为RHDV2致病机理研究、疫苗研发提供参考材料和理论依据,为临床生产中饲料制粒工艺优化、高效消毒剂与疫苗灭活剂选择提供指导。
1 材料和方法 1.1 材料1.1.1 样品来源: 病料样品来源为2020年4月四川省某兔场疑似RHDV2感染的病死兔(20–60日龄)。
1.1.2 主要试剂和仪器: 病毒基因组RNA提取试剂盒购自于宝生物工程(大连)有限公司;2×Taq PCR Master Mix、2×SYBR Green Pro Taq HS Premix、反转录试剂盒购自于湖南艾科瑞生物工程有限公司;叠氮溴化丙锭(PMA)购自Biotium公司;其余试剂均为国产分析纯。
1.1.3 引物序列: PCR和qPCR引物参考本实验室已建立的方法[14] (表 1),引物由生工生物工程(上海)股份有限公司合成。PCR反应体积(20 μL)包含10 μL的2×SYBR Green Pro Taq HS Premix或2×Taq PCR Master Mix,每种引物(F/R) 1 μL (10 μmol/L),2 μL模板,ddH2O补足20 μL。
| Primers | Primer sequences (5′→3′) | Annealing tempe/℃ | Fragment/bp |
| RHDV2-PCR-F | GGGTGTCATATCCACCCCAAA | 53.0 | 441 |
| RHDV2-PCR-R | CCCAGGTTGAACACGAG | ||
| RHDV2-qPCR-F | ACTCTCACTRAACAATTACTC | 55.4 | 101 |
| RHDV2-qPCR-R | ATCAACACTCAAGCCAAG |
1.2 病死兔剖解及样品处理
在严格生物安全条件下对送检病死兔进行解剖,采集心脏、肺脏、脾脏、肝脏和肾脏用于提取病毒RNA。
1.3 RNA的提取与cDNA合成:取病变组织,按宝生物生物技术有限公司病毒RNA提取试剂盒说明书进行操作,提取病毒RNA,–80 ℃备用。以提取的RNA作为模板,使用反转录试剂盒获得cDNA于–20 ℃保存备用。
1.4 RT-PCR与RT-qPCR检测以上述反转录获得的cDNA作为模板,以RHDV2-PCR-F/R引物进行扩增。反应结束后,取PCR产物经琼脂糖凝胶电泳检测后回收目的条带,送至生工生物工程(上海)股份有限公司测序,测序结果用BLAST比对分析。核酸阳性样品以RHDV2-qPCR-F/R引物进行qPCR检测,验证该引物的特异性。
1.5 病毒液的制备含RHDV2肝脏和脾脏组织,研磨成匀浆并反复冻融3次。用无菌0.22 μm滤头过滤制成病毒液,分装后于–80 ℃保存。
1.6 病毒片的制备制备大小为10 mm×10 mm的无菌方形滤纸片若干作为吸附介质,平铺于无菌平皿内,逐片滴加病毒液,滴加量为10 μL/片。用接种环涂匀整个介质表面,置室温下自然阴干后备用。
1.7 RHDV2对酸碱敏感性用50 μL HCl (pH=1、pH=3)或NaOH溶液(pH=10、pH=13)均匀滴加于病毒片表面,静置30 min后,取病毒片于含500 μL无菌蒸馏水的离心管中振荡离心,取200 μL备用,每样重复3组。
1.8 RHDV2对热敏感性将病毒片置于离心管中,经65 ℃处理30 min,85 ℃处理30 s、1 min、2 min、3 min后,分别置于含500 μL无菌蒸馏水的离心管中振荡离心,取200 μL备用,每处理重复3组。
1.9 RHDV2对兽用消毒剂敏感性将病毒片置于一次性无菌培养皿中,用50 μL过硫酸氢钾(0.5%)、聚维酮碘(0.1%)、75%酒精,均匀滴加于病毒片表面,作用30 min后,收集病毒片于含500 μL无菌蒸馏水的离心管中,取200 μL备用,每样重复3组。
1.10 RHDV2对不同浓度甲醛的敏感性用50 μL 0.2%、0.3%甲醛分别均匀滴加于病毒片表面,作用30 min后,收集病毒片于含500 μL无菌蒸馏水的离心管中,取200 μL备用,每样重复3组。
1.11 PMA处理样品与RHDV2 PMA-RT-qPCR检测200 μL各处理组样本,分别加入10 μL PMA染液(至终浓度2 mmol/μL),1500 r/min,离心10 min。再置于暗室孵育15 min。将所有管置于冰上,在500 W卤素灯下照射15 min后保存备用。使用病毒基因组RNA提取试剂盒提取上述各处理组样品的病毒RNA,用于RT-qPCR检测。
1.12 数据分析统计归纳各组RT-qPCR检测所得拷贝数,并对拷贝数做log转换处理。计算各处理病毒杀灭率(公式1)。

|
(1) |
用引物RHDV2-PCR-F/R扩增VP60基因序列,产物经琼脂糖凝胶电泳可见在441 bp左右有一特异性扩增条带(图 1),产物测序后经BLAST比对分析,结果显示,目的片段基因序列与GenBank中RHDV2 VP60基因(登录号:MN276176.1)的一致性为98.35%。

|
| 图 1 RHDV2 VP60 PCR扩增结果 Figure 1 PCR detection of RHDV2 VP60 gene. M: DNA marker DL2000; 1: RHDV2 VP60 amplification target band; 2: negative control. |
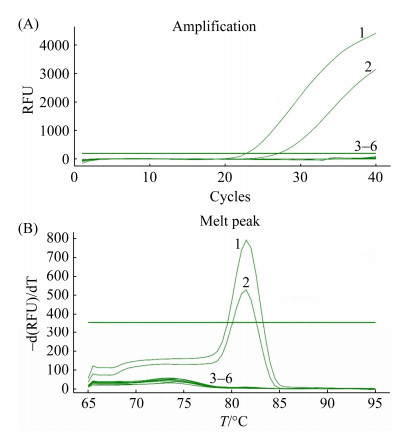
组织病料提取RNA进行RT-qPCR检测,结果表明,RHDV2为阳性,经典RHDV、兔巴氏杆菌、欧洲褐兔综合征病毒(European brown hare syndrome virus,EBHSV)均为核酸阴性[15] (图 2-A、B)。
|
| 图 2 RHDV2扩增曲线与熔解曲线 Figure 2 RHDV2 amplification curve and dissolution curve. A: amplification curve; B: dissolution curve. 1: pMD19T-RHDV2-VP60; 2: diseased tissue material for testing; 3–6: negative control (pMD19T), pMD19T- RHDV441, pGM-T-EBSHV, Pasteurella multocida. |
2.2 RHDV2对酸碱敏感性
用不同pH值的酸碱处理病毒片后,提取病毒RNA并进行PMA-RT-qPCR检测,每处理重复3组,计算病毒拷贝数均值以及病毒杀灭率。结果表明,RHDV2对酸碱均敏感,随pH值降低或升高,病毒杀灭率均有提高(表 2)。RHDV2对盐酸(pH=3)与氢氧化钠溶液(pH=10)敏感性较低,随pH值降低或升高,病毒杀灭率均有提高。与经典RHDV相比,RHDV2同样对酸碱有一定的耐受力[16]。在实际生产应用中,盐酸(pH=1)或氢氧化钠溶液(pH=13)可用于养殖场内环境(如地面、圈舍、沟渠等)与外环境(养殖场外围、公路等)的消毒,但在使用后需注意对废液的中和处理,以免影响环境。
| Treatment | Log (Mean copy number) | Inactivation rate/% |
| HCl (pH=1) | 3.95 | 95.32 |
| HCl (pH=3) | 4.37 | 88.78 |
| NaOH (pH=10) | 4.83 | 66.12 |
| NaOH (pH=13) | 4.4 | 87.98 |
2.3 RHDV2对热敏感性
病毒片置于无菌离心管,经65 ℃处理30 min,85 ℃处理30 s、1 min、2 min、3 min后,提取病毒RNA并进行PMA-RT-qPCR检测,每处理重复3组,计算病毒拷贝数均值以及病毒杀灭率。结果表明,两种试验温度均对RHDV2有杀灭作用,65 ℃处理毒片30 min后,病毒杀灭率可达77.61%。用83 ℃处理毒片,病毒杀灭率随时间的延长而升高,处理时间延长至3 min对病毒的杀灭率有大幅度提升(表 3)。在实际饲料生产中,调制与制粒过程(80–83 ℃)不仅可以杀灭细菌[17],也能对原料中可能存在的RHDV2有杀灭作用,生产中针对消除RHDV2潜在威胁的制粒工艺优化可考虑适当延长作用时间。
| Treatment | Log (Mean copy number) | Inactivation rate/% |
| 65 ℃, 30 min |
4.63 | 77.61 |
| 83 ℃, 1 min | 4.65 | 76.56 |
| 83 ℃, 3 min | 4.22 | 92.41 |
| 83 ℃, 5 min | 4.06 | 95.10 |
2.4 RHDV2对兽用消毒剂敏感性
用不同兽用消毒剂处理病毒片后,提取病毒RNA并进行PMA-RT-qPCR检测,每处理重复3组,计算病毒拷贝数均值以及病毒杀灭率。结果表明,试验所用3种消毒剂对RHDV2的杀灭率均在80%以上,其中聚维酮碘对RHDV2杀灭作用最好,病毒杀灭率高达88.78%;75%乙醇其次,杀灭率可达84.51%;0.5%过硫酸氢钾杀灭率为80.05% (表 4)。据此,在生产中可选择高效且成本可控的消毒剂。
| Treatment | Log (Mean copy number) | Inactivation rate/% |
| 0.5% potassium peroxymonosulfate | 4.58 | 80.05 |
| 0.1% povidone iodine | 5.06 | 88.78 |
| 75% ethanol | 4.5 | 84.51 |
2.5 RHDV2对不同浓度甲醛的敏感性
用两种浓度甲醛处理病毒片后,提取病毒RNA并进行PMA-RT-qPCR检测,每处理重复3组,计算病毒拷贝数均值以及病毒杀灭率。两种浓度的甲醛对病毒都有杀灭作用,0.3%甲醛的杀灭率优于0.2%甲醛,杀灭率可达82.22% (表 5)。甲醛是灭活疫苗生产中常用的灭活剂[18],适当浓度的甲醛灭活病毒后,病毒抗原性、血凝性均不改变,故常用于灭活疫苗的制备。其作用浓度为0.1%–0.8%,需37–39 ℃处理24 h以上。鉴于经典RHDV组织灭活疫苗对RHDV2的感染仅有有限的保护力,故需研发针对RHDV2的有效疫苗。本研究结果表明,甲醛可有效灭活RHDV2,可用于疫苗制备。
| Treatment | Log (Mean copy number) | Inactivation rate/% |
| 0.2% formaldehyde | 5.14 | 71.16 |
| 0.3% formaldehyde | 4.53 | 82.22 |
由于RHDV2不能在体外培养,阻碍了对该病毒的进一步研究。经典RHDV的理化特性研究是将病毒液处理后,注射在兔体内,以其发病率和死亡率作为研究结果[19]。但该方法受到试验动物自身健康状态、饲养环境等因素的限制,且结果并不代表病毒拷贝数的改变。故经典RHDV的理化特性研究仍有待进一步完善。本研究采用PMA-RT- qPCR用于RHDV2理化特性的检测,利用PMA修饰失活病毒核酸阻断PCR扩增,结合qPCR实现了对待检病毒是否具有复制能力的区分,为今后开展RHDV2相关研究提供重要的科学依据。
| [1] | Meyers G, Wirblich C, Thiel HJ. Rabbit hemorrhagic disease virus-molecular cloning and nucleotide sequencing of a calicivirus genome. Virology, 1991, 184(2): 664-676. DOI:10.1016/0042-6822(91)90436-F |
| [2] | Parra F, Prieto M. Purification and characterization of a calicivirus as the causative agent of a lethal hemorrhagic disease in rabbits. Journal of Virology, 1990, 64(8): 4013-4015. DOI:10.1128/JVI.64.8.4013-4015.1990 |
| [3] |
Liu SJ, Xue HP, Pu BQ, Qian NH, Xu WY, Du NX. A new viral disease of rabbit——viral hemorrhage in rabbit. Animal Husbandry and Veterinary Medicine, 1984, 16(6): 253-255.
(in Chinese) 刘胜江, 薛华平, 浦伯清, 钱年华, 徐为燕, 杜念兴. 兔的一种新病毒病——兔病毒性出血症. 畜牧与兽医, 1984, 16(6): 253-255. |
| [4] | Abrantes J, van der Loo W, Le Pendu J, Esteves PJ. Rabbit haemorrhagic disease (RHD) and rabbit haemorrhagic disease virus (RHDV): a review. Veterinary Research, 2012, 43(1): 12. DOI:10.1186/1297-9716-43-12 |
| [5] | McIntosh MT, Behan SC, Mohamed FM, Lu ZQ, Moran KE, Burrage TG, Neilan JG, Ward GB, Botti G, Capucci L, Metwally SA. A pandemic strain of calicivirus threatens rabbit industries in the Americas. Virology Journal, 2007, 4: 96. DOI:10.1186/1743-422X-4-96 |
| [6] | Lavazza A, Scicluna MT, Capucci L. Susceptibility of hares and rabbits to the European brown hare syndrome virus (EBHSV) and rabbit haemorrhagic disease virus (RHDV) under experimental conditions. Journal of Veterinary Medicine. Series B, 1996, 43(7): 401-410. |
| [7] | Puggioni G, Cavadini P, Maestrale C, Scivoli R, Botti G, Ligios C, Le Gall-Reculé G, Lavazza A, Capucci L. The new French 2010Rabbit Hemorrhagic Disease Virus causes an RHD-like disease in the Sardinian Cape hare (Lepus capensis mediterraneus). Veterinary Research, 2013, 44(1): 96. DOI:10.1186/1297-9716-44-96 |
| [8] | Camarda A, Pugliese N, Cavadini P, Circella E, Capucci L, Caroli A, Legretto M, Mallia E, Lavazza A. Detection of the new emerging rabbit haemorrhagic disease type 2 virus (RHDV2) in Sicily from rabbit (Oryctolagus cuniculus) and Italian hare (Lepus corsicanus). Research in Veterinary Science, 2014, 97(3): 642-645. DOI:10.1016/j.rvsc.2014.10.008 |
| [9] | Le Gall-Reculé G, Zwingelstein F, Boucher S, Le Normand B, Plassiart G, Portejoie Y, Decors A, Bertagnoli S, Guérin JL, Marchandeau S. Detection of a new variant of rabbit haemorrhagic disease virus in France. Veterinary Record, 2011, 168(5): 137-138. |
| [10] | Rouco C, Aguayo-Adán JA, Santoro S, Abrantes J, Delibes-Mateos M. Worldwide rapid spread of the novel rabbit haemorrhagic disease virus (GI.2/RHDV2/b). Transboundary and Emerging Diseases, 2019, 66(4): 1762-1764. |
| [11] |
Tan YG, Zhu J, Guo HM, Wu QM, Chen ZY, Li CF, Liu GQ. Prokaryotic expression and preparation of polyclonal antibodies of VP60 protein from new rabbit hemorrhagic disease virus. Chinese Veterinary Science, 2016, 46(3): 332-337.
(in Chinese) 谭永贵, 朱杰, 郭慧敏, 吴巧梅, 陈宗艳, 李传峰, 刘光清. 新型兔出血症病毒(RHDV2) VP60蛋白的原核表达及多克隆抗体的制备. 中国兽医科学, 2016, 46(3): 332-337. |
| [12] | 於颖. PMA-qPCR定量检测畜禽肉类中食源性致病菌活菌的研究. 东华大学硕士学位论文, 2015. |
| [13] | Deshmukh R, Bhand S, Roy U. A novel method for rapid and sensitive detection of viable Escherichia coli cells using UV-induced PMA-coupled quantitative PCR. Brazilian Journal of Microbiology, 2020, 51(2): 773-778. DOI:10.1007/s42770-019-00161-8 |
| [14] | 王波. 用SYBR Green Ⅰ实时荧光定量RT-PCR方法检测RHDV、RHDV2的初步研究. 四川农业大学硕士学位论文, 2016. |
| [15] |
Yang ZX, Zhao XL, Li Y, Yao XP, Wang Y, Liu YD, Meng ZQ, Geng Y, Bai Y. Development of a complex RT-PCR for the detection and differentiation of rabbit hemorrhagic disease virus and rabbit hemorrhagic disease virus 2. Chinese Veterinary Science, 2016, 46(6): 710-716.
(in Chinese) 杨泽晓, 赵希仑, 李岩, 姚学萍, 王印, 刘亚东, 蒙正群, 耿毅, 白瑜. 兔出血症病毒与兔出血症病毒2型复合RT-PCR检测方法的初步研究. 中国兽医科学, 2016, 46(6): 710-716. |
| [16] |
Tang SW. Research progress on rabbit viral hemorrhagic disease. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2010(5): 21-22.
(in Chinese) 汤少伟. 兔病毒性出血症研究进展. 上海畜牧兽医通讯, 2010(5): 21-22. |
| [17] |
Qin Y, Wang JR, Qiao HZ, Yu CP, Li LR, Chen YJ, Huang J. The effect of processing technology on nutritional quality of feed. Feed Research, 2019, 42(12): 83-86.
(in Chinese) 秦毅, 王金荣, 乔汉桢, 于翠萍, 李林儒, 陈勇江, 黄进. 加工工艺对饲料营养品质的影响. 饲料研究, 2019, 42(12): 83-86. |
| [18] |
Xu SZ, Yin YB, Wang X. Research progress on routine inactivants in veterinary vaccines. China Animal Husbandry & Veterinary Medicine, 2010, 37(9): 162-167.
(in Chinese) 徐守振, 尹燕博, 王新. 动物疫苗中常用抗原灭活剂的研究进展. 中国畜牧兽医, 2010, 37(9): 162-167. |
| [19] |
Du NX, Xu WY, Liu SJ, Xu FN, Yu YR, Li RJ. Studies on rabbit haemorrhagic disease. Scientia Agricultura Sinica, 1991, 24(1): 1-10.
(in Chinese) 杜念兴, 徐为燕, 刘胜江, 徐福南, 虞蕴如, 李汝俭. 兔出血症研究. 中国农业科学, 1991, 24(1): 1-10. |
 2021, Vol. 61
2021, Vol. 61