中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 许淑娟, 谢晶莹, 冯若飞. 2021
- Shujuan Xu, Jingying Xie, Ruofei Feng. 2021
- DEAD-box RNA解旋酶家族在天然免疫应答信号通路中的作用
- DEAD-box RNA helicase family in innate immune response signaling pathway
- 微生物学报, 61(3): 587-595
- Acta Microbiologica Sinica, 61(3): 587-595
-
文章历史
- 收稿日期:2020-05-28
- 修回日期:2020-08-17
- 网络出版日期:2020-09-25
2. 甘肃农业大学动物医学院, 甘肃 兰州 730070
2. College of Veterinary Medicine, Gansu Agricultural University, Lanzhou 730070, Gansu Province, China
DEAD-box蛋白家族是一大类依赖于ATP的RNA解旋酶,通过和RNA结合并相互作用促进RNA折叠和/或构象重排[1]。它们拥有识别RNA和广泛参与多个细胞过程的能力,导致它们可以以多种方式影响病毒感染宿主细胞后引起的天然免疫应答。天然免疫(innate immune)是抵抗病原微生物感染的第一道防线,在病原微生物感染的早期识别过程及诱发炎症反应过程中发挥重要作用。天然免疫反应是免疫细胞通过一些固定的模式识别受体(pattern-recognition receptors,PRRs)识别病原相关模式分子(pathogen-associated molecular patterns,PAMPs),主要的PRRs包括Toll样受体(Toll-like receptor,TLRs)、NOD样受体(NOD-like receptor,NLRs)、RIG-Ⅰ样受体(RIG-like receptor,RLRs)和细胞质的DNA受体。不同的PRRs激活特定的信号通路,共同引发免疫细胞发生非特异性免疫反应,包括诱导细胞因子表达、产生促炎因子和引发细胞死亡。近年来,许多研究表明DEAD-box解旋酶家族成员广泛参与细胞抗病毒天然免疫过程,它们通过识别病毒核酸或调控天然免疫信号通路的重要分子来发挥其抗病毒功能。因此,研究并解读DEAD-box解旋酶蛋白家族在病毒感染宿主细胞过程中所起的作用有十分重要的意义,接下来我们将讨论DEAD-box解旋酶家族成员在病毒感染中扮演的不同角色。
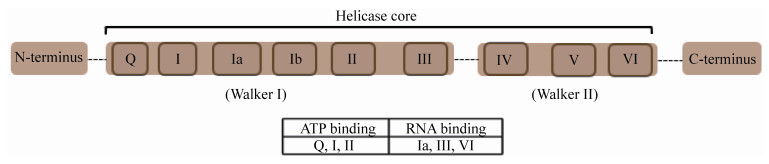
1 DEAD-box解旋酶家族的结构与功能DEAD-box RNA解旋酶家族属于真核RNA解旋酶超家族SF2,是参与细胞活动的最大解旋酶家族之一,目前发现的人源DEAD-box RNA解旋酶有36种。该家族在不同物种中具有高度保守性,它们在结构上几乎相同,所有成员的核心区域包含2个类似细菌RecA的结构域,结构域中有9个相似的保守基序:基序Q、基序Ⅰ、基序Ia、基序Ib、基序Ⅱ、基序Ⅲ、基序Ⅳ、基序Ⅴ和基序Ⅵ (图 1),这些基序形成了RNA和ATP结合位点[1]。其中基序Ⅱ DEAD (Asp-Glu-Ala-Asp)氨基酸序列是最保守的,也是发挥解旋酶活性的重要基序,因此该家族命名为DEAD-box解旋酶家族。除此之外,解旋酶核心区域的两侧是N端结构域和C端结构域,长度从几十个氨基酸到几百个氨基酸不等。不同成员的N端结构和C端结构略有差别,是区分不同成员的重要因素。研究人员认为这些结构域促进了DEAD-box解旋酶与其他蛋白质和/或RNA的相互作用。体外对DEAD-box解旋酶的研究表明,这些蛋白质参与RNA代谢的多个过程:翻译起始、前体mRNA剪接、mRNA输出和衰变以及核糖体的生物合成等[2]。在这些过程中,它们的功能包括局部解开RNA双链、重塑RNA-蛋白质复合物、ATP依赖的RNA结合和RNA双链退火。
|
| 图 1 DEAD-box解旋酶基序图 Figure 1 The motifs defining the dead-box helicases. |
2 DEAD-box解旋酶家族对病毒增殖的负调节作用
宿主细胞遭受病毒感染时,首先先天免疫应答会启动对入侵病原体的识别。病毒识别依赖于病毒的RNA/DNA特征,比如独特的RNA/DNA结构和dsRNA复制中间体。部分DEAD-box解旋酶作为RNA结合蛋白在识别病毒感染中发挥重要作用。在已知的研究中,经典的RIG-Ⅰ样受体介导的信号通路为RIG-Ⅰ或黑色素瘤分化相关基因(melanoma differentiation-associated gene-5,MDA5)通过与病毒RNA结合,激活RLR信号级联,上调Ⅰ型干扰素(Interferon,IFN-α/β)的表达。对RIG-Ⅰ和MDA5的结构分析发现它们都具有DEAD解旋酶核心结构域,即它们都属于DEAD-box解旋酶家族。RIG-Ⅰ可识别没有加帽的病毒RNA和短的5′ dsRNAs复制中间体,而MDA5能结合较长的dsRNA复制中间体。除DEAD结构域外,它们还具有活化半胱天冬酶的效应结构域(CARDs)[3-5]。胞质中RIG-Ⅰ和MDA5都通过CARD结构域结合并激活线粒体中的线粒体抗病毒信号蛋白(mitochondria antiviral signaling protein,MAVS),引起IKKε (IkappaB kinase)和TBK1 (TANK-binding kinase 1)复合物的募集。然后IKKε/TBK1复合物引起IRF3/7 (interferon regulatory factor 3/7)磷酸化及核移位以激活IFN-Ⅰ转录[6]。同时,宿主为增强先天免疫效果,IFN-α/β以自分泌和旁分泌的方式刺激同源受体,激活JAK (Janus kinase)/STAT (signal transducer and activator of transcription)信号通路,导致数百个IFN刺激基因表达[7]。激活的干扰素刺激基因包括多种RNA解旋酶,例如RIG-Ⅰ、MDA5、DDX60和DDX60L等。
在现有的研究中发现DDX1可能参与病毒感染过程中先天性免疫信号通路的激活。Zhang等发现它可作为传感器识别并结合poly(I: C),将信号传递给DDX21和DHX36,然后通过DDX21和DHX36触发信号传递给IFN-β[8],激活IFN I信号通路。例如,Zhou等发现在猪肠道致病性冠状病毒(transmissible gastroenteritis coronavirus,TGEV)研究中,DDX1和TGEV非结构蛋白nsp14共同作用并充当Ⅰ型干扰素信号通路的共激活因子,增强通过核因子κB (nuclear factor kappa-B,NF-κB)诱导的IFN-β产生。DDX1也可以通过与口蹄疫病毒(foot-and-mouth disease virus,FMDV) 3D蛋白结合并促进Ⅰ型IFN产生[9]。高表达的IFN-β会抑制病毒在宿主细胞体内增殖,达到抑制病毒的目的。
与DDX1类似,DDX3也是最早在病毒感染宿主细胞中被鉴定为可以参与病毒RNA识别的RNA解旋酶之一,该酶对病毒RNA的应用具有重要意义[10]。Ko等在DDX3对乙肝病毒(hepatitis B virus,HBV)复制的体外研究中发现DDX3通过抑制HBV的共价闭环DNA转录来抑制HBV的增殖[11]。不仅如此,DDX家族成员的先天免疫功能还包括作为蛋白质与蛋白质之间相互作用的支架,促进先天免疫信号转导。DDX3通过与TBK1/IKKε结合激活IRF3/7信号进而调节HBV感染宿主细胞的先天免疫应答(图 2)。Li等的结果表明,DDX3在登革热病毒(Dengue virus,DENV)早期感染过程中通过诱导IFNβ的产生发挥抗病毒作用[12]。在B型流感病毒(influenza viruses,IVs)的研究中,发现DDX6作为RNA共传感器,增强了RIG-Ⅰ介导的IFN-β的诱导表达[13]。这些文章有力地证明了DEAD-box解旋酶有助于宿主激活这些经典免疫信号通路以应对胞质病毒RNA。不仅如此,DDX家族还参与固有免疫的另一个重要监测机制——胞质DNA识别。通过已有的研究,我们了解了cGAS-STING途径,cGAS (cyclic GMP-AMP synthase)对DNA的识别导致产生环二核苷酸(cyclic dinucleotide,cGAMP)结合干扰素基因刺激蛋白(stimulator of interferon genes,STING)信号,进而导致TBK1的磷酸化。然而,近几年有报道称DDX41在cGAS-STING途径充当一个重要角色。它在单纯疱疹病毒(herpes simplex virus,HSV)感染和B型DNA转录的研究中充当dsDNA传感器。Chang CJ的研究发现DDX41可以与位于内质网膜上的STING形成复合物,从而触发TBK1磷酸化激活下游IRF3和NF-κB,引起IFN-I产生[14-15]。在此之后,Ma等继续证明了DDX41有效地响应了poly(dA: dT)和cGAMP刺激并诱导产生IFN-β的这一过程[16]。由此可见,DEAD-box家族在应对病毒的负调节时不仅仅作为识别病毒的工具,同时还是抗病毒的效应器。

|
| 图 2 DEAD-box解旋酶正调节固有免疫相关信号通路 Figure 2 DEAD-box helicase positively regulates innate immunity-related signal pathways. |
3 DEAD-box蛋白家族对病毒增殖的正调节作用
病毒在宿主细胞内常常会挟持大量的宿主细胞蛋白促进自身繁殖,其中有很多DDX解旋酶家族成员。大量研究报道病毒挟持DDX1充当病毒复制的辅助因子进而促进病毒增殖,包括人类免疫缺陷病毒(human immunodeficiency virus-1,HIV-1)、丙肝病毒(hepatitis C virus,HCV)、严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS)、委内瑞拉马脑炎病(venezuelan equine encephalitis virus,VEEV)和JC病毒(John cunningham virus,JCV)等[17]。在前人的研究中我们得知,部分剪接或未剪接的HIV RNA转录本的核输出需要病毒蛋白核出口调控蛋白(the protein regulator of expression of virion,Rev)与Rev响应元件(the rev response element,RRE)结合,并以协作的方式进行寡聚化。Hammond等的研究发现DDX1在HIV复制时,可以在体内与含Rev的HIV转录物相互作用,在体外与RRE和Rev直接相互作用形成转运复合体以及促进Rev蛋白寡聚化[18]。除此之外,在Lin等的研究中还发现DDX1的主要作用是维持Rev/RRE核质转运复合物的稳定性,从而确保Rev蛋白的正确定位[19]。
DDX3的N末端具有NES序列,NES是一种核定位信号,拥有NES序列的蛋白可以从细胞核穿梭到细胞质中。Yedavalli等的研究中也证实DDX3依靠核转运蛋白Exportin-1可以穿梭到胞质中,并且它与Rev/RRE/CRM1运输复合物结合可增强未剪接或部分剪接的HIV RNA从细胞核到细胞质的输出。研究人员对DDX3进行siRNA或突变体处理后发现Rev/RRE/CRM1复合体运输功能减弱,说明它介导了Rev蛋白依赖性的HIV RNA转运[20-22]。除了调节Rev蛋白功能外,DDX3还直接与HIV-1 Tat蛋白相互作用,促进Tat蛋白的功能以及HIV-1 mRNA的翻译[23]。近年来研究发现,调节HIV的Rev蛋白功能需要依靠多种DDX家族成员,DDX5 (p68)、DDX17、DDX21、DDX24、DDX36、DDX47、DDX56和DHX9均涉及,并共同调节Rev蛋白的功能[24-26] (图 3)。

|
| 图 3 DEAD-box解旋酶家族成员促进病毒增殖 Figure 3 DEAD-box helicase family promotes virus proliferation. |
目前针对其他DDX家族成员研究中,对病毒感染引起的固有免疫的负调节报道较少。其中,DDX5可作为转录辅助因子与病毒非结构蛋白直接结合促进病毒增殖,例如SARS-CoV解旋酶nsp13蛋白、HCV NS5B蛋白等[27-28]。与DDX3不同的是Upadya等在HCV感染的宿主细胞中发现DDX5缺乏C端会失去从细胞核重新定位到细胞质中的能力[29]。武炜利用RNA病毒或DNA病毒感染Hela细胞发现激活Caspase3/6能够使DDX21发生自体切割,切割后的DDX21会从细胞核的核仁迁移进入细胞质并抑制IFN的产生[30]。DHX15可通过促进HBV增强子/核心启动子活性,增强HBV RNA转录从而上调HBV DNA复制[31]。Jin等的研究发现在PRRSV感染MARC-145细胞时,病毒蛋白nsp2的N端、nsp10的中间端和C端分别能与DDX18结合,并使DDX18的亚细胞定位从核内转移至胞质中,促进PRRSV的复制[32]。Feng等在RNA病毒感染过程中发现DDX25通过干扰DENV病毒诱导的IRF3和NF-κB的核移位来阻断IFN信号通路,从而达到DENV利用宿主因子逃避宿主固有免疫应答的目的[33]。Zheng等的研究指出DDX46可以通过保守的CCGGUU元件结合MAVS、TRAF3 (TNF receptor-associated factor 3)和TRAF6转录本。在病毒感染后,DDX46依靠它的DEAD解旋酶结构域募集了m6A脱甲基酶ALKBH5,m6A修饰这些抗病毒转录本使其去甲基化,让这些转录本停留在细胞核中,因此阻止了它们的翻译并抑制了干扰素的产生[34]。在FMDV体外复制研究中,DDX56通过破坏IRF3与IPO5 (importin-5)的相互作用而阻止IRF3的入核,最终减少病毒引起的Ⅰ型干扰素的生成[35]。同时,在同为小RNA病毒科的脑心肌炎病毒(encephalomyocarditis virus,EMCV)的研究中发现,EMCV也可以利用DDX56作为病毒复制的辅助因子来帮助病毒增殖。通过以上报道可知,病毒通常会改变DEAD-box解旋酶家族成员在宿主细胞中的分布,或是利用自身的非结构蛋白与它们结合并相互作用,阻断先天免疫信号通路转导,以达到免疫逃逸的目的。
4 展望迄今为止,文献报道的DEAD-box解旋酶家族与病毒的关系可能只是冰山一角,因为该家族成员在病毒感染引起的先天免疫调节中扮演着不同的角色,揭示了病毒感染与RNA解旋酶在许多方面的相互作用。其次,DEAD-box解旋酶与病毒的相互作用具有高度的独立性:同一种DDX解旋酶会以多种方式参与病毒的复制过程的多个阶段,这是因为RNA结合过程在病毒复制的许多情况下是很重要的。同样,上述多个DDX家族成员的研究表明解旋酶活性对其抗病毒效应是必不可少的。令人非常感兴趣的是,部分DDX家族成员在病毒感染的研究中具有两面性:一方面影响病毒的固有免疫途径;另一方面却在帮助RNA病毒复制。例如DDX3和DDX1,它们不仅可以作为传感器识别病毒RNA,也可以作为抗病毒的效应器。比较DDX5 (P68)和DDX17 (P72/P82)时证实它们的同源性高达70%[36],并且在Fuller-Pace等的研究中发现它们在正常细胞中转录调控、RNA剪接和核糖体生物合成方面显示出相似的功能。但是涉及病毒感染方面的研究时,DDX17有效地抑制了布尼亚病毒科(Bunyavirus)的裂谷热病毒(Rift Valley fever virus,RVFV)和拉克罗斯病毒(La Crosse virus,LACV),而DDX5不具有类似的功能。DDX17能优先与RVFV成熟mRNA结合,并显示出对CT和CA重复元件的偏好性;其次还发现DDX17与RVFV的一种pre-miRNA发夹结合抑制病毒复制。但是在水泡性口炎病毒(vesicular stomatitis virus,VSV)病毒研究中发现DDX17与病毒复制毫无关系,表明DDX17对病毒的作用有选择性[37]。
随着生物学技术的不断发展,对DEAD-box家族的研究不断深入,目前已经获得了DEAD-box家族中部分成员的晶体结构,以及一些具有针对性的小分子抑制剂。可是,对于DEAD-box家族成员在天然免疫应答以及抗病毒反应中的作用,我们仍还有很多疑惑。希望在未来能看到将它们开发成新型抗病毒药物用于临床,为人类的生命健康提供助力。
| [1] | 王新. DDX3调控NF-κB信号通路的机制研究. 南京农业大学博士学位论文, 2017. |
| [2] | Rudolph MG, Klostermeier D. When core competence is not enough: functional interplay of the DEAD-box helicase core with ancillary domains and auxiliary factors in RNA binding and unwinding. Biological Chemistry, 2015, 396(8): 849-865. DOI:10.1515/hsz-2014-0277 |
| [3] | Zhong X, Feng L, Zang R, Lei CQ, Yang Q, Shu HB. ZFYVE1 negatively regulates MDA5but not RIG-Ⅰ-mediated innate antiviral response. PLoS Pathogens, 2020, 16(4): e1008457. DOI:10.1371/journal.ppat.1008457 |
| [4] | Brisse M, Ly H. Comparative structure and function analysis of the RIG-Ⅰ-like receptors: RIG-Ⅰ and MDA5. Frontiers in Immunology, 2019, 10: 1586. DOI:10.3389/fimmu.2019.01586 |
| [5] | Louber J, Brunel J, Uchikawa E, Cusack S, Gerlier D. Kinetic discrimination of self/non-self RNA by the ATPase activity of RIG-Ⅰ and MDA5. BMC Biology, 2015, 13: 54. DOI:10.1186/s12915-015-0166-9 |
| [6] | Heaton SM, Borg NA, Dixit VM. Ubiquitin in the activation and attenuation of innate antiviral immunity. Journal of Experimental Medicine, 2016, 213(1): 1-13. DOI:10.1084/jem.20151531 |
| [7] | Gargan S, Ahmed S, Mahony R, Bannan C, Napoletano S, O'Farrelly C, Borrow P, Bergin C, Stevenson NJ. HIV-1 promotes the degradation of components of the Type 1 IFN JAK/STAT pathway and blocks anti-viral ISG induction. EBioMedicine, 2018, 30: 203-216. DOI:10.1016/j.ebiom.2018.03.006 |
| [8] | Zhang ZQ, Kim T, Bao MS, Facchinetti V, Jung SY, Ghaffari AA, Qin J, Cheng GH, Liu YJ. DDX1, DDX21, and DHX36 helicases form a complex with the adaptor molecule TRIF to sense dsRNA in dendritic cells. Immunity, 2011, 34(6): 866-878. DOI:10.1016/j.immuni.2011.03.027 |
| [9] | Xue Q, Liu HS, Zeng QY, Zheng HX, Xue QH, Cai XP. The DEAD-Box RNA helicase DDX1 interacts with the viral protein 3D and inhibits foot-and-mouth disease virus replication. Virologica Sinica, 2019, 34(6): 610-617. DOI:10.1007/s12250-019-00148-7 |
| [10] | Brai A, Fazi R, Tintori C, Zamperini C, Bugli F, Sanguinetti M, Stigliano E, Esté J, Badia R, Franco S, Martinez MA, Martinez JP, Meyerhans A, Saladini F, Zazzi M, Garbelli A, Maga G, Botta M. Human DDX3 protein is a valuable target to develop broad spectrum antiviral agents. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(19): 5388-5393. DOI:10.1073/pnas.1522987113 |
| [11] | Ko C, Lee S, Windisch MP, Ryu WS. DDX3 DEAD-box RNA helicase is a host factor that restricts hepatitis B virus replication at the transcriptional level. Journal of Virology, 2014, 88(23): 13689-13698. DOI:10.1128/JVI.02035-14 |
| [12] | Li GH, Feng TT, Pan W, Shi XH, Dai JF. DEAD-box RNA helicase DDX3X inhibits DENV replication via regulating type one interferon pathway. Biochemical and Biophysical Research Communications, 2015, 456(1): 327-332. DOI:10.1016/j.bbrc.2014.11.080 |
| [13] | Núñez RD, Budt M, Saenger S, Paki K, Arnold U, Sadewasser A, Wolff T. The RNA helicase DDX6 associates with RIG-Ⅰ to augment induction of antiviral signaling. International Journal of Molecular Sciences, 2018, 19(7): 1877. DOI:10.3390/ijms19071877 |
| [14] | Chang CJ. Immune sensing of DNA and strategies for fish DNA vaccine development. Fish & Shellfish Immunology, 2020, 101: 252-260. |
| [15] | Briard B, Place DE, Kanneganti TD. DNA sensing in the innate immune response. Physiology (Bethesda), 2020, 35(2): 112-124. |
| [16] | Ma F, Li B, Liu SY, Iyer SS, Yu YX, Wu AP, Cheng GH. Positive feedback regulation of type Ⅰ IFN production by the IFN-inducible DNA sensor cGAS. Journal of Immunology, 2015, 194(4): 1545-1554. DOI:10.4049/jimmunol.1402066 |
| [17] | Meier-Stephenson V, Mrozowich T, Pham M, Patel TR. DEAD-box helicases: the Yin and Yang roles in viral infections. Biotechnology and Genetic Engineering Reviews, 2018, 34(1): 3-32. DOI:10.1080/02648725.2018.1467146 |
| [18] | Hammond JA, Lamichhane R, Millar DP, Williamson JR. A DEAD-box helicase mediates an RNA structural transition in the HIV-1 Rev response element. Journal of Molecular Biology, 2017, 429(5): 697-714. DOI:10.1016/j.jmb.2017.01.018 |
| [19] | Lin MH, Sivakumaran H, Jones A, Li DS, Harper C, Wei T, Jin HP, Rustanti L, Meunier FA, Spann K, Harrich D. A HIV-1 Tat mutant protein disrupts HIV-1 Rev function by targeting the DEAD-box RNA helicase DDX1. Retrovirology, 2014, 11: 121. DOI:10.1186/s12977-014-0121-9 |
| [20] | Yedavalli VSRK, Neuveut C, Chi YH, Kleiman L, Jeang KT. Requirement of DDX3 DEAD box RNA helicase for HIV-1 Rev-RRE export function. Cell, 2004, 119(3): 381-392. DOI:10.1016/j.cell.2004.09.029 |
| [21] | Heaton SM, Atkinson SC, Sweeney MN, Yang SNY, Jans DA, Borg NA. Exportin-1-dependent nuclear export of DEAD-box helicase DDX3X is central to its role in antiviral immunity. Cells, 2019, 8(10): 1181. DOI:10.3390/cells8101181 |
| [22] | Ishaq M, Hu JJ, Wu XY, Fu Q, Yang YL, Liu QZ, Guo DY. Knockdown of cellular RNA helicase DDX3 by short hairpin RNAs suppresses HIV-1 viral replication without inducing apoptosis. Molecular Biotechnology, 2008, 39(3): 231-238. DOI:10.1007/s12033-008-9040-0 |
| [23] | Lai MC, Wang SW, Cheng L, Tarn WY, Tsai SJ, Sun HS. Human DDX3 interacts with the HIV-1 Tat protein to facilitate viral mRNA translation. PLoS One, 2013, 8(7): e68665. DOI:10.1371/journal.pone.0068665 |
| [24] | Yasuda-Inoue M, Kuroki M, Ariumi Y. DDX3 RNA helicase is required for HIV-1 Tat function. Biochemical and Biophysical Research Communications, 2013, 441(3): 607-611. DOI:10.1016/j.bbrc.2013.10.107 |
| [25] | Naji S, Ambrus G, Cimermančič P, Reyes JR, Johnson JR, Filbrandt R, Huber MD, Vesely P, Krogan NJ, Yates Ⅲ JR, Saphire AC, Gerace L. Host cell interactome of HIV-1 Rev includes RNA helicases involved in multiple facets of virus production. Molecular & Cellular Proteomics, 2012, 11(4): M111.015313. |
| [26] | Zhou XX, Luo J, Mills L, Wu SX, Pan T, Geng GN, Zhang J, Luo HH, Liu C, Zhang H. DDX5 facilitates HIV-1 replication as a cellular co-factor of Rev. PLoS One, 2013, 8(5): e65040. DOI:10.1371/journal.pone.0065040 |
| [27] | Chen JY, Chen WN, Poon KMV, Zheng BJ, Lin X, Wang YX, Wen YM. Interaction between SARS-CoV helicase and a multifunctional cellular protein (Ddx5) revealed by yeast and mammalian cell two-hybrid systems. Archives of Virology, 2009, 154(3): 507-512. DOI:10.1007/s00705-009-0323-y |
| [28] | Goh PY, Tan YJ, Lim SP, Tan YH, Lim SG, Fuller-Pace F, Hong WJ. Cellular RNA helicase p68 relocalization and interaction with the hepatitis C virus (HCV) NS5B protein and the potential role of p68 in HCV RNA replication. Journal of Virology, 2004, 78(10): 5288-5298. DOI:10.1128/JVI.78.10.5288-5298.2004 |
| [29] | Upadya MH, Aweya JJ, Tan YJ. Understanding the interaction of hepatitis C virus with host DEAD-box RNA helicases. World Journal of Gastroenterology, 2014, 20(11): 2913-2926. DOI:10.3748/wjg.v20.i11.2913 |
| [30] | 武炜. Caspase依赖的DDX21切割调控抗病毒先天性免疫机制研究. 中国农业科学院硕士学位论文, 2019. |
| [31] | 杨柳青. DHX15在HBV复制中的意义及其机制初步研究. 重庆医科大学硕士学位论文, 2018. |
| [32] | Jin H, Zhou L, Ge XN, Zhang H, Zhang RM, Wang C, Wang L, Zhang ZB, Yang HC, Guo X. Cellular DEAD-box RNA helicase 18(DDX18) promotes the PRRSV replication via interaction with virus nsp2 and nsp10. Virus Research, 2017, 238: 204-212. DOI:10.1016/j.virusres.2017.05.028 |
| [33] | Feng TT, Sun T, Li GH, Pan W, Wang KZ, Dai JF. DEAD-box helicase DDX25 is a negative regulator of type Ⅰ interferon pathway and facilitates RNA virus infection. Frontiers in Cellular and Infection Microbiology, 2017, 7: 356. DOI:10.3389/fcimb.2017.00356 |
| [34] | Zheng QL, Hou J, Zhou Y, Li ZY, Gao XT. Correction: Corrigendum: The RNA helicase DDX46 inhibits innate immunity by entrapping m6A-demethylated antiviral transcripts in the nucleus. Nature Immunology, 2017, 18(12): 1361. |
| [35] | Li D, Fu SZ, Wu ZQ, Yang WP, Ru Y, Shu HB, Liu XT, Zheng HX. Correction: DDX56 inhibits type Ⅰ interferon by disrupting assembly of IRF3-IPO5 to inhibit IRF3 nucleus import. Journal of Cell Science, 2020, 133(4): jcs244681. DOI:10.1242/jcs.244681 |
| [36] | Uhlmann-Schiffler H, Rössler OG, Stahl H. The mRNA of DEAD box protein p72 is alternatively translated into an 82-kDa RNA helicase. Journal of Biological Chemistry, 2002, 277(2): 1066-1075. DOI:10.1074/jbc.M107535200 |
| [37] | Moy RH, Cole BS, Yasunaga A, Gold B, Shankarling G, Varble A, Molleston JM, TenOever BR, Lynch KW, Cherry S. Stem-loop recognition by DDX17 facilitates miRNA processing and antiviral defense. Cell, 2014, 158(4): 764-777. DOI:10.1016/j.cell.2014.06.023 |
 2021, Vol. 61
2021, Vol. 61