中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 汪湾, 尚潇潇, 曾秋耀, 刘冬冬, 李贝贝, 张嘉琪, 杨洪艳, 黄译乐, 胡薇, 傅锦坚, 徐建华. 2021
- Wan Wang, Xiaoxiao Shang, Qiuyao Zeng, Dongdong Liu, Beibei Li, Jiaqi Zhang, Hongyan Yang, Yile Huang, Wei Hu, Jinjian Fu, Jianhua Xu. 2021
- 多囊卵巢综合征患者肠道菌群和生化免疫分子特征
- Characteristics of intestinal microflora and biochemical immune molecules in patients with polycystic ovarian syndrome
- 微生物学报, 61(2): 452-468
- Acta Microbiologica Sinica, 61(2): 452-468
-
文章历史
- 收稿日期:2020-04-19
- 修回日期:2020-06-04
- 网络出版日期:2020-08-19
2. 广州中医药大学第二附属医院(广州中医药大学第二临床医学院)生物信息分析中心, 广东 广州 510120;
3. 中山大学肿瘤防治中心检验科, 华南肿瘤学国家重点实验室, 癌症医学协同创新中心, 广东 广州 510060;
4. 广州中医药大学第二附属医院(广州中医药大学第二临床医学院)妇产科, 广东省中医药综合症临床研究广东省重点实验室, 广东 广州 510120;
5. 广州中医药大学顺德医院, 广东 佛山 523888;
6. 广西柳州市妇幼保健院, 广西 柳州 545001
2. Bioinformatics Group, The Second Affiliated Hospital of Guangzhou University of Chinese Medicine (The Second Clinical Medical College of Guangzhou University of Chinese Medicine), Guangzhou 510120, Guangdong Province, China;
3. Department of Clinical Laboratory Medicine, Sun Yat-sen University Cancer Center, State Key Laboratory of Oncology in South China, Collaborative Innovation Center for Cancer Medicine, Guangzhou 510060, Guangdong Province, China;
4. Department of Gynecology, The Second Affiliated Hospital of Guangzhou University of Chinese Medicine (The Second Clinical Medical College of Guangzhou University of Chinese Medicine), Guangdong Provincial Key Laboratory of clinical Research on Traditional Chinese Medicine Syndrome, Guangzhou 510120, Guangdong Province, China;
5. Shunde Hospital of Guangzhou University of Chinese Medicine, Foshan 523888, Guangdong Province, China;
6. Guangxi Liuzhou Maternal and Child Health Hospital, Liuzhou 545001, Guangxi Zhuang Autonomous Region, China
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是绝经前女性中最常见的内分泌和代谢疾病之一[1],发病率为5%–20%,是导致不孕的主要原因[2],也是女性生殖障碍疾病研究的重点[3]。多囊卵巢综合征主要特征是雄激素过多,排卵功能障碍和多囊卵巢,并常伴有胰岛素抵抗[4]。由于多囊卵巢综合征至今病因仍不明确,限制了治疗方法的发展。因此,进一步探寻多囊卵巢综合征发病机制、改善疗效对临床治疗有着重要的意义。
先前研究表明PCOS与雄激素、17-羟孕酮[5]、抗苗勒管激素[6]、巨噬细胞[7]、单核细胞[8]等生化免疫指标密切相关。但随着科学工作者对多囊卵巢综合征研究的深入,以及检测技术的进步,人们逐渐意识到肠道菌群的分泌和调节在多囊卵巢综合征的发生发展中起着举足轻重的作用。肠道菌群是人体最大的微生物系统,具有相当大的代谢活性[9]。不仅有消化吸收功能,还具有抵抗病原入侵、抗肿瘤[10]、抗衰老[11]、建立机体免疫、促进肠道蠕动[12]、生长代谢[13]以及维持肠道内环境的稳态等多种功能,一旦其菌群结构改变或失调,则可引起机体代谢紊乱。已有研究结果表明多囊卵巢综合征患者的肠道菌群与健康对照人群存在差异性[14]。
本研究设计前瞻性队列研究方案,选取健康女性对照和多囊卵巢综合征患者作为研究对象,留取粪便和血清标本,釆用宏基因组测序进行菌群结构组成分析,比较多囊卵巢综合征患者与健康对照间肠道菌群谱的结构特征差异,找出在多囊卵巢综合征患者中富集的主要菌群,作为未来进行PCOS诊疗潜在靶点进行研究。并采用化学发光法和酶联免疫吸附法检测血清中性激素水平和炎症因子水平,分析差异菌的相对丰度与多囊卵巢综合征患者体内激素水平和炎症因子水平间的联系,从而探讨肠道菌群对多囊卵巢综合征患者机体生化、免疫系统的影响,现将研究结果报道如下。
1 材料和方法 1.1 研究对象选取2018年3月到2019年5月在广州中医药大学第二附属医院妇科门诊就诊的23例多囊卵巢综合征患者和23例健康对照作为研究对象。本研究获得广州中医药大学第二附属医院伦理委员会批准,所有研究对象均知情同意并签署知情同意书。
1.1.1 PCOS纳入标准: (1) 符合西医PCOS诊断标准者;(2) 3个月内未使用任何激素类药物;(3)所选取的志愿者均符合采样前4周内未使用抗生素、益生菌或免疫抑制剂,无肠炎、急慢性胃肠道疾病、自身免疫性疾病等,无相关手术史。
1.1.2 健康对照纳入标准: 来自普通社区,并且月经周期规律,正常的卵巢形态和正常的激素水平。过去1年内母乳喂养或怀孕,或在过去3个月内使用抗生素的被排除。
1.1.3 排除标准: 高雄激素血症或排卵功能障碍(库欣综合征,21-羟化酶缺乏症,甲状腺疾病,雄激素分泌性肿瘤,先天性肾上腺增生和高泌乳素血症)。
1.2 标本取样1.2.1 粪便标本取样: PCOS患者在初次被诊断为多囊卵巢综合征且使用药物前留取粪便标本,避开经期采集,使用ML-001A粪便标本采集套装(深圳达云基因科技有限公司),采集成形粪便(约5 g),–80 ℃冻存,后进行宏基因组测序分析。
1.2.2 血液标本取样: 血液标本于经期第3天(卵泡期)清晨空腹采集静脉血,长期未行月经者随机一天清晨空腹采集,当天将血清标本分装成3管(1 mL/管),−80 ℃冻存,后进行生化免疫相关检测。
1.3 实验室检测1.3.1 DNA提取及文库制备: 每个粪便样品的冷冻试样(约5 g),用Zymol DNA提取试剂盒提取DNA,DNA浓度和纯度使用NanoDrop系统(Thermo Fisher Scientific)进行测量并通过琼脂糖凝胶电泳估计分子大小,合格后进行建库和宏基因组测序。
1.3.2 建库和宏基因组测序: 利用Illumina平台进行测序,首先提取基因组DNA,采用超声法Covaris或者Bioruptor将大片段DNA (如基因组DNA、BAC或长片段PCR产物)随机打断并产生某长度DNA片段,然后用T4 DNA Polymerase、Klenow DNA Polymerase和T4 PNK将打断形成的粘性末端修复成平末端,再通过3′端加碱基“A”,使得DNA片段能与3′端带有“T”碱基的特殊接头连接,用电泳法选择需回收的目的片段连接产物,再使用PCR技术扩增两端带有接头的DNA片段;最后,用合格的文库进行cluster制备和测序。
1.3.3 血清激素检测: 将血液标本在3000 r/min、4 ℃离心15 min后分装,并在−80 ℃下保存,用于随后的血清检测。卵泡刺激素(FSH)、促黄体生成素(LH)、雌二醇(E2)、睾酮(T)、催乳素(PRL)、孕激素(PRG)均采用免疫e602仪器检测,雄烯二酮(AND)、脱氢异雄酮硫酸盐(DHEA-S)、性激素结合球蛋白(SHGB)、17α羟孕酮(17-α-OH)均采用西门子IMMULITE 2000仪器检测。游离雄激素指数(FAI)被定义为T (nmol/L×100)/ SHBG(nmol/L)。
1.3.4 炎症因子检测: 使用R & D的酶联免疫吸附试剂盒检测血清中各类炎症因子。试剂盒DY279-05检测巨噬细胞炎症蛋白1(MCP-1),试剂盒DY1065-05检测脂联素(Adiponectin),试剂盒DY398-05检测瘦素(Leptin),试剂盒DY266-05检测干扰素诱导蛋白10 (IP-10),试剂盒DY270-05检测巨噬细胞炎症蛋白1 (MIP-1),试剂盒DY285B-05检测γ-干扰素(IFN-γ),试剂盒DY210-05检测肿瘤坏死因子α (TNF-α),共检测7种炎症因子的水平,使用SIEMENS酶免分析仪检测吸光度,通过直线回归构建7个炎症因子的标准曲线分别计算浓度。
1.3.5 临床信息调查: 年龄、身高、体重、腰围、臀围、多毛评分(mFG)、痤疮评分(Pillsburg)。BMI定义为体重/身高的平方(kg/m2),腰臀比定义为腰围/臀围,mFG评分大于4分则定义为多毛体质,痤疮评分用Pillsburg四级改良分级法将痤疮严重程度分为Ⅰ–Ⅳ级。
1.4 统计分析两组血清学及临床指标差异统计分析使用SPSS 23.0软件,所有数据使用Shapiro Wilk检验进行正态性检验,P > 0.05表示呈正态分布,用单因素ANOVA检验方差齐性,P > 0.05表示方差齐。满足正态分布且方差齐的连续性变量用x±s表示,并使用独立样本t检验进行两组间比较,P < 0.05表示有统计学意义。不满足正态分布或方差不齐的连续性变量用M(P25–P75)表示,并使用Mann-Whitney U检验进行两组间比较,P < 0.05表示有统计学意义。所有测序的数据均用R语言进行分析,用Kruskal Wallis检验对组间α-多样性进行对比分析,用Welch’s T test检验对组间物种丰度差异进行对比分析,用spearman相关性分析对变量间相关性进行分析,所有统计结果均以P < 0.05表示有统计学意义。组间标志菌种lefse分析,用非参数因子Kruskal-Wallis秩和检验筛选出biomarker菌种(P < 0.05),再用线性判别分析(LDA)对biomarker菌种评估差异物种的影响力(即LDA score),取LDA > 2.0的菌种,为有统计学意义的差异菌种。
2 结果和分析 2.1 基础信息23例PCOS患者和23例健康对照共46份血清样本、46份粪便标本以及46份问卷调查。两组间年龄和体重指数(BMI)间不存在差异(P > 0.05) (表 1)。
| Test | PCOS (n=23) | Normal (n=23) | Shapiro Wilk | T test | Mann Whitney U |
| Age | 27.00(23.00,28.00) | 25.00(23.00,31.00) | P > 0.05 | P=0.515 | |
| Body Mass Index, BMI/(kg/m2) | 21.48(19.23,26.04) | 20.70(19.00,22.15) | P < 0.05 | P=0.345 | |
| Prolactin, PRL/(mIU/L) | 408.97±298.09 | 429.03±253.74 | P > 0.05 | P=0.807 | |
| Progesterone, PRG/(mIU/L) | 0.71(0.49,1.01) | 0.82(0.67,1.23) | P < 0.05 | P=0.482 | |
| Estradiol, E2/(pmol/L) | 209.00(144.10,267.20) | 151.80(127.60,186.20) | P < 0.05 | P=0.046 | |
| Testosterone, T/(nmol/L) | 1.29±0.69 | 0.91±0.51 | P > 0.05 | P=0.037 | |
| Follicle stimulating hormone, FSH/(IU/L) | 6.467±2.42 | 7.61±1.76 | P > 0.05 | P=0.074 | |
| Luteinizing hormone, LH/(IU/L) | 16.87(10.79,22.94) | 6.49(5.11,9.05) | P < 0.05 | P < 0.001 | |
| LH/FSH | 2.84(1.62,3.46) | 0.96(0.76,1.23) | P > 0.05 | P < 0.001 | |
| Androstenedione, AND/(ng/mL) | 3.86(2.42,5.48) | 1.97(1.42,2.98) | P > 0.05 | P < 0.001 | |
| sex hormone-binding globulin, SHBG/(nmol/L) | 46.70(33.40,78.00) | 60.00(36.90,84.20) | P < 0.05 | P=0.253 | |
| Dehydroisoandrostenone sulfate, DHEA-S/(μg/dL) | 232.78±128.07 | 222.26±95.18 | P > 0.05 | P =0.753 | |
| 17α-hydroxyprogesterone, 17-α-OH/(ng/mL) | 0.92(0.66,1.38) | 0.48(0.38,0.78) | P > 0.05 | P < 0.001 | |
| Free androgen index, FAI | 2.69(1.33,4.42) | 1.22(0.68,3.06) | P < 0.05 | P=0.040 | |
| Monocyte chemoattractant protein-1, MCP-1/(pg/mL) | 31.12(18.11,49.51) | 28.69(10.68,36.94) | P < 0.05 | P=0.640 | |
| Adiponectin/(μg/mL) | 10.81(7.64,14.92) | 4.82(2.26,5.86) | P > 0.05 | P < 0.001 | |
| Leptin/(μg/L) | 10.39±2.23 | 8.95±3.17 | P > 0.05 | P=0.099 | |
| interferon inducible protein 10, IP10/(pg/mL) | 20.63(8.88,126.72) | 34.04(26.86,47.55) | P < 0.05 | P=0.381 | |
| Macrophage inflammatory protein-1, MIP1/(pg/mL) | 39.27(6.11,403.35) | 45.18(14.45,111.27) | P < 0.05 | P=0.172 | |
| Interferon-γ, IFN-γ/(pg/mL) | 0.00(0.00,6.63) | 0.00(0.00,15.52) | P < 0.05 | P=0.890 | |
| tumor necrosis factor-α, TNF-α/(pg/mL) | 0.43(0.00,13.62) | 0.93(0.00,2.20) | P < 0.05 | P=0.941 | |
| Hirsutism | 1.00(0.00,1.00) | 0.00(0.00,0.00) | P < 0.05 | P < 0.001 | |
| Acne | 1.00(0.00,1.00) | 0.00(0.00,0.00) | P < 0.05 | P < 0.001 | |
| Polycystic ovary multiple, PCOM | 1.00(0.00,1.00) | 0.00(0.00,0.00) | P < 0.05 | P < 0.001 | |
| The sample size of each group in the PCOS group and the healthy control group is n=23. Shapiro Wilk test is performed on all data. A group with P > 0.05 indicates that the normal distribution is satisfied. One-way ANOVA was used to test the homogeneity of variance, and the group with P > 0.05 indicated uniform variance. The results of all group normality tests are shown in Table 1. The one-way ANOVA variance homogeneity test results show Age, BMI, PRG, E2, LH, LH/FSH, AND, 17-a-OH, MCP-1, Adiponectin, IP10, MIP-1, TNF-a, Hirsutism, Acne, PCOM groups have uneven variances, P values are 0.03, 0.00, 0.03, 0.01, 0.00, 0.00, 0.00, 0.02, 0.01, 0.03, 0.01, 0.02, 0.03, 0.00, 0.00, 0.00. The two groups were in accordance with the normal distribution and the variance was uniformly expressed as x±s, and the independent sample T test was used for comparative analysis between the two groups. P < 0.05 indicated that the difference was statistically significant. Any one of the two groups that does not satisfy the normal distribution or uneven variance is represented by M(P25, P75), and the Mann-Whitney U test is used. P < 0.05 indicates that the difference is statistically significant. | |||||
2.1.1 临床指标分析: 多毛评分中,23名PCOS患者多毛评分0分的有10人,1分的有10人,2分的有3人,23名女性健康对照多毛评分中23人全部为0分。痤疮分级中,23名PCOS患者痤疮分级0级的有9人,Ⅰ级的有9人,Ⅱ级的有2人,Ⅲ级的有2人,Ⅳ级的有1人,23名女性健康对照痤疮评级中23人全部为0级。B超多囊情况中,23名PCOS患者中16人B超结果显示有多个囊泡,7人B超结果显示正常,未发现多个囊泡,23名女性健康对照B超结果均显示正常。统计分析发现两组间临床指标存在明显差异,PCOS患者毛发水平(hirsutism)、痤疮水平(acne)和B超多囊(PCOM)情况明显比健康对照组严重(P < 0.001) (表 1)。
2.1.2 血清学指标分析: 通过数据分析发现,两组间生化指标存在明显差异,PCOS患者E2、T、LH、LH/FSH、AND、17-α-OH、FAI水平明显高于健康对照女性(P值分别为0.046、0.037、小于0.001、小于0.001、小于0.001、小于0.001、0.040)。两组间免疫指标对比发现,PCOS患者Adiponectin水平明显高于健康对照组(P < 0.001),具体信息见表 1。
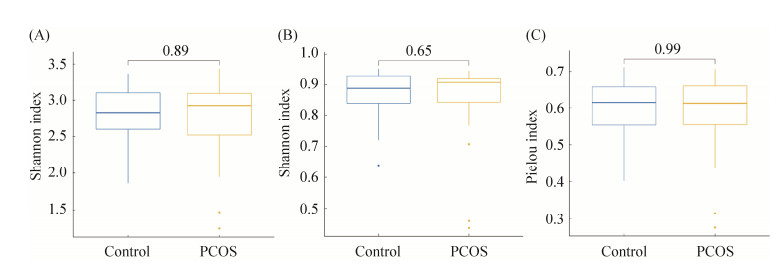
2.2 肠道微生物组学特征性研究2.2.1 多样性分析: 对两组间肠道菌群α-多样性的Shannon指数和Simpson指数以及Pielou指数进行对比分析,结果无统计学差异(P > 0.05),表明两组之间肠道微生物多样性没有差异(图 1)。
|
| 图 1 PCOS组和健康对照组间多样性分析 Figure 1 Diversity analysis between PCOS group and healthy control group. A: Shannon index of α-diversity; B: Simpson index of α-diversity; C: Pielou index of α-diversity; blue is the healthy control group, and yellow is the PCOS group. The thick line in the center of the box plot is the median, and the upper and lower sides represent the upper quartile and lower quartile, respectively, and the far end of the upper and lower line segments represent the upper and lower edges. |
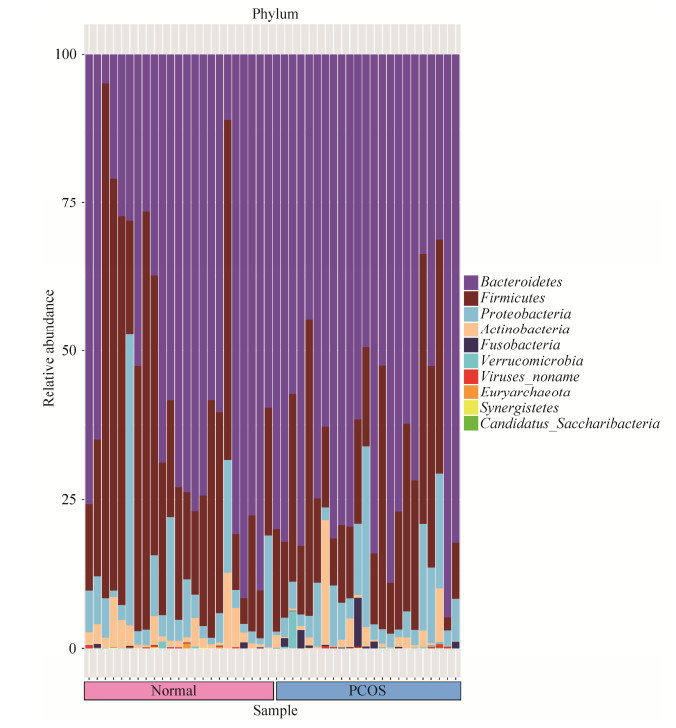
2.2.2 PCOS组和健康对照组微生物种群组成及比较: (1) 两组菌群在门水平上的构成:两组样本共包含10个门:拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、疣微菌门(Verrucomicrobia)、未知病毒(Viruses noname)、广古菌门(Euryarchaeota)、互养菌门(Synergistetes)、Candidatus Saccharibacteria菌门。所有样本中的优势菌门为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),分别在对照组中依次占56.26%、32.70%、7.97%、2.75%;在PCOS组中依次占68.18%、21.25%、7.12%、2.32% (图 2)。
|
| 图 2 PCOS组和对照组门水平上物种注释条形图 Figure 2 Bar chart of species annotations at the phylum level of the PCOS and control groups. |
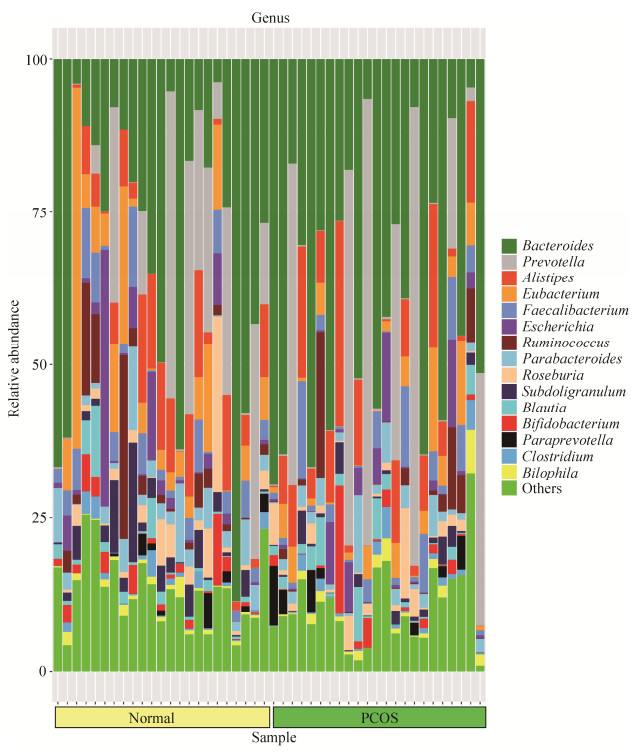
(2) 两组菌群在属水平上的构成:两组46个样本中共发现134个菌属,其中,厚壁菌门54个属,变形菌门31个属,放线菌门16个属,拟杆菌门11个属。菌群多样性最高的是厚壁菌门,其次是变形菌门、放线菌门和拟杆菌门(图 3)。健康对照组中大部分优势菌属来自拟杆菌门、厚壁菌门和变形菌门,丰度由高到低依次是:拟杆菌属(Bacteroides) 29.93%、普雷沃氏菌属(Prevotella) 12.359%、优杆菌属(Eubacterium) 8.61%、另枝菌属(Alistipes) 7.00%、梭菌属(Faecalibacterium) 4.37%、埃希氏菌属(Escherichia) 4.04%、副杆菌属(Parabacteroides) 3.84%、瘤胃球菌属(Ruminococcus) 3.79%、罕见小球菌属(Subdoligranulum) 3.40%、罗斯氏菌属(Roseburia) 3.23%、双歧杆菌属(Bifidobacterium) 1.90%、劳特氏菌属(Blautia) 1.73%、巨单胞菌属(Megamonas) 1.29%。PCOS组中大部分优势菌属来自拟杆菌门和厚壁菌门,丰度由高到低依次是:拟杆菌属(Bacteroides) 37.93%、普雷沃氏菌属(Prevotella) 16.02%、另枝菌属(Alistipes) 8.49%、梭菌属(Faecalibacterium) 3.90%、优杆菌属(Eubacterium) 3.88%、埃希氏菌属(Escherichia) 2.90%、瘤胃球菌属(Ruminococcus) 2.72%、副杆菌属(Parabacteroides) 2.62%、罗斯氏菌属(Roseburia) 2.23%、劳特氏菌属(Blautia) 2.05%、双歧杆菌属(Bifidobacterium) 1.73%、帕拉普氏菌属(Paraprevotella) 1.39%,罕见小球菌属(Subdoligranulum) 1.37%、嗜胆菌属(Bilophila) 1.23%。
|
| 图 3 PCOS组和对照组属水平上物种注释条形图 Figure 3 Bar chart of species annotations at the genus level of the PCOS and control groups. |
(3) 两组菌群在种水平上的构成:健康对照组中对群落结构影响较大的物种是:拟杆菌门的普氏菌(Prevotella copri)、粪便拟杆菌(Bacteroides stercoris)、Alistipes putredinis、普通拟杆菌(Bacteroides vulgatus)、Bacteroides plebeius、Bacteroides ovatus,占比28.86%。厚壁菌门的产气真杆菌(Eubacterium rectale)、普拉梭菌(Faecalibacterium prausnitzii)、Subdoligranulum unclassified、Ruminococcus bromii、Roseburia inulinivorans,占比17.77%。变形菌门的大肠埃希菌(Escherichia coli)占比3.09%。PCOS组中对群落结构影响较大的物种是:拟杆菌门的普氏菌(Prevotella copri)、Alistipes putredinis、普通拟杆菌(Bacteroides vulgatus)、粪便拟杆菌(Bacteroides stercoris)、Bacteroides plebeius、Bacteroides massiliensis、Prevotella stercorea、Bacteroides coprocola、Bacteroides ovatus、Bacteroides uniformis,占比45.07%。厚壁菌门的普拉梭菌(Faecalibacterium prausnitzii)、Ruminococcus bromii,占比6.77% (图 4)。
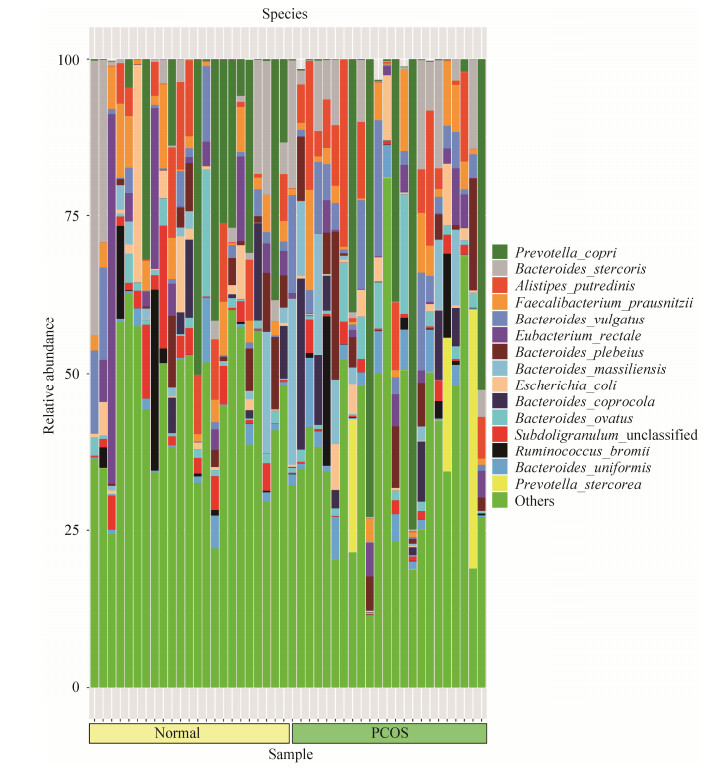
|
| 图 4 PCOS组和对照组种水平上物种注释条形图 Figure 4 Bar chart of species annotations at the species level of the PCOS and control groups. |
2.2.3 LefSe(LDA effect size,线性判别分析效果大小)分析: 对两组受试者肠道微生物进行种水平LefSe分析,有4个菌种相对丰度在两组间存在差异(LDA > 2)。PCOS组和健康对照组菌群结构对比分析发现,普通拟杆菌(Bacteroides vulgatus)和弗格森埃希菌(Escherichia fergusonii)在PCOS组中的相对丰度高于对照组,而凸腹真杆菌(Eubacterium ventriosum)和Subdoligranulum unclassified菌的相对丰度低于健康对照组(图 5)。
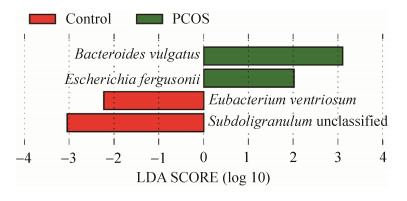
|
| 图 5 PCOS组和健康对照组对比分析中有统计学差异的微生物种类挖掘 Figure 5 Excavation of microbial species with statistical differences in comparative analysis between PCOS group and healthy control group. Legend: Green indicates that the species is enriched in PCOS group, red indicates that the species is enriched in healthy control group. |
2.2.4 两组间相对丰度分布: 观察4种标志菌种在两组间的相对丰度分布,发现有两种标志菌种普通拟杆菌(Bacteroides vulgatus)与Subdoligranulum unclassified菌属于主要菌群,在相对丰度 > 1%的水平发生了变化。另外两种标志菌种凸腹真杆菌(Eubacterium ventriosum)与弗格森埃希菌(Escherichia fergusonii)在低丰度水平(相对丰度 < 1%)发生变化(图 6)。
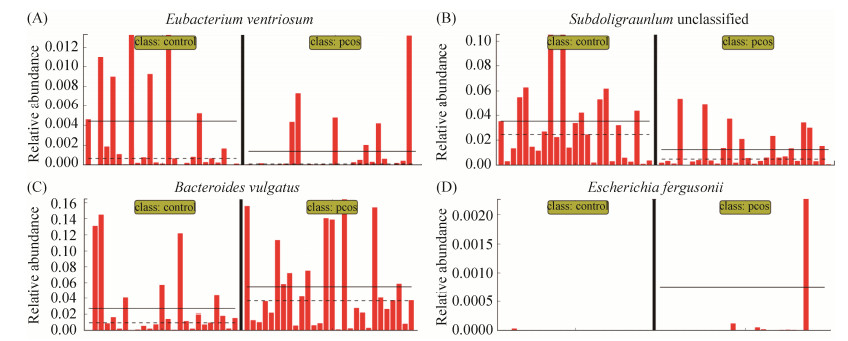
|
| 图 6 四种标志菌在PCOS组和对照组相对丰度分布 Figure 6 Distribution of relative abundance of four different species in PCOS group and control group. Legend: A: The relative abundance distribution of Eubacterium ventriosum between the two groups; B: The relative abundance distribution of Subdoligranulum unclassified between the two groups; C: The relative abundance distribution of Bacteroides vulgatus between the two groups; D: The relative abundance distribution of Escherichia fergusonii between the two groups. The left side of the vertical solid line is the distribution of the species in healthy control species, and the right side of the vertical solid line is the distribution of the species in PCOS patients, The solid horizontal line represents the mean of relative abundance, and the horizontal dashed line represents the median. |
2.2.5 菌种间相关性分析: 普通拟杆菌(Bacteroides vulgatus)与凸腹真杆菌(Eubacterium ventriosum)和Subdoligranulum unclassified菌、未分类霍德曼菌(Holdemania unclassified)呈现负相关,与内氏反刍球菌(Ruminococcus gnavus)呈现正相关。凸腹真杆菌(Eubacterium ventriosum)还与内氏反刍球菌(Ruminococcus gnavus)呈现负相关,与Subdoligranulum unclassified菌呈现强正相关,与未分类拉尔斯顿氏菌(Ralstonia unclassified)呈现正相关。Subdoligranulum unclassified菌除了与普通拟杆菌和凸腹真杆菌具有明显的相关性外还与脱硫弧菌(Desulfovibrio piger)和未分类拉尔斯顿氏菌(Ralstonia unclassified)呈现正相关。除此之外,还有棒状戈登菌(Gordonibacter pamelaeae)与迟缓埃格特菌(Eggerthella lenta)呈现正相关(图 7)。
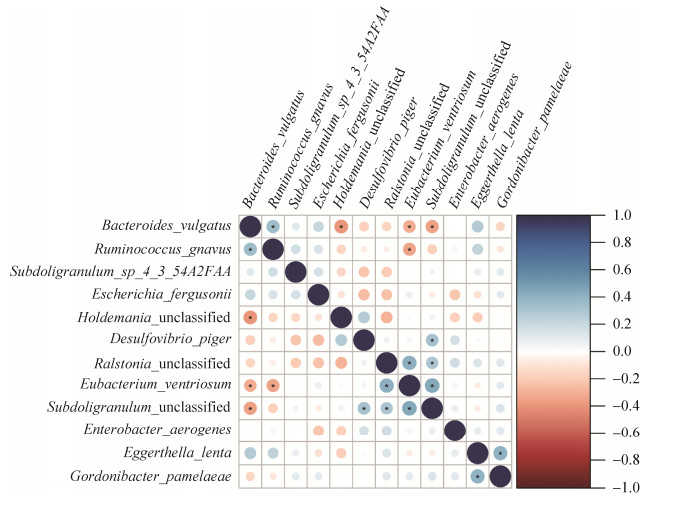
|
| 图 7 菌种间相关性分析 Figure 7 Correlation analysis between species. Legend: Blue represents a positive correlation, red represents a negative correlation, the color shade represents the correlation coefficient, and * represents a significant correlation (P < 0.05). |
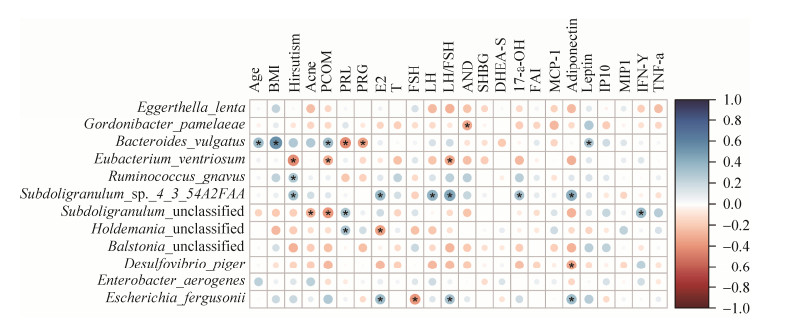
2.2.6 细菌与生化免疫指标的spearman相关性分析: 棒状戈登菌(Gordonibacter pamelaeae)与 AND呈负相关。普通拟杆菌(Bacteroides vulgatus)的丰度与Age、BMI、PCOM、Leptin呈正相关,与PRL、PRG呈现负相关。凸腹真杆菌(Eubacterium ventriosum)与Hirsutism、LH/FSH比值呈负相关。活泼瘤胃球菌(Ruminococcus gnavus)与Hirsutism正相关。Subdoligranulum sp_4_3_54A2FAA菌的相对丰度与Hirsutism、E2、LH、LH/FSH、17-α-OH、Adiponectin呈正相关。Subdoligranulum unclassified菌与PRL、IFN-γ呈正相关,与Acne、PCOM呈负相关。未分类霍德曼菌(Holdemania unclassified)与PRL正相关,与E2负相关。脱硫弧菌(Desulfovibrio piger)与Adiponectin呈负相关。弗格森埃希菌(Escherichia fergusonii)与E2和LH/FSH、Adiponectin呈正相关,与FSH呈负相关(图 8)。
|
| 图 8 PCOS组与健康对照组差异菌与生化免疫指标相关性分析 Figure 8 Correlation analysis of differential species and biochemical immune indexes between PCOS group and healthy control group. Legend: Blue represents a positive correlation, red represents a negative correlation, the color shade represents the correlation coefficient, and * represents a significant correlation (P < 0.05). |
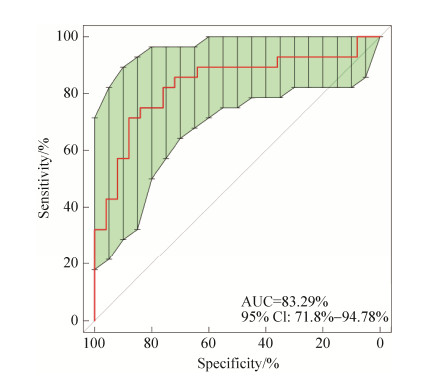
2.2.7 PCOS诊断模型: 使用R包随机森林模型筛选特征变量,进行1000次的交叉验证得到候选菌,利用RF模型筛选的物种相对丰度对每一个体计算其PCOS患病风险,绘制ROC曲线,并计算出AUC作为判别模型效能评价参数,选取标志物组合数<30,且判别效能最佳的组合,在模型中输出每个物种的重要性指数,重要性指数越高,代表该标志物用来判别PCOS和非PCOS的重要性越高。最终得到5个菌的最优组合,当布鲁米球菌(Ruminococcus bromii)、棒状戈登菌(Gordonibacter pamelaeae)、脱硫弧菌(Desulfovibrio piger)、凸腹真杆菌(Eubacterium ventriosum)、斯特雷沃菌(Prevotella stercorea) 5个菌种联合诊断时,AUC为83.29%,阈值为0.32,具有较好的诊断效能(图 9)。
|
| 图 9 五个菌联合诊断时的ROC曲线 Figure 9 ROC curve during combined diagnosis of five species. |
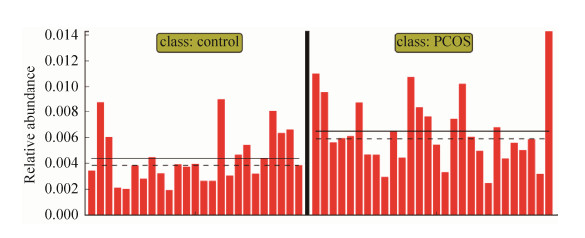
2.2.8 Pathway基因通路: 在Kruskal-Wallis秩和检验的基础上作线性判别分析,通过Lefse软件作图,当LDA > 2时,在PCOS人群中富集的基因通路为鸟苷核苷酸从头生物合成的超途径I (PWY 7228 superpathway of guanosine nucleotides de novo biosynthesis I) (图 10)。
|
| 图 10 组间标志通路在PCOS组和健康对照间的分布 Figure 10 Distribution of inter-group marker pathways between PCOS group and healthy control group. Legend: The left side of the vertical solid line is the distribution of the pathway in healthy controls, the right side of the vertical solid line is the distribution of the pathway in PCOS patients, the horizontal solid line indicates the average value of relative abundance, and the horizontal dotted line indicates Digits. |
3 讨论
本课题组使用前瞻性队列研究方案,选取健康女性对照和多囊卵巢综合征患者作为研究对象,通过基因测序、生信分析、生化发光、酶联免疫吸附等方法,对多囊卵巢综合征患者和健康对照人群的肠道菌群结构、丰度、物种多样性以及血清学指标进行了对比分析。发现多囊卵巢综合征患者与健康对照的肠道菌群在门、属、种水平均有明显差异。两组间具有标志性差异的菌种有4个,其中普通拟杆菌、凸腹真杆菌和Subdoligranulum unclassified菌3个菌种彼此间存在相关性,并且差异菌种与生化免疫指标间也存在相关性。发现布鲁米球菌、棒状戈登菌、脱硫弧菌、凸腹真杆菌、斯特雷沃菌5个菌联合诊断具有较好的诊断效能,从肠道菌群角度提供了一种PCOS的新检测方法。此外,通过基因分析发现,鸟苷核苷酸从头生物合成的超途径I基因通路在PCOS人群中富集,提示核苷酸合成的增强可能与多囊卵巢综合征发病机制有关,值得后续深入探讨。
PCOS患者组和健康对照组人群在肠道菌群的多样性上并没有发现显著差异,由于PCOS患者间存在明显的异质性,且大部分关于PCOS与健康对照间差异的研究都主要针对菌群丰度的差异,也未表明PCOS患者肠道菌群多样性发生降低,关于肠道菌群多样性的探讨一直存在争议,并不是多样性高就代表有绝对的优势,很多疾病治愈后反而多样性发生明显的降低[15]。
本研究结果显示通过对PCOS患者和健康对照的横断面分析,从门水平上,所有样本中的优势菌门为拟杆菌门、厚壁菌门、变形菌门和放线菌门。但健康对照组中大部分优势菌属来自拟杆菌门、厚壁菌门和变形菌门,而PCOS组中大部分优势菌属则来自拟杆菌门和厚壁菌门。本研究结果发现,与健康对照组相比较,PCOS患者组中,厚壁菌门的比例明显下降,拟杆菌门的比例明显上升。提示肠道菌群结构与丰度的变化在PCOS的发生发展过程中起重要作用。
从属的水平上,在两组所有样本中,拟杆菌门下的菌属丰度均处于最高水平,厚壁菌门下菌属的菌群多样性最高。其中,拟杆菌门的拟杆菌属、普雷沃氏菌属、另枝菌属和副杆菌属,厚壁菌门的优杆菌属、梭菌属、罗斯氏菌属、瘤胃球菌属,放线菌门的双歧杆菌属,变形菌门的埃希氏菌属,在所有样本中均有检出,但无论在组内还是组间的个体丰度仍存在明显差异。
从种的水平上,健康对照组中对群落结构影响较大的物种中有6个属于拟杆菌门,占28.86%,5个属于厚壁菌门,占17.77%。而PCOS组中对群落结构影响较大的物种中有10个为拟杆菌门,占45.07%,明显高于健康对照组,3个为厚壁菌门,仅占6.77%,明显低于健康对照组。并发现PCOS患者组的肠道菌群与健康对照组间有4种菌的相对丰度存在差异(LDA > 2),为之前关于PCOS差异菌种的研究作了非常有意义的补充。其中普通拟杆菌(Bacteroides vulgatus)和弗格森埃希菌(Escherichia fergusonii)在PCOS患者中的丰度高于健康对照组,而凸腹真杆菌(Eubacterium ventriosum)和Subdoligranulum unclassified菌在PCOS患者中的相对丰度低于健康对照组。而且普通拟杆菌和Subdoligranulum unclassified菌作为人体肠道中的主要菌群(相对丰度 > 1%), 该两种菌的相对丰度在两组间具有差异,更加反映出PCOS患者与健康女性对照间肠道菌群的差异明显。并且通过菌种内相关性分析发现,普通拟杆菌、Subdoligranulum unclassified菌和弗格森埃希菌三种菌间互相具有相关性。这也给我们提示PCOS患者肠道菌群的紊乱可能不仅是单一菌种丰度发生变化的结果,人体肠道本就是一个复杂的内环境,单一菌种对机体的作用是有限的,多个菌种丰度的改变以及不同菌种间的相互作用可能是推动肠道菌群紊乱的主要动力。
已有研究发现PCOS的发病机制可能与胰岛素抵抗和高胰岛素血症[16]以及慢性炎症反应相关[17],而这两种机制均与本研究发现的PCOS患者肠道中富集的两种菌密切相关。本研究发现的PCOS患者肠道中普通拟杆菌(Bacteroides vulgatus)明显富集,之前已有研究发现普通拟杆菌的相对丰度在PCOS患者肠道内特异性增高,该菌不仅可通过胆汁酸-白介素22轴调控PCOS的发生发展,导致胰岛素抵抗和卵巢功能障碍[18],还可以和普雷沃菌(Prevotella copri)协同作用,加重胰岛素抵抗[19]。本研究发现的PCOS患者肠道中富集的另一种菌弗格森埃希菌(Escherichia fergusonii)属于肠杆菌科、埃希菌属,是人类罕见的致病菌,弗格森埃希菌能通过活细胞及其培养物滤液在回肠中产生大量积液导致腹泻[20],从而伴随机体的慢性炎症反应,该菌的高丰度状态是否通过慢性炎症对PCOS的发病产生影响,值得后续深入研究。
最新研究发现肠道菌群可在免疫系统的形成和功能调节等方面发挥作用,且不同部位的肠道菌群具有相对应的免疫细胞组成[21]。肠道菌群与生化免疫指标也具有紧密联系,肠道菌群的代谢产物可以恢复胰岛的功能,从而增强胰岛素的分泌[22],肠道菌群也能有效抑制机体中毒性蛋白团块的聚集,从而对机体起到一定的保护作用[23]。本研究发现普通拟杆菌的丰度与孕激素和催乳素呈现强负相关(P < 0.05),而Subdoligranulum unclassified菌与催乳素呈现正相关(P < 0.05),且这两个主要菌种间呈现强负相关性。PCOS患者中往往有雄激素过多的情况,有研究显示高雄激素血症会导致肠道菌群失调引起脂联素和瘦素水平的升高[24],本研究中显示普通拟杆菌的丰度与瘦素正相关(P < 0.05),均在PCOS患者中富集,且PCOS患者的脂联素显著高于健康对照组(P < 0.05)。PCOS患者的肠道菌群与生化免疫指标与对照组均具有差异,并具有一定相关性,为PCOS患者的综合性诊疗提供了方向。
由于PCOS患者的临床症状差异较大,容易与其他疾病混淆,所以PCOS的诊断需要排除其他具有相似症状的疾病,并依靠临床检测和超声检查为主,其中月经不规律较易观察,但是高雄激素血症需要抽血进行血清学检测,卵巢多囊样改变需要B超观测卵巢,这些操作均对人体具有一定的损伤,且人体激素水平和卵巢状态波动较大不稳定,检测结果有时候不具有代表性,不利于临床准确诊断和指导相关治疗。本研究发现布鲁米球菌、棒状戈登菌、脱硫弧菌、凸腹真杆菌、斯特雷沃菌5个菌是较为稳定的PCOS肠道菌群生物标志物,当这5个菌种联合诊断时AUC为83.29%,由于本研究的病例来源均是初次诊断为多囊卵巢综合征的患者,未经过任何药物治疗前采集粪便标本,均属于I、II期,所以5个菌种的组合具有较高的早期诊断价值。其中凸腹真杆菌的相对丰度在两组间又存在标志性差异(LDA > 2),故该菌种对PCOS具有巨大的潜在诊断价值。本研究从肠道菌群角度提供了一种PCOS的新诊断方法,通过采集粪便标本进行PCOS的诊断不仅无创,而且节约成本方便操作,不失为一种方便快捷的诊断新方法。该检测方法不仅仅可以用于单独意义上的PCOS疾病诊断,以及预测其患有PCOS的风险,同时可以丰富个人遗传信息等非疾病诊断,并为PCOS的辅助诊断与疗效监测提供参考,具有重要的临床价值。
| [1] | Escobar-Morreale HF. Polycystic ovary syndrome:definition, aetiology, diagnosis and treatment. Nature Reviews Endocrinology, 2018, 14(5): 270-284. DOI:10.1038/nrendo.2018.24 |
| [2] | Azziz R, Carmina E, Chen ZJ, Dunaif A, Laven JSE, Legro RS, Lizneva D, Natterson-Horowtiz B, Teede HJ, Yildiz BO. Polycystic ovary syndrome. Nature Reviews Disease Primers, 2016, 2(1): 16057. DOI:10.1038/nrdp.2016.57 |
| [3] | Rubin KH, Glintborg D, Nybo M, Abrahamsen B, Andersen M. Development and risk factors of type 2 diabetes in a nationwide population of women with polycystic ovary syndrome. The Journal of Clinical Endocrinology & Metabolism, 2017, 102(10): 3848-3857. |
| [4] | Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic ovary syndrome. The Lancet, 2007, 370(9588): 685-697. DOI:10.1016/S0140-6736(07)61345-2 |
| [5] | Rosenfield RL, Ehrmann DA. The Pathogenesis of Polycystic Ovary Syndrome (PCOS):the hypothesis of PCOS as functional ovarian Hyperandrogenism revisited. Endocrine Reviews, 2016, 37(5): 467-520. DOI:10.1210/er.2015-1104 |
| [6] | Tata B, El Houda Mimouni N, Barbotin AL, Malone SA, Loyens A, Pigny P, Dewailly D, Catteau-Jonard S, Sundström-Poromaa I, Piltonen TT, Dal Bello F, Medana C, Prevot V, Clasadonte J, Giacobini P. Elevated prenatal anti-Müllerian hormone reprograms the fetus and induces polycystic ovary syndrome in adulthood. Nature Medicine, 2018, 24(6): 834-846. DOI:10.1038/s41591-018-0035-5 |
| [7] | Wu RJ, Van der Hoek KH, Ryan NK, Norman RJ, Robker RL. Macrophage contributions to ovarian function. Human Reproduction Update, 2004, 10(2): 119-133. DOI:10.1093/humupd/dmh011 |
| [8] | González F, Kirwan JP, Rote NS, Minium J. Evidence of mononuclear cell preactivation in the fasting state in polycystic ovary syndrome. American Journal of Obstetrics and Gynecology, 2014, 211(6): 635. |
| [9] | Ehrlich SD. The human gut microbiome impacts health and disease. Comptes Rendus Biologies, 2016, 339(7/8): 319-323. |
| [10] | Gurbatri CR, Lia I, Vincent R, Coker C, Castro S, Treuting PM, Hinchliffe TE, Arpaia N, Danino T. Engineered probiotics for local tumor delivery of checkpoint blockade nanobodies. Science Translational Medicine, 2020, 12(530): eaax0876. DOI:10.1126/scitranslmed.aax0876 |
| [11] | Kundu P, Lee HU, Garcia-Perez I, Tay EXY, Kim H, Faylon LE, Martin KA, Purbojati R, Drautz-Moses DI, Ghosh S, Nicholson JK, Schuster S, Holmes E, Pettersson S. Neurogenesis and prolongevity signaling in young germ-free mice transplanted with the gut microbiota of old mice. Science Translational Medicine, 2019, 11(518): eaau4760. DOI:10.1126/scitranslmed.aau4760 |
| [12] | Obata Y, Castaño Á, Boeing S, Bon-Frauches AC, Fung C, Fallesen T, de Agüero MG, Yilmaz B, Lopes R, Huseynova A, Horswell S, Maradana MR, Boesmans W, Vanden Berghe P, Murray AJ, Stockinger B, Macpherson AJ, Pachnis V. Neuronal programming by microbiota regulates intestinal physiology. Nature, 2020, 578(7794): 284-289. DOI:10.1038/s41586-020-1975-8 |
| [13] |
Ding XL, Zhang LF, Li M, Chen J, Yang BH. The relationship between intestinal flora and immunity. Chinese Journal of Microecology, 2017, 29(8): 971-974.
(in Chinese) 丁晓蕾, 张蓝方, 李明, 陈骏, 杨葆华. 肠道菌群与免疫的相关性研究. 中国微生态学杂志, 2017, 29(8): 971-974. |
| [14] | Torres PJ, Siakowska M, Banaszewska B, Pawelczyk L, Duleba AJ, Kelley ST, Thackray VG. Gut microbial diversity in women with polycystic ovary syndrome correlates with Hyperandrogenism. The Journal of Clinical Endocrinology & Metabolism, 2018, 103(4): 1502-1511. |
| [15] | Zhang Y, Bobe G, Revel JS, Rodrigues RR, Sharpton TJ, Fantacone ML, Raslan K, Miranda CL, Lowry MB, Blakemore PR, Morgun A, Shulzhenko N, Maier CS, Stevens JF, Gombart AF. Improvements in metabolic syndrome by Xanthohumol derivatives are linked to altered gut Microbiota and bile acid metabolism. Molecular Nutrition & Food Research, 2020, 64(1): 1900789. |
| [16] |
He XT, Meng XW, Zhang XJ, Sun ZH. Research progress on the etiology and pathogenesis of polycystic ovary syndrome. Maternal and Child Health Care of China, 2017, 32(7): 1588-1591.
(in Chinese) 何晓彤, 孟祥雯, 张雪娇, 孙中华. 多囊卵巢综合征病因与发病机制的研究进展. 中国妇幼保健, 2017, 32(7): 1588-1591. |
| [17] |
Xu JY, Chen ZJ, Du YZ. Research progresses of the association between gut microbiome and polycystic ovary syndrome. Journal of Shanghai Jiaotong University (Medical Science), 2016, 36(8): 1250-1255.
(in Chinese) 徐洁颖, 陈子江, 杜艳芝. 肠道菌群与多囊卵巢综合征发病关系的研究进展. 上海交通大学学报(医学版), 2016, 36(8): 1250-1255. DOI:10.3969/j.issn.1674-8115.2016.08.028 |
| [18] | Qi XY, Yun CY, Sun LL, Xia JL, Wu Q, Wang Y, Wang L, Zhang YM, Liang XY, Wang LY, Gonzalez FJ, Patterson AD, Liu HY, Mu LS, Zhou ZH, Zhao Y, Li R, Liu P, Zhong C, Pang YL, Jiang CT, Qiao J. Gut microbiota-bile acid-interleukin-22 axis orchestrates polycystic ovary syndrome. Nature Medicine, 2019, 25(8): 1225-1233. DOI:10.1038/s41591-019-0509-0 |
| [19] | Pedersen HK, Gudmundsdottir V, Nielsen HB, Hyotylainen T, Nielsen T, Jensen BAH, Forslund K, Hildebrand F, Prifti E, Falony G, Le Chatelier E, Levenez F, Doré J, Mattila I, Plichta DR, Pöhö P, Hellgren LI, Arumugam M, Sunagawa S, Vieira-Silva S, Jørgensen T, Holm JB, Trošt K, Consortium MHIT, Kristiansen K, Brix S, Raes J, Wang J, Hansen T, Bork P, Brunak S, Oresic M, Ehrlich SD, Pedersen O. Human gut microbes impact host serum metabolome and insulin sensitivity. Nature, 2016, 535(7612): 376-381. DOI:10.1038/nature18646 |
| [20] | Gaastra W, Kusters JG, van Duijkeren E, Lipman LJA. Escherichia fergusonii. Veterinary Microbiology, 2014, 172(1/2): 7-12. |
| [21] | James KR, Gomes T, Elmentaite R, Kumar N, Gulliver EL, King HW, Stares MD, Bareham BR, Ferdinand JR, Petrova VN, Polański K, Forster SC, Jarvis LB, Suchanek O, Howlett S, James LK, Jones JL, Meyer KB, Clatworthy MR, Saeb-Parsy K, Lawley TD, Teichmann SA. Distinct microbial and immune niches of the human colon. Nature Immunology, 2020, 21(3): 343-353. DOI:10.1038/s41590-020-0602-z |
| [22] | Brial F, Alzaid F, Sonomura K, Kamatani Y, Meneyrol K, Le Lay A, Péan N, Hedjazi L, Sato TA, Venteclef N, Magnan C, Lathrop M, Dumas ME, Matsuda F, Zalloua P, Gauguier D. The Natural Metabolite 4-Cresol Improves Glucose Homeostasis and Enhances β-Cell Function. Cell Reports, 2020, 30(7): 2306-2320. DOI:10.1016/j.celrep.2020.01.066 |
| [23] | Goya ME, Xue F, Sampedro-Torres-Quevedo C, Arnaouteli S, Riquelme-Dominguez L, Romanowski A, Brydon J, Ball KL, Stanley-Wall NR, Doitsidou M. Probiotic Bacillus subtilis PROTECTS against α-synuclein aggregation in C. elegans. Cell Reports, 2020, 30(2): 367-380.e7. DOI:10.1016/j.celrep.2019.12.078 |
| [24] | Sherman SB, Sarsour N, Salehi M, Schroering A, Mell B, Joe B, Hill JW. Prenatal androgen exposure causes hypertension and gut microbiota dysbiosis. Gut Microbes, 2018, 9(5): 400-421. |
 2021, Vol. 61
2021, Vol. 61