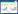中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 薛正莲, 王珊, 孙俊峰, 王芳, 周健. 2021
- Zhenglian Xue, Shan Wang, Junfeng Sun, Fang Wang, Jian Zhou. 2021
- 链霉菌形态分化与次级代谢产物合成的研究进展
- Research progress on morphological differentiation and secondary metabolite biosynthesis of Streptomyces
- 微生物学报, 61(12): 3870-3886
- Acta Microbiologica Sinica, 61(12): 3870-3886
-
文章历史
- 收稿日期:2021-03-05
- 修回日期:2021-04-24
- 网络出版日期:2021-06-02
链霉菌属(Streptomyces)隶属于细菌域、放线菌门、链霉菌科,是目前已知的基因组G+C含量较高的革兰氏阳性(G+)丝状细菌,达到70%–74%,且富含次级代谢基因簇和各类调控元件。目前发现约有40%的微生物来源的生物活性物质均来源于放线菌,包括多种抗生素、免疫抑制剂、抗肿瘤药、除草剂、抗氧化剂、伤口愈合剂和其他生物活性化合物等,其中链霉菌属合成的生物活性物质占80%左右[1–2]。目前临床上使用的抗生素有超过60%的均为链霉菌的次级代谢产物或其衍生物,如大环内酯类抗生素、氨基糖苷类抗生素、四环素、酰胺醇等,这对人类的生产和生活都有着举足轻重的作用[3–4]。当今,随着全基因测序技术的蓬勃发展,如NGS、Nanopore以及Pacbio SMRT等,越来越多链霉菌的基因组信息被挖掘,天蓝色链霉菌[5]、阿维链霉菌[6]和灰色链霉菌的全基因组已相继测序成功。同时伴随着生命科学、生物工程、计算机学、生物信息学、分子生物学、比较基因组学等众多学科的飞速发展与相互交融,如何提高已知抗生素的产量以及激活沉默生物合成基因簇以发掘新型抗生素,已经成为当今研究的重点。同时研究表明抗生素等次级代谢产物的合成与链霉菌生命周期中的形态分化密不可分[7],链霉菌在进化过程中形成了一套复杂的形态分化周期,如图 1所示[8]。首先在合适的环境中,孢子(spore)在一端或两端生长形成发芽孢子(germinating spore),发芽孢子沿顶端生长形成具有多分枝多核的营养菌丝(vegetative mycelium),然后营养菌丝在各种疏水蛋白的作用下突破培养基与空气的表面张力形成气生菌丝(aerial hyphae),随着气生菌丝的生长发育形成隔膜进而形成单核的孢子链(spore chains),最终孢子链断裂形成独立的孢子,这种独特的生活方式有助于链霉菌在自然环境中生存。在链霉菌形态分化过程中,主要会形成两类突变株:一种称之为bld突变株,另一种为whi突变株,前者不能形成气生菌丝,主要由bld级联基因调控;后者不能形成成熟的孢子,主要由whi系列基因调控[9–10]。链霉菌在生成孢子的过程中伴随着多种次级代谢产物的合成,同时链霉菌在不同的发酵条件下会呈现蓬松、分散以及紧密的菌丝形态,菌丝形态差异与次级代谢产物的产量密切相关。bldA、bldC、bldH/adpA、bldM、bldN、ssgA、ssgB、ftsZ、whi和whiT等基因不仅对链霉菌的形态分化至关重要[11–13],同时也在链霉菌次级代谢过程中起重要作用。对链霉菌形态分化周期的全面理解将促进我们对次级代谢产物生物合成的全面理解,有助于我们通过合理的代谢工程手段去构建新型抗生素、提高抗生素生产菌的耐受性,并且可以通过改变形态学基因的表达来改变链霉菌的微观形态,同时提高相关次级代谢产物的产量,这对人类的健康发展具有重大意义。
1 链霉菌生长周期中的形态分化 1.1 孢子萌发形成基内菌丝
孢子萌发形成基内菌丝是链霉菌生长发育的起始阶段,该过程主要涉及链霉菌菌丝的分裂以及顶端的生长。胞质分裂是生命体生长发育和物种延续的基础,二分裂是原核生物普遍的胞质分裂方式,该过程主要由纤维蛋白同源蛋白FtsZ在分裂点组装形成Z环并招募分裂体,同时在Min系统、拟核闭塞系统以及Ter linkage系统的精确定位下使分裂体精准定位在胞质中间[14–16],然后FtsZ通过踏板运动的方式收缩Z环以启动分裂点细胞膜内陷和细胞壁的合成,最终使细胞纵向或横向一分为二,形成两个新的个体。但链霉菌的胞质分裂不同于二分裂,而是主要通过一种特殊的隔膜结构进行胞质分裂,这与链霉菌沿顶端生长有很大的关系[17–18]。
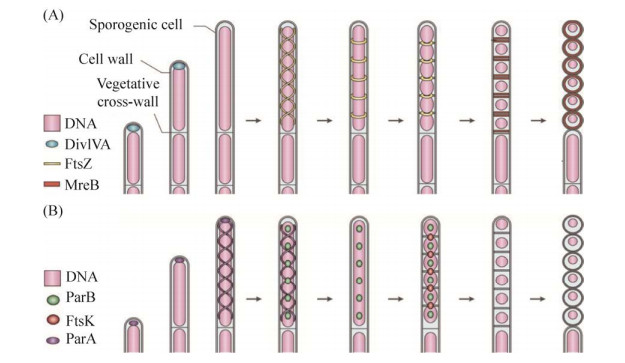
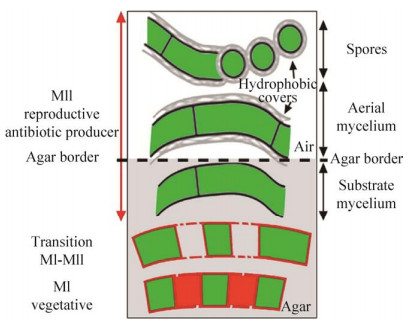
1.1.1 链霉菌的隔膜结构::链霉菌的胞质分裂不同于大肠杆菌以及枯草芽孢杆菌的二分裂方式,主要通过一种特殊的隔膜结构进行胞质分裂,这种隔膜结构存在于链霉菌的整个生长周期,隔膜在链霉菌生长周期分布如图 2所示[19]。主要分为3个时期:MI时期、MI-MII过渡期以及MII时期。在MI时期菌丝体被一种特殊的隔膜分隔成1 μm左右的单核区域,由交替的活细胞和死细胞组成且难以观察,只有通过活死细胞染色才能观察到这种隔膜的存在;同时形成可通透相连的Cross-membrane膜泡聚集结构,这是隔膜Cross-wall的前体;在随后的MI-MII过渡期,活细胞以多核小室的形式生长,死细胞完全降解;进而链霉菌的生长发育开始进入MII时期,Cross-membrane逐渐变成稀疏的Cross-wall结构,相邻的区域之间可以发生物质交换,最终使孢子丝分隔断裂成一个个大小相等的孢子[20],次生代谢通常仅限于MII阶段。虽然链霉菌生长不依赖FtsZ所指导的二分裂,但链霉菌ftsZ突变体不能产生Cross-wall隔膜,使菌丝体无法分裂以及孢子无法产生,进而导致突变株产生较多分枝,这不影响菌体的存活但影响菌体的增殖;然而将ftsZ回补之后菌体能够形成隔膜结构,这表明隔膜结构的形成依赖于FtsZ介导的分裂体结构。此外,链霉菌中小蛋白CrgA,能够通过与fts家族中的FtsZ、FtsI、FtsQ相互作用来影响分裂体组分的分配进而影响菌丝和孢子的分裂[21]。
|
| 图 2 链霉菌生长周期中菌丝体的隔膜分布[19] Figure 2 Location of vegetative septum in the cell-cycle of Streptomyces[19]. The discontinuity of the hyphal membrane represents the change of membrane permeability in dying cells. In the MI and transition phases, the permeable and connected Cross-membrane is mainly used for material exchange, while the MII phase forms a Cross-wall structure, where red and green represent dying cells and living cells, respectively. The traditional nomenclature of substrates and aerial mycelium is indicated by black letters (right); the new terms of MI and MII stages are indicated by red letters (left). |
1.1.2 链霉菌的顶端生长::
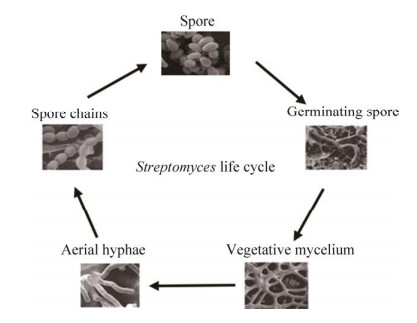
在许多对称生长的生物模型中,它们通过细胞骨架蛋白FtsZ和肌动蛋白同源物MreB协调合成的刚性聚合物—细胞壁肽聚糖(Peptidoglycan, PG),使细菌保持其特有的杆状体形态,该形态可优化比表面积从而促进养分吸收。为了保持细菌的形状和细胞的完整性,PG的组装必须在时间和空间上得到精确的控制。然而对于不对称生长的链霉菌而言,其顶端生长则是独立于MreB蛋白呈现极性生长,这种特性主要由顶端标记蛋白DivIVA调控,该蛋白由AfsK激酶活化[22–23]。divIVA基因能够直接控制细胞壁合成PBPs (Penicillin-binding proteins,PBP),是很多放线菌的极性生长的必需基因,如在天蓝色链霉菌(Streptomyces coelicolor)中过表达divIVA将使菌体呈现更多的分枝结构,在结核分枝杆菌敲除divIVA将导致菌体变成球状。链霉菌菌丝体的极性生长以及新分枝点的形成需要由DivIVA等诸多蛋白参与组装尖端组织中心(Tip organizing center, TIPOC),TIPOC是一个非常庞大且复杂的多蛋白装配体,除DivIVA蛋白外,其还包括丝状形成蛋白FilP、链霉菌细胞骨架元素(Streptomyces cytoskeletal element,Scy)、纤维素合酶(Cellulose synthase,ClsA)以及PBP、细胞分裂机器(FtsZ、SsgA、SsgB、ParA和ParB)、DNA转移酶TraB和DivIVA磷酸激酶AfsK等,它们的结构示意图如图 3所示[24–26]。Scy对TIPOCs的组装、局部化非常重要,它与DivIVA结合从而促进分枝过程中形成新的极性中心,并支持现有菌丝两端的极性生长,同时作为支架蛋白稳定TIPOCs结构。ParA/ParB作为一种在细胞分裂前促进DNA分离的活性分配系统,其中ParA是一种在细胞骨架中提供分离力的ATP酶,ParB是一种促使核蛋白复合体组装的DNA结合蛋白。同时ParA能够介导ParB复合物的有效组装,Scy蛋白能够将该复合物招募到菌丝尖端并与FtsZ、SsgA、SsgB相互作用,发挥协调生长和染色体分离的作用,对细胞形态和分枝模式有显著影响[27–28]。FilP在菌丝顶端的渐变区域中积累,通过与Scy和DivIVA相互作用影响菌丝形态,其浓度处于一种动态状态,这主要依赖于菌丝顶端的延伸程度,它在菌丝生长停滞时立即消失。FilP和Scy是由相邻的基因编码的,尽管它们的长度不同,但它们在结构和功能上具有相似性[29]。TraB为DNA转移酶,它在接合转移中具有重要作用。ClsA与DivIVA相互作用,主要参与细胞膜中β-葡聚糖的合成。此外,Sharm等发现EF1025是一种影响杆菌细胞长度和形态的新型DivIVA相互作用蛋白,过表达EF1025将会导致细胞伸长[30]。
1.2 基内菌丝生长形成气生菌丝
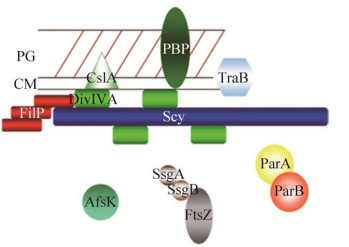
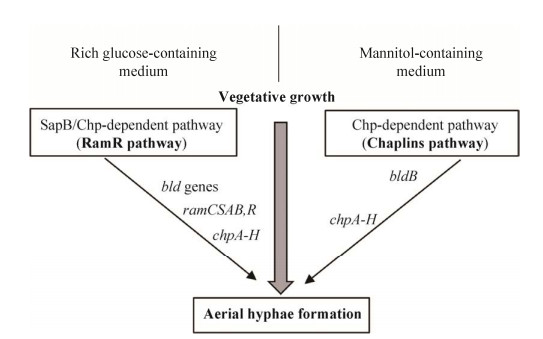
基内菌丝生长形成气生菌丝发生在MI到MII的过渡时期,此时细胞会发生大量不规则的程序性死亡,从而为气生菌丝的形成提供营养,该过程还需要SapB、Chaplins、Rodlin 3种疏水性蛋白,它们参与疏水鞘的形成,辅助基内菌丝突破培养基与空气的表面张力生长成气生菌丝,3种蛋白根据培养基的组成不同可通过不同的途径合成,如图 4所示[31]。SapB (Spore-associated protein)是一种由18个氨基酸组成的羊毛硫肽类化合物,由bld家族基因通过激活一种与气生菌丝产生相关的操纵子ramCSAB产生[32],这是气生菌丝合成的起点。bld家族基因包括bldA、bldB、bldC、bldD、bldJ、bldI、bldK、bldN、bldL、bldG、bldH等转录调控因子,其功能如表 1所示[33]。灰色链霉菌通常在R2YE培养基上通过RamR途径产生SapB蛋白,如图 5所示[34]。首先由afsA-g基因产生2-异辛酰基-3R-羟甲基-γ-丁内酯,然后以该物质为前体产生信号分子γ-丁内酯,γ-丁内酯作为一种自诱导物,与灰色链霉菌菌浓度呈正相关,是链霉菌之间一种交流的“语言”,当培养基内γ-丁内酯达到一定浓度时,它能与群体感应调控蛋白ArpA结合,抑制其DNA结合活性,进而激活bldH的表达,产生BldH蛋白。BldH蛋白能够与bldN及ssgA的启动子区域结合,促进两者的转录和表达,BldN和SsgA通过调控AmfR,进而激活操纵子ramCSAB的表达,最终合成SapB蛋白[35],这种表面活性剂改变培养基与空气之间的表面张力使得基内菌丝突破培养基表层形成气生菌丝。然而当链霉菌在MS培养基上生长时,bldB通过Chaplins途径产生X因子从而正向调控Chaplins蛋白和Rodlin蛋白[36–37],其中X因子尚未有进行详细的功能研究。Chaplins蛋白包括2种类型,即chpA-C和chpD-H,前者较长并含有2个Chaplins结构域,后者较短只含有1个Chaplins结构域,这两种分泌型的疏水蛋白与SapB蛋白的作用一致,由RamAB这种ABC转运蛋白运输至菌丝体表面并分散至培养基表面创造疏水环境[38]。这是存在于同一宿主菌中的两个相对独立的调控系统,这两种系统是宿主菌根据自身能量和菌体密度条件应答不同的外界环境压力所做出的调控反应,使得链霉菌在生长稳定期阶段能够协调过渡,有利于下一步的形态分化和次级代谢产物的合成。
| Gene names | Gene functions |
| bldA | Leucine tRNA for UUA codon |
| bldB | Encoding a DNA binding protein, may contain a helix-helix-helix domain that can form a homodimer |
| bldC | Putative MerR family transcriptional activator |
| bldD | Small DNA binding protein, capable of binding to the promoters of whiG, bldN and sigH |
| bldG | Putative resistance factor |
| bldH | AdpA homologue containing TTA codon |
| bldK | Encodes the ABC transporter, which initiates the expression of bld gene cassette |
| bldM | Response regulator may play a role in the early and late stages of growth and development |
| bldN | Encodes extracellular functional sigma factor, recognizes bldM promoter region, may play a role in the early and late stages of growth and development |
| bldI | Unknown |
| bldJ | Encoding a 665Da signal peptide |
| bldL | Unknown |
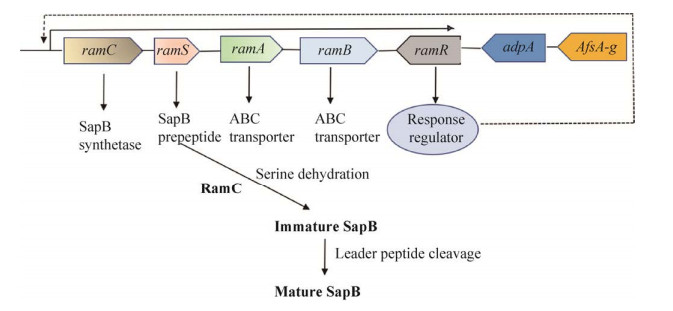
|
| 图 5 灰色链霉菌中SapB合成的调控机制 Figure 5 Regulation mechanism of SapB synthesis in Streptomyces griseus. |
1.3 气生菌丝发育形成孢子
气生菌丝发育形成孢子链,最后断裂形成孢子,需要隔膜Cross-wall闭合断裂以及DNA分隔,该过程如图 6所示[39–40]。链霉菌的气生菌丝通过顶端伸长生长,并携带DivIVA的顶端元件,细胞骨架蛋白FtsZ聚集成螺旋状的细丝,这些细丝被重新塑成有规则间隔的Z环,每个Z环处都能组装形成一个分裂体,形成孢子隔膜,最后这些隔膜同时封闭断裂形成多个孢子,同时DNA在ParA、ParB、FtsK的作用下分配到每个孢子中,该过程不需要精确的定位系统,这是链霉菌进行传播和繁殖的重要途径。气生菌丝发育形成孢子的过程中需要Whi系列基因的表达来调控,Whi系列基因的功能如表 2所示。该系列基因主要通过调控孢子链分裂蛋白基因如fts、dynA、dynB、ssgA、ssgB、sepF等的转录来使得隔膜Cross-wall断裂和DNA的分隔形成孢子,其中SsgA、SsgB是研究的比较清楚的蛋白,几乎在所有细胞壁发生重构的地方都有分布,ssgA、ssgB基因的缺失会导致菌株无法产生孢子,同时还会导致菌株的气生菌丝产生大量的分枝。在隔膜Cross-wall断裂过程中,首先SsgA在细胞膜内部聚集形成有序的点,同时FtsZ招募分裂体的形成,然后SsgA通过SsgB与FtsZ的相互作用,再通过SsgB与膜蛋白SepG相互作用使得分裂体迁移至分裂点处,并在FtsZ与SsgA的聚集点形成Z环,在Z环的作用下使得DNA分隔最终完成孢子链的分裂,同时也需要SepF、发动蛋白相似蛋白DynAB来维持孢子丝分裂体的稳定[41]。
| Gene names | Gene functions |
| whiG | Encoding RNA polymerase sigma factor, which is a key regulator of aerial hyphae spore formation |
| whiH | Encoding a member of the GntR repressor protein family, this mutant causes incomplete differentiation of aerial hyphae |
| whiI | Encoding response regulator, this mutant does not form a sporulation gap |
| whiA | whiA and whiB together regulate aerial hyphae to form spores |
| whiB | whiB and whiD encode the specific protein Wbl (WhiB-like protein) that binds to the 4Fe-4S cluster in Streptomyces |
| whiE | whiE begins to be transcribed in the late stage of sporulation, encoding the synthesis of the spore pigment gray polyketide |
2 链霉菌的形态分化与次级代谢的全局性调控 2.1 bldA的调控
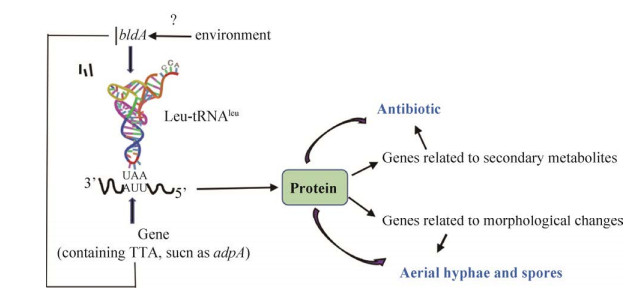
bldA基因是链霉菌中关于形态分化和次级代谢的一个全局调控基因,在1976年由Hopwood在天蓝色链霉菌中鉴定出[42],1987年发现该基因能够编码链霉菌中UUA密码子翻译所必需的独特tRNA即tRNALeu,在富含GC的链霉菌基因组中,TTA非常罕见,如在天蓝色链霉菌的7825个染色体基因中,仅有145个含TTA的基因,其中adpA基因富含TTA并在各种链霉菌属物种中呈高度保守。缺少编码亮氨酸的tRNA将会导致mRNA翻译受影响,蛋白合成受阻,直接影响与初级代谢相关的基因,导致气生菌丝的发育和孢子形成受到干扰,使得菌株呈现光秃表型,进而影响次级代谢产物的合成,这是链霉菌的一种普遍现象,在多种链霉菌中都能够观察到此现象,bldA基因对形态分化和次级代谢的影响如图 7所示[43]。小牛链球菌(S. calvus) bldA基因中的点突变A21G导致成熟tRNA的结构紊乱,最后导致秃头表型。bldA突变的天蓝色链霉菌不能进行正常的形态分化,同时天蓝色链霉菌中的多种次级代谢产物将无法合成,如放线紫红素(Actinorhodin,ACT)、十一烷基灵菌红素(Undecylprodigiosin,RED)、钙依赖抗生素(The calcium-dependent antibiotic,CDA)、锌离子载体(Coelibactin)和甲基霉素(Methylmycin)等多种次级代谢产物, 因为它们的CSR (Cluster-situated regulators)、sactII-ORF4、redZ或mmyB都分别含有TTA基因;在天蓝色链霉菌中过表达bldA基因,次级代谢产物产量增加,同时菌落颜色加深[44]。同时bldA突变体会导致灰色链霉菌(S. griseus)失去气生菌丝的形成和次生代谢产物的产生[45]。此外bldA突变体在克拉维链霉菌(S. clavulatus)中导致菌体发育缺陷,克拉维酸的产量严重降低[46]。在林可链霉菌(S. lincolnensis)中敲除bldA基因,菌株将无法合成林可霉素且无法形成孢子;回补该基因,林可霉素的合成恢复,而将bldA基因过表达将使得林可霉素产量显著提高[47]。波赛链霉菌(S. peucetius)是一种产柔红霉素的且含有TTA基因的bldA缺陷菌株,当在该菌体内表达bldA基因能大幅度提升柔红霉素的效价[48]。秃裸链霉菌(S. variabilis)是不含有TTA基因的bldA缺陷菌株,在该菌体内表达bldA基因会使得秃裸链霉菌产生一种之前从未报道的4-E/4-Z- annimycin抗生素,证明bldA基因是此抗生素合成路径中的一个开关,它的表达能够激活隐形次级代谢的生物合成[49]。bldA的调控机制还有很多尚不清楚,但是它对于链霉菌菌体的形态分化和次级代谢产物合成至关重要,对该调控机制的理解将有助于我们构建有应用前景的工程菌株。
2.2 双组分系统的调控
链霉菌中双组分系统(TCSs)参与菌体的多种生理过程,如趋化性、新陈代谢、渗透压稳定、毒力因子调控、生物膜形成以及群体感应等[50],尤其与链霉菌的形态分化与次级代谢调控有着密切联系。TCSs作为基本的刺激-相应偶合机制,主要包含一个膜上的组氨酸激酶和相应的反应调节因子。其中组氨酸激酶具有激酶、磷酸转移酶和磷酸酶的活性,激酶在感知外界的信号后通过自磷酸化将磷酸基团转移到对应的反应调节子上,磷酸化状态改变的反应调节因子将参与糖酵解、糖异生、应激信号通路、蛋白质分泌和细胞包膜代谢等核心过程,进而调控次生代谢和形态分化[51]。目前,已有多对双组分信号转导系统的功能得到了诠释,如AbsAl/A2、PhoP-R、MtrAB、AfsQ1/Q2、DraR-K、MacRS、Sco52832/Sco5283、RspA1/A2等几乎涵盖了链霉菌次级代谢及生长发育等各个方面[52]。AbsAl/2是一种负调控因子,它的受体蛋白能够结合到相应途径特异性调节基因的启动子区,抑制它们的转录,从而阻碍相应次级代谢产物的合成[53]。磷酸盐是细菌生存所必需的成分,磷代谢异常会直接或间接影响链霉菌的生长发育及次级代谢产物的合成,PhoPR是参与链霉菌磷酸盐代谢、氮代谢、形态分化和次级代谢等生理过程的双组分系统,在培养基缺乏磷元素时,PhoPR能够激活与磷代谢相关的基因,同时抑制氮代谢的主要调控因子的表达来维持菌体内氮磷的平衡;同时PhoPR能够通过与转录激活因子AfsR竞争afsS的启动子区域,影响afsS的表达来影响抗生素的合成[54]。双组分系统MtrAB能够通过调控chpA-chpH、rdlA、rdlB、ramA、ramB、ramC、ramS、ramR等基因的转录来影响SapB、Chaplins、Rodlin的合成来影响菌丝体的形成;同时也能够正调控whiH、whiI基因的转录来影响孢子的成熟[55]。AfsQ1/Q2首先在变铅青链霉菌(S. lividans)中发现,它通过感知氮代谢中间产物或C/N/P的比例来激活受体蛋白,进而与抗生素生物合成途径中的启动子结合来影响抗生素的合成,此外AfsQ1还通过调控whiD、bldM基因的转录来影响气生菌丝和孢子的形成[56]。DraR-K双组分调控系统通过调控抗生素合成基因簇中的途径特异性调控基因来影响抗生素的合成,如能够影响天蓝色链霉菌中放线紫红菌素(Actinorhodin,ACT)等抗生素的产生以及阿维链霉菌(S. avermitilis) NRRL 8165中阿维菌素和寡霉素的产量[57]。MacRS的靶基因mmpA、mmpB、mmpC能够直接调控膜蛋白基因从而影响Cross-wall的形成和孢子的合成来影响链霉菌的形态分化,同时它还能够间接调控抗生素合成基因簇的转录来影响抗生素的合成,如在天蓝色链霉菌M145中敲除该基因,ACT、RED、CDA的产量显著下降。Sco52832/ Sco5283编码的双组分系统中,当sco52832基因中的核苷酸发生T到C的突变将会导致激酶HAMP结构域的第二个螺旋中的125位天冬氨酸被甘氨酸取代,从而导致菌体从紧密生长变成分散生长的形态,同时改变了菌体对碳源的吸收方式使得菌丝受氧气和营养的限制减小,进而使得目的蛋白质产量增加[58]。
2.3 拟核结合蛋白的调控在链霉菌的生命周期中,拟核结合蛋白(Nucleoid-associated proteins,NAPs)作为染色体高级结构的重要成分,在链霉菌的形态分化和次级代谢过程中发挥了重要作用,在气生菌丝分化为孢子链再到独立孢子的过程中,染色体也分配到了每一个孢子中,这需要拟核结合蛋白的帮助,按照功能NAPs可以分为DNA曲形蛋白(HupA、HupS和sIHF)、DNA桥连蛋白(Lsr2)、DNA保护蛋白(Dps)和DdbA几大类[59],它们几乎涉及链霉菌DNA相关的全部过程,如基因表达、DNA的分裂、DNA的重组、DNA修复以及拟核的形成,同时伴随着菌体的形态分化。在天蓝色链霉菌中HupS、Dps、sIHF蛋白参与孢子形成过程中的拟核分配和压缩,同时在这个过程中需要SsgA和SsgB蛋白相互作用使分裂体迁移至分裂位点,Lsr2能够特异性结合到ssgB的启动子区,HupA也能够结合到ssgA、ssgB和ssgR的启动子区调控基因的转录,表明NAPs在链霉菌的形态分化过程中发挥了重要作用[60]。此外NAPs也可通过蛋白质的修饰(磷酸化、甲基化、乙酰化等)以及参与蛋白质的降解来调控链霉菌次级代谢产物的合成,但是这种调控受外界环境压力的影响,如在天蓝色链霉菌中,hupA突变体在固体培养基中放线紫红素的合成增加,而在液体培养基中放线紫红素和十一烷基灵菌红素几乎不产;而Lsr2能够与染色体上富含AT的序列结合,从而保护链霉菌中的转录沉默基因簇以免其中特定代谢产物的不恰当表达,并对链霉菌中的信号传递和拮抗化合物合成进行全局调控,总之lsr2在链霉菌中起着代谢守门人的作用,在链霉菌的代谢回路中发挥着关键作用[61],我们可以通过基因工程手段调控lsr2的活性从而促进链霉菌中大量隐性次级代谢物的产生,如在玫瑰孢链霉菌中lsr2突变体能够激活隐性代谢基因簇从而激活Mureidomycin的生物合成[62]。NAPs作为链霉菌生长周期和次级代谢途径新型的共同调控因子,对链霉菌形态分化和次级代谢产生了重要的影响。
2.4 其他链霉菌对于形态分化和抗生素合成的全局性调控因子一般位于抗生素合成基因簇外,除了以上两种还有很多,目前发现的几十种γ-丁内酯分子也是一种全局性调控因子,主要包括A因子(2-isocapriloil-3R-经甲基-γ-丁内酯)型、维基尼丁羟酸内酯(VB)型、IM-2型和SCB型4种[63]。如A因子型能够对灰色链霉菌中的链霉素的合成和菌体的形态分化产生影响;VB型参与维基尼链霉菌中的维基尼霉素生物合成的调控;IM-2型参与浅紫灰链霉菌中D-环丝氨酸抗生素的合成;SCB型参与天蓝色链霉菌中多种抗生素和色素的合成调控。Sigma(σ)因子也属于一种全局性调控因子,它能可逆地与RNA聚合酶核心酶的活性催化位点结合来激活起始转录,确保链霉菌形态分化和次级代谢相关基因的准确表达。在天蓝色链霉菌中SigB、SigL、SigX、SigN、SigF、SigH、SigK、SigM、SigG、SigT等第三类σ因子能够调控天蓝色链霉菌的形态分化,还有多达45个第四类σ因子参与抗生素的调控,如Sig T的缺失能加速菌体分化、提高抗生素产量,调节缺乏氮源时放线紫红素的合成。nsdA作为一种负调控因子调控天蓝色链霉菌的形态分化和次级代谢,此外还有很多小分子化合物参与链霉菌的形态分化和抗生素的合成,如正负调控因子ppGpp[64]、无机磷酸盐、DasR和N-乙酰葡萄糖胺等。
3 菌丝形态与次级代谢产物的合成链霉菌是次级代谢产物和工业相关酶的生产者,并且在发酵过程中会随着菌丝网络的生长可能表现出3种类型的形态:可能分支或不分支的细丝,团块和沉淀,这些形态与目的产物的产量密切相关。如惰性阳离子对天青链霉菌的形态有明显的影响,添加过量的Mg2+、Ca2+和Mn2+通过改变渗透压以及菌丝细胞壁附近的理化性质导致天青链霉菌呈现颗粒生长,最终使得目的产物迷宫肽素A1的产量增加[65]。Xia等通过比较了普通摇瓶和3 L发酵罐中不同的转速和搅拌速度下S. flocculus CGMCC4.1223形态与拉达霉素甲酯产量之间的关系,当搅拌速度在400 r/min时菌丝形态为大颗粒;600 r/min时菌丝形态为支化团块;在800 r/min时菌丝形态变为游离细丝;1000 r/min时菌丝形态为细小碎片,在搅拌速度从低到高的过程中拉达霉素甲酯的产量从低到高再到低,在800 r/min时产量达到最高,这是因为较高的搅拌速度通过促进破碎来减小颗粒尺寸从而提高了总体生长速率,但增加搅拌速度也会导致细胞裂解,说明形态对搅拌速度有极大的依赖性,游离的细丝使得营养物质的传递效率提高,从而对细胞的次级代谢产生刺激作用进而对产量产生巨大的影响,此外我们也可以通过将细胞分裂激活基因ssgA的过表达从而导致菌丝呈分散生长进而提高目的产物的产量[66]。Van Dissel等通过转速来影响微量滴定板MTP中生长的青紫链霉菌菌丝形态,最后使用图像分析和主成分分析,发现当以1400–1600 r/min的转速时,MTP中的菌丝形态类似于摇瓶中获得的形态,同时也保持了与摇瓶中相当的目的产品的合成。该研究表明,可以通过精细地控制混合速率从而与大规模培养相似的方式来控制微培养物中链霉菌的形态,这可以促进高通量筛选和放大;这表明形态学和产量之间有着密切的关系,同时流体动力学在塑造形态和产物形成方面都起着重要作用[67]。Zhao等将S. rimosus M527的otrA抗性基因通过含有强启动子permE*的质粒在天蓝色链霉菌M145中过表达,不仅使得天蓝色链霉菌M145对多种氨基糖苷类抗生素如庆大霉素、潮霉素、链霉素和壮观霉素的抗性增加,而且天蓝色链霉菌M145的气生菌丝体形成加快,孢子早熟,同时在5L发酵罐中胞内和胞外放线菌丝蛋白生成量分别比原始菌株高6倍和2倍[68]。apasm 4178基因由AdpA样蛋白APASM 1021调控,Wu等将apasm 4178基因在A. pretiosum ATCC 31280中进行过表达,导致菌丝体呈现分散状态,且菌体中抗肿瘤药Ansamitocin P-3(AP-3)提高了46.50%。同时将apasm 4178在生产盐霉素的白色链霉菌BK 3-25和生产井冈霉素的吸水链霉菌TL01中过表达,不仅导致菌体呈现分支或不分支的细丝,而且盐霉素和井冈霉素的产量分别提高了33.80%和14.94%[69]。当在青霉链霉菌S. penicillium中敲除基因hyaS时,十一烷基灵菌红素的产生明显随着菌丝束的增加而提高[70]。此外,敲除S.lividans中的matA和matB导致菌丝体分散并提高了酪氨酸酶的产量[71]。总之菌丝形态分化与次级代谢产物的产量密切相关,菌丝形态变化与次级代谢产物合成变化往往呈现协同效应,不同的次级代谢产物生产菌倾向于不同的形态。为了优化次级代谢产物的生产,需要结合链霉菌的形态工程。形态学工程[72]的经典策略包括调节pH值、温度、培养基组成、通气、搅拌以及形态学基因的表达,其中通过基因操作进行的形态学工程更具针对性和灵活性,对形态学基因的合理调控将有利于次级代谢产物的合成。
4 总结和展望链霉菌被认为是天然次级代谢产物发现和大量生产的最佳底盘生物之一,它有许多与酵母、大肠杆菌和其他微生物不同的独特特征[73],目前多数研究者通过位点特异性单交换和双交换、RecET重组系统、oriT直接捕获系统(oriT-directed capture system)、基因簇弹出(pop-up)系统、I-SceI核酸内切酶系统、依赖于酵母同源重组系统的TAR (Transformation associated recombination)克隆系统以及依赖于CRISPR-Cas9的CATCH (Cas9-assisted targeting of chromosome segments)技术等分子操作手段直接对次级代谢生物合成基因簇中的生物合成基因和调节基因进行拷贝来扩大目的产物的产量,或者在组学分析的指导下系统性地对次级代谢产物合成途径进行重构来提高产量,但这些方法往往忽略了形态与产量之间的关系,两者在菌体的生命过程中密切相关且受到了复杂的网络调控。对bldA和bldG突变体的克拉维链霉菌进行蛋白质组学分析,最终发现形态分化和次级代谢的相关蛋白的表达量均受到了不同程度的改变,其代谢网络如图 8所示[74],证明链霉菌的形态分化和次级代谢密不可分,且两者均受到了复杂的网络调控。本课题组一直致力于微生物代谢工程相关的研究工作,前期我们通过紫外、NTG (Nitrosoguanidine)、5-BU (5-bromouracil)、ARTP (Atmospheric room temperature plasma)等多种诱变方式有效获得了高产新霉素的弗氏链霉菌菌株,在此基础上我们通过基因工程手段过表达新霉素合成路径中的关键基因从而提高新霉素的产量,进而我们通过不同的铵盐驯化得到了新霉素显著提高的耐胺菌株,这将有利于新霉素大规模补料发酵。同时借助扫描电镜观察发现,弗氏链霉菌呈现聚集变短的形态且产孢提前,这说明在过表达或敲除次级代谢产物合成基因簇的关键基因基础上,继而通过形态学工程方法能够进一步提高菌株次级代谢产物的产量。
综上所述,对链霉菌生长周期的全面理解将促进我们对次级代谢产物合成的认识,我们可通过基因工程手段加快链霉菌菌丝和孢子的成熟,进而缩短形态分化周期和发酵周期,也可通过启动子交换、核糖体工程、RNA调控、激活正调控基因、灭活负调控基因、异源表达、共培养和培养基优化等方法,来激活相关形态学基因的表达,进而产生新型次级代谢产物和提高已知次级代谢产物的产量,此外也可以通过调节pH值、温度、培养基组成、通气和搅拌等形态学工程策略来提高次级代谢产物的产量。
| [1] |
Zhao JH, Fang H, Zhang DW. Research progress in biosynthesis of secondary metabolites of microorganisms. Biotechnology Bulletin, 2020, 36(11): 141-147.
(in Chinese) 赵江华, 房欢, 张大伟. 微生物次级代谢产物生物合成的研究进展. 生物技术通报, 2020, 36(11): 141-147. |
| [2] |
Zhang L, Chang KL, Yao G, Du BH, Mei XG. Research progress on secondary metabolites of Streptomyces albireticuli and Streptomyces albofavus. Chinese Journal of Antibiotics, 2021, 46(2): 89-96.
(in Chinese) 张琳, 常恺莉, 姚感, 杜秉海, 梅显贵. Streptomyces albireticuli和Streptomyces albofavus次生代谢产物的研究进展. 中国抗生素杂志, 2021, 46(2): 89-96. DOI:10.3969/j.issn.1001-8689.2021.02.001 |
| [3] | Li Y, Tan HR. Biosynthesis and molecular regulation of secondary metabolites in microorganisms. Science China Life Sciences, 2017, 60(9): 935-938. DOI:10.1007/s11427-017-9115-x |
| [4] | 周展. 链霉菌转录调控和转运分泌的功能基因系统进化研究. 浙江大学学位论文, 2012. http://cdmd.cnki.com.cn/article/cdmd-10335-1012338296.htm |
| [5] | Bentley SD, Chater KF, -M, Cerdeño-Tárraga A, Challis GL, Thomson NR, James KD, Harris DE, Quail MA, Kieser H, Harper D, Bateman A, Brown S, Chandra G, Chen CW, Collins M, Cronin A, Fraser A, Goble A, Hidalgo J, Hornsby T, Howarth S, -H, Huang C, Kieser T, Larke L, Murphy L, Oliver K, Rabbinowitsch E, -A, Rajandream M, Rutherford K, Rutter S, Seeger K, Saunders D, Sharp S, Squares R, Squares S, Taylor K, Warren T, Wietzorrek A, Woodward J, Barrell BG, Parkhill J, Hopwood DA. Complete genome sequence of the model Actinomycete Streptomyces coelicolor A3(2). Nature, 2002, 417(6885): 141-147. DOI:10.1038/417141a |
| [6] | Ikeda H, Ishikawa J, Hanamoto A, Shinose M, Kikuchi H, Shiba T, Sakaki Y, Hattori M, Ōmura S. Complete genome sequence and comparative analysis of the industrial microorganism Streptomyces avermitilis. Nature Biotechnology, 2003, 21(5): 526-531. DOI:10.1038/nbt820 |
| [7] | Liu G, Chater KF, Chandra G, Niu GQ, Tan HR. Molecular regulation of antibiotic biosynthesis in Streptomyces. Microbiology and Molecular Biology Reviews, 2013, 77(1): 112-143. DOI:10.1128/MMBR.00054-12 |
| [8] | Flärdh K, Buttner MJ. Streptomyces morphogenetics: dissecting differentiation in a filamentous bacterium. Nature Reviews Microbiology, 2009, 7(1): 36-49. DOI:10.1038/nrmicro1968 |
| [9] | 朱冬青. A因子依赖蛋白AdpA对链霉菌形态分化和次生代谢的调节. 上海交通大学学位论文, 2008. https://d.wanfangdata.com.cn/thesis/ChJUaGVzaXNOZXdTMjAyMDEwMjgSB0Q0NTA1NTEaCDcyNG95dHdw |
| [10] | Willey JM, Willems A, Kodani S, Nodwell JR. Morphogenetic surfactants and their role in the formation of aerial hyphae in Streptomyces coelicolor. Molecular Microbiology, 2006, 59(3): 731-742. DOI:10.1111/j.1365-2958.2005.05018.x |
| [11] | 陶丽媛. 林可链霉菌NRRL 2936株bldA基因调控功能探究. 华东理工大学学位论文, 2018. http://cdmd.cnki.com.cn/article/cdmd-10251-1018211686.htm |
| [12] | Bush MJ, Chandra G, Findlay KC, et al. BldC delays nntry into development to produce a sustained period of vegetative growth in Streptomyces venezuelae. mBio, 2019, 10(1): 2812-2818. |
| [13] | Elliot Bibb MJ, Buttner MJ, Leskiw BK. bldD is a direct regulator of key developmental genes in Streptomyces coelicolor A3(2). Molecular Microbiology, 2001, 40(1): 257-269. DOI:10.1046/j.1365-2958.2001.02387.x |
| [14] | Kretschmer S, Schwille P. Toward spatially regulated division of protocells: insights into the E. coli Min system from in vitro studies. Life, 2014, 4(4): 915-928. DOI:10.3390/life4040915 |
| [15] | Dhaked HPS, Ray S, Battaje RR, Banerjee A, Panda D. Regulation of Streptococcus pneumoniae FtsZ assembly by divalent cations: paradoxical effects of Ca2+ on the nucleation and bundling of FtsZ polymers. The FEBS Journal, 2019, 286(18): 3629-3646. DOI:10.1111/febs.14928 |
| [16] | Godino E, López JN, Foschepoth D, Cleij C, Doerr A, Castellà CF, Danelon C. De novo synthesized Min proteins drive oscillatory liposome deformation and regulate FtsA-FtsZ cytoskeletal patterns. Nature Communications, 2019, 10: 4969. DOI:10.1038/s41467-019-12932-w |
| [17] | Santos-Beneit F, Roberts DM, Cantlay S, McCormick JR, Errington J. A mechanism for FtsZ-independent proliferation in Streptomyces. Nature Communications, 2017, 8: 1374. DOI:10.1038/s41467-017-01520-5 |
| [18] | Barrows JM, Sundararajan K, Bhargava A, Goley ED. FtsA regulates Z-ring morphology and cell wall metabolism in an FtsZ C-terminal linker-dependent manner in Caulobacter crescentus. Journal of Bacteriology, 2020, 202(7): e00693-19. |
| [19] | Yagüe P, Willemse J, Koning RI, Rioseras B, López-García MT, Gonzalez-Quiñonez N, Lopez-Iglesias C, Shliaha PV, Rogowska-Wrzesinska A, Koster AJ, Jensen ON, van Wezel GP, Manteca Á. Subcompartmentalization by cross-membranes during early growth of Streptomyces hyphae. Nature Communications, 2016, 7: 12467. DOI:10.1038/ncomms12467 |
| [20] | Yagüe P, Rodríguez-García A, López-García MT, Martín JF, Rioseras B, Sánchez J, Manteca A. Transcriptomic analysis of Streptomyces coelicolor differentiation in solid sporulating cultures: first compartmentalized and second multinucleated mycelia have different and distinctive transcriptomes. PLoS One, 2013, 8(3): e60665. DOI:10.1371/journal.pone.0060665 |
| [21] | Shin Y, Fu RQ, Qin HJ, Taylor J, Rajagopalan MR, Cross TA. Understanding the role of the N-terminal CrgA interactions with FtsZ in the Mycobacterium tuberculosis divisome. Biophysical Journal, 2017, 112(3): 501a. |
| [22] | Melzer ES, Sein CE, Chambers JJ, Siegrist MS. DivIVA concentrates mycobacterial cell envelope assembly for initiation and stabilization of polar growth. Cytoskeleton, 2018, 75(12): 498-507. DOI:10.1002/cm.21490 |
| [23] | Pickford H, Alcock E, Singh A, Kelemen G, Bhatt A. A mycobacterial DivIVA domain-containing protein involved in cell length and septation. Microbiology, 2020, 166(9): 817-825. DOI:10.1099/mic.0.000952 |
| [24] | Fuchino K, Bagchi S, Cantlay S, Sandblad L, Wu D, Bergman J, Kamali-Moghaddam M, Flärdh K, Ausmees N. Dynamic gradients of an intermediate filament-like cytoskeleton are recruited by a polarity landmark during apical growth. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(21): E1889-E1897. DOI:10.1073/pnas.1305358110 |
| [25] | Holmes NA, Walshaw J, Leggett RM, Thibessard A, Dalton KA, Gillespie MD, Hemmings AM, Gust B, Kelemen GH. Coiled-coil protein Scy is a key component of a multiprotein assembly controlling polarized growth in Streptomyces. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(5): E397-E406. DOI:10.1073/pnas.1210657110 |
| [26] | Jyothikumar V, Klanbut K, Tiong J, Roxburgh JS, Hunter IS, Smith TK, Herron PR. Cardiolipin synthase is required for Streptomyces coelicolor morphogenesis. Molecular Microbiology, 2012, 84(1): 181-197. DOI:10.1111/j.1365-2958.2012.08018.x |
| [27] | Ditkowski B, Holmes N, Rydzak J, Donczew M, Bezulska M, Ginda K, Kedzierski P, Zakrzewska-Czerwińska J, Kelemen GH, Jakimowicz D. Dynamic interplay of ParA with the polarity protein, Scy, coordinates the growth with chromosome segregation in Streptomyces coelicolor. Open Biology, 2013, 3(3): 130006. DOI:10.1098/rsob.130006 |
| [28] | Javadi A, Soderholm N, Olofsson A, Flardh K, Sandblad L. Assembly mechanisms of the bacterial cytoskeletal protein FilP. Life Science Alliance, 2019, 2(3): 15. |
| [29] | Frojd MJ, Flardh K. Apical assemblies of intermediate filament-like protein FilP are highly dynamic and affect polar growth determinant DivIVA in Streptomyces venezuelae. Molecular Microbiology, 2019, 112(1): 47-61. DOI:10.1111/mmi.14253 |
| [30] | Sharma K, Sultana T, Liao MM, Dahms TES, Dillon JAR. EF1025, a hypothetical protein from Enterococcus faecalis, interacts with DivIVA and affects cell length and cell shape. Frontiers in Microbiology, 2020, 11: 83. DOI:10.3389/fmicb.2020.00083 |
| [31] | Capstick DS, Willey JM, Buttner MJ, Elliot MA. SapB and the chaplins: connections between morphogenetic proteins in Streptomyces coelicolor. Molecular microbiology, 2007, 64(3): 602-613. DOI:10.1111/j.1365-2958.2007.05674.x |
| [32] | Kodani S, Hudson ME, Durrant MC, Buttner MJ, Nodwell JR, Willey JM. From the Cover: The SapB morphogen is a lantibiotic-like peptide derived from the product of the developmental gene ramS in Streptomyces coelicolor. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(31): 11448-11453. DOI:10.1073/pnas.0404220101 |
| [33] | Bignell DRD, Francis IM, Fyans JK, Loria R. Thaxtomin a production and virulence are controlled by several bld gene global regulators in Streptomyces Scabies. Molecular Plant-Microbe Interactions, 2014, 27(8): 875-885. DOI:10.1094/MPMI-02-14-0037-R |
| [34] | Gaskell AA, Giovinazzo JA, Fonte V, Willey JM. Multi-tier regulation of the Streptomycete morphogenetic peptide SapB. Molecular Microbiology, 2012, 84(3): 501-515. DOI:10.1111/j.1365-2958.2012.08041.x |
| [35] | Kang YJ, Wang YY, Hou BB, Wang RD, Ye J, Zhu XY, Wu HZ, Zhang HZ. AdpAlin, a pleiotropic transcriptional regulator, is involved in the cascade regulation of lincomycin biosynthesis in Streptomyces lincolnensis. Frontiers in Microbiology, 2019, 10: 2428. DOI:10.3389/fmicb.2019.02428 |
| [36] | de Jong W, Vijgenboom E, Dijkhuizen L, Wösten HAB, Claessen D. SapB and the rodlins are required for development of Streptomyces coelicolor in high osmolarity media. FEMS Microbiology Letters, 2012, 329(2): 154-159. DOI:10.1111/j.1574-6968.2012.02517.x |
| [37] | Claessen D, Stokroos I, Deelstra HJ, Penninga NA, Bormann C, Salas JA, Dijkhuizen L, Wösten HAB. The formation of the rodlet layer of Streptomycetes is the result of the interplay between rodlins and chaplins. Molecular Microbiology, 2004, 53(2): 433-443. DOI:10.1111/j.1365-2958.2004.04143.x |
| [38] |
Zhang GF, Liang DM, Qiao JJ, Caiyinqinggele. Research progress in Streptomyces transport system. Microbiology China, 2020, 47(11): 3689-3698.
(in Chinese) 张国锋, 梁冬梅, 乔建军, 财音青格乐. 链霉菌转运系统研究进展. 微生物学通报, 2020, 47(11): 3689-3698. |
| [39] | Noens EE, Mersinias V, Willemse J, Traag BA, Laing E, Chater KF, Smith CP, Koerten HK, van Wezel GP. Loss of the controlled localization of growth stage-specific cell-wall synthesis pleiotropically affects developmental gene expression in a ssgA mutant of Streptomyces coelicolor. Molecular Microbiology, 2007, 64(5): 1244-1259. DOI:10.1111/j.1365-2958.2007.05732.x |
| [40] | Willemse J, Borst JW, de Waal E, Bisseling T, van Wezel GP. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces. Genes & Development, 2011, 25(1): 89-99. |
| [41] | Zhang L, Willemse J, Claessen D, van Wezel GP. SepG coordinates sporulation-specific cell division and nucleoid organization in Streptomyces coelicolor. Open Biology, 2016, 6(4): 150164. DOI:10.1098/rsob.150164 |
| [42] | Merrick MJ. A morphological and genetic mapping study of bald colony mutants of Streptomyces coelicolor. Journal of General Microbiology, 1976, 96(2): 299-315. DOI:10.1099/00221287-96-2-299 |
| [43] |
Fan JY, Wang ED. Advance of mechanism of the regulator bldA in Streptomyces. Chinese Bulletin of Life Sciences, 2019, 31(6): 527-533.
(in Chinese) 范佳奕, 王恩多. 链霉菌调控因子bldA的作用机制研究进展. 生命科学, 2019, 31(6): 527-533. |
| [44] | Chater KF, Chandra G. The use of the rare UUA codon to define "expression space" for genes involved in secondary metabolism, development and environmental adaptation in Streptomyces. The Journal of Microbiology, 2008, 46(1): 1-11. DOI:10.1007/s12275-007-0233-1 |
| [45] | Higo A, Horinouchi S, Ohnishi Y. Strict regulation of morphological differentiation and secondary metabolism by a positive feedback loop between two global regulators AdpA and BldA in Streptomyces griseus. Molecular Microbiology, 2011, 81(6): 1607-1622. DOI:10.1111/j.1365-2958.2011.07795.x |
| [46] | Ferguson NL, Peña-Castillo L, Moore MA, Bignell DRD, Tahlan K. Proteomics analysis of global regulatory cascades involved in clavulanic acid production and morphological development in Streptomyces clavuligerus. Journal of Industrial Microbiology & Biotechnology, 2016, 43(4): 537-555. |
| [47] | Hou BB, Tao LY, Zhu XY, Wu W, Guo MJ, Ye J, Wu HZ, Zhang HZ. Global regulator BldA regulates morphological differentiation and lincomycin production in Streptomyces lincolnensis. Applied Microbiology and Biotechnology, 2018, 102(9): 4101-4115. DOI:10.1007/s00253-018-8900-1 |
| [48] | Pokhrel AR, Chaudhary AK, Nguyen HT, Dhakal D, Le TT, Shrestha A, Liou K, Sohng JK. Overexpression of a pathway specific negative regulator enhances production of daunorubicin in bldA deficient Streptomyces peucetius ATCC 27952. Microbiological Research, 2016, 192: 96-102. DOI:10.1016/j.micres.2016.06.009 |
| [49] | Kalan L, Gessner A, Thaker MN, Waglechner N, Zhu XM, Szawiola A, Bechthold A, Wright GD, Zechel DL. A cryptic polyene biosynthetic gene cluster in Streptomyces calvus is expressed upon complementation with a functional bldA gene. Chemistry & Biology, 2013, 20(10): 1214-1224. |
| [50] | Zschiedrich CP, Keidel V, Szurmant H. Molecular mechanisms of two-component signal transduction. Journal of Molecular Biology, 2016, 428(19): 3752-3775. DOI:10.1016/j.jmb.2016.08.003 |
| [51] | 刘萌. 天蓝色链霉菌中一对新的双组分信号转导系统MacRS调控机制的研究. 济南: 山东大学学位论文, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10422-1019067349.htm |
| [52] | 于晓秋. 天蓝色链霉菌双组分信号转导系统SCO2120/SCO2121的功能研究. 山东大学学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10422-1017278588.htm |
| [53] | McKenzie NL, Nodwell JR. Phosphorylated AbsA2 negatively regulates antibiotic production in Streptomyces coelicolor through interactions with pathway-specific regulatory gene promoters. Journal of Bacteriology, 2007, 189(14): 5284-5292. DOI:10.1128/JB.00305-07 |
| [54] | Santos-Beneit F, Rodríguez-García A, Sola-Landa A, Martín JF. Cross-talk between two global regulators in Streptomyces: PhoP and AfsR interact in the control of afsS, pstS and phoRP transcription. Molecular Microbiology, 2009, 72(1): 53-68. DOI:10.1111/j.1365-2958.2009.06624.x |
| [55] | Som NF, Heine D, Holmes N, Knowles F, Chandra G, Seipke RF, Hoskisson PA, Wilkinson B, Hutchings MI. The MtrAB two-component system controls antibiotic production in Streptomyces coelicolor A3(2). Microbiology: Reading, England, 2017, 163(10): 1415-1419. DOI:10.1099/mic.0.000524 |
| [56] | Chen SS, Zheng GS, Zhu H, He HQ, Chen L, Zhang WW, et al. Roles of two-component system AfsQ1/Q2 in regulating biosynthesis of the yellow-pigmented coelimycin P2 in Streptomyces coelicolor. FEMS Microbiology Letters, 2016, 363(15): 8. |
| [57] | Yu ZY, Zhu H, Dang FJ, Zhang WW, Qin ZJ, Yang S, Tan HR, Lu YH, Jiang WH. Differential regulation of antibiotic biosynthesis by DraR-K, a novel two-component system in Streptomyces coelicolor. Molecular Microbiology, 2012, 85(3): 535-556. DOI:10.1111/j.1365-2958.2012.08126.x |
| [58] | Arroyo-Pérez EE, González-Cerón G, Soberón-Chávez G, Georgellis D, Servín-González L. A novel two-component system, encoded by the sco5282/sco5283 genes, affects Streptomyces coelicolor morphology in liquid culture. Frontiers in Microbiology, 2019, 10: 1568. DOI:10.3389/fmicb.2019.01568 |
| [59] |
Liao GJ, Shen L, Hu CH. Streptomyces nucleoid-associated proteins: role in morphological differentiation and secondary metabolism. Acta Microbiologica Sinica, 2017, 57(5): 651-658.
(in Chinese) 廖国建, 沈兰, 胡昌华. 拟核结合蛋白调控链霉菌形态分化和次级代谢的作用和机制. 微生物学报, 2017, 57(5): 651-658. |
| [60] | Gehrke EJ, Zhang XF, Pimentel-Elardo SM, Johnson AR, Rees CA, Jones SE, et al. Silencing cryptic specialized metabolism in Streptomyces by the nucleoid-associated protein Lsr2. Elife, 2019, 8: 28. |
| [61] | Datta C, Jha RK, Ahmed W, Ganguly S, Ghosh S, Nagaraja V. Physical and functional interaction between nucleoid-associated proteins HU and Lsr2 of Mycobacterium tuberculosis: altered DNA binding and gene regulation. Molecular Microbiology, 2019, 111(4): 981-994. DOI:10.1111/mmi.14202 |
| [62] | Deng LN, Wang R, Wang GW, Liu MX, Liao GJ, Liao ZH, Chen M. Targeted isolation of sulfur-containing metabolites from Lsr2-deletion mutant strain of Streptomyces roseosporus. RSC Advances, 2017, 7(60): 37771-37777. DOI:10.1039/C7RA06482A |
| [63] |
Li XX. The activtion of silent gene clusters and products identification in Streptomyces Act12. Yangling, China: Northwest A & F University, 2017. (in Chinese) 李晓霞. 生防链霉菌Act12中沉默基因簇的激活与产物鉴定. 杨凌: 西北农林科技大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10712-1017102267.htm |
| [64] | Gatewood ML, Jones GH. (p)ppGpp inhibits polynucleotide phosphorylase from Streptomyces but not from Escherichia coli and increases the stability of bulk mRNA in Streptomyces coelicolor. Journal of Bacteriology, 2010, 192(17): 4275-80. DOI:10.1128/JB.00367-10 |
| [65] | Tesche S, Rösemeier-Scheumann R, Lohr J, René HK, Büchs J, Krull R. Salt-enhanced cultivation as a morphology engineering tool for filamentous actinomycetes: increased production of labyrinthopeptin A1 in Actinomadura namibiensis. Engineering in Life Sciences, 2019, 19(11): 781-794. DOI:10.1002/elsc.201900036 |
| [66] | Xia X, Lin SJ, Xia XX, Cong FS, Zhong JJ. Significance of agitation-induced shear stress on mycelium morphology and lavendamycin production by engineered Streptomyces flocculus. Applied Microbiology and Biotechnology, 2014, 98(10): 4399-4407. DOI:10.1007/s00253-014-5555-4 |
| [67] | Van Dissel D, Wezel GP. Morphology-driven downscaling of Streptomyces lividans to micro-cultivation. Antonie Van Leeuwenhoek, 2018, 111(3): 457-469. DOI:10.1007/s10482-017-0967-7 |
| [68] | Zhao YF, Lu DD, Bechthold A, Ma Z, Yu XP. Impact of otrA expression on morphological differentiation, actinorhodin production, and resistance to aminoglycosides in Streptomyces coelicolor M145. Journal of Zhejiang University-Science B, 2018, 19(9): 708-717. DOI:10.1631/jzus.B1800046 |
| [69] | Wu YT, Kang QJ, Zhang LL, Bai LQ. Subtilisin-involved morphology engineering for improved antibiotic production in Actinomycetes. Biomolecules, 2020, 10(6): 851. DOI:10.3390/biom10060851 |
| [70] | Koebsch I, Overbeck J, Piepmeyer S, Meschke H, Schrempf H. A molecular key for building hyphae aggregates: the role of the newly identified Streptomyces protein HyaS. Microbial Biotechnology, 2009, 2(3): 343-360. DOI:10.1111/j.1751-7915.2009.00093.x |
| [71] | Van Dissel D, Willemse J, Zacchetti B, Claessen D, Pier GB, van Wezel GP. Production of poly-β-1, 6-N-acetylglucosamine by MatAB is required for hyphal aggregation and hydrophilic surface adhesion by Streptomyces. Microbial Cell, 2018, 5(6): 269-279. DOI:10.15698/mic2018.06.635 |
| [72] | Böl M, Schrinner K, Tesche S, Krull R. Front cover: challenges of influencing cellular morphology by morphology engineering techniques and mechanical induced stress on filamentous pellet systems-a critical review. Engineering in Life Sciences, 2021, 21(45): 3-4. |
| [73] | Liu R, Deng ZX, Liu TG. Streptomyces species: ideal chassis for natural product discovery and overproduction. Metabolic Engineering, 2018, 50: 74-84. DOI:10.1016/j.ymben.2018.05.015 |
| [74] | Paradkar A. Clavulanic acid production by Streptomyces clavuligerus: biogenesis, regulation and strain improvement. Journal of Antibiotics, 2013, 66(7): 411-420. DOI:10.1038/ja.2013.26 |
 2021, Vol. 61
2021, Vol. 61