中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 胡平, 赵卓冉, 袁亚萍, 李莎莎, 景晓愿, 李钟杰. 2021
- Ping Hu, Zhuoran Zhao, Yaping Yuan, Shasha Li, Xiaoyuan Jing, Zhongjie Li. 2021
- 中药蛴螬多肽Probrelin抗白色念珠菌活性研究
- Activity of the antimicrobial peptide probrelin from traditional Chinese medicine grub against Candida albicans
- 微生物学报, 61(11): 3619-3630
- Acta Microbiologica Sinica, 61(11): 3619-3630
-
文章历史
- 收稿日期:2021-02-06
- 修回日期:2021-04-13
- 网络出版日期:2021-09-08
白色念珠菌作为人体正常菌群的成员,主要存在于人类皮肤、胃肠道、呼吸道和泌尿生殖道中,而在个体免疫力低下或者免疫缺陷时可引起阴道浅部感染以及口腔粘膜感染,在适当情况下也会进入血液系统而导致深层组织感染[1-2]。近年来,由于抗菌药物的大量及不规范使用,导致白色念珠菌耐药率逐年升高,而由耐药菌株引起的感染的治疗难度都大大增加[1-3]。因此,急需新型有效的抗白色念珠菌新药物分子。
抗微生物多肽为新型有效的抗白色念珠菌药物的研发提供了新的策略。作为新型抗菌药物候选分子中的明星分子,抗微生物多肽不仅具有广谱的抗微生物活性,对耐药菌株也有很好的抑制杀灭作用[4]。抗微生物多肽主要通过破坏细胞膜来抑制杀灭病原微生物,也可通过作用于多靶点的方式来抑制杀灭病原微生物,并能够抑制生物膜的形成或者破坏生物膜,还具有免疫调节作用,进而清除入侵病原微生物[5-8]。目前,有众多的抗微生物多肽药物处于临床研究阶段,并展现出良好的应用前景[9]。
我国的中药资源蕴含着巨量的药物活性分子,而其中的动物类药物是获得抗微生物多肽的良好资源。蛴螬,金龟甲总科幼虫的统称,中医多用于治疗疼痛、丹毒、疮疡、痔漏等症,现代研究表明,蛴螬具有抗肿瘤、抗氧化、抗病毒和抗菌作用[10-11]。在前期的研究中,我们对蛴螬物种白星花金龟(Protaetia brevitarsis Lewis)的转录组学进行了分析[12]。进一步通过与抗微生物多肽数据库对比,我们从中获得一条潜在的抗微生物多肽Probrelin (TRGVLQEFLKAVLR)。本研究中,针对抗微生物多肽Probrelin的抗白色念珠菌正常菌株及临床耐药菌株的最小抑菌浓度及最小杀真菌浓度进行测定,利用PI吸收实验观察其对白色念珠菌细胞膜完整性的影响,探究其对白色念珠菌生物膜形成及成熟生物膜的影响,并利用棋盘法探究其与抗真菌药物间的效应。通过本研究,旨在探究蛴螬抗微生物多肽Probrelin抗白色念珠菌的有效性,以期为抗白色念珠菌药物的研发及治疗提供新的解决思路。
1 材料和方法 1.1 材料白色念珠菌(Candida albicans) AY93025购买于中国典型培养物保藏中心,白色念珠菌临床耐药菌株CR-1、CR-2、CR-3、CR-4及CR-5为本实验保藏菌种。蛴螬多肽Probrelin (氨基酸序列:TRGVLQEFLKAVLR;纯度:> 95%;修饰:C端酰胺化)由上海吉尔生化有限公司合成。酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD)购买于青岛海博生物技术有限公司,结晶紫、碘化丙啶(propidium iodide,PI)及2.5%电镜固定液购买于北京索莱宝科技有限公司,96孔细胞培养板及细菌培养平皿购买于耐思生物科技有限公司。抗生素Clotrimazole、Amphotericin B、Nystatin及Anidulafungin购买于上海源叶生物科技有限公司。
1.2 最小抑菌浓度及最小杀真菌浓度检测多肽对白色念珠菌的抑制活性参照临床和实验室标准协会(CLSI)的标准采取微量稀释法进行检测[13]。将冻存于–80 ℃的白色念珠菌接种于YPD培养基,置于35 ℃培养摇床250 r/min的摇速下培养至对数生长期。用培养基将菌浓度调至103–104 CFU/mL,并将多肽用无菌的生理盐水等梯度稀释。在无菌的96孔培养板中,每孔加入80 μL上述稀释的菌液和20 μL上述稀释的多肽溶液,每个多肽浓度设置3个平行。将96孔培养板置于摇床中培养24 h,将不能观察到菌生长的多肽浓度定义为最小抑菌浓度(minimum inhibitory concentration,MIC)。同时,从菌不能生长的多肽浓度孔取样涂布YPD平板,35 ℃培养箱培养24 h,统计菌落数,将菌落数低于初始菌落数0.1%的多肽浓度定义为多肽的最小杀真菌浓度(minimum fungicidal concentration,MFC)。
1.3 杀菌动力学检测将白色念珠菌AY93025培养至对数生长期,用培养基将菌浓度调至104–106 CFU/mL。将稀释好的菌液与多肽孵育,使得多肽的终浓度分别为1、2、4 MIC,并以生理盐水为阴性对照。分别在时间点0、0.25、0.50、1.00 h取样,梯度稀释后涂布平板。将平板置于35 ℃培养箱培养24 h,统计菌落数,绘制杀菌动力学曲线。
1.4 PI吸收实验将白色念珠菌AY93025培养至对数生长期,用培养基将菌浓度调至1×105–5×105 CFU/mL。将稀释好的菌液与多肽孵育,使得多肽的终浓度分别为1/2、1、2 MIC,并以生理盐水为阴性对照,同时加入PI (终浓度为5 μg/mL),35 ℃避光孵育0.5 h。用PBS洗涤细胞并重悬,利用荧光显微镜观察,统计并计算荧光阳性细胞比例。
1.5 核酸阻滞实验将不同浓度多肽分别与300 ng质粒pET-28a的环状及线状(经EcoR I及Xho Ⅰ双酶切)、单链DNA (鲑鱼精子DNA,索莱宝)在超纯水中混合均匀,使得多肽与质粒的质量比分别为40:1、20:1、10:1、5:1,同时以单质粒为对照。混合体系在室温条件下孵育30 min,1.5%琼脂糖凝胶电泳,检测核酸迁移阻滞情况。
1.6 扫描电子显微镜检测将白色念珠菌AY93025培养至对数生长期,35 ℃条件下与多肽孵育30 min,多肽的终浓度4 MIC,并以生理盐水为阴性对照。离心收集菌体并用PBS洗涤,菌体用2.5%的电镜固定液进行固定,然后用酒精系列脱水干燥,用扫描电镜(JSM-6390LV)进行观察。
1.7 体外生物膜检测将白色念珠菌AY93025培养至对数生长期,用培养基将菌浓度调至1×106–5×106 CFU/mL,取100 μL稀释好的菌液加入无菌的96孔培养板中,35 ℃静置培养4 h (生物膜早期形成)或者24 h (成熟生物膜)。去除培养基并用PBS洗去游离的菌体,加入含有多肽的新培养基,同时以不含多肽为对照组,35 ℃静置培养24 h。去除培养基并用PBS洗去游离的菌体,加入0.1%的结晶紫溶液染色10 min。去除染液并用无菌水洗去多余的染液,每孔加入150 μL的33%乙酸,室温孵育30 min后每孔取出100 μL于新的96孔板中,酶标仪测492 nm光吸收值,计算生物膜形成抑制率(生物膜早期形成)或清除率(成熟生物膜)。
1.8 菌丝形成实验将白色念珠菌AY93025培养至对数生长期,用PBS洗涤,再用含有10%胎牛血清的RPMI 1640培养基重悬并调菌浓度至105–106 CFU/mL,37 ℃条件下与多肽孵育4 h,多肽的终浓度1/2 MIC,并以生理盐水为阴性对照。利用显微镜进行拍摄,观察白色念珠菌菌丝形成情况。
1.9 协同效应检测利用棋盘法检测多肽与抗真菌药物间的抗白色念珠菌AY93025效应。将多肽用含有抗生素的生理盐进行梯度稀释,检测混合体系下多肽的MIC (cMIC),其中抗生素的最终浓度为1/4 MIC,计算部分抑菌浓度指数(the fractional inhibitory concentration index,FICI)。FICI的计算公式为:FICI=cMICA/MICA+cMICB/MICB。FICI≤0.5为协同,0.5 < FICI < 4为无作用,FICI > 4为拮抗[14]。
1.10 小鼠皮下感染模型为了评估多肽在体内的抗白色念珠菌活性,构建了小鼠皮下感染模型[15]。雄性Balb/c小鼠(SPF,20–25 g),每组6只。小鼠剔除背部毛并用75%酒精消毒处理,然后每只小鼠注射50 μL经生理盐洗涤并重悬的对数生长期的白色念珠菌AY93025 (107 CFU/mL)。感染1 h后分别在感染部位皮下注射50 μL的生理盐(阴性对照组)及多肽(0.5 mg/mL)。每24小时给药1次,连续给药3 d。第4天取感染部位皮肤组织,经匀浆及梯度稀释后涂布平板,计算组织菌载量。
2 结果和分析 2.1 活性检测利用肉汤稀释法测定蛴螬多肽Probrelin对白色念珠菌正常菌株及临床耐药菌株的最小抑制浓度,结果如表 1所示。蛴螬多肽Probrelin对白色念珠菌AY93025及临床耐药菌株CR的MIC均为100 μg/mL,MFC为100–200 μg/mL。这些结果表明,蛴螬多肽Probrelin对白色念珠菌敏感菌株及其临床耐药菌株均具有抑制杀灭活性。
| Strains | MIC/(μg/mL) | MFC/(μg/mL) |
| Candida albicans AY93025 | 100 | 200 |
| Candida albicans clinical resistant strain CR-1 | 100 | 200 |
| Candida albicans clinical resistant strain CR-2 | 100 | 100 |
| Candida albicans clinical resistant strain CR-3 | 100 | 100 |
| Candida albicans clinical resistant strain CR-4 | 100 | 100 |
| Candida albicans clinical resistant strain CR-5 | 100 | 100 |
| MIC: minimum inhibitory concentrations; MFC: minimum fungicidal concentrations. | ||
2.2 杀菌动力学
为了探究蛴螬多肽Probrelin的杀菌模式,选择白色念珠菌AY93025为模式菌株,对其进行杀菌动力学检测。通过图 1可以看出,经1 MIC蛴螬多肽Probrelin处理1 h,白色念珠菌的菌落数只有轻微的下降;经2 MIC蛴螬多肽Probrelin处理0.5 h,白色念珠菌的菌落数下降约一个数量级;而经4 MIC蛴螬多肽Probrelin处理0.5 h,白色念珠菌的菌落数下降约两个数量级。从图 1中同样可以看出,蛴螬多肽Probrelin对白色念珠菌的杀菌模式具有时间和浓度依赖性。
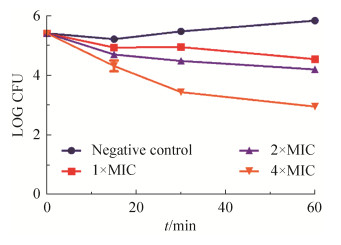
|
| 图 1 蛴螬多肽Probrelin对白色念珠菌AY93025的杀菌动力学 Figure 1 Time-killing kinetics of probrelin against C. albicans AY93025. Negative control: saline; MIC: minimum inhibitory concentrations; LOG CFU: log10 (CFU/mL). |
2.3 PI吸收检测
为了探究蛴螬多肽Probrelin是否会破坏细胞膜,白色念珠菌AY93025经多肽处理并进行PI染色。通过图 2及图 3可以看出,与对照组相比,随着多肽浓度的升高,荧光阳性细胞数逐渐增多。1/2 MIC多肽浓度处理组荧光阳性细胞数占比仅为0.88%,1 MIC多肽浓度处理组荧光阳性细胞数占比为10.08%,2 MIC多肽浓度处理组荧光阳性细胞数占比为28.19%。这些结果说明,随着多肽作用浓度的提升,对白色念珠菌细胞膜的破坏度逐渐增加。从这些结果中还可看出,蛴螬多肽Probrelin除了作用于白色念珠菌细胞膜外,还有可能作用于其他靶标,而且随着作用浓度的升高,逐渐以作用细胞膜的方式影响白色念珠菌细胞。
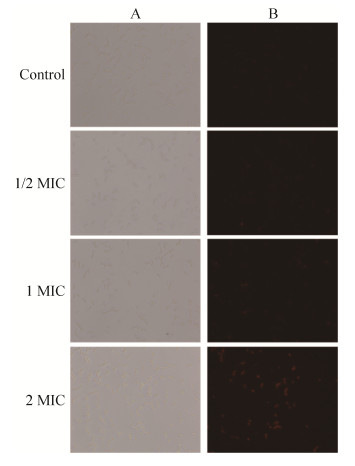
|
| 图 2 PI吸收检测 Figure 2 PI absorption test. A: normal image; B: fluorescence image; Control: saline; MIC: minimum inhibitory concentrations. |
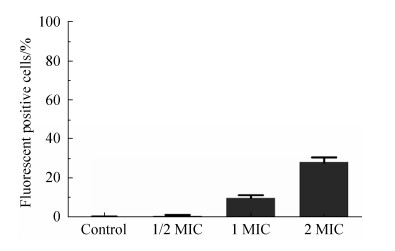
|
| 图 3 PI吸收实验荧光阳性细胞数占比 Figure 3 Percentage of fluorescent positive cells in PI absorption test. MIC: minimum inhibitory concentrations. |
2.4 核酸阻滞实验
通过核酸阻滞实验探究蛴螬多肽Probrelin是否会与核酸间有直接的相互作用,进而影响白色念珠菌的生理活动。通过图 4可以看出,与蛴螬多肽Probrelin孵育后,质粒DNA pET-28a、质粒DNA pET-28a双酶切片段及鲑鱼精子DNA在核酸凝胶电泳中的迁移情况都没有受到阻滞影响,说明蛴螬多肽Probrelin与DNA没有直接的相互作用。
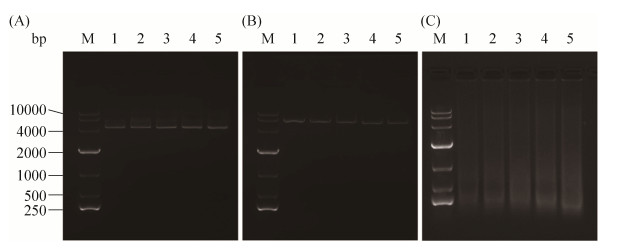
|
| 图 4 蛴螬多肽Probrelin对核酸的影响 Figure 4 Effects of the peptide Probrelin on nucleic acid. A: plasmid pET-28a; B: plasmid pET-28a digested by EcoR I and Xho I; C: sperm DNA from salmon. M: marker. Rate of peptide/nucleic acid: line 1 for 0:1, line 2 for 5:1, line 3 for 10:1, line 4 for 20:1, line 5 for 40:1. |
2.5 扫描电子显微镜检测
扫描电子显微镜用来检测蛴螬多肽Probrelin对白色念珠菌形态结构的影响。如图 5所示,未经蛴螬多肽Probrelin处理(negative control)的白色念珠菌具有光滑的形态,而经蛴螬多肽Probrelin处理(4 MIC) 30 min的白色念珠菌其形态结构发生显著变化,其表面上具有不规则的卷曲结构,说明该多肽可能影响了其细胞壁。

|
| 图 5 扫描电子显微镜检测蛴螬多肽Probrelin对白色念珠菌形态的影响 Figure 5 Scanning electron microscopy micrographs of the untreated (negative control) and 30 min probrelin (4 MIC) treated C. albicans cells. |
2.6 体外生物膜检测
生物膜在白色念珠菌的感染过程中发挥着重要作用,同时也影响白色念珠菌感染的治疗效果。通过图 6-A可以看出,蛴螬多肽Probrelin可以有效抑制白色念珠菌生物膜的形成,且具有浓度依赖性,在MIC浓度下的抑制率为59.49%,在2 MIC浓度下的抑制率为89.91%。通过图 6-B可以看出,蛴螬多肽Probrelin可以有效清除白色念珠菌生物膜,且同样具有浓度依赖性,在MIC浓度下的清除率为60%,在2 MIC浓度下的清除率为82.34%。
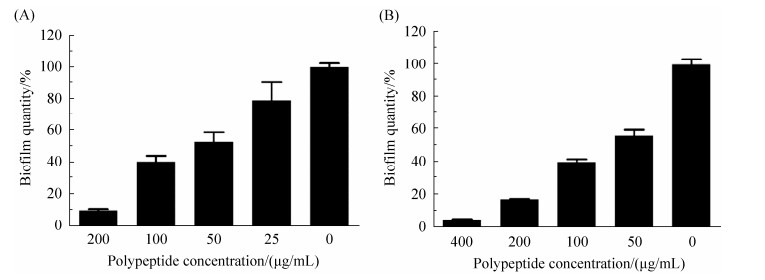
|
| 图 6 蛴螬多肽Probrelin对白色念珠菌生物膜的影响 Figure 6 Effects of the peptide probrelin on biofilm of C. albicans. A: formation of biofilm; B: mature biofilm. |
2.7 菌丝形成实验
为了研究蛴螬多肽Probrelin对白色念珠菌形态转变的影响,用含有10%胎牛血清的RPMI 1640培养基对白色念珠菌进行培养。如图 7所示,经过蛴螬多肽Probrelin (1/2 MIC)处理4 h后,与非处理组(negative control)相比,白色念珠菌的菌丝形成情况受到显著影响,说明蛴螬多肽Probrelin抑制了白色念珠菌形态的改变。

|
| 图 7 蛴螬多肽Probrelin对白色念珠菌菌丝形成的影响 Figure 7 Effects of the peptide probrelin on yeast-to-hypha transition of C. albicans treated without (negative control) or with probrelin (1/2 MIC) for 4 h. |
2.8 协同效应检测
联合用药是提高治疗效果以及应对耐药菌感染的有效策略,为探究蛴螬多肽Probrelin与抗真菌药物间在抗白色念珠菌上是否具有联合用药的前景,通过棋盘法检测蛴螬多肽Probrelin与Clotrimazole、Amphotericin B、Nystatin及Anidulafungin间的效应。通过表 2可以看出,蛴螬多肽Probrelin与Clotrimazole间的FICI值为0.5,具有协同效应;蛴螬多肽Probrelin与Amphotericin B、Nystatin及Anidulafungin间的FICI值分别为0.75、1.25及1.25,说明既不具有协同效用,也不具有拮抗效应。
| Parameters | Clotrimazole | Amphotericin B | Nystatin | Anidulafugin |
| MIC/(μg/mL) | 10 | 5 | 5 | 0.01 |
| FICI | 0.50 | 0.75 | 1.25 | 1.25 |
2.9 小鼠体内活性研究
为了研究蛴螬多肽Probrelin的治疗效果,构建了小鼠背部皮肤的皮下白色念珠菌感染模型。如图 8所示,与对照组小鼠相比,经蛴螬多肽Probrelin治疗的小鼠其病变脓包的形成受到明显抑制(图 8-A,图 8-B)。同时,与对照组相比,蛴螬多肽Probrelin可以有效清除感染部位的菌载量(图 8-C,P < 0.01)。因此,在生理条件下,蛴螬多肽Probrelin依然具有良好的抗白色念珠菌活性。

|
| 图 8 蛴螬多肽Probrelin的体内抗白色念珠菌活性 Figure 8 In vivo activity of probrelin against C. albicans in a mouse subcutaneous infection model. A: pustule from negative control group; B: pustule from probrelin treatment group; C: fungal burden (P < 0.01). |
3 讨论
作为第四大最常见的血液感染类型,由白色念珠菌引起的系统性感染造成约40%的死亡率,且其感染率和死亡率都在升高[1-2]。抗真菌药物的临床应用,虽然有效地控制了白色念珠菌的感染,但由于长期用药以及不规范用药等原因,导致耐药菌株的出现[16-17]。抗微生物多肽作为一类具有良好开发应用前景的抗菌药物候选分子,不仅能有效抑制成杀灭正常菌株,还能有效抑制成杀灭耐药菌株,如多肽ZY13[18]。在本研究中,我们探究了蛴螬多肽Probrelin的抗白色念珠菌活性。研究结果表明,蛴螬多肽Probrelin对正常菌株及临床耐药菌株均具有良好的抑制杀灭作用(表 1)。杀菌动力学实验进一步验证了蛴螬多肽Probrelin对白色念珠菌具有良好的抑制成杀灭作用,且其抑制成杀灭活性具有浓度和时间依赖性(图 1)。
对于抗微生物多肽来说,大多通过作用于细胞膜来行使作用[5, 19]。如抗白色念珠菌多肽AMP-17[20]、Ctn[14-33]和P7[22]。PI吸收实验表明,蛴螬多肽Probrelin在低浓度下对白色念珠菌细胞膜的完整性影响较小,但在高浓度下对细胞膜的破坏能力增加(图 2,图 3),说明蛴螬多肽Probrelin在低浓度和高浓度下对白色念珠菌的作用方式不同,这种作用方式非常类似于抗微生物多肽Buforin Ⅱ[23]及Hp1404[24]。由此我们推断,蛴螬多肽Probrelin在低浓度下除了作用于细胞膜,还可能与白色念珠菌胞外的相关靶点相互作用,进而抑制其生长增殖,而在高浓度下既可通过破坏细
胞膜来杀灭白色念珠菌,又可能进入胞内与相关靶点相互作用来抑制或杀灭白色念珠菌。对于抗微生物多肽来说,大多具有正电荷特性,当其通过破坏细胞膜的完整性进入细胞内部后,可以通过静电作用非特异性地与核酸结合,进而干扰核酸相关的生理过程,如抗微生物多肽APP[25]和P7[22]。本研究中,通过核酸阻滞实验表明,蛴螬多肽Probrelin与核酸之间不存在基于静电作用的非特异性相互作用(图 4),说明其细胞膜之外的靶标不是核酸,具体作用于胞内何种靶标,需要后期进行更加深入的研究。为了进一步探究蛴螬多肽Probrelin,本研究通过扫描电子显微镜对经多肽处理与非处理白色念珠菌的形态结构进行观察,结果表明,蛴螬多肽Probrelin还可以通过破坏细胞壁影响白色念珠菌的形态结构(图 5)。
对于白色念珠菌来说,其引起的大多数疾病与其在宿主或非生物表面上形成的生物膜有关。生物膜可以为白色念珠菌提供稳定的环境,并使白色念珠菌可以耐受极高浓度的抗菌剂[26-27]。除此之外,从生物膜释放的白色念珠菌细胞可以迁移到血液中并导致高死亡率的系统性感染[28]。因此,抑制生物膜的生成或者破坏生物膜可提高抗白色念珠菌感染的有效性。多种抗微生物多肽被证明可作用于白色念珠菌的生物膜,如polybia-MPI[29]、Ctn[14-33]和dermaseptin-S1[29]。本研究的结果表明,蛴螬多肽Probrelin既可以抑制白色念珠菌生物膜的生成,又可以破坏已生成的生物膜(图 6)。形态转变即菌丝形成在白色念珠菌生物膜形成过程中发挥着重要作用,并与白色念珠菌的侵入性感染密切相关[31]。研究结果表明,蛴螬多肽Probrelin可以有效抑制白色念珠菌菌丝的形成(图 7),说明其可通过抑制白色念珠菌形态的转变来抑制生物膜的形成,并能阻断其侵入性感染。因此,在生物膜及侵入性层面上,蛴螬多肽Probrelin可以用于白色念珠菌相关感染的治疗。
此外,由于耐受性或耐药性,导致抗生素治疗对白色念珠菌引起的感染难以起效,而联合用药是一个有效的抗白色念珠菌策略[32]。本研究中所选取的抗真菌药物Clotrimazole (抑制细胞膜合成)及Anidulafungin (抑制细胞壁合成)属于抑菌药物,Amphotericin B及Nystatin属于杀菌药物(破坏细胞膜完整性)[33]。对于抗菌药物来说,相同靶点的药物间会存在拮抗作用,而不同靶点的药物间会存在协同效应。我们的研究结果显示,蛴螬多肽Probrelin体现出以破坏细胞膜为主兼具非破坏细胞膜的作用方式(图 2,图 3)。因此推断,蛴螬多肽Probrelin与Clotrimazole及Anidulafungin可能会存在协同效应,而与Amphotericin B及Nystatin不一定会存在拮抗作用。我们的研究结果证实了这种推断,即蛴螬多肽Probrelin与抗真菌药物Clotrimazole间展现出协同作用,但与Anidulafungin间既不具有协同也不具有拮抗效应,与Amphotericin B及Nystatin间不存在拮抗及协同效应(表 2)。至于蛴螬多肽Probrelin与Clotrimazole及Anidulafungin间所展现的两种不同效应,则可能与蛴螬多肽Probrelin影响白色念珠菌细胞壁结构有关(图 5)。因此,蛴螬多肽Probrelin与抗真菌药物Clotrimazole的联合用药,可作为解决白色念珠菌相关感染的有效策略之一。
白色念珠菌是常见的引起皮肤和黏膜感染的病原真菌[34],本研究中,我们通过构建小鼠的皮下感染模型来评估蛴螬多肽Probrelin能否用于治疗白色念珠菌引起的皮肤感染。结果表明,蛴螬多肽Probrelin可以有效地清除入侵的白色念珠菌,进而阻断白色念珠菌的感染(图 8)。因此,蛴螬多肽Probrelin可被开发用于防治白色念珠菌引起的相关皮肤感染。
综上结果表明,蛴螬多肽Probrelin对白色念珠菌正常菌株及临床耐药菌株均具有良好的抑制作用,对白色念珠菌的抑制或杀灭作用具有浓度和时间依赖性,且在低作用浓度下对白色念珠菌细胞膜的破坏能力非常弱,而在高作用浓度下则可以破坏白色念珠菌细胞膜的完整性。蛴螬多肽Probrelin还可以抑制白色念珠菌生物膜的形成以及破坏生物膜,并与抗真菌药物Clotrimazole间具有协同作用。因此,蛴螬多肽Probrelin可作为新的药物分子或模板分子用于抗白色念珠菌药物的研发。
| [1] | Dadar M, Tiwari R, Karthik K, Chakraborty S, Shahali Y, Dhama K. Candida albicans-Biology, molecular characterization, pathogenicity, and advances in diagnosis and control-An update. Microbial Pathogenesis, 2018, 117: 128-138. DOI:10.1016/j.micpath.2018.02.028 |
| [2] | Costa-De-oliveira S, Rodrigues AG. Candida albicans antifungal resistance and tolerance in bloodstream infections: the triad yeast-host-antifungal. Microorganisms, 2020, 8(2): 154. DOI:10.3390/microorganisms8020154 |
| [3] |
Wan JF, Tang CP, Shen ZB, Jiang T. Research status of natural compounds combine with antifungal agents against drug-resistent Candida albicans. China Journal of Chinese Materia Medica, 2014, 39(1): 28-33.
(in Chinese) 万江帆, 唐春萍, 沈志滨, 江涛. 中药单体联用抗真菌药物抗耐药白色念珠菌的研究现状. 中国中药杂志, 2014, 39(1): 28-33. |
| [4] | Jenssen H, Hamill P, Hancock REW. Peptide antimicrobial agents. Clinical Microbiology Reviews, 2006, 19(3): 491-511. DOI:10.1128/CMR.00056-05 |
| [5] | Nguyen LT, Haney EF, Vogel HJ. The expanding scope of antimicrobial peptide structures and their modes of action. Trends in Biotechnology, 2011, 29(9): 464-472. DOI:10.1016/j.tibtech.2011.05.001 |
| [6] | Mahlapuu M, Håkansson J, Ringstad L, Björn C. Antimicrobial peptides: an emerging category of therapeutic agents. Frontiers in Cellular and Infection Microbiology, 2016, 6: 194. |
| [7] | Hancock RE. Cationic peptides: effectors in innate immunity and novel antimicrobials. The Lancet Infectious Diseases, 2001, 1(3): 156-164. DOI:10.1016/S1473-3099(01)00092-5 |
| [8] | Chung PY, Khanum R. Antimicrobial peptides as potential anti-biofilm agents against multidrug-resistant bacteria. Journal of Microbiology, Immunology and Infection, 2017, 50(4): 405-410. DOI:10.1016/j.jmii.2016.12.005 |
| [9] | Fox JL. Antimicrobial peptides stage a comeback. Nature Biotechnology, 2013, 31(5): 379-382. DOI:10.1038/nbt.2572 |
| [10] |
Zhao Y, Li ZG, Wang LH, Sun YT, Zhao L, Zan K. Quality standard and research progress of traditional Chinese medicine Holotrichia diomphalia larvae. Chinese Journal of Drug Evaluation, 2020, 37(4): 257-261, 281.
(in Chinese) 赵艳, 李正刚, 王路宏, 孙艳涛, 赵磊, 昝珂. 中药蛴螬的质量标准及研究进展. 中国药物评价, 2020, 37(4): 257-261, 281. DOI:10.3969/j.issn.2095-3593.2020.04.004 |
| [11] |
Wang C, Yu YG, Zhang Q, Yu XX, Liang ZM. Preparation and stability studies of grub antimicrobial peptides. Guangdong Agricultural Sciences, 2018, 45(2): 116-122.
(in Chinese) 王成, 余以刚, 张青, 余祥雄, 梁泽明. 蛴螬抗菌肽的制备及其稳定性研究. 广东农业科学, 2018, 45(2): 116-122. |
| [12] | Li ZJ, Meng MM, Li SS, Deng B. The transcriptome analysis of Protaetia brevitarsis Lewis larvae. PLoS ONE, 2019, 14(3): e0214001. DOI:10.1371/journal.pone.0214001 |
| [13] | Guilhelmelli F, Vilela N, Smidt KS, de Oliveira MA, da Cunha Morales Álvares A, Rigonatto MC, da Silva Costa PH, Tavares AH, de Freitas SM, Nicola AM, Franco OL, Derengowski LD, Schwartz EF, Mortari MR, Bocca AL, Albuquerque P, Silva-Pereira I. Activity of scorpion venom-derived antifungal peptides against planktonic cells of Candida spp. and Cryptococcus neoformans and Candida albicans biofilms.. Frontiers in Microbiology, 2016, 7: 1844. |
| [14] | Cassone M, Otvos Jr L. Synergy among antibacterial peptides and between peptides and small-molecule antibiotics. Expert Review of Anti-Infective Therapy, 2010, 8(6): 703-716. DOI:10.1586/eri.10.38 |
| [15] | Youn C, Archer NK, Miller LS. Research techniques made simple: mouse bacterial skin infection models for immunity research. Journal of Investigative Dermatology, 2020, 140(8): 1488-1497. DOI:10.1016/j.jid.2020.04.012 |
| [16] | Brion LP, Uko SE, Goldman DL. Risk of resistance associated with fluconazole prophylaxis: Systematic review. Journal of Infection, 2007, 54(6): 521-529. DOI:10.1016/j.jinf.2006.11.017 |
| [17] | Liu SY, Hou YL, Chen X, Gao Y, Li H, Sun SJ. Combination of fluconazole with non-antifungal agents: a promising approach to cope with resistant Candida albicans infections and insight into new antifungal agent discovery. International Journal of Antimicrobial Agents, 2014, 43(5): 395-402. DOI:10.1016/j.ijantimicag.2013.12.009 |
| [18] | Jin L, Bai X, Luan N, Yao H, Zhang Z, Liu W, et al. A designed tryptophan- and lysine/arginine-rich antimicrobial peptide with therapeutic potential for clinical antibiotic-resistant Candida albicans vaginitis. Journal of Medicinal Chemistry, 2016, 59(5): 1791-1799. DOI:10.1021/acs.jmedchem.5b01264 |
| [19] | Fjell CD, Hiss JA, Hancock REW, Schneider G. Designing antimicrobial peptides: form follows function. Nature Reviews Drug Discovery, 2012, 11(1): 37-51. DOI:10.1038/nrd3591 |
| [20] | Ma HL, Zhao XY, Yang LB, Su PP, Fu P, Peng J, Yang N, Guo G. Antimicrobial peptide AMP-17 affects Candida albicans by disrupting its cell wall and cell membrane integrity. Infection and Drug Resistance, 2020, 13: 2509-2520. DOI:10.2147/IDR.S250278 |
| [21] | de Aguiar FLL, Santos NC, de Paula Cavalcante CS, Andreu D, Baptista GR, Gonçalves S. Antibiofilm activity on Candida albicans and mechanism of action on biomembrane models of the antimicrobial peptide ctn[15-34]. International Journal of Molecular Sciences, 2020, 21(21): 8339. DOI:10.3390/ijms21218339 |
| [22] | Li LR, Song FX, Sun J, Tian X, Xia SF, Le GW. Membrane damage as first and DNA as the secondary target for anti-candidal activity of antimicrobial peptide P7 derived from cell-penetrating peptide ppTG20 against Candida albicans. Journal of Peptide Science, 2016, 22(6): 427-433. DOI:10.1002/psc.2886 |
| [23] | Park CB, Kim HS, Kim SC. Mechanism of action of the antimicrobial peptide buforin Ⅱ: buforin Ⅱ kills microorganisms by penetrating the cell membrane and inhibiting cellular functions. Biochemical and Biophysical Research Communications, 1998, 244(1): 253-257. DOI:10.1006/bbrc.1998.8159 |
| [24] | Li ZJ, Xu XB, Meng LX, Zhang Q, Cao LY, Li WX, Wu YL, Cao ZJ. Hp1404, a new antimicrobial peptide from the scorpion Heterometrus petersii. PLoS ONE, 2014, 9(5): e97539. DOI:10.1371/journal.pone.0097539 |
| [25] | Li LR, Sun J, Xia SF, Tian X, Cheserek MJ, Le GW. Mechanism of antifungal activity of antimicrobial peptide APP, a cell-penetrating peptide derivative, against Candida albicans: intracellular DNA binding and cell cycle arrest. Applied Microbiology and Biotechnology, 2016, 100(7): 3245-3253. DOI:10.1007/s00253-015-7265-y |
| [26] | Tsui C, Kong EF, Jabra-Rizk MA. Pathogenesis of Candida albicans biofilm. Pathogens and Disease, 2016, 74(4): ftw018. DOI:10.1093/femspd/ftw018 |
| [27] | Mathé L, Van Dijck P. Recent insights into Candida albicans biofilm resistance mechanisms. Current Genetics, 2013, 59(4): 251-264. DOI:10.1007/s00294-013-0400-3 |
| [28] | Finkel JS, Mitchell AP. Genetic control of Candida albicans biofilm development. Nature Reviews Microbiology, 2011, 9(2): 109-118. DOI:10.1038/nrmicro2475 |
| [29] | Wang KR, Yan JX, Dang W, Xie JQ, Yan B, Yan WJ, Sun MY, Zhang BZ, Ma MX, Zhao YY, Jia FJ, Zhu RR, Chen W, Wang R. Dual antifungal properties of cationic antimicrobial peptides polybia-MPI: Membrane integrity disruption and inhibition of biofilm formation. Peptides, 2014, 56: 22-29. DOI:10.1016/j.peptides.2014.03.005 |
| [30] | Belmadani A, Semlali A, Rouabhia M. Dermaseptin-S1 decreases Candida albicans growth, biofilm formation and the expression of hyphal wall protein 1 and aspartic protease genes. Journal of Applied Microbiology, 2018, 125(1): 72-83. DOI:10.1111/jam.13745 |
| [31] | Pereira R, dos Santos Fontenelle RO, de Brito EHS, de Morais SM. Biofilm of Candida albicans: formation, regulation and resistance. Journal of Applied Microbiology, 2021, 131(1): 11-22. DOI:10.1111/jam.14949 |
| [32] | Spitzer M, Robbins N, Wright GD. Combinatorial strategies for combating invasive fungal infections. Virulence, 2017, 8(2): 169-185. DOI:10.1080/21505594.2016.1196300 |
| [33] |
Wang AP, Wang RJ, Li RY. New progress of antifungal agents. Dermatology Bulletin, 2017, 34(5): 540-550, 4.
(in Chinese) 王爱平, 王若珺, 李若瑜. 抗真菌药物新进展. 皮肤科学通报, 2017, 34(5): 540-550, 4. |
| [34] | Fang JY, Tang KW, Yang SH, Alalaiwe A, Yang YC, Tseng CH, Yang SC. Synthetic naphthofuranquinone derivatives are effective in eliminating drug-resistant Candida albicans in hyphal, biofilm, and intracellular forms: an application for skin-infection treatment. Frontiers in Microbiology, 2020, 11: 2053. DOI:10.3389/fmicb.2020.02053 |
 2021, Vol. 61
2021, Vol. 61




