中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 曹晶晶, 熊悯梓, 钞亚鹏, 赵盼, 汪志琴, 仲乃琴. 2021
- Jingjing Cao, Minzi Xiong, Yapeng Chao, Pan Zhao, Zhiqin Wang, Naiqin Zhong. 2021
- 极耐盐碱固氮菌的分离鉴定及固氮特性研究
- Isolation and identification of extremely salt-tolerant azotobacter and its nitrogen-fixing characteristics
- 微生物学报, 61(11): 3483-3495
- Acta Microbiologica Sinica, 61(11): 3483-3495
-
文章历史
- 收稿日期:2021-01-24
- 修回日期:2021-03-17
- 网络出版日期:2021-04-09
2. 中国科学院微生物研究所, 北京 100101;
3. 内蒙古自治区马铃薯肥料农药高效利用技术企业重点实验室, 内蒙古 呼伦贝尔 021000;
4. 中国科学院农业微生物先进技术工程实验室, 北京 100101
2. Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
3. The Enterprise Key Laboratory of Advanced Technology for Potato Fertilizer and Pesticide, Hulunbuir 021000, Inner Mongolia Autonomous Region, China;
4. Engineering Laboratory for Advanced Microbial Technology of Agriculture, Chinese Academy of Sciences, Beijing 100101, China
氮素是植物生长过程中最关键的营养元素,是氨基酸、蛋白质的重要组成成分。土壤中可利用的氮素十分有限,不能最大限度满足作物的高产需求[1]。人为施用氮肥是实现作物高产最重要的措施之一,但氮肥过量会改变土壤氮循环,使微生物生物量中氮显著减少,导致盐碱化加剧[2]。盐离子过度富集和高pH值除引发渗透胁迫、植物细胞水分损失和中毒外[3],还影响微生物的活动,制约氮素及其他养分的转化和供应,致使土壤中可利用的营养元素更为缺乏[4]。
在农业生态系统中,作物生物量中约24%的氮素来自非共生N2O固定[5]。固氮菌能将空气中的氮转化为植物可利用的铵盐,为植物生长发育提供必需的养分。已有研究表明,施用固氮菌剂能减轻高盐胁迫对植物造成的危害,促进植物生长[6],也能显著提高土壤的供氮能力,降低土壤pH与电导率,进而使植物根系微生态环境得到改善。Fischer等研究发现,接种固氮菌能促进盐碱环境中植物的生长,减少其对氮肥的消耗[7]。Chaudhary等将耐盐固氮菌接种到小麦上,显著提高了盐碱地小麦的生物量和籽粒产量[8];Hindersah等发现耐盐固氮菌可以促进植物生长,增加番茄叶片数和根系干重[9]。王慧桥等利用固氮菌提高了盐碱土壤有效氮含量和脲酶活性,从而提高了玉米产量[10];然而,土壤的酸碱程度直接影响固氮菌的定殖和菌群结构[11]。目前,关于固氮菌的研究和应用多集中于盐碱程度较低的土壤,而对于适宜极端盐碱环境固氮菌的报道较少。我国盐碱地面积约9913万hm2,占总耕地面积的70%左右[12-13]。其中,pH高于9.0、盐含量0.6%以上的重度盐碱地每年以1.4%的速率增长[14-15]。为此,需要充分挖掘可耐受极端环境的固氮微生物资源,将空气中的氮素转化为植物所需要的养分,建立盐碱生境植物生长的养分持留和相对自维持系统,从而实现化肥用量的有效减少。
本文从海南省三沙市热带珊瑚岛极端盐碱土壤中筛选到1株自生固氮菌,通过形态特征、生理生化指标测定及16S rRNA片段(基因)序列分析进行菌种鉴定,研究其环境适应性,并通过盆栽试验验证其固氮和促生长效果,以期为开发极端盐碱地改良复合菌剂提供菌种资源。
1 材料和方法 1.1 试验材料 1.1.1 土壤样品来源:海南省三沙市热带珊瑚岛,土样理化性质:pH为9.7,有机碳含量2.45 g/kg,全氮含量0.13 g/kg,全磷含量68.4 mg/kg,速效磷含量14.64 mg/kg,钾含量58.02 g/kg,电导率166 μs/cm,有机质含量0.4%。
1.1.2 LB培养基(1 L):蛋白胨10 g,酵母提取物5 g,NaCl 10 g,用ddH2O定容,调pH至7.0–7.2。
1.1.3 阿须贝固氮菌培养基(Ashby 1 L):KH2PO4 0.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO35.0 g,甘露醇10 g,CaSO4·2H2O 0.1 g,用ddH2O定容,调pH至7.0–7.5。
1.1.4 固氮培养基(1 L):甘露醇20 g,KH2PO4 0.2 g,K2HPO4 0.8 g,MgSO4·7H2O 0.2 g,CaSO4·2H2O 0.1 g,酵母膏0.5 g,FeCl3微量,Na2MoO4·2H2O微量,用ddH2O定容,调pH至7.2。
1.1.5 King氏培养基(1 L):蛋白胨20 g,K2HPO4 1.725 g,丙三醇15 mL,MgSO4·7H2O 1.5 g,色氨酸0.1 g,用ddH2O定容,调pH至7.2。
1.1.6 比色液(50 mL):将20 mL 0.025 mmol/L的FeCl3缓缓加入30 mL浓硫酸中。
1.1.7 MSA基础培养基(1 L):葡萄糖4 g,蛋白胨5 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,用ddH2O定容,调pH至7.0。
1.1.8 磷酸缓冲液(100 mL):NaH2PO4·2H2O 590.5 mg,Na2HPO4·12H2O 2.427 g,NH4Cl 250 mg,KH2PO4·H2O 75 mg,NaCl 125 mg,用ddH2O定容。
1.1.9 CAS染液(100 mL):A液:称取铬天青S 60.5 mg,用ddH2O定容至50 mL,然后加入10 mL 1 mmol/L FeCl3 (用10 mmol/L HCl配制);B液:称取72.9 mg六烷基三甲基溴化铵(HDTMA),用ddH2O定容至40 mL;将A液混匀后缓缓沿杯壁加入到B液中。
1.1.10 MSA-CAS培养基:向1 L MSA基础培养基中依次加入50 mL磷酸缓冲液和50 mL CAS染液,混匀即可。
1.1.11 PKO培养基(1 L):葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.1 g,MnSO4·H2O 30 mg,FeSO4 30 mg,Ca3(PO4)2 5 g,酵母粉0.5 g,琼脂20 g,用ddH2O定容,调pH至7.0。
1.1.12 解钾培养基(1 L):葡萄糖10 g,钾长石2.5 g,Na2HPO4 0.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g CaCO3 5 g,CaSO4·7H2O 0.1 g,琼脂20 g,用ddH2O定容,调pH至7.0。
1.1.13 主要试剂:细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;2×T5 Super PCR Mix购自北京擎科新业生物技术有限公司;细菌理化性质检测试剂条购自北京兰伯瑞生物科技有限公司;固氮酶检测试剂盒购自北京鸿跃创新科技有限公司;氨氮和总氮的测定由北京中科光析化工技术研究所完成。
1.1.14 主要仪器:PCR仪S1000购自伯乐生命医学产品(上海)有限公司;电泳仪EPS 300和凝胶成像分析仪购自上海天能科技有限公司。采用日立冷场发射扫描电子显微镜SU8010观察菌体形态。
1.2 耐盐碱固氮菌的分离与筛选称取5 g土样,加入装有45 mL无菌水的三角瓶中,振荡均匀后静置30 min,用无菌水稀释至1000倍;取100 μL均匀涂布于Ashby固体培养基,37 ℃倒置培养3 d,挑选单菌落进行纯化分离,置于4 ℃冰箱内保存备用。
分别配制pH 7、pH 8、pH 9和pH 10,NaCl含量为0.6%的LB液体培养基,接种所筛选到的细菌,37 ℃、200 r/min培养24 h,测定OD600的吸光度,选择耐盐碱性较强的菌株做后续实验。
1.3 固氮菌的鉴定形态学观察:将待测菌液均匀涂布于固氮培养基,37 ℃培养24 h,观察菌落形态;利用扫描电子显微镜观察菌体形态及大小。
生理生化特性分析:采用Biolog GENIII鉴定板1030鉴定菌株可利用碳源;梅里埃API 20NE非发酵G-杆菌鉴定试剂盒测待试菌株其他生理生化指标。
分子系统学分析:将菌株单克隆接种至LB培养基中,37 ℃振荡培养24 h后送博迈德生物工程股份有限公司测序。将得到的序列在NCBI网站比对,选取相似度高的菌株以及同一菌群内知名度高的菌株作为参考菌株,应用MEGA 5.0软件构建系统发育树。
1.4 菌株生长量、耐盐碱特性测定取固氮菌单菌落分别接种于100 mL LB和固氮液体培养基,37 ℃、200 r/min振荡培养,间隔2 h取样,分光光度计测定OD600的吸光值,作出生长曲线。
接种固氮菌单克隆至液体固氮培养基,37 ℃、200 r/min培养24 h,作为种子菌液备用。分别取5 mL种子菌液,接种于pH为7、8、9、10、11、12的液体固氮培养基,37 ℃、200 r/min培养24 h,测定其OD600值。
配制pH 9,NaCl浓度分别为0%、1%、2%、3%、4%、5%、6%、7%、8%的液体固氮培养基,按5%的接种量接种上述种子菌液,37 ℃、200 r/min培养24 h,测定其OD600值。
1.5 固氮酶基因nifH检测以固氮菌总DNA为模板,采用巢式PCR进行两轮扩增[16],第一轮反应用引物PolF和PolR进行扩增;第二轮反应以第一轮反应产物为模板,用引物PolF和PolR-GCb进行扩增(引物序列如表 1所示)。
| Primers | Sequence (5'→3') |
| PolR | ATSGCCATCATYTCRCCGGA |
| PolF | TGCGAYCCSAARGCBGACTC |
| PolF-GCb | CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCTGCGAYCCSAARGCBGACTC |
| R=A/G; Y=C/T; S=G/C. | |
将上述反应所得PCR产物进行胶回收,并连接T-载体,热击法转化至大肠杆菌DH10B,挑取单克隆接种于液体LB培养基,过夜培养后送至博迈德生物工程股份有限公司测序。将得到的序列在GenBank中进行比对。
1.6 菌株固氮酶活性及胞外泌铵能力测定将Ashby固体培养基上获得的单克隆接种于液体无氮培养基,37 ℃、200 r/min振荡培养过夜,6000 r/min离心10 min,将上清液过滤除菌后加至包被固氮酶(NITS)抗体的微孔中,37 ℃温育30 min,洗涤5次,加入HRP标记的固氮酶抗体,37 ℃温育30 min,洗涤5次,加入TMB底物显色10 min,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中固氮酶浓度。
将37 ℃、200 r/min振荡培养24 h的固氮菌培养液6000 r/min离心10 min后取上清,用0.22 µm滤膜过滤除菌,并送至北京中科光析化工技术研究所测定其氨氮和总氮含量。
1.7 菌株促生特性测定 1.7.1 采用SalKowski比色法测定菌株所分泌的生长素(IAA)[17]:将供试菌株接种于100 mL的King氏液体培养基中,37 ℃、200 r/min培养2 d,将培养液离心取上清,按1:1比例加入比色液,在530 nm波长下测定其吸光度,标准曲线采用3-IAA(3-吲哚乙酸)标准品制作,试验重复3次。
1.7.2 产铁载体检测:将菌株接种于MSA-CAS液体培养基中,37 ℃、200 r/min振荡培养2 d。培养液由蓝色变为红色、橙黄色或紫色者均为阳性。
1.7.3 溶磷试验:将菌株接种至PKO培养基上,37 ℃培养一段时间后,菌落周围形成透明圈者为阳性。
1.7.4 解钾试验:将菌株接种至解钾培养基上,37 ℃培养一段时间后,菌落周围形成透明圈者为阳性。
1.8 温室盆栽试验购买珊瑚砂和玉米种子(品种:正大12),在日光温室中设置2个处理:CK (浇施200 mL H2O);T (浇施含菌量为1×109 CFU的固氮菌悬浮液),6次重复。每盆(13 cm×13 cm)播种4粒玉米种子,出苗后持续观察其生长状况,测定株高、茎粗、叶绿素含量等农艺性状,60 d后测定玉米植株生物量。
在采自海南省三沙市热带珊瑚岛的珊瑚砂中加入腐殖酸,点播玉米种子。玉米出苗后浇施pH 9、NaCl含量0.6%的碳酸盐缓冲溶液,以模拟极端盐碱环境。培养60 d后测定其主要农艺性状,检测DJ-1的固氮促生效果。
1.9 数据处理试验数据采用Origin 2018和SPSS 20软件处理,运用MEGA 5.0软件构建系统发育树。
2 结果和分析 2.1 固氮菌的分离与筛选从采自海南省三沙市热带珊瑚岛的土壤样品中分离获得3株固氮菌(图 1-A)。其中DJ-1菌株可在NaCl含量为0.6%的培养基上快速生长,生物量显著高于其他两株菌,当培养基pH为8.0时生物量最大,OD600值达1.232,其他两株菌的吸光值仅为0.582和0.492,可见DJ-1具有较强的耐碱性。
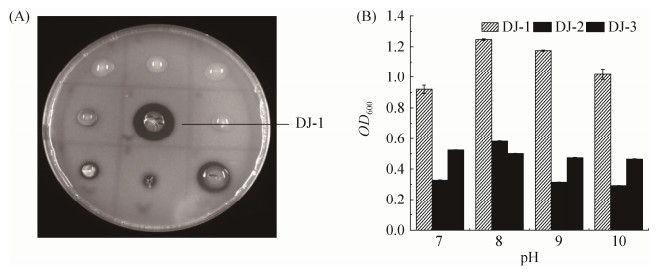
|
| 图 1 菌株的筛选 Figure 1 Screening of strains. A: isolation of nitrogen-fixing bacteria; B: determination of saline-alkali resistance of azotobacter. Values represents means±SD. Three biological repeats were performed. |
2.2 菌种鉴定 2.2.1 形态特征观察:
形态学观察结果如图 2所示,DJ-1菌落呈圆形,中间凸起,全缘光滑,白色半透明,无色素;在无氮培养基上生长良好;菌体杆状,两端钝圆,大小为(0.5–1.3) μm×(0.3–0.5) μm,单个排列,革兰氏染色阴性。
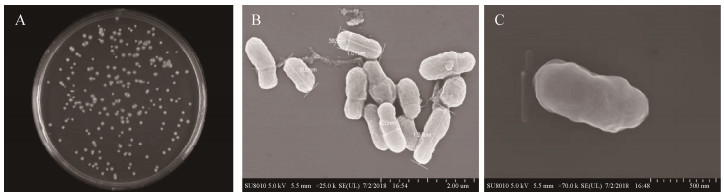
|
| 图 2 菌株形态特征 Figure 2 Strain morphological characteristics. A: colony morphology; B: cell size; C: cell morphology. |
2.2.2 生理生化特性分析:
试验结果如表 2所示,菌株DJ-1在pH 6、NaCl含量为8%的条件下可生长;可利用葡萄糖、果糖、麦芽糖、蔗糖、甘露醇和精氨酸、丝氨酸、丙氨酸等部分氨基酸作为唯一碳源,但不能利用糊精、柠檬酸、酮戊二酸及部分脂类;硝酸盐还原试验为阳性,表明硝酸盐可作为DJ-1的氮源。氧化酶、脲酶试验均呈阳性,表明该菌可以分解过氧化氢和尿素。
| Test items | Results | Test items | Results | |
| Nitrate reduction | + | Indole test | – | |
| Urease | + | Glucose acidification | – | |
| Gelatin hydrolysis | – | Glucose assimilation | + | |
| D-mannitol | + | Citric acid | – | |
| Oxidase | + | Malic acid | + | |
| Maltose | + | Fructose | + | |
| L-Arginine | + | L-serine | + | |
| L-methyl lactate | – | L-galactose lactone | – | |
| pH 6.0 | + | 8% NaCl | + | |
| +: positive; -: negative. | ||||
2.2.3 基于16S rRNA片段序列的分子系统学分析:
固氮菌测序结果比对发现,菌株DJ-1 (NMDCN0000M5F)与Agrobacterium tumefaciens NCPPB2437T (NR115516)、Agrobacterium tumefaciens IAM 12048T (NR041396)的亲缘关系最近,其相似性分别为99.85%和100%。结合形态学分析及生理生化性质测定结果,将菌株DJ-1鉴定为根癌土壤杆菌(Agrobacterium tumefaciens)。用MEGA 5.0软件构建系统发育树如图 3所示。
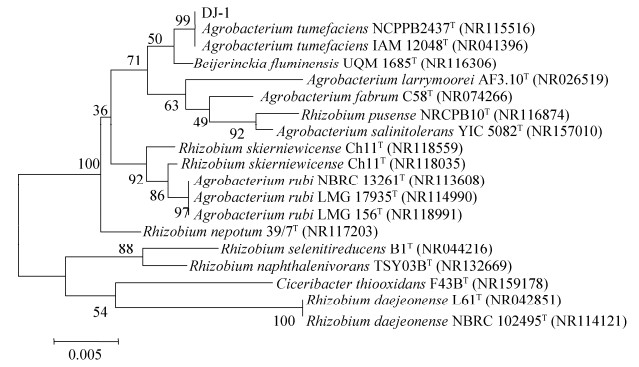
|
| 图 3 基于16S rRNA片段序列构建的菌株DJ-1系统发育树 Figure 3 Strain DJ-1 phylogenetic tree constructed based on the 16S rRNA fragment sequence. T: standard strain. The numbers at each branch points is the percentage supported by bootstrap; Bar 0.005 at the bottom is the sequence divergence. Those in parentheses are the accession numbers in GenBank. |
2.3 菌株生长曲线及耐盐碱特性测定
图 4-A结果显示,在接种后0–4 h内,DJ-1在固氮培养基和LB培养基上的生长均处于迟缓期,培养4 h后进入均快速生长阶段,但在固氮培养基上的繁殖速度明显低于LB培养基。至16 h时,其在LB培养基上已进入稳定期,OD600值为1.278,生物量约为固氮培养基上的1.8倍,而在固氮培养基上,培养18 h后进入稳定期,OD600值为0.702。
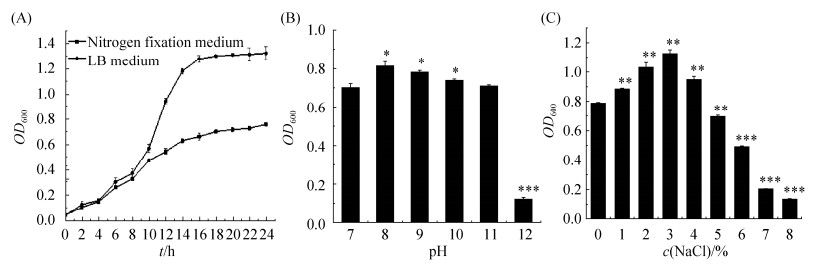
|
| 图 4 菌株生长特性 Figure 4 Strain growth characteristics. A: growth curve; B: alkali resistance; C: salt tolerance. The asterisks denote statistically significant differences as determined by Student's t-test, *: P < 0.05, **: P < 0.01. Values represents means ± SD. Three biological repeats were performed. |
图 4-B结果显示,在pH 7–11的范围内,DJ-1均能正常生长,其最适pH为8。在pH 8–10的培养条件下,菌液的浓度均显著高于pH 7,而pH 11条件下菌株生长状况与pH 7无明显差异。在pH 12的条件下,DJ-1的生长明显受到限制,但菌株仍能缓慢增殖。
图 4-C结果显示,在pH 9的培养基中添加1%–4%的NaCl,DJ-1生长繁殖速度均显著高于无盐培养基,表明该菌株具有一定的嗜盐功能。其中,NaCl浓度为3%的培养条件下,其繁殖和生长速度最快。当盐浓度高于5%时,菌株生长受到一定程度的限制,繁殖速度趋缓,至NaCl浓度8%时,菌株仍能存活并缓慢生长。综上所述,DJ-1可耐受pH 12或NaCl含量8%的极端盐碱环境。
2.4 DJ-1nifH基因检测以DJ-1的总DNA为模板,扩增出400 bp和1000 bp左右的2个片段(图 5),测序结果对比发现,400 bp的片段序列与Agrobacterium tumefaciens strain ISSDS-369 NifH-like gene (EF620480.1)和Agrobacterium tumefaciens strain ISSDS-370 NifH-like gene (EF620481.1)相似性分别达90.00%和93.36%,初步确定该片段编码固氮酶nifH基因。

|
| 图 5 nifH基因 Figure 5 nifH gene. |
2.5 DJ-1固氮酶活性及胞外泌铵能力
经测定,DJ-1菌株在液体无氮培养基中培养24 h后,胞外泌铵量为9.8 mg/L,培养液中总氮含量为0.28%,其固氮酶浓度为424.33 ng/L,表明该菌株有较强的自生固氮能力。
2.6 菌株促生特性分析在King氏培养基中振荡培养2 d后,用SalKowski比色法检测发现,DJ-1可产生长素(IAA) 34.5 μg/mL;在MSA-CAS液体培养基中振荡培养2 d后其染色液由蓝色变为橙黄色,表明该菌具有产铁载体的能力。在PKO和解钾培养基上培养一段时间后,其菌体周围产生透明圈,表明其具有一定的溶磷和解钾能力(图 6)。

|
| 图 6 DJ-1溶磷和解钾的能力 Figure 6 The ability of DJ-1 to dissolve phosphorus and potassium. A: solubilizing phosphorus; B: dissolving potassium. |
2.7 盆栽试验 2.7.1 DJ-1的固氮促生效果:
盆栽试验结果表明,浇施耐盐碱固氮菌DJ-1,玉米植株长势、主要农艺性状及生物量均明显优于对照(图 7)。随着生育进程的推进,处理间玉米株高、茎粗、叶宽等农艺性状的差距也越来越大。图 8数据显示,玉米培养15 d时,浇施固氮菌的处理组平均株高达到36.34 cm,较对照组的28.84 cm提高26.01%;处理组平均茎粗为3.04 cm,较对照组的2.705 mm提高了12.38%;处理组叶片平均宽度为1.45 cm,较对照组的1.21 cm增加了19.59%;处理组叶片叶绿素SPAD值平均为34.33,较对照组的29.4增加了16.75%。至培养30 d时,处理组株高、茎粗、叶宽及叶绿素SPAD值分别较对照组提高了28.55%、13.45%、27.48%和23.63%。至60 d时,二者株高、茎粗、叶宽3个性状的差异最大,处理组较对照组分别提高了37.85%、13.64%、29.29%。本试验栽培基质采用珊瑚砂,未浇施营养,因此,玉米生长后期表现出严重脱肥现象,所有处理植株叶片的叶绿素含量均呈下降态势。

|
| 图 7 玉米接种DJ-1后的表型 Figure 7 Phenotype of maize inoculated with DJ-1. A: control; B: DJ-1 treatment. |
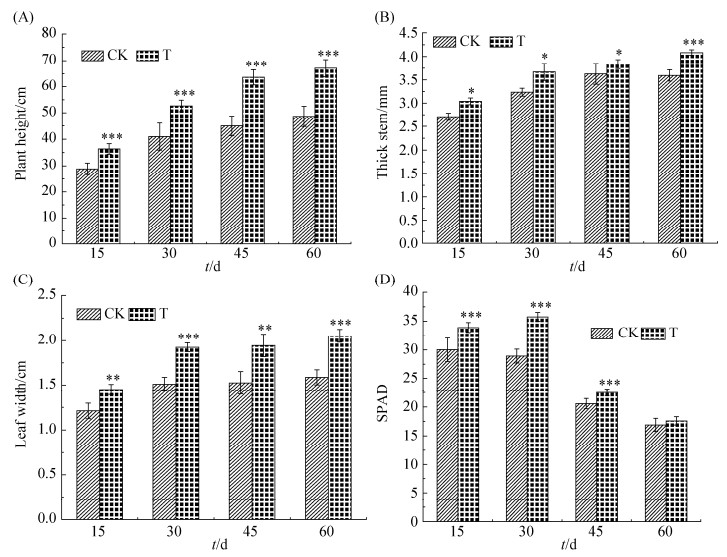
|
| 图 8 玉米主要农艺指标 Figure 8 Main agronomic indicators of corn. A: plant height; B: thick stem; C: leaf width; D: SPAD. The asterisks denote statistically significant differences as determined by Student's t-test. *: P < 0.05; **: P < 0.01; ***: P < 0.001. Values represents means±SD. Three biological repeats were performed. |
生物量的积累是玉米对光能利用效率和环境适应能力的综合表现。图 9数据显示,DJ-1能促进根系发育。与对照组相比,处理组地上部分和的地下部分干物质积累量分别提高了86.5%和74.37%,差异均达显著水平。

|
| 图 9 玉米生物量 Figure 9 Corn biomass. A: underground part biomass; B: aboveground biomass. The asterisks denote statistically significant differences as determined by Student 's t-test. *: P < 0.05; **: P < 0.01. Values represents means±SD. Three biological repeats were performed. |
2.7.2 DJ-1在盐碱环境下的固氮促生效果:
岛礁珊瑚砂属极端盐碱环境,若不加改良直接播种玉米,种子发芽率很低。按珊瑚砂: 腐殖酸为3:1的量加入腐殖酸,玉米种子均可出苗。图 10结果显示(T1:岛礁珊瑚砂处理,T2:岛礁珊瑚砂中浇碳酸盐缓冲溶液处理),浇施DJ-1对盐碱环境玉米生长有促生效果,出苗60 d后,其株高、茎粗和叶绿素SPAD值分别较对照提高21.88%、17.34%和8.47%,株高和茎粗的差异达显著水平。

|
| 图 10 DJ-1在盐碱条件下的接种效果 Figure 10 DJ-1 inoculation effect under saline-alkali conditions. A: plant height; B: thick stem; C: SPAD. The asterisks denote statistically significant differences as determined by Student's t-test, *: P < 0.05; **: P < 0.01. Values represents means±SD. Three biological repeats were performed. |
3 讨论和结论
近20年来,在微生物资源的研究工作中,一个新的热点是植物根际促生细菌,这类细菌存在于植物根圈范围内,在代谢过程中能产生促进植物生长的物质,而根癌土壤杆菌就是其中一个重要的种类。《伯杰细菌鉴定手册》认为这类细菌没有固氮功能,将其列入土壤杆菌属,而非根瘤菌属。至1990年,英国Sastry[18]实验室和中国科学院微生物研究所[19-20]相继检测到根癌土壤杆菌的自生固氮活力,并用Western免疫印迹和Southern印迹技术分别检测到固氮酶铁蛋白和相应的结构基因nifH[19]及其调节基因nifA[21]。固氮酶基因nifH的序列高度保守,常用于研究固氮微生物的分子标记。本文也克隆到了DJ-1的固氮酶基因nifH,进一步验证了其固氮作用的可靠性。
直接氮输入和间接NO3-增加是提高土壤无机氮含量的重要措施,但也能引发钙、镁淋溶和土壤理化性质的改变,使难降解化合物积聚,导致土壤板结、生物多样性和稳定性降低、土壤中磷(P)含量减少等一系列问题[22-23]。自生固氮菌可将无机氮转化为有效氮,在增加土壤含氮量的同时,还可减少难降解化合物,有效调节土壤pH值,利于土壤生物多样性的恢复[24]。因此,自生固氮菌可作为含有特殊功能生物肥料的原料,部分替代化学合成氮肥[25]。多数固氮菌无法在高盐碱环境下定殖,牛艳芳等从非盐碱土壤中分离的固氮菌,最适生长pH值为6–8[26];姜焕焕等从盐碱土壤中
分离的固氮菌,最适生长pH值范围为7–9[27]。随着我国黄河三角洲极端盐碱土地的开发利用及沿海珊瑚岛礁建设工程的推进,需要环境友好新型微生物肥料推陈出新,筛选可耐受极端盐碱环境固氮、促生长微生物显得十分必要。
截至目前,尚未见耐受极端盐碱环境的土壤根癌杆菌报道。张广志等采用原生质体融合技术将耐盐菌与圆褐固氮菌(Azotobacter chroococcum)进行细胞融合,得到了一株具有固氮性能、可耐受10% NaCl条件的非根癌杆菌[28]。本研究从海南省三沙市热带珊瑚岛土样中分离的根癌土壤杆菌DJ-1,集固氮、促生长、耐盐碱功能于一体,在pH 11、NaCl浓度8%的条件下仍能缓慢生长。我们利用珊瑚砂为基质、浇施碳酸盐缓冲液(模拟极端盐碱环境)进行盆栽试验发现,DJ-1处理后玉米和碱蓬的株高和茎粗均显著提高。在非盐碱条件下,DJ-1处理的水稻株高可增加34.34%,鲜重生物量增加39.66%;DJ-1处理小白菜后种子的发芽势提高77.78%,发芽率增加23.08%。可见,DJ-1具有良好的应用前景。未来,在菌株释放到环境之前,尚需进行急性经口毒性试验、一次破损皮肤刺激试验、溶血试验、抗菌药物敏感试验、急性腹腔注射致病性试验及急性眼刺激试验,并明确其对多种作物的致病性。有研究显示,根癌土壤杆菌可引起桃树及部分双子叶植物产生根癌[29-30],具有一定的潜在致病性。DJ-1在分类上属根癌土壤杆菌,本文目的是找寻一种耐盐碱的功能微生物,仅对其功能开展了较为深入的研究,发现在温室模拟的盐碱环境下,DJ-1处理的玉米、碱蓬、小白菜和水稻并未形成根癌,且对于这些作物促生作用显著。De Saeger等研究表明根癌土壤杆菌的致病基因主要集中在Ti-质粒上[31]。Ti-质粒可使原核生物和真核生物之间进行基因重组,其左右边界之间的Ti-DNA可以被任何其他序列取代,是分子遗传学的主要研究对象和基因工程的重要工具,遗传操作技术已十分成熟。DJ-1具有致病风险,但是根据其特性依然可以进行广泛应用,通过基因工程手段编辑致病基因,或用其他功能基因进行替换,开发环境友好、具有极端耐盐碱和固氮特性的微生物种质资源,然后再加以利用。另外,也可克隆DJ-1的极端耐盐碱、固氮促生长功能基因,转化至其他菌种中,增强主推菌株的功能和环境适应性,使其更好地为农业生产服务。
| [1] | LeBauer DS, Treseder KK. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed. Ecology, 2008, 89(2): 371-379. DOI:10.1890/06-2057.1 |
| [2] | Lu M, Yang YH, Luo YQ, Fang CM, Zhou XH, Chen JK, Yang X, Li B. Responses of ecosystem nitrogen cycle to nitrogen addition: a meta-analysis. New Phytologist, 2011, 189(4): 1040-1050. DOI:10.1111/j.1469-8137.2010.03563.x |
| [3] |
Shi WJ, Yang JQ, Ma Y. Review on saline-alkali soil improvement with planting halophyte method in arid region. Journal of Water Resources and Water Engineering, 2015, 26(5): 229-234.
(in Chinese) 史文娟, 杨军强, 马媛. 旱区盐碱地盐生植物改良研究动态与分析. 水资源与水工程学报, 2015, 26(5): 229-234. |
| [4] |
Zhu JF, Cui ZR, Wu CH, Deng C, Chen JH, Zhang HX. Research advances and prospect of saline and alkali land greening in China. World Forestry Research, 2018, 31(4): 70-75.
(in Chinese) 朱建峰, 崔振荣, 吴春红, 邓丞, 陈军华, 张华新. 我国盐碱地绿化研究进展与展望. 世界林业研究, 2018, 31(4): 70-75. |
| [5] | Ladha JK, Tirol-Padre A, Reddy CK, Cassman KG, Verma S, Powlson DS, van Kessel C, de B Richter D, Chakraborty D, Pathak H. Global nitrogen budgets in cereals: a 50-year assessment for maize, rice and wheat production systems. Scientific Reports, 2016, 6: 19355. DOI:10.1038/srep19355 |
| [6] |
Luo D, Pan CD, Zhou J, Luo M, Ji H, Li S. Effect of inoculation with endophytic diazotrophic bacteria on physiological characters of Tamarix ramosissima Ledeb. seedlings under salt-drought stress. Arid Land Geography, 2012, 35(1): 154-161.
(in Chinese) 罗达, 潘存德, 周俊, 罗明, 季华, 李硕. 干旱及盐双胁迫下内生固氮菌接种对多枝柽柳实生苗生理特性的影响. 干旱区地理, 2012, 35(1): 154-161. |
| [7] | Fischer RA, Edmeades GO. Breeding and cereal yield progress. Crop Science, 2010, 50: S-85-S-98. DOI:10.2135/cropsci2009.10.0564 |
| [8] | Chaudhary D, Narula N, Sindhu SS, Behl RK. Plant growth stimulation of wheat (Triticum aestivum L.) by inoculation of salinity tolerant Azotobacter strains. Physiology and Molecular Biology of Plants, 2013, 19(4): 515-519. DOI:10.1007/s12298-013-0178-2 |
| [9] | Hindersah R, Suryatmana P, Setiawati MR, Fitriatin BN, Simarmata T. Salinity resistance of Azotobacter isolated from saline soil in west Java. 2019. |
| [10] |
Wang HQ, Chen WF, Song FP, Dong YJ. Effects of nitrogen fixing bacteria on growth of maize and nutrient characteristics of coastal saline soil. Chinese Journal of Soil Science, 2018, 49(6): 1341-1347.
(in Chinese) 王慧桥, 陈为峰, 宋付朋, 董元杰. 不同自生固氮菌对盐碱地玉米生长与土壤养分特性的影响. 土壤通报, 2018, 49(6): 1341-1347. |
| [11] | Levy-Booth DJ, Prescott CE, Grayston SJ. Microbial functional genes involved in nitrogen fixation, nitrification and denitrification in forest ecosystems. Soil Biology and Biochemistry, 2014, 75: 11-25. DOI:10.1016/j.soilbio.2014.03.021 |
| [12] |
Zhang Q, Zhao WJ, Chen WF, Qin T, Xu SY. Research progress on remediation and conservation of saline alkali soil. Tianjin Agricultural Sciences, 2018, 24(4): 65-70.
(in Chinese) 张强, 赵文娟, 陈卫峰, 秦涛, 徐升运. 盐碱地修复与保育研究进展. 天津农业科学, 2018, 24(4): 65-70. DOI:10.3969/j.issn.1006-6500.2018.04.016 |
| [13] |
Wang JL, Huang XJ, Zhong TY, Chen ZG. Review on sustainable utilization of salt-affected land. Acta Geographica Sinica, 2011, 66(5): 673-684.
(in Chinese) 王佳丽, 黄贤金, 钟太洋, 陈志刚. 盐碱地可持续利用研究综述. 地理学报, 2011, 66(5): 673-684. |
| [14] |
Wang H, Liu N, Yao YT, Xie WB, Wang L. The relationship between foliar TOC of Tamarix chinensis lour. and nutrient elements' content in saline-alkali soil of north Shanxi.. Ecology and Environmental Sciences, 2017, 26(12): 2036-2044.
(in Chinese) 王慧, 刘宁, 姚延梼, 解文斌, 王林. 晋北干旱区盐碱地柽柳叶总有机碳与营养元素含量的关系. 生态环境学报, 2017, 26(12): 2036-2044. |
| [15] |
Li ZJ, Zhang HL, Guo X, Fan RH, Ma K, Liu JY, Yang FJ. Effects of different improvement measures on soil structure and element composition, photosynthesis and growth of poplar leaves in severe saline-alkali soils of Songnen plain. Bulletin of Botanical Research, 2019, 39(5): 733-739.
(in Chinese) 李占君, 张厚良, 郭兴, 范瑞红, 马珂, 刘继云, 杨逢建. 不同改良措施对松嫩平原重度盐碱地土壤结构与元素组成、杨树叶片光合及生长状况影响差异研究. 植物研究, 2019, 39(5): 733-739. |
| [16] |
Shi JJ, Zhang L, Jiang FY, Wang X, Feng G. AM fungi and mycelial bacteria have dual functions of fixing nitrogen and phosphorus. Acta Pedologica Sinica, 1-13[2020-12-07]. (in Chinese) http://kns.cnki.net/kcms/detail/32.1119.P.20201009.1418.002.html. 石晶晶, 张林, 江飞焰, 王晓, 冯固. AM真菌菌丝际细菌具有固氮解磷双重功能. 土壤学报: 1-13[2020-12-07]. http://kns.cnki.net/kcms/detail/32.1119.P.20201009.1418.002.html. |
| [17] |
Liu LH, Peng GX, Huang SF, Wang ZC, Ting YW, Tan ZY. Diversity and growth-promoting characteristics of endophytic nitrogen-fixing bacteria in ground roots. Microbiology Bulletin, 2019, 46(10): 2538-2547.
(in Chinese) 刘丽辉, 彭桂香, 黄淑芬, 王祖城, 庭友卫, 谭志远. 落地生根内生固氮菌多样性和促生特性. 微生物学通报, 2019, 46(10): 2538-2547. |
| [18] | Kanvinde L, Sastry GRK. Agrobacterium tumefaciens is a diazotrophic bacterium. Applied & Environmental Miorobiology, 1990, 56(7): 2087-2092. |
| [19] |
Zhang JJ, Wang L, Li LN, Zheng WY, Jin Z, Li JD, Li YX. Identification of nitrogen fixation by Agrobacterium. Chinese Science Bulletin, 1992, 37(18): 1725.
(in Chinese) 张静娟, 王丽, 李丽娜, 郑文尧, 金哲, 李久蒂, 李永兴. 土壤杆菌固氮作用的鉴定. 科学通报, 1992, 37(18): 1725. |
| [20] |
Wang L, Zhang JJ. Studies on physiological characteristies of nitrogen fixation by Agrobacterium tumefaciens. Acta Microbiologica Sinica, 1994, 34(5): 385-392.
(in Chinese) 王丽, 张静娟. 土壤杆菌固氮生理特性研究. 微生物学报, 1994, 34(5): 385-392. |
| [21] |
Zhang JL, Zhang JJ. Role of the heterologous nifA c product in the regulation of nif expression in Agrobacterium tumefaciens. Chinese Journal of Biotechnology, 1997, 13(1): 31-36.
(in Chinese) 张金玲, 张静娟. 异源nifAC对根癌土壤杆菌nif基因表达的调节作用. 生物工程学报, 1997, 13(1): 31-36. |
| [22] | Treseder KK. Nitrogen additions and microbial biomass: a meta-analysis of ecosystem studies. Ecology Letters, 2008, 11(10): 1111-1120. DOI:10.1111/j.1461-0248.2008.01230.x |
| [23] | Wang H, Liu SR, Zhang X, Mao QG, Li XZ, You YM, Wang JX, Zheng MH, Zhang W, Lu XK, Mo JM. Nitrogen addition reduces soil bacterial richness, while phosphorus addition alters community composition in an old-growth N-rich tropical forest in Southern China. Soil Biology and Biochemistry, 2018, 127: 22-30. DOI:10.1016/j.soilbio.2018.08.022 |
| [24] | Janssens IA, Dieleman W, Luyssaert S, Subke JA, Reichstein M, Ceulemans R, Ciais P, Dolman AJ, Grace J, Matteucci G, Papale D, Piao SL, Schulze ED, Tang J, Law BE. Reduction of forest soil respiration in response to nitrogen deposition. Nature Geoscience, 2010, 3(5): 315-322. DOI:10.1038/ngeo844 |
| [25] | Wu SH, Zhuang GQ, Bai ZH, Cen Y, Xu SJ, Sun HS, Han XG, Zhuang XL. Mitigation of nitrous oxide emissions from acidic soils by Bacillus amyloliquefaciens, a plant growth-promoting bacterium. Global Change Biology, 2018, 24(6): 2352-2365. DOI:10.1111/gcb.14025 |
| [26] |
Niu YF, Yan W, Chen LH. Diversity and characterization of nitrogen-fixing bacteria in Betula platypylla rhizosphere in Arxan. Journal of Northeast Forestry University, 2017, 45(5): 101-105, 120.
(in Chinese) 牛艳芳, 闫伟, 陈立红. 阿尔山白桦根际土壤固氮菌多样性及特性. 东北林业大学学报, 2017, 45(5): 101-105, 120. |
| [27] |
Jiang HH, Qi PS, Wang T, Chi XY, Chen MN. Screening of multi-function nitrogen-fixing bacteria in peanut rhizosphere and their tolerances to saline. Biotechnology Bulletin, 2019, 35(3): 24-30.
(in Chinese) 姜焕焕, 祁佩时, 王通, 迟晓元, 陈明娜. 花生根际多功能固氮菌的分离及其耐盐碱特性研究. 生物技术通报, 2019, 35(3): 24-30. |
| [28] |
Zhang GZ, Yang HT, Li JS, Chen K. Construction of salt-tolerant Azotobacter by protoplast fusion. Soil and Fertilizer Sciences in China, 2010(2): 86-89.
(in Chinese) 张广志, 杨合同, 李纪顺, 陈凯. 利用原生质体融合构建耐盐固氮菌. 中国土壤与肥料, 2010(2): 86-89. |
| [29] |
Li YJ, Li Q, Zhang ZX, Li SF. Screening and identification of peach endophytic bacteria against Agrobacterium tumefaciens. China Agricultural Sciences, 2017, 50(20): 3918-3929.
(in Chinese) 李昱佳, 李茜, 张志想, 李世访. 拮抗根癌土壤杆菌的桃内生细菌的筛选鉴定. 中国农业科学, 2017, 50(20): 3918-3929. |
| [30] | 李祝. 根癌农杆菌拮抗真菌的筛选、发酵及有机锡新化合物抗TMV、抗癌机制研究. 贵州大学博士学位论文, 2008. |
| [31] | De Saeger J, Park J, Chung HS, Hernalsteens JP, van Lijsebettens M, Inzé D, van Montagu M, Depuydt S. Agrobacterium strains and strain improvement: Present and outlook. Biotechnology Advances, 2020: 107677. |
 2021, Vol. 61
2021, Vol. 61




