中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 陈婕, 吴涓. 2021
- Jie Chen, Juan Wu. 2021
- 乳白耙齿菌F17好氧降解四溴双酚A的特性及机理研究
- Characteristics and mechanism of aerobic biodegradation of tetrabromobisphenol A by Irpex lacteus F17
- 微生物学报, 61(10): 3328-3339
- Acta Microbiologica Sinica, 61(10): 3328-3339
-
文章历史
- 收稿日期:2021-01-24
- 修回日期:2021-04-08
- 网络出版日期:2021-06-15
溴代阻燃剂(brominated flame retardants, BFRs)是目前应用最广泛的一类有机阻燃剂, 主要添加在各种电子产品、纺织品和塑料中[1]。四溴双酚A (TBBPA)可作为反应型和添加型阻燃剂用于印刷电路板和ABS塑料中, 因其良好的化学稳定性和阻燃性而成为使用最广泛的溴代阻燃剂[2-3]。TBBPA在多种环境介质以及生物体内均有检出[4-5], 能引起肝脏毒性、免疫毒性、神经毒性和细胞毒性, 并具有内分泌干扰效应[6-7], 是一种新型的潜在持久性有机污染物, 长期接触会给人类和有机体带来不良影响。
由于TBBPA的环境持久性、生物毒性与积累性, 探索经济有效的TBBPA去除技术具有重要意义。目前, 对TBBPA的去除方法主要包括光催化降解、化学氧化、微生物降解、热分解和吸附等[8]。在这些方法中, 微生物降解因低成本、高效率且环境友好性, 被认为是去除环境中有机污染物的一种重要且有前景的技术。TBBPA在好氧和厌氧条件下均能被微生物降解[9-10], 目前已有多种细菌被分离鉴定并证明能够有效降解TBBPA, 如丛毛单胞菌属(Comamonas sp.)[11]、苍白杆菌(Ochrobactrum sp.)[12]、节杆菌(Arthrobacter sp.)[13]、假单胞菌(Pseudomonas sp.)[14]和甲基杆菌属(Methylobacterium sp.)[15]等, 而有关白腐真菌降解TBBPA的研究则相对较少[16-17]。
白腐真菌是一类分布广泛的白色丝状真菌, 由于其具有独特的木质素降解酶系, 因此在有机污染物的降解中具有非常良好的应用前景。本实验所用的I. lacteus F17是一种白腐真菌, 它通过分泌木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)和漆酶(Lac)来实现难降解有机污染物的去除[18-19]。有研究表明, I. lacteus F17对多种染料具有良好的降解和脱色能力[20-21], 并能有效降解水相中的多环芳烃(PAHs)[22]。然而, 利用I. lacteus F17降解水相中BFRs的研究尚未见报道, 因此, I. lacteus F17在环境中BFRs的生物去除研究领域里具有潜在的应用价值。
本文以TBBPA为目标污染物, 研究I. lacteus F17对其降解的性能及机理。通过考察共代谢基质的种类和浓度、初始pH、TBBPA初始浓度和接种量等条件对降解过程的影响, 优化了该菌对TBBPA的降解条件。同时, 通过对降解过程中酶活力及降解中间产物的分析揭示其生物降解机理。此项工作旨在探索白腐真菌在BFRs的好氧生物降解中的应用, 从而为BFRs污染环境的生物修复提供科学依据。
1 材料和方法 1.1 实验菌株选用乳白耙齿菌F17 (Irpex lacteus F17)对TBBPA进行生物降解, 该菌株保藏于中国典型培养物保藏中心(CCTCC), 保藏号为CCTCC AF 2014020[18]。
1.2 培养基马铃薯综合液体培养基(g/L):葡萄糖20.0, KH2PO4 3.0, MgSO4·7H2O 1.5, 马铃薯汁1 L。其中, 马铃薯汁的配制方法是将马铃薯削皮, 称取200 g并切成小块放入烧杯中, 加入1000 mL蒸馏水后加热, 煮沸30 min, 随后用双层纱布过滤, 取滤液加入培养基其他成分, 溶解后再用蒸馏水补足至1000 mL, 自然pH。
无机盐培养基(g/L):KH2PO4 0.5, NH4NO3 3.0, K2HPO4·3H2O 0.5, 无机盐溶液2 mL, pH 5.0。
无机盐溶液(g/L):CuSO4·5H2O 1.0, FeSO4·7H2O 1.0, CaCl2·2H2O 1.0, MgSO4·7H2O 4.0, MnSO4·H2O 1.0。
1.3 菌悬液的制备在无菌条件下, 将保存于试管中的I. lacteus F17接入马铃薯综合液体培养基中, 于30 ℃、160 r/min条件下培养5 d, 随后将含有菌丝球的培养液匀浆, 制备成菌悬液待用。
1.4 最适共代谢基质的确定将一定量的TBBPA溶于二氯甲烷中制备成浓度为10000 mg/L的储备液, 向已灭菌的无机盐培养基(培养基在配制时已分别加入8 g/L葡萄糖、丙酮酸钠、柠檬酸钠和酵母粉作为共代谢基质)中加入40 μL TBBPA储备液, 待二氯甲烷挥发后, 再加入1 mL菌悬液, 使降解体系总体积为20 mL, TBBPA初始浓度为20 mg/L。将该体系于30 ℃、160 r/min条件下进行恒温振荡培养, 空白对照是含TBBPA但不添加任何共代谢基质的无机盐培养基。第12天取样, 测定培养液中TBBPA的剩余浓度和菌体干重, 计算TBBPA的生物降解率。
1.5 接种量对I. lacteus F17降解TBBPA的影响在已灭菌的无机盐培养基中按0.1%、0.5%、1%、5%、10% (V/V)的比例分别加入菌悬液, 培养基的最终体积为20 mL, TBBPA初始浓度为20 mg/L, 于30 ℃、160 r/min条件下进行恒温振荡培养, 空白对照是含TBBPA但不接种I. lacteus F17的无机盐培养基。第12天取样, 测定培养液中TBBPA的剩余浓度, 计算TBBPA的降解率。
1.6 初始pH对I. lacteus F17降解TBBPA的影响降解体系的初始pH值分别调节为3.0、4.0、5.0、6.0、7.0、8.0, 然后加入1 mL菌悬液, TBBPA初始浓度为20 mg/L, 于30 ℃、160 r/min条件下进行恒温振荡培养, 空白对照是含TBBPA但不接种I. lacteus F17的无机盐培养基。第12天取样, 测定培养液中TBBPA的剩余浓度, 计算TBBPA的降解率。
1.7 TBBPA初始浓度对I. lacteus F17降解TBBPA的影响向已灭菌的无机盐培养基中加入一定量的TBBPA储备液使其初始浓度分别为1、5、10、20、30 mg/L, 接种1 mL菌悬液, 在30 ℃、160 r/min下进行恒温振荡培养, 空白对照是含TBBPA但不接种I. lacteus F17的无机盐培养基。第12天取样, 测定培养液中TBBPA的剩余浓度, 计算TBBPA的降解率。
1.8 分析方法 1.8.1 样品预处理:降解12 d后将20 mL培养液全部转移至125 mL分液漏斗中, 加入等体积二氯甲烷进行萃取, 静置分层, 收集下层有机相。重复上述操作, 合并2次萃取的有机相, 经无水硫酸钠脱水后, 在40 ℃下进行旋转蒸发, 用甲醇洗下内壁黏附物, 转移至容量瓶中, 随后用甲醇定容。经0.22 μm滤膜过滤后保存至棕色进样小瓶中, 用高效液相色谱法(HPLC)测定TBBPA的浓度, 同时收集水相测定水中溴离子的含量。
1.8.2 I. lacteus F17生物量的测定:采用干重法测定菌体生物量:样品预处理后收集水相, 过滤得到菌丝球, 于80 ℃下烘干至恒重, 称量。
1.8.3 TBBPA的测定:采用高效液相色谱法(HPLC)测定TBBPA, 分析条件为:色谱柱为安捷伦Eclipse C18柱(250 mm×4.6 mm, 5 μm), 流动相是甲醇: 水=85:15(V/V), 柱温35 ℃, 检测波长290 nm, 流速1 mL/min, 进样量20 μL, 测定时间8 min。
1.8.4 Br-含量的测定:采用离子色谱仪测定水相中Br-的含量, 以4.5 mmol/L Na2CO3和1.4 mmol/L NaHCO3作为淋洗液, 流速为1.2 mL/min, 进样量25 μL, 样品运行时间18 min。
1.8.5 锰过氧化物酶(MnP)的测定[19]:将培养液离心(8000 r/min, 10 min), 吸取上清液150 μL, 加入780 μL乳酸钠缓冲液(110 mmol/L, pH 4.0), 50 μL MnSO4 (40 mmol/L), 20 μL H2O2 (4 mmol/L), 于30 ℃水浴锅中反应5 min, 冰浴终止反应, 在240 nm下测定吸光度, 计算酶活力。一个酶活力单位(U)定义为每分钟将1 μmol Mn2+氧化成为Mn3+所需的酶量。
1.8.6 TBBPA降解产物的分析:采用气相色谱-质谱联用仪(GC-MS)分析TBBPA的中间代谢产物, 分析条件如下:色谱柱为TG-5MS毛细管柱(30 m×0.25 mm, 0.25 μm), 载气为高纯度氦气(He), 离子源(EI)温度为300 ℃, 进样口温度设定为300 ℃, 进样量1 μL。气相色谱升温程序如下:100 ℃保留2 min;以20 ℃/min的速率升至200 ℃;最后以15 ℃/min的速率升至310 ℃, 保留10 min。采用全扫描方式, 扫描范围为40- 500 m/z。
在本文的所有降解实验中, 每组实验均设置了5个平行, 每个平行均设置3个重复。取测定结果的平均值为最终结果。
2 结果和分析 2.1 共代谢基质对TBBPA生物降解的影响 2.1.1 共代谢基质种类的确定:向降解体系中分别加入8 g/L四种常见的易分解共代谢基质即葡萄糖、丙酮酸钠、柠檬酸钠和酵母粉, 以不加入共代谢基质为对照, 确定I. lacteus F17降解TBBPA的最适共代谢基质的种类, 结果如图 1-A所示。除酵母粉外, 葡萄糖、丙酮酸钠和柠檬酸钠的加入均能促进I. lacteus F17对TBBPA的生物降解, 与对照相比, 降解率分别提高了21.2%、20.1%、4.9%, 除柠檬酸钠外, 葡萄糖、丙酮酸钠和酵母粉均能促进I. lacteus F17的生长。其中, 以葡萄糖为共代谢基质时, I. lacteus F17的生长量及对TBBPA的降解率均高于其他共代谢基质, 因此应选择葡萄糖作为I. lacteus F17降解TBBPA的最适共代谢基质。

|
| 图 1 共代谢基质对I. lacteus F17生物降解TBBPA的影响 Figure 1 Effects of co-metabolic substrates on the biodegradation of TBBPA by I. lacteus F17. A: effects of different co-metabolic substrates on the biodegradation of TBBPA and biomass; B: effects of glucose concentration on the biodegradation of TBBPA. |
2.1.2 葡萄糖浓度对TBBPA生物降解的影响:
在降解体系中分别加入0、1、2、5、8 g/L葡萄糖, 考察葡萄糖浓度对TBBPA降解的影响, 结果见图 1-B。葡萄糖的加入对菌体的生长具有一定的促进作用, 然而菌体的生长量在葡萄糖浓度大于2 g/L后趋于稳定。与生长特性不同的是, TBBPA的降解率随着葡萄糖浓度的增加而增大, 当葡萄糖浓度为8 g/L时, 降解率达到最大为76.0%。因此, 选择8 g/L葡萄糖作为最适共代谢基质进行后续实验。
2.2 降解条件的优化 2.2.1 I. lacteus F17接种量对TBBPA生物降解的影响:分别按0.1%、0.5%、1%、5%和10% (V/V)的接种量向降解体系中加入I. lacteus F17菌悬液, 反应体系的最终体积为20 mL, 在TBBPA初始浓度20 mg/L、外加共代谢基质8 g/L葡萄糖、pH 5.0以及30 ℃的条件下, 考察I. lacteus F17接种量对TBBPA生物降解的影响。如图 2-A所示, 接种量为0.1%-5%时, 随着接种量的增大TBBPA的降解率也随之增大, 但在接种量为5%时降解率达到最大即66.4%, 因此以下均采用5%的接种量进行降解实验。

|
| 图 2 环境因素对TBBPA降解的影响 Figure 2 Effects of environmental factors on the biodegradation of TBBPA. A: inoculum volume on the biodegradation of TBBPA; B: initial pH on the biodegradation of TBBPA; C: TBBPA initial concentration on the biodegradation of TBBPA. |
2.2.2 溶液初始pH值对TBBPA降解的影响:
降解体系的初始pH值分别设定为3.0、4.0、5.0、6.0、7.0、8.0, TBBPA初始浓度20 mg/L, 外加共代谢基质为8 g/L的葡萄糖, I. lacteus F17接种量为5%, 于30 ℃下考察初始pH值对TBBPA降解的影响。从图 2-B可以看出, 当pH为3.0时, TBBPA的降解率较低, 仅为42.2%。然而在pH 4.0-8.0, I. lacteus F17则表现出较好的降解能力, TBBPA降解率均达到70%以上, 最高为75.41%。本实验选择pH 5.0作为I. lacteus F17降解TBBPA的最适pH。
2.2.3 TBBPA初始浓度对其降解的影响:TBBPA初始浓度分别设定为1、5、10、20和30 mg/L, 在外加共代谢基质为8 g/L的葡萄糖、I. lacteus F17接种量为5%、pH 5.0以及30 ℃的条件下, 考察其初始浓度对I. lacteus F17生物降解TBBPA的影响, 结果如图 2-C所示。当TBBPA浓度从1 mg/L提高至5 mg/L, 其降解率显著增加, 并且在TBBPA初始浓度为5 mg/L时其降解率达到最大为78.4%, 但随着TBBPA初始浓度的增大, 其降解率略有降低, 因此5 mg/L是I. lacteus F17降解TBBPA的最适初始浓度。
2.3 MnP对TBBPA生物降解的影响白腐真菌对有机污染物的降解主要依赖其自身分泌的胞外降解酶, 包括木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)和漆酶(Lac)。已有的研究表明I. lacteus F17主要依靠所分泌的MnP来实现对有机污染物的降解和脱色[23-24], 因此本实验考察了TBBPA生物降解过程中MnP活力的变化, 降解条件为外加共代谢基质8 g/L葡萄糖, I. lacteus F17接种量5%, 初始pH 5.0, 为便于分析TBBPA降解产物, 将TBBPA初始浓度设为20 mg/L, 实验结果如图 3所示。TBBPA的降解率随着降解时间的延长而增大, 并在第10天时达到最大。对比图 3-A和图 3-B发现, TBBPA的生物降解率与MnP活力在第8-14天时表现出相同的变化趋势, 且两者均在第10天时达到最大, 在第10天降解率达85.5%、脱溴率为14.6%、酶活为15.1 U/L。

|
| 图 3 优化条件下I. lacteus F17对TBBPA的生物降解 Figure 3 The biodegradation of TBBPA by I. lacteus F17 under optimal conditions. A: the biodegradation rate and debromination rate of TBBPA; B: the activity of MnP. |
2.4 TBBPA的生物降解途径分析
通过GC-MS对I. lacteus F17生物降解TBBPA的中间产物进行分析, 检测到7种中间降解产物, 即1-(3-溴-4-羟基)苯乙酮、对羟基苯甲酸、双酚A、2, 5-二羟基苯乙酮、2, 5-二羟基苯甲酸、2, 4-二羟基苯乙酮和2, 4-二羟基苯甲酸(图 4), 其中, 1-(3-溴-4-羟基)苯乙酮在文献中鲜有报道。根据已检测到的物质, 结合相关文献[11-12], 提出了I. lacteus F17生物降解TBBPA的可能途径(图 5)。首先, TBBPA脱去一个溴原子, 形成3, 3ʹ, 5-三溴双酚A, 随后两种不同路径有可能是同时发生的。途径一是, 3, 3ʹ, 5-三溴双酚A依次经过β-断裂、羟基化、去质子和氧化生成1-(3-溴-4-羟基)苯乙酮和对羟基苯甲酸;途径二是3, 3ʹ, 5-三溴双酚A继续脱溴生成双酚A, 随后双酚A中两个苯环之间的键断开, 通过一系列反应生成2, 5-二羟基苯乙酮、2, 5-二羟基苯甲酸、2, 4-二羟基苯乙酮和2, 4-二羟基苯甲酸。

|
| 图 4 TBBPA生物降解的中间产物的质谱图 Figure 4 The mass spectrum of intermediate products during the biodegradation of TBBPA by I. lacteus F17. A: 1-(3-bromo-4-hydroxyphenyl) ethanone; B: 4-hydroxybenzoic acid; C: bisphenol A; D: 2, 5-dihydroxyacetophenone; E: 2, 5-dihydroxybezoic acid; F: 2, 4-dihydroxyacetophenone; G: 2, 4-dihydroxybezoic acid. |
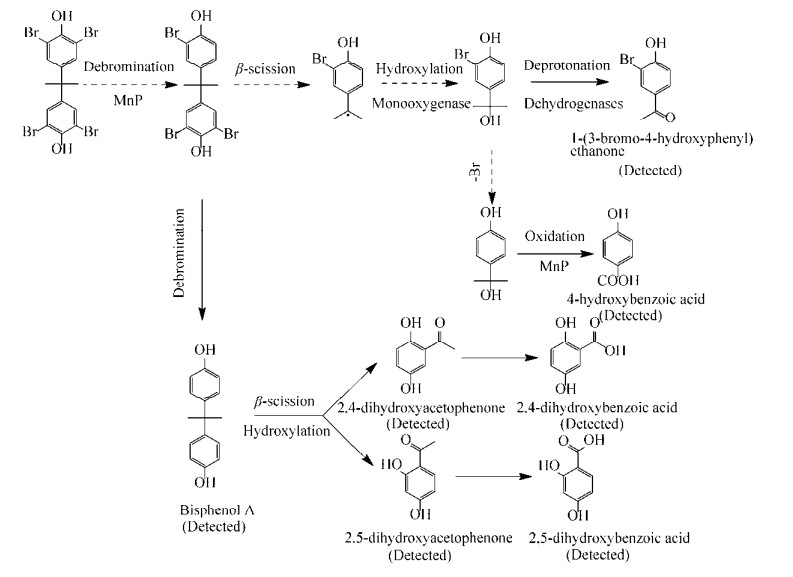
|
| 图 5 TBBPA的生物降解途径 Figure 5 The biodegradation pathway of TBBPA. |
3 讨论
共代谢是微生物降解有机污染物的一种重要方式, 共代谢基质的加入能够促进菌体的生长及降解酶的合成, 从而有利于难降解有机污染物的降解。葡萄糖、丙酮酸钠、柠檬酸钠和酵母粉均是易被微生物利用的共代谢基质, 相关研究表明这四种共代谢基质在其适宜浓度下均能不同程度地促进微生物对有机污染物的降解[1, 25]。本文的实验结果表明, 在不添加任何共代谢基质的降解体系中TBBPA的降解率为59.0%, 而添加了葡萄糖、丙酮酸钠和柠檬酸钠均能促进I. lacteus F17的生长及其对TBBPA的生物降解, 其中葡萄糖和丙酮酸钠能显著提高I. lacteus F17对TBBPA的降解效率, 且葡萄糖对I. lacteus F17的生长促进效果更明显。这一结果表明I. lacteus F17可以通过共代谢的方式更有效地降解TBBPA。而酵母粉的加入虽能促进I. lacteus F17的生长, 但却导致该菌对TBBPA生物降解能力的降低, 这可能是因为酵母粉中含有丰富的营养物质, 除了能为菌体生长提供碳源以外还能提供丰富的氮源, 而唐文忠[26]研究发现, I. lacteus F17在限氮条件下更有利于MnP的合成, 对刚果红染料表现出更好的脱色及降解能力。因此酵母粉不适宜作为I. lacteus F17的共代谢物。综上所述, 选择葡萄糖作为I. lacteus F17降解TBBPA的共代谢基质更合适。
污染物初始浓度、微生物接种量和体系pH值是影响污染物降解的重要因素。实验结果表明, 在一定条件下TBBPA浓度过高会影响其降解效果, 因为过高浓度的TBBPA可能会对菌体造成一定的毒害作用, 抑制菌体的生长和酶的分泌, 因此污染物的适宜浓度也是决定降解效果的重要因素之一。刘俊等[22]研究了I. lacteus F17对水相中菲和蒽的降解, 结果表明当菲和蒽的初始浓度为5 mg/L时, 降解率较高。Chen等[17]用黄孢原毛平革菌降解TBBPA, 其最佳降解浓度也为5 mg/L, 均与本文的实验结果相一致。Peng等[11]研究了丛毛单胞菌属对TBBPA的降解, 当其初始浓度为5 mg/L时降解率为70.2%, 而本实验中用I. lacteus F17降解5 mg/L的TBBPA, 降解率可达78.4%。因此I. lacteus F17对TBBPA的生物降解能力不亚于某些细菌。
微生物接种量是影响有机污染物生物降解的重要因素。微生物接种量过低时, 菌体生长速度缓慢且生物量少, 进而影响产酶量, 导致降解率偏低。而微生物接种量过高时, 菌体可能产生对营养物的竞争, 影响酶的合成。因此, 适宜的接种量是影响降解效果的重要因素, 这也是每一批实验在温度、pH、TBBPA初始浓度等条件相同的情况下降解率出现差异的主要原因。在本实验中发现, I. lacteus F17降解TBBPA的最适接种量为5%。
降解体系的初始pH会影响微生物对营养物质的吸收和转运, 影响胞外酶的分泌及活性。研究表明, I. lacteus F17在pH 4.0-8.0时对菲和蒽共存体系具有较好的降解效果[22]。在本实验中, pH 3.0时, 由于体系酸性过大, 影响I. lacteus F17的生长和生物酶的活性, 从而导致TBBPA的生物降解率较低, 仅为42.2%。然而, 初始pH在4.0-8.0范围内时, TBBPA的生物降解率普遍较高, 降解率均达到70%以上, 同时也表明I. lacteus F17可以在较宽的pH范围内有效降解TBBPA。由于I. lacteus F17在弱酸性环境中生长更好[22], 因此本实验选择pH 5.0作为I. lacteus F17降解TBBPA的最适pH。
白腐真菌因其独特而强大的木质素降解酶系而对多种芳香烃化合物表现出广谱的降解能力, Zhao等[24]的研究表明, I. lacteus F17在染料脱色及降解体系中以MnP为主要的降解酶。为了尽可能地检测到较多的降解中间产物, 更准确地分析TBBPA的代谢途径, 在研究降解过程中MnP活力变化的实验以及产物分析实验中, 选择了较高初始浓度的TBBPA (20 mg/L)。结果表明MnP活力在第8天之前较低, 但在第10天时呈现出显著的增大, 酶活达到15.1 U/L, 随后MnP活力开始略有下降, 这可能是因为采取平行实验的过程中, 每个降解体系中即使接种量相同, 但体系中真菌的细胞密度并不能完全一致, 从而导致每个降解体系中真菌的生物量与其分泌的酶活力不尽相同, 因此造成了这种随着降解时间增加MnP酶活力反而下降的现象。结合降解过程中TBBPA降解率和脱溴率的变化不难发现, 当MnP活力处于最高水平时, TBBPA的降解率和脱溴率也达到最高, 随着MnP活力的下降, 降解率略有降低, 脱溴率无显著变化, 这一实验结果表明, I. lacteus F17所合成的MnP的活力影响着TBBPA的生物降解效果。MnP是一种含亚铁血红素的过氧化物酶, 据报道MnP对Mn2+有依赖性, Mn2+是MnP在氧化还原反应中的电子供体, 并且Mn2+的浓度会影响MnP的产量[27], 因此可通过外加适量的Mn2+来提高MnP的活性, 从而提高TBBPA的生物降解率。此外, 环境温度和pH值也是影响酶活性变化的重要因素, 因此也可通过实验来确定I. lacteus F17的最适产酶温度和pH, 从而提高TBBPA的生物降解率。在优化的降解条件下, I. lacteus F17对20 mg/L TBBPA的降解率最高可达到85.5%。Chen等[17]研究了黄孢原毛平革菌(白腐真菌)对TBBPA的降解, 当TBBPA初始浓度为20 mg/L时降解率为85.7%, 刘莉莉等[15]使用甲基杆菌(细菌)降解20 mg/L TBBPA时降解率仅为30.12%, 因此白腐真菌在降解TBBPA方面具有很大的应用潜力, 可扩大阻燃剂污染环境的生物治理中可利用的微生物资源。
An等[12]研究发现TBBPA在苍白杆菌属的作用下通过裂解、脱溴、脱氢和氧化同时实现还原脱溴与好氧矿化而生成了小分子化合物。万博等[26]利用铜绿假单胞菌NY3好氧降解TBBPA, 发现降解过程中主要发生了脱溴、羟基化、开环和脱羧等反应。本文通过对TBBPA生物降解中间产物的分析, 推测出I. lacteus F17对TBBPA的生物降解主要是通过脱溴、β-断裂、羟基化、去质子和氧化等过程实现的, 其中产物1-(3-溴-4-羟基)苯乙酮在文献中鲜有报道, 并推测出它是由3, 3ʹ, 5-三溴双酚A依次经过β-断裂、羟基化、去质子而生成的。
4 结论对I. lacteus F17好氧降解TBBPA的特性进行了较为详细的研究, I. lacteus F17可以通过共代谢方式实现对TBBPA更有效的降解, 最适共代谢基质为葡萄糖, 且在pH 4.0-8.0范围内均能较好地降解TBBPA。通过单因素优化确定了I. lacteus F17好氧降解TBBPA的最优条件:葡萄糖8 g/L, TBBPA初始浓度5 mg/L, 菌悬液接种量5%, pH 5.0。在上述优化条件下对20 mg/L TBBPA的降解率最高可达85.5%, 比优化之前提高了26.5%。GC-MS分析表明, TBBPA在生物降解过程中经过脱溴、β-断裂、羟基化、去质子和氧化等反应, 通过检测到的7种中间产物1-(3-溴-4-羟基)苯乙酮、对羟基苯甲酸、双酚A、2, 5-二羟基苯乙酮、2, 5-二羟基苯甲酸、2, 4-二羟基苯乙酮和2, 4-二羟基苯甲酸, 推测出在I. lacteus F17降解TBBPA的过程中可能涉及两条同时进行的途径。
| [1] |
Fan ZZ, Wang J, Liu SS, Zhou JT. Aerobic degradation characteristics of tetrabromobisphenol A by Pseudomonas. Chinese Journal of Environmental Engineering, 2014, 8(6): 2597-2604.
(in Chinese) 范真真, 王竞, 刘沙沙, 周集体. 假单胞菌好氧降解四溴双酚A的特性. 环境工程学报, 2014, 8(6): 2597-2604. |
| [2] |
Chen YM, Song ZH. Research advances in environmental remediation technologies for tetrabromobisphenol A. Environmental Science and Management, 2016, 41(8): 90-94.
(in Chinese) 陈雨萌, 宋志慧. 环境中四溴双酚A降解技术的进展研究. 环境科学与管理, 2016, 41(8): 90-94. DOI:10.3969/j.issn.1673-1212.2016.08.023 |
| [3] |
Yan MY, Pang ZH, Li XM, Chen JY, Li JS. Progress on degradation technology of tetrabromobisphenol A. Environmental Science & Technology, 2013, 36(4): 49-54.
(in Chinese) 闫梦玥, 庞志华, 李小明, 谌建宇, 黎京士. 四溴双酚A降解技术的最新研究进展. 环境科学与技术, 2013, 36(4): 49-54. DOI:10.3969/j.issn.1003-6504.2013.04.011 |
| [4] | Liu K, Li J, Yan SJ, Zhang W, Li YJ, Han D. A review of status of tetrabromobisphenol A (TBBPA) in China. Chemosphere, 2016, 148: 8-20. DOI:10.1016/j.chemosphere.2016.01.023 |
| [5] | Malkoske T, Tang YL, Xu WY, Yu SL, Wang HT. A review of the environmental distribution, fate, and control of tetrabromobisphenol A released from sources. Science of the Total Environment, 2016, 569/570: 1608-1617. DOI:10.1016/j.scitotenv.2016.06.062 |
| [6] |
Ning ML, Hu JJ, Lu LR, Cai YW, Li GY, An TC. Toxicity mechanism of tetrabromobisphenol A to human respiratory system cells 16HBE and Beas2B. Chinese Science Bulletin, 2020, 65(10): 931-939.
(in Chinese) 宁美霖, 胡俊杰, 卢莉蓉, 蔡仪威, 李桂英, 安太成. 四溴双酚A对人体呼吸系统细胞16HBE和Beas2B的接触暴露毒性机制. 科学通报, 2020, 65(10): 931-939. |
| [7] |
Zhang J, Yu SL, Tang YL, Zhang YH. Research progresses on toxicity and removal technology of Tetrabromobisphenol A in water. Water Technology, 2016, 10(1): 1-6.
(in Chinese) 张均, 于水利, 唐玉霖, 张运海. 水源水中四溴双酚-A的毒性特征与去除技术研究进展. 供水技术, 2016, 10(1): 1-6. DOI:10.3969/j.issn.1673-9353.2016.01.001 |
| [8] |
Wang YM, Wang YL. Research progress on tetrabrombisphenol A(TBBPA). Environmental Engineering, 2016, 34(4): 1-5, 11.
(in Chinese) 王彦民, 王娅丽. 溴代阻燃剂TBBPA最新研究进展. 环境工程, 2016, 34(4): 1-5, 11. |
| [9] | Jiang YC, Lu HL, Xia K, Wang Q, Yang JJ, Hong HL, Liu JC, Yan CL. Effect of mangrove species on removal of tetrabromobisphenol A from contaminated sediments. Chemosphere, 2020, 244: 125385. DOI:10.1016/j.chemosphere.2019.125385 |
| [10] |
Chen YW, Fan MJ, Sun JY, Shen SB. Study on the anaerobic co-metabolic biodegradation of tetrabromobisphenol A. China Environmental Science, 2018, 38(4): 1459-1465.
(in Chinese) 陈英文, 范梦婕, 孙靖云, 沈树宝. 四溴双酚A厌氧共代谢降解性能研究. 中国环境科学, 2018, 38(4): 1459-1465. |
| [11] | Peng XX, Zhang ZL, Luo WS, Jia XS. Biodegradation of tetrabromobisphenol A by a novel Comamonas sp. strain, JXS-2-02, isolated from anaerobic sludge. Bioresource Technology, 2013, 128: 173-179. DOI:10.1016/j.biortech.2012.10.051 |
| [12] | An TC, Zu L, Li GY, Wan SG, Mai BX, Wong PK. One-step process for debromination and aerobic mineralization of tetrabromobisphenol-A by a novel Ochrobactrum sp. T isolated from an e-waste recycling site. Bioresource Technology, 2011, 102(19): 9148-9154. DOI:10.1016/j.biortech.2011.06.080 |
| [13] | Ren L, Jia Y, Ruth N, Shi YH, Wang JH, Qiao C, Yan YC. Biotransformations of bisphenols mediated by a novel Arthrobacter sp. strain YC-RL1. Applied Microbiology and Biotechnology, 2016, 100(4): 1967-1976. DOI:10.1007/s00253-015-7076-1 |
| [14] | Ma YN, Zhao YY, Wang YF, Li XZ, Sun FF, Corvini PFX, Ji R. Effects of Cu2+ and humic acids on degradation and fate of TBBPA in pure culture of Pseudomonas sp. strain CDT. Journal of Environmental Sciences, 2017, 62: 60-67. DOI:10.1016/j.jes.2017.07.012 |
| [15] |
Liu LL, Wang XX, Chen X, Zhou CC, Tang Z, Lin S. Studies on aerobic degradation mechanism of tetrabromobisphenol A and functional enzymes of Methylobacterium sp. TP-1. Acta Scientiae Circumstantiae, 2018, 38(11): 4250-4258.
(in Chinese) 刘莉莉, 汪烯烯, 陈鑫, 周纯淳, 唐周, 林森. Methylobacterium sp.TP-1好氧降解四溴双酚A机理及其功能酶研究. 环境科学学报, 2018, 38(11): 4250-4258. |
| [16] | Uhnáková B, Ludwig R, Pěknicová J, Homolka L, Lisá L, Šulc M, Petříčková A, Elzeinová F, Pelantová H, Monti D, Křen V, Haltrich D, Martínková L. Biodegradation of tetrabromobisphenol A by oxidases in basidiomycetous fungi and estrogenic activity of the biotransformation products. Bioresource Technology, 2011, 102(20): 9409-9415. DOI:10.1016/j.biortech.2011.07.036 |
| [17] | Chen ZH, Yin H, Peng H, Lu GN, Liu ZH, Dang Z. Identification of novel pathways for biotransformation of tetrabromobisphenol A by Phanerochaete chrysosporium, combined with mechanism analysis at proteome level. Science of the Total Environment, 2019, 659: 1352-1361. DOI:10.1016/j.scitotenv.2018.12.446 |
| [18] | Yao MW, Li WM, Duan ZH, Zhang YL, Jia R. Genome sequence of the white-rot fungus Irpex lacteus F17, a type strain of lignin degrader fungus. Standards in Genomic Sciences, 2017, 12(1): 1-6. DOI:10.1186/s40793-016-0218-y |
| [19] | Duan ZH, Shen R, Liu BJ, Yao MW, Jia R. Comprehensive investigation of a dye-decolorizing peroxidase and a manganese peroxidase from Irpex lacteus F17, a lignin-degrading basidiomycete. AMB Express, 2018, 8(1): 119. DOI:10.1186/s13568-018-0648-6 |
| [20] | Chen WT, Zheng LL, Jia R, Wang N. Cloning and expression of a new manganese peroxidase from Irpex lacteus F17 and its application in decolorization of reactive black 5. Process Biochemistry, 2015, 50(11): 1748-1759. DOI:10.1016/j.procbio.2015.07.009 |
| [21] | Yang XT, Zheng JZ, Lu YM, Jia R. Degradation and detoxification of the triphenylmethane dye malachite green catalyzed by crude manganese peroxidase from Irpex lacteus F17. Environmental Science and Pollution Research, 2016, 23(10): 9585-9597. DOI:10.1007/s11356-016-6164-9 |
| [22] |
Liu J, Wu J. Selective degradation of coexisting phenanthrene and anthracene by Irpex lacteus F17. Acta Microbiologica Sinica, 2019, 59(5): 916-925.
(in Chinese) 刘俊, 吴涓. 乳白耙齿菌F17对共存菲、蒽的降解差异性. 微生物学报, 2019, 59(5): 916-925. |
| [23] |
Wu J, Liu J, Chen J. Degradation of single and mixed PAHs by Irpex lacteus F17. Acta Microbiologica Sinica, 2020, 60(12): 2734-2746.
(in Chinese) 吴涓, 刘俊, 陈婕. 乳白耙齿菌F17对单一和复合多环芳烃的降解差异解析. 微生物学报, 2020, 60(12): 2734-2746. |
| [24] | Zhao XS, Huang XJ, Yao JT, Zhou Y, Jia R. Fungal growth and manganese peroxidase production in a deep tray solid-state bioreactor, and in vitro decolorization of poly R-478 by MnP. Journal of Microbiology and Biotechnology, 2015, 25(6): 803-813. DOI:10.4014/jmb.1410.10054 |
| [25] |
Wan B, Nie MQ, Qi HX, Nie HY, Wang XD, Chen R, Feng HM. Study on the characteristic features of the aerobic biodegradation of tetrabromobisphenol A by Pseudomonas aeruginosa NY3. Journal of Safety and Environment, 2016, 16(5): 196-200.
(in Chinese) 万博, 聂麦茜, 齐慧霞, 聂红云, 王小豆, 陈锐, 冯红梅. 铜绿假单胞菌NY3好氧降解四溴双酚A的特性研究. 安全与环境学报, 2016, 16(5): 196-200. |
| [26] |
Tang WZ, Jia R, Cheng XB, Li XD. Study on the decolorization of Congo red by Schizophyllum sp. F17 and its degradation enzymes. Journal of Biology, 2007, 24(4): 24-28.
(in Chinese) 唐文忠, 荚荣, 程晓滨, 李旭东. 裂褶菌F17对刚果红的脱色及主要降解酶的研究. 生物学杂志, 2007, 24(4): 24-28. DOI:10.3969/j.issn.2095-1736.2007.04.007 |
| [27] |
Wang B, Wang Y, Zhou XY, Lu GY. Study advance of manganese peroxidase(MnP). Guangxi & Development of Chemical Industry, 2005, 34(4): 28-31.
(in Chinese) 王蓓, 王圆, 周晓云, 芦国营. 锰过氧化物酶(MnP)的研究进展. 化工技术与开发, 2005, 34(4): 28-31. DOI:10.3969/j.issn.1671-9905.2005.04.010 |
 2021, Vol. 61
2021, Vol. 61




