中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 朱伟峰, 陈露, 王芳, 胡波, 陈萌萌. 2021
- Weifeng Zhu, Lu Chen, Fang Wang, Bo Hu, Mengmeng Chen. 2021
- 巴氏杆菌糖酵解酶的黏附作用研究
- The adhesion activity of Pasteurella glycolytic enzymes
- 微生物学报, 61(10): 3264-3275
- Acta Microbiologica Sinica, 61(10): 3264-3275
-
文章历史
- 收稿日期:2021-01-11
- 修回日期:2021-04-24
- 网络出版日期:2021-06-22
2. 农业部兽用生物制品工程技术重点实验室, 江苏 南京 210014;
3. 国家兽用生物制品工程技术研究中心, 江苏 南京 210014
2. Key Laboratory of Veterinary Biological Engineering and Technology, Ministry of Agriculture, Nanjing 210014, Jiangsu Province, China;
3. National Center for Engineering Research of Veterinary Bio-products, Nanjing 210014, Jiangsu Province, China
巴氏杆菌病(pasteurellosis)是主要由多杀性巴氏杆菌(Pasteurella multocida)引起的多种畜禽、野生动物和人类的一种传染病的总称。巴氏杆菌病呈地方流行性和特征,会造成动物死亡或影响其生长、降低饲料报酬,给畜禽养殖业带来较大经济损失[1-2]。巴氏杆菌病因发病程度和感染动物不同而有不同的病名,如猪肺疫、猪进行性萎缩性鼻炎、禽霍乱、牛出血性败血症、兔巴氏杆菌病(兔出败)等,其中多数疫病被我国政府列为二类动物疫病[3]。近年来巴氏杆菌在多种动物中的临床分离或检出率都位居前列[4-6]。多杀性巴氏杆菌同样可以造成人类感染发病,是一种人兽共患病病原体[1-2]。
尽管目前已经报道了部分巴氏杆菌致病机制及可能的毒力因子,但是巴氏杆菌的致病机制依然还不完全清楚[7-8]。部分致病性细菌的致病机制中包括兼职功能蛋白的致病作用,即代谢相关蛋白质/酶或分子伴侣发挥了致病作用。这些兼职致病作用中研究得最多的是黏附作用,包括对宿主细胞的黏附和对宿主分子(如纤连蛋白和血浆纤维蛋白溶解酶原)的黏附[9-11]。负责糖酵解代谢途径的各个酶是研究得最多的兼职毒力因子。但是目前关于巴氏杆菌糖酵解酶黏附作用的研究还很少。我们的一项前期工作已经提示至少一种糖酵解酶可能在巴氏杆菌黏附宿主的过程中发挥作用[8]。本研究的目的是进一步研究巴氏杆菌糖酵解酶全部9个成员对宿主分子及宿主细胞的黏附作用。
1 材料和方法 1.1 菌株和细胞系及培养条件本研究使用的多杀性巴氏杆菌C51-17株、大肠杆菌BL21(DE3)、兔肾传代细胞RK13均由本实验室保存提供。C51-17株使用胰蛋白胨大豆肉汤培养基(tryptose soya agar,TSB)或者大豆酪蛋白琼脂培养基(trypticase soy broth,TSA)(海博,青岛),加入10%新生牛血清(Gbico),于37 ℃摇床或培养箱培养。大肠杆菌载体菌使用Luria-Bertani (LB)固体或液体培养基(海博,青岛),加入相应抗生素(氨苄或卡那霉素)进行培养。对重组菌使用自诱导培养基(海博,青岛)或者LB添加不同浓度异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)在不同温度条件下进行诱导。RK13细胞使用Dulbecco’s Modified Eagle Medium (DMEM)培养基(Gbico)添加10%胎牛血清(Gbico)进行培养。
1.2 九个糖酵解途径酶的克隆、表达和纯化以多杀性巴氏杆菌C51-17菌株的全基因组序列(ASM428695v1)设计9个糖酵解酶:磷酸葡萄糖异构酶(phosophoglucose isomerase,PGI)、磷酸果糖激酶(phosphofructokinase,PFK)、醛缩酶(aldolase,ALD)、丙糖磷酸异构酶(triose phosphate isomerase,TPI)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3- phosphate dehydrogenase,GAPDH)、磷酸甘油激酶(phosphoglycerate kinase,PGK)、磷酸甘油酸变位酶(phosphoglycerate mutase,PGM)、烯醇化酶(enolase,ENO)、丙酮酸激酶(pyruvate kinase,PYK)的克隆引物(表 1)。按照文献[5]提取C51-17菌株基因组并进行PCR扩增。扩增产物送南京擎科生物有限公司进行序列测定,确定目的片段序列正确后进行后续操作。酶切质粒并通过同源重组克隆试剂盒(诺唯赞,南京)将目的片段的PCR扩增片段连接到质粒上,将阳性重组质粒转化BL21感受态细胞。经PCR鉴定后,将阳性克隆送南京擎科生物科技有限公司测序。然后进行诱导表达,首先使用自诱导培养基于37 ℃进行诱导。在上述方法效果不理想时使用LB加入不同浓度IPTG于不同浓度下进行诱导的方法。诱导条件确定后,进行扩大培养,收集菌体后,按镍柱纯化方法加入适量含20 mmol/L咪唑的His结合缓冲液,冰浴超声后,4 ℃、15000 r/min离心10 min分离上清和沉淀,进行后续纯化。镍柱(GE Healthcare,Little Chalfont,UK)纯化按说明书进行操作。采用梯度洗脱法确定蛋白最佳洗脱方案。再经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)并显色后检测纯化效果。最佳洗脱方案确定后进行集中纯化,再次检测纯化效果。
| Name | Sequence (5′→3′) | Protein |
| PGI-F | cagcaaatgggtcgcggatccATGAAAAACATCAATCCTACAACAACA | PGI |
| PGI-R | gcaagcttgtcgacggagctcACGCCATTGTTTATATTGGTTAATTAA | |
| PFK-F | cagcaaatgggtcgcggatccATGATAAAAAAAATAGCAGTATTAACCAGT | PFK |
| PFK-R | gcaagcttgtcgacggagctcGTCTAAACGTTTCGATAATGCTAACC | |
| ALD-F | cagcaaatgggtcgcggatccATGACAGAACTCGAACAAAAAAAAGA | ALD |
| ALD-R | gcaagcttgtcgacggagctcTTTTCCCCTCTTTTCGAGATCTT | |
| TPI-F | cagcaaatgggtcgcggatccATGGCTCGTCGTCCTTTAGTTATG | TPI |
| TPI-R | gcaagcttgtcgacggagctcGTTTTTTGCTTTTGCTGCGG | |
| GAPDH-F | gccatggctgatatcggatccATGGCAATTAAAATTGGTATCAACG | GAPDH |
| GAPDH-R | gcaagcttgtcgacggagctcACCTTTGTAGTTATAAACGTGTGCG | |
| PGK-F | cagcaaatgggtcgcggatccATGTCAGTAATCAAAATGACAGACTTGG | PGK |
| PGK-R | gcaagcttgtcgacggagctcACCATTTGCACGTTTTTCTAAGATT | |
| PGM-F | cagcaaatgggtcgcggatccATGGAATTGGTCTTTATTCGCC | PGM |
| PGM-R | gcaagcttgtcgacggagctcAAGGTAGTATTTTTCCACGACTTTTAAA | |
| ENO-F | cagcaaatgggtcgcggatccATGGCAAAAATCGTTAAAGTGATCG | ENO |
| ENO-R | gcaagcttgtcgacggagctcTGCTTGACCTTTAACCGCTTTT | |
| PYK-F | cagcaaatgggtcgcggatccATGTCTAGAAGACTAAGAAGAACGAAGATT | PYK |
| PYK-R | gcaagcttgtcgacggagctcTTCTACAACTAGTGTACGGCAAGTATTT |
1.3 多克隆抗体的制备
采购6-8周龄ICR雌鼠进行随机分组,每组5只。首次免疫采用等体积弗氏完全佐剂(Sigma)与100 µg/50 µL纯化的重组蛋白乳化后,腹腔注射,每只100 µL;14 d后,以等体积弗氏不完全佐剂(Sigma)与100 µg/50 µL纯化的重组蛋白乳化后,皮下注射。第二次免疫10 d后采集制备血清并用蛋白A抗体纯化试剂盒(金斯瑞)纯化出血清中的多克隆抗体。采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)方法[12]检测并比较各蛋白与其多克隆抗体的结合情况。以纯化的糖酵解酶重组蛋白包被ELISA板(0.2 μg/孔),37 ℃孵育2 h。使用5%的脱脂乳于封闭后加入1/200稀释的对应糖酵解酶多克隆抗体(孵育免疫前血清抗体为对照),37 ℃孵育1 h。以PBST洗涤3遍以后,37 ℃孵育偶联HRP的羊抗鼠二抗30 min。经过彻底洗涤以后加入100 μL的3, 3′, 5, 5′-四甲基联苯胺(3, 3′, 5, 5′-tetramethylbenzidine,TMB)单组分显色液(湖州英创),反应10 min后加入50 μL终止液(2 mmol/L硫酸)。最后在酶标仪上读取450 nm的吸光度。
1.4 糖酵解酶在巴氏杆菌菌体表面存在情况测定参考先前的文献报道[13]。将过夜培养的C51-17菌株离心收集后,用PBS重新混匀再离心,重复2-3次。以等体积磷酸缓冲盐溶液(phosphate buffer saline,PBS)重悬,涂布于多孔载玻片。将载玻片风干,然后在-20 ℃下在100%甲醇中固定10 min,PBS轻缓洗涤3遍。用各重组蛋白的抗血清IgG (1:100)孵育载玻片,并以免疫前的小鼠血清IgG为阴性对照,室温孵育30 min。PBS轻缓洗涤3次,用Cy3标记的山羊抗小鼠IgG(H+L) (KPL,美国)再次孵育。最后洗涤后,用荧光显微镜(Zeiss,德国)检查所有载玻片。
1.5 兔肾细胞黏附实验参照文献[11, 14]进行实验。传代兔肾细胞RK13在24孔板长至合适密度(70%-80%),固定并经牛血清白蛋白(bovine albumin,BSA)封闭后加入重组糖酵解酶蛋白进行孵育(对照孔加入BSA),200 µg/孔,37 ℃孵育2 h。无菌PBS轻缓洗涤3次,加入纯化的重组蛋白多克隆血清的IgG (1:100稀释),37 ℃作用1 h。PBS洗涤后,加入二抗(Cy3标记的山羊抗小鼠IgG),37 ℃作用1 h后PBS洗涤。使用4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole,DAPI)对细胞核染色。彻底洗涤后,使用荧光显微镜对样品进行观察及拍照。
1.6 抗体封闭黏附抑制实验参照文献[14]进行实验。在24孔板内加入细胞爬片(WHB卧宏生物),兔肾细胞长至合适密度(70%-80%),PBS洗涤后以4%组织细胞固定液(Solarbio)固定。PBS洗涤3次,加入1% BSA于4 ℃过夜封闭。将过夜培养的C51-17离心收集并用PBS洗涤2-3次,以等体积PBS重悬。分成等份,各组分别加入一种纯化的重组蛋白多克隆抗体(1:100稀释) (免疫前血清纯化的IgG抗体和康复血清纯化IgG抗体分别作为阴阳对照),37 ℃孵育1 h。孵育结束后,按照细菌: 细胞=10:1比例加入到经洗涤后的细胞板中,37 ℃孵育1 h。彻底洗涤后,先后孵育巴氏杆菌感染小鼠康复血和Cy3标记的山羊抗小鼠IgG抗体。最后使用DAPI染核3-5 min,洗涤后封片,采用倒置荧光显微镜进行镜检,计数100个细胞上的细菌数量。相对结合活性=实验组细菌数量/阴性对照组细菌数量×100%。
1.7 纤维连接蛋白(Fn)和血浆纤维溶解酶原(Plg)结合活性检测参照文献[11, 14]进行Far Western blotting实验。首先进行巴氏杆菌重组糖酵解酶重组蛋白的SDS-PAGE,约10 µg/泳道,同时以红斑丹毒丝菌SpaA重组蛋白为阳性对照,红斑丹毒丝菌HP1472重组蛋白为阴性对照[15]。电泳结束后将蛋白转印到NC膜上。5%脱脂乳封闭,4 ℃过夜。加入10 µg/mL人源Fn或Plg (Sigma),37 ℃孵育2 h。漂洗5遍后,分别加入1/1000稀释的兔抗人Fn抗体和兔抗人Plg抗体,37 ℃孵育1 h。漂洗后加入HRP偶联的羊抗兔IgG作为二抗,37 ℃孵育1 h;最后,将洗涤后的膜用ECL显色试剂盒(诺唯赞,南京)在化学发光成像系统(天能,上海)中显色。
1.8 多杀性巴氏杆菌对Plg和Fn的结合活性的抑制试验参照文献[8, 13]所述进行抑制试验,稍作修改。将多杀性巴氏杆菌(108 CFU/孔)进行包被和封闭。然后加入重组糖酵解酶多克隆抗体(1/10稀释)或免疫前血清抗体(对照组,1/10稀释)在37 ℃孵育0.5 h。PBS洗涤3次后,加入Plg (10 µg/ mL)或Fn (10 µg/ mL) 37 ℃孵育2 h。洗涤数次后,使用兔抗Plg的IgG (1/2000)和兔抗Fn的IgG (1/1000)作为一抗,37 ℃作用1 h。使用HRP偶联的山羊抗兔IgG作为二抗孵育,洗涤后,加入100 µL/每孔TMB显色液,室温避光反应10 min后,加入终止反应液。在酶标仪上读取450 nm的吸光度。相对结合活性=实验组OD450/阴性对照组OD450×100%
1.9 数据处理与统计学检验实验数据均使用平均值(means)±标准差(standard deviation,SD)来表示。用T检验检测实验组和对照组的统计学差异,P < 0.05视为差异显著的标准。
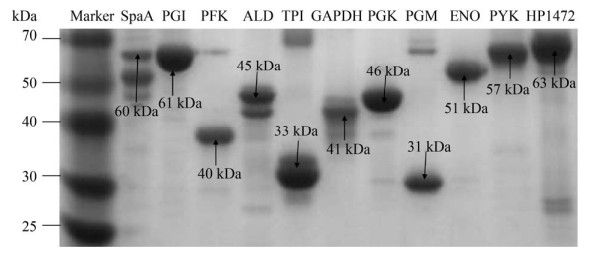
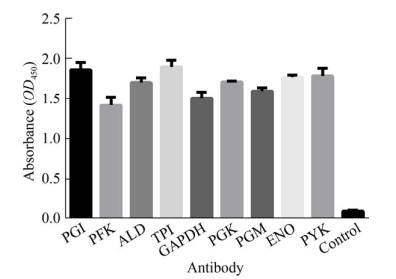
2 结果和分析 2.1 糖酵解酶的克隆、表达、纯化及多克隆抗体制备通过构建重组质粒和诱导表达,成功获得9个糖酵解酶的重组蛋白:PGI (~61 kDa)、PFK (~40 kDa)、ALD (~45 kDa)、TPI (~33 kDa)、GAPDH (~41 kDa)、PGK (~46 kDa)、PGM (~31 kDa)、ENO (~51 kDa)、PYK (~57 kDa)。9个糖酵解酶重组蛋白的上清表达如图 1所示。其中除了ALD使用PET32a载体表达外,其他8个糖酵解酶都使用PET28a载体表达。后面Far Western blotting实验中用作对照的猪丹毒丝菌的两个重组蛋白SpaA (~60 kDa)和HP1472 (~63 kDa)也一起展示在图 1中。经过2次免疫及蛋白A纯化后成功获得各个糖酵解酶重组蛋白的多克隆抗体(图 2)。由于不同组免疫前血清的检测结果极其相似(数值都非常低),为了使图 2更加简洁,我们在图中只展示了一个组(PGI组)免疫前血清的检测结果作为对照。除了PFK、GAPDH、PGM的抗体与自身蛋白结合能力稍弱外,其余糖酵解酶的多克隆抗体与自身蛋白的结合能力相近。
|
| 图 1 多杀性巴氏杆菌糖酵解酶的纯化 Figure 1 Purification of recombinant proteins of Pasteurella multocida glycolytic enzyme. |
|
| 图 2 糖酵解酶多克隆抗体与其重组蛋白结合活性的ELISA检测结果 Figure 2 ELISA results of binding activity between glycolytic enzyme polyclonal antibodies and their recombinant proteins. |
2.2 糖酵解酶在多杀性巴氏杆菌的表面分布测定
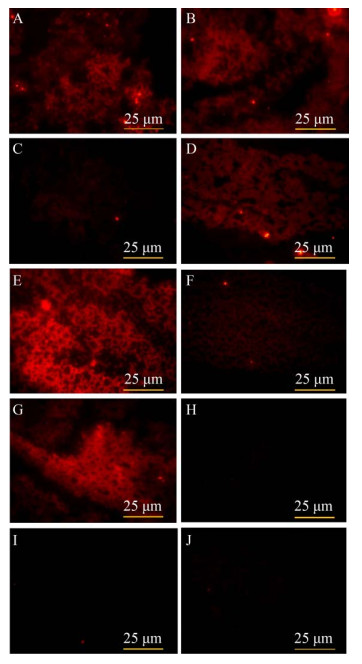
采用间接免疫荧光进行检测,发现经PGI、PFK、TPI、GAPDH、PGM的多克隆抗体孵育处理的玻片上出现成片明亮的红色区域,即这些组中巴氏杆菌菌体表面均可见明显的荧光(图 3)。ALD (图 3-C)和PGK (图 3-F)多克隆抗体孵育处理的玻片上只有暗淡的红色区域(呈单个存在的亮点为杂质),即巴氏杆菌菌体表面的荧光较弱。ENO (图 3-H)和PYK (图 3-I)多克隆抗体处理组的巴氏杆菌菌体表面则未见明显的荧光。这表明除ENO、PYK外其他7个糖酵解酶在巴氏杆菌菌体表面均存在。
|
| 图 3 多杀性巴氏杆菌菌体表面糖酵解酶存在情况的检测结果 Figure 3 Detection results of the existence of glycolytic enzymes on Pasteurella mutocida cell surface. A: PGI; B: PFK; C: ALD; D: TPI; E: GAPDH; F: PGK; G: PGM; H: ENO; I: PYK; J: Negative control. |
2.3 重组糖酵解酶对兔肾细胞的黏附实验
实验结果表明PGI、PFK、ALD、TPI、GAPDH、PGK、PGM重组蛋白孵育组能观察到细胞具有明显的红色荧光(Cy3标记的山羊抗小鼠IgG),ENO和PYK重组蛋白孵育组及阴性对照组则观察不到荧光。即PGI、PFK、ALD、TPI、GAPDH、PGK、PGM能够黏附兔肾细胞(图 4)。

|
| 图 4 重组巴氏杆菌糖酵解酶黏附兔肾细胞 Figure 4 The adhesion of recombinant Pasteurella glycolytic enzymes to rabbit kidney cells. A: PGI; B: PFK; C: ALD; D: TPI; E: GAPDH; F: PGK; G: PGM; H: ENO; I: PYK; J: Negative control. |
2.4 抗体封闭黏附抑制实验
结果显示,预孵育不同糖酵解酶多克隆抗体后PGI多克隆抗体能使多杀性巴氏杆菌的黏附率下降20%左右,差异显著(P=0.0257) (图 5)。但是预孵育其他糖酵解的多克隆抗体并不能显著降低多杀性巴氏杆菌的黏附率(P > 0.05)。

|
| 图 5 糖酵解酶抗体封闭抑制多杀性巴氏杆菌黏附兔肾细胞的实验结果 Figure 5 Glycolytic enzyme antibody block inhibition results of Pasteurella multocida adhesion to rabbit kidney cells. Relative adhesion activity= Number of adhered bacteria per cell in experiment group/Number of adhered bacteria per cell in control group. *: P < 0.05 in T test, and the difference is significant. |
2.5 Fn和Plg结合活性
检测Fn结合活性的Far Western blotting结果显示,各泳道也均存在符合预期的特异性条带(图 6-A)。检测Plg结合活性的Far Western blotting结果显示,在重组蛋白泳道上均存在与预期大小相符的条带(图 6-B)。即巴氏杆菌糖酵解酶均能够与Fn和Plg结合。

|
| 图 6 Far Western blotting检测多杀性巴氏杆菌重组糖酵解酶蛋白结合Fn和Plg的结果 Figure 6 Detection results of recombinant Pasteurella glycolytic enzymes binding to Fn and Plg by far Western blotting. A: recombinant glycolytic enzymes binding to Fn; B: recombinant glycolytic enzymes binding to Plg. |
2.6 多杀性巴氏杆菌对Plg和Fn结合活性的抑制试验
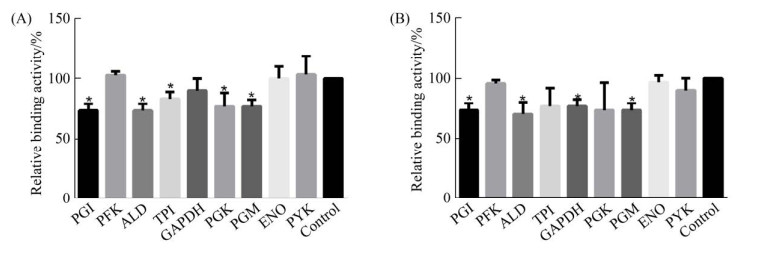
结果显示部分糖酵解酶的多克隆抗体能够抑制巴氏杆菌结合宿主的Plg和Fn。孵育PGI、ALD、TPI、PGK、PGM多克隆抗体后多杀性巴氏杆菌结合Fn的活性分别下降了约27%、27%、17%、23%、23% (图 7-A),差异显著(P < 0.05);孵育PGI、ALD、GAPDH、PGM多克隆抗体后多杀性巴氏杆菌结合Plg活性下降,分别下降了约27%、30%、23%、27% (图 7-B),差异显著(P < 0.05)。
|
| 图 7 糖酵解酶抗体封闭抑制多杀性巴氏杆菌结合Fn和Plg的实验结果 Figure 7 Glycolytic enzyme antibody block inhibition results of P. multocida binding Fn and plg. A: inhibition activity of P. multocida binding activity to Fn; B: inhibition activity of P. multocida binding activity to Plg. Relative binding activity=OD450 value of experiment group/OD450 value of experiment group. *: P < 0.05 in T test, and the difference is significant. |
3 讨论
糖酵解酶通常包括10个成员,本研究中对多杀性巴氏杆菌糖酵解酶的其中9个成员开展了研究,不包括己糖激酶。包括巴氏杆菌在内的许多原核微生物的营养物质运输方式中,除主动运输方式(营养物质不被修饰和改变)外,还存在基团转位这一吸收营养物质的途径。基团转位机制对葡萄糖、甘露糖和果糖等糖类分子进行运输时主要依靠磷酸转移酶系统(phosphotransferase system),因而糖分子被摄入到细菌内部时已被磷酸化,如葡萄糖已被转变为葡萄糖-6-磷酸[16-17]。因此,在这类原核微生物中不存在己糖激酶,巴氏杆菌全基因组序列[18]中也无法找到编码己糖激酶的基因序列,故本研究未对其己糖激酶进行研究。
本研究中经PGI、PFK、ALD、TPI、GAPDH、PGK、PGM的多克隆抗体及荧光二抗孵育后巴氏杆菌菌体表面出现了明显的荧光,这就表明这7个糖酵解成员在巴氏杆菌菌体表面都有存在。ELISA检测结果显示当糖酵解酶重组蛋白包被量相同时,除了PFK、GAPDH、PGM组反应稍弱外,各组反应水平相近。因而糖酵解酶菌体表面定位检测的部分结果,如ENO和PYK抗体处理组未见明显的荧光、ALD和PGK抗体处理组只见较弱的荧光,应该与抗体识别能力差异无关。荧光强度的差异反映了这些糖酵解酶在巴氏杆菌菌体表面存在量的差异。当这些本应出现在胞浆中的糖代谢酶出现在微生物表面时,这就意味着它们还发挥着其他功能[9],在病原菌中最常见的功能是黏附功能[11],因而本研究对这些糖酵解酶的黏附作用进行了研究。
多个糖酵解酶成员存在于巴氏杆菌菌体表面意味着巴氏杆菌具有在菌体外表面发生糖酵解代谢的潜在能力。我们目前还没有找到关于细菌菌体外表面发生糖代谢作用的报道。我们认为通常情况下巴氏杆菌菌体表面并不会出现糖代谢,因为如前文所述巴氏杆菌糖酵解代谢的底物从葡萄糖-6-磷酸开始[17],而环境中存在的葡萄糖通常不会磷酸化[19]。但是在一些特殊情况下如正在发生内化作用[20]时,巴氏杆菌进入宿主细胞内部,则细菌表面可能接触到宿主细胞内的葡萄糖-6-磷酸进而发生糖酵解代谢,最终增强自身的生命活动和致病作用。所以在以后的研究中应当进一步设计实验检测巴氏杆菌菌体表面是否能够发生糖酵解作用及其效率,并研究菌体表面糖代谢对细菌致病过程的促进作用。
重组蛋白对宿主细胞的黏附实验表明PGI、PFK、ALD、TPI、GAPDH、PGK、PGM能够黏附宿主细胞,巴氏杆菌黏附抑制实验中这些糖酵解酶多克隆抗体的孵育处理都能使巴氏杆菌相对黏附率的平均值不同程度降低。尽管部分糖酵解酶(如PFK)的多克隆抗体孵育后巴氏杆菌的相对黏附率平均值与PGI组基本相同甚至更低,但是他们的方差较高,T检验与对照组差异并不显著。所以为了严格起见,本研究仅认为PGI在巴氏杆菌黏附宿主细胞过程中发挥直接作用。
对常见黏附相关宿主分子的黏附与黏附抑制实验结果表明,有的糖酵解酶成员(PGI、PFK、ALD、TPI、GAPDH、PGK、PGM)在巴氏杆菌结合Plg或Fn等宿主分子中发挥作用。Plg和Fn都具有多个适于结合宿主分子的结构域,并且Fn还是细胞胞外基质的构成成分[21-22],因而这些分子的结合都将促进巴氏杆菌黏附宿主细胞,即这些糖酵解酶在巴氏杆菌黏附宿主细胞过程中间接发挥作用。已有的研究表明病原细菌可以利用宿主的血浆纤维蛋白溶解酶原/血浆纤维蛋白溶解酶来实现跨越宿主组织屏障迁移或者实现营养的利用[23],因而巴氏杆菌糖酵解酶的兼职致病作用应该不仅局限于黏附,应该还有更多的致病作用,需要进一步研究。
糖酵解酶对Fn和Plg结合活性的Far Western blotting检测结果(图 6)与其多克隆抗体的结合抑制实验结果(图 7)并不完全一致。这种不一致现象在其他的一些研究中也出现过[14, 24]。Western blotting是一种检测抗体和目的蛋白反应的技术,而Far Western blotting则是一种研究蛋白质相互作用的技术。在Far Western blotting中待检蛋白先经过SDS-PAGE和转印,封闭后再与已知蛋白(诱饵蛋白,如本研究的Fn和Plg)孵育,最后通过一抗和二抗检测已知蛋白的信号进而确定待检蛋白和已知蛋白的相互作用[25]。由于检测中待检蛋白都经过了变性处理,所以检测结果显示的是待检蛋白的一级结构与已知蛋白的相互作用,是一种潜能,与真实相互作用还有差距。
具有结合已知蛋白(如Fn或Plg)潜能的细菌蛋白(如糖酵解酶)是否能够介导细菌结合已知蛋白还受到两方面因素影响:第一,只有当细菌蛋白位于细菌菌体表面时才能介导细菌结合Fn或Plg。我们的研究显示ENO和PYK并不存在于巴氏杆菌菌体表面,所以尽管他们的Far Western blotting结果显示他们具有很好的Fn或Plg结合能力,但是他们无法介导巴氏杆菌结合Fn和Plg,其抗体也无法抑制这些结合。第二,细菌蛋白一级结构中只有部分位点参与结合已知蛋白[13],因而只有结合位点在菌体表面暴露程度高时才能有效介导细菌结合已知蛋白。这就要求结合位点在细菌蛋白折叠成高级结构时暴露在外面,且定位到细菌外膜后仍然暴露在外面。因而尽管本研究中某些糖酵解酶如ALD和TPI对Fn和Plg的结合作用相对较弱,但是其结合位点在巴氏杆菌菌体表面的暴露程度可能较高,所以其抗体依然有效抑制了巴氏杆菌结合Fn和Plg。
病原菌的兼职蛋白除了糖酵解酶外还包括其他代谢酶及分子伴侣,兼职蛋白的致病作用包括了感染的多个环节,如黏附宿主分子、侵入组织、免疫逃避、免疫调节[9-10, 26]等。本研究已经发现部分糖酵解酶(PGI、PFK、ALD、TPI、GAPDH、PGK、PGM)位于巴氏杆菌菌体表面,他们或者直接在巴氏杆菌黏附宿主细胞过程中发挥作用,或者通过黏附宿主Plg和Fn等分子的方式间接促进巴氏杆菌黏附宿主细胞。因而兼职蛋白可能在巴氏杆菌致病机制中发挥重要作用,但是目前关于兼职蛋白致病作用的研究还很少,未来有必要加强包括糖酵解酶在内的兼职蛋白在巴氏杆菌致病机制中作用的研究。这些研究结果将为巴氏杆菌致病机制带来新的认识,为防控动物巴氏杆菌病的药物研究和疫苗研究提供新的基础。
| [1] | 姚金水. 巴氏杆菌病//陈怀涛, 赵德明. 兽医病理学. 北京: 中国农业出版社, 2013. |
| [2] | Wilson BA, Ho M. Pasteurella multocida: from zoonosis to cellular microbiology. Clinical Microbiology Reviews, 2013, 26(3): 631-655. |
| [3] | 萧索. 农业部公告《一、二、三类动物疫病病种名录》. 农业知识, 2009(6): 9. |
| [4] |
Lin LS, Huang Q, Cai LJ, Ma JL, Yao HC, Pan ZH. Isolation and diversity analysis of bovine Pasteurella multocida. Acta Microbiologica Sinica, 2018, 58(12): 2240-2248.
(in Chinese) 林立山, 黄秦, 才灵杰, 马家乐, 姚火春, 潘子豪. 牛源多杀性巴氏杆菌的分离与初步鉴定. 微生物学报, 2018, 58(12): 2240-2248. |
| [5] | Zhu WF, Fan ZY, Qiu RL, Chen L, Wei HJ, Hu B, Chen MM, Wang F. Characterization of Pasteurella multocida isolates from rabbits in China. Veterinary Microbiology, 2020, 244: 108649. DOI:10.1016/j.vetmic.2020.108649 |
| [6] |
Guo L, Tang XB, Liu T, Dong C, Liu F, Yu HY, Wu B. Isolation, identification and epidemiological investigation of common bacterial epidemics in pigs in 2014. Animals Breeding and Feed, 2015(10): 1-3.
(in Chinese) 郭龙, 汤细彪, 刘田, 董超, 刘峰, 喻红艳, 吴斌. 2014年猪群常见细菌性疫病的分离鉴定与流行病学调查. 养殖与饲料, 2015(10): 1-3. DOI:10.3969/j.issn.1671-427X.2015.10.001 |
| [7] | Hatfaludi T, Al-Hasani K, Boyce JD, Adler B. Outer membrane proteins of Pasteurella multocida. Veterinary Microbiology, 2010, 144(1/2): 1-17. |
| [8] | Zhu WF, Wei HJ, Chen L, Qiu RL, Fan ZY, Hu B, Chen M, Wang F. Characterization of host plasminogen exploitation of Pasteurella multocida. Microbial Pathogenesis, 2019, 129: 74-77. DOI:10.1016/j.micpath.2019.01.044 |
| [9] | Henderson B, Martin A. Bacterial virulence in the moonlight: multitasking bacterial moonlighting proteins are virulence determinants in infectious disease. Infection and Immunity, 2011, 79(9): 3476-3491. |
| [10] | Kainulainen V, Korhonen T. Dancing to another tune-adhesive moonlighting proteins in bacteria. Biology, 2014, 3(1): 178-204. DOI:10.3390/biology3010178 |
| [11] | Zhu WF, Zhang Q, Li JT, Wei YM, Cai CZ, Liu L, Xu ZM, Jin ML. Glyceraldehyde-3-phosphate dehydrogenase Acts as an adhesin in Erysipelothrix rhusiopathiae adhesion to porcine endothelial cells and as a receptor in recruitment of host fibronectin and plasminogen. Veterinary Research, 2017, 48(1): 16. DOI:10.1186/s13567-017-0421-x |
| [12] | Zhu WF, Wu C, Kang C, Cai CZ, Wang Y, Li JT, Zhang Q, Sun XM, Jin ML. Evaluation of the protective efficacy of four newly identified surface proteins of Erysipelothrix rhusiopathiae. Vaccine, 2018, 36(52): 8079-8083. DOI:10.1016/j.vaccine.2018.10.071 |
| [13] | Zhu WF, Wang Y, Cai CZ, Li JT, Wu C, Kang C, Jin ML. Erysipelothrix rhusiopathiae recruits host plasminogen via the major protective antigen SpaA. FEMS Microbiology Letters, 2017, 364(5): fnx036. |
| [14] | Zhu WF, Cai CZ, Li JT, Zhang Q, Huang JJ, Jin ML. Characterization of protective antigen CbpB as an adhesin and a plasminogen-binding protein of Erysipelothrix rhusiopathiae. Research in Veterinary Science, 2019, 124: 352-356. DOI:10.1016/j.rvsc.2019.04.002 |
| [15] | Zhu WF, Cai CZ, Huang JJ, Liu L, Xu ZM, Sun XM, Jin ML. Characterization of pathogenic roles of two Erysipelothrix rhusiopathiae surface proteins. Microbial Pathogenesis, 2018, 114: 166-168. DOI:10.1016/j.micpath.2017.11.057 |
| [16] |
Wu T, Zhao JJ, Mao XJ. Effect of PTS modifications on L-tryptophan production in Escherichia coli. Chinese Journal of Biotechnology, 2017, 33(11): 1877-1882.
(in Chinese) 吴涛, 赵津津, 毛贤军. 大肠杆菌磷酸烯醇式丙酮酸-糖磷酸转移酶系统改造对产L-色氨酸的影响. 生物工程学报, 2017, 33(11): 1877-1882. |
| [17] | 曾巧英. 细菌的生长繁殖与生态//陆承平. 兽医微生物学. 北京: 中国农业出版社, 2012. |
| [18] | May BJ, Zhang Q, Li LL, Paustian ML, Whittam TS, Kapur V. Complete genomic sequence of Pasteurella multocida, Pm70. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(6): 3460-3465. DOI:10.1073/pnas.051634598 |
| [19] | 王镜岩, 秦咏梅. 六碳糖的分解和糖酵解作用//朱圣庚, 徐长法. 生物化学. 北京: 高等教育出版社, 2016. |
| [20] | 刘永杰. 细菌的感染与致病机理//陆承平. 兽医微生物学. 北京: 中国农业出版社, 2012. |
| [21] | Raymond BBA, Djordjevic S. Exploitation of plasmin(ogen) by bacterial pathogens of veterinary significance. Veterinary Microbiology, 2015, 178(1/2): 1-13. |
| [22] | Henderson B, Nair S, Pallas J, Williams MA. Fibronectin: a multidomain host adhesin targeted by bacterial fibronectin-binding proteins. FEMS Microbiology Reviews, 2011, 35(1): 147-200. |
| [23] | Lähteenmäki K, Edelman S, Korhonen TK. Bacterial metastasis: the host plasminogen system in bacterial invasion. Trends in Microbiology, 2005, 13(2): 79-85. DOI:10.1016/j.tim.2004.12.003 |
| [24] | Zhu WF, Cai CZ, Wang Y, Li JT, Wu C, Kang C, Sun XM, Jin ML. Characterization of roles of SpaA in Erysipelothrix rhusiopathiae adhesion to porcine endothelial cells. Microbial Pathogenesis, 2017, 113: 176-180. DOI:10.1016/j.micpath.2017.10.020 |
| [25] | Wu YL, Li Q, Chen XZ. Detecting protein-protein interactions by far western blotting. Nature Protocols, 2007, 2(12): 3278-3284. |
| [26] | Madureira P, Baptista M, Vieira M, Magalhães V, Camelo A, Oliveira L, Ribeiro A, Tavares D, Trieu-Cuot P, Vilanova M, Ferreira P. Streptococcus agalactiae GAPDH is a virulence-associated immunomodulatory protein. Journal of Immunology, 2007, 178(3): 1379-1387. |
 2021, Vol. 61
2021, Vol. 61




