中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 宋晶磊, 肖云杰, 杨海涛, 王泽方. 2021
- Jinglei Song, Yunjie Xiao, Haitao Yang, Zefang Wang. 2021
- 枯草芽孢杆菌疏水蛋白BslA的结构及应用
- The structure and application of Bacillus subtilis hydrophobin BslA
- 微生物学报, 61(10): 3035-3045
- Acta Microbiologica Sinica, 61(10): 3035-3045
-
文章历史
- 收稿日期:2021-01-05
- 修回日期:2021-05-05
- 网络出版日期:2021-06-17
疏水蛋白是一类具有特殊理化性质的小分子量蛋白质,是一种分泌型蛋白质,能够在亲疏水界面自组装成膜,从而反转界面性质[1]。真菌疏水蛋白广泛存在于子囊菌、担子菌、接合菌等高等真菌的气生菌丝或者子实体中,表达量较高且基因序列与真菌中已知其他蛋白质序列不同[2]。Wessels等将这种由真菌中提取出来的大小为10 kDa左右的蛋白命名为疏水蛋白,其命名原指此类蛋白中具有一定含量的疏水性氨基酸残基[3]。根据水缘性图谱和自组装蛋白的溶解情况,疏水蛋白被分为两类:易溶于过氧甲酸和三氟乙酸(TFA) 等有机溶剂且蛋白表面形成棒状的拓扑结构的被称为Ⅰ型疏水蛋白;易溶于2% SDS或者60%乙醇且蛋白表面缺乏棒状拓扑结构的被称为Ⅱ型疏水蛋白[4]。
疏水蛋白在真菌发育的不同时期表达并参与不同生命过程的调控。例如,在真菌孢子和子实体刚开始形成时,疏水蛋白附着于孢子或子实体表面,形成气生结构,由于疏水蛋白具有很强的生物表面活性,能将水的表面张力从72 mJ/m2降到24 mJ/m2,从而利于子实体或孢子的扩散、促进其生长发育[5]。此外,疏水蛋白还参与真菌与环境的相互作用,如疏水蛋白分泌在植物的根部,保护植物免于噬菌体的侵袭[5]。疏水蛋白具有这些功能是因为疏水蛋白可以自组装形成双亲性蛋白膜,疏水面朝向气体而亲水面朝向水中,使得蛋白表面活性得到极大的提高[5]。疏水蛋白这种特殊的理化性质,使得它具有多种潜在的应用价值。如利用疏水蛋白的双亲性改变药物分子的水溶性及细胞膜通透性,从而实现肿瘤药物的有效输送[6];利用疏水蛋白自组装性质修饰生物传感器,进行信号检测[7];利用疏水蛋白的生物表面活性,将其应用为食品乳化剂、蛋白质纯化标签等[8-11]。
近年来,Kobayashi等在枯草芽孢杆菌的生物被膜中发现一种小分子量蛋白质,其分子量约15 kDa,具有和真菌疏水蛋白相似的性质,并将其命名为BslA (Biofilm-surface layer protein,formerly YuaB)[12]。BslA在枯草芽孢杆菌生物被膜中被表达,并在枯草芽孢杆菌生物被膜发育过程中具有不同作用。在自然界中,枯草芽孢杆菌主要存在于土壤中,土壤的水中可能含有影响枯草芽孢杆菌生存的重金属离子、农业杀菌剂以及其他拮抗性微生物等。枯草芽孢杆菌生物被膜中的BslA具有疏水保护作用,自组装后的BslA形成疏水薄膜,对枯草芽孢杆菌形成一种保护作用,阻碍环境中有害物质进入枯草芽孢杆菌细胞内部,从而避免外界毒素对枯草芽孢杆菌细胞自身造成伤害,保证了细胞内部生命活动的正常进行,进而使得枯草芽孢杆菌得以在恶劣的自然条件下生存[12]。此外,在枯草芽孢杆菌孢子的传播过程中,BslA还可以改变空气界面张力,辅助孢子向空气中传播[13-14]。
随着疏水蛋白需求的日益增长,人们在不同的表达系统中对疏水蛋白的生产进行了大量尝试。最初使用同源的丝状真菌宿主生产真菌疏水蛋白,然而由于在转录水平经常发生基因沉默,致使真菌表达疏水蛋白效果不佳,这表明丝状真菌宿主并不适合大规模生产疏水蛋白[15]。为了克服这一局限性,研究人员相继开发使用毕赤酵母和大肠杆菌生产异源性疏水蛋白。其中毕赤酵母系统是目前最常用于生产可溶性真菌疏水蛋白的异源表达系统[16-17]。然而,在使用酵母系统表达疏水蛋白过程中,需要用到甲醇作为诱导剂,从而使得酵母表达系统用于大规模工业生产风险性较高,实际应用具有局限性,通常在实验室进行小规模生产应用。一些研究组尝试使用大肠杆菌系统进行真菌疏水蛋白的表达纯化,然而在大部分情况下,大肠杆菌系统表达的真菌疏水蛋白均以包涵体的形式存在,在利用变复性技术处理后,真菌疏水蛋白能够保持部分功能[18-20]。
研究发现,大肠杆菌表达系统表达异源性真菌疏水蛋白形成包涵体是由于在表达过程中形成不正确的二硫键导致的[19]。本课题组利用基因工程手段对真菌疏水蛋白HFBI及HGFI的8个半胱氨酸进行突变,并在大肠杆菌系统内成功表达了具有功能的、可溶性的真菌疏水蛋白,证明细菌表达系统可以用于生产可溶性、功能性的异源真菌疏水蛋白突变体[20]。另外,研究发现,来自枯草芽孢杆菌的功能性BslA缺乏半胱氨酸残基,说明功能性BslA中没有半胱氨酸残基形成二硫键,证明二硫键对于枯草芽孢杆菌疏水蛋白BslA的生物活性不是必需的。同时,本课题组将BslA基因克隆到大肠杆菌表达载体,成功表达出了具有自组装活性的枯草芽孢杆菌可溶性疏水蛋白BslA。因此,利用细菌表达系统进行枯草芽孢杆菌疏水蛋白的大规模生产具有可行性。相比于真菌疏水蛋白,BslA来源于枯草芽孢杆菌,在大肠杆菌蛋白表达过程中无需糖基化修饰、最终产物不是包涵体、纯化过程中无需甲醇诱导,且蛋白产量高,蛋白纯化周期短,并且由于带有His-tag纯化标签,只需要通过亲和层析及凝胶过滤层析就能拿到纯度大于95%的可溶性蛋白,故该种纯化过程更加简单、易于操作、生物安全与生产安全性高,且疏水蛋白双亲性和成膜的性质没有发生改变,能够进行工业化生产应用。因此,BslA作为枯草芽孢杆菌来源的疏水蛋白,相比于真菌疏水蛋白,在制备生产、表达、应用范围等领域都有显著的优势。推动疏水蛋白在食品乳化、保鲜、药物传输系统、组织工程、生物传感器等领域的应用。
2 BslA结构及性质研究对枯草芽孢杆菌疏水蛋白BslA进行表征,有助于阐明枯草芽孢杆菌疏水蛋白的结构特点、自组装机制等。这些结构信息与自组装机制为进一步设计有实践价值的应用提供理论支撑[5, 21-22]。BslA能够自组装形成双亲性蛋白膜的性质使得它能够作为一种新型的表面活性剂,如用于修饰材料表面、固定酶分子等[23]。BslA自组装形成表面活性蛋白膜的性质是由于BslA中的疏水氨基酸通过折叠扭曲,形成一个疏水帽子状结构,疏水帽子再与BslA中的其他氨基酸进一步组装形成功能化的蛋白分子[24]。因此,通过阐明BslA的结构及性质,才能明确BslA的自组装过程,探究BslA中分子的聚集方式、分子的相互作用方式、BslA组装后形成双亲性蛋白膜的形态结构、组成、分子聚集方式和成膜质量等信息。为BslA蛋白膜的生物功能与BslA结构之间的关系提供分子水平的依据[24]。常用于研究蛋白膜功能与结构的技术方法手段有原子力显微镜、扫描电子显微镜、X射线衍射[25]、紫外分光光度计、和频共振光谱[26]、Langmuir-Blodgett等[26]。
2.1 BslA性质研究为了进一步研究BslA自组装形成的双亲性蛋白膜,首先得确定BslA分子的聚集方式、分子的相互作用、分子的构象变化。Wang等利用Langmuir- Blodgett技术,模拟BslA自组装过程,研究了BslA自组装成蛋白膜的性质。发现在气体和液体交替界面,BslA分子能够自组装形成类似脂质单层膜的稳定的膜状结构[26]。通过紫外光谱对BslA表面膜结构进行分析,结果也表明BslA在表面压力增加的过程中会形成稳定的单层双亲性膜而不是多层膜[26]。
Morris等利用Langmuir-Blodgett (LB)技术对BslA分子自组装的过程分析发现:在Langmuir-Blodgett槽中,自组装刚开始时,BslA分子之间彼此分散,分子间相互孤立。此时BslA彼此间没有相互作用,BslA分子可以自由移动[27]。但当调节LB槽中设定的压力,使BslA分子压力增大,彼此分散、孤立的BslA分子则会在LB槽施加的压力下发生聚集,组装为具有疏水性质的液态膜。相比于BslA分散时的状态,形成液态膜状态下的BslA,在局部上,单个BslA分子可以近似看成椭圆形球体,BslA椭圆形球体的长轴与BslA分子疏水帽子质量中心位置呈一定角度稍稍倾斜(约为8°),整体上BslA分子的排列更加紧密,临界表面压力更大。在纯化BslA蛋白过程中,发现BslA自组装能力极强,轻度振荡菌悬液,会影响BslA自组装,会使BslA蛋白二聚体增多,从而无法形成单层膜状结构。这表明在气液界面,BslA具有二聚化或者形成膜状结构等不同的组装形式[27]。
Liu W等利用Langmuir-Blodgett技术分析发现:BslA疏水性质液态膜的分子表面压力为25 mN/m,当其表面压力达到45 mN/m时,BslA的自组装结构会被破坏,液态膜中各BslA分子会失去弹性,形成有序朝向的固态膜状结构,固态膜状结构中BslA分子紧密排列,单分子层的分子尽可能地靠近,BslA分子垂直于水平面,此时膜的压缩性很低,分子间有很强的键键相互作用,此时的表面压力称为临界表面压力[28]。因为BslA临界表面压力数值高于生物蛋白大分子的临界表面压力25–35 mN/m,低于脂质分子的临界表面压力65–70 mN/m,故推测BslA具有的疏水性质介于蛋白质分子和脂质分子中间。利用Langmuir- Blodgett技术,Liu等证明了BslA自组装形成具有一定形态的拓扑结构的弹性双亲性膜界面,从而使得枯草芽孢杆菌表面具有疏水性[28]。
使用透射电子显微镜对疏水蛋白结构形态进行观察分析,发现当BslA浓度为0.5 mg/mL、pH值为7.0时,BslA蛋白呈膜状结构,并且对BslA呈膜状结构的区域进行快速傅里叶变换(FFT:fast fourier transform)运算分析,显示该区域BslA蛋白薄膜具有类晶体样点状信号特征[27]。进一步对该样品较薄的区域进行染色后发现,该区域是BslA自组装形成的稳定蛋白界面的薄膜[27]。此外,从透射电镜样品的基质上也发现该蛋白形成了相似的薄膜。这些信息综合证明了在电镜样本基质界面形成的薄膜是BslA自组装形成的而不是BslA沉淀形成的[27]。
扫描电子显微镜观察BslA形成的膜状蛋白结构时发现,双亲性蛋白膜表面有褶皱的拓扑结构,且比较粗糙。当BslA疏水氨基酸突变后则不能形成这样的拓扑结构。分析认为,粗糙的拓扑结构在BslA形成的疏水蛋白膜中具有重要作用,推测可能和BslA双亲性质有关[29]。
原子力显微镜作为有效的工具被广泛应用于蛋白表层结构的研究,其优势在于可以获得高分辨率的蛋白膜的表面结构。为了更加详细地研究BslA自组装形成膜状结构时的形态,研究人员用原子力显微镜观察了表面压恒定为23 mN/m的BslA单层膜分子,得到了BslA高分辨率的疏水和亲水单层表面膜的结构。云母表面粗糙,是理想的测试液体双亲性质的载体,在原子力显微镜下,BslA垂直排列在云母载体表面且疏水帽子向上,BslA的近似高度为3.5 nm[27]。这为BslA的自组装形成蛋白膜后的性质分析提供了形态学和结构信息。
为了探索BslA自组装形成蛋白膜的动力学性质、自组装界面结构等情况,进一步研究疏水蛋白薄膜在界面自组装的分子机制,Wang ZG等利用和频共振光谱研究了BslA在界面组装时的界面分子取向、界面分子动力学信息。发现BslA在空气/水界面上形成了一个排列有序且取向整齐的结构,随着BslA浓度增加,其表面分子压力也在增加。当BslA体积浓度低于1 μmol/L时,BslA界面显示出很强的吸附力;当体积浓度高于1 μmol/L,达到6 μmol/L时界面逐渐饱和达到最大表面分子压23 mN/m[26]。拟合吸附等温线显示其吸附自由能是–8.65 kJ/mol,证明BslA在空气/水界面具有很强的自组装活性,可以自组装形成双亲性蛋白膜,进而阻止外界物质进入枯草芽孢杆菌细胞内部,保护枯草芽孢杆菌细胞不受外界物质侵害[26]。
BslA自组装形成双亲性蛋白膜后,具有很强的疏水性,接触角测试显示,当用75%的乙醇洗涤时,疏水蛋白的疏水性质几乎不改变,仍然能够保持其疏水性。BslA最高可以抵抗高达80%的乙醇洗涤而仍然保持其疏水特性[13]。Epstein等测试了用乙醇洗涤BslA处理的疏水塑料表面时疏水塑料表面液滴接触角大小的变化。测试结果显示,当BslA在疏水塑料表面自组装成蛋白膜后,用不同浓度的乙醇洗涤疏水塑料表面的蛋白膜,液滴接触角的大小随着乙醇洗涤浓度的增加而减小,乙醇浓度从0%到80%范围内,接触角几乎保持在约135°–145°不变。当乙醇浓度为90%时,接触角急剧下降到70°左右。而用不同浓度的乙醇洗涤未经BslA处理的疏水塑料表面时,液滴的接触角大小并未有明显改变[13]。说明疏水蛋白BslA自组装形成的蛋白膜可以抵御不同浓度乙醇的洗涤。随后,Epstein等又分别检测了不同浓度酒精下,接触角大小随时间的变化以及接触角大小是否与液滴体积的变化相关。不同浓度乙醇洗涤作用下,液滴体积越大,物体表面接触角越大,表明物体表面的疏水性质越强。研究结果发现蛋白膜的疏水性随着乙醇浓度的变化而变化,乙醇浓度越高,蛋白膜的疏水性的持续时间越短,接触角减小的时间越快[13]。测试BslA的性质时发现,BslA的疏水性质极强,使用100℃的60% SDS溶液洗涤吸附在硅化玻璃上的BslA膜时,BslA的接触角减小,说明此时BslA的疏水性质减弱。而当用100 ℃沸水或75%乙醇处理BslA时,BslA的接触角几乎不改变,显示BslA可以抵御热水和75%乙醇的洗涤[13]。
2.2 BslA结构研究通过透射电镜、扫描电镜、原子力显微镜对BslA的研究,可以得到一些BslA结构的表征数据,然而,这些表征数据却无法从分子角度来阐明疏水蛋白BslA结构和性质之间的关系。只有通过解析BslA三级结构,才可以更方便地了解其功能,阐明其结构和功能之间的联系。BslA全长由181个氨基酸残基构成,这181个氨基酸序列主要分为两部分,N端的1–28个氨基酸构成了一段信号肽,29–181位氨基酸形成该蛋白的成熟肽[30]。X射线衍射技术是利用晶体形成的X射线衍射图谱对物质空间原子分布解析的一种结构学分析手段。Hobley等利用X射线衍射获得了疏水蛋白BslA的晶体结构信息,其整体结构如图 1所示。BslA的结构由1个α螺旋和13个β折叠组成,它们整体形成了1个疏水帽子和1个类似于免疫球蛋白的主体结构。其中类似于免疫球蛋白的主体结构主要由两部分β折叠区域组成,这2个区域的β折叠形成的方向相反,其中一个区域由4个β折叠构成,另外一个区域由3个β折叠构成。疏水帽子位于类似于免疫球蛋白的主体结构的上方,疏水帽子的结构是由3条β折叠组成。虽然BslA主体结构具有类似于免疫球蛋白的结构特征,但与其他免疫球蛋白样结构相比较BslA的疏水帽子结构是非常独特的[30]。
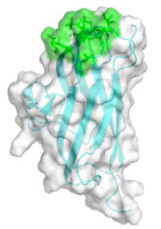
|
| 图 1 BslA的整体结构图(PDB ID:4BHU)[30] Figure 1 The overall structure of BslA[30]. The entire figure shows the structure of the mature peptide of amino acids 42–181 of BslA. Green represents the hydrophobic cap of BslA; white represents the immunoglobulin-like main structure formed by BslA; light blue represents the β-sheet. |
尽管BslA疏水蛋白(图 2-A)与Ⅱ型真菌疏水蛋白HFB Ⅱ (图 2-B)的氨基酸序列不同,但是二者却有相似的理化性质。将枯草芽孢杆菌疏水蛋白BslA与Ⅱ型真菌疏水蛋白HFB Ⅱ的结构进行对比分析发现,BslA的疏水帽子由11个疏水氨基酸组成,疏水帽子位于2个β折叠区域形成的免疫球蛋白状结构的顶部,且其表面没有二硫键来稳定表面结构,通过疏水氨基酸折叠成疏水帽子,其余氨基酸形成免疫球蛋白样的有序结构来稳定整体蛋白结构[30]。而Linder教授团队在2004年解析的Ⅱ型真菌疏水蛋白HFB Ⅱ蛋白的三维结构显示(图 2-B),Ⅱ型真菌疏水蛋白HFB Ⅱ表面暴露了80%左右的疏水氨基酸[25]。这些疏水氨基酸在蛋白表面形成疏水补丁,疏水补丁自组装在一起,使真菌疏水蛋白具有双亲性性质。Ⅱ型真菌疏水蛋白HFB Ⅱ的晶体结构分析显示,HFB Ⅱ分子内8个半胱氨酸形成了4对二硫键,二硫键的形成增强了疏水蛋白的稳定性,避免了因疏水氨基酸暴露过多而使得可溶蛋白形成的疏水核心内部不稳定的问题,从而保证了蛋白质分子的稳定性,使得疏水蛋白可以正常发挥功能。2006年HAkanpaa等解析出Ⅱ型真菌疏水蛋白HFB Ⅰ的高分辨率晶体结构,如图 2-C所示。与Ⅱ型真菌疏水蛋白HFB Ⅱ进行序列对比后发现,HFB Ⅰ和HFB Ⅱ在疏水蛋白的N端都存在一个疏水活性口袋,该疏水口袋包含Val59、Ala60、Val62、Ala63、Ala66、Leu67等非极性的疏水氨基酸残基,具有很大的序列保守性[31]。

|
| 图 2 枯草芽孢杆菌疏水蛋白与真菌疏水蛋白结构图[25, 30-31] Figure 2 The structure of Bacillus subtilis hydrophobin and fungal hydrphobin[25, 30-31]. A: BslA hydrophobin (PDB ID: 4BHU) crystal structure, hydrophobic residues are marked in cyan; B: Type II hydrophobin HFB Ⅱ (PDB ID: 1R2M) crystal structure, hydrophobic residues are marked in green; C: The crystal structure of type I hydrophobin HFB I (PDB ID: 2GVM), the hydrophobic residues are marked in blue. |
虽然BslA缺乏二硫键样的刚性结构,不能像真菌疏水蛋白的疏水残基聚合形成疏水斑,但BslA通过疏水残基朝向内部形成疏水帽子的柔性结构来最小化环境作用力。但当蛋白接触到界面时,疏水帽子会通过结构改变,在非极性相中插入疏水性残基,形成高度有序的膜结构。如图 2-A所示,疏水帽子区域暴露了大量的疏水氨基酸,这种蛋白排列顺序类似胶束,疏水蛋白帽子朝向德卡默中心(Decamer center),从而排除了溶剂分子。BslA的总表面积是6670Å2,估测疏水帽子结构区域表面积大小为1620 Å2,约占总表面积大小的24%。而真菌疏水蛋白表面暴露的疏水氨基酸约占真菌疏水蛋白表面积的12%[30]。BslA疏水帽子中央76、77、79三个亮氨酸残基对于BslA发挥功能至关重要,当这3个氨基酸残基突变形成带正电的氨基酸或者中性氨基酸残基,BslA将不能形成有弹性的蛋白拓扑结构,失去疏水特性[30]。
3 疏水蛋白的应用疏水蛋白由于双亲性和自组装的特点而广泛得到关注,其应用已经在各个领域展开研究。枯草芽孢杆菌来源的BslA蛋白具有在溶液界面自组装、进而形成双亲性薄膜的特性。疏水蛋白BslA自组装后具有稳定溶液粒子的功能,而形成双亲性薄膜可以减小疏水蛋白表面张力,提高疏水蛋白表面活性。相比于真菌疏水蛋白,枯草芽孢杆菌疏水蛋白BslA表达纯化方式简洁且产率高,经济成本更加低廉,能够批量化生产。疏水蛋白在表面活性剂、食品加工过程的乳化剂、纳米技术中的生物固定以及表面应用修饰等领域都有广阔的应用前景,许多科学家利用其自组装功能和疏水性质开发了不同的应用。如利用BslA作为乳化剂来稳定乳浊液、BslA固定生物大分子从而控制生物传感器、BslA用作生物实验材料表面修饰等[32-36]。
3.1 BslA作为乳化剂应用乳化剂是乳浊液表面稳定的表面活性剂,可以提高乳浊液的稳定性,促进水油完全混合,形成稳定而分散的乳浊液[33]。因为BslA可以自组装形成双亲性液滴,不同浓度的BslA液滴自组装形成不同大小的液滴,而BslA液滴的大小可以影响乳浊液的稳定性,因此调节BslA浓度、控制BslA自组装过程可促使乳化剂形成不同形状大小的液滴[33]。在烘焙中,通过调节不同乳化技术及BslA的浓度,改变BslA与液滴接触面积的大小,进而调节乳化剂与面筋相互作用的强弱程度,从而起到改变口感的效果[33]。同样的原理,在冲剂粉末饮料中,BslA可以增强粉末在水溶液中的分散性,提高粉末饮品的口感。在冰淇淋等甜品中,调节BslA的浓度可以改变溶液的黏稠程度,塑造外形光滑的形貌。在日常化妆品中,BslA自组装的蛋白膜液滴可以稳定不同化学物质,提高化妆品中不同物质的稳定性与均一性[33]。
3.2 固定生物大分子控制生物传感器在生物传感器表面固定生物大分子,从而利用生物大分子进行生物感应和辅助药物靶向运输是生物传感器研究的热点之一。传统的生物传感器通过在传感器上固定一种蛋白质,通过控制不同环境条件,使传感器上固定的蛋白质与目标配体发生相互作用,以感应和控制生物传感器的信号[28]。但如何实现固定的蛋白质与目标配体精准识别,避免固定的蛋白质与传感器表面发生不必要的相互作用,实现固定蛋白元件特异性识别目标配体,具有很大的探索空间[37]。最近,耶鲁大学的研究人员提出了一种在蛋白N端或者C端融合一种标签蛋白,通过蛋白N端或者C端中的标签蛋白和目标配体的特异性结合,从而实现信号传导的方法来设计生物传感器,并对此进行了验证。其原理是利用BslA自组装的性质,在BslA蛋白的N端或者C端融合spyTag标签(GenBank No. MF974389),在目标配体的N端或者C端融合能够与spy共价结合的spyCatcher标签(GenBank No.MF974388),通过spyTag与spyCatcher标签共价结合巧妙地将BslA和目标配体结合在一起。再通过BslA的自组装性质间接将目的蛋白在生物传感器表面自组装形成单层膜状结构,通过增加生物传感器表面自组装BslA的数量,进而间接提高目标配体在生物传感器上的数量,使得检测的灵敏度与特异程度大大提高[37]。由于BslA蛋白自组装时可以最小化界面作用力,且与之融合的spyTag和目标配体之间特异性结合,故可以减小生物传感器进行检测时的假阳性结果。利用这种方法,还可以将BslA应用在固定化治疗上,例如可以固定某种蛋白,使之产生抗体[37]。
3.3 生物实验用材料的表面修饰疏水蛋白能够稳定自组装形成有序的蛋白膜结构,使BslA应用于生物实验用材料的表面涂层修饰成为可能。利用疏水蛋白的疏水性,可以提高疏水分子在材料表面的亲和性,防止非特异性蛋白质和细菌在材料表面的亲和与黏附;在细胞培养过程中,BslA修饰培养器皿表面还可以增加细胞的附着,促进细胞的生长[22]。细胞由于种类性质的差异、在体外培养过程中和体内生理环境的差异,细胞贴壁效果差。疏水蛋白由于具有双亲性,可以在培养材料表面形成膜状结构,可以较好地修饰培养材料表面,为细胞贴壁时提供良好的附着点,以提高细胞培养的效率。
4 总结和展望枯草芽孢杆菌疏水蛋白BslA是枯草芽孢杆菌特殊发育时期分泌的一种蛋白质,因其特殊的性质,BslA具有特殊的理论与应用研究价值。在理论研究方面,本文所述的结构分析方法均对研究BslA蛋白的结构、主要性质以及在生物技术领域的应用起到了极其重要的作用,不同技术方法从不同层次揭示了BslA的不同结构信息。Langmuir- Blodgett技术可以很好地模仿BslA在枯草芽孢杆菌体外自组装形成稳定的膜结构,透射电镜、扫描电镜、原子力显微镜、和频共振光谱分别从微观和宏观的角度阐释了BslA表面的形态特征,为之后的性质研究提供了科学依据。X-ray衍射结构解析则大大提高了研究者基于BslA结构对疏水蛋白发挥功能的理解,揭示了一个由3个β折叠区域形成的双亲性生物大分子结构,为进一步理解BslA疏水性、自组装性奠定了基础。由于研究技术和研究方法的局限性,关于BslA在生物体内的其他功能和相互作用机制,还有待进一步探讨。相信随着科学研究的逐渐深入,BslA的性质和功能会得到更清晰的阐释。
BslA在应用方面,由于枯草芽孢杆菌疏水蛋白生物安全性高、规模化生产快、自组装性质稳定,故可以对其在食品塑形剂、工业乳化剂、生物传感器、纳米材料表面修饰等领域展开应用。随着学科交叉研究体系逐渐走向成熟,利用疏水蛋白BslA修饰化学材料,可以拓展化学材料的用途、提高材料性能的优越性。如利用疏水蛋白BslA对纳米粉末状有机金属框架的表面进行修饰,可提高其在医药载体方面的应用潜力。纳米粉末状有机金属框架是一种新型化学材料,可用作纳米药物载体,与其他纳米药物载体相比,具有比表面积大、载药量高、生物相容性好等特点,且有机金属框架的粒径小,能够有效避开网状内皮系统,延缓药物释放,增加治疗效果[38-39]。疏水蛋白BslA是一种高效的自组装载体,利用其对碳纳米管、金纳米棒等材料的修饰,可实现碳纳米管、金纳米棒等材料进入细胞的功能[40]。用枯草芽孢杆菌来源的疏水蛋白来修饰有机金属框架作为药物载体来实现肿瘤药物的靶向运输这一领域的研究尚属空白。有机金属框架能够改善肿瘤治疗过程中由于药物的持续使用产生多重耐药性、治疗效果衰减等现象[40]。因为本实验室具有成熟的大肠杆菌蛋白表达系统且BslA在大肠杆菌蛋白表达系统中无需甲醇诱导,生产安全性高。此外,大肠杆菌表达系统纯化生产蛋白实验周期短。本实验室通过将bslA基因(除去N端1–28位信号肽及29–42位不保守区序列)克隆在大肠杆菌表达载体上,并且成功利用大肠杆菌表达系统纯化出可溶性具有功能的BslA蛋白。用BslA修饰载药后的有机金属框架,使得有机金属框架具有良好的分散性和靶向性,能够有效降低药物的过敏反应。随着枯草芽孢杆菌疏水蛋白应用研究的深入,枯草芽孢杆菌疏水蛋白将会在生物医药领域具有巨大的应用潜力。
伴随着疏水蛋白在工业化生产的广泛应用、与其他学科研究的交叉深入,对于枯草芽孢杆菌疏水蛋白BslA结构和性质的研究提出了更大的挑战。随着近几年来冷冻电子显微镜技术的发展,不同表征方法逐渐成熟,相信枯草芽孢杆菌疏水蛋白BslA结构和功能的分子机制能够得到更好的阐明,从而在纳米生物技术、食品、生物工程等领域展现出越来越大的行业潜力。
| [1] | 王斌. 二硫键在疏水蛋白自组装过程中的功能研究. 天津大学硕士学位论文, 2018. |
| [2] | Vries OMH, Fekkes MP, Wösten HAB, Wessels JGH. Insoluble hydrophobin complexes in the walls of Schizophyllum commune and other filamentous fungi. Archives of Microbiology, 1993, 159(4): 330-335. DOI:10.1007/BF00290915 |
| [3] | Wessels JG, de Vries OM, Asgeirsdóttir SA, Springer J. The thn mutation of Schizophyllum commune, which suppresses formation of aerial hyphae, affects expression of the Sc3 hydrophobin gene. Journal of General Microbiology, 1991, 137(10): 2439-2445. DOI:10.1099/00221287-137-10-2439 |
| [4] | Kwan AHY, Winefield RD, Sunde M, Matthews JM, Haverkamp RG, Templeton MD, MacKay JP. Structural basis for rodlet assembly in fungal hydrophobins. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(10): 3621-3626. DOI:10.1073/pnas.0505704103 |
| [5] | de Vocht ML, Scholtmeijer K, van der Vegte EW, de Vries OMH, Sonveaux N, Wösten HAB, Ruysschaert JM, Hadziioannou G, Wessels JGH, Robillard GT. Structural characterization of the hydrophobin SC3, as a monomer and after self-assembly at hydrophobic/hydrophilic interfaces. Biophysical Journal, 1998, 74(4): 2059-2068. DOI:10.1016/S0006-3495(98)77912-3 |
| [6] | Wang KP, Xiao YJ, Wang YY, Feng YQ, Chen C, Zhang J, Zhang Q, Meng SX, Wang ZF, Yang HT. Self-assembled hydrophobin for producing water-soluble and membrane permeable fluorescent dye. Scientific Reports, 2016, 6: 23061. DOI:10.1038/srep23061 |
| [7] | Tao J, Wang YY, Xiao YJ, Yao P, Chen C, Zhang DH, Pang W, Yang HT, Sun D, Wang ZF, Liu J. One-step exfoliation and functionalization of graphene by hydrophobin for high performance water molecular sensing. Carbon, 2017, 116: 695-702. DOI:10.1016/j.carbon.2017.02.052 |
| [8] | Quarantin A, Hadeler B, Kröger C, Schäfer W, Favaron F, Sella L, Martínez-Rocha AL. Different hydrophobins of Fusarium graminearum are involved in hyphal growth, attachment, water-air interface penetration and plant infection. Frontiers in Microbiology, 2019, 10: 751. DOI:10.3389/fmicb.2019.00751 |
| [9] | Calabrese MF, Eakin CM, Wang JM, Miranker AD. A regulatable switch mediates self-association in an immunoglobulin fold. Nature Structural & Molecular Biology, 2008, 15(9): 965-971. |
| [10] | Pokroy B, Epstein AK, Persson-Gulda MCM, Aizenberg J. Fabrication of bioinspired actuated nanostructures with arbitrary geometry and stiffness. Advanced Materials, 2009, 21(4): 463-469. DOI:10.1002/adma.200801432 |
| [11] | Winandy L, Hilpert F, Schlebusch O, Fischer R. Comparative analysis of surface coating properties of five hydrophobins from Aspergillus nidulans and Trichoderma reseei. Scientific Reports, 2018, 8: 12033. DOI:10.1038/s41598-018-29749-0 |
| [12] | Kobayashi K, Iwano M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Molecular Microbiology, 2012, 85(1): 51-66. DOI:10.1111/j.1365-2958.2012.08094.x |
| [13] | Epstein AK, Pokroy B, Seminara A, Aizenberg J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(3): 995-1000. DOI:10.1073/pnas.1011033108 |
| [14] | Morikawa M. Beneficial biofilm formation by industrial bacteria Bacillus subtilis and related species. Journal of Bioscience and Bioengineering, 2006, 101(1): 1-8. DOI:10.1263/jbb.101.1 |
| [15] | Schuurs TA, Schaeffer EAM, Wessels JGH. Homology-dependent silencing of the SC3 gene in Schizophyllum commune. Genetics, 1997, 147(2): 589-596. DOI:10.1093/genetics/147.2.589 |
| [16] | Niu BL, Wang DD, Yang YY, Xu HJ, Qiao MQ. Heterologous expression and characterization of the hydrophobin HFBI in Pichia pastoris and evaluation of its contribution to the food industry. Amino Acids, 2012, 43(2): 763-771. DOI:10.1007/s00726-011-1126-5 |
| [17] | Gandier JA, Master ER. Pichia pastoris is a suitable host for the heterologous expression of predicted class I and class II hydrophobins for discovery, study, and application in biotechnology. Microorganisms, 2018, 6(1): E3. DOI:10.3390/microorganisms6010003 |
| [18] | Wang ZF, Feng SR, Huang YJ, Qiao MQ, Zhang BH, Xu HJ. Prokaryotic expression, purification, and polyclonal antibody production of a hydrophobin from Grifola frondosa. Acta Biochimica et Biophysica Sinica, 2010, 42(6): 388-395. DOI:10.1093/abbs/gmq033 |
| [19] | Baneyx F, Mujacic M. Recombinant protein folding and misfolding in Escherichia coli. Nature Biotechnology, 2004, 22(11): 1399-1408. DOI:10.1038/nbt1029 |
| [20] | Cheng YY, Wang B, Wang YY, Zhang HY, Liu C, Yang L, Chen ZZ, Wang YN, Yang HT, Wang ZF. Soluble hydrophobin mutants produced in Escherichia coli can self-assemble at various interfaces. Journal of Colloid and Interface Science, 2020, 573: 384-395. DOI:10.1016/j.jcis.2020.04.012 |
| [21] | Sunde M, Kwan AHY, Templeton MD, Beever RE, MacKay JP. Structural analysis of hydrophobins. Micron, 2008, 39(7): 773-784. DOI:10.1016/j.micron.2007.08.003 |
| [22] | Lienemann M, Gandier JA, Joensuu JJ, Iwanaga A, Takatsuji Y, Haruyama T, Master E, Tenkanen M, Linder MB. Structure-function relationships in hydrophobins: probing the role of charged side chains. Applied and Environmental Microbiology, 2013, 79(18): 5533-5538. DOI:10.1128/AEM.01493-13 |
| [23] | Linder M, Szilvay GR, Nakari-Setälä T, Söderlund H, Penttilä M. Surface adhesion of fusion proteins containing the hydrophobins HFBI and HFBII from Trichoderma reesei. Protein Science, 2002, 11(9): 2257-2266. |
| [24] | Hofer U. Bacterial physiology: a raincoat for Bacillus subtilis. Nature Reviews Microbiology, 2013, 11(10): 660-661. |
| [25] | Linder M, Popov A, Hakanpää J, Schmidt A, Rouvinen J. Hydrophobin HFBII in detail: ultrahigh-resolution structure at 0.75 Å. Acta Crystallographica Section D, 2006, 62(4): 356-367. DOI:10.1107/S0907444906000862 |
| [26] | Wang ZG, Morales-Acosta MD, Li SH, Liu W, Kanai TP, Liu YT, Chen YN, Walker FJ, Ahn CH, Leblanc RM, Yan ECY. Correction: a narrow amide I vibrational band observed by sum frequency generation spectroscopy reveals highly ordered structures of a biofilm protein at the air/water interface. Chemical Communications, 2016, 52(68): 10440-10441. DOI:10.1039/C6CC90360F |
| [27] | Morris RJ, Bromley KM, Stanley-Wall N, MacPhee CE. A phenomenological description of BslA assemblies across multiple length scales. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, 2016, 374(2072): 20150131. DOI:10.1098/rsta.2015.0131 |
| [28] | Liu W, Li SH, Wang ZG, Yan ECY, Leblanc RM. Characterization of surface-active biofilm protein BslA in self-assembling Langmuir monolayer at the air-water interface. Langmuir, 2017, 33(30): 7548-7555. DOI:10.1021/acs.langmuir.7b01739 |
| [29] | Morris VK, Kwan AH, Sunde M. Analysis of the structure and conformational states of DewA gives insight into the assembly of the fungal hydrophobins. Journal of Molecular Biology, 2013, 425(2): 244-256. DOI:10.1016/j.jmb.2012.10.021 |
| [30] | Hobley L, Ostrowski A, Rao FV, Bromley KM, Porter M, Prescott AR, MacPhee CE, van Aalten DMF, Stanley-Wall NR. BslA is a self-assembling bacterial hydrophobin that Coats the Bacillus subtilis biofilm. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(33): 13600-13605. DOI:10.1073/pnas.1306390110 |
| [31] | Hakanpää J, Szilvay GR, Kaljunen H, Maksimainen M, Linder M, Rouvinen J. Two crystal structures of Trichoderma reesei hydrophobin HFBI-The structure of a protein amphiphile with and without detergent interaction. Protein Science, 2006, 15(9): 2129-2140. DOI:10.1110/ps.062326706 |
| [32] | Ullah N, Wang XJ, Chen L, Xu XL, Li ZX, Feng XC. Influence of biofilm surface layer protein A (BslA) on the gel structure of myofibril protein from chicken breast. Journal of the Science of Food and Agriculture, 2017, 97(14): 4712-4720. DOI:10.1002/jsfa.8339 |
| [33] | Brandani GB, Schor M, Morris R, Stanley-Wall N, MacPhee CE, Marenduzzo D, Zachariae U. The bacterial hydrophobin BslA is a switchable ellipsoidal Janus nanocolloid. Langmuir, 2015, 31(42): 11558-11563. DOI:10.1021/acs.langmuir.5b02347 |
| [34] | Bromley KM, MacPhee CE. BslA-stabilized emulsion droplets with designed microstructure. Interface Focus, 2017, 7(4): 20160124. DOI:10.1098/rsfs.2016.0124 |
| [35] | Schloss AC, Liu W, Williams DM, Kaufman G, Hendrickson HP, Rudshteyn B, Fu L, Wang HF, Batista VS, Osuji C, Yan ECY, Regan L. Fabrication of modularly functionalizable microcapsules using protein-based technologies. ACS Biomaterials Science & Engineering, 2016, 2(11): 1856-1861. |
| [36] | Tuteja A, Choi W, Ma ML, Mabry JM, Mazzella SA, Rutledge GC, McKinley GH, Cohen RE. Designing superoleophobic surfaces. Science, 2007, 318(5856): 1618-1622. DOI:10.1126/science.1148326 |
| [37] | Williams DM, Kaufman G, Izadi H, Gahm AE, Prophet SM, Vanderlick KT, Osuji CO, Regan L. Facile protein immobilization using engineered surface-active biofilm proteins. ACS Applied Nano Materials, 2018, 1(6): 2483-2488. DOI:10.1021/acsanm.8b00520 |
| [38] | Taylor PK, Yeung ATY, Hancock REW. Antibiotic resistance in Pseudomonas aeruginosa biofilms: Towards the development of novel anti-biofilm therapies. Journal of Biotechnology, 2014, 191: 121-130. DOI:10.1016/j.jbiotec.2014.09.003 |
| [39] | Cai MR, Chen GS, Qin LY, Qu CH, Dong XX, Ni J, Yin XB. Metal organic frameworks as drug targeting delivery vehicles in the treatment of cancer. Pharmaceutics, 2020, 12(3): 232. DOI:10.3390/pharmaceutics12030232 |
| [40] | Jayaramulu K, Geyer F, Schneemann A, Kment Š, Otyepka M, Zboril R, Vollmer D, Fischer RA. Hydrophobic metal-organic frameworks. Advanced Materials, 2019, 31(32): 1900820. |
 2021, Vol. 61
2021, Vol. 61




