中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 贾昊凝, 李艳, 黎晏彰, 鲁安怀, 丁竑瑞. 2020
- Haoning Jia, Yan Li, Yanzhang Li, Anhuai Lu, Hongrui Ding. 2020
- 矿物电子能量协同微生物胞外电子传递与生长代谢
- Mineral electronic energy cooperates with microbial extracellular electron transfer and growth metabolism
- 微生物学报, 60(9): 2084-2105
- Acta Microbiologica Sinica, 60(9): 2084-2105
-
文章历史
- 收稿日期:2020-05-15
- 修回日期:2020-06-22
- 网络出版日期:2020-07-21
能量代谢是一切生命活动的核心。在太阳光可以直接照射到的地球表面,光能微生物通过光合色素或视紫素吸收转化太阳能合成有机质并利用太阳光能量来支持地表生态系统的运行[1-2]。其他不含光合色素或视紫素的微生物则通过环境介质中的还原性物质获取化学能,比如在没有日光照射的深部生境,微生物主要以热液作用释放或产生的氢气、甲烷、硫化氢等还原性物质作为电子与能量来源[3-6]。近年来研究显示,半导体矿物金红石(TiO2)、闪锌矿(ZnS)、硫镉矿(CdS)等通过吸收大于自身禁带宽度的光子能量产生的高能量光电子,能够在实现光能的捕获与转化的同时支持传统非光合微生物的生长代谢[7-9],表明除太阳光光子、变价元素价电子之外,半导体矿物光电子是微生物能够利用的一种新型能量形式。另外,在热液活动活跃区域,环境温度可达300 ℃以上,热液口输出传导热流能量并产生广谱热辐射的体量非常巨大,并且热液能够与周围海水混合形成热液羽流,其中的微生物被发现在热液区红外辐射的影响下生长代谢效率明显加快[10-11],表明热辐射能量同样可能被微生物吸收利用。由此可见,地球上微生物能量利用具有丰富的多样性和高度的未知性。
在地球岩石圈、水圈、土壤圈、大气圈及生物圈多圈层交互作用过程中,能量与物质的流动与交换不仅发生在同一圈层内,也发生在不同圈层之间。特别是在地表关键带、大洋深部等圈层交互作用繁杂的生境中,孕育着数量巨大、代谢活跃却又缺乏充分认知的微生物种群。值得一提的是,矿物作为岩石圈的主要组成部分,是地球物质与能量转化的重要无机载体。前人研究结果已充分揭示,含变价元素矿物可以通过氧化还原反应转化化学能,金属氧化物或硫化物矿物能够利用自身的半导体特性吸收转化光能驱动氧化还原反应,并最终存储为化学能或生物质能[7-9, 12-13]。
矿物作为地球能量流动与转化的载体功能主要是通过矿物电子能量的传递与转化来实现的。矿物电子能量主要包含两种形式,一类是矿物中所含变价元素原子中的价电子能量,主要通过矿物表面溶解、吸附及氧化还原等反应方式改变或重组原有化学键及化合态来实现能量的传递与交换;另一类是存在于半导体固体分子轨道上的导带电子能量,主要通过光、热等外界能量激发电子从基态成键轨道跃迁至激发态反键轨道来转化能量,降低反应活化能。二者最为显著的区别在于,元素价电子能量的传递与转化需要矿物直接作为反应物参与化学反应,因而会改变矿物原有的化学键;半导体导带电子能量的传递与转化过程中,是通过矿物晶体分子轨道上的电子跃迁过程来提高供体电子的能量,矿物充当“催化剂”的角色降低了电子供体与受体之间反应的活化能,并最终保持矿物原有的化学键不被改变。
在矿物与微生物协同作用中,不同形式的矿物电子能量通过多种胞外电子传递方式影响微生物的生长代谢,极大地丰富了微生物的能量获取途径[14]。矿物并不是简单作为直接参与生长代谢的电子供体/受体,还可能打破矿物与微生物胞外电子传递通路的热力学势垒,提高电子能量的传递效率。因此,厘清传统的矿物元素价电子和半导体导带电子能量的存在形式、产生机理、传递机制及其对微生物生长代谢的调控效应,有助于深刻理解矿物与微生物协同作用过程,深入揭示矿物与微生物协同作用对地球多圈层交互作用、对地球环境演化与生物进化等宏观过程的影响,具有开展多学科交叉研究的前景与理论突破的机遇。
1 矿物电子能量形式 1.1 元素价电子能量矿物中的价电子一般来自原子的最外层或次外层,是该原子能够与其他原子相互作用形成化学键的电子。当pH、Eh及介质环境等条件发生改变时,矿物晶格内部原子与原子之间原有的化学键可能不再稳定,在吸收一定能量发生活化后与环境介质中的原子进行有效碰撞,此时原有化学键就会克服热力学势垒发生断裂,并重组为当前介质条件下最为稳定的新化学键。从能量传递角度来看,在反应体系活化能的热力学限制以及与温度、压力、催化剂、溶剂、光照等介质条件相关的反应动力学影响下,原本束缚在晶格内的矿物价电子将沿着氧化还原电势梯度传递,伴随着原有化学键的活化、断裂与重组,最终以化学能的形式赋存于新生成的化学键中。因此,矿物的价电子能量实质上是一种存在于晶格内部的化学能,其能量大小与成键原子种类、化学键类型、晶体结构等因素有关,体现了矿物中元素在地球化学循环过程中的氧化还原活性。
需要加以区别的是,在矿物-溶液体系价电子能量传递的过程中,矿物可能通过两种方式进行电子传递:一是在溶液中氢键的作用下,矿物表面发生溶解,原子价电子建立起的阴阳离子静电作用或共用电子对相互作用被破坏,阴阳离子脱离晶格进入溶液,并与介质中的离子或分子发生有效碰撞,导致价电子通过转移、偏移或共用等重新分布方式形成新的化学键;二是在矿物表面的活性位点,介质中分子或离子与矿物表面发生碰撞,其电子与矿物金属原子的外层轨道电子被共用形成共价键,或者分子或离子直接提供一对电子与金属原子提供的空轨道形成配位键后,再与矿物晶格中的变价元素之间进行电子转移发生吸附-氧化还原反应,导致暂态的共价键或配位键被破坏,产物解吸附脱离矿物表面进入溶液,使活性位点不断再生,以供新一轮吸附-氧化还原反应进行。
1.2 半导体导带电子能量根据固体能带理论,当原子或离子紧密堆积形成固体矿物时,外层价电子是离域的,所有的价电子归整个矿物晶格的原子共有,可以在整个固体中运动,因此被称为共有化电子[15]。这些半导体矿物分子轨道上的共有化电子在产生过程与传递行为上区别于元素价电子。在孤立的原子中每一个壳层都对应确定的能量,而半导体矿物晶体是由一系列原子周期性排列而成的。这些原子相互靠近,电子壳层发生交叠,电子不再完全局限于某一个原子上,而是能够在相邻原子的相似
能量壳层上进行共有化运动,从而使原子轨道相互叠加后重新线性组合为分子轨道,轨道数目不变并产生能级的分裂,其中能量较低的成键轨道构成价带集合,能量较高的反键轨道构成导带集合。对半导体而言,价电子占据低能量的成键轨道,而高能量的反键轨道大多数为空轨道。成键轨道的电子在吸收一定能量后,能够跃迁并占据反键轨道成为自由电子,即价带电子受到外界激发跃迁至导带成为相对高能的自由态半导体导带电子,并在价带留下空穴,形成还原性电子-氧化性空穴对。需要注意的是,由于电子在反键轨道处于不稳定的激发态,需要建立动态的电子传递通道才能有效阻碍电子-空穴的复合过程。因而,只有电子供体或电子源捕获空穴,半导体导带电子才能有效传递给电子受体构建完整的电子传递通道,实现外界激发能量向化学能的转化,并最终提高供体的电子能量、突破反应的能量势垒促进反应的发生。
光电子是最为典型的一种矿物半导体导带电子能量形式。当入射光子能量高于半导体矿物的禁带宽度时,半导体矿物价带电子被激发到导带,形成还原性光电子-氧化性光空穴对,进而分别触发氧化还原反应来释放、转化能量。日光照射下地表半导体矿物广泛承载着能量转化功能,比如地表铁锰氧化物矿物如水钠锰矿、针铁矿、赤铁矿等具有灵敏、长效的日光光子-光电子转换能力[14]。
广义上半导体矿物光电子还包含了其吸收热能产生的热电子,但二者的产生方式与能量形式又有不同。在结晶态的固体中,原子按照一定规律排列在晶格上,原子间的相互作用使得它们总是围绕平衡位置不断做热振动,从而形成格波。格波具有能量,根据量子理论,格波的能量也是量子化的,以声子作为这种量子化的最小能量单位。当半导体矿物吸收热能,热端由于温度升高而具有更剧烈的原子振动,电子或空穴与声子相互作用,使得原子壳层电子吸收量子化的能量,从内层逸出形成载流子。自然界黄铁矿、黄铜矿、斑铜矿等多种铜铁硫化物半导体矿物已被证实有优良的热电响应性能[16-20]。当这些矿物处于温度场环境中时,其高温端载流子能量与浓度高于低温端,就会发生载流子的扩散,在矿物内部形成电场,从而使其转化热能产生可自由流动的热电子。从能量的角度而言,光由量子化的光子组成,以电磁波的形式向外辐射能量,可以引起半导体晶体的光致激发并转化为电能;而热是粒子随机运动程度的度量,在晶体中通过同为量子化的声子以弹性波的形式传播,能够引起半导体晶体的热激发而转换为电能。
需要说明的是,这些半导体导带电子能量与价电子能量联系密切又有所不同。光电子和热电子是光激发和热激发过程中携带能量的基本粒子,它们均是作为一种中间激发态电子形式参与氧化还原反应,最终都会转化为稳态的价电子,并以化学能的形式储存半导体所吸收的光能或热能。由此可见,半导体导带电子能量都是通过外来能量的作用产生激发态电子能量,虽然不像价电子直接参与反应,但对电子供体中的价电子突破热力学势垒产生了显著的催化作用;其中热电子产生、传递方式与能量大小显著有别于光电子,体现了半导体导带电子能量形式的多样性。
无论是元素价电子还是半导体矿物导带电子,这些不同形式的矿物电子能量均已被证明具有促进微生物生长代谢的效应。在复杂多变的自然环境中,矿物价电子能量的传递往往伴随着矿物氧化还原状态的改变。一些岩石圈广泛分布的含变价元素矿物如铁锰氧化物、硫化物等矿物在地球多圈层交互作用下与微生物的作用活跃,常常通过胞外电子传递影响微生物的生长代谢,并实现矿物协同微生物驱动的元素地球化学循环过程[21-27]。而在微生物获取半导体导带电子能量的过程中,矿物则作为能量转换的介质将微生物本身无法利用的能量(如光能、热能)转化为光电子或热电子从而被微生物利用,如金红石(TiO2)、闪锌矿(ZnS)、硫镉矿(CdS)等通过吸收大于自身禁带宽度的光子能量产生的高能量光电子,可以在实现光能捕获与转化的同时支持传统非光合微生物的生长代谢[7-9, 13]。因此,不同的矿物电子能量是微生物从无机环境获取能量的不同形式,体现了矿物与微生物协同作用并促进微生物生长代谢过程中扮演的不同角色。
2 矿物协同微生物胞外电子传递的可能载体无论是矿物中的元素价电子还是半导体导带电子能量,这些来自微生物胞外的电子能量形式都需要通过某种跨膜电子输运的分子机制才能被微生物获取利用。这一过程将细胞外矿物介导的氧化还原反应与细胞内的生长代谢活动联系起来,涉及外膜蛋白、电子穿梭体以及纳米导线等多种传输介质[28],且多种介质之间往往共同作用,体现了微生物面对不同环境下的能量利用策略。因此,揭示矿物电子能量在电子传递链上转化的关键位点,找出将矿物电子能量转化为微生物可利用能量的合适载体,是厘清矿物与微生物协同作用中电子能量转化过程与机制的关键。
2.1 外膜关键蛋白目前微生物胞外电子传递主要是由具有氧化还原活性的蛋白质贯穿整个细胞膜套的一条电子传递链来实现,而细胞外膜上这些具有氧化还原活性的关键蛋白是微生物胞外电子直接传递机制的关键载体,也是矿物电子能量协同微生物胞外电子传递的一类可能载体。这些外膜蛋白具有进化上的多样性,在不同种群的微生物生长代谢中建构的胞外电子传递通道亦不同。
氢醌氧化酶-周质c型细胞色素-孔蛋白跨膜复合物是微生物获取胞外电子能量的一种典型外膜蛋白载体模式,功能相似却非同源的跨外膜复合体可能是不同种群微生物独立进化的结果。以研究最为透彻的两种胞外电子传递模式菌种Shewanella oneidensis MR-1(S. oneidensis MR-1)和Geobacter sulurreducens (G. sulurrreducens)为例,二者都可以将Fe(Ⅲ)矿物作为电子受体。S. oneidensis MR-1的c型细胞色素CymA、Fcc3、MtrA、MtrC、OmcA、STC以及孔状外膜蛋白MtrB形成了一种以Fe(Ⅲ)矿物为电子受体氧化细胞质膜中氢醌的途径(图 1-A),即CymA氧化氢醌再将电子转移至周质的Fcc3和STC[29-31],再通过MtrA、MtrB、MtrC能构成的跨膜蛋白复合物将电子从周质蛋白转移到细菌表面[32-34],最后经过MtrC和OmcA的相互作用,将电子转移到矿物电子受体中[35-37];而在G. sulurrreducens孔蛋白-c型细胞色素复合体中,ImcH和CbcL氧化氢醌[38-39],电子经过周质中的PpcA和PpcD传递给c型细胞色素OmaB、OmaC、OmcB和OmcC[40-44],而这些细胞色素与孔状外膜蛋白OmbB和OmbC形成复合体最终将电子传导至细胞表面(图 1-B)。

|
| 图 1 电子传入微生物直接电子传递模式示意图 Figure 1 The schematic diagram of direct electron transfer mode. A: the pathway of S. oneidensis MR-1 for electron introduction into outer membrane proteins[28]; B: the pathway of G. sulurreducens for electron introduction into outer membrane proteins[28]; C: the electron transport model of A. ferroxidans[50]. |
一些嗜热/嗜温微生物的胞外电子传递也有功能类似但不同源的关键载体蛋白。例如,嗜热革兰氏阳性菌Thermincola potens JR (T. potens JR)的多功能性末端还原酶OcwA能与电极、氮氧化物、Fe(Ⅲ)矿物与氧化性电子穿梭体相互作用,使生长代谢适应不同的末端电子受体,以应对复杂多变的环境[45]。OcwA形态上与已知的末端还原酶MtrC/OmcA类似,但在蛋白质结构上血红素的折叠和组织与后者明显不同,反而与氮硫循环中的关键蛋白NrfA、c554、MccA等结构上相关,揭示了胞外电子传递载体蛋白的多样性源自不同电活性微生物独立进化的结果。在一些极端生境如热液烟囱内壁及通道内部等最靠近热液口中心位置的高温区,生长着温度超过100℃的超嗜热极端微生物,其中严格自养的Pyrodictium brockii (P. brockii)和能够利用有机物的Pyrococcus furiosus (P. furiosus)是目前超嗜热硫还原菌研究中相对深入的两个代表性物种[46-49],且Phil等还在P. brockii细胞膜中发现了醌类电子穿梭体及对跨膜电子传递起关键作用的c-型细胞色素,但完整的电子传递通路还有待研究[46]。值得一提的是,一些喜温的嗜酸微生物的胞外电子传递过程也以这些关键载体蛋白为载体,例如嗜酸性氧化亚铁硫杆菌Acidithiobacillus ferroxidans(A. ferroxidans)可以通过氧化Fe(Ⅱ)将电子由外膜蛋白Cyc2传入膜周质空间的Rus蛋白,并以此为电子流支点,电子通过Cyc1-aa3跨膜复合物路径驱动O2还原产生质子动力(PMF),以提升能量通过CycA1-bc1-NDH1跨膜复合物再传递入胞内将NAD+还原为NADH参与卡尔文循环同化二氧化碳(图 2-C),可以利用电极电子同化二氧化碳的电子传入通路,首次证明胞外电子能够传入胞内驱动固碳的卡尔文循环[50]。嗜热/嗜酸性微生物胞外电子传递通路的研究扩展了胞外电子传递途径在自然界极下广泛存在的可能,为深部地球环境下极端生境微生物碳氮硫等元素循环的机制与调控方式的研究奠定了基础。

|
| 图 2 微生物纳米导线及其电子传递机制 Figure 2 Microbial nanowires and their electron transfer mechanism. A: the morphology of G. sulfurreducens nanowires under transmission electron microscopy[61]; B: the schematic diagram of type Ⅳ fimbria nanowires of G. sulurreducens[62]; C: the scanning Morphology of S. oneidensis MR-1 nanowire under electron microscope[70]; D: the schematic diagram of electron transfer mechanism of S. oneidensis MR-1 nanowire[69]. |
值得注意的是,这些介导微生物传出电子并还原胞外氧化性物质的关键蛋白,同时也具有氧化胞外还原性物质从而介导电子传入的能力。转录组数据和离体蛋白实验表明PccH是参与G. sulfurreducens实现胞外电子传入的关键蛋白,但并不参与电子传出过程[51-52];并且在电子传入过程中,细胞色素蛋白会部分降解,所含的Fe会以FeOx纳米颗粒的形式重新沉淀在表面以促进胞外电子传递[53],而该机制是否取代了细胞色素蛋白而成为电子传递通路的载体尚有待进一步研究。通过敲除Mtr途径相关载体蛋白的突变株与野生株的对比实验表明S. oneidensis MR-1的Mtr电子传递通道相关蛋白可以介导直接电子传入过程,即将胞外电子逆向传递到细胞质膜中的CymA[54]。另外,跨膜蛋白Mtr的同源物也同样具有介导电子传入的效应,例如,光合铁氧化菌Rhodopseudomonas palustris TIE-1 (R. palustris TE-1)的基因组中包含mtrA、mtrB的同源基因pioA、pioB,当这些Mtr同源基因被敲除,R. palustris TIE-1的生长代谢和胞外电子传递能力均会显著降低,即PioA和PioB可能介导了微生物氧化胞外Fe(Ⅱ)的电子传入过程[55-56];另一种嗜中性铁氧化菌Sideroxydans lithotroohicus ES-1(S. lithotroohicus ES-1)的基因组上同样也包含mtrA和mtrB的同源基因mtoA和mtoB,并且S. lithotroohicus可以通过MtoA、MtoB以及一种但血红素c型细胞色素MtoD构成通道氧化胞外Fe(Ⅱ)并传递给细胞质上的CymA还原醌类物质[57-58]。因此,双向电子传导在获取胞外矿物电子能量的电活性微生物中可能广泛存在,电子的传递方向可能与环境的Eh及胞内氧化性醌类/还原性氢醌的含量有关。
2.2 纳米导线微生物纳米导线是一种纤毛状的微生物导电附属物,具有较强的导电性,当这些微生物数量众多,形成的纳米线还会形成纳米导线网络进行远距离的电子传递,但可能存在不同的导电机制[59-60]。以G. sulfurreducens的Ⅳ型菌毛型纳米导线为例(图 2-A),由细胞色素OmcS组成的纳米线能够将胞内物质与胞外电子受体连接起来[61-64](图 2-B),固定在细胞膜中的一端接受细胞周质中电子传导物质的电子后,在电子离域化运动下经过纳米线上芳香氨基酸形成的大π键完成运输和传递,其导电性与菌毛蛋白芳香族氨基酸的数量正相关,具有温度与pH依赖性,是一种类似金属导线的胞外电子传递方式[61, 65-67]。值得一提的是,OmcS在Geobacter spp.纳米导线上的作用并非是无可替代的,纳米磁铁矿能够通过附着在Geobacter metallireducens (G. metallireducens)的纳米导线上来赋予OmcS缺失菌株参与胞外Fe(Ⅲ)还原以及种间电子传递的能力,并且加入磁铁矿会使野生株OmcS基因表达受到抑制[68],即在磁铁矿被G. metallireducens利用时只需要产生较少的OmcS即可满足微生物的胞外电子传递需求,表明磁铁矿的一个潜在功能可能是弥补OmcS在促进电接触方面的不足,并且有可能反映了无机矿物在自然界中微生物胞外电子传输机制早期演化中起到的作用。
而S. oneidensis MR-1的纳米导线又有所不同(图 2-C),更类似于细胞外膜与周质向外延伸的一种形式,其表面附着密集的c型细胞色素[69](图 2-D),敲除外膜关键蛋白MtrA或OmcA会导致纳米线失活,表明了S. oneidensis MR-1纳米导线对Mtr途径的依赖性[70-71],即S. oneidensis MR-1的纳米导线本质上是外膜关键蛋白在更多反应位点分布的一种拓展形式。
近年来的研究表明嗜热微生物在胞外电子传递还原胞外矿物受体的过程中也会发育类似的导电附属物,如,嗜热革兰氏阳性异化铁还原菌Carboxdothermus ferrireducens (C. ferrireducens)除了通过细胞表面相关的c型细胞色素介导,还检测到了菌毛状附属物参与水铁矿的还原[72];深海沉积物中的嗜热/嗜温微生物群落中厌氧甲烷古菌(ANME)和硫酸盐还原菌(SRB)在60 ℃下都会发育类似S. oneidensis MR-1的细胞膜外关键蛋白与纳米导线结构,从而将ANME氧化H2产生的电子传递给SRB实现种间互营养,并且SRB的纳米导线结构仅在与ANME互营养获取电子时才会高度发育[73]。
因此,在微生物获取矿物电子能量的过程中,无论是类金属导电的Geobacter型纳米导线,还是Shewanella型纳米导线作为细胞色素-跨膜复合物延展,其矿物电子能量都需要有合适的细胞外膜蛋白进行介导才能实现跨膜运输。运用纳米导线,微生物将与胞外物质之间的氧化-还原活性位从细胞外膜拓展到了更大范围,在微生物所形成的胞外聚合网络中也大量存在此类纳米线结构,是矿物电子能量转化为微生物可利用价电子能量的关键载体之一,在自然界的微生物-碳氮硫等元素循环的耦合过程中可能起到了关键作用。
2.3 电子穿梭体除了胞外直接电子传递外,矿物协同微生物作用还可能通过各种电子穿梭载体来进行间接电子传递。一些微生物自分泌或外源的黄素类物质、吩嗪、醌类等有机分子,以及存在于自然环境中的H2、Fe3+、HS-等无机物质都已被证明能够充当电子穿梭体[74-77],在微生物-矿物界面与MtrC和OmcA等色素蛋白结合或通过渗透作用进入细胞膜内。
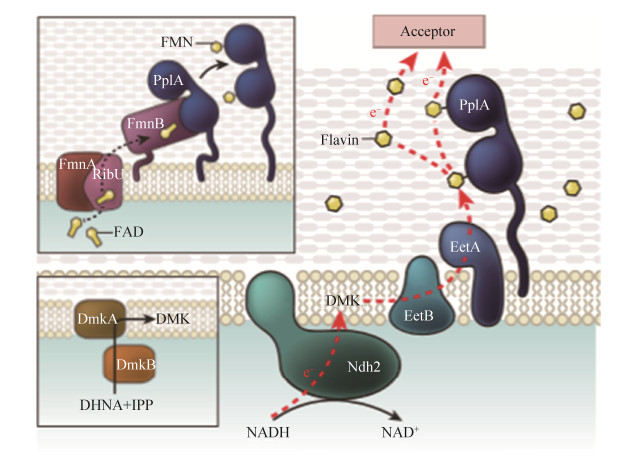
黄素类物质是最典型的电子穿梭体之一。S. oneidensis的Mtr呼吸途径能够还原胞外的黄素类物质[78],并且Shewanella spp.已被证明可以分泌或使用核黄素/黄素单核苷酸将电子传递给赤铁矿、针铁矿、纤铁矿等胞外矿物电子受体[74, 79]。值得一提的是,在存在大量黄素的低氧环境中,Listeria monocytogenes (L. monocytogenes)可能存在一条独特而简化的电子传递链(图 3),即NADH脱氢酶Ndh2将电子传递到膜周质独特醌类物质中,经DmkA和DmkB催化合成去甲基甲萘醌衍生物,再经EetB、EetA传递给胞外黄素类穿梭体,最终由PplA结合黄素促进电子向胞外电子受体转移[80-81]。值得一提的是,这条简化的电子传递途径仅在L. monocytogenes处于缺氧且大量黄素存在的条件下才会被使用,揭示了微生物在特定环境中采取胞外电子传递策略的灵活性。
一些Pseudomonas spp.能够分泌还原性的吩嗪类物质H2PHZ/PHZ。吩嗪类穿梭体通过直接与OmcA和MtrC相互作用来将电子从细胞外膜转移至赤铁矿及针铁矿[82-84],且吩嗪已被证实能够通过Pseudomonas aeruginosa (P. aeruginosa)胞外DNA结合[85],促进生物膜基质中绿藻素和吩嗪羧酰胺的保留与代谢过程,从而支持更为有效的氧化还原循环与更为快速的胞外电子传递,为电子穿梭体在生物膜中的保留和有效胞外电子传递提供了模型。
腐殖酸(HAs)是自然环境中广泛存在的一种电子穿梭体。HAs中的醌基通过可逆的单电子转移反应能够在氢醌及半醌/醌之间灵活转化[86-87],使得HAs能够从电子穿梭体接收Geobacter、Shewanella等腐殖质还原菌的电子并转移到其他电子受体[88]。作为天然的络合配体,HAs倾向于螯合环境中的金属离子,能够通过和Fe、Cu、Al等金属的络合形成HA-M络合物参与胞外电子传递[89]。而与金属络合后,HA作为电子穿梭体在胞外电子传递中的作用可能会增强或减弱,如Cu与HA之间形成的共价键非常弱,阻碍了自由电子的转移,Al不具有可变价态的氧化还原活性,二者与HA的络合不仅不会产生额外的氧化还原活性位点,还会减少HA分子本身的某些氧化还原位点,降低间接电子传递的效率[90]。相反,HA与Fe络合产生了额外的氧化还原活性位点,因此HA-Fe(Ⅲ)络合物能够接受G.metallireducens等微生物胞外呼吸传出的电子[91-92]。
存在于S. oneidensis细胞周质中的HSn–能将胞内代谢产生的电子转移到表面电子受体,形成弱结晶马基诺矿(FeS)作为电子导体进一步提高微生物胞外呼吸电流[93],并且在该途径中细胞表面的多硫化物还原酶能够作为外膜细胞色素的替代性关键蛋白,从而使OmcA、MtrC、CymA等Mtr途径主要蛋白质缺失的突变株能够保留一定的胞外电子传递能力,显著扩大了富硫缺氧环境下微生物能够长距离进行胞外电子传递的可能性[93-95]。
值得一提的是,排除在微生物电子传递链之外的胞外聚合物(EPS)通过电子穿梭体对胞外电子传递起到了间接调控作用(图 4)。作为决定生物膜理化性质的基本生物成分,EPS的功能往往表现在保护细胞免受不利环境的侵害而促进生物膜的形成[96-98]。其化学成分中的DNA、腐殖质或某些蛋白质具有氧化还原活性[99-103],甚至可以在c型细胞色素的参与下合成金属纳米粒子[104]。无论是通过膜结合蛋白、纳米导线还是电子穿梭体,微生物与胞外电子受体/供体之间的电子传递必然会经过EPS层,而EPS层的覆盖会导致膜结合细胞色素蛋白不能有效地将电子直接转移到胞外受体,导致微生物直接电子传递能力的减弱。在一些极端环境中,当EPS耗尽,微生物会暴露于恶劣条件下而导致表面蛋白失活。然而,由于EPS可以帮助细胞更好地附着在矿物等其他电子受体/供体上,有助于维持高浓度的电子穿梭以体提高微生物间接电子传递能力[105],例如黄素类物质必须在EPS层内扩散从而达到储存电子载体的功能。类似地,G. sulfurreducens的鞭毛能够促进厚层生物膜的形成充当膜基质的支架,从而容纳更多的细胞色素以提高直接接触电子传递效率[106]。
3 矿物电子能量协同微生物生长代谢 3.1 价电子能量协同微生物生长代谢
当矿物作为胞外电子供体,矿物价电子能量可以作为微生物生长代谢的电子“源”,如A. ferroxidans能够通过氧化黄铁矿(FeS2)来获取能量,S. lithotroohicus能够氧化矿物结构中或吸附态的Fe(Ⅱ)满足生长需要[25-26, 55],热液区硫化物沉积物中以Thiomicrospira为代表的硫氧化菌能够将硫化物矿物及自然硫作为天然电子供体[107]。矿物价电子传递过程沿氧化还原电势升高的梯度方向进行,主要分为两种具体情况:第一种情况与微生物直接获取利用溶液介质中离子的情况本质上是相同的,即矿物表面溶解使原子脱离原有晶格以游离态离子的形式进入溶液环境,再通过与氧化性电子穿梭体或外膜活性蛋白进行有效碰撞并发生电子转移;第二种情况则涉及矿物表面的吸附-氧化还原反应,即矿物表面活性位点吸附氧化性电子穿梭体或外膜活性蛋白,在二者变价元素原子间建立起暂态共价键或配位键后进行电子转移,再通过生成物解吸附脱离矿物表面使活性位点进行下一轮吸附-氧化还原反应。最终,无论是生成电子穿梭体进行间接电子传递,还是电子通过外膜活性蛋白载体进入一系列载体蛋白构成的直接电子传递链,矿物中的元素价电子都是脱离了矿物晶格化学键的束缚而被微生物获取。
当矿物作为胞外电子受体时,矿物价电子能量能够通过微生物还原作用构成完整的电子传递链以维持微生物胞外呼吸的进行。如赤铁矿、针铁矿、磁铁矿、水钠锰矿等矿物中Fe(Ⅲ)、Mn(Ⅳ)矿物不仅是G. metallireducens GS-15、S. oneidensis MR-1等模式异化金属还原菌胞外呼吸的电子受体[21-23],也能够作为C. ferrireducens、Geoglobus ahangari (G. ahangari)、Mardentima maritime (M. maritima)110S等许多存在于极端环境下嗜热/嗜温微生物的电子“汇”[72, 108-109]。由于矿物能够作为胞外电子受体/供体,具有混合价态的矿物如磁铁矿能够在环境中缺乏电子受体的情况下暂时充当电子受体,当介质的氧化还原状态发生改变,磁铁矿能够转换为微生物的电子供体,从而以一种“环境电池”的方式协同微生物应对复杂多变的环境[110-111]。
3.2 半导体导带电子能量协同微生物生长代谢在以往的研究中,赤铁矿、磁铁矿等半导体矿物由于导带电位与一些外膜蛋白氧化还原电位相近,通常被认为是微生物进行长程电子传递的良好“电子导体”,被用以促进微生物与胞外不溶物的电子传递与微生物种间电子传递过程。例如,Shewanella loihica (S. loihica)以乳酸盐作碳源和电子供体,加入胶体赤铁矿后的SEM显示有厚层细胞-Fe2O3形成,由于Fe2O3的导带与外膜细胞色素蛋白的电位相近,二者之间的电子交换过程不存在能量势垒,从而能够产生显著光电流提高体系的导电性,促进导电网络在S. loihica中的建立[112]。当赤铁矿或磁铁矿纳米颗粒加入乙酸盐或乙醇作为底物和稻田土壤作为接种物的混合培养基中,Geobacter spp.和Methanosarcina spp.迅速占据了群落中的主导地位,生长代谢与种间电子传递的促进使得表观上产甲烷速率明显提高[113]。赤铁矿等半导体矿物提高胞外电子传递通路导电性能,促进微生物群落结构改变的功能在G. sulfurreducens、Thiobacillus denitrificans (T. denitrificans)等微生物的种间电子传递促进中得到体现[113-115]。由于不需要投入光能以外的其他形式能量合成充当电子导体的蛋白质,半导体矿物作为电子导体的途径被认为可能具有某种生态优势,从而在能够长程电子传递中起关键性作用。
这些涉及半导体矿物的胞外电子传递途径研究,将矿物的半导体特性作为提高微生物胞外电子传递效率的关键,机理上多是从矿物导带与特定外膜蛋白电位的匹配性出发,把半导体矿物作为一种良好的“电子导体”来理解的。实际上,半导体矿物这一作为“电子导体”在促进胞外电子传递中起到的作用,需要根据价电子是否吸收能量发生跃迁加以区分。如果半导体没有吸收外界能量被激发,矿物导带将作为电子传递的中继站,通过矿物表面原子空置的反键轨道与表面关键蛋白或黄素、吩嗪等电子穿梭体基团的孤对电子形成配位键,建立起胞外电子传递的“入口”。相应地,如果价电子吸收了光能等外界能量从能量较低的成键轨道跃迁至原先空置的反键轨道,即从价带跃迁至导带,就会在价电子原有位置留下了空穴。由于电子在激发态的反键轨道处于不稳定状态,与空穴具有复合趋势,只有当环境中的还原性物质如甲酸、乙酸、抗坏血酸等有机酸作为电子供体捕获空穴,导带电子还原Fe3+、核黄素等氧化态电子穿梭体、或细胞色素的铁卟啉辅基等电子载体,从而有效阻碍电子-空穴对的复合过程,才能建构起动态的电子传递通道使半导体导带电子被微生物所利用。
目前微生物可利用的半导体导带电子能量主要是光电子能量。金红石(TiO2)、针铁矿(Fe2O3)和闪锌矿(ZnS)是最先被证实可以产生微生物可利用光电子能量的半导体矿物,利用构建的电池体系,其在日光下所产生的光电子可被非光合作用微生物A. ferroxidans的生长代谢所利用[7]。由于天然金红石和闪锌矿在pH=7.0的条件下导带电位光电子电势分别为–0.36 V和–1.58 V(vs. NHE),而Fe3+/Fe2+氧化还原电对的标准电势为+0.77 V,因此高电势的天然半导体矿物光电子能够还原Fe3+为Fe2+。在这一途径中,Fe2+/Fe3+氧化还原对做电子载体,A. ferroxidans将Fe2+氧化为Fe3+,而Fe3+可以被光电子在此还原为Fe2+从而间接为微生物利用(图 5-A),从而建立动态的电子传递通道,使得从价带跃迁的光电子能够相对稳定地存在于导带而不与空穴发生复合,有效转化所吸收的外界能量。需要注意的是,该途径受到光波长和光强两方面因素调控,光波长越长,光子能量越低,光子-光电子转化效率越低,微生物反映的生长代谢速率也就越低。而微生物利用光电子时体系的光强则存在最优光强,在光强未达到最优光强的范围内,光强越强,单位时间内转化的电子数目越多,产生的光电流密度越大,微生物的生长代谢效率也就越高。而当光强超过了最优值,体系中的光电流密度超过微生物可进行胞外电子传递能力的极限,反而会抑制微生物的生长代谢。并且,高光强下产生的氧化性自由基还可能会导致微生物膜被破坏,从而使光电流密度与微生物的生长代谢速率降低[8]。
A. ferroxidans在金红石和闪锌矿相互作用下特定波长的光能-生物质能转化效率约为0.13‰– 0.18‰和0.25‰–1.9‰[7]。需要注意的是,一般植物的光合作用效率以太阳辐射而非某一特定波长光能作为总能量进行计算,且其最大值不超过10‰[116]。虽然由于总能量分母的不同,不能将植物光合作用半导体导带电子能量的转化效率直接比较,但是可以确定光电能微生物获取半导体光电子是一种有效的新型电子传递模式。
这种半导体矿物与微生物协同作用的新途径,在自然界可能普遍发生。例如,金红石、闪锌矿及针铁矿的光电子可以对化能异养菌Alcaligenes faecalis (A. faecalis)的生长起到明显的促进作用。值得注意的是,在天然半导体光催化的作用下,A. faecalis能够随着矿物光电子的输入而在群落中迅速占据优势地位,显著降低天然红壤微生物群落的多样性,改变红壤微生物群落结构,其16S rRNA测试结果表明,A. faecalis在群落中的比例在5 d后稳定在70%,而对照试验仅占不到8%,说明矿物光电子能够影响微生物群落构成。非光合CO2还原菌Moorella thermoacetica(M. thermoacetica)能够将半胱氨酸的巯基还原为S2–,与介质中的Cd2+形成硫镉矿(CdS)附着在细菌表面,并在可见光下产生光电子与表面H+形成活性中间体将CO2还原为乙酸(图 5-B),留下的光空穴则被半胱氨酸氧化为二硫键以促进微生物生长代谢[8-9]。值得一提的是,一些生物兼容性更好的金属纳米团簇能够进入胞内产生光电子能量,如Au纳米团簇进入M. thermoacetica产生光电子有效克服了跨膜能量损失(图 5-C),并且在与细胞膜蛋白结合上相比CdS更加稳定,其产生的光电子光致发光寿命更长,电子传递效率也更高[117]。

|
| 图 5 光电能微生物电子转移示意图 Figure 5 The schematic diagram of photoelectron microbial electron transfer. A: the schematic diagram of electron transfer in the photoelectron system of A. ferrooxidans[14]; B: the schematic diagram of electron transfer in the photoelectron system of M. thermoacetica-CdS[9]; C: Schematic diagram of M. thermoacetica-Au nano-cluster system[117]. |
4 半导体矿物导带电子能量协同微生物胞外电子传递展望
半导体矿物电子能量及其与微生物胞外电子传递通路关键位点与电子载体的相关研究,扩展了人们对微生物利用矿物电子能量调控自身生长代谢及其他生命活动机制的认知。微生物获取光电子这一新兴电子能量的能力已应用于微生物工程中,但自然条件下尚未发现的新型矿物电子调控机制有可能对探索自然能量影响微生物生命活动的相关研究予以启示。如TiO2与表达[FeFe]-氢化酶的重组Escherichia coli (E. coli)组合,能够利用光照条件下TiO2产生的光电子(图 6),结合甲基紫晶这一人工合成电子穿梭体,实现重组大肠杆菌高效光催化产H2[118];E. coli细胞还能够通过原位合成生物相容的CdS,经氢化酶催化以及细菌细胞的自聚集在有氧条件下实现光催化产氢[119],展现了光电子调控微生物基因表达进而影响生命活动的可能。一些具有光电子响应的化合物如C3N4能够与携带一氧化氮生成酶的E. coli组合,在光照条件下产生的光电子能够加强微生物生长代谢,并促进内源NO3–酶促还原为NO,并有效抑制肿瘤细胞的生长[120],进一步显示了半导体矿物-微生物界面光电子传递调控微生物代谢机制的多样性和复杂性,并揭示了半导体导带电子能量调控微生物生命活动的其他潜在可能。目前,自然条件下微生物-矿物界面半导体光电子研究主要集中在促进微生物生长代谢现象等方面,矿物光电子被微生物获取后会如何具体作用于其基因表达与代谢方式还有待进一步研究。
由于半导体矿物电子能量传递过程中的胞外主要关键电子载体与传统的价电子能量模式可能会有所区别,其电子传递链相关界面上的关键蛋白等电子载体的分子结构尚需开展进一步的表征,其功能也待验证;半导体矿物电子传递链中能量形式与大小发生显著变化的关键节点及影响机制也亟待明确。绘制矿物与微生物协同作用过程中更为完整、精细的长程电子传递链,并探讨不同能量、不同形式的电子产生并影响碳、氮、硫等元素赋存状态变化与物质循环过程中的热力学与动力学机制十分必要。
围绕地球不同生境中不同类型矿物电子能量的产生机制,探索矿物电子能量被微生物获取的精细过程,深入探讨矿物电子能量在关键位点与载体上的能量转化过程,以及矿物电子能量的传递效率同微生物代谢效率、产物之间的协变规律,将有助于我们更全面、深刻地理解矿物协同微生物调控元素生物地球化学循环的环境响应机制。
| [1] | Des Marais DJ. When did photosynthesis emerge on earth?. Science, 2000, 289(5484): 1703-1705. |
| [2] | Béjà O, Aravind L, Koonin EV, Suzuki MT, Hadd A, Nguyen LP, Jovanovich SB, Gates CM, Feldman RA, Spudich JL, Spudich EN, DeLong EF. Bacterial rhodopsin:evidence for a new type of phototrophy in the sea. Science, 2000, 289(5486): 1902-1906. DOI:10.1126/science.289.5486.1902 |
| [3] | Corliss JB, Dymond J, Gordon LI, Edmond JM, Von Herzen RP, Ballard RD, Green K, Williams D, Bainbridge A, Crane K, van Andel TH. Submarine thermal Springs on the Galápagos rift. Science, 1979, 203(4385): 1073-1083. DOI:10.1126/science.203.4385.1073 |
| [4] | Whitman WB, Coleman DC, Wiebe WJ. Prokaryotes:the unseen majority. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(12): 6578-6583. DOI:10.1073/pnas.95.12.6578 |
| [5] | Lane N, Allen JF, Martin W. How did LUCA make a living? Chemiosmosis in the origin of life. BioEssays, 2010, 32(4): 271-280. DOI:10.1002/bies.200900131 |
| [6] | Schrenk MO, Huber JA, Edwards KJ. Microbial provinces in the subseafloor. Annual Review of Marine Science, 2010, 2: 279-304. DOI:10.1146/annurev-marine-120308-081000 |
| [7] | Lu AH, Li Y, Jin S, Wang X, Wu XL, Zeng CP, Li Y, Ding HR, Hao RX, Lv M, Wang CQ, Tang YQ, Dong HL. Growth of non-phototrophic microorganisms using solar energy through mineral photocatalysis. Nature Communications, 2012, 3(1): 768. DOI:10.1038/ncomms1768 |
| [8] | Sakimoto KK, Wong AB, Yang PD. Self-photosensitization of nonphotosynthetic bacteria for solar-to-chemical production. Science, 2016, 351(6268): 74-77. DOI:10.1126/science.aad3317 |
| [9] | Kornienko N, Sakimoto KK, Herlihy DM, Nguyen SC, Alivisatos AP, Harris CB, Schwartzberg A, Yang PD. Spectroscopic elucidation of energy transfer in hybrid inorganic-biological organisms for solar-to-chemical production. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(42): 11750-11755. DOI:10.1073/pnas.1610554113 |
| [10] | Yurkov V, Beatty JT. Isolation of aerobic anoxygenic photosynthetic bacteria from black smoker plume waters of the Juan de Fuca ridge in the Pacific Ocean. Applied and Environmental Microbiology, 1998, 64(1): 337-341. |
| [11] | Beatty JT, Overmann J, Lince MT, Manske AK, Lang AS, Blankenship RE, Van Dover CL, Martinson TA, Plumley FG. An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(26): 9306-9310. DOI:10.1073/pnas.0503674102 |
| [12] | Igarashi K, Kato S. Extracellular electron transfer in acetogenic bacteria and its application for conversion of carbon dioxide into organic compounds. Applied Microbiology and Biotechnology, 2017, 101(16): 6301-6307. DOI:10.1007/s00253-017-8421-3 |
| [13] | Lu AH, Li Y, Ding HR, Xu XM, Li YZ, Ren GP, Liang J, Liu YW, Hong H, Chen N, Chu SQ, Liu FF, Li Y, Wang HR, Ding C, Wang CQ, Lai Y, Liu J, Dick J, Liu KH, Hochella Jr MF. Photoelectric conversion on Earth's surface via widespread Fe-and Mn-mineral coatings. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(20): 9741-9746. DOI:10.1073/pnas.1902473116 |
| [14] | Lu AH, Li Y, Jin S. Interactions between semiconducting minerals and bacteria under light. Elements, 2012, 8(2): 125-130. DOI:10.2113/gselements.8.2.125 |
| [15] | 刘恩科, 朱秉升, 罗晋生. 半导体物理学. 第7版. 北京: 电子工业出版社, 2008. |
| [16] | Herzig PM, Hannington MD. Polymetallic massive sulfides at the modern seafloor a review. Ore Geology Reviews, 1995, 10(2): 95-115. DOI:10.1016/0169-1368(95)00009-7 |
| [17] | Xu Y, Schoonen MAA. The absolute energy positions of conduction and valence bands of selected semiconducting minerals. American Mineralogist, 2000, 85(3/4): 543-556. |
| [18] | Uhlig C, Guenes E, Schulze AS, Elm MT, Klar PJ, Schlecht S. Nanoscale FeS2 (pyrite) as a sustainable thermoelectric material. Journal of Electronic Materials, 2014, 43(6): 2362-2370. DOI:10.1007/s11664-014-3065-x |
| [19] | Qiu PF, Zhang TS, Qiu YT, Shi X, Chen LD. Sulfide bornite thermoelectric material:a natural mineral with ultralow thermal conductivity. Energy & Environmental Science, 2014, 7(12): 4000-4006. |
| [20] | Ang R, Khan AU, Tsujii N, Takai K, Nakamura R, Mori T. Thermoelectricity generation and electron-magnon scattering in a natural chalcopyrite mineral from a deep-sea hydrothermal vent. Angewandte Chemie, 2015, 127(44): 13101-13105. DOI:10.1002/ange.201505517 |
| [21] | Lovley DR, Stolz JF, Nord Jr GL, Phillips EJP. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism. Nature, 1987, 330(6145): 252-254. DOI:10.1038/330252a0 |
| [22] | Lovley DR, Phillips EJP. Novel mode of microbial energy metabolism:organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Applied and Environmental Microbiology, 1988, 54(6): 1472-1480. DOI:10.1128/AEM.54.6.1472-1480.1988 |
| [23] | Myers CR, Nealson KH. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science, 1988, 240(4857): 1319-1321. DOI:10.1126/science.240.4857.1319 |
| [24] | Jiao YQ, Kappler A, Croal LR, Newman DK. Isolation and characterization of a genetically tractable photoautotrophic Fe(Ⅱ)-oxidizing bacterium, Rhodopseudomonas palustris strain TIE-1. Applied and Environmental Microbiology, 2005, 71(8): 4487-4496. DOI:10.1128/AEM.71.8.4487-4496.2005 |
| [25] | Garcia O, Bigham JM, Tuovinen OH. Oxidation of isochemical FeS2 (marcasite-pyrite) by Acidithiobacillus thiooxidans and Acidithiobacillus ferrooxidans. Minerals Engineering, 2007, 20(1): 98-101. |
| [26] | Shelobolina ES, Xu HF, Konishi H, Kukkadapu RK, Wu T, Blö the M, Roden E. Microbial lithotrophic oxidation of structural Fe(Ⅱ) in Biotite. Applied and Environmental Microbiology, 2012, 78(16): 5746-5752. DOI:10.1128/AEM.01034-12 |
| [27] | Li Y, Wang X, Li YZ, Duan JS, Jia HN, Ding HR, Lu AH, Wang CQ, Nie Y, Wu XL. Coupled anaerobic and aerobic microbial processes for Mn-carbonate precipitation:a realistic model of inorganic carbon pool formation. Geochimica et Cosmochimica Acta, 2019, 256: 49-65. DOI:10.1016/j.gca.2019.02.002 |
| [28] | Shi L, Dong HL, Reguera G, Beyenal H, Lu AH, Liu J, Yu HQ, Fredrickson JK. Extracellular electron transfer mechanisms between microorganisms and minerals. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
| [29] | Firer-Sherwood MA, Bewley KD, Mock JY, Elliott SJ. Tools for resolving complexity in the electron transfer networks of multiheme cytochromes c. Metallomics, 2011, 3(4): 344-348. DOI:10.1039/c0mt00097c |
| [30] | Marritt SJ, Lowe TG, Bye J, McMillan DGG, Shi L, Fredrickson J, Zachara J, Richardson DJ, Cheesman MR, Jeuken LJC, Butt JN. A functional description of CymA, an electron-transfer hub supporting anaerobic respiratory flexibility in Shewanella. Biochemical Journal, 2012, 444(3): 465-474. DOI:10.1042/BJ20120197 |
| [31] | McMillan DGG, Marritt SJ, Butt JN, Jeuken LJC. Menaquinone-7 is specific cofactor in Tetraheme Quinol dehydrogenase CymA. Journal of Biological Chemistry, 2012, 287(17): 14215-14225. DOI:10.1074/jbc.M112.348813 |
| [32] | Ross DE, Ruebush SS, Brantley SL, Hartshorne RS, Clarke TA, Richardson DJ, Tien M. Characterization of protein-protein interactions involved in iron reduction by Shewanella oneidensis MR-1. Applied and Environmental Microbiology, 2007, 73(18): 5797-5808. DOI:10.1128/AEM.00146-07 |
| [33] | Hartshorne RS, Reardon CL, Ross D, Nuester J, Clarke TA, Gates AJ, Mills PC, Fredrickson JK, Zachara JM, Shi L, Beliaev AS, Marshall MJ, Tien M, Brantley S, Butt JN, Richardson DJ. Characterization of an electron conduit between bacteria and the extracellular environment. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(52): 22169-22174. DOI:10.1073/pnas.0900086106 |
| [34] | White GF, Shi Z, Shi L, Wang ZM, Dohnalkova AC, Marshall MJ, Fredrickson JK, Zachara JM, Butt JN, Richardson DJ, Clarke TA. Rapid electron exchange between surface-exposed bacterial cytochromes and Fe(Ⅲ) minerals. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(16): 6346-6351. DOI:10.1073/pnas.1220074110 |
| [35] | Xiong YJ, Shi L, Chen BW, Mayer MU, Lower BH, Londer Y, Bose S, Hochella MF, Fredrickson JK, Squier TC. High-affinity binding and direct electron transfer to solid metals by the Shewanella oneidensis MR-1 outer membrane c-type cytochrome OmcA. Journal of the American Chemical Society, 2006, 128(43): 13978-13979. DOI:10.1021/ja063526d |
| [36] | Lower BH, Shi L, Yongsunthon R, Droubay TC, McCready DE, Lower SK. Specific bonds between an iron oxide surface and outer membrane cytochromes MtrC and OmcA from Shewanella oneidensis MR-1. Journal of Bacteriology, 2007, 189(13): 4944-4952. DOI:10.1128/JB.01518-06 |
| [37] | Meitl LA, Eggleston CM, Colberg PJS, Khare N, Reardon CL, Shi L. Electrochemical interaction of Shewanella oneidensis MR-1 and its outer membrane cytochromes OmcA and MtrC with hematite electrodes. Geochimica et Cosmochimica Acta, 2009, 73(18): 5292-5307. DOI:10.1016/j.gca.2009.06.021 |
| [38] | Levar CE, Chan CH, Mehta-Kolte MG, Bond DR. An inner membrane cytochrome required only for reduction of high redox potential extracellular electron acceptors. mBio, 2014, 5(6): e02034-14. DOI:10.1128/mBio.02034-14 |
| [39] | Zacharoff L, Chan CH, Bond DR. Reduction of low potential electron acceptors requires the CbcL inner membrane cytochrome of Geobacter sulfurreducens. Bioelectrochemistry, 2016, 107: 7-13. DOI:10.1016/j.bioelechem.2015.08.003 |
| [40] | Leang C, Coppi MV, Lovley DR. OmcB, a c-type polyheme cytochrome, involved in Fe(Ⅲ) reduction in Geobacter sulfurreducens. Journal of Bacteriology, 2003, 185(7): 2096-2103. DOI:10.1128/JB.185.7.2096-2103.2003 |
| [41] | Lloyd JR, Leang C, Myerson ALH, Coppi MV, Cuifo S, Methe B, Sandler SJ, Lovley DR. Biochemical and genetic characterization of PpcA, a periplasmic c-type cytochrome in Geobacter sulfurreducens. Biochemical Journal, 2003, 369(1): 153-161. DOI:10.1042/bj20020597 |
| [42] | Qian XL, Reguera G, Mester TN, Lovley DR. Evidence that OmcB and OmpB of Geobacter sulfurreducens are outer membrane surface proteins. FEMS Microbiology Letters, 2007, 277(1): 21-27. DOI:10.1111/j.1574-6968.2007.00915.x |
| [43] | Morgado L, Bruix M, Pessanha M, Londer YY, Salgueiro CA. Thermodynamic characterization of a triheme cytochrome family from Geobacter sulfurreducens reveals mechanistic and functional diversity. Biophysical Journal, 2010, 99(1): 293-301. DOI:10.1016/j.bpj.2010.04.017 |
| [44] | Liu YM, Fredrickson JK, Zachara JM, Shi L. Direct involvement of ombB, omaB, and omcB genes in extracellular reduction of Fe(Ⅲ) by Geobacter sulfurreducens PCA. Frontiers in Microbiology, 2015, 6: 1075. |
| [45] | Costa NL, Hermann B, Fourmond V, Faustino MM, Teixeira M, Einsle O, Paquete CM, Louro RO. How thermophilic gram-positive organisms perform extracellular electron transfer:characterization of the cell surface terminal reductase OcwA. mBio, 2019, 10(4): e01210-19. DOI:10.1128/mBio.01210-19 |
| [46] | Pihl TD, Schicho RN, Black LK, Schulman BA, Maier RJ, Kelly RM. Hydrogen-sulfur autotrophy in the hyperthermophilic archaebacterium, Pyrodictium brockii. Biotechnology and Genetic Engineering Reviews, 1990, 8(1): 345-378. DOI:10.1080/02648725.1990.10647874 |
| [47] | Blumentals II, Robinson AS, Kelly RM. Characterization of sodium dodecyl sulfate-resistant proteolytic activity in the hyperthermophilic archaebacterium Pyrococcus furiosus. Applied and Environmental Microbiology, 1990, 56(7): 1992-1998. DOI:10.1128/AEM.56.7.1992-1998.1990 |
| [48] | Brown SH, Costantino HR, Kelly RM. Characterization of amylolytic enzyme activities associated with the hyperthermophilic archaebacterium Pyrococcus furiosus. Applied and Environmental Microbiology, 1990, 56(7): 1985-1991. DOI:10.1128/AEM.56.7.1985-1991.1990 |
| [49] | Conover RC, Kowal AT, Fu WG, Park JB, Aono S, Adams MW, Johnson MK. Spectroscopic characterization of the novel iron-sulfur cluster in pyrococcus furiosus ferredoxin. Journal of Biological Chemistry, 1990, 265(15): 8533-8541. |
| [50] | Ishii T, Kawaichi S, Nakagawa H, Hashimoto K, Nakamura R. From chemolithoautotrophs to electrolithoautotrophs:CO2 fixation by Fe(Ⅱ)-oxidizing bacteria coupled with direct uptake of electrons from solid electron sources. Frontiers in Microbiology, 2015, 6: 994. |
| [51] | Strycharz SM, Glaven RH, Coppi MV, Gannon SM, Perpetua LA, Liu AN, Nevin KP, Lovley DR. Gene expression and deletion analysis of mechanisms for electron transfer from electrodes to Geobacter sulfurreducens. Bioelectrochemistry, 2011, 80(2): 142-150. DOI:10.1016/j.bioelechem.2010.07.005 |
| [52] | Santos TC, De Oliveira AR, Dantas JM, Salgueiro CA, Cordas CM. Thermodynamic and kinetic characterization of PccH, a key protein in microbial electrosynthesis processes in Geobacter sulfurreducens. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2015, 1847(10): 1113-1118. DOI:10.1016/j.bbabio.2015.06.005 |
| [53] | Heidary N, Kornienko N, Kalathil S, Fang X, Ly KH, Greer HF, Reisner E. Disparity of cytochrome utilization in anodic and cathodic extracellular electron transfer pathways of Geobacter sulfurreducens biofilms. Journal of the American Chemical Society, 2020, 142(11): 5194-5203. DOI:10.1021/jacs.9b13077 |
| [54] | Ross DE, Flynn JM, Baron DB, Gralnick JA, Bond DR. Towards electrosynthesis in Shewanella:energetics of Reversing the Mtr Pathway for Reductive Metabolism. PLoS One, 2011, 6(2): e16649. DOI:10.1371/journal.pone.0016649 |
| [55] | Jiao YQ, Newman DK. The pio operon is essential for phototrophic Fe(Ⅱ) oxidation in Rhodopseudomonas palustris TIE-1. Journal of Bacteriology, 2007, 189(5): 1765-1773. DOI:10.1128/JB.00776-06 |
| [56] | Bose A, Gardel EJ, Vidoudez C, Parra EA, Girguis PR. Electron uptake by iron-oxidizing phototrophic bacteria. Nature Communications, 2014, 5(1): 3391. DOI:10.1038/ncomms4391 |
| [57] | Liu J, Wang ZM, Belchik SM, Edwards MJ, Liu CX, Kennedy DW, Merkley ED, Lipton MS, Butt JN, Richardson DJ, Zachara JM, Fredrickson JK, Rosso KM, Shi L. Identification and characterization of MtoA:a decaheme c-Type cytochrome of the neutrophilic Fe(Ⅱ)-oxidizing bacterium Sideroxydans lithotrophicus ES-1. Frontiers in Microbiology, 2012, 3: 37. |
| [58] | Shi L, Rosso KM, Zachara JM, Fredrickson JK. Mtr extracellular electron-transfer pathways in Fe(Ⅲ)-reducing or Fe(Ⅱ)-oxidizing bacteria:a genomic perspective. Biochemical Society Transactions, 2012, 40(6): 1261-1267. DOI:10.1042/BST20120098 |
| [59] |
Xu JL, Zhou SG, Yuan Y, Wang YQ, Zhuang L. Live wire:a review on electron transfer mechanism and applications of microbial nanowires. Progress in Chemistry, 2012, 24(9): 1794-1800.
(in Chinese) 许杰龙, 周顺桂, 袁勇, 王跃强, 庄莉. 有" 生命" 的电线:浅析微生物纳米导线电子传递机制及其应用. 化学进展, 2012, 24(9): 1794-1800. |
| [60] |
Liu X, Ma LY. Microbial nanowire and nanotube and their involvements in extracellular electron transfer and exchange of intracellular molecular. Bulletin of Mineralogy, Petrology and Geochemistry, 2018, 37(1): 48-54.
(in Chinese) 刘茜, 马旅雁. 微生物纳米导线、纳米管与胞外电子传递及胞间物质交换. 矿物岩石地球化学通报, 2018, 37(1): 48-54. |
| [61] | Reguera G, McCarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [62] | Shi L, Squier TC, Zachara JM, Fredrickson JK. Respiration of metal (hydr) oxides by Shewanella and Geobacter:a key role for multihaem c-type cytochromes. Molecular Microbiology, 2007, 65(1): 12-20. DOI:10.1111/j.1365-2958.2007.05783.x |
| [63] | Cologgi DL, Lampa-Pastirk S, Speers AM, Kelly SD, Reguera G. Extracellular reduction of uranium via geobacter conductive pili as a protective cellular mechanism. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(37): 15248-15252. DOI:10.1073/pnas.1108616108 |
| [64] | Wang FB, Gu YQ, O'Brien JP, Yi SM, Yalcin SE, Srikanth V, Shen C, Vu D, Ing NL, Hochbaum AI, Egelman EH, Malvankar NS. Structure of microbial nanowires reveals stacked Hemes that transport electrons over micrometers. Cell, 2019, 177(2): 361-369. DOI:10.1016/j.cell.2019.03.029 |
| [65] | Lovley DR. Live wires:direct extracellular electron exchange for bioenergy and the bioremediation of energy-related contamination. Energy & Environmental Science, 2011, 4(12): 4896-4906. |
| [66] | Malvankar NS, Vargas M, Nevin KP, Franks AE, Leang C, Kim BC, Inoue K, Mester T, Covalla SF, Johnson JP, Rotello VM, Tuominen MT, Lovley DR. Tunable metallic-like conductivity in microbial nanowire networks. Nature Nanotechnology, 2011, 6(9): 573-579. DOI:10.1038/nnano.2011.119 |
| [67] | Malvankar NS, Vargas M, Nevin KP, Tremblay PL, Evans-Lutterodt K, Nykypanchuk D, Martz E, Tuominen MT, Lovley DR. Structural basis for metallic-like conductivity in microbial nanowires. mBio, 2015, 6(2): e00084-15. DOI:10.1128/mBio.00084-15 |
| [68] | Liu FH, Rotaru AE, Shrestha PM, Malvankar NS, Nevin KP, Lovley DR. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange. Environmental Microbiology, 2015, 17(3): 648-655. DOI:10.1111/1462-2920.12485 |
| [69] | Pirbadian S, Barchinger SE, Leung KM, Byun HS, Jangir Y, Bouhenni RA, Reed SB, Romine MF, Saffarini DA, Shi L, Gorby YA, Golbeck JH, El-Naggar MY. Shewanella oneidensis MR-1 nanowires are outer membrane and periplasmic extensions of the extracellular electron transport components. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(35): 12883-12888. DOI:10.1073/pnas.1410551111 |
| [70] | Gorby YA, Yanina S, McLean JS, Rosso KM, Moyles D, Dohnalkova A, Beveridge TJ, Chang IS, Kim BH, Kim KS, Culley DE, Reed SB, Romine MF, Saffarini DA, Hill EA, Shi L, Elias DA, Kennedy DW, Pinchuk G, Watanabe K, Ishii SI, Logan B, Nealson KH, Fredrickson JK. Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(30): 11358-11363. DOI:10.1073/pnas.0604517103 |
| [71] | El-Naggar MY, Wanger G, Leung KM, Yuzvinsky TD, Southam G, Yang J, Lau WM, Nealson KH, Gorby YA. Electrical transport along bacterial nanowires from Shewanella oneidensis MR-1. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(42): 18127-18131. DOI:10.1073/pnas.1004880107 |
| [72] | Gavrilov SN, Lloyd JR, Kostrikina NA, Slobodkin AI. Fe(Ⅲ) Oxide reduction by a Gram-positive thermophile:physiological mechanisms for dissimilatory reduction of poorly crystalline Fe(Ⅲ) oxide by a thermophilic gram-positive bacterium Carboxydothermus ferrireducens. Geomicrobiology Journal, 2012, 29(9): 804-819. DOI:10.1080/01490451.2011.635755 |
| [73] | Wegener G, Krukenberg V, Riedel D, Tegetmeyer HE, Boetius A. Intercellular wiring enables electron transfer between methanotrophic archaea and bacteria. Nature, 2015, 526(7574): 587-590. DOI:10.1038/nature15733 |
| [74] | Wang ZM, Shi Z, Shi L, White GF, Richardson DJ, Clarke TA, Fredrickson JK, Zachara JM. Effects of soluble flavin on heterogeneous electron transfer between surface-exposed bacterial cytochromes and iron oxides. Geochimica et Cosmochimica Acta, 2015, 163: 299-310. DOI:10.1016/j.gca.2015.03.039 |
| [75] | Glasser NR, Saunders SH, Newman DK. The colorful world of extracellular electron shuttles. Annual Review of Microbiology, 2017, 71: 731-751. DOI:10.1146/annurev-micro-090816-093913 |
| [76] | Thirumurthy MA, Jones AK. Geobacter cytochrome OmcZs binds riboflavin:implications for extracellular electron transfer. Nanotechnology, 2020, 31(12): 124001. DOI:10.1088/1361-6528/ab5de6 |
| [77] |
Ma JL, Ma C, Tang J, Zhou SG, Zhuang L. Mechanisms and applications of electron shuttle-mediated extracellular electron transfer. Progress in Chemistry, 2015, 27(12): 1833-1840.
(in Chinese) 马金莲, 马晨, 汤佳, 周顺桂, 庄莉. 电子穿梭体介导的微生物胞外电子传递:机制及应用. 化学进展, 2015, 27(12): 1833-1840. |
| [78] | Ross DE, Brantley SL, Tien M. Kinetic characterization of OmcA and MtrC, terminal reductases involved in respiratory electron transfer for dissimilatory iron reduction in Shewanella oneidensis MR-1. Applied and Environmental Microbiology, 2009, 75(16): 5218-5226. DOI:10.1128/AEM.00544-09 |
| [79] | Shi Z, Zachara JM, Shi L, Wang ZM, Moore DA, Kennedy DW, Fredrickson JK. Redox reactions of reduced flavin mononucleotide (FMN), riboflavin (RBF), and anthraquinone-2, 6-disulfonate (AQDS) with ferrihydrite and lepidocrocite. Environmental Science & Technology, 2012, 46(21): 11644-11652. |
| [80] | Light SH, Su L, Rivera-Lugo R, Cornejo JA, Louie A, Iavarone AT, Ajo-Franklin CM, Portnoy DA. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature, 2018, 562(7725): 140-144. DOI:10.1038/s41586-018-0498-z |
| [81] | Light SH, Méheust R, Ferrell JL, Cho J, Cho J, Deng D, Agostoni M, Iavarone AT, Banfield JF, D'Orazio SEF, Portnoy DA. Extracellular electron transfer powers flavinylated extracellular reductases in Gram-positive bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(52): 26892-26899. DOI:10.1073/pnas.1915678116 |
| [82] | Wang Y, Newman DK. Redox reactions of phenazine antibiotics with ferric (hydr)oxides and molecular oxygen. Environmental Science & Technology, 2008, 42(7): 2380-2386. |
| [83] | Paquete CM, Fonseca BM, Cruz DR, Pereira TM, Pacheco I, Soares CM, Louro RO. Exploring the molecular mechanisms of electron shuttling across the microbe/metal space. Frontiers in Microbiology, 2014, 5: 318. |
| [84] | Bosire EM, Rosenbaum MA. Electrochemical potential influences phenazine production, electron transfer and consequently electric current generation by Pseudomonas aeruginosa. Frontiers in Microbiology, 2017, 8: 892. DOI:10.3389/fmicb.2017.00892 |
| [85] | Saunders SH, Tse ECM, Yates MD, Otero FJ, Trammell SA, Stemp EDA, Barton JK, Tender LM, Newman DK. Extracellular DNA promotes efficient extracellular electron transfer by pyocyanin in Pseudomonas aeruginosa biofilms. bioRxiv, 2019. DOI:10.1101/2019.12.12.872085 |
| [86] | Ratasuk N, Nanny MA. Characterization and quantification of reversible redox sites in humic substances. Environmental Science & Technology, 2007, 41(22): 7844-7850. |
| [87] |
Wu YD, Li FB, Liu TX. Mechanism of extracellular electron transfer among microbe-humus-mineral in soil:a review. Acta Pedologica Sinica, 2016, 53(2): 277-291.
(in Chinese) 吴云当, 李芳柏, 刘同旭. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展. 土壤学报, 2016, 53(2): 277-291. |
| [88] | Nevin KP, Lovley DR. Potential for nonenzymatic reduction of Fe(Ⅲ) via electron shuttling in subsurface sediments. Environmental Science & Technology, 2000, 34(12): 2472-2478. |
| [89] | Monteiro SCR, Pinho GLL, Hoffmann K, Barcarolli IF, Bianchini A. Acute waterborne copper toxicity to the euryhaline copepod Acartia tonsa at different salinities:influence of natural freshwater and marine dissolved organic matter. Environmental Toxicology and Chemistry, 2013, 32(6): 1412-1419. DOI:10.1002/etc.2197 |
| [90] | Zhou SG, Chen SS, Yuan Y, Lu Q. Influence of humic acid complexation with metal ions on extracellular electron transfer activity. Scientific Reports, 2015, 5(1): 17067. DOI:10.1038/srep17067 |
| [91] | Lovley DR, Blunt-Harris EL. Role of humic-bound iron as an electron transfer agent in dissimilatory Fe(Ⅲ) reduction. Applied and Environmental Microbiology, 1999, 65(9): 4252-4254. DOI:10.1128/AEM.65.9.4252-4254.1999 |
| [92] | Zhang CF, Zhang DD, Li ZL, Akatsuka T, Yang SY, Suzuki D, Katayama A. Insoluble Fe-humic acid complex as a solid-phase electron mediator for microbial reductive dechlorination. Environmental Science & Technology, 2014, 48(11): 6318-6325. |
| [93] | Kondo K, Okamoto A, Hashimoto K, Nakamura R. Sulfur-mediated electron shuttling sustains microbial long-distance extracellular electron transfer with the aid of metallic iron sulfides. Langmuir, 2015, 31(26): 7427-7434. DOI:10.1021/acs.langmuir.5b01033 |
| [94] | Nakamura R, Okamoto A, Tajima N, Newton GJ, Kai F, Takashima T, Hashimoto K. Biological iron-monosulfide production for efficient electricity harvesting from a deep-sea metal-reducing bacterium. ChemBioChem, 2010, 11(5): 643. DOI:10.1002/cbic.200900775 |
| [95] | Deng X, Dohmae N, Kaksonen AH, Okamoto A. Biogenic iron sulfide nanoparticles to enable extracellular electron uptake in sulfate-reducing bacteria. Angewandte Chemie, 2020, 132(15): 6051-6055. DOI:10.1002/ange.201915196 |
| [96] | Sheng GP, Yu HQ, Li XY. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review. Biotechnology Advances, 2010, 28(6): 882-894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [97] | Flemming HC, Neu TR, Wozniak DJ. The EPS matrix:the "house of biofilm cells". Journal of Bacteriology, 2007, 189(22): 7945-7947. DOI:10.1128/JB.00858-07 |
| [98] | Flemming HC, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg S. Biofilms:an emergent form of bacterial life. Nature Reviews Microbiology, 2016, 14(9): 563-575. DOI:10.1038/nrmicro.2016.94 |
| [99] | Decho AW. Microbial exopolymer secretions in ocean environments:their role(s) in food webs and marine processes. Oceanography and Marine Biology, 1990, 28: 73-154. |
| [100] | Decho AW. Microbial biofilms in intertidal systems:an overview. Continental Shelf Research, 2000, 20(10/11): 1257-1273. |
| [101] | Palmgren R, Nielsen PH. Accumulation of DNA in the exopolymeric matrix of activated sludge and bacterial cultures. Water Science and Technology, 1996, 34(5/6): 233-240. |
| [102] | Jahn A, Griebe T, Nielsen PH. Composition of Pseudomonas putida biofilms:accumulation of protein in the biofilm matrix. Biofouling, 1999, 14(1): 49-57. DOI:10.1080/08927019909378396 |
| [103] | Gehrke T, Telegdi J, Thierry D, Sand W. Importance of extracellular polymeric substances from Thiobacillus ferrooxidans for bioleaching. Applied and Environmental Microbiology, 1998, 64(7): 2743-2747. DOI:10.1128/AEM.64.7.2743-2747.1998 |
| [104] | Marshall MJ, Beliaev AS, Dohnalkova AC, Kennedy DW, Shi L, Wang ZM, Boyanov MI, Lai B, Kemner KM, McLean JS, Reed SB, Culley DE, Bailey VL, Simonson CJ, Saffarini DA, Romine MF, Zachara JM, Fredrickson JK. c-Type cytochrome-dependent formation of U (Ⅳ) nanoparticles by Shewanella oneidensis. PLoS Biology, 2006, 4(8): e268. DOI:10.1371/journal.pbio.0040268 |
| [105] | Xiao Y, Zhang EH, Zhang JD, Dai YF, Yang ZH, Christensen HEM, Ulstrup J, Zhao F. Extracellular polymeric substances are transient media for microbial extracellular electron transfer. Science Advances, 2017, 3(7): e1700623. DOI:10.1126/sciadv.1700623 |
| [106] | Liu X, Zhuo SY, Jing XY, Yuan Y, Rensing C, Zhou SG. Flagella act as Geobacter biofilm scaffolds to stabilize biofilm and facilitate extracellular electron transfer. Biosensors and Bioelectronics, 2019, 146: 111748. DOI:10.1016/j.bios.2019.111748 |
| [107] | Wirsen CO, Brinkhoff T, Kuever J, Muyzer G, Molyneaux S, Jannasch HW. Comparison of a new Thiomicrospira strain from the mid-atlantic ridge with known hydrothermal vent isolates. Applied and Environmental Microbiology, 1998, 64(10): 4057-4059. DOI:10.1128/AEM.64.10.4057-4059.1998 |
| [108] | Manzella MP, Reguera G, Kashefi K. Extracellular electron transfer to Fe(Ⅲ) oxides by the hyperthermophilic archaeon Geoglobus ahangari via a direct contact mechanism. Applied and Environmental Microbiology, 2013, 79(15): 4694-4700. DOI:10.1128/AEM.01566-13 |
| [109] | Kawaichi S, Yamada T, Umezawa A, McGlynn SE, Suzuki T, Dohmae N, Yoshida T, Sako Y, Matsushita N, Hashimoto K, Nakamura R. Anodic and cathodic extracellular electron transfer by the filamentous bacterium Ardenticatena maritima 110S. Frontiers in Microbiology, 2018, 9: 68. DOI:10.3389/fmicb.2018.00068 |
| [110] | Byrne JM, Klueglein N, Pearce CI, Rosso KM, Appel E, Kappler A. Redox cycling of Fe(Ⅱ) and Fe(Ⅲ) in magnetite by Fe-metabolizing bacteria. Science, 2015, 347(6229): 1473-1476. DOI:10.1126/science.aaa4834 |
| [111] | Zhao LD, Dong HL, Kukkadapu RK, Zeng Q, Edelmann RE, Pentrák M, Agrawal A. Biological redox cycling of iron in nontronite and its potential application in nitrate removal. Environmental Science & Technology, 2015, 49(9): 5493-5501. |
| [112] | Nakamura R, Kai F, Okamoto A, Newton GJ, Hashimoto K. Self-constructed electrically conductive bacterial networks. Angewandte Chemie, 2009, 48(3): 508-511. DOI:10.1002/anie.200804750 |
| [113] | Kato S, Hashimoto K, Watanabe K. Microbial interspecies electron transfer via electric currents through conductive minerals. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(25): 10042-10046. DOI:10.1073/pnas.1117592109 |
| [114] | Jiang SH, Park S, Yoon Y, Lee JH, Wu WM, Dan NP, Sadowsky MJ, Hur HG. Methanogenesis facilitated by geobiochemical iron cycle in a novel syntrophic methanogenic microbial community. Environmental Science & Technology, 2013, 47(17): 10078-10084. |
| [115] | Aulenta F, Rossetti S, Amalfitano S, Majone M, Tandoi V. Conductive magnetite nanoparticles accelerate the microbial reductive dechlorination of trichloroethene by promoting interspecies electron transfer processes. ChemSusChem, 2013, 6(3): 433-436. DOI:10.1002/cssc.201200748 |
| [116] | Blankenship RE, Tiede DM, Barber J, Brudvig GW, Fleming G, Ghirardi M, Gunner MR, Junge W, Kramer DM, Melis A, Moore TA, Moser CC, Nocera DG, Nozik AJ, Ort DR, Parson WW, Prince RC, Sayre RT. Comparing photosynthetic and photovoltaic efficiencies and recognizing the potential for improvement. Science, 2011, 332(6031): 805-809. DOI:10.1126/science.1200165 |
| [117] | Zhang H, Liu H, Tian ZQ, Lu D, Yu Y, Cestellos-Blanco S, Sakimoto KK, Yang PD. Bacteria photosensitized by intracellular gold nanoclusters for solar fuel production. Nature Nanotechnology, 2018, 13(10): 900-905. DOI:10.1038/s41565-018-0267-z |
| [118] | Honda Y, Hagiwara H, Ida S, Ishihara T. Application to photocatalytic H2 Production of a whole-cell reaction by Recombinant Escherichia coli cells expressing[FeFe]-hydrogenase and maturases genes. Angewandte Chemie International Edition, 2016, 55(28): 8045-8048. DOI:10.1002/anie.201600177 |
| [119] | Wei W, Sun PQ, Li Z, Song KS, Su WY, Wang B, Li YZ, Zhao J. A surface-display biohybrid approach to light-driven hydrogen production in air. Science Advances, 2018, 4(2): eaap9253. DOI:10.1126/sciadv.aap9253 |
| [120] | Zheng DW, Chen Y, Li ZH, Xu L, Li CX, Li B, Fan JX, Cheng SX, Zhang XZ. Optically-controlled bacterial metabolite for cancer therapy. Nature Communications, 2018, 9(1): 1680. DOI:10.1038/s41467-018-03233-9 |
 2020, Vol. 60
2020, Vol. 60