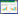中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 杨永刚, 李道波, 许玫英. 2020
- Yonggang Yang, Daobo Li, Meiying Xu. 2020
- 微生物胞外长距离电子传递网络研究进展
- Research progress in microbial extracellular long-distance electron transport networks
- 微生物学报, 60(9): 2072-2083
- Acta Microbiologica Sinica, 60(9): 2072-2083
-
文章历史
- 收稿日期:2020-03-28
- 修回日期:2020-05-26
- 网络出版日期:2020-05-29
电子传递过程是地球环境演化和生命进化的重要驱动力[1]。在长期自然选择和进化过程中,部分微生物衍生出了一些独特的电子传递和能量转化方式,能够通过细胞电子传递链与胞外电子供体或受体发生电子交换,这类微生物被称为电活性微生物。在土壤、沉积物、废水等环境中,电活性微生物可以通过多种胞外电子传递(extracellular electron transfer,EET)过程相互交错、相互影响,从而构成了微生物胞外电子传递网络[2-4]。
电子传递距离是衡量和评价电活性微生物电子传递能力的重要指标。生物体系中跨越多个氧化还原活性中心的电子传递(距离 > 1个纳米)即可定义为长距离电子传递(long-distance electron transport,LDET)[5]。近年来,随着多学科理论和技术的融合发展,微生物纳米导线、导电生物被膜及微生物种间电子传递等多种新型的微生物胞外电子传递机制不断被发现,不同分子、不同细胞甚至不同物种之间的长距离电子传递途径也陆续被报道[2-4, 6]。相应地,微生物长距离电子传递的尺度也从纳米拓展至微米甚至厘米。在实际环境中,不同的微生物长距离电子传递过程构成了错综复杂的长距离电子传递网络(long-distance electron transport networks,LETNs),共同驱动物质循环和能量转化。这一系列新发现不仅补充和拓展了人们对电活性微生物电子传递机制的科学认知,而且为更好地利用电活性微生物解决环境保护、新能源、新材料、绿色化工等领域所面临的科学难题和技术挑战提供了重要的科学参考。
本文将以电子传递距离为主线,重点关注电活性微生物主导的不同尺度的长距离电子传递过程和网络,对LETNs的机制、功能及面临的理论和技术问题进行探讨,并对未来的主要研究方向进行展望。
1 纳米尺度的微生物电子传递网络 1.1 微生物跨膜电子传递网络对于革兰氏阴性细菌而言,细胞周质空间的跨度一般为20–30 nm。目前有关细菌跨膜电子传递过程研究得最为清楚的是Shewanella oneidensis (图 1-A)。据估算,一个S. oneidensis细胞的周质空间(约0.2 fL)中含有超过30万个来自细胞色素c的血红素,因此S. oneidensis的周质空间存在着一个密集的电子传递网络[7]。由CymA-MtrA- MtrC/OmcA组成的跨膜细胞色素c通道不仅是该菌向胞外输出电子的主要途径,也是其从胞外获得电子的主要途径[3]。其中,电子进入和排出周质空间的主要通道蛋白CymA和MtrA分别位于细胞内膜和外膜[3, 8],距离超过10 nm,因此两者之间的电子传递需要借助其他蛋白共同介导[7]。目前已报道的S. oneidensis周质空间中参与跨膜电子传递的蛋白主要包括STC、FccA和MCC等。然而,基于模型预测和基因敲除的结果显示,周质空间中还可能有超过10个氧化还原蛋白参与了跨膜电子传递[3, 9-10]。但是,这些蛋白的具体功能及其在CymA与MtrA之间电子传递中的作用尚缺少直接证据。在EET过程中,周质空间中的氧化还原蛋白并非全部发挥功能,其中一些冗余蛋白(如NrfA、NapB、DmsC)的存在甚至起到抑制作用[9]。我们最近的研究表明,S. decolorationis S12中sorA与mcc位于同一操纵子、编码2个在EET中发挥相反功能的周质空间蛋白,当敲除sorA基因后菌株S12还原电极的EET效率提高了25%[10-11]。可见,减少冗余蛋白也是提高细菌EET速率的有效途径。

|
| 图 1 基于Shewanella (A)和Geobacter (B)的周质空间及细胞表面的电子传递网络 Figure 1 Bacterial periplasmic and outer surface electron transfer networks based on researches on Shewanella (A) and Geobacter (B). RF: riboflavin; FMN: flavin mononucleotide. |
Geobacter sulfurreducens是研究EET的另一个模式菌,它具有类似Shewanella的跨膜电子传递系统(图 1-B),并可以进行双向电子传递。Shi等已对该系统做了较全面的介绍[2-3]。目前的研究显示,G. sulfurreducens可以进行双向的跨膜电子传递,但这两种EET途径所使用的细胞色素c不同。比如,敲除OmcZ和OmcS等重要的电子传出功能细胞色素c并不影响G. sulfurreducens的胞外电子输入[12];而参与电子输入的周质空间蛋白PccH并不参与电子传出过程[13]。这可能与G. sulfurreducens在不同电位下所表达的细胞色素c种类不同这一特性有关。但有关G. sulfurreducens的电子输入机理至今尚不清楚。
铁氧化菌Rhodopseudomonas palustris和Acidithiobacillus ferrooxidans常被用于研究细菌自外向内的电子传递机制。R. palustris的胞外电子传入通道与S. oneidensis用于电子传出的Mtr通道非常相似:PioA锚定于外膜孔蛋白PioB中,通过周质空间中的铁硫蛋白PioC与内膜上的氧化还原蛋白系统连接;而在A. ferrooxidans细胞的周质空间中,PioC被铜蓝蛋白和另外两种细胞色素c代替[14-15]。值得注意的是,胞外铁氧化的EET是逆电势梯度的过程,需要特殊的能量补偿机制。R. palustris和A. ferrooxidans分别需要酸性环境所提供的质子梯度化学能和光能才能进行反向电子传递[16]。
革兰氏阳性菌细胞壁的厚度往往超过30 nm,且含有大量绝缘性的肽聚糖、磷壁酸等物质[17]。因而,已发现的具有EET功能的革兰氏阳性细菌较少,且大多依赖核黄素、醌类物质等电子介体[18]。Thermincola potens是目前唯一已报道的可以利用跨细胞色素c进行EET的革兰氏阳性细菌[19],但该菌的跨膜电子传递机制尚缺乏直接证据。
1.2 微生物细胞表面的电子传递网络一般地,微生物细胞表面都会有数十纳米厚、组分复杂的胞外多聚物(extracellular polymer substances,EPS)。EPS中不仅包含大量的微生物氧化还原酶、电子介体等氧化还原活性分子,还会吸附胞外电子受体,在细胞表面形成电子传递网络[20]。已有研究显示,微生物外表面的多种氧化还原酶(如细胞色素c、过氧化氢还原酶、铁硫蛋白等)可能都参与了EET[21-22]。
以S. oneidensis为例,其外膜表面的细胞色素c密度可高达30000个/μm2[23]。MtrC/OmcA是两个主要的外膜细胞色素c,MtrC接收MtrA的电子并传递给邻近的OmcA或其他胞外电子受体(图 1-A)。实际上,即使在MtrC/OmcA都缺失的条件下,S. oneidensis仍能维持30%以上的EET能力,这是因为S. oneidensis在这种情况下会启动备用的外膜电子传递蛋白(如MtrF、铁硫蛋白等)[21, 24]。这种EET途径的灵活性有助于Shewanella在多变的环境中生存。此外,Shewanella的外膜细胞色素c还具有高度的特异性,如在可溶性Fe(Ⅲ)还原过程中,MtrC发挥了关键作用,而OmcA和MtrF则无明显作用[25];外膜细胞色素c的表达水平还会随电子受体氧化还原电位的不同而发生改变[26]。Okamoto等还报道了胞外细胞色素c与不同电子介体之间的特异性结合关系,即OmcA特异性结合核黄素(riboflavin, RF),而MtrC特异性结合黄素单核苷酸(flavin mononucleotide,FMN)[27],但相关的结合和解离过程受到环境氧化还原状态的调控[28]。
G. sulfurreducens拥有更多种类的外膜细胞色素c (outer membrane cytochrome c,Omc),如OmcB、OmcC、OmcS、OmcZ等。这些细胞色素c的功能和组成在还原胞外电子受体(如矿物颗粒、腐殖质和电极等)时也表现出高度的灵活性和特异性。比如OmcZ是参与G. sulfurreducens电极还原的关键蛋白,但并不参与其胞外腐殖质呼吸;OmcS是参与还原电极及固态铁锰氧化物的关键蛋白,但并不参与该菌还原可溶性铁的过程[25]。最近的研究还发现,G. sulfurreducens可以感应胞外电子受体氧化还原电位的差异,通过CbcL或ImcH途径调控细胞的呼吸代谢;这两种途径所利用的外膜细胞色素c和EET功能也存在显著差异[29]。这些研究表明,细菌可以根据外部环境变化而精准地调控细胞表面电子传递网络的组成和电子传递效率。由此可见,纳米尺度的跨膜及细胞表面电子传递网络在提高电活性微生物的环境适应性和定殖能力方面发挥着重要作用。
2 微生物微米尺度的电子传递网络 2.1 纳米导线2005年,Reguera等首次报道了G. sulfurreducens可以合成直径为3–5 nm、长度为10–20 μm且具有导电功能的蛋白纳米线[6]。这些纳米导线可以在细胞周围形成交错的导电网络,通过直接接触将电子传递给具有微米级尺度距离的胞外电子受体。此后,纳米导线陆续在不同环境的10多种微生物中发现,包括S. oneidensis、Syntrophus aciditrophicus以及古菌Methanospirillum hungatei等[3, 30-32],甚至在人体下颚骨的生物被膜中也发现了大量纳米导线,推测纳米导线在环境中普遍存在且发挥着重要功能[33]。此外,微生物纳米导线还被认为是极具应用价值的绿色能源材料[34],已引起了微生物学、物理学和材料学等不同学科研究者的广泛关注[5, 32-34]。
S. oneidensis的纳米导线被证实是由细胞外膜延伸引起的,通常具有较粗的直径,其导电性可能是由细胞膜上密集的细胞色素c所形成[23]。G. sulfurreducens的纳米导线自从被发现以来一直被认为是四型菌毛(图 1-B),其导电性是由于菌毛蛋白PilA中密集的芳香氨基酸通过苯环π-π共轭所形成[35]。但相关的推测由于缺乏直接证据而在很长一段时间受到研究者的质疑[36]。直到最近,不同课题组通过冷冻电镜技术证明G. sulfurreducens的纳米导线是由细胞色素c (OmcS)分子首尾相接而成[37-38]。尽管如此,仍有一些问题尚需解答,比如:为何G. sulfurreducens的菌毛基因pilA通过异源表达或自组装而成的纳米线具有导电性[39-40]?微生物是否可以合成分子组成不同的纳米导线?
2.2 微生物细胞间的电子传递网络微生物细胞间的电子传递在产甲烷、甲烷氧化、硫酸盐还原等多种重要生物地球化学循环过程中发挥着关键作用。细胞间的电子传递可以分为可溶性代谢中间物(如甲酸、氢气等)或电子介体(核黄素、吩嗪等)扩散介导的间接型和固态导体(如细胞色素c、纳米导线或人工导体材料等)介导的直接接触型两种方式[41-42]。尽管间接型的细胞间电子传递广泛存在,但其本质上是电子介体长距离扩散后的近距离电子传递过程,本文不再详述。直接接触型的微生物种间电子传递被认为具有更高的电子转移效率和更好的实际应用前景,因而近年来研究进展比较迅速。下面将在前期有关微生物直接种间电子传递研究综述的基础上[42-44],进一步对该方向近期的重要进展进行总结。
Geobacter是到目前为止所发现的唯一可以在不同种微生物之间发生直接电子传递的细菌。前期研究发现,pilA基因突变后Geobacter无法与其他微生物形成共生体系,因此纳米导线在很长一段时间被认为是Geobacter直接电子传递模式中的关键[45]。而最近Liu等的研究发现,在缺失纳米导线的条件下,G. sulfurreducens和G. metallireducens仍可通过细胞色素c介导的直接电子传递和黄素介导的间接电子传递形成共生体系[46-47]。S. aciditrophicus也是一个研究较多的需要与其他微生物形成共生系统的共生型细菌,但早期的研究认为它主要通过间接电子传递维持共生。最近,Walker等发现了S. aciditrophicus的四型菌毛基因及其合成纳米导线的能力,并且发现该菌还可以通过纳米导线与G. sulfurreducens形成共生关系[30]。该研究还指出,在普遍存在的微生物共生体系中,直接和间接的电子传递过程可以同时进行,但会受到共生对象、底物种类以及环境因素的调控。
尽管越来越多的微生物细胞间直接电子传递被发现,但相关的电子传递机制尚不完全清楚,外膜细胞色素c与菌毛在共生体系中如何协同作用、电子受体细胞如何接收电子、共生体系内的能量如何分配等问题仍然有待解答。
2.3 生物被膜内电子传递网络地球上大多数的微生物以生物被膜的形式存在[48]。由于生物被膜的EPS中含有大量的脂类、多糖等绝缘性物质,一般认为生物被膜是不导电的。然而越来越多的研究表明[20],当生物被膜中富集了大量的氧化还原蛋白、纳米导线等具有电子传递功能的组分时,其导电能力将显著增加,可以达到数百μS/cm[35, 49]。
Geobacter是目前唯一已知的可以形成导电生物被膜的纯培养微生物。Geobacter生物被膜的导电性主要来自于其内部的纳米导线和细胞色素c[42, 49]。Geobacter生物被膜外侧细胞释放的电子可以传递给内侧的细胞和电子受体进行跨越几十微米的电子传递[49]。但是,Geobacter生物被膜的导电机制目前仍存在一定争议。较早的研究发现Geobacter生物被膜具有类似金属的导电特性[35],而最近的研究表明Geobacter生物被膜内的电子传递是依赖氧化还原基团间的电子跃迁过程,主要证据是其电导率会随氧化还原电位的变化而呈“倒钟形”变化,且随含水量的降低而降低[42, 50-51]。电子跃迁模型要求生物被膜内的氧化还原分子形成高度有序、致密的电子传递网络,而目前有关微生物是否以及如何根据环境变化调整生物被膜内的电子传递网络结构和功能等研究仍然较少。Liu等发现生物被膜的导电性会随厚度的增加而提高[52]。除纳米导线外,鞭毛的存在也有利于生物被膜内氧化还原分子的高效组装并加快电子传递[53]。与Geobacter相比,Shewanella的电子传递途径更为多样,但其形成生物被膜的能力较弱,因而Shewanella生物被膜的导电性研究较少[35]。如果可以有效促进Shewanella生物被膜的形成,将为研究认识生物被膜的电子传递机制提供另一种重要模型。
越来越多的来自沉积物、废水、海水等环境的混合菌生物被膜或颗粒污泥也被发现具有导电性[54-58]。较早的研究认为高丰度的Geobacter是导电生物被膜的必要条件,但近来的研究发现低丰度、甚至缺失Geobacter的生物被膜也可以具有较高的导电性[58]。这些生物被膜普遍表现出电子跃迁的导电机制,最大电导率对应的氧化还原电位在–200到–400 mV之间[52, 57]。相对于纯菌生物被膜,混合菌生物被膜的物理结构和电子传递网络更为复杂。除了细胞色素c和纳米导线,其他的氧化还原活性物质如电子介体、腐殖质、矿物颗粒等也有可能发挥重要作用(图 2-A)。Yates等发现铁硫蛋白也可能是混合菌生物被膜电子传递网络中的关键组分[22],我们的研究也发现Shewanella生物被膜细胞表面铁硫蛋白参与了EET过程[21]。值得注意的是,目前已报道的导电生物被膜大多来自人工构建的反应器,自然环境中导电生物被膜或生物聚集体的分布及功能特点尚待阐明。

|
| 图 2 生物被膜(A)和沉积物(B)内的长距离电子传递网络 Figure 2 LETNs in biofilms (A) and sediments (B). |
3 厘米及更远距离的微生物电子传递网络
电缆细菌是由数以万计的短杆状细胞首尾相连形成长达数厘米的微生物(图 2-B)。它们在各种自然水体的泥-水界面普遍存在,对S、P、C及Fe等元素的循环发挥着重要作用[59]。受沉积物理化特性的影响,电缆细菌在泥-水界面形成错综复杂的电子传递网络。除了介导多种元素之间的氧化还原过程,电缆细菌还介导了不同物种之间的代谢和电子传递[60]。近两年,研究人员采用跨学科的技术手段开展了电缆细菌研究,取得大量新进展。
Bjerg等发现电缆细菌中的细胞色素c从沉积物端向氧气端逐渐由还原态转为氧化态,提出细胞色素c是电缆细菌电子传递的主要途径[41]。电缆细菌的结构是认识其长距离电子传递的关键。Jiang等发现电缆细菌的细胞外表面有多条凸起的贯穿整个细胞的脊,脊内含有一条直径约50 nm的纳米线[61]。最近的研究发现,电缆细菌细胞表面具有导电性,其凸起的脊内部的纳米导线的导电性高达79 S/cm[62]。但该研究的结果也显示电缆细菌的纳米线并非由细胞色素c组成,这与之前Bjerg等提出的电缆细菌主要通过细胞色素c进行电子传递的观点不一致[41, 62]。Geerlings等最近的研究发现,只有沉积物一端的电缆细菌细胞进行代谢并获得能量,而氧气一端的细胞可能只是负责维持纳米导线结构并还原氧气[63]。随着电缆细菌导电性的发现,一些新的问题也随之产生,如电缆细菌的导体表面及其纳米导线的分子组成是什么?能否与周围环境中的矿物颗粒或EET功能微生物进行直接电子传递?
在发现电缆细菌介导泥-水界面的电子传递之后,Malvankar等发现了更深层(50 cm)的天然海洋沉积物中也存在与电缆细菌所介导的电子传递速率相当的厘米级尺度电子传递过程(7 μS/cm),对于表层氧化后的沉积物则没有明显导电性,而添加黄铁矿可以显著提高沉积物的导电性[55]。推测在深层沉积物中矿物质等非生物材料所介导的电子传递过程也发挥着重要作用。在地球表层、海底热液口等多种环境中也陆续发现了由矿物所介导的数厘米甚至数米的电子传递[64-65],结合矿物表层的光电效应以及微生物氧化还原过程[66],不同环境中生物地球电化学过程的重要功能将远远超出我们现有的科学认知。
4 总结和展望随着越来越多具有长距离电子传递功能电活性微生物菌种资源和环境样品的发现,微生物LETNs的作用特点和调控机制逐渐得到阐明,已成为生命、环境、材料等多个学科共同关注的热点。根据已有的研究证据,我们有理由推测,电活性微生物所介导的不同尺度、不同类型的长距离电子传递过程在实际环境中广泛存在,并且相互耦联,形成更大尺度的LETNs,共同驱动物质循环和能量转化。以自然水体环境为例,电缆细菌在泥-水界面构成了跨度为几个厘米的LETNs。与此同时,更深层沉积物中普遍存在的各种电活性微生物以及腐殖质、矿物颗粒等电子传递载体,可以构建成更庞大的深层LETNs,源源不断地将沉积物中的电子向上传递给表层的电缆细菌LETNs,从而形成贯穿上覆水体和深层沉积物的巨型LETNs (图 2-B)。在认识LETNs功能机制的基础上,可以综合利用生物电化学、材料学、环境工程等技术手段,实现对环境中LETNs的定向强化和调控。如在土壤或活性污泥中添加生物炭、活性炭、矿物颗粒等导体或半导体材料,可以有效促进微生物间的电子传递,从而提高甲烷产生、污染物降解或电能回收效率[42, 67-69]。由此可见,LETNs机理、核心微生物及关键组分的阐明不仅对于认识元素生物地球化学循环具有重要意义,在生物合成、环境保护、新能源、新材料等领域也有重要的应用前景。
未来几年,以电活性微生物为核心的LETNs的主要研究方向将包括以下几个方面。
(1) 新型长距离电子传递功能电活性微生物资源的挖掘。目前已知的具有长距离电子传递功能的微生物种类极少,更多类型、更多环境来源的长距离电子传递功能微生物及其长距离电子传递机制的发现和揭示将为全面认识LETNs结构与功能提供宝贵的菌种资源和信息。
(2) 自然生态系统中LETNs的分布和功能特点。目前有关LETNs的研究主要集中在微生物纯培养体系和人工反应器,而对于自然生态系统中LETNs的分布规律及功能作用特点的阐明将更加全面系统地揭示LETNs的生态功能,在LETNs结构功能及其调控机制方面取得系列新的科学认知。
(3) LETNs定向调控技术及其应用。结合环境保护、生物电子、新能源、新材料等领域的实际需求,研发LETNs特异性定向调控技术,将充分发挥LETNs的功能特点,为绿色生产与能源回收利用提供重要的技术支撑。
此外,作为一个多学科交叉的研究领域,除分子生物学、微生物组学研究技术外,恒电位仪、导电探针台、微纳器件及原子力显微镜等设备在LETNs研究中也发挥着必不可少的作用。如何利用不同学科的理论和技术构建系统化、标准化的LETNs研究平台也将是深入揭示LETNs结构功能及其调控机制所亟需解决的重要问题。
随着长距离电子传递功能微生物资源、环境分布特点及其生态功能作用的逐步阐明,将为更加深入、系统地认识不同环境中的微生物生态网络结构特征及其作用机制提供重要的科学参考。共生微生物培养体系中LETNs结构及功能的揭示也有望为当前大量未培养微生物人工培养技术手段的建立和优化提供重要的科学理论指导。
| [1] | Richardson DJ. Bacterial respiration:a flexible process for a changing environment. Microbiology, 2000, 146(3): 551-571. |
| [2] | Shi L, Squier TC, Zachara JM, Fredrickson JK. Respiration of metal (hydr)oxides by Shewanella and Geobacter:a key role for multihaem c-type cytochromes. Molecular Microbiology, 2007, 65(1): 12-20. |
| [3] | Shi L, Dong HL, Reguera G, Beyenal H, Lu AH, Liu J, Yu HQ, Fredrickson JK. Extracellular electron transfer mechanisms between microorganisms and minerals. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
| [4] | Logan BE, Rossi R, Ragab A, Saikaly PE. Electroactive microorganisms in bioelectrochemical systems. Nature Reviews Microbiology, 2019, 17(5): 307-319. DOI:10.1038/s41579-019-0173-x |
| [5] | McLendon G. Long-distance electron transfer in proteins and model systems. Accounts of Chemical Research, 1988, 21(4): 160-167. DOI:10.1021/ar00148a005 |
| [6] | Reguera G, McCarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [7] | Sturm G, Richter K, Doetsch A, Heide H, Louro RO, Gescher J. A dynamic periplasmic electron transfer network enables respiratory flexibility beyond a thermodynamic regulatory regime. The ISME Journal, 2015, 9(8): 1802-1811. DOI:10.1038/ismej.2014.264 |
| [8] | Yang YG, Xu MY, Guo J, Sun GP. Bacterial extracellular electron transfer in bioelectrochemical systems. Process Biochemistry, 2012, 47(12): 1707-1714. DOI:10.1016/j.procbio.2012.07.032 |
| [9] | Bretschger O, Obraztsova A, Sturm CA, Chang IS, Gorby YA, Reed SB, Culley DE, Reardon CL, Barua S, Romine MF, Zhou JZ, Beliaev AS, Bouhenni R, Saffarini D, Mansfeld F, Kim BH, Fredrickson JK, Nealson KH. Current production and metal oxide reduction by Shewanella oneidensis MR-1 wild type and mutants. Applied and Environmental Microbiology, 2007, 73(21): 7003-7012. DOI:10.1128/AEM.01087-07 |
| [10] |
Kong GN, Xu MY, Song D, Yang YG. Role of Mcc in Shewanella decolorationis S12 electrode respiration. Microbiology China, 2017, 44(7): 1547-1554.
(in Chinese) 孔冠楠, 许玫英, 宋达, 杨永刚. Mcc在脱色希瓦氏菌S12电极呼吸中的作用. 微生物学通报, 2017, 44(7): 1547-1554. |
| [11] | Kong GN, Song D, Guo J, Sun GP, Zhu CJ, Chen FS, Yang YG, Xu MY. Lack of periplasmic non-heme protein SorA increases Shewanella decolorationis current generation. Frontiers in Microbiology, 2020, 11: 262. DOI:10.3389/fmicb.2020.00262 |
| [12] | Dantas JM, Tomaz DM, Morgado L, Salgueiro CA. Functional characterization of PccH, a key cytochrome for electron transfer from electrodes to the bacterium Geobacter sulfurreducens. FEBS Letters, 2013, 587(16): 2662-2668. DOI:10.1016/j.febslet.2013.07.003 |
| [13] | Strycharz SM, Glaven RH, Coppi MV, Gannon SM, Perpetua LA, Liu AN, Nevin KP, Lovley DR. Gene expression and deletion analysis of mechanisms for electron transfer from electrodes to Geobacter sulfurreducens. Bioelectrochemistry, 2011, 80(2): 142-150. DOI:10.1016/j.bioelechem.2010.07.005 |
| [14] | Gupta D, Sutherland MC, Rengasamy K, Meacham JM, Kranz RG, Bose A. Photoferrotrophs produce a PioAB electron conduit for extracellular electron uptake. mBio, 2019, 10(6): e02668-19. DOI:10.1128/mBio.02668-19 |
| [15] | Bose A, Gardel EJ, Vidoudez C, Parra EA, Girguis PR. Electron uptake by iron-oxidizing phototrophic bacteria. Nature Communications, 2014, 5: 3391. DOI:10.1038/ncomms4391 |
| [16] | Bird LJ, Bonnefoy V, Newman DK. Bioenergetic challenges of microbial iron Metabolisms. Trends in Microbiology, 2011, 19(7): 330-340. DOI:10.1016/j.tim.2011.05.001 |
| [17] | Pankratova G, Hederstedt L, Gorton L. Extracellular electron transfer features of Gram-positive bacteria. Analytica Chimica Acta, 2019, 1076: 32-47. DOI:10.1016/j.aca.2019.05.007 |
| [18] | Light SH, Su L, Rivera-Lugo R, Cornejo JA, Louie A, Iavarone AT, Ajo-Franklin CM, Portnoy DA. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature, 2018, 562(7725): 140-144. DOI:10.1038/s41586-018-0498-z |
| [19] | Carlson HK, Iavarone AT, Gorur A, Yeo BS, Tran R, Melnyk RA, Mathies RA, Auer M, Coates JD. Surface multiheme c-type cytochromes from Thermincola potens and implications for respiratory metal reduction by Gram-positive bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(5): 1702-1707. DOI:10.1073/pnas.1112905109 |
| [20] | Xiao Y, Zhang EH, Zhang JD, Dai YF, Yang YZ, Christensen HEM, Ulstrup J, Zhao F. Extracellular polymeric substances are transient media for microbial extracellular electron transfer. Science Advances, 2017, 3(7): e1700623. DOI:10.1126/sciadv.1700623 |
| [21] | Yang YG, Kong GN, Chen XJ, Lian YL, Liu WZ, Xu MY. Electricity generation by Shewanella decolorationis S12 without cytochrome c. Frontiers in Microbiology, 2017, 8: 1115. DOI:10.3389/fmicb.2017.01115 |
| [22] | Yates MD, Eddie BJ, Kotloski NJ, Lebedev N, Malanoski AP, Lin BC, Strycharz-Glaven SM, Tender LM. Toward understanding long-distance extracellular electron transport in an electroautotrophic microbial community. Energy & Environmental Science, 2016, 9(11): 3544-3558. |
| [23] | Subramanian P, Pirbadian S, El-Naggar MY, Jensen GJ. Ultrastructure of Shewanella oneidensis MR-1 nanowires revealed by electron cryotomograph. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(14): E3246-E3255. DOI:10.1073/pnas.1718810115 |
| [24] | Coursolle D, Baron DB, Bond DR, Gralnick JA. The Mtr respiratory pathway is essential for reducing flavins and electrodes in Shewanella oneidensis. Journal of Bacteriology, 2010, 192(2): 467-474. DOI:10.1128/JB.00925-09 |
| [25] | Richter K, Schicklberger M, Gescher J. Dissimilatory reduction of extracellular electron acceptors in anaerobic respiration. Applied and Environmental Microbiology, 2012, 78(4): 913-921. DOI:10.1128/AEM.06803-11 |
| [26] | Grobbler C, Virdis B, Nouwens A, Harnisch F, Rabaey K, Bond PL. Effect of the anode potential on the physiology and proteome of Shewanella oneidensis MR-1. Bioelectrochemistry, 2018, 119: 172-179. DOI:10.1016/j.bioelechem.2017.10.001 |
| [27] | Okamoto A, Kalathil S, Deng X, Hashimoto K, Nakamura R, Nealson KH. Cell-secreted flavins bound to membrane cytochromes dictate electron transfer reactions to surfaces with diverse charge and pH. Scientific Reports, 2014, 4: 5628. |
| [28] | Edwards MJ, White GF, Norman M, Tome-Fernandez A, Ainsworth E, Shi L, Fredrickson JK, Zachara JM, Butt JN, Richardson DJ, Clarke TA. Redox linked flavin sites in extracellular decaheme proteins involved in microbe-mineral electron transfer. Scientific Reports, 2015, 5: 11677. DOI:10.1038/srep11677 |
| [29] | Levar CE, Hoffman CL, Dunshee AJ, Toner BM, Bond DR. Redox potential as a master variable controlling pathways of metal reduction by Geobacter sulfurreducens. The ISME Journal, 2017, 11(3): 741-752. DOI:10.1038/ismej.2016.146 |
| [30] | Walker DJF, Nevin KP, Holmes DE, Rotaru AE, Ward JE, Woodard TL, Zhu JX, Ueki T, Nonnenmann SS, McInerney MJ, Lovley DR. Syntrophus conductive pili demonstrate that common hydrogen-donating syntrophs can have a direct electron transfer option. The ISME Journal, 2020, 14(3): 837-846. DOI:10.1038/s41396-019-0575-9 |
| [31] | Ilshadsabah A, Suchithra TV. Bacterial nanowires: an invigorating tale for future//Prasad R. Microbial Nanobionics. Cham: Springer, 2019: 77-88. |
| [32] | Walker DJF, Martz E, Holmes DE, Zhou ZM, Nonnenmann SS, Lovley DR. The archaellum of Methanospirillum hungatei is electrically conductive. mBio, 2019, 10(2): e00579-19. DOI:10.1128/mBio.00579-19 |
| [33] | Wanger G, Gorby Y, El-Naggar MY, Yuzvinsk TD, Schaudinn C, Gorur A, Sedghizadeh PP. Electrically conductive bacterial nanowires in bisphosphonate-related osteonecrosis of the jaw biofilms. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 2013, 115(1): 71-78. DOI:10.1016/j.oooo.2012.08.446 |
| [34] | Liu XM, Gao HY, Ward JE, Liu XR, Yin B, Fu TD, Chen JH, Lovley DR, Yao J. Power generation from ambient humidity using protein nanowires. Nature, 2020, 578(7796): 550-554. DOI:10.1038/s41586-020-2010-9 |
| [35] | Malvankar NS, Vargas M, Nevin KP, Franks AE, Leang C, Kim BC, Inoue K, Mester T, Covalla SF, Johnson JP, Rotello VM, Tuominen MT, Lovley DR. Tunable metallic-like conductivity in microbial nanowire networks. Nature Nanotechnology, 2011, 6(9): 573-579. DOI:10.1038/nnano.2011.119 |
| [36] | Lovley DR, Walker DJF. Geobacter protein nanowires. Frontiers in Microbiology, 2019, 10: 2078. DOI:10.3389/fmicb.2019.02078 |
| [37] | Wang FB, Gu YQ, O'Brien JP, Yi SM, Yalcin SE, Srikanth V, Shen C, Vu D, Ing NL, Hochbaum AI, Egelman EH, Malvankar NS. Structure of microbial nanowires reveals stacked hemes that transport electrons over micrometers. Cell, 2019, 177(2): 361-369. DOI:10.1016/j.cell.2019.03.029 |
| [38] | Filman DJ, Marino SF, Ward JE, Yang L, Mester Z, Bullitt E, Lovley DR, Strauss M. Cryo-EM reveals the structural basis of long-range electron transport in a cytochrome-based bacterial nanowire. Communications Biology, 2019, 2: 219. DOI:10.1038/s42003-019-0448-9 |
| [39] | Liu X, Wang SW, Xu AM, Zhang L, Liu HS, Ma LZ. Biological synthesis of high-conductive pili in aerobic bacterium Pseudomonas aeruginosa. Applied Microbiology and Biotechnology, 2019, 103(3): 1535-1544. DOI:10.1007/s00253-018-9484-5 |
| [40] | Cosert KM, Castro-Forero A, Steidl RJ, Worden RM, Reguera G. Bottom-up fabrication of protein nanowires via controlled self-assembly of recombinant Geobacter pilins. mBio, 2019, 10(6): e02721-19. DOI:10.1128/mBio.02721-19 |
| [41] | Bjerg JT, Boschker HTS, Larsen S, Berry D, Schmid M, Millo D, Tataru P, Meysman FJR, Wagner M, Nielsen LP, Schramm A. Long-distance electron transport in individual, living cable bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(22): 5786-5791. DOI:10.1073/pnas.1800367115 |
| [42] | Li C, Lesnik KL, Liu H. Stay connected:electrical conductivity of microbial aggregates. Biotechnology Advances, 2017, 35(6): 669-680. DOI:10.1016/j.biotechadv.2017.07.010 |
| [43] |
Kong GN, Xu MY, Yang YG. Direct contact-dependent microbial extracellular electron transfer. Acta Microbiologica Sinica, 2017, 57(5): 643-650.
(in Chinese) 孔冠楠, 许玫英, 杨永刚. 基于直接接触的微生物胞外电子传递. 微生物学报, 2017, 57(5): 643-650. |
| [44] |
Zhong W, Jiang YG, Shi L. Direct electron transfer between bacteria and archaea. Acta Microbiologica Sinica, 2020.
(in Chinese) 钟雯, 蒋永光, 石良. 细菌与古菌之间的直接电子传递. 微生物学报, 2020. DOI:10.13343/j.cnki.wsxb.20200106 |
| [45] | Summers ZM, Fogarty HE, Leang C, Franks AE, Malvankar NS, Lovley DR. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. Science, 2010, 330(6009): 1413-1415. DOI:10.1126/science.1196526 |
| [46] | Liu X, Zhuo SY, Rensing C, Zhou SG. Syntrophic growth with direct interspecies electron transfer between pili-free Geobacter species. The ISME Journal, 2018, 12(9): 2142-2151. DOI:10.1038/s41396-018-0193-y |
| [47] | Huang LY, Liu X, Ye Y, Chen M, Zhou SG. Evidence for the coexistence of direct and riboflavin-mediated interspecies electron transfer in Geobacter co-culture. Environmental Microbiology, 2020, 22(1): 243-254. DOI:10.1111/1462-2920.14842 |
| [48] | O'Toole G, Kaplan HB, Kolter R. Biofilm formation as microbial development. Annual Review of Microbiology, 2000, 54: 49-79. DOI:10.1146/annurev.micro.54.1.49 |
| [49] | Steidl RJ, Lampa-Pastirk S, Reguera G. Mechanistic stratification in electroactive biofilms of Geobacter sulfurreducens mediated by pilus nanowires. Nature Communications, 2016, 7: 12217. DOI:10.1038/ncomms12217 |
| [50] | Phan H, Yates MD, Kirchhofer ND, Bazan GC, Tender LM, Nguyen TQ. Biofilm as a redox conductor:a systematic study of the moisture and temperature dependence of its electrical properties. Physical Chemistry Chemical Physics, 2016, 18(27): 17815-17821. DOI:10.1039/C6CP03583C |
| [51] | Yates MD, Strycharz-Glaven SM, Golden JP, Golden JP, Roy J, Tsoi S, Erickson JS, El-Naggar MY, Barton SC, Tender LM. Measuring conductivity of living Geobacter sulfurreducens biofilms. Nature Nanotechnology, 2016, 11(11): 910-913. DOI:10.1038/nnano.2016.186 |
| [52] | Liu PP, Mohamed A, Liang P, Beyenal H. Effect of electrode spacing on electron transfer and conductivity of Geobacter sulfurreducens biofilms. Bioelectrochemistry, 2020, 131: 107395. DOI:10.1016/j.bioelechem.2019.107395 |
| [53] | Liu X, Zhuo SY, Jing XY, Yuan Y, Rensing C, Zhou SG. Flagella act as Geobacter biofilm scaffolds to stabilize biofilm and facilitate extracellular electron transfer. Biosensors and Bioelectronics, 2019, 146: 111748. DOI:10.1016/j.bios.2019.111748 |
| [54] | Malvankar NS, Lau J, Nevin KP, Franks AE, Tuominen MT, Lovley DR. Electrical conductivity in a mixed-species biofilm. Applied and Environmental Microbiology, 2012, 78(16): 5967-5971. DOI:10.1128/AEM.01803-12 |
| [55] | Malvankar NS, King GM, Lovley DR. Centimeter-long electron transport in marine sediments via conductive minerals. The ISME Journal, 2015, 9(2): 527-531. DOI:10.1038/ismej.2014.131 |
| [56] | Morita M, Malvankar NS, Franks AE, Summers ZM, Giloteaux L, Rotaru AE, Rotaru C, Lovley DR. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates. mBio, 2011, 2(4): e00159-11. DOI:10.1128/mBio.00159-11 |
| [57] | Li C, Lesnik KL, Liu H. Conductive properties of methanogenic biofilms. Bioelectrochemistry, 2018, 119: 220-226. DOI:10.1016/j.bioelechem.2017.10.006 |
| [58] | Yates MD, Barr Engel S, Eddie BJ, Lebedev N, Malanoski AP, Tender LM. Redox-gradient driven electron transport in a mixed community anodic biofilm. FEMS Microbiology Ecology, 2018, 94(6): fiy081. |
| [59] | Nielsen LP, Risgaard-Petersen N, Fossing H, Christensen PB, Sayama M. Electric currents couple spatially separated biogeochemical processes in marine sediment. Nature, 2010, 463(7284): 1071-1074. DOI:10.1038/nature08790 |
| [60] | Lovley DR. Happy together:microbial communities that hook up to swap electrons. The ISME Journal, 2017, 11(2): 327-336. DOI:10.1038/ismej.2016.136 |
| [61] | Jiang ZX, Zhang S, Klausen LH, Song J, Li Q, Wang ZG, Stokke BT, Huang YD, Besenbacher F, Nielsen LP, Dong MD. In vitro single-cell dissection revealing the interior structure of cable bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(34): 8517-8522. DOI:10.1073/pnas.1807562115 |
| [62] | Meysman FJR, Cornelissen R, Trashin S, Bonné R, Martinez SH, van der Veen J, Blom CJ, Karman C, Hou JL, Eachambadi RT, Geelhoed JS, de Wael K, Beaumont HJE, Cleuren B, Valcke R, van der Zant HSJ, Boschker HTS, Manca JV. A highly conductive fibre network enables centimetre-scale electron transport in multicellular cable bacteria. Nature Communication, 2019, 10(1): 4120. DOI:10.1038/s41467-019-12115-7 |
| [63] | Geerlings NMJ, Karman C, Trashin S, As KS, Kienhuis MVM, Hidalgo-Martinez S, Vasquez-Cardenas D, Boschker HTS, De Wael K, Middelburg JJ, Polerecky L, Meysman FJR. Division of labor and growth during electrical cooperation in multicellular cable bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(10): 5478-5485. DOI:10.1073/pnas.1916244117 |
| [64] | Nakamura R, Takashima T, Kato S, Takai K, Yamamoto M, Hashimoto K. Electrical current generation across a black smoker chimney. Angewandte Chemie International Edition, 2010, 49(42): 7692-7694. DOI:10.1002/anie.201003311 |
| [65] | Sato M, Mooney HM. The electrochemical mechanism of sulfide self-potentials. Geophysics, 1960, 25(1): 226-249. |
| [66] |
Lu AH, Li Y, Ding HR, Wang CQ. Mineralogical photoelectrons and minerals and microorganisms synergistic interactions. Bulletin of Mineralogy, Petrology and Geochemistry, 2018, 37(1): 1-15.
(in Chinese) 鲁安怀, 李艳, 丁竑瑞, 王长秋. 矿物光电子能量及矿物与微生物协同作用. 矿物岩石地球化学通报, 2018, 37(1): 1-15. |
| [67] | Lei YQ, Sun DZ, Dang Y, Feng XL, Huo D, Liu CQ, Zheng K, Holmes DE. Metagenomic analysis reveals that activated carbon aids anaerobic digestion of raw incineration leachate by promoting direct interspecies electron transfer. Water Research, 2019, 161: 570-580. DOI:10.1016/j.watres.2019.06.038 |
| [68] | Liu FH, Rotaru AE, Shrestha PM, Malvankar NS, Nevin KP, Lovley DR. Promoting direct interspecies electron transfer with activated carbon. Energy & Environmental Science, 2012, 5(10): 8982-8989. |
| [69] | Zhou SG, Xu JL, Yang GQ, Zhuang L. Methanogenesis affected by the co-occurrence of iron(Ⅲ) oxides and humic substances. FEMS Microbiology Ecology, 2014, 88(1): 107-120. DOI:10.1111/1574-6941.12274 |
 2020, Vol. 60
2020, Vol. 60