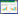中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 祝贵兵. 2020
- Guibing Zhu. 2020
- 陆地和淡水生态系统新型微生物氮循环研究进展
- Novel nitrogen cycles in terrestrial and freshwater ecosystems
- 微生物学报, 60(9): 1972-1984
- Acta Microbiologica Sinica, 60(9): 1972-1984
-
文章历史
- 收稿日期:2020-05-24
- 修回日期:2020-06-15
- 网络出版日期:2020-07-23
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
氮是生态系统中重要的营养元素,为生命体生长提供必不可少的物质和能量。自然界中的有机氮、无机氮、分子氮之间的相互转化构成了氮循环。厌氧氨氧化、完全氨氧化是近年来氮循环研究的重大发现,形成了氮循环代谢的新途径,改变了传统的氮循环观点。随着15N同位素示踪技术和分子生物学技术的发展应用,人们对硝酸盐异化还原为铵(DNRA)的氮反应机理也有了重新认识。本文总结了厌氧氨氧化、完全氨氧化、硝酸盐异化还原为铵这3种新型氮循环在自然环境中的热区分布(图 1)。厌氧氨氧化反应热区存在于典型好氧/缺氧界面:在土壤生态系统发生于植物根际微界面,在地表水生态系统发生于水陆交错带,在地下水生态系统发生于饱和土壤与地下水的交界层;完全氨氧化和硝酸盐异化还原为铵的反应热区目前仅发现于地表水的水陆交错带。此外,本文还剖析了这3种新型氮循环的发生机制与作用机理及其环境效应,并对近期需要重点研究的问题进行了展望。
|
| 图 1 陆地水生态系统厌氧氨氧化、DNRA及完全氨氧化热区分布 Figure 1 Hotspots of anammox, DNRA and comammox in terrestrial ecosystems. |
1 厌氧氨氧化在自然界中的发生、分布与贡献
厌氧氨氧化(anaerobic ammonium oxidation, anammox)是指在厌氧条件下由厌氧氨氧化菌以亚硝酸盐为电子受体将氨氮直接氧化为氮气,完成封闭的产氮气循环,避免了强效温室气体氧化亚氮(N2O)的产生[1-2]。现代工农业发展将大量氮化合物带入环境,使氮循环代谢失衡,厌氧氨氧化具有同时去除硝态氮和氨态氮的功能,对维持全球氮循环平衡、水体氮污染修复、缓解温室效应具有重要意义。
1995年,Mulder在中试反硝化流化床中首次发现厌氧氨氧化细菌[3],开启了厌氧氨氧化研究的历程。在自然界中,厌氧氨氧化首次发现于斯卡格拉克海峡(Skagerrak,在丹麦日德兰半岛与挪威南部之间)与奥尔胡斯湾(Aarhus Bay,丹麦港口)海洋沉积物[4]。随后发现厌氧氨氧化广泛存在于海水或海洋沉积物[5-6],对海洋生态系统N2流失贡献率高达50%,甚至在OMZ(溶解氧最低区域)可达到100%,显著影响全球氮循环平衡和N2O通量[7]。近年来,在陆地淡水、土壤以及地下水系统也发现了规模性的厌氧氨氧化反应[8-10],证明了厌氧氨氧化在陆地水生态系统中对N2产生具有重要贡献。
1.1 地表水生态系统厌氧氨氧化在淡水生态系统中是无处不在、普遍发生的。厌氧氨氧化将水环境中NH4+-N和NO3–-N无机氮化合物转化为氮气,降低了地表水氮素营养水平,在调控和维持水环境生态功能稳定和水资源安全方面发挥重要作用。河流、湖泊、岸边带、河流入海口等各种地表水系统均报道有厌氧氨氧化发生和作用[9, 11-12],总体趋势是岸边带和入海口厌氧氨氧化反应活性较高,在入海口等区域对N2流失贡献超过反硝化;其次是湖泊,而河流的厌氧氨氧化活性较低。
河流入海口、岸边带营养盐及电子供体较为丰富,周期性水位变化形成缺氧/好氧界面,氧化还原电位梯度频繁交迭,为厌氧氨氧化等氮循环提供了最大反应驱动力。该区域不仅是厌氧氨氧化发生的热区,也是反硝化、氨氧化及DNRA的反应热区。最近研究评估的河流入海口沉积物厌氧氨氧化反应速率高达13.68 μmol N/(kg·h),对N2损失的贡献率为15.9%,每年去除从内陆输入的无机氮达2.4×106 t N[13]。研究报道白洋淀湖泊岸边带厌氧氨氧化速率达到20 μmol N/(kg·h),引起的N2损失贡献率高达35%,厌氧氨氧化的快速发生具有显著的N2O减排效应[9];综合研究表明,湖泊岸边带营养物质含量相对丰富,厌氧氨氧化反应速率高于河流岸边带,中国内陆湖泊岸边带厌氧氨氧化每年去除5.6×105 t N;湖泊和河流开阔水体区域厌氧氨氧化反应速率显著低于岸边带,其中湖泊水体沉积物厌氧氨氧化速率高于河流水体[14-16]。与自然河流不同,城市河流有机质和氮化合物含量较高,厌氧氨氧化速率可高达11.4 μmol N/(kg·h)[17],但因其区域面积分布窄而限制了厌氧氨氧化去除的氮污染总量。
综合调查研究结果显示,湖泊岸边带厌氧氨氧化作用对中国内陆淡水生态系统无机氮污染去除率达到11.4%[16],河流入海口系统厌氧氨氧化作用去除陆域向海域输入无机氮的40.4%[13],地表水厌氧氨氧化的生物地球化学及热区分布特征的研究重新修订了陆地淡水系统氮通量。值得注意的是,目前厌氧氨氧化速率多数未在原位测定,虽然在测定过程中温度、反应底物浓度等外加环境参数与原位基本保持一致,但仍不排除测量的厌氧氨氧化反应活性比实际稍高的可能。
1.2 土壤生态系统陆地生态系统厌氧氨氧化的研究报道主要集中在稻田土壤。稻田是陆地生态系统中重要的氮沉降和N2O产生区域[18],周期性的干湿交替促使稻田土壤成为特殊的陆地土壤生态系统,提供了厌氧氨氧化反应发生的环境条件。2011年首次在典型高氮污染的稻田土壤中发现存在大量厌氧氨氧化菌并发生显著的厌氧氨氧化反应,厌氧氨氧化速率为0.5–2.9 μmol N/(kg·h),贡献了4%–37%的N2损失量,且0–10 cm的表层土壤厌氧氨氧化活性最高。该研究揭示了除反硝化作用、氨挥发、径流、土壤淋失、植物吸收之外,厌氧氨氧化也是稻田氮肥流失的一种重要途径[19]。之后研究证实了在不同气候带、土壤母质和发育条件等稻田土壤系统存在有广泛的厌氧氨氧化反应[20-22];而且水稻根际典型的缺氧/好氧交界区适宜厌氧氨氧化发生,该区域还原态NH4+与氧化态NO3–共存,根呼吸及甲烷氧化产生的二氧化碳为厌氧氨氧化提供了碳源,因此厌氧氨氧化产生的N2显著高于非根际区域[23],是稻田土壤厌氧氨氧化的热区。
在其他土壤生态系统中也发现有厌氧氨氧化反应,但发生并不广泛,推测水分是限制旱地土壤厌氧氨氧化发生的主要原因。Shen等分别于2013年在多种农业作物土壤中检测到厌氧氨氧化细菌,于2017年在灌溉比较频繁的蔬菜地土壤检测到厌氧氨氧化反应,活性高达1.5 μmol N/(kg·h),对N2流失的贡献率达18.4% [24];在高海拔青藏高原那曲的旱地土壤中同样检测到厌氧氨氧化细菌,其活性和丰度均低于湿地土壤[25]。相对于稻田土壤和淡水系统沉积物,旱地土壤含水量低,处于水不饱和状态,而且土壤孔隙水蒸发严重进而导致土壤长期缺水,过低的水含量和过高的氧含量均制约了厌氧氨氧化发生。近期的研究发现,对旱地土壤加纯水培养3个月后开始检测到厌氧氨氧化菌丰度和活性[26]。该研究表明水可以复苏旱地土壤的厌氧氨氧化细菌,即通过改变长期浸水旱地土壤的氧化还原电位,诱导厌氧氨氧化的发生。
1.3 地下水生态系统相较于地表水和土壤生态系统,针对地下水生态系统的厌氧氨氧化研究起步较晚。随着氮肥的广泛施用,淋溶的硝酸盐和随地表径流迁移的铵盐可同时交汇于地下水系统,为厌氧氨氧化反应提供有效的底物来源。另一方面,地下水有机质含量低,且系统更新周期长环境稳定,利于厌氧氨氧化菌的生长代谢。地下水生态系统极有可能是适宜厌氧氨氧化反应的生境。近年来研究也陆续在地表堆肥区、污水沉积地和海河盆地等区域的地下含水层,发现了活跃的厌氧氨氧化反应[27-29],说明地下水生态系统的确发生着厌氧氨氧化反应。
Wang等利用同位素示踪技术和高通量测序分析等技术手段,在一个典型湿地岸边带区域初步揭示了厌氧氨氧化在其地下水系统的发生规律。厌氧氨氧化主导湿地岸边带地下水位线以下饱和含水层中的氮流失(37.5%–67.6%),而反硝化主导地下水位线以上非饱和土壤中的氮流失。硝酸盐异化还原成铵对该过程中底物氨氮和亚硝酸盐的调控具有重要作用。随着水位上升,厌氧氨氧化对氮流失的贡献显著增加,并伴随温室气体N2O排放的显著减少(~39.3%±10.6%)。地下含水层中厌氧氨氧化的发现,为地下水硝酸盐治理提供了新途径[15]。之后,Wang等进一步在全球范围共1000多个样层进行系统性深入研究,首次发现厌氧氨氧化在全球地下含水层广泛发生且具有“热层”效应,对氮流失的贡献达36.8%–79.5%。同位素示踪技术和高通量测序技术分析表明亚表层土壤和饱和地下水交界层是厌氧氨氧化发生的关键分界点,在非饱和土层不发生,在饱和土层开始发生并以Candidatus Brocadia anammoxidans为主导菌属[30]。上述研究表明厌氧氨氧化在地下含水层氮循环及氮污染修复中可以起到重要作用。由此推测,在全球气候变化的影响下,降水增加、地下水位线升高,将改变全球地下含水层氮流失路径,从而影响全球温室气体排放和氮循环通量。
1.4 厌氧氨氧化菌的特性自然界中物质的结构和组成决定其性质。对于微生物而言,其细胞结构和组成决定了微生物的功能和对环境的敏感性。厌氧氨氧化体是厌氧氨氧化菌特有的细胞器,体积约占50%,其体膜是厌氧氨氧化反应发生的主要场所,含有激活厌氧氨氧化反应的所有的酶。厌氧氨氧化体独特的结构和组成特征,特别是厌氧氨氧化体膜上致密的阶梯烷膜脂能够有效阻止膜内有毒物质(例如N2H4)扩散进入细胞质,同时也能有效保护厌氧氨氧化体免受外界环境剧烈变化而造成的伤害,有利于厌氧氨氧化细菌在特殊环境中存活[31]。由此推测,高低温、干旱、较高的酸碱度等条件下可能存在厌氧氨氧化菌,甚至在合适的条件下会激活厌氧氨氧化反应。前期研究发现在–30 ℃、高pH值(> 8)、低pH值(< 4)的不同河流水体沉积物均检测出厌氧氨氧化菌[20]。澳大利亚卡尔古利地区是全球公认的未被人类污染的远古地区之一,距今已有25亿年以上。在该地区采集的土壤样品,经过加水实验成功复苏了古老土壤中的厌氧氨氧化菌[26]。此外,在温度为65 ℃的温泉中检测到Candidatus Brocadia fulgida,Candidatus Brocadia anammoxidans和Candidatus Kuenenia stuttgartiensis[32]等不同种的厌氧氨氧化菌。研究特殊生理环境下厌氧氨氧化菌的分布及其激活机制对于开发新型厌氧氨氧化技术,扩展厌氧氨氧化技术的应用范围具有重要作用。
2 完全氨氧化过程传统硝化过程包括两个过程:由氨氧化古菌(ammonia oxidizing archaea,AOA)和氨氧化细菌(ammonia oxidizing bacteria,AOB)将氨(NH4+)氧化成亚硝酸盐(NO2–);再由亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)将NO2–氧化成硝酸盐(NO3–)。Costa等根据动力学理论猜想自然界中存在可以同时执行硝化过程两个步骤的生物体,即在一个生物体内可以完成从NH4+到NO3–的完全氧化,并将其称为完全氨氧化微生物(complete ammonia oxidizers,comammox)[33]。研究学者发现了3种富集培养的细菌具备将NH4+直接转化为NO3–的能力[34-36],证实了完全氨氧化微生物的存在。目前研究发现完全氨氧化微生物均属于分布广泛的硝化螺菌属(Nitrospira)谱系Ⅱ[34]。由于comammox含有的amoA基因与传统氨氧化过程AOA和AOB amoA基因不同,因此将其作为特殊的生物标记物可以准确识别和量化comammox[35-37]。除此之外,研究学者基于comammox amoA的系统发育分析,将comammox Nitrospira分为了clade A和clade B两个类群[35-38]。
2.1 地表水生态系统Comammox在淡水生态系统中分布广泛,甚至存在于高海拔青藏高原上的河流中[39-40]。和传统氨氧化过程相比,comammox在地表水生态系统中往往体现出较高的丰度[41-42],表明comammox可能在地表水生态系统中的硝化过程中发挥重要作用,这与旱地土壤中comammox的低贡献有所不同[41-43]。Wang等首次发现岸边带陆向土壤是comammox的反应热区。该区域comammox的丰度和活性均高于传统氨氧化,且高于其他岸边带区域(开阔水体沉积物、岸边带沉积物和中心土壤)[44]。Shi等也在岸边带中发现了较高丰度的comammox(高于AOA和AOB)[39]。这些研究结果表明了在湿地岸边带氮循环过程中,comammox起到了不可忽视的作用。
2.2 土壤生态系统自从2015年发现comammox的存在以来,宏基因组和qPCR等技术就被广泛运用于检测土壤生态系统中comammox的丰度和多样性[39, 42, 45]。但是由于在区分comammox、AOA和AOB三个过程方面存在方法学上的挑战,许多研究未对comammox的速率进行评估。同位素技术虽然发展成熟,但是由于comammox、AOA和AOB利用的底物相同,且产物NO2–和NO3–的转化速率较快,因此难以有效测定这三个过程的速率。Wang等开发了双抑制剂法,在一定程度上区分了comammox、AOA和AOB三个过程,评估了comammox在旱地农田土壤中对氨氧化的贡献,且该研究表明comammox广泛分布在农田作物根际和非根际土壤中,对氨氧化的贡献(小于2%)均低于传统氨氧化过程。目前研究发现作物类型和作物根系对comammox的影响较小[43],而氨浓度、氧浓度等环境因素显著影响comammox的丰度和分布[33, 39, 41, 43]。
在土壤生态系统中,完全氨氧化和传统氨氧化过程存在着明显的生态位分化。Shi等研究了全国不同生境中comammox的分布和影响因素,在水稻田、小麦田、岸边带等土壤样品中均检测到comammox的存在,且不同环境中的comammox丰度具有较大差异,揭示了comammox环境分布的广泛性和高度异质性[39]。Comammox对氨的亲和力较高,与传统氨氧化过程相比,comammox在低氨土壤中往往更具有竞争优势[35, 41]。而Li等发现施肥农田土壤具有更高丰度的comammox,且comammox对硝化作用有着积极贡献[46]。这些结果表明comammox的适宜生境不限于低营养环境。营养水平对于comammox的群落分布有影响,目前研究表明氮肥的施用显著增加了comammox clade A的丰度[46-47]。而Wang等发现在未添加NH4+的土壤中,clade B对硝化作用具有更高的贡献[48]。这可能是由于clade B中含有Amt型转运体,相比于clade A(Rh型转运体),clade B对NH4+具有更高的亲和力[49]。因此低氨土壤可能更利于comammox clade B的存在。
2.3 地下水生态系统地下水生态系统中可能是另一适合comammox的生境[45, 50-51]。Fowler等发现地下水快速砂滤系统中comammox在Nitrospira菌群中占比较高,因此推测在地下水环境中comammox对硝化作用具有较大贡献[51]。Hu等采集了地表水和地下水,将其作为快速砂滤系统水源,根据宏基因组测序分析显示,地表水和地下水砂滤系统中comammox分别由clade B和clade A主导,且comammox对该系统中氨氧化的贡献最为显著[45]。Palomo等基于全球样品宏基因组数据分析,揭示了在地表水和地下水中comammox Nitrospira的高丰度和多样性[42]。这些结果说明了comammox在淡水环境的氮循环过程中发挥着重要作用。因此,综合评估氨氧化过程中各个途径的生态位差异,以及它们对不同生态系统硝化作用的相对贡献是极其必要的。
3 硝酸盐异化还原成铵硝酸盐异化还原成铵(dissimilatory nitrate reduction to ammonium,DNRA)以有机质为电子供体,将NO3–还原为NH4+重新进入环境中参与氮循环,是除反硝化、厌氧氨氧化外的第三种硝酸盐异化还原过程。除有机碳外,游离硫化物(硫化氢和硫化物离子)以及单质硫也可以作为微生物DNRA的电子供体[52]。DNRA过程并未出现氮损失,是N循环的重要中间过程,连接着氮化合物的氧化和还原。在不同的生态系统中,DNRA的作用不尽相同。在贫营养的海洋和土壤系统中,DNRA产生NH4+以提高系统的初级生产力;在淡水生态系统中,DNRA可能是富营养化的重要因素,因为NH4+促进的藻类生长和富营养化的速率明显高于NO3–。尽管20世纪80年代DNRA就被证实存在于自然生态系统中[53],但是近年来,随着人们对氮循环过程研究的深入与完善,以及人类活动对氮循环的干扰加大,DNRA在氮循环过程中的作用和对自然生态系统的作用才被重视。
目前对土壤生态系统DNRA已有较多研究,但同步测定反硝化、厌氧氨氧化、DNRA活性的研究较少。土壤生态系统的研究集中在稻田淹水土壤中,稻田表层土壤能够检测到DNRA的存在,但其速率较低[54]。澳大利亚稻田土壤DNRA占硝酸盐还原的14.9%[55]。Shan等将15N示踪技术与N2/Ar技术结合,首次同时测得稻田土壤反硝化、厌氧氨氧化与DNRA的速率与贡献率,其中DNRA占总硝酸盐还原的0.54%–17.6%,证明DNRA在稻田硝酸盐还原中发挥了部分作用[56]。除了稻田土壤,林地和草地土壤也检测到了DNRA的存在,分别占到了消耗NO3–的4.6%–75%和0.6%–96.9%[57-58],DNRA在土壤硝酸盐还原中起到了很大作用,有助于土壤氮素的保存。
近年来,淡水生态系统中DNRA过程的研究越来越多。Pang等对中国典型湖泊沉积物DNRA过程进行了报道,其中DNRA贡献率为8.1%–35.4%[59]。Jiang对中国东部平原湖泊的DNRA过程进行了研究,得到反硝化是硝酸盐还原的主导过程,DNRA占硝酸盐总还原量的4.3%–21.9%[60]。除此之外,其他地区湖泊DNRA过程硝酸盐还原占比为2.8%–34.4%。在湖泊生态系统中,虽然DNRA过程不占主导地位,但却是硝酸盐还原的重要过程。而造成DNRA贡献率差别的主要因素是沉积物中有机氮的含量和C/N比。对于富营养化的湖泊,水华改变了湖泊的初级生产力,提供了大量的不稳定有机质,影响氮转化的速率和过程。同时,藻类的利用使得N含量减少,为DNRA过程提供了有利条件,研究表明,水华通过改变环境中有机质含量间接影响了DNRA[60]。
DNRA在水陆交错带地区硝酸盐还原过程中发挥了重要作用。岸边带沉积物相不仅是厌氧氨氧化的热区,也是DNRA的热区,其硝酸盐还原各过程(反硝化、DNRA、厌氧氨氧化)速率均高于开阔水体沉积物,在高有机质和NO3–情况下,DNRA速率超过反硝化和厌氧氨氧化,主导了硝酸盐还原过程[61]。岸边带陆相芦苇根际与非根际土壤的DNRA速率在靠近岸边的芦苇根际地区最高,对硝酸盐还原的贡献率高达67.5%,即使在非根际区域,DNRA的贡献率也能达到51.9%,对于岸边带土壤硝酸盐还原起到了重要作用[10]。
针对地下水生态系统的DNRA过程研究还较少。在岸边带饱和含水层(80–100 cm),DNRA速率比厌氧氨氧化和反硝化速率高10倍,贡献了硝酸盐还原的88%–93%[15],主导地下水生态系统硝酸盐还原的过程。DNRA为厌氧氨氧化提供底物NH4+,二者耦合,有助于去除地下水层的N和减少N2O排放通量。因此,DNRA过程是否在地下水生态系统氮循环中发挥了重要作用还需进一步研究。DNRA过程通常发生在缺氧、电子供体丰富的区域[62]。由于DNRA过程以有机碳为电子供体,研究发现DNRA与有机碳和无机氮具有相关性[63]。在增加土壤有机碳与NO3–比例的情况下,可以增加DNRA的速率[64]。也有研究表明,DNRA速率与沉积物的有机碳和NH4+含量具有明显相关性[10, 65]。此外,DNRA与硫酸盐含量关系密切。在硫酸盐浓度较高的湖泊中,DNRA对减少硝酸盐异化作用的贡献更大。DNRA与硫循环耦合可能在高硫酸盐浓度和高沉积有机碳的湖泊中发挥重要作用[60]。由于硫化物可以被DNRA细菌用作有效的电子供体,高浓度的硫化物可以提高DNRA的速率[66]。
4 厌氧氨氧化、完全氨氧化、DNRA之间的关系反硝化、厌氧氨氧化、DNRA均是硝酸盐异化还原过程,因此共同竞争NO3–。其中,反硝化和厌氧氨氧化是脱氮作用,将环境中的氮转变成气态氮逸失,闭合氮循环;DNRA是截留环境中氮,使其重新进入内循环。在稻田土壤DNRA具有提高肥料利用率,防止氮肥流失的作用,尤其当稻田土壤氮含量低时,DNRA速率提高,能够显著截留氮素养分,防止反硝化及硝酸盐渗透淋失[67]。
厌氧氨氧化、反硝化、DNRA对硝酸盐去除贡献比例变化也归因于各反应细菌代谢途径的差异。多数异养的反硝化细菌可依赖分解氧化有机化合物获得能量,使用有机碳作为电子供体。当温度升高时,难降解有机质转化为易降解的、可溶性的有机质,产生的更多的电子供体促进了异养反硝化微生物。厌氧氨氧化由自养型细菌发生,能量由含氮化合物和二氧化碳提供,而且温度的升高对厌氧氨氧化过程有减弱作用[68]。Rahman等在澳大利亚墨尔本4个人工湿地检测硝酸盐还原相关微生物发现,DNRA速率变化与温度成负相关,当冬季12 ℃时,DNRA活性高于反硝化,负责67%±23%的NOX还原,高温和高NOX时,反硝化活性高于DNRA,氮去除过程增强[69]。
氧气(O2)水平对反硝化过程有着重要影响。高浓度的O2可以抑制反硝化还原酶从而抑制反硝化。而DNRA对O2的敏感性要低于反硝化[70]。Zhu等研究发现旱地表层土壤中DNRA对亚硝酸盐还原的贡献较小,然而在深层土壤中,其活性却显著高于反硝化和厌氧氨氧化[71]。除此之外C/N比也会影响反硝化和DNRA对NO3–的竞争[72]。DNRA过程更容易在高C/N比环境中发生,并能成为硝酸盐异化还原的主要途径[73]。然而在高C/N比环境中,厌氧氨氧化作用却会受到显著抑制,从而降低了其生物脱氮性能[74]。硫化物的存在也会影响反硝化、厌氧氨氧化和DNRA的竞争关系。当环境中低价态硫化物浓度升高时,由硫还原细菌介导的DNRA过程的电子供体增多,从而促进了DNRA作用,然而高浓度硫化物则会抑制反硝化和厌氧氨氧化过程[75-76]。
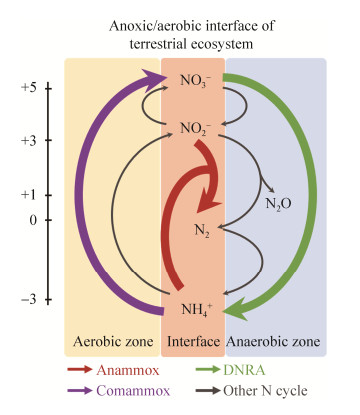
除了竞争关系,DNRA、厌氧氨氧化和完全氨氧化之间存在耦合关系(图 2)。DNRA产生的NH4+,为厌氧氨氧化反应提供活性底物。氨氧化、完全氨氧化补充了DNRA过程需要的NO2–/NO3–[10];DNRA对厌氧氨氧化起主要的协调作用,促进了厌氧氨氧化发生。
|
| 图 2 陆地生态系统典型缺氧、好氧界面的新型氮循环过程的潜在耦合机制 Figure 2 Potential coupling mechanism of new nitrogen cycling processes at typical anoxic and aerobic interfaces in terrestrial ecosystems. |
5 展望
新型氮循环的发现为人们研究温室气体N2O的产生和释放过程提供了新视角,但目前仍不能准确量化各新型氮循环在N2O产生和减排中的作用。尤其是与N2O产生直接相关的各循环过程的微生物间的互作关系尚不清晰,亟待进一步研究。
厌氧氨氧化作用具有固定CO2、减排N2O功能,建立了氮循环和碳循环之间的桥梁,但厌氧氨氧化反应中电子传递与能量代谢过程并不清楚。因此,选择合适的电子传递载体作为电子传递过程的“指示分子”,进而从分子水平和微观电子传递角度揭示厌氧氨氧化反应机制过程,有待进一步研究。Comammox能够将NH4+氧化成NO2–,从而可能产生N2O,然而在自然环境中comammox是否释放N2O仍然未知。DNRA对土壤硝酸盐的还原有着重要作用,有助于土壤氮素的保存。但是如何让DNRA过程在N2O减排及土壤氮保留方面发挥其应用价值,仍需要深入探索。除此之外,未来研究中将新型氮循环过程考虑在内,重新评估不同环境中各个氮循环过程对氮损失的相对贡献是极其重要的。对于陆地生态系统不同氮循环反应热区的微生物机理、生物地球化学机制和环境效应的研究仍不透彻,亟需深入解析。同时,如何将各种新型氮循环反应热区的科学发现转化为可实施的生态工程强化技术,切实应用于陆地系统氮循环修复与氮污染治理,也是一个科技结合的新方向。
| [1] | Strous M, Heijnen JJ, Kuenen JG, Jetten MSM. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms. Applied Microbiology and Biotechnology, 1998, 50(5): 589-596. DOI:10.1007/s002530051340 |
| [2] | Jetten MSM, Cirpus I, Kartal B, van Niftrik L, van de Pas-Schoonen KT, Sliekers O, Haaijer S, van der Star W, Schmid M, van de Vossenberg J, Schmidt I, Harhangi H, van Loosdrecht M, Gijs Kuenen J, Op den Camp H, Strous M. 1994-2004:10 years of research on the anaerobic oxidation of ammonium. Biochemical Society Transactions, 2005, 33(1): 119-123. |
| [3] | Mulder A, van de Graaf AA, Robertson LA, Kuenen JG. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiology Ecology, 1995, 16(3): 177-183. |
| [4] | Thamdrup B, Dalsgaard T. Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments. Applied and Environmental Microbiology, 2002, 68(3): 1312-1318. DOI:10.1128/AEM.68.3.1312-1318.2002 |
| [5] | Ward B, Devol A, Rich JJ, Chang BX, Bulow SE, Naik H, Pratihary A, Jayakumar A. Denitrification as the dominant nitrogen loss process in the Arabian Sea. Nature, 2009, 461(7260): 78-81. DOI:10.1038/nature08276 |
| [6] | Jensen MM, Lam P, Revsbech NP, Nagel B, Gaye B, Jetten MS, Kuypers MM. Intensive nitrogen loss over the Omani Shelf due to anammox coupled with dissimilatory nitrite reduction to ammonium. The ISME Journal, 2011, 5(10): 1660-1670. DOI:10.1038/ismej.2011.44 |
| [7] | Devol AH. Nitrogen cycle:solution to a marine mystery. Nature, 2003, 422(6932): 575-576. DOI:10.1038/422575a |
| [8] | Zhu GB, Wang SY, Feng XJ, Fan GN, Jetten MSM, Yin CQ. Anammox bacterial abundance, biodiversity and activity in a constructed wetland. Environmental Science & Technology, 2011, 45(23): 9951-9958. |
| [9] | Zhu GB, Wang SY, Wang WD, Wang Y, Zhou LL, Jiang B, Op den Camp HJM, Risgaard-Petersen N, Schwark L, Peng YZ, Hefting MM, Jetten MSM, Yin CQ. Hotspots of anaerobic ammonium oxidation at land-freshwater interfaces. Nature Geoscience, 2013, 6(2): 103-107. |
| [10] | Wang SY, Pi YX, Jiang YY, Pan HW, Wang XX, Wang XM, Zhou JM, Zhu GB. Nitrate reduction in the reed rhizosphere of a riparian zone:from functional genes to activity and contribution. Environmental Research, 2020, 180: 108867. DOI:10.1016/j.envres.2019.108867 |
| [11] | Schubert CJ, Durisch-Kaiser E, Wehrli B, Thamdrup B, Lam P, Kuypers MMM. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika). Environmental Microbiology, 2006, 8(10): 1857-1863. DOI:10.1111/j.1462-2920.2006.01074.x |
| [12] | Kim H, Bae HS, Ramesh KR, Ogram A. Distributions, abundances and activities of microbes associated with the nitrogen cycle in riparian and stream sediments of a river tributary. Water Research, 2016, 106: 51-61. DOI:10.1016/j.watres.2016.09.048 |
| [13] | Yang XR, Weng BS, Li H, Marshall CW, Li H, Chen YS, Yu S, Zhu GB, Zhu YG. An overlooked nitrogen loss linked to anaerobic ammonium oxidation in estuarine sediments in China. Journal of Soils and Sediments, 2017, 17(10): 2537-2546. DOI:10.1007/s11368-017-1728-y |
| [14] | Wang WD, Liu WY, Wu D, Wang XX, Zhu GB. Differentiation of nitrogen and microbial community in the littoral and limnetic sediments of a large shallow eutrophic lake (Chaohu Lake, China). Journal of Soils and Sediments, 2019, 19(2): 1005-1016. DOI:10.1007/s11368-018-2090-4 |
| [15] | Wang SY, Wang WD, Zhao SY, Wang XM, Hefting MM, Schwark L, Zhu GB. Anammox and denitrification separately dominate microbial N-loss in water saturated and unsaturated soils horizons of riparian zones. Water Research, 2019, 162: 139-150. DOI:10.1016/j.watres.2019.06.052 |
| [16] | Zhu GB, Wang SY, Zhou LL, Wang Y, Zhao SY, Xia C, Wang WD, Zhou R, Wang CX, Jetten MSM, Hefting MM, Yin CQ, Qu JH. Ubiquitous anaerobic ammonium oxidation in inland waters of China:an overlooked nitrous oxide mitigation process. Scientific Reports, 2015, 5: 17306. DOI:10.1038/srep17306 |
| [17] | Wei HC, Gao DZ, Liu Y, Lin XB. Sediment nitrate reduction processes in response to environmental gradients along an urban river-estuary-sea continuum. Science of the Total Environment, 2020, 718: 137185. DOI:10.1016/j.scitotenv.2020.137185 |
| [18] | Reay DS, Davidson EA, Smith KA, Smith P, Melillo JM, Dentener F, Crutzen PJ. Global agriculture and nitrous oxide emissions. Nature Climate Change, 2012, 2(6): 410-416. DOI:10.1038/nclimate1458 |
| [19] | Zhu GB, Wang SY, Wang Y, Wang CX, Risgaard-Petersen N, Jetten MSM, Yin CQ. Anaerobic ammonia oxidation in a fertilized paddy soil. The ISME Journal, 2011, 5(12): 1905-1912. DOI:10.1038/ismej.2011.63 |
| [20] | Zhu GB, Xia C, Wang SY, Zhou LL, Liu L, Zhao SY. Occurrence, activity and contribution of anammox in some freshwater extreme environments. Environmental Microbiology Reports, 2015, 7(6): 961-969. DOI:10.1111/1758-2229.12341 |
| [21] | Sato Y, Ohta H, Yamagishi T, Guo Y, Nishizawa T, Rahman MH, Kuroda H, Kato T, Saito M, Yoshinaga I, Inubushi K, Suwa Y. Detection of anammox activity and 16S rRNA genes in ravine paddy field soil. Bulletin of Japanese Society of Microbial Ecology, 2012, 27(3): 316-319. |
| [22] | Shen LD, Liu S, Huang Q, Lian X, He ZF, Geng S, Jin RC, He YF, Lou LP, Xu XY, Zheng P, Hu BL. Evidence for the cooccurrence of nitrite-dependent anaerobic ammonium and methane oxidation processes in a flooded paddy field. Applied and Environmental Microbiology, 2014, 80(24): 7611-7619. DOI:10.1128/AEM.02379-14 |
| [23] | Nie SA, Li H, Yang XR, Zhang ZJ, Weng BS, Huang FY, Zhu GB, Zhu YG. Nitrogen loss by anaerobic oxidation of ammonium in rice rhizosphere. The ISME Journal, 2015, 9(9): 2059-2067. DOI:10.1038/ismej.2015.25 |
| [24] | Shen LD, Wu HS, Liu X, Li J. Vertical distribution and activity of anaerobic ammonium-oxidising bacteria in a vegetable field. Geoderma, 2017, 288: 56-63. DOI:10.1016/j.geoderma.2016.11.007 |
| [25] | Wang SY, Liu WY, Zhao SY, Wang C, Zhuang LJ, Liu L, Wang WD, Lu YL, Li FB, Zhu GB. Denitrification is the main microbial N loss pathway on the Qinghai-Tibet Plateau above an elevation of 5000 m. Science of the Total Environment, 2019, 696: 133852. DOI:10.1016/j.scitotenv.2019.133852 |
| [26] | Zhu GB, Wang SY, Wang C, Zhou LG, Zhao SY, Li YX, Li FB, Jetten MSM, Lu YL, Schwark L. Resuscitation of anammox bacteria after >10, 000 years of dormancy. The ISME Journal, 2019, 13(4): 1098-1109. DOI:10.1038/s41396-018-0316-5 |
| [27] | Smith RL, Böhlke JK, Song B, Tobias CR. Role of anaerobic ammonium oxidation (Anammox) in nitrogen removal from a freshwater aquifer. Environmental Science & Technology, 2015, 49(20): 12169-12177. |
| [28] | Moore Z, Cowman S, Conroy RM. A randomised controlled clinical trial of repositioning, using the 30° tilt, for the prevention of pressure ulcers. Journal of Clinical Nursing, 2011, 20(17/18): 2633-2644. |
| [29] | Song YH, Mao GN, Gao GH, Bartlam M, Wang YY. Structural and functional changes of groundwater bacterial community during temperature and pH disturbances. Microbial Ecology, 2019, 78(2): 428-445. DOI:10.1007/s00248-019-01333-7 |
| [30] | Wang SY, Zhu GB, Zhuang LJ, Li YX, Liu L, Lavik G, Berg M, Liu ST, Long XE, Guo JH, Jetten MSM, Kuypers MMM, Li FB, Schwark L, Yin CQ. Anaerobic ammonium oxidation is a major N-sink in aquifer systems around the world. The ISME Journal, 2020, 14(1): 151-163. DOI:10.1038/s41396-019-0513-x |
| [31] | Sinninghe Damsté JS, Strous M, Rijpstra WIC, Hopmans EC, Geenevasen JAJ, van Duin ACT, van Niftrik LA, Jetten MSM. Linearly concatenated cyclobutane lipids form a dense bacterial membrane. Nature, 2002, 419(6908): 708-712. DOI:10.1038/nature01128 |
| [32] | Jaeschke A, Op den Camp HJM, Harhangi H, Klimiuk A, Hopmans EC, Jetten MSM, Schouten S, Sinninghe Damsté JS. 16S rRNA gene and lipid biomarker evidence for anaerobic ammonium-oxidizing bacteria (anammox) in California and Nevada hot springs. FEMS Microbiology Ecology, 2009, 67(3): 343-350. DOI:10.1111/j.1574-6941.2008.00640.x |
| [33] | Costa E, Pérez J, Kreft JU. Why is metabolic labour divided in nitrification?. Trends in Microbiology, 2006, 14(5): 213-219. DOI:10.1016/j.tim.2006.03.006 |
| [34] | Van Kessel MAHJ, Speth DR, Albertsen M, Nielsen PH, Op den Camp HJM, Kartal B, Jetten MSM, Lücker S. Complete nitrification by a single microorganism. Nature, 2015, 528(7583): 555-559. DOI:10.1038/nature16459 |
| [35] | Daims H, Lebedeva EV, Pjevac P, Han P, Herbold C, Albertsen M, Jehmlich N, Palatinszky M, Vierheilig J, Bulaev A, Kirkegaard RH, von Bergen M, Rattei T, Bendinger B, Nielsen PH, Wagner M. Complete nitrification by Nitrospira bacteria. Nature, 2015, 528(7583): 504-509. DOI:10.1038/nature16461 |
| [36] | Pinto AJ, Marcus DN, Ijaz UZ, Bautista-de lose Santos QM, Dick GJ, Raskin L. Metagenomic evidence for the presence of comammox Nitrospira-like bacteria in a drinking water system. mSphere, 2016, 1(1): e00054-15. |
| [37] | Pjevac P, Schauberger C, Poghosyan L, Herbold CW, van Kessel MAHJ, Daebeler A, Steinberger M, Jetten MSM, Lücker S, Wagner M, Daims H. AmoA-targeted polymerase chain reaction primers for the specific detection and quantification of comammox Nitrospira in the environment. Frontiers in Microbiology, 2017, 8: 1508. DOI:10.3389/fmicb.2017.01508 |
| [38] | Xia F, Wang JG, Zhu T, Zou B, Rhee SK, Quan ZX. Ubiquity and diversity of complete ammonia oxidizers (comammox). Applied and Environmental Microbiology, 2018, 84(24): e01390-18. |
| [39] | Shi Y, Jiang YY, Wang SY, Wang XM, Zhu GB. Biogeographic distribution of comammox bacteria in diverse terrestrial habitats. Science of the Total Environment, 2020, 717: 137257. DOI:10.1016/j.scitotenv.2020.137257 |
| [40] | Zhang SB, Xia XH, Li SL, Zhang LW, Wang GQ, Li MS, Shi YN, Chen NW. Ammonia oxidizers in high-elevation rivers of the qinghai-tibet plateau display distinctive distribution patterns. Applied and Environmental Microbiology, 2019, 85(22): e01701-19. |
| [41] | Xu YF, Liu GL, Hua YM, Wan XQ, Hu JL, Zhu DW, Zhao JW. The diversity of comammox bacteria and the effect of sewage discharge on their abundance in eutrophic lake sediments. Journal of Soils and Sediments, 2020, 20(5): 2495-2503. DOI:10.1007/s11368-020-02618-y |
| [42] | Palomo A, Dechesne A, Smets BF. Genomic profiling of Nitrospira species reveals ecological success of comammox Nitrospira. BioRxiv, 2019, doi: 10.1101/612226. |
| [43] | Wang XM, Wang SY, Jiang YY, Zhou JM, Han C, Zhu GB. Comammox bacterial abundance, activity, and contribution in agricultural rhizosphere soils. Science of the Total Environment, 2020, 727: 138563. DOI:10.1016/j.scitotenv.2020.138563 |
| [44] | Wang SY, Wang XM, Zhou JM, Han C, Jetten MSM, Schwark L, Li FB, Lu YL, Zhu GB. Prevalence and hotspots of complete ammonia oxidation in riparian zone ecosytems. Environmental Science & Technology, 2020. Under revision. Manuscript ID: es-2020-00915f. |
| [45] | Hu WC, Liang JS, Ju F, Wang QJ, Liu RP, Bai YH, Liu HJ, Qu JH. Metagenomics unravels differential microbiome composition and metabolic potential in rapid sand filters purifying surface water versus groundwater. Environmental Science & Technology, 2020, 54(8): 5197-5206. |
| [46] | Li CY, Hu HW, Chen QL, Chen DL, He JZ. Comammox Nitrospira play an active role in nitrification of agricultural soils amended with nitrogen fertilizers. Soil Biology and Biochemistry, 2019, 138: 107609. DOI:10.1016/j.soilbio.2019.107609 |
| [47] | Liu TL, Wang ZH, Wang SL, Zhao YP, Wright AL, Jiang XJ. Responses of ammonia-oxidizers and comammox to different long-term fertilization regimes in a subtropical paddy soil. European Journal of Soil Biology, 2019, 93: 103087. DOI:10.1016/j.ejsobi.2019.103087 |
| [48] | Wang ZH, Cao YQ, Zhu-Barker X, Nicol GW, Wright AL, Jia ZJ, Jiang XJ. Comammox Nitrospira clade B contributes to nitrification in soil. Soil Biology and Biochemistry, 2019, 135: 392-395. DOI:10.1016/j.soilbio.2019.06.004 |
| [49] | Koch H, van Kessel MAHJ, Lücker S. Complete nitrification:insights into the ecophysiology of comammox Nitrospira. Applied Microbiology and Biotechnology, 2019, 103(1): 177-189. DOI:10.1007/s00253-018-9486-3 |
| [50] | Palomo A, Fowler SJ, Gülay A, Rasmussen S, Sicheritz-Ponten T, Smets BF. Metagenomic analysis of rapid gravity sand filter microbial communities suggests novel physiology of Nitrospira spp.. The ISME Journal, 2016, 10(11): 2569-2581. DOI:10.1038/ismej.2016.63 |
| [51] | Fowler SJ, Palomo A, Dechesne A, Mines PD, Smets BF. Comammox Nitrospira are abundant ammonia oxidizers in diverse groundwater-fed rapid sand filter communities. Environmental Microbiology, 2018, 20(3): 1002-1015. DOI:10.1111/1462-2920.14033 |
| [52] | Bonin P. Anaerobic nitrate reduction to ammonium in two strains isolated from coastal marine sediment:a dissimilatory pathway. FEMS Microbiology Ecology, 1996, 19(1): 27-38. |
| [53] | Steenkamp DJ, Peck Jr HD. Proton translocation associated with nitrite respiration in Desulfovibrio desulfuricans. Journal of Biological Chemistry, 1981, 256(11): 5450-5458. |
| [54] | Nishio T. Estimating nitrogen transformation rates in surface aerobic soil of a paddy field. Soil Biology and Biochemistry, 1994, 26(9): 1273-1280. DOI:10.1016/0038-0717(94)90153-8 |
| [55] | Yin SX, Chen D, Chen LM, Edis R. Dissimilatory nitrate reduction to ammonium and responsible microorganisms in two Chinese and Australian paddy soils. Soil Biology and Biochemistry, 2002, 34(8): 1131-1137. DOI:10.1016/S0038-0717(02)00049-4 |
| [56] | Shan J, Zhao X, Sheng R, Xia YQ, Ti CP, Quan XF, Wang SW, Wei WX, Yan XY. Dissimilatory nitrate reduction processes in typical Chinese paddy soils:rates, relative contributions, and influencing factors. Environmental Science & Technology, 2016, 50(18): 9972-9980. |
| [57] | Silver WL, Herman DJ, Firestone MK. Dissimilatory nitrate reduction to ammonium in upland tropical forest soils. Ecology, 2001, 82(9): 2410-2416. |
| [58] | Silver WL, Thompson AW, Reich A, Ewel JJ, Firestone MK. Nitrogen cycling in tropical plantation forests:potential controls on nitrogen retention. Ecological Applications, 2005, 15(5): 1604-1614. DOI:10.1890/04-1322 |
| [59] | Pang YM, Ji GD. Biotic factors drive distinct DNRA potential rates and contributions in typical Chinese shallow lake sediments. Environmental Pollution, 2019, 254: 112903. DOI:10.1016/j.envpol.2019.07.071 |
| [60] | Jiang XY, Gao G, Zhang L, Tang XM, Shao KQ, Hu Y. Denitrification and dissimilatory nitrate reduction to ammonium in freshwater lakes of the Eastern Plain, China:influences of organic carbon and algal bloom. Science of the Total Environment, 2020, 710: 136303. DOI:10.1016/j.scitotenv.2019.136303 |
| [61] | Wang SY, Pi YX, Song YP, Jiang YY, Zhou LG, Liu WY, Zhu GB. Hotspot of dissimilatory nitrate reduction to ammonium (DNRA) process in freshwater sediments of riparian zones. Water Research, 2020, 173: 115539. DOI:10.1016/j.watres.2020.115539 |
| [62] | van den Berg EM, van Dongen U, Abbas B, Van Loosdrecht MC. Erratum:enrichment of DNRA bacteria in a continuous culture. The ISME Journal, 2015, 9(12): 2749. DOI:10.1038/ismej.2015.195 |
| [63] | Rütting T, Boeckx P, Müller C, Klemedtsson L. Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle. Biogeosciences, 2011, 8(7): 1779-1791. DOI:10.5194/bg-8-1779-2011 |
| [64] | Lu WW, Zhang HL, Min J, Shi WM. Dissimilatory nitrate reduction to ammonium in a soil under greenhouse vegetable cultivation as affected by organic amendments. Journal of Soils and Sediments, 2015, 15(5): 1169-1177. |
| [65] | Bu CN, Wang Y, Ge CH, Ahmad HA, Gao BY, Ni SQ. Dissimilatory nitrate reduction to ammonium in the yellow river estuary:rates, abundance, and community diversity. Scientific Reports, 2017, 7(1): 6830. DOI:10.1038/s41598-017-06404-8 |
| [66] | Zhu J, He Y, Zhu YS, Huang MS, Zhang YP. Biogeochemical sulfur cycling coupling with dissimilatory nitrate reduction processes in freshwater sediments. Environmental Reviews, 2018, 26(2): 121-132. DOI:10.1139/er-2017-0047 |
| [67] | Pandey AP, Suter H, He JZ, Hu HW, Chen DL. Nitrogen addition decreases dissimilatory nitrate reduction to ammonium in rice paddies. Applied and Environmental Microbiology, 2018, 84(17): e00870-18. |
| [68] | Tan EH, Zou WB, Zheng ZZ, Yan XL, Du MG, Hsu TC, Tian L, Middelburg JJ, Trull TW, Kao SJ. Warming stimulates sediment denitrification at the expense of anaerobic ammonium oxidation. Nature Climate Change, 2020, 10: 349-355. DOI:10.1038/s41558-020-0723-2 |
| [69] | Moklesur Rahman M, Roberts KL, Warry F, Grace MR, Cook PLM. Factors controlling dissimilatory nitrate reduction processes in constructed stormwater urban wetlands. Biogeochemistry, 2019, 142(3): 375-393. DOI:10.1007/s10533-019-00541-0 |
| [70] | Fazzolari E, Mariotti A, Germon JC. Dissimilatory ammonia production vs. denitrification in vitro and in inoculated agricultural soil samples. Canadian Journal of Microbiology, 1990, 36(11): 786-793. DOI:10.1139/m90-135 |
| [71] | Zhu GB, Wang SY, Li YX, Zhuang LJ, Zhao SY, Wang C, Kuypers MMM, Jetten MSM, Zhu YG. Microbial pathways for nitrogen loss in an upland soil. Environmental Microbiology, 2018, 20(5): 1723-1738. DOI:10.1111/1462-2920.14098 |
| [72] | Fazzolari É, Nicolardot B, Germon JC. Simultaneous effects of increasing levels of glucose and oxygen partial pressures on denitrification and dissimilatory nitrate reduction to ammonium in repacked soil cores. European Journal of Soil Biology, 1998, 34(1): 47-52. DOI:10.1016/S1164-5563(99)80006-5 |
| [73] | Bonin P, Omnes P, Chalamet A. Simultaneous occurrence of denitrification and nitrate ammonification in sediments of the French Mediterranean Coast. Hydrobiologia, 1998, 389(1/3): 169-182. DOI:10.1023/A:1003585115481 |
| [74] | Bi Z, Takekawa M, Park G, Soda S, Zhou JT, Qiao S, Ike M. Effects of the C/N ratio and bacterial populations on nitrogen removal in the simultaneous anammox and heterotrophic denitrification process:mathematic modeling and batch experiments. Chemical Engineering Journal, 2015, 280: 606-613. DOI:10.1016/j.cej.2015.06.028 |
| [75] | An S, Gardner WS. Dissimilatory nitrate reduction to ammonium (DNRA) as a nitrogen link, versus denitrification as a sink in a shallow estuary (Laguna Madre/Baffin Bay, Texas). Marine Ecology Progress Series, 2002, 237: 41-50. DOI:10.3354/meps237041 |
| [76] | Wisniewski K, Biase A di, Munz G, Oleszkiewicz JA, Makinia J. Kinetic characterization of hydrogen sulfide inhibition of suspended anammox biomass from a membrane bioreactor. Biochemical Engineering Journal, 2019, 143: 48-57. DOI:10.1016/j.bej.2018.12.015 |
 2020, Vol. 60
2020, Vol. 60