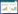中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 聂明. 2020
- Ming Nie. 2020
- 气候变暖下水圈甲烷排放及其微生物学机制
- Hydrospheric methane emission and its microbiological mechanisms under climate warming
- 微生物学报, 60(9): 1821-1833
- Acta Microbiologica Sinica, 60(9): 1821-1833
-
文章历史
- 收稿日期:2020-02-17
- 修回日期:2020-04-14
- 网络出版日期:2020-04-24
甲烷是重要的温室气体之一,在百年尺度上的增温潜势为二氧化碳的28倍,约占整个温室气体贡献量的15%[1-2]。随着人类活动的不断加剧,大气中的甲烷浓度已从工业革命前的0.7 mmol/mol陡增到超过1.8 mmol/mol,上升速度是近20年中最为迅猛的时候,这极大地抵消了国际社会对减缓气候变化作出的积极努力[1-2]。湿地、淡水系统(如湖泊、河流等)、冻土与海洋等水圈生态系统是甲烷最为主要的自然排放源,也是甲烷代谢微生物最为主要的栖息地[3]。因此,阐明水圈生态系统中甲烷排放格局与相关微生物学过程是准确预测未来地球气候系统变化所面临的重大课题。
气候变暖已被证实可潜在增加水圈生态系统的甲烷排放,甲烷排放的增加反之将进一步加剧气候变暖,如同“潘多拉的魔盒”般打开了水圈甲烷排放与气候变暖间的正反馈效应[3-4]。水圈甲烷排放的强度主要受到产甲烷菌和甲烷氧化菌的双重影响,同时还受到气泡、扩散和植物传输三种途径对甲烷释放的调控作用[3]。尽管在实验室中微生物的生长与代谢跟温度的关系被广泛认知与精确定量,但在复杂自然界中微生物对气候变暖的响应与反馈研究仍存在诸多问题和争议[3-4]。整体而言,气候变暖对甲烷代谢微生物群落结构与功能的影响主要分为两大类(图 1)。(1)直接影响——气候变暖直接改变生境温度,影响微生物的生长与代谢活性;(2)间接影响——气候变暖通过改变植物(浮游生物)多样性与生产力(即微生物生长基质的数量与质量)、水文条件、pH、沉积物质地等环境因子间接调控微生物的生长与代谢[4-5]。水圈生态系统中参与甲烷代谢的微生物本身具有高度的复杂性和多样性,又受到气候变暖影响下众多环境因子变化的共同调控,导致我们对未来气候变化背景下水圈甲烷排放的预测存在极大的不确定性[6]。

|
| 图 1 气候变暖对水圈甲烷代谢微生物的直接与间接影响以及所产生的温室气体对气候变暖的反馈效应 Figure 1 Direct and indirect effects of climate warming on hydrospheric CH4 metabolic microorganisms and routes of feedbacks to climate warming through greenhouse gas productions |
本文综述了气候变暖背景下湿地、淡水系统、冻土与海洋等主要水圈生态系统中微生物介导甲烷排放的现状与趋势。首先,本文立足于水圈元素生物地球化学循环的宏观机制与生态效应,介绍了这些水圈生态系统中甲烷排放量及其气候变暖背景下的演变趋势,探讨了水圈微生物介导的甲烷代谢对区域与全球尺度上碳收支的作用与未来趋势。在此基础上,围绕微生物与环境因子间的互作关系,从气候变暖对甲烷代谢途径影响以及气候变暖的间接影响等几个方面,回顾了气候变暖背景下水圈生态系统中介导甲烷循环相关微生物群落结构与功能的研究,并建议了未来研究的主要方向。
1 水圈甲烷排放格局与未来趋势当前,全球甲烷排放总量为567-884 Tg/year,甲烷排放源可分为自然源与人为源[3, 7]。包括湿地、淡水系统、冻土与海洋等在内的水圈生态系统是全球最为重要的甲烷排放源,占全球甲烷排放总量的近一半[3, 7]。
1.1 湿地湿地指长久或暂时性沼泽地、湿原、泥炭地或水域地带,带有或静止或流动的淡水、半咸水或咸水水体,包括低潮时水深不超过6 m的海域[8]。由于水圈湿地巨大的植物生产力以及通过水体输入的大量外源碳,湿地以仅占4%-6%的陆地面积,储量了全球20%-25%的土壤碳[9]。厌氧环境为湿地甲烷排放创造了必要条件,在自然甲烷源中湿地甲烷排放量最大,为140-280 Tg/year[10-11]。同时,全球尺度上湿地甲烷排放存在较强的空间异质性,热带湿地、温带湿地与寒带湿地的排放量分别约为湿地总量的50%-60%、5%与34%[12-13]。
增温整体上会同时促进湿地产甲烷菌与甲烷氧化菌的生长与代谢[14-15]。一项全球性的数据分析研究表明,气候变暖对湿地甲烷排放的促进作用比对二氧化碳排放更为强烈[16]。该研究表明,当温度从0 ℃升高到30 ℃后湿地甲烷排放量增加了57倍[16],这可能是由于产甲烷菌较甲烷氧化菌具有较高的温度敏感性所致[17]。这一发现挑战了湿地产甲烷速率与甲烷氧化速率随增温而同步增加的认识[15]。由于高纬度地区的未来气候变暖趋势更为强烈,这将明显地促进寒带湿地的甲烷排放量,形成甲烷排放与气候变暖的正反馈效应[18]。
此外,气候变暖还可通过改变全球降雨格局而影响湿地甲烷排放的另一关键因子,即水文条件[18]。研究表明,气候变暖背景下未来平均降雨量将有可能在目前干旱的中纬度地区与亚热带地区减少,而在目前湿润的中纬度地区与高纬度地区增强[19]。干旱季节的延长将降低湿地的水分含量,从而抑制甲烷的排放;而降雨增加将提高湿地面积与水位,促进湿地甲烷排放[20-21]。此外,降水增加将提高有机碳向湿地剖面较深处的输入,从而提高甲烷的生产[22]。
尽管湿地已被确认为全球最大的自然甲烷源,但评估气候变暖对甲烷排放及其在碳收支上贡献的影响还任重道远。目前主要的挑战有:(1)全球性的湿地甲烷排放长期跟踪监测体系亟待完善;(2)湿地甲烷排放及其相关微生物驱动机制对气候变暖直接与间接的多重响应及其地理分异规律还知之甚少;(3)人类活动对于甲烷循环的叠加影响尚不明晰。湿地作为全球最重要的高碳汇生态系统类型之一,其保护、维持或恢复对于减缓全球气候变化将起到十分重要的积极作用,因此提升对气候变暖背景下湿地甲烷排放机制的认识将对科学地管理湿地起到积极作用。
1.2 淡水系统全球淡水系统中总的甲烷排放量高达100 Tg/year[23]。在河流中由水坝建设生成的人造淡水系统,由于富营养化的普遍存在,大约有13 Tg/year的甲烷排放量[23]。淡水系统的甲烷产生主要是通过沉积物中微生物产甲烷作用实现的;高浊度、低氧的淡水剖面也是甲烷重要来源[24-25]。淡水系统产生的甲烷主要通过扩散作用排放到大气中,也可通过植物通气组织进行释放[23]。然而,地表水中的甲烷氧化途径(尤其是甲烷好氧氧化)可以氧化掉大部分甲烷,在缓冲甲烷净排放中起到关键作用[26]。
气候变暖将加速淡水系统的甲烷排放,特别是在高纬度地区。据估计,北极淡水湖泊甲烷排放量将从目前约13 Tg/year增加至本世纪末的28 Tg/year[27]。同时,气候变暖正以前所未有的速度影响北方地区一半以上的湖泊,导致水体温度增加、富碳基质融化与分解、水体氧气浓度下降、冰期时间减短,这均将促进甲烷排放。有研究估计,到2100年,冰期的减短将提高50%的寒带淡水系统甲烷排放[28]。另一方面,气候变暖可通过降低甲烷的溶解度来增加水体中甲烷气泡的形成,导致大量的甲烷可以迅速绕过水体中好氧和厌氧氧化层,加速释放到大气中[29]。
如同湿地生态系统一样,气候变暖引起的全球降雨格局变化也将影响淡水系统甲烷的排放,但影响较为复杂。降雨以及冰融水的减少可延长原有淡水的滞留时间,加剧单位面积水体富营养化和缺氧,从而增加甲烷排放;然而,亚热带地区由于气候变暖引起的降水量持续减少,可能导致一些淡水系统面积减少或完全丧失,导致甲烷排放的总体下降[30]。在富含有机质的淡水系统,降雨可能会增强这些区域的甲烷排放[31]。
1.3 冻土冻土是至少在0 ℃以下连续2年,并含有冰的各种土壤、沉积物与岩石[32]。冻土主要分布在北半球的高海拔与高纬度地区,占北半球陆地面积的约24%。全球约有一半土壤碳汇储藏在冻土中,相当于全球大气碳汇的2倍[33]。尽管当前冻土还是微弱甲烷排放源,约为1 Tg/year[7],但气候变暖背景下冻土可能成为重要的甲烷排放源,已受到学界的普遍关注。
气候变暖对生态系统的增温效应在冻土区域尤为明显。比如,极地生态系统变暖的速度比全球其他任何地方都要快。气候模型预测,极地生态系统的年平均气温到2100年将上升8 ℃,而全球平均气温上升为1.4-5.8 ℃;与此同时,极地生态系统在夏季处于零上温度的频度与程度也将增加[33-34]。如果对气候变暖趋势不加以遏制,本世纪末将有一半左右的冻土消失[3]。大量研究表明,冻土层温度升高、有机质降解产物(如乙酸和H2/CO2)会提高产甲烷菌代谢活性,提升甲烷的排放[34-36]。然而,目前大多数模型并没有考虑介导甲烷循环的相关微生物对气候变暖的反馈作用,因而未来冻土甲烷排放量还有较大的不确定性。研究发现,考虑这些微生物作用的模型预测气候变暖情景下冻土甲烷排放量(30-90 Tg/year)要远大于其他模型(6-15 Tg/year)[37-38]。
另一个让国际社会感到不安的是封存在冻土中的巨量甲烷气体水合物(约500000 Tg CH4)——“可燃冰”。随着气候变暖的加剧,冻土融化可能导致“可燃冰”中甲烷的释放。尽管部分甲烷会被甲烷氧化微生物所利用,但消耗量还不确定,“可燃冰”就像威力不断升级的“炸弹”影响着地球气候系统[39-40]。
1.4 海洋尽管海洋面积辽阔,但其甲烷排放量位于自然排放源的中等水平,约30 Tg/year[41]。这主要是因为硫酸盐依赖的甲烷厌氧氧化过程能有效消耗掉90%以上海洋产生的甲烷[42]。当前,源自远海、陆缘海与河口区域甲烷排放量分别约为2、6和2 Tg/year[41]。较高的初级生产力、源源不断的陆源有机质输入以及直接来自于河流的甲烷输入,使位于特殊位置的陆缘海与河口成为了海洋甲烷排放的热点区域[43-44]。另一个重要的甲烷排放源是来自于海底渗漏,如海底泥火山与碳氢化合物渗漏等,排放量约为20 Tg/year[41]。
尽管全球海洋表面的甲烷含量饱和,但大多数产甲烷微生物在富氧的海洋表面水域是不能生存的,产生了“海洋甲烷悖论”这一让人费解的现象[45-46]。最近的研究发现了新型微生物及其代谢机制,如一些海域微生物可通过好氧分解溶解性有机质中膦酸酯组分产生大量的甲烷[47],或者通过参与的甲基化硫化合物代谢产甲烷[48],这些均有助于揭示海洋中甲烷的未知来源。可见,发现微生物的代谢新途径以及新调控机制对于认识海洋甲烷循环及其对全球碳平衡的作用是极为重要的。
气候变暖已显著升高了海洋水体温度,这不仅可直接促进微生物的生长代谢,同时也进一步提高微生物生长基质的有效性,但对产甲烷菌与甲烷氧化菌两类微生物介导的甲烷生产和氧化相关过程的净影响还有待进一步研究,特别是在远海[3, 6, 10]。在陆缘海与河口区域,由于地形地貌复杂多样、水文动力过程复杂、陆海相互作用强烈、人类活动干扰强度大等原因,认识气候变暖对于这些区域甲烷排放及其微生物过程的影响同样面临着巨大挑战[3, 6, 10]。
如同其他水圈生态系统,位于高纬度的海洋将经受到更为严重的气候变暖影响。海冰的存在可以减少海水湍流和波浪的产生而限制气体交换,也可以减少微生物生长基质的可利用性,是高纬度海洋与大气间甲烷交换的重要屏障[49]。研究发现,北冰洋海冰覆盖面积在近几十年来逐渐减少,尤其是在夏季,这将促进北冰洋产甲烷菌的活性以及甲烷排放的物理交换过程[50-51]。另一方面,气候变暖导致的海冰减少将提高全球海平面,这不仅将扩大近海微生物厌氧生境的面积,而且通过增强对海岸带的侵蚀为相关甲烷代谢微生物提供更为丰富的生长基质[52-53],势必潜在改变近海甲烷的排放格局。
2 气候变暖背景下甲烷微生物与环境因子间的互作关系由于参与甲烷代谢的微生物种类繁多,不同类型微生物对气候变暖响应的方向与强度可能存在不同。此外,气候变暖还会通过改变水圈水文、植被等环境条件间接影响甲烷代谢微生物,人类活动带来的多重影响也不可忽视。这些因素叠加起来形成了气候变暖对甲烷代谢相关微生物群落与功能的复杂调控作用。
2.1 增温对产甲烷代谢途径的影响产甲烷菌主要分为乙酸发酵型、氢营养型和甲基营养型三种类型。乙酸发酵型菌通过分解乙酸,将乙酸的羧基氧化为二氧化碳,甲基还原为甲烷;氢营养型菌利用氢气,将二氧化碳还原为甲烷;甲基营养型菌利用甲基类化合物、甲胺类化合物和甲基硫化合物等生产甲烷[54]。在大多数水圈生态系统中几种代谢途径同时存在,但对环境温度变化的响应存在不同,导致这些途径对甲烷生产的贡献随温度变化而不同。一般来说,相对于乙酸发酵型菌,温度的升高更加有利于氢营养型菌,主要原因是氢营养型产甲烷菌可能比乙酸发酵型具有更高的温度适宜性[34],以及高温环境促进了相关微生物发酵生产氢气[55]。此外,热力学分析表明,温度升高条件下,乙酸的产甲烷代谢过程更倾向于通过乙酸互营氧化菌和氢营养型产甲烷古菌的耦联作用进行[56-57]。虽然这种代谢路径的变化主要存在于从低温向中等温度的转变过程中,但将给水圈甲烷生产带来显著的影响[58-59]。另外,甲基营养型菌在水圈生态系统中也广泛分布[60],以及还发现很多新的未培养古菌[61],但对于这些微生物响应环境温度变化的认识还十分有限,有待更多的研究以期更为精准评估气候变暖背景下的甲烷排放通量。
2.2 增温对微生物甲烷生产与氧化的不均等性影响许多研究表明,增温不仅可提高微生物介导的甲烷生产,同时也会增强微生物介导的甲烷好氧与厌氧氧化作用[14-15]。目前,产甲烷过程和甲烷氧化过程对增温的响应是否存在不均等性,以及其相关调控机制均不清晰。一个重要的限制因素是水圈生态系统的高度异质性。在英国泥炭沼泽的研究发现,增温同时促进了微生物甲烷生产与氧化,但随着温度的升高甲烷生产增长的强度比甲烷氧化要大,甲烷氧化的消耗补偿作用将越来越弱,导致该泥炭沼泽大量甲烷的排放[14]。然而,在淡水系统中,高温情况下微生物甲烷氧化功能可与甲烷生产功能平衡,甚至超过甲烷的生产,这表明甲烷氧化对于调控甲烷净排放的作用较之前可能被低估[62]。另一方面,底物有效性可能是调控甲烷氧化强度的另一关键因子。例如,Duc等发现甲烷氧化的提高不是直接来自于增温的直接促进作用,而是间接来自于产甲烷菌活性增强后为甲烷氧化提供了充足底物[63]。此外,在淡水系统中,含碳量丰富的细泥中甲烷氧化可随增温而增强,而由于基质限制导致粗砂砾中甲烷氧化对温度变化并不敏感[64]。
2.3 水分条件对甲烷代谢微生物响应增温的影响淹水所产生的厌氧环境是甲烷产生的必要条件,气候变暖可导致降雨量及其季节分配改变,同时也可加剧土壤水分的蒸发,这均将影响地上/下水位而间接改变水圈生态系统中甲烷排放及其相关微生物过程[3, 7]。在芬兰泥炭地,研究人员分别在湿润与干旱区域采用开顶式气室法研究增温对产甲烷菌与甲烷氧化菌的影响,发现在干旱区域,水分减少对参与甲烷代谢相关微生物的影响强于增温,并可能抵消该区域微弱增温的影响。此外,增温对于湿润区域的甲烷氧化菌及其功能潜力没有显著影响,但在干旱区域减少了Type Ⅰ类b型甲烷氧化菌[65]。事实上,对于不同类型水圈系统,气候变暖导致的多因素相互作用对甲烷排放影响还未能形成统一的认识。研究发现,增温与干旱化提高了美国阿拉斯加沼泽中的甲烷排放[66],而在加拿大的沼泽却没有得到相同结论[67]。另外,气候变暖伴随着的水位变化可能会通过其他方式影响水圈甲烷排放及其相关微生物过程,导致预测水圈甲烷排放十分困难,如在北美的泥炭地发现增温与干旱化对参与甲烷循环微生物的影响主要是通过改变孔隙水的化学成分与植物生产力[68]。
2.4 植被对甲烷代谢微生物响应增温的影响植物不仅通过通气组织为甲烷排放提供通道,还通过地上/下凋落物与根系分泌物的形式为甲烷循环相关微生物提供生长所需基质[69]。有证据表明,增温对产甲烷速率的促进作用很大程度上依赖于增温对植被生长的正效应。在美国弗罗里达州的淡水系统,增温对产甲烷速率的促进强度与土壤中植物源的木质纤维素含量相关[70]。在英国的泥炭沼泽,泥炭藓的存在促进了增温对甲烷氧化菌的生长,从而消耗掉了大部分产生的甲烷,对于限制该区域甲烷排放起到重要的平衡作用[14]。另一方面,植被群落组成的不同会影响输入基质的质量与数量,从而影响气候变暖背景下水圈甲烷的排放。在美国阿拉斯加州,通过对25处不同植被类型的湿地研究发现,当泥炭藓向维管植物演变后产甲烷代谢途径发生了转变,促进了甲烷排放。这一结果表明,未来气候变暖将促进这些区域维管植物的生长与分布,从而可能导致高纬度湿地甲烷排放的增加[71]。在中国的若尔盖湿地也有类似发现,尽管增温与甲烷排放息息相关,但温度对于产甲烷代谢的影响主要源于植被类型[72]。
2.5 富营养化对甲烷代谢微生物响应增温的影响水圈是人类赖以生存的生态系统,也是受人类活动影响最为严重的生态系统之一。化石燃料的燃烧和氮肥的广泛使用加速了活性营养盐的排放,并通过水体径流输运、大气沉降等方式进入各类水圈生态系统,使水圈生态系统逐步由生产力水平较低的贫营养状态向生产力水平较高的富营养状态转变[73-74]。由于甲烷氧化与氨氧化的代谢通路非常相似,且甲烷与铵离子的分子结构类似,因此外源氮的输入可能会抑制甲烷氧化[75]。此外,富营养化可通过提高水体中基质的可利用性以及降低水体含氧量,从而影响微生物介导的甲烷排放。通过对来自于10个不同纬度的湖泊沉积物与水体研究发现,富营养化均不同程度的增强了这些湖泊甲烷排放对温度的敏感性[76]。模型分析进一步表明,湖泊水体增加2 ℃情况下富营养湖泊的甲烷排放将增加101%-183%,而贫营养湖泊的甲烷排放仅增加47%-56%[76]。另一项研究表明,营养盐对于甲烷排放的限制作用随着温度的升高而增强[77]。在人类活动和气候变化的双重驱动下,富营养化的影响范围将不断扩大,从过去主要集中于温带大型浅水湖泊逐渐扩展到寒冷地区的湖泊[78-79],这势必将增强富营养化对水圈中甲烷排放及其相关微生物过程响应增温的影响。
3 总结和展望气候变暖正深刻影响着人类的生存与发展,成为当今人类社会亟待解决的重大问题。水圈生态系统既是全球最为重要的碳汇之一,也是全球最为重要的甲烷自然排放源,深入开展研究气候变暖与水圈碳循环的相互作用是生态学、地学与微生物学等相关学科的核心研究内容之一,当前正处在前所未有的迅猛发展时期。阐明气候变暖背景下水圈甲烷排放格局及其相关微生物调控机制,是理解水圈调控全球气候系统中的关键,也将为未来应对全球气候变化而寻求高效发挥水圈碳汇潜力的技术方法提供基础理论支撑。
近年来,新的研究方法、技术与研究体系如雨后春笋般涌现,促进了水圈相关研究的快速发展,但还有很多基础科学问题未解决。从某种意义上说,气候变暖下对水圈微生物介导甲烷排放的研究还处于初期阶段。例如,参与甲烷代谢的微生物到底存在多少种、目前发现的新型微生物在生态系统层面上到底发挥了多大的作用等基本问题尚无法明确回答,未来还将面临着巨大的挑战,尤其如下几个方面在未来有待深入的研究。
3.1 结合微观机制与宏观过程开展研究分子生物学技术的应用与发展极大促进了对参与甲烷排放相关微生物的种类、遗传背景、生理与代谢机制等的认识,但是目前大多停留在描述实验室样品中这些微生物的基础生物学特性层面,对于这些微生物尤其是新型微生物的地理分布格局及其形成机制、生态系统功能与贡献、受多环境因子的协同调控机制等亟待加强深入研究。
3.2 基于生态系统复杂性和气候变暖长期性开展研究气候变暖同时通过直接与间接作用调控甲烷排放及其相关微生物过程,此外水圈生态系统也面临着来自于富营养化、土地利用方式、生物入侵等诸多全球变化问题的影响,而这些多重影响往往具有长期效应且随时间在作用方式与程度上可能发生变异。这需要通过设计精确的野外控制实验或者长期有效的实地跟踪调查等方式而进行科学研究。
3.3 加强对薄弱区的研究以往与甲烷排放的相关研究主要集中在湿地与冻土生态系统,而这一研究在海洋生态系统中相对薄弱,尤其远海与深海区域,其根本原因是受地理位置限制所致。尽管如此,海洋生态系统甲烷排放在调控全球气候变化中的重要性不容忽视,未来研究亟需在更为广阔的海洋生态系统中开展全面长期的研究,尽快阐明这些区域包括甲烷在内的碳循环及对气候反馈的微生物学机制与生态效应,为地球气候生态系统模型的准确预测提供理论支撑。
| [1] | Saunois M, Bousquet P, Poulter B, Peregon A, Ciais P, Canadell JG, Dlugokencky EJ, Etiope G, Bastviken D, Houweling S, Janssens-Maenhout G, Tubiello FN, Castaldi S, Jackson RB, Alexe M, Arora VK, Beerling DJ, Bergamaschi P, Blake DR, Brailsford G, Brovkin V, Bruhwiler L, Crevoisier C, Crill P, Covey K, Curry C, Frankenberg C, Gedney N, Höglund-Isaksson L, Ishizawa M, Ito A, Joos F, Kim HS, Kleinen T, Krummel P, Lamarque JF, Langenfelds R, Locatelli R, Machida T, Maksyutov S, McDonald KC, Marshall J, Melton JR, Morino I, Naik V, O'Doherty S, Parmentier FJW, Patra PK, Peng CH, Peng SS, Peters GP, Pison I, Prigent C, Prinn R, Ramonet M, Riley WJ, Saito M, Santini M, Schroeder R, Simpson IJ, Spahni R, Steele P, Takizawa A, Thornton BF, Tian HQ, Tohjima Y, Viovy N, Voulgarakis A, van Weele M, van der Werf GR, Weiss R, Wiedinmyer C, Wilton DJ, Wiltshire A, Worthy D, Wunch D, Xu XY, Yoshida Y, Zhang BW, Zhang Z, Zhu QA. The global methane budget 2000-2012. Earth System Science Data, 2016, 8(2): 697-751. DOI:10.5194/essd-8-697-2016 |
| [2] | Saunois M, Jackson RB, Bousquet P, Poulter B, Canadell JG. The growing role of methane in anthropogenic climate change. Environmental Research Letters, 2016, 11(12): 120207. DOI:10.1088/1748-9326/11/12/120207 |
| [3] | Dean JF, Middelburg JJ, Röckmann T, Aerts R, Blauw LG, Egger M, Jetten MSM, de Jong AEE, Meisel OH, Rasigraf O, Slomp CP, in't Zandt MH, Dolman AJ. Methane feedbacks to the global climate system in a warmer world. Reviews of Geophysics, 2018, 56(1): 207-250. |
| [4] | Singh BK, Bardgett RD, Smith P, Reay DS. Microorganisms and climate change:terrestrial feedbacks and mitigation options. Nature Reviews Microbiology, 2010, 8(11): 779-790. DOI:10.1038/nrmicro2439 |
| [5] | Bardgett RD, Freeman C, Ostle NJ. Microbial contributions to climate change through carbon cycle feedbacks. The ISME Journal, 2008, 2(8): 805-814. DOI:10.1038/ismej.2008.58 |
| [6] | Kirschke S, Bousquet P, Ciais P, Saunois M, Canadell JG, Dlugokencky EJ, Bergamaschi P, Bergmann D, Blake DR, Bruhwiler L, Cameron-Smith P, Castaldi S, Chevallier F, Feng L, Fraser A, Heimann M, Hodson EL, Houweling S, Josse B, Fraser PJ, Krummel PB, Lamarque JF, Langenfelds RL, Le Quéré C, Naik V, O'Doherty S, Palmer PI, Pison I, Plummer D, Poulter B, Prinn RG, Rigby M, Ringeval B, Santini M, Schmidt M, Shindell DT, Simpson IJ, Spahni R, Steele LP, Strode SA, Sudo K, Szopa S, van der Werf GR, Voulgarakis A, van Weele M, Weiss RF, Williams JE, Zeng G. Three decades of global methane sources and sinks. Nature Geoscience, 2013, 6(10): 813-823. DOI:10.1038/ngeo1955 |
| [7] | Ciais P, Sabine C, Bala G, Bopp L, Brovkin V, Canadell J, Chhabra A, DeFries R, Galloway J, Heimann M, Jones C, Le Quéré C, Myneni RB, Piao S, Thornton P. Carbon and other biogeochemical cycles//Stocker TF, Qin D, Plattner GK, Tignor M, Allen SK, Boschung J, Nauels A, Xia Y, Bex V, Midgley PM. Climate Change 2013: the Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press, 2013. |
| [8] | Keddy PA. Wetland ecology:principles and conservation. Cambridge: Cambridge University Press, 2010. |
| [9] | Mitsch WJ, Bernal B, Nahlik AM, Mander Ü, Zhang L, Anderson CJ, Jørgensen SE, Brix H. Wetlands, carbon, and climate change. Landscape Ecology, 2013, 28(4): 583-597. DOI:10.1007/s10980-012-9758-8 |
| [10] | Reay DS, Smith P, Christensen TR, James RH, Clark H. Methane and global environmental change. Annual Review of Environment and Resources, 2018, 43: 165-192. DOI:10.1146/annurev-environ-102017-030154 |
| [11] | Meng L, Hess PGM, Mahowald NM, Yavitt JB, Riley WJ, Subin ZN, Lawrence DM, Swenson SC, Jauhiainen J, Fuka DR. Sensitivity of wetland methane emissions to model assumptions:application and model testing against site observations. Biogeosciences, 2012, 9(7): 2793-2819. DOI:10.5194/bg-9-2793-2012 |
| [12] | Bloom AA, Palmer PI, Fraser A, Reay DS, Frankenberg C. Large-scale controls of methanogenesis inferred from methane and gravity spaceborne data. Science, 2010, 327(5963): 322-325. DOI:10.1126/science.1175176 |
| [13] | Wang ZP, Zeng D, Patrick Jr WH. Methane emissions from natural wetlands. Environmental Monitoring and Assessment, 1996, 42(1/2): 143-161. |
| [14] | van Winden JF, Reichart GJ, McNamara NP, Benthien A, Damste JSS. Temperature-induced increase in methane release from peat bogs:a mesocosm experiment. PLoS One, 2012, 7(6): e39614. DOI:10.1371/journal.pone.0039614 |
| [15] | Kip N, van Winden J, Pan Y, Bodrossy L, Reichart GJ, Smolders AJP, Jetten MSM, Damsté JSS, Op den Camp HJM. Global prevalence of methane oxidation by symbiotic bacteria in peat-moss ecosystems. Nature Geoscience, 2010, 3(9): 617-621. DOI:10.1038/ngeo939 |
| [16] | Yvon-Durocher G, Allen AP, Bastviken D, Conrad R, Gudasz C, St-Pierre A, Thanh-Duc N, del Giorgio PA. Methane fluxes show consistent temperature dependence across microbial to ecosystem scales. Nature, 2014, 507(7493): 488-491. DOI:10.1038/nature13164 |
| [17] | Schipper LA, Hobbs JK, Rutledge S, Arcus VL. Thermodynamic theory explains the temperature optima of soil microbial processes and high Q10 values at low temperatures. Global Change Biology, 2014, 20(11): 3578-3586. DOI:10.1111/gcb.12596 |
| [18] | IPCC. Climate Change 2014:Synthesis report. Cambridge: Cambridge University Press, 2014. |
| [19] | Collins M, Knutti R, Arblaster JM, Dufresne JL, Fichelet T, Friedlingstein P, Gao X, Gutowski WJ, Johns T, Krinner G, Shongwe M, Tebaldi C, Weaver AJ, Wehner M. Long-term climate change: projections, commitments and irreversibility//Stocker TF, Qin D, Plattner GK, Tignor M, Allen SK, Boschung J, Nauels A, Xia Y, Bex V, Midgley PM. Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press, 2013. |
| [20] | Dowrick DJ, Freeman C, Lock MA, Reynolds B. Sulphate reduction and the suppression of peatland methane emissions following summer drought. Geoderma, 2006, 132(3/4): 384-390. |
| [21] | Zhang Z, Zimmermann NE, Stenke A, Li X, Hodson EL, Zhu GF, Huang CL, Poulter B. Emerging role of wetland methane emissions in driving 21st century climate change. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(36): 9647-9652. DOI:10.1073/pnas.1618765114 |
| [22] | Glaser PH, Siegel DI, Chanton JP, Reeve AS, Rosenberry DO, Corbett JE, Dasgupta S, Levy Z. Climatic drivers for multidecadal shifts in solute transport and methane production zones within a large peat basin. Global Biogeochemical Cycles, 2016, 30(11): 1578-1598. DOI:10.1002/2016GB005397 |
| [23] | Bastviken D, Tranvik LJ, Downing JA, Crill PM, Enrich-Prast A. Freshwater methane emissions offset the continental carbon sink. Science, 2011, 331(6013): 50. DOI:10.1126/science.1196808 |
| [24] | Upstill-Goddard RC, Barnes J. Methane emissions from UK estuaries:re-evaluating the estuarine source of tropospheric methane from Europe. Marine Chemistry, 2016, 180: 14-23. DOI:10.1016/j.marchem.2016.01.010 |
| [25] | Tang KW, McGinnis DF, Frindte K, Brüchert V, Grossart HP. Paradox reconsidered:methane oversaturation in well-oxygenated lake waters. Limnology and Oceanography, 2014, 59(1): 275-284. DOI:10.4319/lo.2014.59.1.0275 |
| [26] | Conrad R. Control of microbial methane production in wetland rice fields. Nutrient Cycling in Agroecosystems, 2002, 64(1/2): 59-69. DOI:10.1023/A:1021178713988 |
| [27] | Tan ZL, Zhuang QL. Arctic lakes are continuous methane sources to the atmosphere under warming conditions. Environmental Research Letters, 2015, 10(5): 054016. DOI:10.1088/1748-9326/10/5/054016 |
| [28] | Wik M, Varner RK, Anthony KW, MacIntyre S, Bastviken D. Climate-sensitive northern lakes and ponds are critical components of methane release. Nature Geoscience, 2016, 9(2): 99-105. DOI:10.1038/ngeo2578 |
| [29] | Wever TF, Abegg F, Fiedler HM, Fechner G, Stender IH. Shallow gas in the muddy sediments of Eckernförde Bay, Germany. Continental Shelf Research, 1998, 18(14/15): 1715-1739. |
| [30] | Tranvik LJ, Downing JA, Cotner JB, Loiselle SA, Striegl RG, Ballatore TJ, Dillon P, Finlay K, Fortino K, Knoll LB, Kortelainen PL, Kutser T, Larsen S, Laurion I, Leech DM, McCallister S, McKnight DM, Melack JM, Overholt E, Porter JA, Prairie Y, Renwick WH, Roland F, Sherman BS, Schindler DW, Sobek S, Tremblay A, Vanni MJ, Verschoor AM, von Wachenfeldt E, Weyhenmeyer GA. Lakes and reservoirs as regulators of carbon cycling and climate. Limnology and Oceanography, 2009, 54(6): 2298-2314. |
| [31] | Sawakuchi HO, Bastviken D, Sawakuchi AO, Krusche AV, Ballester MVR, Richey JE. Methane emissions from Amazonian rivers and their contribution to the global methane budget. Global Change Biology, 2014, 20(9): 2829-2840. DOI:10.1111/gcb.12646 |
| [32] | Tarnocai C, Canadell JG, Schuur EAG, Kuhry P, Mazhitova G, Zimov S. Soil organic carbon pools in the northern circumpolar permafrost region. Global Biogeochemical Cycles, 2009, 23(2): GB2023. |
| [33] | Camill P. Permafrost thaw accelerates in boreal peatlands during late-20th century climate warming. Climatic Change, 2005, 68(1/2): 135-152. |
| [34] | Allan J, Ronholm J, Mykytczuk NCS, Greer CW, Onstott TC, Whyte LG. Methanogen community composition and rates of methane consumption in Canadian high arctic permafrost soils. Environmental Microbiology Reports, 2014, 6(2): 136-144. DOI:10.1111/1758-2229.12139 |
| [35] | Blanc-Betes E, Welker JM, Sturchio NC, Chanton JP, Gonzalez-Meler MA. Winter precipitation and snow accumulation drive the methane sink or source strength of Arctic tussock tundra. Global Change Biology, 2016, 22(8): 2818-2833. DOI:10.1111/gcb.13242 |
| [36] | Drake TW, Wickland KP, Spencer RGM, McKnight DM, Striegl RG. Ancient low-molecular-weight organic acids in permafrost fuel rapid carbon dioxide production upon thaw. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(45): 13946-13951. DOI:10.1073/pnas.1511705112 |
| [37] | McCalley CK, Woodcroft BJ, Hodgkins SB, Wehr RA, Kim EH, Mondav R, Crill PM, Chanton JP, Rich VI, Tyson GW, Saleska SR. Methane dynamics regulated by microbial community response to permafrost thaw. Nature, 2014, 514(7523): 478-481. DOI:10.1038/nature13798 |
| [38] | Gao X, Schlosser CA, Sokolov A, Anthony KW, Zhuang QL, Kicklighter D. Permafrost degradation and methane:low risk of biogeochemical climate-warming feedback. Environmental Research Letters, 2013, 8(3): 035014. DOI:10.1088/1748-9326/8/3/035014 |
| [39] | Mestdagh T, Poort J, de Batist M. The sensitivity of gas hydrate reservoirs to climate change:perspectives from a new combined model for permafrost-related and marine settings. Earth-Science Reviews, 2017, 169: 104-131. DOI:10.1016/j.earscirev.2017.04.013 |
| [40] | Ruppel CD, Kessler JD. The interaction of climate change and methane hydrates. Reviews of Geophysics, 2017, 55(1): 126-168. |
| [41] | US EPA. Methane and nitrous oxide emissions from natural sources. Washington, DC: US EPA, 2010. |
| [42] | Boetius A, Ravenschlag K, Schubert CJ, Rickert D, Widdel F, Gieseke A, Amann R, Jørgensen BB, Witte U, Pfannkuche O. A marine microbial consortium apparently mediating anaerobic oxidation of methane. Nature, 2000, 407(6804): 623-626. DOI:10.1038/35036572 |
| [43] | Bange HW, Bartell UH, Rapsomanikis S, Andreae MO. Methane in the Baltic and North seas and a reassessment of the marine emissions of methane. Global Biogeochemical Cycles, 1994, 8(4): 465-480. DOI:10.1029/94GB02181 |
| [44] | Abril G, Borges AV. Carbon dioxide and methane emissions from estuaries//Tremblay A, Varfalvy L, Roehm C, Garneau M. Greenhouse Gas Emissions-Fluxes and Processes. Berlin: Springer, 2005. |
| [45] | Reeburgh WS. Oceanic methane biogeochemistry. Chemical Reviews, 2007, 107(2): 486-513. DOI:10.1021/cr050362v |
| [46] | Karl DM, Beversdorf L, Björkman KM, Church MJ, Martinez A, Delong EF. Aerobic production of methane in the sea. Nature Geoscience, 2008, 1(7): 473-478. DOI:10.1038/ngeo234 |
| [47] | Repeta DJ, Ferrón S, Sosa OA, Johnson CG, Repeta LD, Acker M, DeLong EF, Karl DM. Marine methane paradox explained by bacterial degradation of dissolved organic matter. Nature Geoscience, 2016, 9(12): 884-887. DOI:10.1038/ngeo2837 |
| [48] | Damm E, Helmke E, Thoms S, Schauer U, Nöthig E, Bakker K, Kiene RP. Methane production in aerobic oligotrophic surface water in the central Arctic Ocean. Biogeosciences, 2010, 7(3): 1099-1108. DOI:10.5194/bg-7-1099-2010 |
| [49] | Kitidis V, Upstill-Goddard RC, Anderson LG. Methane and nitrous oxide in surface water along the north-west passage, Arctic Ocean. Marine Chemistry, 2010, 121(1/4): 80-86. |
| [50] | Maslanik JA, Fowler C, Stroeve J, Drobot S, Zwally J, Yi D, Emery W. A younger, thinner Arctic ice cover:increased potential for rapid, extensive sea-ice loss. Geophysical Research Letters, 2007, 34(24): L24501. DOI:10.1029/2007GL032043 |
| [51] | Loose B, McGillis WR, Perovich D, Zappa CJ, Schlosser P. A parameter model of gas exchange for the seasonal sea ice zone. Ocean Science, 2014, 10(1): 17-28. DOI:10.5194/os-10-17-2014 |
| [52] | Vonk JE, Sánchez-García L, van Dongen BE, Alling V, Kosmach D, Charkin A, Semiletov IP, Dudarev OV, Shakhova N, Roos P, Eglinton TI, Andersson A, Gustafsson Ö. Activation of old carbon by erosion of coastal and subsea permafrost in Arctic Siberia. Nature, 2012, 489(7414): 137-140. DOI:10.1038/nature11392 |
| [53] | Borges AV, Champenois W, Gypens N, Delille B, Harlay J. Massive marine methane emissions from near-shore shallow coastal areas. Scientific Reports, 2016, 6: 27908. DOI:10.1038/srep27908 |
| [54] | Conrad R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments. FEMS Microbiology Ecology, 1999, 28(3): 193-202. DOI:10.1111/j.1574-6941.1999.tb00575.x |
| [55] | Glissman K, Chin KJ, Casper P, Conrad R. Methanogenic pathway and archaeal community structure in the sediment of eutrophic lake dagow:effect of temperature. Microbial Ecology, 2004, 48(3): 389-399. DOI:10.1007/s00248-003-2027-2 |
| [56] | Dolfing J. Thermodynamic constraints on syntrophic acetate oxidation. Applied and Environmental Microbiology, 2014, 80(4): 1539-1541. DOI:10.1128/AEM.03312-13 |
| [57] | Rui JP, Qiu QF, Lu YH. Syntrophic acetate oxidation under thermophilic methanogenic condition in Chinese paddy field soil. FEMS Microbiology Ecology, 2011, 77(2): 264-273. DOI:10.1111/j.1574-6941.2011.01104.x |
| [58] | Liu PF, Klose M, Conrad R. Temperature effects on structure and function of the methanogenic microbial communities in two paddy soils and one desert soil. Soil Biology and Biochemistry, 2018, 124: 236-244. DOI:10.1016/j.soilbio.2018.06.024 |
| [59] | Deng YC, Liu PF, Conrad R. Effect of temperature on the microbial community responsible for methane production in alkaline NamCo wetland soil. Soil Biology and Biochemistry, 2019, 132: 69-79. DOI:10.1016/j.soilbio.2019.01.024 |
| [60] |
Cheng L, Zhang ZZ, Wang C, Zhang H. Recent advances in methanogens. Microbiology China, 2016, 43(5): 1143-1164.
(in Chinese) 承磊, 郑珍珍, 王聪, 张辉. 产甲烷古菌研究进展. 微生物学通报, 2016, 43(5): 1143-1164. |
| [61] |
Duan CH, Zhang CJ, Sun YH, Li M. Recent advances on the novel methanogens. Acta Microbiologica Sinica, 2019, 59(6): 981-995.
(in Chinese) 段昌海, 张翠景, 孙艺华, 李猛. 新型产甲烷古菌研究进展. 微生物学报, 2019, 59(9): 981-995. |
| [62] | Fuchs A, Lyautey E, Montuelle B, Casper P. Effects of increasing temperatures on methane concentrations and methanogenesis during experimental incubation of sediments from oligotrophic and mesotrophic lakes. Journal of Geophysical Research, 2016, 121(5): 1394-1406. |
| [63] | Duc NT, Crill P, Bastviken D. Implications of temperature and sediment characteristics on methane formation and oxidation in lake sediments. Biogeochemistry, 2010, 100(1/3): 185-196. |
| [64] | Shelley F, Abdullahi F, Grey J, Trimmer M. Microbial methane cycling in the bed of a chalk river:oxidation has the potential to match methanogenesis enhanced by warming. Freshwater Biology, 2015, 60(1): 150-160. DOI:10.1111/fwb.12480 |
| [65] | Peltoniemi K, Laiho R, Juottonen H, Bodrossy L, Kell DK, Minkkinen K, Mäkiranta P, Mehtätalo L, Penttilä T, Siljanen HMP, Tuittila ES, Tuomivirta T, Fritze H. Responses of methanogenic and methanotrophic communities to warming in varying moisture regimes of two boreal fens. Soil Biology and Biochemistry, 2016, 97: 144-156. DOI:10.1016/j.soilbio.2016.03.007 |
| [66] | Turetsky MR, Treat CC, Waldrop MP, Waddington JM, Harden JW, McGuire AD. Short-term response of methane fluxes and methanogen activity to water table and soil warming manipulations in an Alaskan peatland. Journal of Geophysical Research, 2008, 113(G3): G00A10. |
| [67] | Munir TM, Strack M. Methane flux influenced by experimental water table drawdown and soil warming in a dry boreal continental bog. Ecosystems, 2014, 17(7): 1271-1285. DOI:10.1007/s10021-014-9795-z |
| [68] | White JR, Shannon RD, Weltzin JF, Pastor J, Bridgham SD. Effects of soil warming and drying on methane cycling in a northern peatland mesocosm. Journal of Geophysical Research, 2008, 113(G3): G00A06. |
| [69] | Joabsson A, Christensen TR, Wallén B. Vascular plant controls on methane emissions from northern peatforming wetlands. Trends in Ecology & Evolution, 1999, 14(10): 385-388. |
| [70] | Inglett KS, Inglett PW, Reddy KR, Osborne TZ. Temperature sensitivity of greenhouse gas production in wetland soils of different vegetation. Biogeochemistry, 2012, 108(1/3): 77-90. |
| [71] | Hines ME, Duddleston KN, Rooney-Varga JN, Fields D, Chanton JP. Uncoupling of acetate degradation from methane formation in Alaskan wetlands:connections to vegetation distribution. Global Biogeochemical Cycles, 2008, 22(2): GB2017. |
| [72] | Cui MM, Ma AZ, Qi HY, Zhuang XL, Zhuang GQ, Zhao GH. Warmer temperature accelerates methane emissions from the Zoige wetland on the Tibetan Plateau without changing methanogenic community composition. Scientific Reports, 2015, 5: 11616. DOI:10.1038/srep11616 |
| [73] | Moss B, Kosten S, Meerhoff M, Battarbee RW, Jeppesen E, Mazzeo N, Havens K, Lacerot G, Liu ZW, De Meester L, Paerl H, Scheffer M. Allied attack:climate change and eutrophication. Inland Waters, 2011, 1(2): 101-105. DOI:10.5268/IW-1.2.359 |
| [74] | Schilder J, van Hardenbroek M, Bodelier P, Kirilova EP, Leuenberger M, Lotter AF, Heiri O. Trophic state changes can affect the importance of methane-derived carbon in aquatic food webs. Proceedings of the Royal Society B: Biological Sciences, 2017, 284(1857): 20170278. DOI:10.1098/rspb.2017.0278 |
| [75] | Chowdhury TR, Dick RP. Ecology of aerobic methanotrophs in controlling methane fluxes from wetlands. Applied Soil Ecology, 2013, 65: 8-22. DOI:10.1016/j.apsoil.2012.12.014 |
| [76] | Sepulveda-Jauregui A, Hoyos-Santillan J, Martinez-Cruz K, Anthony KMW, Casper P, Belmonte-Izquierdo Y, Thalasso F. Eutrophication exacerbates the impact of climate warming on lake methane emission. Science of the Total Environment, 2018, 636: 411-419. DOI:10.1016/j.scitotenv.2018.04.283 |
| [77] | Sihi D, Inglett PW, Inglett KS. Carbon quality and nutrient status drive the temperature sensitivity of organic matter decomposition in subtropical peat soils. Biogeochemistry, 2016, 131(1/2): 103-119. |
| [78] | Jeppesen E, Moss B, Bennion H, Carvalho L, DeMeester L, Feuchtmayr H, Friberg N, Gessner MO, Hefting M, Lauridsen TL, Liboriussen L, Malmquist HJ, May L, Meerhoff M, Olafsson JS, Soons MB, Verhoeven JTA. Interaction of climate change and eutrophication//Kernan M, Battarbee RW, Moss B. Climate Change Impacts on Freshwater Ecosystems. Brian Moss. Oxford: Blackwell Publishing Ltd, 2010. |
| [79] | Jeppesen E, Kronvang B, Olesen JE, Audet J, Søndergaard M, Hoffmann CC, Andersen HE, Lauridsen TL, Liboriussen L, Larsen SE, Beklioglu M, Meerhoff M, Özen A, Özkan K. Climate change effects on nitrogen loading from cultivated catchments in Europe:implications for nitrogen retention, ecological state of lakes and adaptation. Hydrobiologia, 2011, 663(1): 1-21. DOI:10.1007/s10750-010-0547-6 |
 2020, Vol. 60
2020, Vol. 60