中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 赵卫松, 郭庆港, 于稳欠, 王培培, 苏振贺, 张晓云, 鹿秀云, 马平, 李社增. 2020
- Zhao Weisong, Guo Qinggang, Yu Wenqian, Wang Peipei, Su Zhenhe, Zhang Xiaoyun, Lu Xiuyun, Ma Ping, Li Shezeng. 2020
- 解淀粉芽胞杆菌PHODB35的溶磷特性及其对番茄的促生作用
- Phosphate-solubilizing characteristics of Bacillus amyloliquefaciens PHODB35 and its growth-promoting effect on tomato
- 微生物学报, 60(7): 1370-1383
- Acta Microbiologica Sinica, 60(7): 1370-1383
-
文章历史
- 收稿日期:2019-08-24
- 修回日期:2020-02-11
- 网络出版日期:2020-04-08
磷是植物生长中不可缺少的大量元素之一,土壤缺少磷素造成作物产量受到影响[1]。已有研究表明小麦缺磷时会出现推迟分蘖时间、减少穗粒数目、籽粒干瘪等现象[2]。尽管土壤中全磷含量比较充足,但能够被植物直接吸收利用的有效磷含量小于全磷量的5%[3-4],主要原因在于其易与Ca2+、Al3+等金属离子结合形成难溶性磷酸盐,且常被看作是限制性营养元素[5]。目前,许多国家通过使用大量磷肥确保作物增产,间接导致了磷矿资源的消费量逐年增加[6],不仅增加了农业成本,而且可能造成严重的生态环境问题[7-8]。部分学者认为按照现有的年开采消费速度,我国的磷矿资源使用年限将严重不足[9-10]。因此,如何提高土壤中磷肥的利用效率是保证农业可持续发展的重要方面,有待进一步找到经济、安全和有效的方法,以减少对环境造成的危害和降低农业成本。
微生物在植物生长方面具有重要作用,有针对性地筛选对作物具有促生或肥效功能的有益微生物,为减少化肥的使用提供了重要思路,被认为是一种环境友好和经济有效的方法[11]。已有研究表明,解磷微生物对磷养分的循环和植物生长具有重要作用,主要表现为能够提高土壤中可溶性磷含量和增加作物产量[12-13]。目前,国内外科研工作者开展了大量筛选溶磷菌株及其相关的工作,研究指出溶磷菌的溶磷或解磷过程极为复杂,其可能的解磷机制主要包括有机酸酸解作用、酶解作用和释放H+等,且不同菌株间存在区别[14-15]。然而植物促生菌对植物有一定的种属专一性和生境选择性,针对我国不同气候、生境中分离筛选植物促生菌株,以生产适应不同地区和作物的生物菌剂及其生物有机肥是有必要的,同时在大力倡导减肥减药的国家战略背景下,迫切需要解决生产上土壤中磷肥的利用率这一问题。
本研究从河北省保定市容城县容城镇东牛东庄村番茄大棚中采集的土壤中分离筛选出解磷能力较高的细菌菌株PHODB35,通过形态学和分子生物学水平对其进行鉴定,并对该菌株在不同环境因子和营养因子下的溶磷能力(温度、pH、接种量、不同碳源、氮源、磷源)以及该菌株产生的有机酸进行分析,探索菌株PHODB35对土壤中难溶性磷的解磷能力及其对番茄的促生长作用,结果为研制微生物菌肥提供资源,为进一步开展田间应用奠定基础。
1 材料和方法 1.1 土壤样品2015年从河北省保定市容城县容城镇东牛东庄番茄大棚中利用取土器收集5-10 cm的土壤,置于无菌封口袋中混匀。土样带回实验室后,去除根系、石块等杂物,4 ℃保存备用。
1.2 供试培养基、营养液和番茄品种解无机磷培养基(NBRIP,g/L):葡萄糖10,磷酸钙5,MgCl2·6H2O 5,MgSO4·7H2O 0.25,KCl 0.2,(NH4)2SO4 0.1,pH 7.0;用于解磷微生物菌株的分离和筛选。LB培养基(g/L):蛋白胨10,酵母5,NaCl 5,调节pH值在7.0-7.2;用于菌株的纯化和种子液培养。上述培养基添加1.5%的琼脂即得到相应的固体培养基,在湿热灭菌锅121 ℃高压灭菌30 min备用。
参考赵卫松等[16]方法准备完全营养液和缺磷营养液、培养基质,用于番茄的温室盆栽试验。番茄品种:荷兰8号,购于河北省定兴县华农蔬菜专业合作社,选择长势均匀一致的幼苗开展试验。
1.3 解磷微生物的分离与筛选 初筛:采用溶磷平板法。称取1.0 g土壤样品加入到装有灭菌玻璃珠的三角瓶中,加入99 mL的无菌水,在30 ℃、180 r/min充分振荡45 min后,采用梯度稀释法进行稀释,分别取10-3-10-5的稀释液100 μL,涂布接种于NBRIP培养基平板上,倒置于培养箱中30 ℃培养7 d。用灭菌牙签挑取能够产生透明圈的单菌落,测量透明圈直径(D)和菌落生长直径(d),并计算解磷比(透明圈直径和菌落生长直径的比值,即D/d)。
1.3.2 复筛:选取解磷比高的单菌落进一步转接至LB培养基平板上活化培养。将活化培养的单菌落接种于液体LB培养基中,30 ℃、180 r/min培养48 h,将发酵液在12000 r/min离心10 min,菌体用无菌水洗涤2次,并用无菌水制备成菌悬液,调节菌量OD600=1.0。取5 mL菌悬液接种于装有100 mL NBRIP液体培养基的250 mL三角瓶中,培养10 d后,采用钼锑抗比色法测定发酵液中的可溶性磷浓度[17],通过公式(1)计算菌株PHODB35的解磷率[18]。最终筛选到1株具有较高解无机磷能力的菌株,并命名为PHODB35。
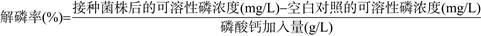
|
公式(1) |
将分离菌划线接种于LB平板上,30 ℃培养,观察菌落形态特征。个体形态:通过显微镜观察菌株PHODB35菌体的形状。
1.4.2 分子生物学鉴定:将保存的菌株PHODB35转接到LB培养液中,30 ℃、180 r/min下恒温振荡过夜培养。采用CTAB法提取菌株PHODB35的DNA作为16S rRNA基因扩增的模板。以27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)为引物[19]进行PCR扩增。PCR反应体系如下(25 μL):2×Taq Master Mix(含Mg2+) 12.5 μL,引物(10 μmol/L)各1 μL,模板DNA 1 μL,dd H2O补足至25 μL。PCR反应程序:95 ℃ 5 min;94 ℃ 1 min,54 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 5 min。将PCR产物进行凝胶电泳检测。同时,以菌株PHODB35菌株基因组DNA为模板,以芽胞杆菌gyrB基因兼并引物[20] (gyrB-F:5′-GAAGCACGGACAATCACC-3′;gyrB-R:5′-TCCAAAGCACTCTTACGG-3′)进行PCR扩增,PCR反应体系如下(25 μL):2×Taq Master Mix(含Mg2+) 12.5 μL,引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O补足至25 μL。PCR反应程序:95 ℃ 5 min,94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃10 min。将PCR产物进行凝胶电泳检测。将获得的16S rRNA和gyrB基因扩增产物并送上海生物工程有限公司测序,分别将不同基因测序结果与GenBank数据库中的相应基因序列进行比较,利用MEGA 5.1软件进行Clustal W多重序列比对,并采用Kimura 2-parameter模式和Neighbor-joining算法构建系统发育树。
1.5 不同环境因子对菌株PHODB35溶磷能力的影响挑取菌株PHODB35的单菌落接种于液体LB培养基中,30 ℃、180 r/min培养48 h,将发酵液在12000 r/min离心10 min,菌体用无菌水洗涤2次,并用无菌水重悬,调节菌量OD600=1.0,作为后续实验的种子液。采用正交实验设计对接种量(1%、5%和10%)、温度(25 ℃、30 ℃和35 ℃)、pH (6.0、7.0和8.0)进行优化,培养10 d后,按照1.3方法测定发酵液中的可溶性磷浓度。
1.6 不同营养因子对菌株PHODB35溶磷能力的影响在上述1.5明确最佳接种量、温度和pH条件的基础上,利用单因素试验设计在NBRIP培养液中将相应营养因子用等量的碳源、氮源和磷源进行替换,培养10 d后,按照1.3方法测定发酵液中的可溶性磷浓度。系统地评价了不同碳源(葡萄糖、蔗糖、麦芽糖和甘露糖)、氮源(硫酸铵、氯化铵、硝酸铵、硝酸钠、硝酸钾)和磷源(磷酸钙、磷酸铝)对菌株PHODB35溶磷能力的影响。
1.7 PHODB35菌株溶磷过程中产生的有机酸分析 1.7.1 菌株产生有机酸的定性分析:将6 mg的溴甲酚紫加入到100 mL灭菌的解无机磷培养基(NBRIP)中,混匀,制成固体平板。用灭菌的牙签挑取在LB平板上活化的PHODB35菌株,接种到平板上,30 ℃培养7 d。观察平板颜色是否发生变化,当产生有机酸时,平板将由紫色变成黄色[21]。初步明确菌株是否能够产生有机酸。
1.7.2 菌株产生有机酸的定量分析:将种子液按照5%的接种量接种于NBRIP培养液中,30 ℃、180 r/min振荡培养,以未接种种子液的处理为空白对照,在培养的不同时间(0、2、4、6、8和10 d)取2 mL样品于离心管中,在12000 r/min离心5 min,过0.22 μm滤膜于进样小瓶中,-20 ℃保存待测。
仪器方法:采用高效液相色谱-质谱联用仪(HPLC-MS)测定PHODB35菌株解磷过程中的有机酸。质谱部分:ESI离子源,脱溶剂温度350 ℃,离子源温度150 ℃,电压:3.0 kV,正、负离子模式,扫描范围:50-600 m/z。流动相组成为:磷酸氢二铵-磷酸缓冲液(0.01 mol/L,pH=2.7),波长210 nm,流速0.2 mL/min,进样量:1 μL。
1.8 盆栽实验通过温室盆栽培养基质中添加磷酸三钙开展试验,评价菌株PHODB35对土壤中难溶性磷酸盐的溶磷能力。花盆(高:21 cm、盆口直径:22 cm、盆底直径:15 cm)装入培养基质(4 kg/盆),选取长势一致的番茄幼苗移栽于花盆中,每盆3株。参考赵卫松等[16]方法稍作修改,试验设置4个处理,CK1:在培养基质中直接移栽番茄幼苗;CK2:在培养基质中加入磷酸三钙混匀后(培养基质与磷酸三钙质量比为1000︰1)移栽番茄幼苗,并浇施300 mL缺磷营养液;CK3:在培养基质中移栽番茄幼苗,并浇施300 mL完全营养液;T:在培养基质中加入磷酸三钙混匀后移栽番茄幼苗,并浇施菌株PHODB35发酵液300 mL (浓度为108 CFU/mL)。每个处理3次重复,每次重复处理1盆,每盆含有3株番茄苗。置于温室中培养,期间加强作物病虫害管理,为了保证水分,每间隔5 d浇施1次,除处理CK1和CK2浇施LB培养液外,处理CK3和T分别浇施完全营养液和缺磷营养液,40 d后测定番茄的株高、地上部鲜重和干重、地下部鲜重和干重,采用碳酸氢钠提取-钼锑抗比色法测定培养基质中的有效磷含量[17],并参照陈浩等[22]的方法对番茄植株中的有效磷含量进行分析。
1.9 数据处理采用SPSS 17.0软件对不同处理组之间用单因素方差分析中的邓肯新复极差(Duncan’s)检验和独立样本T检验对试验数据进行统计分析,利用SigmaPlot 12.0软件进行作图。
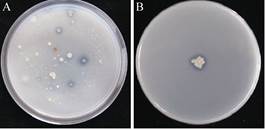
2 结果和分析 2.1 菌株PHODB35的筛选与鉴定采用梯度稀释涂布法并结合溶磷平板法从供试土样样品中筛选到许多株具有明显透明圈的菌株(图 1-A),选择透明圈大的菌落进行分离纯化,命名为PHODB35,其解磷比为1.5 (图 1-B)。形态特征观察表明,菌株PHODB35在LB培养基上培养,菌体为杆状,培养10 h后产生芽胞,芽胞中生,椭圆形,胞囊不膨大,培养初期菌落淡乳白色,脓状,圆形,边缘整齐,菌落隆起,表面湿润;培养后期菌落淡黄色,边缘不整齐,表面干燥有褶皱,初步判断菌株PHODB35为芽胞杆菌属(Bacillus sp.)。
|
| 图 1 解磷菌株筛选 Figure 1 Screening of phosphorus-dissolving bacteria. |
菌株PHODB35的16S rRNA基因序列长度为1458 bp (GenBank序列号为KY785375.1)。将该菌株的16S rRNA基因序列与其他菌株16S rRNA基因的同源性比较并建立系统发育树(图 2-A),结果表明,菌株PHODB35的16S rRNA序列与芽胞杆菌属菌株的同源性最高,进一步将该菌株的gyrB基因序列与其他菌株gyrB基因的同源性比较并建立系统发育树(图 2-B)。基于聚类结果,确定菌株PHODB35与解淀粉芽胞杆菌同源性最高,亲缘关系最近。综合以上形态特征、16S rRNA和gyrB基因序列同源性比对分析的结果,菌株PHODB35鉴定为解淀粉芽胞杆菌(Bacillus amyloliquefaciens)。

|
| 图 2 菌株PHODB35不同基因序列与其他菌株的系统发育树的建立 Figure 2 Establishment of phylogenetic tree of different gene sequences of strain PHODB35 and other strains. A: The 16S rRNA gene phylogenetic tree of strain PHODB35. Numbers in parentheses represent accession number of the sequences in GenBank; Bootstrap values are shown at branching points (expressed as percentages of 1000 replications). |
2.2 不同因子对PHODB35菌株的溶磷效果影响 2.2.1 环境因子的影响:
通过单因素试验,初步明确pH、接种浓度和温度影响菌株PHODB35溶磷能力的范围。本研究进一步利用正交设计对溶磷环境因子进行了优化。研究结果表明,获得的最佳条件为pH 7.0,温度为30 ℃,接种量为5%。获得了上述三因素对溶磷效果影响的模型公式(2)。
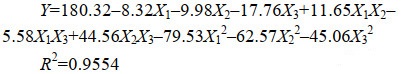
|
公式(2) |
其中,校正R2=0.8980。
进一步的方差分析表明,本研究获得的模型P < 0.0001,存在极显著水平,产生噪音的可能性仅有0.06%,说明该模型可用。该方程的决定系数R2=0.9554,表明理论值与实际值之间的相关性较高,校正决定系数Adj R2=0.8990,表明该模型能解释90%响应值的变化(图 3)。
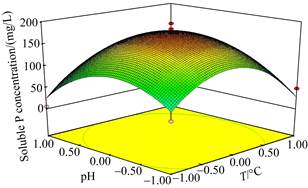
|
| 图 3 菌株PHODB35溶磷条件的优化 Figure 3 Optimization of phosphorus solution conditions of strain PHODB35 by orthogonal test. Green to red represents the concentration of soluble phosphorus from low to high. |
2.2.2 不同营养物质对菌株PHODB35溶磷能力的影响:
为了进一步优化菌株PHODB35的溶磷能力,在不同碳源(葡萄糖、蔗糖、麦芽糖和甘露糖)、氮源(硫酸铵、氯化铵、硝酸钠、硝酸铵和硝酸钾)、磷源(磷酸钙和磷酸铝)条件下进行了研究。
不同氮源对菌株PHODB35溶磷能力的影响(图 4-A):当NBRIP培养液中的氮源为硫酸铵时,接种菌株PHODB35后,发酵液中的可溶性磷浓度为88.77 mg/L,解磷率为3.86%;然而将硫酸铵分别用相同质量的氯化铵、硝酸铵、硝酸钠和硝酸钾替换后,发酵液中的可溶性磷浓度分别为3.61、2.32、6.29、7.00 mg/L,解磷率分别为0.14%、0.08%、0.25%和0.28%。显著性差异分析结果表明,当氮源为硫酸铵时,与其他氮源物质在解磷能力之间存在显著性差异。

|
| 图 4 不同营养物质下菌株PHODB35的溶磷能力 Figure 4 Phosphorus solubilizing capability of strain PHODB35 under different nutrients. A: nitrogen source; B: carbon source; C: phosphorus source. Different lowercase letters represent significant difference according to Duncan's multiple range test at 0.05 level. |
不同碳源对菌株PHODB35解磷能力的影响(图 4-B):当NBRIP培养液中的碳源为葡萄糖时,接种菌株PHODB35后,发酵液中的有效磷浓度为88.77 mg/L,解磷率为3.86%;然而将葡萄糖分别用相同质量的蔗糖、麦芽糖和甘露糖替换后,发酵液中的有效磷浓度分别为2.65、1.60、4.99 mg/L,解磷率分别为0.09%、0.05%和0.20%。显著性差异分析结果表明,当碳源为葡萄糖时,与其他碳源物质在解磷能力之间存在显著性差异。
同时,比较了磷酸钙和磷酸铝两种磷源物质对菌株PHODB35溶磷能力的影响(图 4-C),研究结果表明,当磷源为磷酸铝时,发酵液中的可溶性磷浓度为25.06 mg/L,解磷率仅为1.07%。显著性差异分析表明,两种磷源之间对菌株的溶磷能力存在显著性差异。
2.3 菌株PHODB35产生的有机酸分析平板试验结果表明,菌株PHODB35接种后平板由紫色变成黄色,初步说明能够产生有机酸。进一步利用HPLC结合相应有机酸的标准物质,研究结果表明,含有菌株PHODB35处理的发酵液中产生的有机酸主要为葡萄糖酸(图 5),然而在空白对照的处理中也能够产生有机酸,分析其主要原因是在NBRIP培养液中的葡萄糖经高温灭菌后推测通过氧化反应可能产生了葡萄糖酸。接种菌株PHODB35后产生的有机酸含量显著高于对照。接种菌株PHODB35培养2-10 d后,葡萄糖酸含量增加幅度分别为84.08%、74.23%、69.46%、77.35%和117.70%,而空白对照处理的葡萄糖酸含量显著低于接种菌株PHODB35处理。

|
| 图 5 不同处理的葡萄糖酸含量变化 Figure 5 Changes of gluconic acid content in different treatments. Different lower-case letters showed significant difference according to independent sample test at 0.05 level. |
2.4 盆栽实验 2.4.1 菌株PHODB35对番茄株高、鲜重、干重的影响:
试验结果表明(表 1),添加菌株PHODB35培养液的试验组效果除根鲜重与CK3处理差异显著外,其他指标不存在差异;而与CK2处理相比,添加菌株PHODB35培养液的试验组的株高、地上鲜重、地下鲜重、地上部干重和地下部干重增幅分别为28.5%、22.6%、113.1%、36.8%和28.2%。综合株高、鲜重、干重形态指标,菌株PHODB35对番茄植株具有一定的促生效果。
| Treatment | Plant height/cm | Fresh weight/g | Dry weight/g | ||
| Top plant | Root | Top plant | Root | ||
| CK1 | 26.56±2.22a | 14.06±4.55 a | 3.00±0.87 a | 1.46±0.50 a | 0.29±0.09 a |
| CK2 | 32.33±4.93ab | 21.16±7.08 ab | 3.14±1.17 a | 1.63±0.28 ab | 0.39±0.14 a |
| CK3 | 40.86±4.90 b | 25.09±4.61 b | 3.33±1.27 a | 1.70±0.56 ab | 0.42±0.19 a |
| PHODB35 (T) | 41.45±3.85 b | 25.94±6.50 b | 6.69±1.37 b | 2.23±0.66 ab | 0.50±0.12 a |
| CK1: LB; CK2: Ca3(PO4)2+phosphorus-deficient nutrient solution+LB; CK3: complete nutrient solution. Data followed by the same letters in the same column are not significantly difference according to Duncan’s multiple range test at 0.05 level. The same as below. | |||||
2.4.2 菌株PHODB35对盆栽基质和植物组织中磷含量的影响:
试验结果表明(表 2),菌株PHODB35与对照CK2相比,培养基质的有效磷含量增幅为82.1%,说明菌株具有明显的解磷活性,对土壤中难溶性磷酸钙具有一定的溶磷效果,能够提高土壤有效磷含量。在番茄植株磷方面,而PHODB35处理与CK2相比,增长率为16.2%。
| Treatment | Phosphate content in the substrate/(mg/kg) | Compared with CK2 | Phosphate content in tomato plant/(mg/L) | Compared with CK2 |
| CK1 | 0.84±0.12 a | - | 0.62±0.08 a | - |
| CK2 | 1.06±0.06 a | - | 1.97±0.11 b | - |
| CK3 | 2.28±0.21 b | - | 2.99±0.16 c | - |
| PHODB35 | 1.93±0.25 b | 82.1% | 2.29±0.05 b | 16.2% |
3 讨论
磷是促进作物生长和提高农业产量不可缺少的营养元素。已有研究表明,溶磷微生物能够提高土壤有效磷含量[22-23]、增加作物对磷素吸收和减少磷肥使用量[23-25]、促进磷矿资源的生物有效性[26],最终实现促进作物生长和提高作物产量的目的[27-28]。
解淀粉芽胞杆菌是一类重要的植物促生细菌,不仅表现出优良的生防作用,而且对作物生长有促生作用[29]。利用平板筛选解磷微生物过程中,由于长出的菌落较多且相互之间可能存在营养竞争关系,导致许多菌株的溶磷能力可能受到抑制,菌株是否产生溶磷圈以及溶磷圈大小与溶磷能力之间是否存在相关性观点不一致,如部分学者研究表明,溶磷圈的大小不能代表其溶磷能力的大小[30-33],因此,必须对其溶磷能力进行验证测定。本研究筛选到1株解磷效果较好的菌株PHODB35,该菌株在碳源为葡萄糖、氮源为硫酸铵、磷源为磷酸钙、初始pH值为7.0、温度为30 ℃时,解磷效果最好。进一步通过盆栽试验研究表明,添加该菌株的发酵液不仅显著增加了番茄株高、植株生物量,同时也显著提高了培养基质和植株体内有效磷含量。
已有研究表明,环境和营养因子对溶磷细菌的溶磷效果影响较大。本研究获得的菌株最适碳源是葡萄糖,与闫小梅等[34]和贺梦醒等[35]的研究结果相似;最适氮源是硫酸铵,与刘文干等[19]和闫小梅等[34]的结果相似;Jain等[36]研究结果表明,多数溶磷菌株对磷酸三钙的溶解能力高于磷酸铝和磷矿粉,本研究获得了相似的研究结果,且菌株PHODB35对磷酸三钙的溶磷能力高于磷酸铝。该菌株的最适pH与刘文干等[19]、闫小梅等[34]、贺梦醒等[35]的菌株最适pH值有所不同,进一步表明可能与筛选的菌株种类有关。
在解磷微生物的促生研究中,菌株的实际应用效果如何是评价促生作用的重要指标,决定其是否具备开发成微生物肥料或菌剂的潜力。Paungfoo-Lonhienne等[37]研究结果表明,分离到的伯克氏菌属(Burkholderia)菌株能够显著增加甘蔗根和茎的生物量;Zhao等[38]研究表明通过接种促生菌芽孢杆菌属(Bacillus和Paenibacillus)菌株能够使金银花鲜质量增加16.48%;崔晓双等[29]研究得出接种促生菌芽孢杆菌属(Bacillus)、剑菌属(Ensifer)、根瘤菌属(Rhizobium)、苍白杆菌属(Ochrobactrum)和微杆菌属(Microbacterium)后均能够使玉米、黄瓜和茄子的地上鲜重增加明显,且与空白对照之间存在显著性差异。谭石勇等[39]获得的促生菌株伯克霍德菌属(Burkholderia)能显著提高苎麻种子的萌发率、幼根长、株高和根系干重;秦娟娟等[40]研制的促生菌剂与对照组相比对辣椒植株的株高、根长、鲜重和干重均差异显著;本研究采用盆栽试验对筛选获得的菌株PHODB35进行促生效应的检验,结果表明其能够显著提高番茄植株的株高、鲜重和干重,同时能够显著提高培养基质和植株体内有效磷的含量。
解磷微生物的解磷机制较为复杂,溶磷微生物能够分泌产生许多的有机酸,并且培养条件决定产生的有机酸种类,同时不同溶磷微生物产生的有机酸可能存在区别[14-15, 41]。部分学者认为,解磷微生物能够溶解无机磷化合物,如磷酸钙,其机理是借助细菌生命活动过程中所产生的各种有机酸[42-44],还有学者认为解磷微生物的解磷机制为其产生质子降低了培养基的pH,从而使磷酸盐溶解[45]。本实验明确了菌株PHODB35产生的有机酸主要为葡萄糖酸,获得的有机酸种类与刘文干等[19]和乔志伟等[46]的观点一致,未检测到其他有机酸,是否有其他有机酸的产生还有待于进一步验证和研究。
本研究从番茄根围筛选得到解淀粉芽胞杆菌PHODB35能显著促进番茄的生长。但本研究仅对菌株的溶磷特性和促生作用进行了初步探讨,至于菌株的内在促生机制还有待进一步深入研究。此外,本研究在盆栽试验条件下开展了溶磷微生物对土壤中有效磷的试验,然而微生物菌剂受降水量、温度、土壤pH、土壤微生物等因素影响。在后续试验中,需在大田条件下对菌株PHODB35的促生效果进行研究和验证,为其开发成良好的农用微生物菌剂奠定基础。同时,向土壤中添加外源解磷微生物势必与土壤中原有的微生物群落产生互相作用,可能对土壤微生物群落结构产生一定影响。乔欢等[47]报道解磷青霉(Penicillium guanacastense JP-NJ2)和(P. pinophilum JP-NJ4)的施用明显改变了根际微生物群落中细菌、真菌及放线菌数量,微生物总量也随之变化。因此,该微生物菌剂施用后对土壤根际及其根围微生物的相互关系有待于进一步研究。
| [1] |
Zhang JJ, Li JG, Guo YP, Han C, Qin YT. Screening and identification of phosphate-solubilizing bacteria in rhizosphere soil of Xinjiang walnut. Nonwood Forest Research, 2015, 33(2): 57-62.
(in Chinese) 张晶晶, 李建贵, 郭艺鹏, 韩超, 秦韵婷. 新疆核桃根际土壤中解磷菌的分离筛选及鉴定. 经济林研究, 2015, 33(2): 57-62. |
| [2] |
Xu RJ, Wu SM, Wu Z, Zuo LJ, Zhang S. A strain of Bacillus amyloliquefaciens and its application. CN: 201210364081.4. 2013-01-16. 许仁杰, 伍树明, 伍洲, 左丽娟, 张思.一株解淀粉芽孢杆菌及其应用.中国: 201210364081.4. 2013-01-16. |
| [3] | Pastor N, Rosas S, Luna V, Rovera M. Inoculation with Pseudomonas putida PCI2, a phosphate solubilizing rhizobacterium, stimulates the growth of tomato plants. Symbiosis, 2014, 62(2): 157-167. |
| [4] | Richardson AE, Barea JM, McNeill AM, Prigent-Combaret C. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms. Plant and Soil, 2009, 321(1): 305-333. |
| [5] | Walpola BC, Yoon MH. Isolation and characterization of phosphate solubilizing bacteria and their co-inoculation efficiency on tomato plant growth and phosphorous uptake. African Journal of Microbiology Research, 2013, 7(3): 226-275. DOI:10.5897/AJMR12.2282 |
| [6] | Erisman JW, Bleeker A, Hensen A, Vermeulen A. Agricultural air quality in Europe and the future perspectives. Atmospheric Environment, 2008, 42(14): 3209-3217. DOI:10.1016/j.atmosenv.2007.04.004 |
| [7] | Saravanakumar K, Arasu VS, Kathiresan K. Effect of Trichoderma on soil phosphate solubilization and growth improvement of Avicennia marina. Aquatic Botany, 2013, 104: 101-105. DOI:10.1016/j.aquabot.2012.09.001 |
| [8] | Zhao K, Penttinen P, Zhang XP, Ao XL, Liu MK, Yu XM, Chen Q. Maize rhizosphere in Sichuan, China, hosts plant growth promoting Burkholderia cepacia with phosphate solubilizing and antifungal abilities. Microbiological Research, 2014, 169(1): 76-82. DOI:10.1016/j.micres.2013.07.003 |
| [9] |
Wu PF, Zhang DM, Hao LH, Qi ZP. Status quo and prospects of phosphate-soluble microorganisms. Journal of Agricultural Science and Technology, 2008, 10(3): 40-46.
(in Chinese) 吴鹏飞, 张冬明, 郝丽虹, 漆智平. 解磷微生物研究现状及展望. 中国农业科技导报, 2008, 10(3): 40-46. DOI:10.3969/j.issn.1008-0864.2008.03.007 |
| [10] |
Jiang HM, Yin ZW, Shi FC, Liu CY, Fan BQ. Isolation, identification of a salt-tolerant, phosphate-solubilizing and crop-growth promoting Aspergillus japonicus. Acta Microbiologica Sinica, 2018, 58(5): 862-881.
(in Chinese) 江红梅, 殷中伟, 史发超, 刘彩月, 范丙全. 一株耐盐日本曲霉的筛选及其溶磷促生作用. 微生物学报, 2018, 58(5): 862-881. |
| [11] |
Cui RQ, Zhang JM, Ma XJ, Li C, Tian L. Multifunction of marine Bacillus sp. strain T28 on tomato growth-promoting. Plant Physiology Journal, 2015, 51(11): 1855-1860.
(in Chinese) 崔荣强, 张久明, 马湘君, 李闯, 田黎. 海洋生境芽孢杆菌(Bacillus sp.) T28菌株对番茄生长的多功能促进作用. 植物生理学报, 2015, 51(11): 1855-1860. |
| [12] | Peix A, Rivas-Boyero AA, Mateos PF, Rodriguez-Barrueco C, Martı́nez-Molina E, Velazquez E. Growth promotion of chickpea and barley by a phosphate solubilizing strain of Mesorhizobium mediterraneum under growth chamber conditions. Soil Biology and Biochemistry, 2001, 33(1): 103-110. DOI:10.1016/S0038-0717(00)00120-6 |
| [13] | Zaidi A, Khan S, Amil S. Interactive effect of rhizotrophic microorganisms on yield and nutrient uptake of chickpea (Cicerarietinum L.). European Journal of Agronomy, 2003, 19(1): 15-21. DOI:10.1016/S1161-0301(02)00015-1 |
| [14] | Andersson KO, Tighe MK, Guppy CN, Milham PJ, McLaren TI. Incremental acidification reveals phosphorus release dynamics in alkaline vertic soils. Geoderma, 2015, 259/260: 35-44. DOI:10.1016/j.geoderma.2015.05.001 |
| [15] |
Qin LJ, Yang YZ, Yang XY. Advances in mechanisms of soil phosphorus solubilization and dissolution by phosphate solubilizing microorganisms. Life Science Research, 2019, 23(1): 59-64, 86.
(in Chinese) 秦利均, 杨永柱, 杨星勇. 土壤溶磷微生物溶磷、解磷机制研究进展. 生命科学研究, 2019, 23(1): 59-64, 86. |
| [16] |
Zhao WS, Li SZ, Lu XY, Zhang XY, Wang PP, Guo QG, Qi YZ, Dong LH, Mao XX, Su ZH, Ma P. Growth-promotion effect of Bacillus amyloliquefaciens PHODB35 on wheat plant and yield. Chinese Journal of Biological Control, 2019, 35(3): 399-406.
(in Chinese) 赵卫松, 李社增, 鹿秀云, 张晓云, 王培培, 郭庆港, 齐永志, 董丽红, 毛晓曦, 苏振贺, 马平. 解淀粉芽胞杆菌PHODB35对小麦的促生作用及产量影响. 中国生物防治学报, 2019, 35(3): 399-406. |
| [17] |
Li N, Qiao ZW, Hong JP, Xie YH, Zhang P. Effect of soluble phosphorus microbial mixed fertilizers on phosphorus nutrient and phosphorus adsorption-desorption characteristics in calcareous cinnamon soil. Chinese Journal of Applied and Environmental Biology, 2014, 20(4): 662-668.
(in Chinese) 李娜, 乔志伟, 洪坚平, 谢英荷, 张平. 溶磷混合菌肥对石灰性褐土磷素养分及解析特性的影响. 应用与环境生物学报, 2014, 20(4): 662-668. |
| [18] |
Ke CL, Chen YF, Zhou DB, Huang MJ, Zhang XY, Gao ZF. Isolation, identification and phosphate solubilization analysis of phosphate-solubilizing bacteria derived from banana rhizosphere soil. Microbiology China, 2015, 42(6): 1032-1042.
(in Chinese) 柯春亮, 陈宇丰, 周登博, 黄绵佳, 张锡炎, 高祝芬. 香蕉根际土壤解磷细菌的筛选、鉴定及解磷能力. 微生物学通报, 2015, 42(6): 1032-1042. |
| [19] |
Liu WG, He YQ, Zhang K, Fan JB, Cao H. Isolation, identification and characterization of a strain of phosphate-solubilizing bacteria from red soil. Acta Microbiologica Sinica, 2012, 52(3): 326-333.
(in Chinese) 刘文干, 何园球, 张坤, 樊建波, 曹慧. 一株红壤溶磷菌的分离、鉴定及溶磷特性. 微生物学报, 2012, 52(3): 326-333. |
| [20] |
Shi L, Du JJ, Guo QG, Li BQ, Lu XY, Li SZ, Ma P. Screening and identification of an antifungal chitinolytic bacterium and its gene cloning and expressing. Acta Phytopathologica Sinica, 2013, 43(2): 149-156.
(in Chinese) 石磊, 杜锦锦, 郭庆港, 李宝庆, 鹿秀云, 李社增, 马平. 具分泌几丁质酶活性的生防细菌的筛选鉴定及其几丁质酶基因的克隆和表达. 植物病理学报, 2013, 43(2): 149-156. DOI:10.3969/j.issn.0412-0914.2013.02.006 |
| [21] |
Yang JY, Guo XJ, Guo W, Lü JT, Yuan HS, Zhu BC. Screening and identification of a strain of Bacillus sp. producing organic acids and optimization of its spore production conditions. Feed Industry, 2015, 36(4): 44-51.
(in Chinese) 杨继业, 郭晓军, 郭威, 吕纪涛, 袁洪水, 朱宝成. 产有机酸芽孢杆菌的筛选、鉴定及产芽孢条件优化. 饲料工业, 2015, 36(4): 44-51. |
| [22] |
Chen H, Wang Y, Yuan JH, Zhu WB, Wang SQ. The effect of phosphorus-reduction on soil phosphorus supply and wheat phosphorus uptake in a rice-wheat rotation system in the Taihu Lake region. Journal of Agro-environment Science, 2018, 37(4): 741-746.
(in Chinese) 陈浩, 汪玉, 袁佳慧, 朱文彬, 王慎强. 太湖稻麦轮作区减施磷肥对土壤供磷和小麦吸收磷的影响. 农业环境科学学报, 2018, 37(4): 741-746. |
| [23] | Nakayan P, Hameed A, Singh S, Young LS, Hung MH, Young CC. Phosphate-solubilizing soil yeast Meyerozyma guilliermondii CC1 improves maize (Zea mays L.) productivity and minimizes requisite chemical fertilization. Plant and Soil, 2013, 373(1/2): 301-315. |
| [24] |
Shi FC, Yin ZW, Jiang HM, Fan BQ. Screening, identification of P-dissolving fungus P83 strain and its effects on phosphate solubilization and plant growth promotion. Acta Microbiologica Sinica, 2014, 54(11): 1333-1343.
(in Chinese) 史发超, 殷中伟, 江红梅, 范丙全. 一株溶磷真菌筛选鉴定及其溶磷促生效果. 微生物学报, 2014, 54(11): 1333-1343. |
| [25] | Singh H, Reddy MS. Effect of inoculation with phosphate solubilizing fungus on growth and nutrient uptake of wheat and maize plants fertilized with rock phosphate in alkaline soils. European Journal of Soil Biology, 2011, 47(1): 30-34. DOI:10.1016/j.ejsobi.2010.10.005 |
| [26] | Kaur G, Reddy MS. Effects of phosphate-solubilizing bacteria, rock phosphate and chemical fertilizers on maize-wheat cropping cycle and economics. Pedosphere, 2015, 25(3): 428-437. DOI:10.1016/S1002-0160(15)30010-2 |
| [27] | Mittal V, Singh O, Nayyar H, Kaur J, Tewari R. Stimulatory effect of phosphate-solubilizing fungal strains (Aspergillus awamori and Penicillium citrinum) on the yield of chickpea (Cicer arietinum L. cv. GPF2). Soil Biology and Biochemistry, 2008, 40(3): 718-727. DOI:10.1016/j.soilbio.2007.10.008 |
| [28] | Ghosh P, Rathinasabapathi B, Ma LQ. Phosphorus solubilization and plant growth enhancement by arsenic-resistant bacteria. Chemosphere, 2015, 134: 1-6. DOI:10.1016/j.chemosphere.2015.03.048 |
| [29] |
Yang XY, Chen ZY, Jiang PP, Zhang RS, Liu YZ, Liu YF. Growth-promotion effect of Bacillus amyloliquefaciens B1619 on tomato plant. Chinese Journal of Biological Control, 2016, 32(3): 349-356.
(in Chinese) 杨晓云, 陈志谊, 蒋盼盼, 张荣胜, 刘邮洲, 刘永锋. 解淀粉芽孢杆菌B1619对番茄的促生作用. 中国生物防治学报, 2016, 32(3): 349-356. |
| [30] | Nautiyal CS. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiology Letters, 1999, 170(1): 265-270. DOI:10.1111/j.1574-6968.1999.tb13383.x |
| [31] |
Feng ZY, Chen SS, Wang WC, Yang H, Deng ZL, Li Z, Wang SM, Xu CY. Screening and identification of several phosphate-solubilizing bacteria and effect of their P-solubility. Journal of Nanjing Agricultural University, 2017, 40(5): 842-849.
(in Chinese) 冯哲叶, 陈莎莎, 王文超, 杨华, 邓照亮, 李真, 王世梅, 徐阳春. 几株溶磷细菌的筛选和鉴定及其溶磷效果. 南京农业大学学报, 2017, 40(5): 842-849. |
| [32] |
Ma CY, Zhang Y, Ma WB, Li JH, Yao T. Identification of plant growth promoting rhizobacteria Astragalus membranaceus and their effectives. Acta Prataculturae Sinica, 2017, 26(1): 149-159.
(in Chinese) 马骢毓, 张英, 马文彬, 李建宏, 姚拓. 黄芪根际促生菌(PGPR)筛选与特性研究. 草业学报, 2017, 26(1): 149-159. |
| [33] |
Cui XS, Wang W, Zhang R, Zhang RF. Screening of plant growth-promoting rhizobacteria based on rhizosphere nutrition competiveness and investigation of their promoting effects. Journal of Nanjing Agricultural University, 2015, 38(6): 958-966.
(in Chinese) 崔晓双, 王伟, 张如, 张瑞福. 基于根际营养竞争的植物根际促生菌的筛选及促生效应研究. 南京农业大学学报, 2015, 38(6): 958-966. |
| [34] |
Yan XM, Yu L, Ye CL, Li G, Wu J, Hu F, Jiang Y, Li HX. Phosphate-solubilizing capability of bacterial strain Y1 from fluvo-aquic soil and its promoting effects on peanut. Chinese Agricultural Science Bulletin, 2015, 31(26): 150-155.
(in Chinese) 闫小梅, 虞丽, 叶成龙, 李根, 武俊, 胡锋, 姜瑛, 李辉信. 一株灰潮土解磷菌的解磷特性及其对花生的促生作用. 中国农学通报, 2015, 31(26): 150-155. DOI:10.11924/j.issn.1000-6850.casb15040148 |
| [35] |
He MX, Gao Y, Hu ZX, Xu Y, Long R, Sun QY. Screening, identification, and phosphate-solubilizing capability of phosphate-solubilizing bacterial strain B25. Chinese Journal of Applied Ecology, 2012, 23(1): 235-239.
(in Chinese) 贺梦醒, 高毅, 胡正雪, 徐瑶, 龙瑞, 孙庆业. 解磷菌株B25的筛选、鉴定及其解磷能力. 应用生态学报, 2012, 23(1): 235-239. |
| [36] | Jain R, Saxena J, Sharma V. Differential effects of immobilized and free forms of phosphate-solubilizing fungal strains on the growth and phosphorus uptake of mung bean plants. Annals of Microbiology, 2014, 64(4): 1523-1534. DOI:10.1007/s13213-013-0795-6 |
| [37] | Paungfoo-Lonhienne C, Lonhienne TGA, Yeoh YK, Webb RI, Lakshmanan P, Chan CX, Lim PE, Ragan MA, Schmidt S, Hugenholtz P. A new species of Burkholderia isolated from sugarcane roots promotes plant growth. Microbial Biotechnology, 2014, 7(2): 142-154. DOI:10.1111/1751-7915.12105 |
| [38] | Zhao LF, Xu YJ, Lai XH, Shan CJ, Deng ZS, Ji YL. Screening and characterization of endophytic Bacillus and Paenibacillus strains from medicinal plant Lonicera japonica for use as potential plant growth promoters. Brazilian Journal of Microbiology, 2015, 46(4): 977-989. DOI:10.1590/S1517-838246420140024 |
| [39] |
Tan SY, Yi YJ, Wang HY, Zhou WL, Tan ZJ, Liu Q, Wang CY. Isolation and identification of plant growth-promoting bacteria (PGPB) from ramie (Boehmeria nivea L. Gaud) rhizosphere and their promoting growth effects. Microbiology China, 2015, 42(3): 525-533.
(in Chinese) 谭石勇, 易永健, 汪洪鹰, 周晚来, 谭志坚, 刘潜, 王朝云. 苎麻促生菌的筛选、鉴定及其促生效应. 微生物学通报, 2015, 42(3): 525-533. |
| [40] |
Qin JJ, Yan SZ, Liu J. The growth-promotion on pepper and control of Phytophthora capsici by endophytic bacterium agents. Acta Phytophylacica Sinica, 2010, 37(4): 325-330.
(in Chinese) 秦娟娟, 闫淑珍, 刘佳. 植物内生细菌固体菌剂对辣椒的促生和防病作用. 植物保护学报, 2010, 37(4): 325-330. |
| [41] |
Sun HM, Wang CH, Lu DX, Liu JJ, Yue ST, Yang MY. Research progress of phosphate dissolving microorganisms and their promotion effect on plant growth. Journal of Henan Agricultural Sciences, 2016, 45(5): 1-6.
(in Chinese) 孙合美, 王春红, 卢冬雪, 刘晶晶, 岳胜天, 杨美英. 土壤溶磷微生物及其对植物促生作用研究进展. 河南农业科学, 2016, 45(5): 1-6. |
| [42] | Chen YP, Rekha PD, Arun AB, Shen FT, Lai WA, Young CC. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Applied Soil Ecology, 2006, 34(1): 33-41. DOI:10.1016/j.apsoil.2005.12.002 |
| [43] | Hameeda B, Reddy YHK, Rupela OP, Kumar GN, Reddy G. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna. Current Microbiology, 2006, 53(4): 298-302. |
| [44] |
Wang H, Wang JJ, Xu S, Zhao W, Han YF, Wang XB, Huang ZY. Screening and growth promoting characteristics of efficient organophosphate-degradation bacteria. Acta Microbiologica Sinica, 2017, 57(5): 667-680.
(in Chinese) 王欢, 王敬敬, 徐松, 赵维, 韩一凡, 王兴彪, 黄志勇. 有机磷降解菌的筛选及其促生特性. 微生物学报, 2017, 57(5): 667-680. |
| [45] | Illmer P, Schinner F. Solubilization of inorganic calcium phosphates-solubilization mechanisms. Soil Biology and Biochemistry, 1995, 27(3): 257-263. DOI:10.1016/0038-0717(94)00190-C |
| [46] |
Qiao ZW, Teng FL, Shao XG. Screening, identification and characteristic analysis of phosphorus solubilizing bacteria Burkholderia sp. in yellow soil. Journal of Shanxi Agricultural University(Natural Science Edition), 2019, 39(1): 1-6.
(in Chinese) 乔志伟, 腾飞龙, 邵晓贵. 黄壤伯克氏溶磷细菌的筛选鉴定及溶磷特性. 山西农业大学学报(自然科学版), 2019, 39(1): 1-6. |
| [47] |
Qiao H, Wu XQ, Wei W. Effects of two phosphate-solubilizing Penicillium strains on microbial community structure and their growth-promoting in masson pine rhizosphere. Journal of Nanjing Forestry University(Natural Sciences Edition), 2016, 40(6): 109-116.
(in Chinese) 乔欢, 吴小芹, 魏伟. 两株解磷青霉对马尾松根际土壤的微生态效应及其促生作用. 南京林业大学学报(自然科学版), 2016, 40(6): 109-116. |
 2020, Vol. 60
2020, Vol. 60