中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张翼飞, 许科伟, 符波, 杨帆, 刘和. 2020
- Yifei Zhang, Kewei Xu, Bo Fu, Fan Yang, He Liu. 2020
- 顺北典型油气藏上方土壤甲烷氧化菌菌群特征及其勘探意义
- Characteristics and exploration significance of soil methane oxidation bacteria above typical oil and gas reservoirs in Shunbei
- 微生物学报, 60(6): 1221-1231
- Acta Microbiologica Sinica, 60(6): 1221-1231
-
文章历史
- 收稿日期:2019-07-03
- 修回日期:2019-11-09
- 网络出版日期:2019-11-21
2. 江苏省水处理技术与材料协同创新中心, 江苏 苏州 215009;
3. 中国石油化工股份有限公司石油勘探开发研究院无锡石油地质研究所, 江苏 无锡 214151
2. Jiangsu Collaborative Innovation Center of Technology and Material of Water Treatment, Suzhou 215009, Jiangsu Province, China;
3. Wuxi Institute of Petroleum Geology, Institute of Petroleum Exploration and Development, China Petrochemical Corporation, Wuxi 214151, Jiangsu Province, China
甲烷是大气中仅次于二氧化碳的第二大温室气体[1],据估算地球环境中产生的甲烷排放到大气之前,最高约有20%的甲烷主要由土壤中的甲烷氧化菌氧化分解[2],它以甲烷作为唯一碳源和能源,对碳源具有高度专一性,也是甲烷的唯一生物汇。甲烷氧化菌据生理生化特征和代谢途径可分为Ⅰ型和Ⅱ型两种不同的生理类群,Ⅰ型甲烷氧化菌主要利用RuMP循化同化C1组分,细胞内的颗粒型甲烷单加氧酶进行甲烷的氧化,在高CH4低O2浓度的环境中占有优势[2]。Ⅱ型甲烷氧化菌均利用serine循环进行C1组分同化,除了Methylocella以外都含有可溶型甲烷单加氧酶,在低CH4浓度下表现出更高的亲和力[3]。地下深处轻质烷烃气体在油气藏压力的带动下持续向地表垂直扩散和运移过程中,大部分被土壤中的专性烷烃氧化细菌所利用,导致此类细菌大量发育形成特异性生长。因此,利用甲烷氧化菌菌群特征结合地球化学数据综合分析,可为油气微生物勘探提供有力的数据支撑。
大多数微生物勘探应用都依赖于经典的平板培养方法,将甲烷营养体从土壤中分离。但是,传统培养法的环境条件与原位勘探背景完全不同,极可能选择性富集了特定甲烷氧化菌,很难精准复位甲烷氧化菌的分布特征。而分子生态学技术则能较好地克服这一难点。首先通过提取环境样品总DNA,获得原位地质样品中所有微生物基因组总DNA,进而利用甲烷氧化菌特有的功能基因pmoA精准定量,已知pmoA基因存在于除Methylocella以外的所有的甲烷氧化菌中[4],能全面检测环境样品中甲烷氧化菌的种类。杨帆等[5]在济阳沾化凹陷陈家庄的陈6井附近的剖面利用pmoA、alkb基因的异常高值将油田区与背景区明显区分,成功预测有利油藏区域。而在顺北地区地貌特征以荒漠为主,表面砂层通透性较好,为微渗漏创造了极好的条件,贫瘠的土壤排除了土壤其他微生物的干扰,使嗜烃类菌群特征更加明显。如何有效将菌群特征与油气藏建立联系一直是微生物勘探的难点,本文在基于pmoA基因拷贝数基础上结合化学指标酸解烃含量和地质垂直剖面研究了甲烷氧化菌的丰度异常。采用16S rRNA基因高通量测序技术和pmoA基因的克隆文库比较了油气藏上方和背景区土壤中甲烷氧化菌群落组成的差异,初步阐明了甲烷氧化菌的丰度和群落结构特征与长期微渗漏的烃类存在密切相关性。
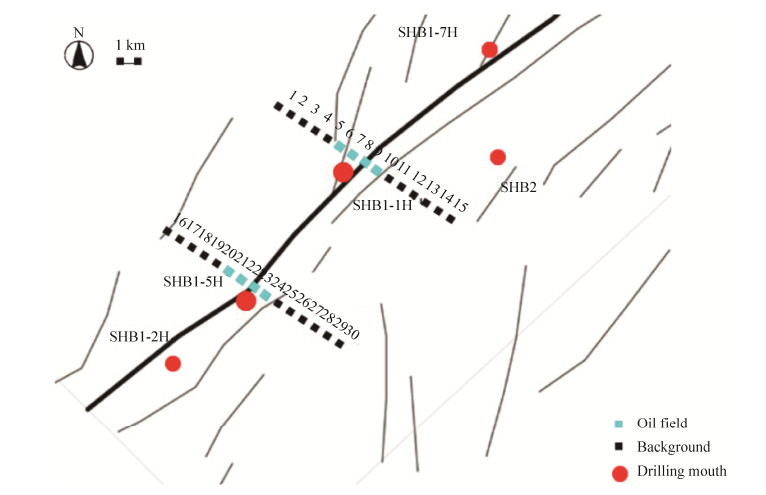
1 材料和方法 1.1 样品来源顺北区块行政区划属新疆维吾尔自治区阿克苏地区沙雅县,地理位置:东经81°30′–83°00′,北纬40°20′–40°50′。区内地表条件复杂,多为荒漠和盐碱地。图 1每2个样品之间相距1 km,总计共30个样品。其中标红的SHB1-1H、SHB1-5H为2个油井,把靠近油气井的OG6–OG9认为油田区,同一剖面其他点为非油田的背景区(CK)。同理SHB1-5H的油田区为OG21–OG24,其他为背景区(CK)。采样深度为30 cm,将采样过后的土壤样品放置已灭菌的生物样袋,低温运至实验室保存,并对土壤的理化性质进行测定(表 1)。
|
| 图 1 顺北地区样品采集图 Figure 1 Sample collection diagram of shunbei area. The Numbers 1–30 represent the sampling site and the representative of the oil field at the beginning of SHB |
| Sample number | Site | TOC/% | Moisture content/% | Hydrocarbon (C1–C3)/(μL/kg) | pH |
| CK1 | Background | 1.23±0.21 | 6.25±0.04 | 488±21 | 7.40±0.11 |
| CK4 | Background | 2.61±0.10 | 3.74±0.07 | 503±18 | 7.56±0.23 |
| OG6 | Oil field | 1.54±0.15 | 8.61±0.02 | 610±25 | 7.67±0.02 |
| OG24 | Oil field | 2.89±0.33 | 3.12±0.02 | 873±40 | 7.27±0.05 |
| CK17 | Background | 0.71±0.47 | 7.97±0.01 | 670±27 | 8.41±0.31 |
| CK28 | Background | 3.04±0.25 | 2.32±0.01 | 579±33 | 7.68±0.10 |
1.2 土壤DNA的提取和PCR的扩增
顺北地区的地貌以荒漠为主,砂土中细菌含量较少。将样品放入甲烷氧化菌培养基富集后再对DNA进行提取。贫瘠的地貌环境导致DNA浓度提取较低,因此本实验中采取SDS结合酚氯仿法[6]和DNA提取试剂盒法两种方法比较DNA浓度和纯化效果。将提取到的DNA溶解于50 μL的ddH2O,通过微量紫外分光光度计(NanoDrop ND-1000 UV)测定DNA浓度和纯度(OD260/OD280和OD260/OD230)。针对pmoA基因的引物A189f和mb661r设置PCR反应体系25 μL:1 μL提取的DNA,5 μL的5 GoTaq Flexi缓冲液(Promega),2.5 μL的MgCl2(25 mol/L,Promega),0.5 μL dNTPs (10 mol/L,Invitrogen),0.5 μL每种正向和反向引物和0.2 μL GoTaqFlexi聚合酶。PCR程序包括:95 ℃的初始变性5 min,35个循环的95 ℃ 50 s,54 ℃ 50 s,72 ℃ 50 s,然后10 min的最终延伸72 ℃。
1.3 pmoA基因的实时荧光定量PCR实验采用Rotor Gene-Q软件对PCR产物进行了融解曲线分析。根据定量PCR(引物组A189f和mb661r)得到的荧光阈值(Ct值)与基因拷贝数对数值建立线性定量标准曲线。每个样品做2组平行性对照。根据已建立的标准曲线,将提取的油气田土壤DNA样品作为模板,根据定量PCR得到的Ct值计算pmoA基因的拷贝数。实验方法如下[7]:反应体系(20 μL):10 μL TB Green PCR Master Mix、1 μL正向引物、1 μL反向引物、1 μL DNA模板,7 μL ddH2O。反应条件:94 ℃变性阶段10 min,94 ℃变性50 s,55–60 ℃退火50 s,72 ℃延伸50 s,共40个循环,循环结束后72 ℃延伸10 min。用pmoA基因拷贝数表示样品中的甲烷氧化菌的丰度。
1.4 土壤样品酸解烃及含水率的测定将顺北土壤样品在阴凉通风处自然晾干,破碎,过0.419 mm筛混匀。缩分后30个样品分装20 g储存于牛皮纸样品袋中待测,酸解烃脱气装置和脱气方法参考国家标准GB/T 29173-2012[8]。土壤含水率采取烘干法进行测定。过程如下:取铝盒在105 ℃烘箱中放置2 h后,称重W,按需取约10 g表层土样放入铝盒中,加盖后称重(铝盒加土壤重量),记为W1,去盖放入烘箱中,在105 ℃条件下烘6 h,至恒重,取出加盖后称重(铝盒加干土的重量),记为W2。按照公式(1)计算。取3次重复,求其平均值。
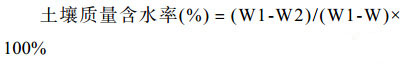
|
公式(1) |
将顺北两条剖面总计30个土壤样品进行涂布培养,具体实验如下[9]:取土壤样品5 g溶于20 mL水后,离心管涡旋振荡。静置2 h后,取其200 μL上清液加入96孔稀释板中,加入600 μL超纯水稀释20倍。取100 μL稀释液接种于甲烷氧化菌培养基中进行涂布,将平板放置灭菌的密封袋中冲入高浓度甲烷气体培养4–5 d,待长出单菌落对样品中的甲烷氧化菌进行平板菌落培养计数,观察甲烷氧化菌数量与pmoA基因是否有良好的响应效果,并分析pmoA基因丰度与酸解烃释放甲烷含量的相关性。
1.6 克隆文库及测序将30个土壤样品pmoA基因扩增的PCR产物使用Qiaex Ⅱ凝胶提取试剂盒(QIAGEN,Hilden,Germany)纯化,用pMD19-T载体在16 ℃进行(TaKaRa,Japan)连接。在由4 μL溶液Ⅰ、7 μL纯化的PCR产物和0.4 μL pMD19-T载体组成的11.4 μL反应体积中进行10 h。将载体转化为大肠杆菌的感受态细胞。然后使用引物组M13和M13R在25 μL PCR反应体积中随机挑选克隆的单菌落用于PCR扩增,PCR反应体积与上述相同。PCR程序包括:95 ℃的初始变性5 min,32个循环的95 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,然后10 min的最终延伸72 ℃。阳性PCR产物在ABI Prism 3730 DNA分析仪上用Big Dye Terminator Kit(Applied Sciences,Foster City,CA)进行DNA测序。将核苷酸序列在GenBank进行比对。
1.7 高通量测序及多元统计分析委托上海美吉生物科技有限公司对油田区样品(OG6、OG8、OG22、OG23)和背景区样品(CK1、CK3、CK11、CK15、CK16、CK17、CK26、CK30)测序,测序在Illumina HiSeq测序平台上进行,利用Uclust方法对有效数据在97%水平上进行操作分类单元(operational taxonomic unit,OTU)聚类,并进行物种注释和丰度分析来揭示样品的物种组成。并使用CANOCO 4.5主成分分析(CCA)评估物种种类与环境参数之间的关系。本文使用线性物种反应模型的趋势相关分析结果,而不是单模态方法。具体方法参照CANOCO4.5使用手册[10]。
2 结果和讨论 2.1 顺北地区油气藏断面上方土壤甲烷氧化菌的丰度 2.1.1 甲烷氧化菌丰度分布特征:对甲烷单加氧酶基因pmoA定量结果、甲烷氧化菌平板计数结果结合酸解烃甲烷含量进行分析,如图 2所示,SHB1-1H井和SHB1-5H井所在的两条剖面pmoA基因在油藏上方OG6、OG7、OG23、OG24点位附近含量较高,总体趋势由中心油田区向两端递减。在剖面边缘两端均有异常的升高,这种异常现象分布可能是由于CK13、CK17点位附近下伏有断层,在附近形成圈闭构造烃类不断向两侧渗透,为甲烷氧化菌提供了良好的生长环境,使其附近pmoA含量增高。甲烷氧化菌的平板计数结果在两条剖面中对有利油藏区域也展现出较强的指示性。

|
| 图 2 顺北剖面pmoA定量与甲烷含量图 Figure 2 pmoA quantitative and methane content map in Shunbei. CK stands for background area and OG stands for oil field area. Each sample is made in two parallel rows, and the error bars indicate the degree of difference in the samples |
在SHB1-5H上方油田区甲烷氧化菌的丰度较背景区高0.5–2个数量级。SHB1-1H剖面样点酸解烃的含量差异性较大,油藏区上方的吸附型甲烷含量明显高于两侧背景区,在油田区OG8、OG9甲烷的含量高达801 μL/kg、754 μL/kg,呈明显的峰状模式,在两侧背景区只有小浮波状峰形,整体与甲烷氧化菌的丰度呈现良好的正相关性。SHB1-5H剖面甲烷的含量整体差异性不大,油藏区略高于背景区。整体呈现西部异常高值,推测西部主要以渗透性砂层为主,在油气渗漏过程中下伏有较好的裂隙发育带。通过图 2可以看出通过酸解烃甲烷的含量与甲烷氧化菌的高值可以较为明显地区分出背景与油田区,而甲烷氧化菌平板计数结果也可以作为一个辅助指标,三者的结合可以极大提高有利油藏预测的成功率,提高勘探效率。
2.1.2 甲烷氧化菌的丰度与地表甲烷含量:以SHB1-5H井剖面为例对平板计数和pmoA基因定量结果与土壤中甲烷含量做相关性分析。如图 3可知,甲烷氧化菌丰度和土壤中甲烷含量存在一定的相关性,两者皮尔逊指数分别达到了61.8%和76.1%。平板计数相关性略高于pmoA基因定量结果。两者都能较好地反映油藏位置。但是,与传统的培养方法相比,我们推荐采用定量PCR技术,以获得采样原位准确的甲烷氧化菌丰度。

|
| 图 3 地表甲烷含量与甲烷氧化菌丰度相关性分析图 Figure 3 Correlation analysis diagram of surface methane content and methane oxidizing bacteria abundance. A: correlation between pmoA gene and soil methane content. B: correlation between plate count results and soil methane content |
2.2 甲烷氧化菌的群落结构分析 2.2.1 基于16S rRNA基因的甲烷氧化菌多样性分析:
每个特定的OTU序列代表一种微生物,因为顺北隶属于荒漠地区,甲烷氧化菌的相对丰度较低,我们采用OTU数量(即绝对值)进行分类统计。在顺北SHB1-1H剖面的高通量数据中一共检测到6种甲烷氧化菌(图 4),分别是Methylocella sp.、Methylocystis sp.、Methylomonas sp.、Methylothermus sp.、Meyhylobacter sp.、Methylomicrobium sp.。将检测到的甲烷氧化菌OTU进行分类。其中Methylocella sp.、Methylocystis sp.为Ⅱ型甲烷氧化菌,Methylomonas sp.、Methylothermus sp.、Meyhylobacter sp.、Methylomicrobium sp.为Ⅰ型甲烷氧化菌。在油田区OG6和OG8的甲烷氧化菌丰度和种类较高,其中以Ⅰ型甲烷氧化菌为主,而背景区以Ⅱ型甲烷氧化菌为主。在油田区Methylobacter sp.占主导,其中在OG6和OG8中其相对丰度分别为28.6%和40.8%,具有明显的优势。随着离油井的距离的增加Ⅱ型甲烷氧化菌逐渐产生优势。在CK3和CK15中Methylocella sp.的相对丰度分别占19.6%和32.7%。Ⅰ型甲烷氧化菌被Ⅱ型甲烷氧化菌代替。根据对湿地土壤的研究,Henckel等[11]发现在极低的原位CH4浓度下,Ⅰ型甲烷氧化菌似乎超过Ⅱ型,而Ⅱ型甲烷氧化菌往往在高CH4和低O2条件下占优势。由于长期的微渗漏,土壤中游离态CH4浓度上升,导致Ⅱ型甲烷氧化菌出现较高丰度。
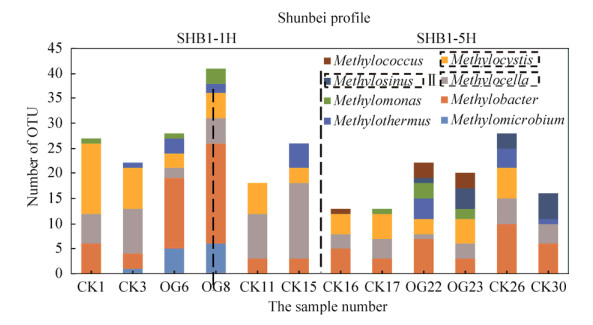
|
| 图 4 顺北剖面甲烷氧化菌OTU的数量 Figure 4 Number of Shunbei methane oxidizing bacteria OTU. SHB1-1H and SHB1-5H represent the two horizontal sections where the sampling points are located, respectively. The dotted line indicates the Ⅱ methane oxidation bacteria |
在SHB1-5H剖面(图 4)中发现背景区CK26中Ⅰ型甲烷氧化菌Methylobacter sp.的相对丰度达到29.4%。Ⅰ型和Ⅱ型似乎没有明显的界限。随着油气的垂直向上渗漏导致油田上方的甲烷氧化菌更加多样,油气区较背景区的甲烷氧化菌丰度也有较明显的优势,且主要以Ⅰ型甲烷氧化菌为主。蔡朝阳等[12]研究表明Ⅰ型和Ⅱ型甲烷氧化菌的代谢途径存在较大差异,Ⅰ型主要利用RuMP循环同化甲醛,在此过程中主要以EDD和EMP途径进行代谢,相比Ⅱ型甲烷氧化菌serine循环代谢功能更加多样,利用甲烷能力较强,所以整体丰度更占优势。在SHB1-1H中Methylobacter sp.在背景区和油田区有较大的差异性,可以作为其剖面的鉴别性物种。而SHB1-5H中并没有出现类似的现象,甲烷氧化菌Methylomonas sp.对油气较为敏感,在背景区域几乎没有被检测到再次出现。甲烷氧化菌随着油气的变化不仅具有水平演变的规律,而且在空间上还存在差异性。
2.2.2 pmoA基因的克隆文库::将油气田上方30 cm样品构建克隆文库(图 5)。土壤文库中大约有87.5%的甲烷氧化型。回收密切相关的序列与未培养和培养的亲属的序列相匹配。系统发育分析表明,该油气田主要有甲基杆菌Methylobacter、甲基单胞菌Methylomonas、甲基微球菌Methylomicrobium、甲基球菌Methylococcus、甲基暖菌Methylocaldum、甲基弯曲菌Methylosinus和一些未培养的甲烷氧化菌组成。

|
| 图 5 甲烷氧化菌pmoA基因的系统发育关系分析 Figure 5 Phylogenetic analysis of pmoA gene of methanotrophin. The tree was constructed using the neighborjoining method in MEGA software. The scale bar represents 1% sequence divergence; values at the nodes are the percentages of 1000 bootstrap replicates supporting the branching order; bootstrap values below 70% are not shown. Representative clones obtained. in this study are shown in different sample number which represent different methanotrophic groups |
从图 5中看出油田上方多为甲基杆菌Methylobacter和甲基单胞菌Methylomonas,这与之前高通量测序结果较为类似,除此之外不可培养的甲烷氧化菌营养体占了较大成分。Zhang等[13]之前对大港油田油气藏上方土壤中pmoA基因的多样性进行了研究,Ⅱ型甲烷氧化菌甲基孢囊菌和甲基弯曲菌是2种可能的油气指示菌,这与我们的结论存在较大的差异性。这表明在不同地理条件下,油气指示菌的类型很有可能发生变化,到底什么原因导致这种差异性?我们还需要对环境因子进行相关性分析,并对甲烷氧化菌内在机制作进一步的研究。
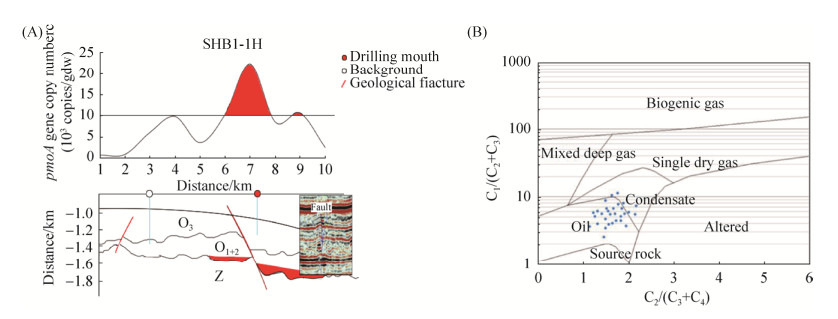
2.3 甲烷氧化菌的油气指示意义及环境影响因素 2.3.1 甲烷氧化菌分布与地质断层的关系::顺北工区主要以碳酸盐岩缝洞型储层发育为主。构造变形程度弱,上奥陶统—志留泥盆系发育较齐全。图 6-A中下方红色断裂层,是油气主要聚集部位。
|
| 图 6 顺北地区地质剖面及微渗漏来源示意图 Figure 6 Map of geological section and source of microseepage in Shunbei area. A: relationship between the abundance of methane oxidizing bacteria and geological faults. B: source of microleakage hydrocarbons. O3: Late Ordovician rock formation; O1+2: Middle Ordovician and Early Ordovician rock formations; Z: Sinian rock formation |
我们将顺北地区的垂直剖面与甲烷氧化菌丰度结合,对比油藏位置和大致的烃类渗漏方向。甲烷氧化菌丰度在SHB1-1H剖面顶端的异常富集现象与中间主断层位置具有较好的对应关系。垂直剖面构造稳定,上层土壤中无明显的断层。图 6-A中2 km处也发现小型断层,对应表层土壤中3–4 km处pmoA含量小幅升高,推测该区域为有利油藏区域。油藏上方微生物异常是储层中广泛发育的岩溶孔洞和断层以及微渗漏共同作用的结果。构造裂缝和溶蚀孔洞的非均质性特点,造成了渗漏的通透性较强,为油气的微渗漏提供了条件。
王国建等[14]研究显示游离态甲烷与乙烷以上重烃的浓度比大于1000指示烃气以生物化学成因为主,小于50往往指示深部运移。本研究图 6-B中C1/(C2+C3)烃值比范围为2.6–13,除此之外乙烷与乙烯等不饱和烃重烃比C2/(C3+C4)为1.1–2.2。初步推断顺北游离烃主要来自于地底油类,少量夹杂凝析油。但是,其中是否包含长期岩变过程由热裂解原因形成的少量甲烷,我们还无法准确地判断。通过地下油藏分布和深处断层以及游离烃的比值,因此推断油气微渗漏的母源来自地下油藏。
2.3.2 甲烷氧化菌分布与环境因素影响::将油气田上方的土壤样品的含水率、pH、有机质(TOC)、酸解烃以及高通量微生物数据进行CCA分析。油气指示微生物受环境的影响:烃类>含水率>有机质>pH。含水率和有机质呈明显的正相关性,pH对甲烷氧化菌无明显的相关性。吴宁等[15]在研究不同气候区中甲烷氧化菌的群落多样性时发现,在不同植被区甲烷氧化菌氧化速率受温度影响,且与含水率呈明显的正相关,但与TOC并无显著相关性。在顺北典型油气藏上方,烃类的含量明显高于之前研究的森林中甲烷浓度(10 ppmv),甲烷浓度相对于Zeng等[15]研究的两个气候区差异明显,成为主导的环境因素。并且独特的荒漠地貌特征,使有机质成为主要的油气微生物生长的必要条件,呈现出正相关。从图 7中可以看出不同的环境因素下会导致油气微生物群落存在明显的差异性。甲烷氧化菌Methylococcus sp.、Methylotenera sp.、Methylocystis sp.受烃类气体影响较大,且以Ⅰ型为主。Dechloromonas sp.、Arthrobacter sp.含量与含水率关联性最强,两者多为革兰氏阴性菌,Dechloromonas sp.能较好地利用水中的溶解苯,且对原油成分中的芳香烃较为敏感[16]。Lysobacter sp.、Methylosoma sp.等受有机质影响较大,有机质为主要的限制因素。相比之前报道的不同环境下,顺北地区烃类对甲烷氧化菌影响优势更加明显。

|
| 图 7 环境因素影响 Figure 7 Influence of soil factors. A typical correspondence analysis (CCA) sequence map of the oil and gas microbial community was determined by the 16S rRNA gene. The arrow points to a variable related to the composition of the community, and the length of the arrow indicates the percentage of the variable as a percentage of the data. Hereinafter referred to as the sample name and environmental factors: MC: water content; HC: hydrocarbon content; TOC: total organic carbon |
3 结论
本研究结合化学勘探方法和分子生态学技术,研究甲烷氧化菌作为油气特征微生物预测地下有利油藏的可行性,通过深入分析甲烷氧化菌数量和组成沿顺北典型油气藏上方的分布规律,发现:(1)顺北地区油气藏上方甲烷氧化菌呈现明显的丰度异常,在主要的断裂带有大量富集现象,与酸解烃甲烷的含量呈正相关的趋势。地质的垂直剖面验证了甲烷等烃类的垂直向上渗漏的方向,侧面证明了甲烷氧化菌的丰度异常可能由地下烃类的长期渗漏导致。(2)顺北地区SHB1-1H剖面油田上方甲烷氧化菌以Ⅰ型为主,由中心向两侧随着微渗漏烃类减少,存在Ⅰ型甲烷氧化菌向Ⅱ型演替的现象。SHB1-5H中Ⅱ型甲烷氧化菌Methylomonas sp.对油气较为敏感。但是在不同的剖面甲烷氧化菌的种类和丰度具有一定的差异性。(3)顺北荒漠地区甲烷氧化菌更易受到微渗漏烃类的影响,烃类组成和含水率成为影响甲烷氧化菌的多样性的显著性因素。
| [1] | Hakemian AS, Rosenzweig AC. The biochemistry of methane oxidation. Annual Review of Biochemistry, 2007, 76: 223-241. DOI:10.1146/annurev.biochem.76.061505.175355 |
| [2] |
Liang ZB, Shi Y, Yue J. Advances in the research of methanotroph. Chinese Journal of Ecology, 2004, 23(5): 198-205.
(in Chinese) 梁战备, 史奕, 岳进. 甲烷氧化菌研究进展. 生态学杂志, 2004, 23(5): 198-205. DOI:10.3321/j.issn:1000-4890.2004.05.036 |
| [3] | Bull ID, Parekh NR, Hall GH, Ineson P, Evershed RP. Detection and classification of atmospheric methane oxidizing bacteria in soil. Nature, 2000, 405(6783): 175-178. DOI:10.1038/35012061 |
| [4] | Lüke C, Frenzel P. Potential of pmoA amplicon pyrosequencing for methanotroph diversity studies. Applied and Environmental Microbiology, 2011, 77(17): 6305-6309. DOI:10.1128/AEM.05355-11 |
| [5] |
Yang F, Shen ZM, Tang YP, Xu KW, Gu L. Microbial anomaly distribution in Chen22 block, Chenjiazhuang oil field, Bohai Bay Basin. Petroleum Geology & Experiment, 2017, 39(1): 141-146.
(in Chinese) 杨帆, 沈忠民, 汤玉平, 许科伟, 顾磊. 渤海湾盆地陈家庄油田陈22块微生物异常分布研究. 石油实验地质, 2017, 39(1): 141-146. |
| [6] | Köchl S, Niederstätter H, Parson W. DNA extraction and quantitation of forensic samples using the phenol- chloroform method and real-time PCR//Carracedo A. Forensic DNA Typing Protocols. Totowa: Humana Press, 2005: 13-29. |
| [7] | McDonald IR, Murrell JC. The particulate methane monooxygenase gene pmoA and its use as a functional gene probe for methanotrophs. FEMS Microbiology Letters, 1997, 156(2): 205-210. DOI:10.1111/j.1574-6968.1997.tb12728.x |
| [8] |
Liao JJ, Rong FZ, Li GZ, Zhang YX. The application of hydrocarbon acidolysis technique to oil and gas exploration. Geophysical and Geochemical Exploration, 2005, 29(3): 209-212, 216.
(in Chinese) 缪九军, 荣发准, 李广之, 张彦霞. 酸解烃技术在油气勘探中的应用. 物探与化探, 2005, 29(3): 209-212, 216. DOI:10.3969/j.issn.1000-8918.2005.03.005 |
| [9] | Rajagopal BS, Belay N, Daniels L. Isolation and characterization of methanogenic bacteria from rice paddies. FEMS Microbiology Letters, 1988, 53(3/4): 153-158. |
| [10] | Rejmánek M, Klinger R. CANOCO 4.5 and some comparisons with PC-ORD and SYN-TAX. Bulletin of the Ecological Society of America, 2003, 84(2): 69-74. DOI:10.1890/0012-9623(2003)84[69:CASCWP]2.0.CO;2 |
| [11] | Dunfield PF, Liesack W, Henckel T, Knowles R, Conrad R. High-affinity methane oxidation by a soil enrichment culture containing a type Ⅱ methanotroph. Applied and Environmental Microbiology, 1999, 65(3): 1009-1014. DOI:10.1128/AEM.65.3.1009-1014.1999 |
| [12] |
Cai CY, He ZF, Hu BL. Progresses in the classification and mechanism of methane-oxidizing bacteria. Journal of Zhejiang University (Agriculture & Life Sciences), 2016, 42(3): 273-281.
(in Chinese) 蔡朝阳, 何崭飞, 胡宝兰. 甲烷氧化菌分类及代谢途径研究进展. 浙江大学学报(农业与生命科学版), 2016, 42(3): 273-281. |
| [13] | Zhang F, She YH, Zheng Y, Zhou ZF, Kong SQ, Hou DJ. Molecular biologic techniques applied to the microbial prospecting of oil and gas in the Ban 876 gas and oil field in China. Applied Microbiology and Biotechnology, 2010, 86(4): 1183-1194. DOI:10.1007/s00253-009-2426-5 |
| [14] |
Wang GJ, Cheng TJ, Tang YP, Huang X, Zhu HP. The application of δ13C1 to surface geochemical exploration and its existing problems. Geophysical and Geochemical Exploration, 2008, 32(5): 549-552.
(in Chinese) 王国建, 程同锦, 汤玉平, 黄欣, 朱怀平. 地表化探中甲烷稳定碳同位素的应用及存在问题. 物探与化探, 2008, 32(5): 549-552. |
| [15] | Zeng LL, Tian GQ, Chen H, Wu N, Yan ZY, Du LF, Shen Y, Wang X. Changes in methane oxidation ability and methanotrophic community composition across different climatic zones. Journal of Soils and Sediments, 2019, 19(2): 533-543. DOI:10.1007/s11368-018-2069-1 |
| [16] | Reed AJ. Molecular analysis of microbial 16S rRNA, mcrA, dsrAB and pmoA genes from deep-sea hydrothermal vent and cold seep sites. Doctor Dissertation of the State University of New Jersey, 2008: 81-90. |
 2020, Vol. 60
2020, Vol. 60