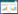中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 肖喜林, 咸淑慧, 张锐, 焦念志. 2020
- Xiao Xilin, Xian Shuhui, Zhang Rui, Jiao Nianzhi. 2020
- 海洋异养细菌利用溶解有机碳的定量评估
- Quantification of biodegradable dissolved organic carbon in the ocean
- 微生物学报, 60(6): 1090-1105
- Acta Microbiologica Sinica, 60(6): 1090-1105
-
文章历史
- 收稿日期:2020-03-10
- 修回日期:2020-04-23
- 网络出版日期:2020-05-08
海洋中有机碳的95%以上以溶解态有机碳(dissolved organic carbon,DOC)的形式存在,DOC中的95%左右又是以生物不能利用的惰性溶解有机碳(refractory DOC,RDOC)存在。海洋中RDOC总量高达624 Pg C[1],与大气CO2总碳量相当[2]。RDOC可在海洋中保存数千年,是海洋重要的碳汇,在海洋碳循环及调节全球气候变化中扮演着举足轻重的作用。探寻RDOC碳库形成机制是认识海洋如何储碳及评估不同海域储碳能力的关键。现在科学家已经认识到,微型生物在代谢过程中,将环境中低浓度的易于被微生物利用的活性DOC、半活性DOC等转化为难以被生物利用的RDOC,可长期储存在海洋中,起到“碳储存”的作用。Jiao等[3]对此进行了系统的阐述,指出包括异养细菌在内的微型生物是RDOC形成的主要因素,提出微型生物碳泵(microbial carbon pump)理论框架。
从微生物可利用性角度,可以粗略地将DOC库划分为微生物可以利用的DOC (biodegradable DOC,BDOC)和微生物难以利用的DOC (即RDOC)。在实验操作上,可以通过测定BDOC的量而评估RDOC的量。海洋BDOC的测定通常通过对在一定条件下一段时间内DOC的消耗量进行评估[4-6]。基于长时间、高频率的监测体系中DOC浓度变化,通过体系中DOC起始、结束的差值及降解动力过程,可以计算出BDOC和RDOC的量。然而,BDOC测定面临若干实际问题。例如,“瓶子效应” (bottle effect)问题,即封闭培养体系的体积大小影响微生物的生长。尽管科研工作者认识到“瓶子效应”已有几十年,相关研究涉及培养体系大小对细菌和浮游植物的生长[7-10]、初级生产力[11-12]、微生物呼吸作用[13]等方面的影响。然而,“瓶子效应”现象在实验数据证据上没有取得共识。有研究认为,培养体系大小不同,会出现瓶子效应[7-8];也有研究认为,培养体系的比表面积不同不会对微生物的生长产生影响或者对微生物的作用有待研究和讨论[9-10]。Del Giorgio和Davis[14]总结1970–2002年间不同水体有机碳可利用性相关研究指出,在不同的研究中,实验的具体设置不一致(如实验周期、实验温度等),降低了不同研究之间的可比性。此外,在BDOC相关研究中,不同研究采用的培养体系构建方式(以一定比例将目标微生物与0.2 μm滤过液混合获得培养体系)不一致[5-6, 15-16],即与原位环境微生物相比较,不同研究中培养体系起始微生物群落经过不同程度稀释。然而,不同体系构建方式对BDOC测定的影响还不清楚。这些因素对BDOC评估的影响没有经过系统的评估,致使没有统一的可执行标准方法进行BDOC和RDOC的评估。
本研究从海洋RDOC研究需求出发,立足于BDOC方法研究,通过系统的对比实验,即过滤方式及滤膜对DOC污染的评估实验、瓶子效应评估实验、稀释梯度评估实验对BDOC定量研究中DOC样品采集方式、培养体系大小及体系构建方式等关键步骤进行验证,以期对BDOC这一重要生态环境指标测定中长期存在的方法学问题提出解决方案,并为制定海洋RDOC评估标准奠定基础。
1 材料和方法 1.1 实验设计 1.1.1 过滤方式及滤膜对DOC污染的评估实验:为评估不同材质滤膜及过滤方式对DOC的污染程度,我们选取了目前研究中常用的5种滤膜及3种过滤方式,探究不同组合对DOC浓度的影响。实验中使用的滤膜分别为GF/F膜(玻璃纤维材质,0.7 μm孔径,Whatman)、GF-75膜(玻璃纤维材质,0.3 μm孔径,Advantec)、聚四氟乙烯滤膜(0.2 μm孔径,Millipore;即PTFE膜)、聚碳酸酯滤膜(0.2 μm孔径,Millipore;即PC膜)和一次性小包装特氟龙滤器(HA)(特氟龙材质,0.2 μm孔径,Millipore);过滤方式包括在线过滤(一次性注射器+在线换膜过滤器)、30 kPa抽滤过滤和重力过滤。实验中,受试样品为不同DOC浓度的样品:Milli-Q水、近岸海水、Citromicrobium bathyomarinum JL354细菌培养液(JL354细菌经过RO培养基(在人工海水中添加1 g/L醋酸钠、1 g/L酵母提取物和1 g/L蛋白胨)[17]三级扩大培养,菌体离心并用生理盐水清洗后,悬浮于生理盐水中;备用)。
1.1.2 瓶子效应评估实验:将30 L厦门近岸海水采集到经盐酸浸泡预处理过的PC桶(以铝箔纸包裹做避光处理)中,运送到实验室后以预先清洗过的0.8 μm孔径的圆盘过滤器(Millipore)过滤以除去捕食者、颗粒物等;得到的滤液分装到5组形状相同、体积不同(30、60、120、240、480 mL)的Boston棕色玻璃瓶(德国CNW公司)中进行恒温黑暗培养(玻璃瓶原体积、装入滤液的体积和表面积体积比见表 1)。培养期间,分别在第0、0.5、1、2、3、5、7、14天进行DOC和细菌丰度检测,每次采样分别从各处理组取出2个平行培养瓶进行采样。
| Bottle size/mL | Filtrate volume/mL | Area-to-volume ratios/(cm-1) |
| 30 | 20 | 1.64 |
| 60 | 40 | 1.32 |
| 120 | 80 | 1.06 |
| 240 | 160 | 0.84 |
| 480 | 320 | 0.67 |
1.1.3 稀释梯度评估实验:
将30 L厦门近岸海水采集到经盐酸浸泡预处理过的PC桶(以铝箔纸包裹做避光处理)中,运送到实验室后以预先清洗过的0.8 μm大圆盘过滤以除去捕食者、颗粒物和非原核生物;将其中的12 L滤液继续进行0.2 μm过滤处理,得到基本除去原核生物的滤液;将得到的0.8 μm滤液和0.2 μm滤液按照5组不同的比例(表 2)分装到5组240 mL棕色玻璃瓶中进行恒温黑暗培养,每瓶装入混合滤液的总体积为160 mL。0.2 μm滤过液理论上不包含原位细菌而0.8 μm滤过液包含原位环境中大部分细菌,实验体系由0.2 μm和0.8 μm滤过液组成,二者混合相当于对原位细菌群落进行稀释。0%、25%、50%、75%、100%表示0.8 μm滤过液占总培养体系体积的百分比例。实验中,分别在第0、0.5、1、2、4、7、13、28天进行总有机碳(total organic carbon,TOC)和细菌丰度的采样。每次采样分别从各处理组分别取两个平行培养瓶进行采样,先进行TOC的采样,后进行细菌丰度的采样。
| Dilution ratio/% | 0.8 μm-filtrate volume/mL | 0.2 μm-filtrate volume/mL | Incubation volume/mL |
| 0 | 0 | 160 | 160 |
| 25 | 40 | 120 | 160 |
| 50 | 80 | 80 | 160 |
| 75 | 120 | 40 | 160 |
| 100 | 160 | 0 | 160 |
1.2 实验材料
实验中使用的塑料材质材料(如PC滤膜、PTFE滤膜、瓶盖、滤器)使用前,分别用去离子水和Milli-Q水各洗3次,然后在2 mol/L HCl浸泡24 h,换入新的2 mol/L HCl再次浸泡24 h,用Milli-Q水将酸洗净,(晾干)备用;DOC瓶垫片在酸泡前需于2% Micro洗涤剂(Cole Parmer公司)浸泡24 h;一次性小包装特氟龙滤器(HA)是独立密封包装的,使用前不做预处理;一次性注射器使用前用Milli-Q水和样品各润洗3遍;实验中GF-75膜和GF/F膜使用前,以铝箔纸包好放入马弗炉中高温灼烧(450 ℃、4 h),备用。
实验中使用的玻璃材质材料(如Boston棕色玻璃瓶、DOC瓶、移液管等),使用前刷洗干净后以自来水、蒸馏水和Milli-Q水各清洗3遍;清洗后于专用洁净台晾干,然后以铝箔纸包好放入马弗炉中高温灼烧(450 ℃、4 h),备用。
1.3 样品采集与测定 1.3.1 DOC样品的采集与测定:用移液管从培养瓶中取30 mL左右水样到DOC瓶中,一般采集2个平行样,每7个采样瓶留出一个空白瓶,在样品上机检测时作为测定系统空白的采样瓶使用。采集的样品立即放入–20 ℃冰柜中冷冻保存并在实验完成后尽快测定。
DOC的测定参考文献报道的方法[18]。简而言之,测定前,DOC样品自然解冻至室温,并以浓磷酸(色谱级)酸化至pH < 2;采用总有机碳分析仪TOC-VCPH (日本岛津公司)进行DOC测定,分析方法为高温催化氧化法;DOC测样时,从低浓度样品开始测定,每测定6个样品加测一个Milli-Q水,每测定12个样品加测一个深海水标准样品(Hansell laboratory)进行空白测定和质控;测定时设定进样体积为100 μL,每个样品进样3次,设置标准偏差 < 200 (峰面积),变异系数 < 2%。若超过标准偏差或者变异系数规定范围,仪器自动追加次数至测定达到仪器默认标准,最多不超过5次。DOC浓度通过扣除Milli-Q水的值,然后除以当天邻苯二甲酸氢钾标准曲线斜率而获得。
1.3.2 异养细菌丰度样品采集与测定:用移液枪取1.8 mL水样于2 mL冻存管内,加入20 μL 50%戊二醛,迅速混匀,避光固定15 min后于液氮中快速冷冻,然后放置于–80 ℃超低温冰箱中保存直至分析测定。
异养细菌丰度测定使用的仪器为美国Beckman Coulter公司生产的EPICS ALTRA 2型流式细胞仪,检测及分析方法见文献报道[19]。简而言之,样品进行检测时,先将样品置于37 ℃水浴锅中解冻;用移液枪移取990 μL样品于一次性小试管中,并加入10 μL 100×SYBR Green I染液,涡旋振荡混匀,室温下黑暗染色15 min;随后,加入10 μL 1 μm标准荧光小球(浓度为106个/mL)作为内参,涡旋混合均匀后上机检测。检测时调节样品流速在0.1–1.0 mL/h以内,使流式细胞仪采集速度在100–150个粒子/s,稳定15 s后,用流式细胞仪分析计数软件进行样品数据采集。
1.4 统计分析文中统计分析使用IBM SPSS25(SPSS Inc.,Chicago,IL,USA),P < 0.05时为具有统计意义。GraphPad Prsim 7的一阶幂指数函数(one phase exponential decay)用于模拟DOC利用曲线。
2 结果和分析 2.1 过滤方式及滤膜评估实验不同DOC样品经过不同过滤方式、滤膜后DOC浓度如图 1所示。对于Milli-Q水,相比较于抽滤过滤,在线过滤会造成相对较大的DOC的污染(5.7–8.1 μmol/L);在同一种过滤方式下,不同滤膜对DOC浓度的影响一致(图 1-A)。对于近岸海水,三种过滤方式、不同滤膜之间DOC浓度没有显著差异(单因素方差分析,P > 0.3);经过不同过滤方式、滤膜过滤后,海水样品DOC浓度为(120.2±1.5) μmol/L,与原位海水总有机碳浓度119.2 μmol/L相当(图 1-B)。从对DOC污染角度考虑,不同滤膜、过滤方式之间没有差别;然而,从过滤时间角度(PC膜、TPFF膜重力过滤时间过长而舍弃采集该样品),抽滤、在线过滤方式更快速。对于JL354纯菌菌液,在抽滤和重力过滤下,各种膜的过滤效果比较一致,且两种过滤方式下DOC没有显著差别(独立样本t检验,P > 0.3) (如图 1-C);在线过滤方式下,不同滤膜过滤的滤液DOC值显著低于其他过滤方式下的值,过滤效果较好(PTFE膜过滤组DOC浓度明显高于其他组,由于滤液中有大量的细胞,故而该组不考虑,如图 2-B所示)。
|
| 图 1 不同样品在不同过滤方式下经过不同滤膜后的DOC浓度 Figure 1 DOC concentrations of Milli-Q water (A), costal seawater of Xiamen, China(B) and JL354 culture(C) filtered through different membranes with different filtration methods. Error bar represent the standrad error calculated from two replicates. PC, PTFE, GF/F, GF-75, HA were the membranes used in this work. |

|
| 图 2 不同样品在不同过滤方式下经过不同滤膜后的细菌丰度 Figure 2 Bacterial abundance of coastal seawater (A) and JL354 bacterial culture(B) filtrates of different membranes and filtration methods. Error bar represent the standrad error calculated from two replicates. |
对于自然海水样品(图 2-A),在在线过滤和抽滤方式下,PC膜、PTFE膜及HA膜对细菌的过滤效率(93%–99%)高于GF/F膜、GF-75膜(40%–70%),这可能主要与滤膜的孔径有关。在重力过滤方式下,PC膜、PTFE膜过滤方式耗时较长(100 mL体积耗时1 h以上),不具应用前景而不做评估,GF/F膜和GF-75膜过滤效率相当。在三种过滤方式下,玻璃纤维材质滤膜在重力过滤及抽滤条件下的细菌过滤效率(55%–70%)较在线过滤方式下效率(40%–45%)高。对于JL354纯菌菌液(图 2-B),在不同过滤方式下,各种滤膜对细菌的过滤效率都达到99%以上;在线过滤方式下玻璃纤维膜滤过液中细菌丰度低于其他滤膜,而在抽滤过滤方式下各种滤膜滤过液中细菌丰度相当。在重力过滤方式下,GF/F膜、GF-75膜一致(PC膜、PTFE膜过滤方式耗时太久而不做考虑),且与其他过滤方式下玻璃纤维滤膜的过滤效率相当。
2.2 瓶子效应评估实验DOC起始浓度为(90.9±1.6) μmol/L,培养过程中的前3 d DOC快速消耗,随后保持相对恒定;培养结束时,不同体积大小培养体系的DOC为(84.5–86.9) μmol/L,DOC浓度变化不大(标准差为1.1,N=10) (图 3-A)。实验结束时,30 mL、60 mL体系DOC浓度高于120 mL、240 mL体系DOC浓度,无显著性差异(独立样本t检验,P=0.1);480 mL体系DOC终浓度为(84.4±0.2) μmol/L,显著低于其他组DOC浓度(86.3±0.9) μmol/L(单样本t检验,P=0.001),差别为(1.9±1.1) μmol/L,在仪器检测限(2 μmol/L)范围内(图 3-A)。
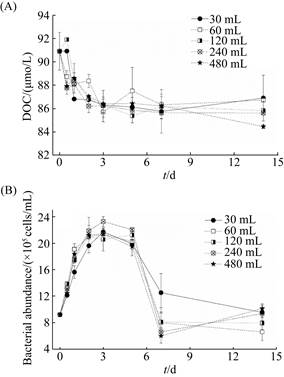
|
| 图 3 瓶子体积大小对细菌利用DOC (A)和细菌丰度(B)的影响 Figure 3 The effect of bottle size on DOC utilization (A) and bacterial abundance (B). Error bar represent the standrad error calculated from two replicates. |
细菌起始丰度为9.2×105细胞/mL,全部培养体系在培养过程中在前3 d细菌丰度快速升高并达到最大值,约为起始的2.4倍;第3–5天为稳定期,随后细菌丰度下降;从第7天开始趋于稳定,约为8.6×105细胞/mL,略低于起始值(图 3-B)。在对数生长期(0–3 d),各培养体系细菌生长速率为0.37–0.42 d-1,但各组之间没有显著性差异(单变量分析,P > 0.37),并且各组最大细菌丰度之间无显著性差异(单因素方差分析,P > 0.5)。
在不同培养体系中,细菌丰度、DOC浓度变化趋势一致。以30 mL培养体系为例,在实验前3 d,DOC浓度消耗量为4.6 μmol/L;细菌丰度升高至2.17×106细胞/mL,细菌单细胞含碳量按20 fg[20]计,约80%的被消耗的有机碳(3.6 μmol/L)被转化成细菌生物量。
2.3 稀释梯度评估实验由细菌丰度的结果看(图 4-B),各组的稀释梯度实际为1.6%、28.3%、55.7%、82.7%、100%,均接近于预设梯度。对于不同稀释梯度组,异养细菌丰度的变化规律相同:细菌丰度均先增加后减少,在第4天达到最高值,随后降低;实验结束时各组细菌丰度相当,稳定在9.7×105细胞/mL左右。在对数生长期,0%、25%、50%、75%、100%各实验组细菌生长速率分别为1.30、0.94、0.73、0.56和0.54 d-1。此外,0%、25%、50%、75%、100%各实验组所达到的最大值细菌丰度不相同:细菌起始丰度越高,所达到的最大细菌丰度值也越高,但丰度最大值相对于其起始丰度所增长的倍数(100.0、7.7、4.6、4.2、3.4倍)也越小。需要注意的是,在稀释体系中,细菌具有不同程度的适应期。

|
| 图 4 不同稀释程度对细菌利用DOC (A)和细菌生长(B)的影响 Figure 4 The effect of dilution on DOC utilization (A) and bacterial growth (B). Error bar represent the standrad error calculated from two replicates. |
各稀释梯度组监测期间DOC浓度变化趋势如图 4-A所示。0%组DOC起始浓度约为(80.2±1.4) μmol/L,较其他组(83.1±1.8 μmol/L)偏低;各组培养过程中DOC一直在消耗,培养结束时DOC的浓度为70.0–76.4 μmol/L;总体趋势上,起始细菌丰度越高,各时间点DOC浓度越低。在28 d的培养期间,各个处理组消耗的DOC各不相同,0%、25%、50%、75%和100%的实验组各消耗的DOC分别为2.7、7.8、10.9、8.6和14.6 μmol/L。
3 讨论 3.1 过滤方式及滤膜对制备DOC样品的影响当前有机碳相关的研究中,使用的滤膜有GF/F滤膜[21-22]、针孔聚砜过滤器(polysulfone filter)[23]、PC滤膜[24-26],而样品过滤方式包括真空抽滤方式、重力过滤方式及在线过滤器方式。然而,目前没有关于不同滤膜、过滤方式在制备有机碳样品时的表现的系统评估。
对于Milli-Q水,在真空抽滤下不同滤膜过滤的结果看,Milli-Q经滤膜过滤后DOC值之间波动较小(标准差为0.7,N=7) (图 1-A);比过滤前Milli-Q水DOC高0.8–1.8 μmol/L,在仪器检测限(2 μmol/L左右)的范围内。因此,本研究中DOC的检测及相关的耗材器具的准备过程没有引入污染,相关操作合理。此外,在线过滤器组DOC值较抽滤组的值明显偏高,但在较高浓度的自然海水样品中不同过滤方式、滤膜处理下没有明显差别(图 1-B),这种现象可能是由于使用的一次性注射器在过滤的过程中有少量有机碳析出;这说明一次性注射器组成的在线过滤方式可能不适合低浓度DOC样品的采集,但是对高浓度DOC样品的影响可以忽略。
对于POC和DOC浓度较高的近岸海水,过滤方式、滤膜对滤液的DOC浓度没有显著差异(图 1-B);实验中滤膜孔径范围内,不同滤膜过滤也不会改变样品中各粒径DOC分子的丰度、组成[27]。由于近岸海水中细菌含量相对应的有机碳含量较低,约为2 μmol/L (以细菌丰度为106细胞/mL,细菌单细胞含碳量约20 fg碳/细胞计),所以过滤时细胞破裂对滤液DOC的量的影响可以忽略;在细菌过滤效率上看,孔径较小的PC膜、PTFE膜和HA一次性过滤器过滤效率较高(大于95%),但还是仍有一小部分细菌通过;而对于与体系预处理粒径(0.8 μm)相当的GF/F滤膜,也过滤掉了超过50%的细菌。
对于室内培养的纯菌液样品,细菌丰度为(1.1±0.3)×108细胞/mL,是近岸海水的100倍左右,远高于自然水体,且细菌生物量对应有机碳含量高(约187 μmol/L),在过滤时要考虑细胞破裂及滤过对滤液DOC的影响。与菌液总有机碳含量相比,滤液DOC值都有较大下降,这主要是因为菌液中含有细菌、胞外分泌物或较多的细胞碎片等在过滤的过程中被截留。
从3类不同DOC浓度、细菌含量的样品DOC结果看,真空抽滤方式制备的DOC样品质量稳定,细菌移除效率高,污染小,可广泛用于不同环境条件下采集不同浓度DOC样品;重力过滤方式也能获得与真空过滤类似的结果,然而多种因素的影响(如水体中颗粒的含量、微生物的丰度等)会直接影响过滤的时间而使重力过滤方式的使用受到限制,因而重力过滤方式可以应用于开阔大洋等水质环境好的样品;在线过滤方式的使用主要问题是需要谨慎处理所用的过滤系统,避免带来污染。需要注意的是,有研究指出玻璃纤维材质滤膜会吸附DOC[28-29],这部分DOC往往会被忽略,而导致高估微生物对DOC的利用。
此外,对于原位海水和纯细菌培养液,尽管GF-75滤膜(滤膜孔径约0.3 μm)与GF/F滤膜(滤膜孔径约0.7 μm)孔径较大,但二者在不同过滤方式下截留的细菌相当(图 2)。这说明玻璃纤维材质滤膜可能会吸附细菌,与Lee等发现GF/F滤膜能截体积较小于滤膜孔径的细菌的现象一致[30]。因此,滤膜对细菌过滤效果不仅与细菌的体积、形状有关[30-32],还与滤膜的材质有关。在过滤过程中,特定形态的细菌会被相对富集,即细菌群落结构在过滤过程中会发生变化。由于微生物群落结构对DOC利用及分子组成会产生影响[33-34],因此体系构建过程中滤膜的选择可能会对微生物利用DOC产生影响。
在操作上,一般认为GF/F膜孔径是颗粒态与非颗粒态有机物的分界线。因此,我们认为在BDOC的定量研究建立体系时采用0.8 μm左右孔径的滤膜过滤获得培养体系,可以排除颗粒态有机物对DOC利用量、速率等的影响。综合上述过滤方式、滤膜孔径材质评估实验的结果,在建立BDOC研究培养体系时,应采用抽滤方式结合非玻璃纤维材质滤膜对原位海水进行过滤;而在对体系进行DOC采样时,由于培养体系中细菌生物量对应的POC量都占DOC中很小的部分(以瓶子大小评估实验和梯度稀释评估实验中最高细菌丰度约2.0×106细胞/mL和细菌单细胞含碳量按20 fg计,细菌生物量(即POC)相当于4 μmol/L有机碳),不建议再进行过滤操作,可以避免可能带来的污染而掩盖BDOC的真实水平;另一方面体系建立时已经进行了过滤操作,水体中的颗粒物质含量已经非常低,水体中的总有机碳浓度基本等同于DOC浓度。
3.2 瓶子效应瓶子效应理论认为较小的比表面积容器可以为细菌提供较好的生长条件,如因富集而产生的较高浓度营养物质、附着场所及颗粒物降解的场所等[42],从细菌的生长角度来为瓶子效应提供理论支撑。然而,近100年来的实验研究并没有得到统一的认识。对现有瓶子效应代表性研究工作进行分析发现,支持的实验数据主要来自于20世纪40年代等,使用的检测手段主要是细菌平板计数、监测培养体系氧气消耗等[7, 42]。因此,检测到的细菌为总细菌类群中的一部分特殊类群,如可培养细菌类群(其比例占当前分子生物学技术鉴定到总细菌类群的不到1%)或具有吸附特性等。近年来,Hammes等[9]利用现代微生物学研究技术对瓶子效应研究,以3种不同来源的高DOC浓度的淡水为研究对象,采用3种不同方法(流式细胞仪计数、传统平板技术及ATP)检测细胞丰度的动态变化,结果未发现瓶子效应的存在。除本研究外,大量不支持瓶子效应的实验研究也有报道(表 3)。
| Water source | Bottle size/mL | Used container | Microorganisms | Bottle effect | Reference |
| The Scripps Institution Pier | 10, 100, 1000, 10000 | Glass-stoppered Pyrex bottles; pipettes; test tube | In situ marine bacteria | YES | [7] |
| River water (oligotrophic), drinking water pilot plant (eutrophic) | 20, 40, 100, 250, 500, 1000 | Glass bottles | Freshwater microorganisms, pure bacteria | NO | [9] |
| North equatorial current | 30, 300, 3800 | Plastic container | In situ marine phytoplankton | YES | [11] |
| Off Scripps Pier | 25, 150, 600 | Beaker, scintillation vials | 3 μm filtered seawater sample | NO | [8] |
| The Menai Bridge Pier, North Wales | 135, 295, 2290 | Pyrex bottles | In situ marine phytoplankton | NO | [12] |
| The Toralla dock, Ria de Vigo, Spain |
50, 125, 570 | Borosilicate glass bottles | 200 μm filtered marine plankton | NO | [13] |
| The freshwater tidal zone of the Guadiana estuary | 500, 1000, 2000, 8000 | Polycarbonate bottles | 100 μm filtered & unfiltered freshwater phytoplankton | NO | [10] |
Hammes等[9]研究中使用能涵盖当前研究中常用6种不同体积的瓶子,但培养体系占使用瓶子容积的比例过高且不一致,培养时间也较短(5 d)。本研究中,通过严格控制可能影响微生物生长的外界因素,使用同一公司生产的形状相同但体积不同(比表面积不同)的棕色瓶子,以近岸海水为研究对象,分装样品至容器2/3体积处,监测不同瓶子大小对细菌生长、DOC利用做了评估。通过比较不同大小培养体系DOC、细菌丰度(图 3),不同大小培养体系之间细菌的生长、DOC利用量和速率并不存在显著性差异,即本研究中在严格控制实验条件的情况下并未发现“瓶子效应”的存在,与Hammes等研究结果一致。需要注意的是,在240 mL和480 mL培养体系中细菌丰度在7 d到14 d有较大升高,与其他大小培养体系变化趋势不同(图 3)。我们不确定引起这种变化的原因,但是由于对应DOC浓度波动不大且不同大小体系之间BDOC和RDOC差别不大(图 5;见下文讨论),因此我们认为培养体积大小在30–480 mL范围内时,培养体积大小对DOC利用的影响不存在或者较小。

|
| 图 5 瓶子效应实验中不同大小培养体系中BDOC、RDOC的估算 Figure 5 The estimation of BDOC and RDOC in bottles size effect experiment using one phase exponential decay model. |
多数科学家认为“瓶子效应”现象存在,然而在相关研究中并未体现出来(表 3)。当前,“瓶子效应”评估实验研究中体积设定范围在20 mL–8 L以内(表 3),没有设置足够大的体积范围,这可能是多数研究中没有发现“瓶子效应”现象的原因。因此,我们建议在后续研究中,扩大研究体积范围,继续探究“瓶子效应”问题。
3.3 培养实验体系构建方式中稀释效应的影响在最初的测定BDOC相关研究中,是以纯菌株在培养液中的生长情况来判定的[36]。一些研究相继指出这种方法的不足并进一步提出了将原位海水在过滤除菌后再以一定比例接入原位细菌进行培养的方法,逐步得到了大家的认可[4, 16]。原位海水的过滤孔径一般在0.2–3.0 μm不等,其目的是去除捕食压力等影响[5, 43]。有的研究中为了减少过滤对细菌活性的影响而直接将原位海水作为接种液,但也有研究指出如果做短期培养,过滤的影响可以忽略[8, 44]。总之,体系建立过程中获得菌液和滤液的过滤孔径的选择是基于研究目的而定,都是尽量获得与原位情况相类似的细菌群落和环境因子。
目前有机碳相关的培养实验研究中,通常是将目标微生物接种至特定的培养体系中(表 4),接种比例为0.5%–10% (V/V),构建体系方式可以分为3大类:(1)将一定孔径过滤后获得的微生物接种至原位海水经过0.2μm过滤的滤液中[38, 45-46],该方法是研究中使用最广泛的一种;(2)将微生物接种至与原位环境类似的人工海水中[24-25, 40];(3)将制备好的DOM添加到原位海水(或经一定孔径过滤的滤液)中[47-48]。这等同于探究经过稀释后的目标微生物对DOC的利用、转化。然而,稀释作用对体系中异养细菌生长及DOC利用的影响仍然不清楚。
| Water type | Inoculum | Inoculum ratio | Culture system | Culture volume | Duration/d | References |
| River, forest, urban sewage and seawater |
< 2.0 μm | 1% | 0.2 μm filtrate | 500 mL | 10–30 | [4, 16, 35] |
| Waste water, drinking water | Single bacteria strain | – | Heat-treated water | – | – | [36] |
| Coastal ocean, Denmark | < 1.2 μm | 5% (V/V) | GF/F filtrate | 1 L glass bottle | 150 | [37] |
| Western Arctic Ocean | < 1.2 μm | 1:9 (V/V) | 0.2 μm filtrate | 1 L PP bottles | 14 | [38] |
| Marsh-dominated estuary | 0.2–2.7 μm | Pieces filter added | 0.2 μm filtrate | 50 mL | 70 | [39] |
| – | < 0.7 μm | 2% (V/V) | Artificial seawater | – | 560 | [40] |
| – | < 200 μm | 1:99 (V/V) | Artificial seawater | 10 L glass bottles | 3 years | [25] |
| – | 0.2–1.5 μm | 1:200 (V/V) | Artificial seawater | 50 L HDPE bottles | 29 | [24] |
| Sargasso Sea | < 0.8 μm | 10%, 20%, 30% | 0.2 μm filtrate | 10 L PC bottles | 4.5–7.5 | [5] |
| Pacific Ocean, Indian Ocean | – | – | GF/F filtrate | Glass ampoule | 30 | [41] |
不稀释的体系包含更接近于原位环境中的微生物群落结构,能更真实地反映海洋生物群落对DOC的利用、转化。在稀释效应评估中,尽管培养体积、条件等因素一致,但经0.2 μm滤过液稀释后的体系中异养细菌最高丰度仍然低于未经稀释体系的细菌丰度且稀释程度越高异养细菌丰度越低。这说明稀释作用除了降低起始细菌丰度外,更重要的是可能增加了细菌生长压力(如病毒裂解作用)。在稀释的体系中,微生物对DOC利用量低于未经稀释的体系且稀释程度越高DOC利用量越低,可能的原因是体系中细菌丰度相对较低而导致微生物对有机碳转化、利用量降低。因此,在进行BDOC和RDOC定量测定时,我们建议利用未经过稀释的体系进行实验。
3.4 BDOC和RDOC研究中的上行控制和下行控制作用在纯培养实验中[49-50],实验前期DOC浓度快速下降随后在较长时间内保持稳定;对应的细菌丰度持续升高并在DOC浓度达到最低时达到最高随后保持稳定,说明在没有捕食压力、病毒裂解作用下,在底物浓度较低或者环境容量达到最大后,细菌丰度会在较长一段时间内继续维持最高值。在本研究的稀释实验中,在不同稀释程度即不同捕食压力下,细菌丰度下降的起始点及稳定后细菌丰度接近,说明细菌丰度下降的原因不是捕食压力而是病毒裂解作用。在稀释实验中,0.2 μm滤过液(0%组)中细菌丰度在达到最大值后保持稳定且与其他一致不同稀释比例组后期细菌丰度保持一致(9.7×105细胞/mL),这可能是细菌生长与病毒裂解相互作用的结果。尽管各组DOC浓度在后期接近且稳定,该DOC浓度是细菌利用环境DOC与病毒裂解细胞释放DOC的动态结果。
综上所述,本研究中瓶子效应评估实验和稀释效应实验使用0.8 μm过滤滤液可以有效减少下行控制效应对评估BDOC和RDOC的影响,培养体系中细菌群落动态变化主要受到体系中微生物可利用资源、病毒等上行控制因子的影响。
3.5 BDOC和RDOC研究中实验周期等问题关于培养时间,总的来说有数天、数周或数月的时间[14]。本研究中,DOC浓度在1–3 d内快速消耗;细菌丰度在0–7 d内动态变化,随后保持相对稳定(图 3、4),DOC、细菌丰度变化趋势与文献报道一致[24, 34, 51]。Del Giorgio和Davis[14]总结1970–2002年间自然水体(包括河流、湖泊、河口、海洋等)BDOC相关研究指出,1–3 d内BDOC占DOC总量约26%,10–15 d约34%。Vonk等[52]系统总结了环极地BDOC相关研究,系统提出了一套适用于极地BDOC研究的操作方法,其中建议环极地BDOC研究周期为28 d。结合本研究和文献报道中DOC降解和细菌动态变化规律,我们认为BDOC研究时间周期应该在2–4周;考虑到细菌动态变化规律,我们建议在实验第1周内应加大采样频率,不仅可以探究BDOC的量,还可以通过估算细菌的生长速率反映BDOC的生物转化率及质量。
Del Giorgio和Davis[14]在总结BDOC研究时指出,培养温度、营养盐添加与否等也是影响BDOC的因素。对海洋环境中的BDOC进行定量研究的目的是通过BDOC的定量来反映整体环境情况及BDOC占总体有机碳比例。因此,实验设置应与原位条件一致(包括温度、营养盐状态),实验结果才能反映水体BDOC真实状态。
3.6 RDOC的定量评估DOC库由不同周转周期的碳库组成,从几小时到几千年[53]。由于时间限制,难以直接通过实验的方法区分不同DOC库中每个碳库的量。瓶子培养方法可以获得DOC浓度随时间的变化,进而可以直接获得一定时间范围内BDOC的含量。同时,根据监测获得的BDOC或者实验中剩余DOC的量可以估测水体RDOC的含量。目前,对培养实验的时间序列DOC数据常用的分析方法有线性回归分析[54]和一阶幂指数(图 5)或者一阶指数函数[6, 14],可以用来估计DOC的利用速率或者BDOC、RDOC的含量。
以瓶子效应评估实验为例,为评估厦门近岸海水中BDOC、RDOC水平,对不同大小培养体系DOC浓度与时间进行一阶幂指数拟合(拟合公式为:DOC=BDOC·e-kt+RDOC),结果如表 5所示。BDOC的利用主要在实验开始前1.5–2.5 d (半周期T/2为0.6–1.3 d),与Del Giorgio和Davis[14]报道一致;不同大小培养体系之间BDOC、RDOC量接近,分别为4.0–6.2 μmol/L、85.5–86.7 μmol/L。因此,不同大小培养体系对BDOC、RDOC的评估没有影响。
| Best-fit values | 30 mL | 60 mL | 120 mL | 240 mL | 480 mL |
| BDOC | 5.27 | 4.03 | 6.22 | 4.87 | 4.75 |
| k | 1.02 | 1.01 | 0.64 | 1.11 | 0.53 |
| RDOC | 86.15 | 86.71 | 85.6 | 85.79 | 85.47 |
| T/2 | 0.68 | 0.69 | 1.1 | 0.62 | 1.3 |
| R2 | 0.84 | 0.81 | 0.88 | 0.94 | 0.85 |
| Note: T/2 stand for the half-life of DOC decay. | |||||
4 结论
在全球气候变化的大背景下,海洋作为全球重要的碳储库和气候调节器的作用受到越来越多的关注,海洋碳循环和碳汇的研究也显得尤为重要和迫切。随着MCP理论框架的提出及RDOC形成机制的认识,海洋微生物在海洋碳循环中的作用得到了极大的重视,RDOC评估也成为海洋碳汇研究的重要突破口。然而,目前海洋RDOC评估没有统一可执行的标准评价方法,制约了人们对海洋储碳能力的认识及全球尺度RDOC研究。
本文系统评估BDOC研究中存在的不确定因素,结合本研究结果及文献总结分析,我们建议的BDOC或者RDOC评估方法如下。
(1) 对于研究对象,获得目标样品后,在尽可能短的时间以0.8μm聚碳酸酯材质滤膜(预先以盐酸清洗)过滤(尽量避免使用玻璃纤维材质滤膜)。过滤系统中,对于需要接触样品部分,能用盐酸清洗的部分,预先以盐酸浸泡清洗;不能盐酸浸泡部分,实验前分别以Milli-Q水和目标样品清洗。滤液保存在黑暗、冷藏环境中备用;如果用于评估BDOC或者LDOC含量,建议立即开展原位实验。
(2) 分装滤液至40 mL棕色DOC瓶(预先450 ℃,6 h处理)中,于黑暗、原位温度条件下培养。实验中,拧松瓶盖并一定时间间隔摇晃一次瓶身以避免瓶内缺氧。我们建议的采样时间点t=0、1、2、3、5、7、14、28 d,每个时间点设置3个生物学平行,同时测定TOC (也即DOC)和细菌丰度。在特定的时间点采集细菌丰度后,以色谱级或以上试剂级别盐酸固定样品至pH < 2,于4 ℃环境下保存,在尽可能短的时间内完成TOC样品分析。
此外,需要特别指出的是,理想的RDOC评估方法应该采用尽量模拟自然环境的培养体系,如尽量大的培养体积和尽量长的培养时间。但RDOC的检测需要在野外现场(如科考航次)进行,培养体积和培养时间受限。因此,从实际工作的可操作性出发,本研究检验了相对较小的培养体系(30–480 mL)和较短的培养时间(14–28 d)。在以上培养条件一致的情况下获得的BDOC或者RDOC数据之间具有可比性,但并不等同于BDOC和RDOC的绝对定量。
| [1] | Hansell DA, Carlson CA, Repeta DJ, Schlitzer R. Dissolved organic matter in the ocean a controversy stimulates new insights. Oceanography, 2009, 22(4): 202-211. DOI:10.5670/oceanog.2009.109 |
| [2] | Friedlingstein P, Jones MW, O'Sullivan M, Andrew RM, Hauck J, Peters GP, Peters W, Pongratz J, Sitch S, LeQuéré C, Bakker DCE, Canadell JG, Ciais P, Jackson RB, Anthoni P, Barbero L, Bastos A, Bastrikov V, Becker M, Bopp L, Buitenhuis E, Chandra N, Chevallier F, Chini LP, Currie KI, Feely RA, Gehlen M, Gilfillan D, Gkritzalis T, Goll DS, Gruber N, Gutekunst S, Harris I, Haverd V, Houghton RA, Hurtt G, Ilyina T, Jain AK, Joetzjer E, Kaplan JO, Kato E, Klein Goldewijk K, Korsbakken JI, Landschützer P, Lauvset SK, Lefèvre N, Lenton A, Lienert S, Lombardozzi D, Marland G, McGuire PC, Melton JR, Metzl N, Munro DR, Nabel JEMS, Nakaoka SI, Neill C, Omar AM, Ono T, Peregon A, Pierrot D, Poulter B, Rehder G, Resplandy L, Robertson E, Rödenbeck C, Séférian R, Schwinger J, Smith N, Tans PP, Tian HQ, Tilbrook B, Tubiello FN, Van Der Werf GR, Wiltshire AJ, Zaehle S. Global carbon budget 2019. Earth System Science Data, 2019, 11(4): 1783-1838. DOI:10.5194/essd-11-1783-2019 |
| [3] | Jiao NZ, Herndl GJ, Hansell DA, Benner R, Kattner G, Wilhelm SW, Kirchman DL, Weinbauer MG, Luo TW, Chen F, Azam F. Microbial production of recalcitrant dissolved organic matter:long-term carbon storage in the global ocean. Nature Reviews Microbiology, 2010, 8(8): 593-599. DOI:10.1038/nrmicro2386 |
| [4] | Servais P, Anzil A, Ventresque C. Simple method for determination of biodegradable dissolved organic carbon in water. Applied and Environmental Microbiology, 1989, 55(10): 2732-2734. DOI:10.1128/AEM.55.10.2732-2734.1989 |
| [5] | Carlson CA, Ducklow HW. Growth of bacterioplankton and consumption of dissolved organic carbon in the Sargasso Sea. Aquatic Microbial Ecology, 1996, 10(1): 69-85. |
| [6] | Lønborg C, Álvarez-Salgado XA, Davidson K, Martínez-García S, Teira E. Assessing the microbial bioavailability and degradation rate constants of dissolved organic matter by fluorescence spectroscopy in the coastal upwelling system of the Ría de Vigo. Marine Chemistry, 2010, 119(1/4): 121-129. DOI:10.1016/j.marchem.2010.02.001 |
| [7] | Zobell CE, Anderson DQ. Observations on the multiplication of bacteria in different volumes of stored sea water and the influence of oxygen tension and solid surfaces. The Biological Bulletin, 1936, 71(2): 324-342. DOI:10.2307/1537438 |
| [8] | Fuhrman JA, Azam F. Bacterioplankton secondary production estimates for coastal waters of British Columbia, Antarctica, and California. Applied and Environmental Microbiology, 1980, 39(6): 1085-1095. DOI:10.1128/AEM.39.6.1085-1095.1980 |
| [9] | Hammes F, Vital M, Egli T. Critical evaluation of the volumetric "Bottle Effect" on microbial batch growth. Applied and Environmental Microbiology, 2010, 76(4): 1278-1281. |
| [10] | Nogueira P, Domingues RB, Barbosa AB. Are microcosm volume and sample pre-filtration relevant to evaluate phytoplankton growth?. Journal of Experimental Marine Biology and Ecology, 2014, 461: 323-330. DOI:10.1016/j.jembe.2014.09.006 |
| [11] | Gieskes WWC, Kraay GW, Baars MA. Current 14C methods for measuring primary production:gross underestimates in oceanic waters. Netherlands Journal of Sea Research, 1979, 13(1): 58-78. DOI:10.1016/0077-7579(79)90033-4 |
| [12] | Fogg GE, Calvario-Martinez O. Effects of bottle size in determinations of primary productivity by phytoplankton. Hydrobiologia, 1989, 173(2): 89-94. DOI:10.1007/BF00015518 |
| [13] | Elena García-Martín E, Serret P, Pérez-Lorenzo M. Testing potential bias in marine plankton respiration rates by dark bottle incubations in the NW Iberian shelf:incubation time and bottle volume. Continental Shelf Research, 2011, 31(5): 496-506. DOI:10.1016/j.csr.2010.07.006 |
| [14] | Del Giorgio PA, Davis J. Patterns in dissolved organic matter lability and consumption across aquatic ecosystems//Findlay SEG, Sinsabaugh RL. Aquatic Ecosystems: Interactivity of Dissolved Organic Matter. Burlington: Academic Press, 2003: 399-424. |
| [15] | Ogura N. Rate and extent of decomposition of dissolved organic matter in surface seawater. Marine Biology, 1972, 13(2): 89-93. DOI:10.1007/BF00366559 |
| [16] | Servais P, Billen G, Hascoët MC. Determination of the biodegradable fraction of dissolved organic matter in waters. Water Research, 1987, 21(4): 445-450. DOI:10.1016/0043-1354(87)90192-8 |
| [17] | Yurkov VV, Krieger S, Stackebrandt E, Beatty JT. Citromicrobium bathyomarinum, a novel aerobic bacterium isolated from deep-sea hydrothermal vent plume waters that contains photosynthetic pigment-protein complexes. Journal of Bacteriology, 1999, 181(15): 4517-4525. DOI:10.1128/JB.181.15.4517-4525.1999 |
| [18] |
Lin JR, Li XL, Chen WF, Huang W, Lu ZM, Cheng SW, Tang TT, Dai MH. Sampling and determination of marine dissolved organic carbon. Oceanologia et Limnologia Sinica, 2008, 39(6): 604-611.
(in Chinese) 林建荣, 李骁麟, 陈蔚芳, 黄伟, 鲁中明, 程赛伟, 唐甜甜, 戴民汉. 海洋溶解有机碳——从采样到分析. 海洋与湖沼, 2008, 39(6): 604-611. DOI:10.3321/j.issn:0029-814X.2008.06.010 |
| [19] | Marie D, Partensky F, Jacquet S, Vaulot D. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I. Applied and environmental microbiology, 1997, 63(1): 186-193. |
| [20] | Fukuda R, Ogawa H, Nagata T, Koike I. Direct determination of carbon and nitrogen contents of natural bacterial assemblages in marine environments. Applied and Environmental Microbiology, 1998, 64(9): 3352-3358. DOI:10.1128/AEM.64.9.3352-3358.1998 |
| [21] | Dinasquet J, Kragh T, Schrøter ML, Søndergaard M, Riemann L. Functional and compositional succession of bacterioplankton in response to a gradient in bioavailable dissolved organic carbon. Environmental Microbiology, 2013, 15(9): 2616-2628. DOI:10.1111/1462-2920.12178 |
| [22] | Zhao Z, Gonsior M, Luek J, Timko S, Ianiri H, Hertkorn N, Schmitt-Kopplin P, Fang XT, Zeng QL, Jiao NZ, Chen F. Picocyanobacteria and deep-ocean fluorescent dissolved organic matter share similar optical properties. Nature Communications, 2017, 8: 15284. DOI:10.1038/ncomms15284 |
| [23] | Poulin BA, Ryan JN, Aiken GR. Effects of iron on optical properties of dissolved organic matter. Environmental Science & Technology, 2014, 48(17): 10098-10106. |
| [24] | Lechtenfeld OJ, Hertkorn N, Shen Y, Witt M, Benner R. Marine sequestration of carbon in bacterial metabolites. Nature Communications, 2015, 6: 6711. DOI:10.1038/ncomms7711 |
| [25] | Osterholz H, Niggemann J, Giebel HA, Simon M, Dittmar T. Inefficient microbial production of refractory dissolved organic matter in the ocean. Nature Communications, 2015, 6: 7422. DOI:10.1038/ncomms8422 |
| [26] | Arrieta JM, Mayol E, Hansman RL, Herndl GJ, Dittmar T, Duarte CM. Dilution limits dissolved organic carbon utilization in the deep ocean. Science, 2015, 348(6232): 331-333. DOI:10.1126/science.1258955 |
| [27] | Xu HC, Guo LD. Molecular size-dependent abundance and composition of dissolved organic matter in river, lake and sea waters. Water Research, 2017, 117: 115-126. DOI:10.1016/j.watres.2017.04.006 |
| [28] | Liu ZF, Stewart G, Kirk Cochran J, Lee C, Armstrong RA, Hirschberg DJ, Gasser B, Miquel JC. Why do POC concentrations measured using Niskin bottle collections sometimes differ from those using in-situ pumps?. Deep Sea Research Part I:Oceanographic Research Papers, 2005, 52(7): 1324-1344. DOI:10.1016/j.dsr.2005.02.005 |
| [29] | Morán X, Gasol JM, Arin L, Estrada M. A comparison between glass fiber and membrane filters for the estimation of phytoplankton POC and DOC production. Marine Ecology Progress Series, 1999, 187: 31-41. DOI:10.3354/meps187031 |
| [30] | Lee S, Kang YC, Fuhrman JA. Imperfect retention of natural bacterioplankton cells by glass fiber filters. Marine Ecology Progress Series, 1995, 119: 285-290. DOI:10.3354/meps119285 |
| [31] | Wang YY, Hammes F, Düggelin M, Egli T. Influence of size, shape, and flexibility on bacterial passage through micropore membrane filters. Environmental Science & Technology, 2008, 42(17): 6749-6754. |
| [32] | Wang YY, Hammes F, Boon N, Egli T. Quantification of the filterability of freshwater bacteria through 0.22, and 0.1μm pore size filters and shape-dependent enrichment of filterable bacterial communities. Environmental Science & Technology, 2007, 41(20): 7080-7086. |
| [33] | Kujawinski EB, Longnecker K, Barott KL, Weber RJM, Kido Soule MC. Microbial community structure affects marine dissolved organic matter composition. Frontiers in Marine Science, 2016, 3: 45. DOI:10.3389/fmars.2016.00045 |
| [34] | Logue JB, Stedmon CA, Kellerman AM, Nielsen NJ, Andersson AF, Laudon H, Lindström ES, Kritzberg ES. Experimental insights into the importance of aquatic bacterial community composition to the degradation of dissolved organic matter. The ISME Journal, 2016, 10(3): 533-545. DOI:10.1038/ismej.2015.131 |
| [35] | Huck PM, Fedorak PM, Anderson WB. Methods for determining assimilable organic carbon and some factors affecting the Van Der Kooij Method. Ozone:Science & Engineering, 1990, 12(4): 377-392. |
| [36] | van der Kooij D, Visser A, Hijnen WAM. Determining the concentration of easily assimilable organic carbon in drinking water. Journal-American Water Works Association, 1982, 74(10): 540-545. DOI:10.1002/j.1551-8833.1982.tb05000.x |
| [37] | Lønborg C, Søndergaard M. Microbial availability and degradation of dissolved organic carbon and nitrogen in two coastal areas. Estuarine, Coastal and Shelf Science, 2009, 81(4): 513-520. DOI:10.1016/j.ecss.2008.12.009 |
| [38] | Davis J, Benner R. Quantitative estimates of labile and semi-labile dissolved organic carbon in the western Arctic Ocean:a molecular approach. Limnology and Oceanography, 2007, 52(6): 2434-2444. DOI:10.4319/lo.2007.52.6.2434 |
| [39] | Medeiros PM, Seidel M, Gifford SM, Ballantyne F, Dittmar T, Whitman WB, Moran MA. Microbially-mediated transformations of estuarine dissolved organic matter. Frontiers in Marine Science, 2017, 4: 69. DOI:10.3389/fmars.2017.00069 |
| [40] | Ogawa H, Amagai Y, Koike I, Kaiser K, Benner R. Production of refractory dissolved organic matter by bacteria. Science, 2001, 292(5518): 917-920. DOI:10.1126/science.1057627 |
| [41] | Ogawa H, Kogure K, Kanda J, Hashihama F, Suzumura M. Detailed variations in bioactive elements in the surface ocean and their interaction with microbiological processes//Uematsu M, Yokouchi Y, Watanabe YW, Takeda S, Yamanaka Y. Western Pacific Air-Sea Interaction Study. Tokyo: TERRAPUB, 2014. 10.5047/w-pass.a03.002 |
| [42] | Zobell CE. The effect of solid surfaces upon bacterial activity. Journal of Bacteriology, 1943, 46(1): 39-56. DOI:10.1128/JB.46.1.39-56.1943 |
| [43] | Lønborg C, Davidson K, Álvarez-Salgado XA, Miller AEJ. Bioavailability and bacterial degradation rates of dissolved organic matter in a temperate coastal area during an annual cycle. Marine Chemistry, 2009, 113(3/4): 219-226. |
| [44] | Carlson CA, Giovannoni SJ, Hansell DA, Goldberg SJ, Parsons R, Otero MP, Vergin K, Wheeler BR. Effect of nutrient amendments on bacterioplankton production, community structure, and DOC utilization in the northwestern Sargasso Sea. Aquatic Microbial Ecology, 2002, 30(1): 19-36. |
| [45] | Jørgensen L, Lechtenfeld OJ, Benner R, Middelboe M, Stedmon CA. Production and transformation of dissolved neutral sugars and amino acids by bacteria in seawater. Biogeosciences, 2014, 11(19): 5349-5363. DOI:10.5194/bg-11-5349-2014 |
| [46] | Davis J, Kaiser K, Benner R. Amino acid and amino sugar yields and compositions as indicators of dissolved organic matter diagenesis. Organic Geochemistry, 2009, 40(3): 343-352. DOI:10.1016/j.orggeochem.2008.12.003 |
| [47] | Sharma AK, Becker JW, Ottesen EA, Bryant JA, Duhamel S, Karl DM, Cordero OX, Repeta DJ, DeLong EF. Distinct dissolved organic matter sources induce rapid transcriptional responses in coexisting populations of Prochlorococcus, Pelagibacter and the OM60 clade. Environmental Microbiology, 2014, 16(9): 2815-2830. DOI:10.1111/1462-2920.12254 |
| [48] | Tada Y, Suzuki K. Changes in the community structure of free-living heterotrophic bacteria in the open tropical Pacific Ocean in response to microalgal lysate-derived dissolved organic matter. FEMS Microbiology Ecology, 2016, 92(7): fiw099. DOI:10.1093/femsec/fiw099 |
| [49] | Gruber DF, Simjouw JP, Seitzinger SP, Taghon GL. Dynamics and characterization of refractory dissolved organic matter produced by a pure bacterial culture in an experimental predator-prey system. Applied and environmental microbiology, 2006, 72(6): 4184-4191. DOI:10.1128/AEM.02882-05 |
| [50] | Goto S, Tada Y, Suzuki K, Yamashita Y. Production and reutilization of fluorescent dissolved organic matter by a marine bacterial strain, Alteromonas macleodii. Frontiers in Microbiology, 2017, 8: 507. |
| [51] | Zheng Q, Chen Q, Cai RH, He C, Guo WD, Wang Y, Shi Q, Chen C, Jiao NZ. Molecular characteristics of microbially mediated transformations of Synechococcus-derived dissolved organic matter as revealed by incubation experiments. Environmental Microbiology, 2019, 21(7): 2533-2543. DOI:10.1111/1462-2920.14646 |
| [52] | Vonk JE, Tank SE, Mann PJ, Spencer RGM, Treat CC, Striegl RG, Abbott BW, Wickland KP. Biodegradability of dissolved organic carbon in permafrost soils and aquatic systems:a meta-analysis. Biogeosciences, 2015, 12(23): 6915-6930. DOI:10.5194/bg-12-6915-2015 |
| [53] | Hansell DA. Recalcitrant dissolved organic carbon fractions. Annual Review of Marine Science, 2013, 5: 421-445. DOI:10.1146/annurev-marine-120710-100757 |
| [54] | Del Giorgio PA, Newell REI. Phosphorus and DOC availability influence the partitioning between bacterioplankton production and respiration in tidal marsh ecosystems. Environmental Microbiology, 2012, 14(5): 1296-1307. DOI:10.1111/j.1462-2920.2012.02713.x |
 2020, Vol. 60
2020, Vol. 60