中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 谢红炼, 汪汉成, 蔡刘体, 周浩, 刘畅, 陆宁, 史彩华, 王香萍. 2020
- Honglian Xie, Hancheng Wang, Liuti Cai, Hao Zhou, Chang Liu, Ning Lu, Caihua Shi, Xiangping Wang. 2020
- 烟草种子内生细菌群落结构与多样性
- Community structure and diversity of endophytic bacteria of tobacco seeds
- 微生物学报, 60(3): 601-616
- Acta Microbiologica Sinica, 60(3): 601-616
-
文章历史
- 收稿日期:2019-06-18
- 修回日期:2019-08-22
- 网络出版日期:2019-12-09
2. 贵州省烟草科学研究院, 贵州 贵阳 550081;
3. 长江大学生命科学学院, 湖北 荆州 434025
2. Guizhou Academy of Tobacco Science, Guiyang 550081, Guizhou Province, China;
3. College of Life Sciences, Yangtze University, Jingzhou 434025, Hubei Province, China
植物种子内生菌是指能够在植物种子细胞内以及细胞间隙与种子长期共存,并与种子建立了和谐共生关系的微生物[1]。种子是植物的重要器官,对植物繁殖后代和农业生产具有重要意义[2],与此同时,种子内生菌也会通过垂直传播传给下一代[3]。种子内生菌依赖种子提供营养和生存环境,又通过信号传导或者自身的代谢产物影响植物的生长,例如种子内生菌可以通过合成生长激素、分泌铁载体以及溶磷作用直接促进植物的生长,也可以通过固氮作用、抗逆作用以及分泌抗生素、蛋白质溶解酶以及与病原微生物竞争营养物质对植物病原菌的拮抗作用间接促进植物的生长[1]。还有研究表明种子内生菌可以提高种子的萌发率,并且在种子萌发过程中,种子内生菌群影响着子代植株内生菌群定殖的动态平衡[4-5]。
烟草(Nicotiana tabacum L.)是我国重要的经济作物,也是西南地区烟农脱贫致富的主要收入来源[6]。挖掘烟草种子内生菌资源,有利于烟草病害生防菌的发现、提高烟草抗重金属、抗环境条件胁迫能力、促进植物良好生长[7]。烟草种子内生细菌已有初步研究报道,如颜瑾在品种K326烟草种子中分离鉴定出假单胞菌属(Pseudomonas)、泛菌属(Pantoea)、寡养单胞菌属(Stenotrophomonas)、芽孢杆菌属(Bacillus)、贪铜菌属(Cupriavidus)细菌[8];马冠华等在品种云烟85、RG11、K326、K346、G28、NC89和红花大金元烟草种子中均分离鉴定出芽孢杆菌属和土壤杆菌属(Agrobacterium)细菌[9];孙敏从品种K326、云烟87、NC82和湘烟3号烟草种子中分离出内生细菌60株,并筛选鉴定出3株金属抗性高、产铁载体能力高及促生效应高的假单胞杆菌属(Pseudomonas)细菌[10]。以上研究均采用分离培养的方法获得烟草种子内生细菌,该方法仅能分离可培养型细菌,对不可培养型细菌缺乏了解。已有研究表明纯培养获得的微生物种类只占环境微生物总数的0.1%-10%[11]。16S rDNA PCR扩增子测序是研究原核生物多样性最常见的方法,可以真实反映微生物群落的结构和多样性[12]。目前,随着测序技术不断成熟,Illumina高通量测序技术被广泛用土壤[13-14]、空气[15-16]、水体[17-18]、肠道[19-20]、种子[21-22]等微生物领域的研究,但基于Illumina高通量测序对烟草种子内生细菌的研究还未见报道。本研究以烟草主栽品种K326、云烟85和云烟87的自收烟草种子为材料,采用Illumina高通量测序技术研究烟草种子内生细菌的群落结构和多样性,旨在进一步了解烟草种子内生细菌的群落结构与多样性,为今后烟草种子内生菌的功能研究和利用以及种子病害生物防控提供参考信息。
1 材料和方法 1.1 烟草种子K326和云烟85裸种,由贵州省烟草科学研究院2016年采自田间烟株,未经洗涤;云烟87裸种为2016年田间采集种,经水洗后晾干,所有种子均于-80 ℃低温保藏。将种子置于流动的自来水下冲洗,去除表面的泥土和附属物,取每品种种子10 g,用75%的酒精消毒30 s,用2%次氯酸钠溶液消毒2 min,最后用无菌水漂洗3次,用最后一次的洗涤液涂布NA琼脂培养基,检测是否消毒完全,消毒完全的种子作为下一步实验样品,每个品种3次生物学重复。品种K326种子样品编号为K326-1、K326-2和K326-3;云烟85种子样品编号为Y85-1、Y85-2和Y85-3;云烟87种子样本编号为Y87-1、Y87-2和Y87-3;共计9个样品。
1.2 烟草种子总DNA的提取取消毒完全的种子5 g,转移至无菌研钵中研磨,采用E.Z.N.A.® Soil DNA Kit试剂盒(购于美国OMEGA公司)提取总DNA,利用NanoDrop2000超微分光光度计(购于美国Thermo Fisher Scientific公司)检测抽提DNA浓度和纯度,A260/A280值要求在1.8-2.0之间。
1.3 烟草种子16S rDNA文库构建及高通量测序以上述DNA为模板,利用引物779F (5′-AAC MGGATTAGATACCCKG-3′)和1193R (5′-ACGTC ATCCCCACCTTCC-3′)对各样品基因组DNA V3-V4区域进行PCR扩增,PCR反应体系(20 μL):5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L上、下游引物各0.8 μL,FastPfu Polymerase 0.4 μL,BSA 0.2 μL和DNA模板10 ng,ddH2O补足至20 μL。将反应体系置于ABI Gene Amp® 9700型PCR仪进行扩增,PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。PCR产物参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(购于Promega公司)进行检测定量。利用TruSeqTM DNA Sample Prep Kit回收纯化PCR产物,Tris-HCl洗脱,2%琼脂糖凝胶电泳检测PCR产物,将扩增产物送至上海美吉生物医药科技有限公司,采用Illumina MiSeq测序平台进行测序,构建16S rRNA文库。
1.4 测序数据处理与统计分析测序得到的原始数据使用Trimmomatic软件质控,使用FLASH软件进行拼接,设置50 bp的窗口,去除平均质量低于20 bp的序列后端的序列,再去除质控后长度低于50 bp的序列;根据重叠碱基将两端序列进行拼接,过滤掉Overlap长度小于10 bp或错配比大于0.2的序列,根据序列首尾两端的Barcode和引物区分样品并调整序列方向,Barcode允许的错配数为0,最大引物错配数为2,去除存在模糊碱基的序列,得到优化序列。
使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类,在聚类的过程中去除单序列和嵌合体,生成OTU表格。利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
以优化序列数据计算α多样性指数:Shannon指数、Simpson指数、Sobs指数、Ace指数、Chao指数等,进行α多样性分析;使用FastTree (version 2.1.3 http://www.microbesonline.org/fasttree/)根据最大似然法构建进化树,然后利用FastUniFrac (http://UniFrac.colorado.edu/)分析得到样本间距离矩阵绘制热图,进行β多样性分析;利用R语言PCA统计、作图,进行主成分分析比较样品间的差异,以此深入了解烟草种子内生细菌群结构与多样性。以上分析均在上海美吉生物医药科技有限公司I-Sanger生信云网站平台(http://www.i-sanger.com/project/index.html)完成。
2 结果和分析 2.1 烟草种子16S rRNA序列测序深度分析本文共测序3组9个样品,随着测序数量的增加,样本稀释曲线均趋于平缓。当reads数在1000时,测序数据达到饱和(图 1)。表明本次测序数据合理,能够覆盖烟草种子内生细菌群落中的绝大多数物种,继续增加测序的深度对样品信息贡献量很小。

|
| 图 1 稀释曲线(OTU水平Shannon指数) Figure 1 Rarefaction curve (Shannon index of OTU level). K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
2.2 内生细菌数据质控
经过优化处理,本次测序9个样本共得到128558条高质量序列片段,50788993个碱基,单一样品序列数在10575-19651条之间,序列平均长度为395 bp。其中K326的3个样品共得到39033条高质量序列片段,15421155个碱基,单一样品序列数在10575-16618条之间,序列长度在277-402 bp之间;云烟85的3个样品共得到45464条高质量序列片段,17957228个碱基,单一样品序列数在11406-19651条之间,序列长度在285-411 bp之间;云烟87的3个样品共得到44061条高质量序列片段,17410610个碱基,单一样品序列数在11944-17347条之间,序列长度在281-422 bp之间。
2.3 内生细菌OTU聚类分析在97%相似度水平对样品序列进行OTU聚类,3个品种烟草种子内生细菌共鉴定得出7个门、13个纲、29个目、61个科、107个属、140个种、172个OTU。其中,K326的3个样品共鉴定得出5个门、9个纲、20个目、34个科、59个属、79个种、99个OTU;云烟85的3个样品共鉴定得出7个门、13个纲、26个目、50个科、90个属、122个种、149个OTU;云烟87的3个样品共鉴定得出7个门、13个纲、27个目、56个科、89个属、111个种、133个OUT (表 1)。
| Taxon | Domain | Kingdom | Phylum | Class | Order | Family | Genus | Species | OTU |
| K326 | 1 | 1 | 5 | 9 | 20 | 34 | 59 | 79 | 99 |
| Y85 | 1 | 1 | 7 | 13 | 26 | 50 | 90 | 122 | 149 |
| Y87 | 1 | 1 | 7 | 13 | 27 | 56 | 89 | 111 | 133 |
| Total | 1 | 1 | 7 | 13 | 29 | 61 | 107 | 140 | 172 |
| K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. | |||||||||
Venn图分析结果表明(图 2),在属和OTU水平,云烟85和云烟87种子内生细菌的属和OTU的数量相近,远高于品种K326。为此,品种云烟85和云烟87种子样品内生细菌种类比K326的多。K326种子中的内生细菌种类几乎在云烟85中都存在,仅有1个独有的OTU。3品种烟草种子内生细菌群落中,共有的属和OTU均远高于单一品种样品。
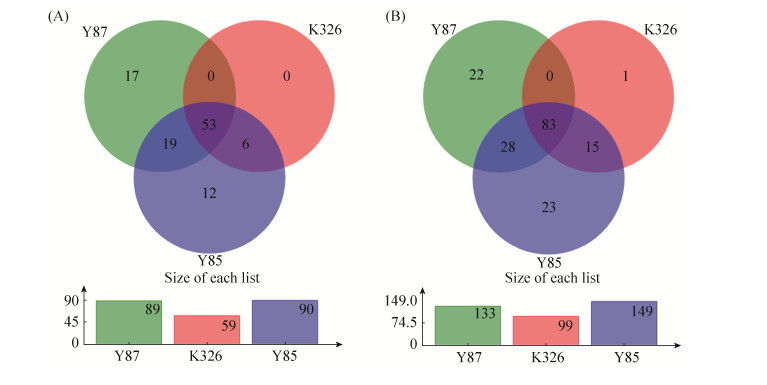
|
| 图 2 3品种烟草种子内生细菌群落Venn图 Figure 2 Venn diagram of endophytic bacterial communities of three varieties tobacco seeds. A: Venn maps about endophytic bacterial communities of three varieties tobacco seeds at the level of genus; B: Venn maps about endophytic bacterial communities of three varieties tobacco seeds at the level of OTU. K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
2.4 内生细菌多样性指数分析
Alpha多样性是对单个样本的多样性的分析,包括一系列统计学分析指数,Shannon、Simpson指数反映群落多样性(Community diversity);Sobs、Chao、Ace指数反映群落丰富度(Community richness);Simpsoneven、Shannoneven、Smithwilson指数反映群落均匀度(Community evenness);Coverage指数反映群落覆盖度(Community coverage)。
Alpha多样性指数显示,3个品种种子的覆盖度指数(Coverage index)均在0.99以上,表明测序数据足够反映内生细菌群落的多样性。多样性指数(Diversity index)显示,品种K326和云烟85种子内生细菌群落多样性均高于云烟87。丰富度指数(Richness index)显示,云烟85种子内生细菌群落丰富度最高,K326种子样品内生细菌群落丰富度最低。均匀度指数(Evenness index)显示,K326和云烟85种子样品内生细菌群落均匀度均高于云烟87种子(表 2)。OTU水平Shannon指数表明,3个品种烟草种子内生细菌群落多样性依次为云烟85 > K326 > 云烟87(图 3)。
| Variety | Richness index | Evenness index | Diversity index | Coverage/% | |||||||
| Sobs | Ace | Chao | Shannoneven | Simpsoneven | Smithwilson | Shannon | Simpson | ||||
| K326 | 87.33±1.15 | 95.92±4.03 | 95.84±4.51 | 0.719±0.007 | 0.156±0.008 | 0.519±0.003 | 3.213±0.038 | 0.074±0.004 | 0.999±0.0005 | ||
| Y85 | 125.67±11.59 | 130.92±9.38 | 128.90±9.21 | 0.756±0.005 | 0.197±0.005 | 0.512±0.002 | 3.651 ±0.0067 | 0.041±0.003 | 0.999±0.0004 | ||
| Y87 | 99.33±11.85 | 108.75±10.30 | 106.51±9.89 | 0.460±0.027 | 0.032±0.006 | 0.512±0.002 | 2.114±0.095 | 0.317±0.031 | 0.999±0.0002 | ||
| K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. | |||||||||||

|
| 图 3 Alpha多样性指数(OTU水平Shannon指数) Figure 3 Alpha diversity index (Shannon index of OTU level). K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
2.5 内生细菌群落基本结构分析
在门水平,3品种烟草种子的内生细菌群落结构极为相似,所有种子内生细菌群落中的优势门均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicute)及拟杆菌门(Bacteroidete)。变形菌门在品种K326、云烟85和云烟87种子内生细菌群落中的占比分别为66.17%、53.82%、81.97%;放线菌门的占比分别为16.91%、32.41%、9.56%;厚壁菌门的占比分别为9.33%、6.75%、9.56%;拟杆菌门的占比分别为7.57%、6.98%、0.83% (图 4)。
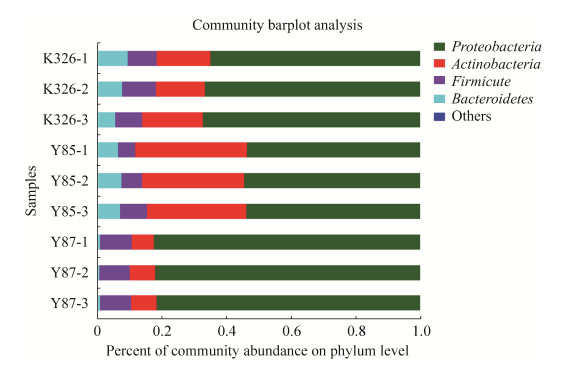
|
| 图 4 3品种烟草种子内生细菌在门水平上的相对丰度 Figure 4 The relative abundance about endophytic bacterial of three varieties tobacco seeds at phylum level. K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
图 5显示,在属水平,品种K326和云烟85的种子样品的内生细菌群落结构较为相似,均与云烟87种子样品内生细菌群落结构存在差异。3个品种种子检测出的共有菌属:假单胞菌属(Pseudomonas)、Lelliottia、细杆菌属(Microbacterium)、鞘脂杆菌属(Sphingobacterium)、糖芽胞杆菌属(Saccharibacillus)、白色杆菌属(Leucobacter)、寡养单胞菌属(Stenotrophomonas)、苍白杆菌属(Ochrobactrum)、大肠杆菌志贺菌属(Escherichia-shigella)、类芽孢杆菌属(Paenibacillus)、根瘤菌属(Rhizobium)、马赛菌属(Massilia)、短状杆菌属(Brachybacterium)、血杆菌属(Sanguibacter)、代尔夫特菌属(Delftia)、金黄杆菌属(Chryseobacterium)、无色菌属(Achromobacter),肠球菌属(Enterococcus)、Verticia、甲基杆菌属(Methylobacterium)、黄杆菌属(Flavobacterium)、萨拉纳菌属(Salana)、藤黄单胞菌属(Luteimonas)、短小杆菌属(Curtobacterium)、果胶杆菌属(Pectobacterium)、芽孢杆菌属(Bacillus)、葡萄菌属(Staphylococcus)。另外,3个品种种子还鉴定出未分类的肠杆菌科(Unclassfied_f_ Enterobacteriaceae)、未分类的草酸杆菌科(Unclassfied_f_Oxalobacteraceae)、未分类的丛毛单胞菌科(Unclassfied_f_Comamonadaceae)、未分类的微杆菌科(Unclassfied_f_Microbacteriaceae)、未分类的变形菌门(Unclassfied_p_Proteobacteria)细菌。其中,葡萄球菌只存在于云烟85 (1.63%)和云烟87 (0.1%)种子中。大肠杆菌志贺菌属在云烟87种子样品内生细菌中的占比为54.84%,而在K326和云烟85种子中的分别为3.22%和2.20%。3个品种种子内生细菌群落菌属种类基本相似,云烟87与其他2个品种内生细菌在丰度上存在较大差异。

|
| 图 5 3品种烟草种子内生细菌在属水平上的相对丰度 Figure 5 The relative abundance about endophytic bacterial of three varieties tobacco seeds at Genus level. K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
选取不同烟草种子样本丰度高的30个细菌属绘制丰度热图,通过颜色直观反映了各样品的丰度前30属的含量情况。图 6上方的样本层级聚类树显示,每个品种的3个样品均单独聚为一个分支,表明每个品种的3个样品的群落结构与组成最为相似。品种K326和云烟85种子样品内生细菌群落结构与组成较为相似,聚为一个大分支,云烟87与其他品种种子内生细菌群落结构与组成存在较大差异,单独聚为一个分支。丰度热图左侧物种层级聚类树显示,丰度相近的菌属聚集在一起。云烟87各菌属丰度与其他2个品种存在差异性,丰度差异最显著的菌属是大肠杆菌志贺菌属。

|
| 图 6 属水平下3品种烟草种子内生细菌的相对丰度热图 Figure 6 Heatmap of the relative abundance of genera identified about endophytic bacterial of three varieties tobacco seeds. K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
2.6 烟草种子样本比较分析
OTU水平的样品距离热图通过距离和颜色反映了样品间内生细菌群落结构与多样性的差异。图 7显示,在OTU水平,每个品种的3个样品内生细菌群落之间不存在差异性,品种K326和云烟85之间存在的差异性较小,而云烟87与K326、云烟85之间均存在较大差异。
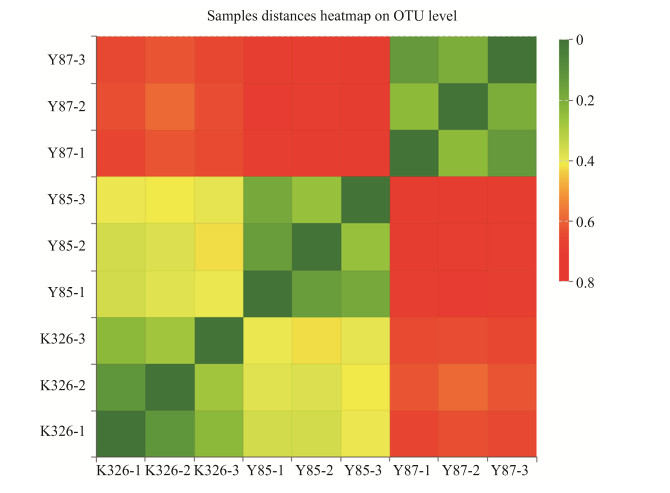
|
| 图 7 OTU水平烟草种子内生细菌距离热图 Figure 7 Endophytic bacterial of three varieties tobacco seeds distances heatmap at OTU level. K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
通过基于Bray-Curtis距离的PCoA分析研究3个品种烟草种子内生细菌群落组成,图 8显示,在属水平,第1主成分PC1和第2主成分PC2对样品的贡献率分别为74.62%、14.37%,是影响烟草种子内生细菌群落结构的主要因素,且PC1的贡献率显著大于PC2。两个主成分将9个种子样品聚为三类,每个品种各为一类。其中,K326与云烟85样品间的距离相对较小,而分别与云烟87样品之间均存在较大差异。在PC1的作用下,品种云烟87种子样品与K326、云烟85的距离被拉开,PC1是造成云烟87种子内生细菌群落组成与其他品种形成差异性的主要因素;在PC2的作用下,品种K326种子样品和云烟85种子样品之间也存在一定距离,PC2是造成K326和云烟85种子内生细菌群落差异的主要因素。

|
| 图 8 属水平烟草种子内生细菌主坐标分析 Figure 8 Principal coordinate analysis of endophytic bacteria of three varieties tobacco seeds at phylum level. K326, Y85 and Y87 were the tobacco seed of cultivar K326, Yunyan85 and Yunyan87, respectively. |
2.7 16S功能预测
利用KEGG Orthology (KO)数据库和COG数据库比对3个品种烟草种子样品内生细菌OTU对应的基因,进行PICRUSt基因预测。结果表明,3品种种子内生细菌KEEG代谢通路丰度基本相似,大部分为代谢相关信息(44.44%-48.11%),其次为环境信息加工(17.71%-19.68%)、遗产信息加工(15.08-15.88%)以及细胞转化(2.91%-3.47%)相关信息,各种子中也产生了人类疾病功能信息,在各种子中丰度达到了0.98%-1.07%,除此之外,还存在低丰度的有机系统相关信息(0.49%-0.75%)(图 9)。
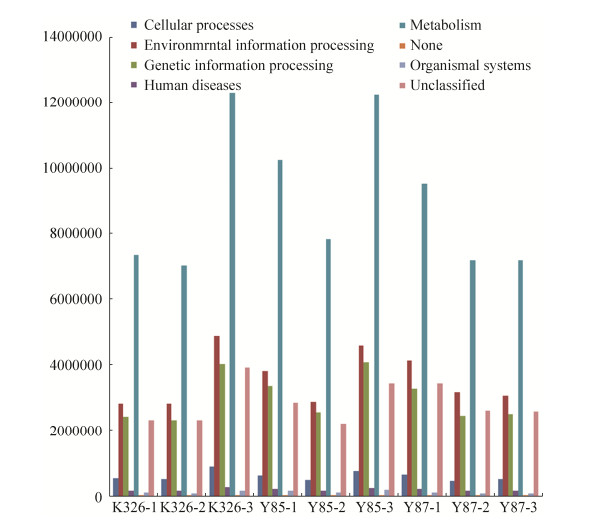
|
| 图 9 OTU水平烟草种子内生细菌KEEG代谢通路相对丰度 Figure 9 Relative abundance about KEEG metabolic pathway of endophytic bacteria in three varieties tobacco seeds at OTU level. |
COG功能分类显示,烟草种子内生细菌COG功能主要包括物质及能量的转运和分解代谢、细胞生物行为发生及调控(图 10)。各种子样品中功能丰度≥1%且由高到低依次顺序为氨基酸转运与代谢作用(9.27%-9.46%),糖类转运与代谢作用(8.40%-9.66%),转录作用(7.84%-8.05%),无机离子转运与代谢作用(7.10%-7.26%),能量生产和转化(6.31%-6.47%),细胞壁、细胞膜及包膜生物发生(5.95%-6.17%),翻译、核糖体结构和生物发生(4.83%-5.48%),信号转导机制(4.29%-5.40%),复制、重组和修复(4.41%-4.82%),脂类转运与代谢作用(2.98%-3.93%),辅酶转运与代谢作用(3.56%-3.77%),翻译后修饰、蛋白质周转及伴侣(3.59%-3.69%),核苷酸转运与代谢作用(2.50%-2.80%),次生代谢产物的合成、运输和分解代谢(1.88%-2.09%),细胞内运输、分泌和囊泡运输(1.77%-2.58%),防卫机制(1.32%-1.51%),及细胞运动(1.27%-2.07%)。比对KO数据库和COG数据库,基因功能预测结果均显示,烟草种子内生细菌检测出的信息绝大多数为有益功能信息。
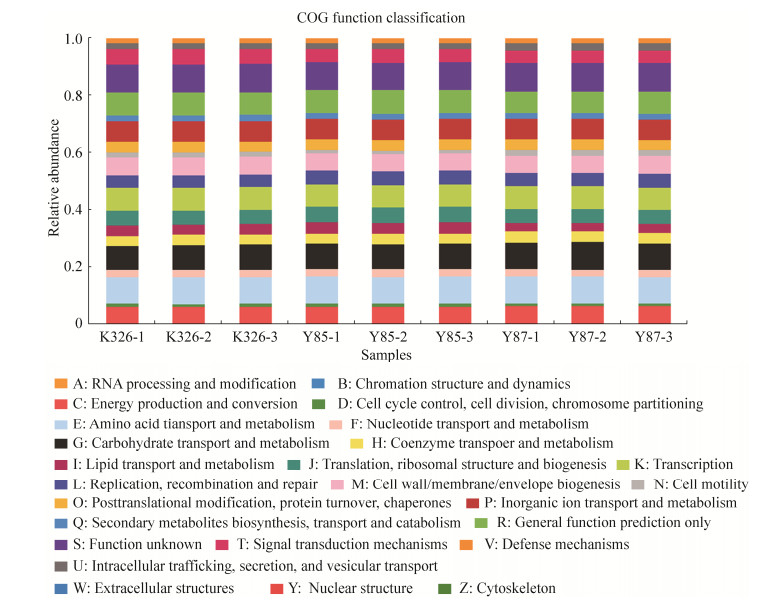
|
| 图 10 OTU水平烟草种子内生细菌COG功能分类 Figure 10 COG function classification of endophytic bacteria in three varieties tobacco seeds at OTU level. |
3 讨论
种子是植物的重要繁殖器官,密切影响着子代植物的性状和健康状况[23],而种子内生细菌的种类和多样性也影响着环境健康[24]。近年来,人们对种子微生物的重视不断提高。本研究利用Illumina高通量测序对3品种烟草种子的内生细菌群落结构及多样性进行了分析,共得到128558条高质量序列片段,50788993个碱基,鉴定出附生真菌7个门、13个纲、29个目、61个科、107个属、140个种、172个OTU。证实了利用Illumina高通量测序技术研究烟草种子内生细菌的可行性。
Alpha多样性指数分析表明,3个品种烟草种子内生细菌多样性由高到低依次是:云烟85、K326、云烟87。通过OTU聚类结果表明,品种云烟85内生细菌所鉴定出的OTU最多,其次是云烟87,且两者鉴定出的OTU数远高于K326。不同生长环境、不同生长状态下的植株,其内生菌的种类、群落特性会存在差异[25]。此外,从内生菌群落丰富度来看,品种云烟85和云烟87远高于K326,这可能与种子质量差异有关。有研究表明,不同品种的种子的营养成分、脂肪酸组成以及吸水速率都存在显著性差异[26-27],且种子的形态结构、营养组成和水分含量均会影响种子内生细菌群落组成[28]。为此,本文云烟85、云烟87和K326品种内生细菌群落结构的差异可能也与这些内在成分和结构有关,有待下一步研究证实。
目前,据研究表明,各类种子内生细菌主要存在于变形菌门、放线菌门和厚壁菌门[29-31],在本研究中,3个品种烟草种子内生细菌群落的优势菌门是变形菌门、放线菌门、厚壁菌门和拟杆菌门,拟杆菌门在各品种烟草种子内生细菌群落中占比均为最低(图 4),表明烟草种子与其他植物种子内生细菌群落在门水平的组成相似。烟草种子内生细菌群落在属水平上的组成较为复杂,分布于假单胞菌属、细杆菌属、糖芽孢杆菌属、白色杆菌属、大肠杆菌志贺菌属、类芽孢杆菌属、根瘤菌属、马赛菌属以及Lelliottia等菌属的细菌在3品种种子样品中均被检测出,且丰度较高,这些菌属细菌可能是烟草种子中的核心细菌菌属,另外在1、2品种烟草种子样品中还存在一些丰度较高分布于鞘脂杆菌属、寡养单胞菌属、苍白杆菌属、短状杆菌属、血杆菌属、黄杆菌属、藤黄色单胞菌属、Verticia以及Salana等菌属的细菌(图 5)。除前人已报道的菌属以外,本文还鉴定出了更多种类的内生细菌种类;相比而言,其所鉴定出的泛菌属、贪铜菌属和土壤菌属细菌在本研究中并未检出,这可能与种子的来源差异有关。
本研究中发现烟草种子中含有许多具有益功能的细菌。其中,假单胞菌属中的荧光假单胞菌被报道对烟草黑胫病具有生防作用,恶臭假单胞菌存在耐金属作用[32-33];类芽孢杆菌可产生具有抗菌作用的蛋白质、肽类物质、胞外多糖、酶活性等物质,可用于防治茄科植物青枯病、烟草赤星病等植物病害[34];根瘤菌属细菌可用于农业、园艺、林业和环境的修复[35];马赛菌属细菌不仅能合成多种次生代谢产物和酶,还能促进植物生长,溶磷降解菲,同时还具有耐重金属作用,在土壤修复领域、化工和医药生产等领域具有巨大的应用潜力[36];肠杆菌属细菌均有ACC脱氨酶活性,可以促进植物生长[37];藤黄单胞菌有降解黄曲霉素和赫曲霉素的作用[38];Lelliottia属细菌可以减少土壤中的砷盐,用于砷转化和生物修复[39];萨勒河菌属细菌能够还原硒酸盐[40]。为此,推测本文发现烟草种子的这些内生菌在烟草种子萌发、子代烟株的生长、及帮助烟株对抗恶劣环境条件等方面具有积极作用。
16S功能预测显示出大量关于蛋白质、核苷酸、糖类、辅酶及代谢产物合成的基因信息,结合种群中存在许多有益功能细菌,提示烟草种子内生细菌可能参与代谢烟草种子内的各种营养物质,为种子的萌发与植株生长发育提供必要的营养、激素等作用。PICRUSt基因预测出现了丰度为0.98%-1.07%的人类疾病相关的基因信息,在烟草种子中存在的大肠杆菌志贺菌属、肠杆菌属以及黄杆菌属细菌,肠杆菌会产生致病因子和毒素,引起感染[41];大肠杆菌志贺菌是一类具有高度传染性、危害严重的革兰氏阴性肠道致病菌,会导致志贺菌性痢疾[42];黄杆菌可引起散发性感染,导致医院内感染的流行[43]。本文发现烟草种子中的这些细菌是否具有潜在致病性,还有待下一步深入研究。
本研究通过Illumina高通量测序分析明确了烟草种子内生细菌群落结构及多样性,初步了解了烟草种子中细菌种群的功能,为今后挖掘烟草种子内生菌的功能研究和利用以及种子病害生物防控提供了准确的微生物信息。此外,本研究仅对3个品种烟草种子内生细菌群落结构及多样性进行了分析,品种数量有限,同时缺少对烟草种子内生真菌群落多样性分析,有待在今后的研究中陆续开展。
| [1] |
Long X, Yan X, Hong JL, Liang ZS, Chen HM. Research advances on endophytic bacteria of plant seeds. Journal of Zhejiang Agricultural Sciences, 2016, 57(8): 1319-1324.
(in Chinese) 龙锡, 严希, 洪佳丽, 梁宗锁, 陈海敏. 植物种子内生菌的研究进展. 浙江农业科学, 2016, 57(8): 1319-1324. |
| [2] |
Hu ZY, Sun ZW. Important position and role in agriculture for seed. Anhui Agricultural Science Bulletin, 2013, 19(24): 46-47.
(in Chinese) 胡宗英, 孙泽威. 植物种子在农业中的重要地位和作用. 安徽农学通报, 2013, 19(24): 46-47. |
| [3] | Berg G, Raaijmakers JM. Saving seed microbiomes. The ISME Journal, 2018, 12(5): 1167-1170. |
| [4] | Barret M, Briand M, Bonneau S, Préveaux A, Valière S, Bouchez O, Hunault G, Simoneau P, Jacques MA. Emergence shapes the structure of the seed microbiota. Applied and Environmental Microbiology, 2015, 81(4): 1257-1266. |
| [5] | Truyens S, Weyens N, Cuypers A, Vangronsveld J. Bacterial seed endophytes: genera, vertical transmission and interaction with plants. Environmental Microbiology Reports, 2015, 7(1): 40-50. |
| [6] |
Zhang HJ, Hu ZC, Xie HX, Wang HO, Chen YQ. General situation and development strategy of tobacco production in China. Journal of Anhui Agricultural Sciences, 2008, 36(32): 14161-14162, 14213.
(in Chinese) 张会娟, 胡志超, 谢焕雄, 王海鸥, 陈有庆. 我国烟草的生产概况与发展对策. 安徽农业科学, 2008, 36(32): 14161-14162, 14213. |
| [7] |
Xing Y, Zhang X, Hao ZP, Zhao ZX, Yu YZ, Chen BD. Biodiversity of endophytes in tobacco plants and their potential application-a mini review. Microbiology China, 2015, 42(2): 411-419.
(in Chinese) 邢颖, 张莘, 郝志鹏, 赵正雄, 于有志, 陈保冬. 烟草内生菌资源及其应用研究进展. 微生物学通报, 2015, 42(2): 411-419. |
| [8] |
Yan J, Shu CH, Tian C, Wang YS, Xiao QM, Chen W, Chao J. Isolation and identification of endophytic bacteria in seeds of tobacco variety K326. Hunan Agricultural Sciences, 2014(18): 21-24, 27.
(in Chinese) 颜瑾, 舒翠华, 田昌, 王运生, 肖启明, 陈武, 巢进. 烤烟K326种子可培养内生细菌的分离与鉴定. 湖南农业科学, 2014(18): 21-24, 27. |
| [9] |
Ma GH, Xiao CG. Population dynamics of endophytic bacteria in symptom-free tobacco plants. Journal of Microbiology, 2004, 24(4): 7-11.
(in Chinese) 马冠华, 肖崇刚. 烟草内生细菌种群动态研究. 微生物学杂志, 2004, 24(4): 7-11. |
| [10] | 孙敏.烤烟三株内生细菌的筛选及应用研究.湖南农业大学硕士学位论文, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10537-1017036966.htm |
| [11] | Amann RI, Ludwig W, Schleifer KH. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiological Reviews, 1995, 59(1): 143-169. |
| [12] | Logares R, Sunagawa S, Salazar G, Cornejo-Castillo FM, Ferrera I, Sarmento H, Hingamp P, Ogata H, De Vargas C, Lima-Mendez G, Raes J, Poulain J, Jaillon O, Wincker P, Kandels-Lewis S, Karsenti E, Bork P, Acinas SG. Metagenomic 16S rDNA Illumina tags are a powerful alternative to amplicon sequencing to explore diversity and structure of microbial communities. Environmental Microbiology, 2014, 16(9): 2659-2671. |
| [13] |
Wu JN, Liu YX, Zhou X, Wang TY, Gao Q, Gao YH, Liu SX. Effects of long-term different fertilization on soil fungal communities in black soil based on the Illumina MiSeq platform. Acta Microbiologica Sinica, 2018, 58(9): 1658-1671.
(in Chinese) 武俊男, 刘昱辛, 周雪, 王天野, 高强, 高云航, 刘淑霞. 基于Illumina MiSeq测序平台分析长期不同施肥处理对黑土真菌群落的影响. 微生物学报, 2018, 58(9): 1658-1671. |
| [14] |
Zhang YJ, Shao HF, Zhang K, Jia HF, Huang WX, Han D. Influences of fertilization on soil environment and microorganism in continuous cropping based on high-throughput sequencing. Journal of Agricultural Science and Technology, 2018, 20(5): 16-25.
(in Chinese) 张艺洁, 邵惠芳, 张珂, 贾宏昉, 黄五星, 韩丹. 基于高通量测序研究施肥对连作植烟土壤环境及微生物的影响. 中国农业科技导报, 2018, 20(5): 16-25. |
| [15] |
Sun CL, Zhang G, Cheng RJ, Zhu LQ, Ding JB, Chang WS. Microbial community structure and diversity of sheepfold atmosphere by 16S rRNA high-throughput sequencing. Acta Veterinaria et Zootechnica Sinica, 2017, 48(7): 1314-1322.
(in Chinese) 孙翠丽, 张阁, 程汝佳, 朱良全, 丁家波, 常维山. 16S rRNA高通量测序方法检测羊圈空气微生物群落结构及多样性. 畜牧兽医学报, 2017, 48(7): 1314-1322. |
| [16] |
Li YM, Tong XL, Xu HT, Tian G, Lang JD, Xiao F, Cai M. Monitor of air borne hospital environment by Illumina high-throughput sequence. Journal of Wenzhou Medical University, 2015, 45(6): 437-439, 442.
(in Chinese) 李燕明, 佟训靓, 许宏涛, 田埂, 郎继东, 肖飞, 蔡虻. Illumina高通量测序技术检测医院内空气中微生物. 温州医科大学学报, 2015, 45(6): 437-439, 442. |
| [17] |
Wang Y, Liu MK, Miao XC, Wang Y, Bai XH. Effect of urban water supply system on fungi population and community structure. Microbiology China, 2019, 46(1): 20-28.
(in Chinese) 王钰, 刘明坤, 苗小草, 王杨, 白晓慧. 城市供水系统对水中真菌数量和群落结构的影响. 微生物学通报, 2019, 46(1): 20-28. |
| [18] |
Xue M, He YY, Qiu MD, Liang HF, Chen DS, Wang LQ, Liu YF, Wen CQ. Characterization of aquatic bacterial community of Litopenaeus vannamei larvae during hatchery period with high-throughput sequencing. Journal of Fisheries of China, 2017, 41(5): 785-794.
(in Chinese) 薛明, 何瑶瑶, 邱孟德, 梁华芳, 陈第省, 王立群, 刘杨锋, 温崇庆. 高通量测序分析凡纳滨对虾育苗期水体菌群结构特征. 水产学报, 2017, 41(5): 785-794. |
| [19] |
Feng FF, Wang YD. Intestinal microbial diversity of Chinese giant turtle analysis by high-throughput sequencing. Jiangsu Agricultural Sciences, 2018, 46(4): 167-170.
(in Chinese) 冯飞斐, 王一丁. 应用Illumina高通量测序技术分析中华真地鳖肠道微生物多样性. 江苏农业科学, 2018, 46(4): 167-170. |
| [20] |
Yang JH, Zhao ZH, Guo WB, Guo JL. Effects of deoxynivalenol on intestinal microbiota of mice analyzed by Illumina-MiSeq high-throughput sequencing technology. Chinese Journal of Animal Nutrition, 2017, 29(1): 158-167.
(in Chinese) 杨俊花, 赵志辉, 郭文博, 郭晋丽. 应用Illumina-MiSeq高通量测序技术分析脱氧雪腐镰刀菌烯醇对小鼠肠道菌群的影响. 动物营养学报, 2017, 29(1): 158-167. |
| [21] | Gao WN, Zheng CS, Lei YH, Kang WG. Analysis of bacterial communities in white clover seeds via high-throughput sequencing of 16S rRNA gene. Current Microbiology, 2019, 76(2): 187-193. |
| [22] |
Liu Y, Qu LL, Ye MD, Huang CS, Zhu YD, Wang QR, Li SB. Diversity of bacterial endophytes communities in the seeds of several Palmae plants via high throughput sequencing method. Acta Microbiologica Sinica, 2019, 59(3): 554-565.
(in Chinese) 刘媛, 渠露露, 叶美迪, 黄曹生, 朱月丹, 王俏然, 李淑彬. 棕榈科植物种子内生细菌群落多样性的高通量测序分析. 微生物学报, 2019, 59(3): 554-565. |
| [23] | Torres-Cortés G, Sophie B, Bouchez O, Genthon C, Briand M, Jacques MA, Barret M. Functional microbial features driving community assembly during seed germination and emergence. Frontiers in Plant Science, 2018, 9: 902. |
| [24] | 罗胜联, 徐涛英, 陈亮, 饶婵, 陈觉梁, 肖潇, 刘承斌.一种促进植物生长和重金属污染土壤修复的内生菌及应用.中国: CN102161976A. 2011-08-24. |
| [25] |
Lan JL, Liu B, Zhu YJ, Tang QR, Lin KM, Su MX, Shi H. Community and diversity of endophytic bacteria inside eggplant. Ecology and Environmental Sciences, 2009, 18(4): 1433-1442.
(in Chinese) 蓝江林, 刘波, 朱育菁, 唐秋榕, 林抗美, 苏明星, 史怀. 茄子植物内生细菌群落结构与多样性. 生态环境学报, 2009, 18(4): 1433-1442. |
| [26] |
Li HZ, Liu Y, Li XJ, Sun ZW, Zhang ZJ. Analysis on nutrient constituents and fatty acids of different Perilla varieties. Chinese Agricultural Science Bulletin, 2014, 30(3): 276-280.
(in Chinese) 李会珍, 刘艳, 李晓君, 孙子文, 张志军. 不同品种紫苏种子营养成分及脂肪酸组分分析. 中国农学通报, 2014, 30(3): 276-280. |
| [27] |
Zhang GC, Ding H, Yang JS, Dai LX, Ci DW, Qin FF, Shi SB, Zhang ZM. Study on water uptake and seed shape of different peanut varieties. Journal of Peanut Science, 2014, 43(4): 26-31.
(in Chinese) 张冠初, 丁红, 杨吉顺, 戴良香, 慈敦伟, 秦斐斐, 石书兵, 张智猛. 不同花生品种种子形状与吸水速率的研究. 花生学报, 2014, 43(4): 26-31. |
| [28] |
Zou YY, Liu Y, Wang JH, Song W. Advances in plant seed-associated microbial ecology. Acta Ecologica Sinica, 2011, 31(10): 2906-2914.
(in Chinese) 邹媛媛, 刘洋, 王建华, 宋未. 种子微生物生态学研究进展. 生态学报, 2011, 31(10): 2906-2914. |
| [29] | Chen HM, Wu HX, Yan B, Zhao HG, Liu FH, Zhang HH, Sheng Q, Miao F, Liang ZS. Core microbiome of medicinal plant Salvia miltiorrhiza seed: a rich reservoir of beneficial microbes for secondary metabolism?. International Journal of Molecular Sciences, 2018, 19(3): 672. |
| [30] | Cankar K, Kraigher H, Ravnikar M, Rupnik M. Bacterial endophytes from seeds of Norway spruce (Picea abies L. Karst). FEMS Microbiology Letters, 2005, 244(2): 341-345. |
| [31] | Ferreira A, Quecine MC, Lacava PT, Oda S, Azevedo JL, Araújo WL. Diversity of endophytic bacteria from Eucalyptus species seeds and colonization of seedlings by Pantoea agglomerans. FEMS Microbiology Letters, 2008, 287(1): 8-14. |
| [32] | 董国菊.荧光假单胞菌Pseudomonas fluorescens P-72-10菌株对烟草黑胫病的生防机理研究.西南大学博士学位论文, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10635-1012442580.htm |
| [33] | 陈光村.恶臭假单胞菌CZ1非饱和生物膜耐受和累积重金属的分子机制.浙江大学博士学位论文, 2011. http://d.wanfangdata.com.cn/Thesis_Y2069479.aspx |
| [34] |
Lu HX, Zhou Y. Research advances in application of Paenibacillus in plant disease control and environment control. Journal of Anhui Agricultural Sciences, 2008, 36(30): 13244-13247.
(in Chinese) 鲁红学, 周燚. 类芽孢杆菌在植物病害防治和环境治理中的应用研究进展. 安徽农业科学, 2008, 36(30): 13244-13247. |
| [35] | Lucy M, Reed E, Glick BR. Applications of free living plant growth-promoting rhizobacteria. Antonie van Leeuwenhoek, 2004, 86(1): 1-25. |
| [36] |
Yang ED, Cui DX, Wang WY. Research progress on the genus Massilia. Microbiology China, 2019, 46(6): 1537-1548.
(in Chinese) 杨恩东, 崔丹曦, 汪维云. 马赛菌属细菌研究进展. 微生物学通报, 2019, 46(6): 1537-1548. |
| [37] | 马嘉敏.苜蓿根际促生菌的分离及促生作用研究.哈尔滨师范大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10231-1013313218.htm |
| [38] | 周育, 王旭, 姜楠, 韦朝领.降解黄曲霉毒素B1和赭曲霉毒素A的泉水单胞菌及其应用.中国: CN201510761081.1. 2016-01-20. |
| [39] | Tian HX, Wang J, Li JY, Wang YJ, Mallavarapu M, He WX. Six new families of aerobic arsenate reducing bacteria: Leclercia, Raoultella, Kosakonia, Lelliottia, Yokenella, and Kluyvera. Geomicrobiology Journal, 2019, 36(4): 339-347. |
| [40] | Von Wintzingerode F, Göbel UB, Siddiqui RA, Rösick U, Schumann P, Frühling A, Rohde M, Pukall R, Stackebrandt E. Salana multivorans gen. nov., sp. nov., a novel actinobacterium isolated from an anaerobic bioreactor and capable of selenate reduction. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(5): 1653-1661. |
| [41] | Starling S. Bacterial evolution: the origins of pathogenic enterococci. Nature Reviews Microbiology, 2017, 15(7): 382-383. |
| [42] |
Wang L, Xu JG. Research advances on the evolutionary relationship between Shigella and Escherichia coli. Disease Surveillance, 2005, 20(5): 275-277.
(in Chinese) 王林, 徐建国. 志贺菌与大肠杆菌进化关系的研究进展. 疾病监测, 2005, 20(5): 275-277. |
| [43] |
Zhang LM, Yin SS, Jian Q. Analysis and clinical significance of continuous surveillance on the resistance of Flavobacterium. Chinese Journal of Convalescent Medicine, 2009, 18(11): 1026-1028.
(in Chinese) 张立敏, 殷书昇, 菅强. 黄杆菌属连续耐药性监测结果分析及临床意义. 中国疗养医学, 2009, 18(11): 1026-1028. |
 2020, Vol. 60
2020, Vol. 60




