中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张金新, 刘颖, 张蜀香, 张振, 范孝叶, 史淑萍, 左贤, 张应烙, 尹彩萍. 2020
- Jinxin Zhang, Ying Liu, Shuxiang Zhang, Zhen Zhang, Xiaoye Fan, Shuping Shi, Xian Zuo, Yinglao Zhang, Caiping Yin. 2020
- 植物病原真菌抑制杂草的活性筛选及菌株CY-H的活性代谢产物
- Screening of herbicidal activities of plant pathogenic fungi and active metabolites of strain CY-H
- 微生物学报, 60(3): 582-589
- Acta Microbiologica Sinica, 60(3): 582-589
-
文章历史
- 收稿日期:2019-06-10
- 修回日期:2019-08-13
- 网络出版日期:2019-11-20
据调查统计,全世界广泛分布着3万种左右的有害杂草,在我国主要有60多种农田杂草对农业生产造成危害[1],在农业领域,与任何其他农业虫害相比,杂草可导致作物产量和质量更大幅度的下降[2]。化学除草剂是一种非常有效的控制杂草的方法[3],由于化学除草剂的生态环境污染和抗药性杂草产生等危害日益突出,使得人们不得不采用更环保有效的方式去防除杂草。已有研究表明植物病原真菌或其次生代谢产物对植物的生长起抑制作用,且对环境相对安全[4],如真菌除草剂Devine是利用美国弗罗里达州的棕榈疫霉(Phytophthora palmivora Butler)致病菌株的厚垣孢子配制成悬浮剂,对杂草Morrenia odorat的防效高达90%以上[5];植物致病菌Ascochyta caulina产生的两种植物毒素,可用来生物防治杂草藜[6]。因此,植物病原真菌源除草剂具有许多潜在的优势,是新型除草剂的重要研发方向[7-8]。本研究拟从多种发病植株中分离植物致病真菌,并从除草活性较好的菌株中分离活性化合物,为开发新型微生物源除草剂奠定一定的基础。
1 材料和方法 1.1 材料 1.1.1 样品的采集:植株病叶采自安徽农业大学(31°51′51.87″N,117°15′6.95″E)农萃园中。
1.1.2 供试种子:(1) 杂草种子:稗草(Echinochloa crusgalli L.)、反枝苋(Amaranthus retroflexus L.);(2)作物种子:油菜(Brassica napus L.)、小麦(Triticum aestivum L.)。
1.2 菌株的分离纯化用蒸馏水将植株病叶清洗干净。在无菌操作台中,对病叶组织进行表面消毒(75%酒精浸泡1 min,3% NaClO浸泡3 min,无菌水冲洗5次),用无菌滤纸吸取叶片表面水分。接着用无菌剪刀沿病健交界处将病叶剪成组织小块,呈三角分布接种于MEA培养基平板。在避光条件下置于28 ℃恒温培养箱中培养3–5 d。在无菌操作台中用接种针从长出的菌落边缘挑取少量菌丝,转接到MEA培养基上,重复上述操作得到单菌落菌株,挖取单菌株菌落接种到MEA斜面培养基中,4 ℃冷冻保藏备用[9]。
1.3 菌株发酵与发酵产物提取用接种针挑取活化的植物病原真菌菌落接种到装有100 mL ME培养基的250 mL锥形瓶中,摇床培养7 d (28 ℃,200 r/min)后经6层纱布过滤后获得发酵液,将少量发酵液(约10 mL)在无菌条件下,通过直径为0.45 μm无菌滤膜过滤除菌,将所得滤液保存在已灭菌的10 mL离心管中备用;在分液漏斗中用乙酸乙酯多次萃取其余发酵液,直至上层乙酸乙酯层无色为止,合并乙酸乙酯萃取液并经减压旋蒸浓缩得到粗浸膏。
1.4 植物病原真菌发酵液的除草活性测试用培养皿生物分析法(Petri dish bioassay)测定植物病原真菌发酵液对稗草和反枝苋的除草活性。具体操作如下:用0.2% NaClO浸泡稗草和反枝苋种子15 min后用蒸馏水洗涤3次,将处理过的种子置于光照培养箱中28 ℃培养1–2 d。定期观察,待种子露白后取出备用。用移液枪吸取植物病原真菌发酵液5 mL置于铺有滤纸的培养皿中,空白对照加入同等量的无菌水。挑选露白的反枝苋或稗草的种子均匀放于培养皿中(每皿20–30粒),并放置在20 ℃、空气相对湿度为50%的恒温气候培养箱中培养2–3 d。测量供试种子的茎和根长,测定发酵液粗提物对反枝苋、稗草的除草活性以及对作物油菜、小麦的安全性(对露白种子根茎的抑制率)[10]。抑制率的计算公式:抑制率(%)=[(空白对照组幼苗茎或根的长度–处理组幼苗茎或根的长度)/(空白对照组幼苗茎或根的长度)]×100%。
1.5 目标菌株的菌种鉴定(1) 形态学鉴定:将已纯化的菌株CY-H接种到MEA固体培养基中,于28 ℃恒温培养箱中培养3–5 d,每日定时观察菌落的形态特征。在生物显微镜下观察其培养性状、菌丝、孢子等微观形态特征,查阅相关文献,比对观察结果,初步确定其分类地位。(2)分子学鉴定:取适量培养3–4 d的CY-H菌株菌体于洁净、干燥的研钵中,加入液氮充分研磨成细粉,按照真菌基因组DNA提取试剂盒说明书中的操作步骤提取基因组DNA,采用ITS通用引物ITS1:5′-CCGTAGGTGAACCTGC GG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′对菌株5.8S rDNA的ITS区域进行PCR扩增,利用1%琼脂糖凝胶电泳检测纯度,将PCR扩增产物送往通用生物技术公司测序。利用BLAST将获得的5.8S rDNA序列在GenBank的核酸序列库中进行同源性序列分析,选取不同相似度序列,利用MEGA 5.0软件进行系统发育分析,并采取邻位相接法(Neighbor-joining,NJ)构建系统发育树,确定CY-H菌株的分类地位。
1.6 CY-H菌株活性物质的分离纯化及结构鉴定使用大米固体培养基对目标菌株CY-H进行大量发酵。从斜面培养基中挖取CY-H菌株菌落接种到MEA培养基上,在28 ℃温培养箱中避光培养3–4 d。待菌丝长至培养皿边缘时,将新鲜活化的菌丝接入装有ME液体培养基的1000 mL锥形瓶中,摇床培养3 d (28 ℃,200 r/min)获得种子液。用移液枪向50瓶固体大米培养基中加入10 mL先前获得的种子液,28 ℃条件下静止培养40 d,培养至20 d时搅拌菌体与大米使其充分混匀。将培养40 d的CY-H大米培养基用玻璃棒划块,倒入乙酸乙酯溶液中浸泡并超声处理1 h。重复上述步骤直至乙酸乙酯相无色。利用旋转蒸发仪将所得滤液减压浓缩得到粗浸膏[11]。通过硅胶柱层析、凝胶柱层析、薄层层析等多种色谱方法从乙酸乙酯粗提物中分离并纯化得到单体化合物。用600 MHz核磁共振波谱仪(美国Agilent公司)对化合物进行1H-NMR谱和13C-NMR谱数据分析,用Mariner System 5304质谱仪(美国ABI公司)测定单体化合物的分子量,比对参考文献确定单体化合物的化学结构。
1.7 化合物的除草活性及对作物安全性测试采用1.4中的培养皿生物分析法测定活性单体化合物的除草活性及对常见作物的安全性。具体操作如下:将分离得到的单体化合物溶于2%丙酮中,得到浓度为100 μg/mL的药液;用移液枪吸取5 mL配好的药液均匀置于铺有两张滤纸的9 cm的培养皿中,放入烘箱使溶剂挥发干得到药膜;向培养皿中加入5 mL蒸馏水,挑选25粒大小相同、成熟度一致的稗草、反枝苋、小麦、油菜露白种子均匀放置在滤纸上,盖好皿盖,在28 ℃、空气相对湿度为50%的恒温气候培养箱中培养1–2 d;测定稗草、反枝苋、小麦、油菜幼苗的根长,计算抑制率,每处理均重复3次;相同操作设置2%丙酮和100 μg/mL 2, 4-二氯苯氧乙酸(2, 4-D)分别作为空白和阳性对照。
2 结果和分析 2.1 目标菌株的确定采集大量长有病斑的植株,并从中分离纯化出39株植物病原真菌。测定菌株发酵母液对稗草的除草活性(表 1),进一步选择对稗草除草活性较好的8株植物病原真菌发酵液,测定其对反枝苋的除草活性,结果见表 2。活性测试表明,菌株SN-1、ZJ、CY-H和HT-3的发酵液对稗草根具有很强的抑制活性,抑制率均大于90%,菌株HL、RBNZ、SH和YJ的发酵液对稗草根具有较好的抑制活性,抑制率在70%–85%之间;菌株SN-1的发酵液对反枝苋根具有很强的抑制活性,抑制率大于90%,ZJ、CY-H、HT-3、HL、RBNZ和SH的发酵液对反枝苋根具有较好的抑制活性,抑制率在74%–87%之间。薄层层析(TLC)结果表明CY-H的层析条带清晰明显,且在解剖镜下可观察到它们的粗浸膏中含有大量晶体,这表明CY-H的粗浸膏中的次生代谢产物可能易于分离。所以,我们将引起茶叶褐斑病的CY-H初步定为下一步研究的目标菌株。
| Fungi | a | b | Sources |
| XQH | 8.4±3.3 | 67.6±2.4 | H. macrophylla |
| SQ | 42.0±2.5 | 39.0±3.3 | P. notoginseng |
| YL | 40.1±2.8 | 67.6±3.3 | M. denudata |
| RBNZ | 25.2±5.6 | 83.5±2.4 | L. japonicum |
| SH | 39.2±2.6 | 80.8±1.9 | C. rubrum |
| GZSN | 1.8±7.2 | 29.8±4.2 | P. bodinieri |
| HL | – | 71.2±6.6 | S. matsudana |
| PT-2 | – | 17.7±6.5 | V. vinifera |
| SN-3 | – | 51.5±3.0 | P. serrulata |
| NZ-5 | 37.0±7.9 | 27.1±10.7 | L. lucidum |
| ZJ | 62.6±3.7 | 96.0±1.3 | C. chinensis |
| YJ | 30.7±3.5 | 84.6±2.1 | R. chinensis |
| SZ | 48.0±2.2 | 72.2±2.5 | D. kaki |
| CM | 9.4±4.3 | 76.6±2.1 | C. sasanqua |
| YNHX | 41.5±4.8 | 62.9±3.7 | J. mesnyi |
| XZ | 38.9±2.8 | 46.0±2.9 | C. camphora |
| GH-2 | 65.6±4.5 | 98.4±1.0 | O. fragrans |
| SN-1 | 76.3±4.3 | 98.7±0.6 | P. serrulata |
| GH-3 | 9.6±5.7 | 22.2±5.6 | O. fragrans |
| SCH | 32.6±3.4 | 64.1±3.5 | C. japonica |
| YM-1 | 12.4±4.4 | 74.1±3.3 | M. rubra |
| YM-2 | 20.8±4.3 | 31.6±4.5 | M. rubra |
| JXC | 20.8±4.0 | 43.0±3.3 | R.carnea |
| JC | 44.6±4.2 | 52.5±4.6 | H. cordata |
| PT-1 | 36.2±3.0 | 84.8±1.4 | V. vinifera |
| HT-3 | 52.4±3.1 | 90.1±2.2 | P. tobira |
| HT-4 | 16.8±14.0 | 63.7±5.5 | P. tobira |
| HT-2 | 2.8±1.6 | 57.7±4.9 | P. tobira |
| HT-5 | 9.1±2.7 | 69.2±8.9 | P. tobira |
| MG | 40.0±9.2 | 98.9±5.3 | R. rugosa |
| CY-5 | 17.5±3.7 | 39.6±4.0 | C. sinensis |
| NZ-1 | 17.9±5.4 | 43.0±4.7 | L. lucidum |
| HT-1 | 12.4±4.5 | 13.0±4.3 | P. tobira |
| GH-1 | 22.1±4.3 | 94.4±1.0 | O. fragrans |
| CY-B | 61.4±4.9 | 63.5±2.4 | C. sinensis |
| CY-6 | 14.1±4.4 | 23.4±2.9 | C. sinensis |
| CM′ | 31.5±3.3 | 41.0±3.1 | F. Ananassa |
| CY-H | 60.9±3.2 | 94.6±1.8 | C. sinensis |
| NZ-2 | 23.9±2.8 | 40.1±2.6 | L. lucidum |
| a: inhibiting rate of stem/%; b: inhibiting rate of root/%. All results are means±SD of three parallel measurements. | |||
| Fungi | a | b | Source |
| HL | 58.0±1.3 | 77.3±0.8 | S. matsudana |
| RBNZ | 60.4±1.3 | 86.7±0.5 | L. japonicum |
| ZJ | 76.0±0.6 | 86.7±0.6 | C. chinensis |
| SH | 68.8±0.8 | 81.8±0.6 | V. odoratissinum |
| SN-1 | 40.1±0.6 | 90.9±0.4 | P. serrulata |
| HT-3 | 63.5±1.0 | 86.7±0.5 | P. tobira |
| YJ | 44.4±0.9 | 50.0±0.4 | R. chinensis |
| CY-H | 60.0±1.1 | 74.3±0.2 | C. sinensis |
| a: inhibiting rate of stem/%; b: inhibiting rate of root/%. All results are means±SD of three parallel measurements. | |||
2.2 菌株CY-H的鉴定 2.2.1 形态学鉴定:
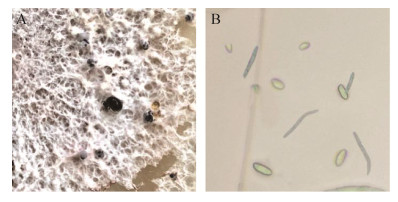
从斜面培养基中挖取CY-H菌株菌落接种到MEA培养基上,在28 ℃恒温避光培养7 d,菌落直径达到90 mm,初期菌丝呈乳白色,边缘规则,至培养后期,菌丝逐步转变为灰黑色。培养至30 d出现黑色的分生孢子器,继续培养6 d后在分生孢子器顶端释放出黄色的分生孢子角(图 2-A),在光学显微镜下分生孢子呈椭圆形和线条型(图 2-B),参考文献[12],与徐成楠等关于间座壳属菌的形态结构相类似,初步确定目标菌株属于间座壳属。
|
| 图 1 菌株CY-H的菌落与分生孢子形态(400×) Figure 1 The colony and spore morphology of strain CY-H (400×). |
|
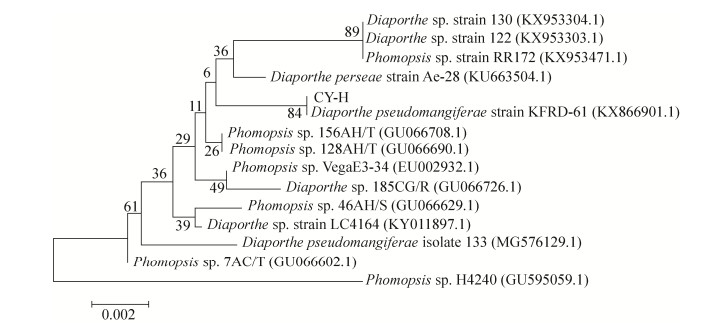
| 图 2 基于真菌CY-H 5.8S-ITS rDNA基因序列构建的系统发育树 Figure 2 Phylogenetic tree generated from rDNA ITS sequences of isolate CY-H using neighbour-joining method. Clades are indicated by the corresponding bootstrap support values and each taxon follows by isolate number and GenBank accession number in bracket. |
2.2.2 分子生物学鉴定:
通过测序可知CY-H菌株的5.8S rDNA序列的长度为582个碱基对(GenBank序列号:MN294467),在NCBI进行BLAST比对后,我们发现该菌与Diaporthe pseudomangiferae strain KFRD-61序列相似度高达99.6%,进一步获取其不同相似度的菌株14株,运用软件MEGA 5.0构建系统发育树(图 2),该菌同D. pseudomangiferae strain KFRD-61进化树距离最近,结合形态学特征,确定该菌为间座壳属真菌Diaporthe sp.。
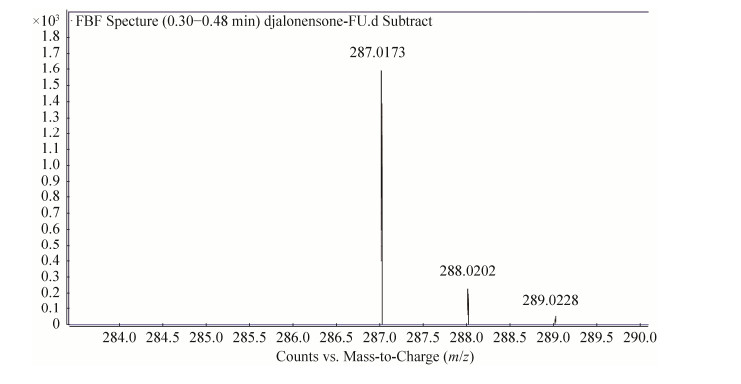
2.3 目标菌种活性化合物的分离与结构鉴定50瓶大米固体培养物经乙酸乙酯萃取、浓缩后获得粗浸膏140 g,经硅胶(200–300目)层析分离,二氯甲烷:甲醇梯度洗脱,得到7个组分(A 100:0、B 100:1、C 100:2、D 100:3、E 100:5、F 100:8、G 100:12),对E组分进一步使用硅胶柱层析,二氯甲烷:甲醇=100:1极性洗脱,经重结晶获得化合物CY1 (44.4 mg),占粗浸膏含量的0.32%。化合物CY1为黄褐色粉末,易溶于二氯甲烷。通过质谱和核磁共振谱分析化合物CY1,得到的波谱数据如下:质谱(图 3)显示HR-ESI-MS:m/z 287.0173[M-H]–,计算值C14H7O7 m/z 287.0192,推测该化合物的分子式为C14H8O7;1H-NMR (600 MHz,DMSO-d6):δ 6.50 (1H,d,J=1.5 Hz),6.64 (1H,d,J=1.5Hz),7.35 (1H,s),7.50 (1H,s),10.42 (2H,s),13.74 (2H,s)。13C-NMR (600 MHz,DMSO-d6):δ 97.5,102.2,102.9,108.2,113.5,115.8,129.5,141.0,141.7,158.5,161.1,161.2,162.7,165.1。比对文献[13],发现其波谱数据与cytosporaphenones C基本一致,因此,单体化合物CY1被鉴定为cytosporaphenones C,其分子结构如图 4所示。
|
| 图 3 .活性化合物CY1的质谱图 Figure 3 ESI-MS spectrum of compound CY1. |

|
| 图 4 活性化合物CY1的分子结构 Figure 4 Structure of compound CY1. |
2.4 单体化合物CY1的除草活性及对作物的安全性测定结果
采用培养皿生物分析法,测定了单体化合物CY1对稗草、反枝苋、小麦和油菜露白种子根的抑制作用(表 3)。在供试浓度为100 μg/mL时,单体化合物CY1对反枝苋根的抑制率低于阳性对照2, 4-D,为57.1%;对稗草根的抑制活性较低,抑制率在20%以下。对作物小麦和油菜根的抑制率远低于2, 4-D,均在20%左右。因此CY1对反枝苋根具有较好的抑制活性,且其对作物安全性较高。
| Compounds | E. crusgalli | A. retroflexus | T. aestivum | B. napus |
| CY1 | 17.2±4.7 | 57.1±1.3 | 20.0±5.3 | 21.9±4.5 |
| 2, 4-D | 100.0 | 82.6±0.8 | 83.7±1.5 | 95.6±0.8 |
| 2, 4-D means positive control; the concentration for the test is 100 μg/mL; All results are means±SD of three parallel measurements. | ||||
3 讨论和结论
本实验从多种发病植株中分离得到39株植物病原真菌,活性筛选结果表明从发病茶叶中分离的菌CY-H乙酸乙酯粗提物对稗草、反枝苋具有较好的除草活性,并对其进行菌株鉴定及活性代谢产物分离。根据形态学和分子生物学鉴定结果,确定菌株CY-H为间座壳属菌(Diaporthe sp.)。间座壳属菌是重要的植物病原真菌,有文献表明[13],间座壳属菌具有产生除草活性物质的潜力,但目前主要是针对间座壳属真菌的鉴定和致病性测定,对其活性次级代谢产物的研究较少。
在活性筛选追踪下,从CY-H菌发酵液的乙酸乙酯粗提物中分离纯化得到1个单体化合物CY1。经核磁共振谱和质谱分析并比对文献,单体化合物CY1被鉴定为cytosporaphenones C,该化合物由刘洪新等于2017年首次从巴戟天内生真菌Cytospora rhizophorae A761分离得到,该内生菌与本文目标菌株同属于间座壳菌目[13];但马双刚等从内生真菌Diaporthe pseudomangiferae (间座壳菌目)中分离到9个化合物,却没有cytosporaphenones C存在[14]。因此,对于单体化合物cytosporaphenones C是否在间座壳菌目菌株中存在普遍性仍需要进一步的实验证明。此外,尚未见关于cytosporaphenones C生物活性的报道。本文首次对化合物CY1进行除草活性测试,结果表明在供试浓度为100 μg/mL时,CY1具有较好的抑制反枝苋根的活性(抑制率为57.1%),且对小麦、油菜的安全性较好(抑制率均在20%左右),具有除草活性的基础。因此,CY-H具有开发为新型微生物源除草剂的潜力,具有深入研究的意义。其他诸如田间防效、活性作用机理、生物安全性等问题还需进一步研究讨论。
| [1] | 张杰.周口地区农业耕作模式对田间杂草的影响.河南师范大学硕士学位论文, 2014. http://d.wanfangdata.com.cn/Thesis/Y2550685 |
| [2] | Ma SJ, Fu LL, He SQ, Lu XP, Wu YY, Ma ZQ, Zhang X. Potent herbicidal activity of Sapindus mukorossi Gaertn. against Avena fatua L. and Amaranthus retroflexus L.. Industrial Crops and Products, 2018, 122: 1-6. DOI:10.1016/j.indcrop.2018.05.046 |
| [3] | Ziveh PS, Mahdavi V. Evaluation of the effectiveness of different herbicides on weed invasion in the fields of triticale. Journal of Plant Protection Research, 2012, 52(4): 435-439. DOI:10.2478/v10045-012-0070-z |
| [4] | 王晓阳.莲子草假隔链格孢菌(Nimbya alternantherae)生防潜力的研究.南京农业大学硕士学位论文, 2009. |
| [5] |
Chen SG, Qiang S. The status and future directions of bioherbicide study and development. Chinese Journal of Biological Control, 2015, 31(5): 770-779.
(in Chinese) 陈世国, 强胜. 生物除草剂研究与开发的现状及未来的发展趋势. 中国生物防治学报, 2015, 31(5): 770-779. |
| [6] | Vurro M, Zonno MC, Evidente A, Andolfi A, Montemurro P. Enhancement of efficacy of Ascochyta caulina to control Chenopodium album by use of phytotoxins and reduced rates of herbicides. Biological Control, 2001, 21(2): 182-190. |
| [7] | Ji H, Wang KY. Research progress of microbial herbicides. Weed Science, 2010(2): 1-7. |
| [8] | Vurro M, Boari A, Evidente A, Andolfi A, Zermane N. Natural metabolites for parasitic weed management. Pest Management Science, 2009, 65(5): 566-571. DOI:10.1002/ps.1742 |
| [9] |
Yu WH, Chen TT, Zou YY, Zhu ML, Wang LJ, Zhang YL. Separation, identification & antimicrobial activity of endophytic fungi isolated from endangered plant of Heptacodium miconioides. Journal of Microbiology, 2015, 35(2): 37-41.
(in Chinese) 余文华, 陈婷婷, 邹园园, 朱蔓莉, 王丽君, 张应烙. 濒危植物七子花内生真菌的分离鉴定及抗菌活性筛选. 微生物学杂志, 2015, 35(2): 37-41. DOI:10.3969/j.issn.1005-7021.2015.02.007 |
| [10] | Zhang YL, Kong LC, Jiang DH, Yin CP, Cai QM, Chen Q, Zheng JY. Phytotoxic and antifungal metabolites from Curvularia sp. FH01 isolated from the gut of Atractomorpha sinensis. Bioresource Technology, 2011, 102(3): 3575-3577. DOI:10.1016/j.biortech.2010.10.028 |
| [11] | Stewart A, Hill R. Applications of Trichoderma in plant growth promotion//Gupta VK, Schmoll M, Herrera-Estrella A, Upadhyay RS, Druzhinina I, Tuohy MG. Biotechnology and Biology of Trichoderma. Amsterdam: Elsevier, 2014: 415-428. |
| [12] |
Xu CN, Chi FM, Ji ZR, Zhang JX, Wang N, Tian H, Zhou ZS. Identification of the Diaporthe pathogen causing stem blight in Liaoning Province. Acta Phytopathologica Sinica, 2018, 48(5): 577-581.
(in Chinese) 徐成楠, 迟福梅, 冀志蕊, 张俊祥, 王娜, 田惠, 周宗山. 辽宁梨树间座壳菌枝枯病的病原鉴定. 植物病理学报, 2018, 48(5): 577-581. |
| [13] | Liu HX, Tan HB, Liu Y, Chen YC, Li SN, Sun ZH, Li HH, Qiu SX, Zhang WM. Three new highly-oxygenated metabolites from the endophytic fungus Cytospora rhizophorae A761. Fitoterapia, 2017, 117: 1-5. DOI:10.1016/j.fitote.2016.12.005 |
| [14] | Liu Z, Zhao JY, Liang X, Lv XX, Li Y, Qu J, Liu YB. Dothiorelone derivatives from an endophyte Diaporthe pseudomangiferaea inhibit the activation of human lung fibroblasts MRC-5 cells. Fitoterapia, 2018, 127: 7-14. DOI:10.1016/j.fitote.2018.04.009 |
 2020, Vol. 60
2020, Vol. 60




