中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 左月婷, 薛亮, 吴清平, 高珺珊, 张菊梅. 2020
- Zuo Yueting, Xue Liang, Wu Qingping, Gao Junshan, Zhang Jumei. 2020
- 诺如病毒感染宿主免疫应答机制及疫苗研究进展
- Advances in researches on immune response mechanism of norovirus infection in hosts
- 微生物学报, 60(11): 2391-2398
- Acta Microbiologica Sinica, 60(11): 2391-2398
-
文章历史
- 收稿日期:2020-01-15
- 修回日期:2020-03-31
- 网络出版日期:2020-04-15
2. 华南理工大学生物科学与工程学院, 广东 广州 510006
2. College of Biological Sciences and Engineering, South China University of Technology, Guangzhou 510006, Guangdong Province, China
诺如病毒(Norovirus,NoV)是引起流行性胃肠炎的最常见原因。据报道,NoV造成了全球约18%的急性胃肠炎病例,其中约有219000例死亡,造成直接医疗费用超过40亿美元、间接社会费用超过600亿美元[1]。我国也是NoV流行的主要地区之一,其中作者课题组研究证实长期以来NoV是我国华南地区重要的急性腹泻病原[2-3],尤其在2016年度,散发性腹泻病人中的NoV感染率高达28.57%[4]。然而由于长期以来缺乏合适的体外培养体系与小动物感染模型,一直阻碍了对NoV致病机制及宿主免疫保护等方面的认识,目前仍没有获得批准的抗NoV感染药物或病毒疫苗。在过去几年里,随着病毒衣壳蛋白外源表达、替代病毒的使用、志愿者实验的开展,尤其是细胞培养模型的突破,研究人员在NoV免疫机理领域的研究取得一系列进展。因此,本文针对近年来在诺如病毒感染宿主的先天性免疫、体液免疫和细胞免疫应答机制等研究进行了综述,并展望了其在诺如病毒候选疫苗研制等领域的应用前景。
1 诺如病毒分子生物学NoV是一种直径为27–37 nm的无包膜单链正义RNA病毒,基因组全长约7.5–7.7 kb。包括3个开放阅读框(Opening reading frames,ORFs)。ORF1为5.1 kb左右,编码约180 kDa的前体蛋白。ORF2约1.8 kb,编码大小58 kDa的衣壳蛋白VP1,在体外真核系统表达可自组装形成病毒样颗粒(virus-like particle,VLP),其形态和抗原性与天然病毒粒子相似,可以作为抗NoV的候选疫苗[5-6]。VP1分为S区和P区,两者由8个氨基酸组成的铰链区连接。P区进一步分成P1亚区与P2亚区,其中P2亚区是大多数细胞受体发生相互作用和免疫表位识别的区域。体外原核表达P区可形成几种结构不同的P颗粒,包括P二聚体、十二聚体的小P颗粒、二十四聚体的完整P颗粒以及三十六聚体P颗粒,其中研究最为深入的是二十四聚体的P颗粒,其最外表面有3个环形结构,已证明这些环形结构是外源表位插入和抗原呈递的有利位点[7],因此P颗粒也被作为候选疫苗之一。ORF3编码约22 kDa的次结构蛋白VP2,可能和基因组包装有关。
NoV的遗传基因和抗原性呈高度多样性,主要衣壳蛋白VP1的氨基酸序列差异高达60%。根据RNA聚合酶和衣壳蛋白区核酸序列的差异,可将其分为10个基因群(GI–GX),每一基因群又可分为多种基因型,同一基因型可再进一步分为不同的基因簇和变异株[8]。与人类感染相关的主要是GⅠ型(GI.1–GI.9)和GⅡ型(GⅡ.1–GⅡ.27)[8]。其中GⅡ.4型在过去20年内盛行,并通过突变和重组而不断演化,从而造成全球55%–85%的NoV暴发[9]。此外,作者课题组在前期研究中发现,GⅡ.3、GⅡ.6等也是NoV感染的常见基因型[10-11],尤其在2014/2015年GⅡ.17型的突然暴发也引起对非GⅡ.4型病毒潜在流行性的广泛关注[3, 12]。
2 诺如病毒感染的宿主相关性宿主对NoV感染的保护作用可以从遗传和免疫学两个方面阐释。
2.1 诺如病毒的宿主易感性从遗传来看,宿主对NoV的易感性是由其岩藻糖基转移酶2(FUT2)基因决定的,该基因调控人类组织血型相关抗原(human histo-blood group antigens,HBGAs)的表达。HBGAs是一种在特定细胞表面表达的聚糖,存在于红细胞、呼吸道、消化道和泌尿生殖道粘膜上皮细胞表面以及唾液等其他身体分泌物中,是ABO血型系统以及Lewis血型系统的主要决定因子。编码功能性FUT2酶的个体为分泌阳性表型,其携带FUT2基因,这类人群对NoV易感。且其中的功能性岩藻糖基转移酶2将岩藻糖转移至胃肠细胞中的HGBA前体,与多数GⅡ.4型NoV的感染有关[13]。不编码功能性FUT2酶的个体为分泌阴性表型,不在粘膜表面表达HBGAs,对NoV感染具有抗性,此类人约占欧亚非洲人口的20%[14]。但是也有一些毒株可以感染非分泌型个体。美国一家护理机构发现非分泌型个体也可能感染GⅡ.4 Den Haag和GⅡ.4 New Orleans,之后通过进一步研究确定了非分泌型Lea+b-个体的唾液确实与GⅡ.4 Den Haag和GⅡ.4 New Orleans VLP结合[15]。此外,GI.1 VLP与A型、AB型和H型唾液结合,与B型唾液不结合[16]。这些观察结果可以归因为宿主分泌状态对NoV的遗传易感性差异。
2.2 诺如病毒的宿主免疫保护机制 2.2.1 先天性免疫对诺如病毒的保护作用:在小鼠模型中,先天性免疫应答主要通过干扰素(IFN)依赖性途径限制病毒复制[17]。缺乏Ⅰ型IFN (IFN-α和IFN-β)受体的小鼠在受到急性鼠诺如病毒(MNoV)攻击后死亡[18]。此外,如果Ⅱ型IFN (IFN-γ)受体也发生突变,则致死性加剧。这两项结果表明Ⅰ型和Ⅱ型IFN有联合抗病毒作用[19]。另外,已有研究证明Ⅲ型IFN (IFN-λ)参与体内MNoV的控制。腹腔注射IFN-λ可降低病毒持久性,在不产生适应性免疫应答的情况下清除病毒[20]。由此可见IFN在控制MNoV复制方面有至关重要的作用。
2.2.2 适应性免疫对诺如病毒的作用:先天性免疫应答通过早期产生IFN来阻止病毒复制,然而启动适应性免疫应答对于控制诺如病毒感染更加重要。基于动物模型的研究显示适应性免疫应答有助于清除NoV感染并可能产生免疫记忆预防再次感染。
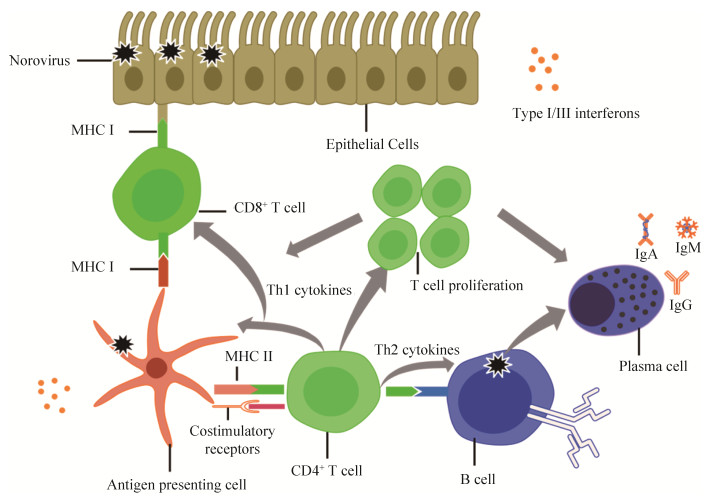
适应性免疫应答包括体液免疫和细胞免疫两部分。在体液免疫应答方面,人感染NoV会导致IgA、IgG和IgM抗体水平的增加[21]。IgA在可检测水平中最早产生。感染后5 d血清IgA抗体水平显著上升,感染后2 d唾液IgA抗体水平显著上升[22]。预先存在特异性粪便IgA抗体水平降低了粪便中病毒RNA滴度并减轻了胃肠炎疾病的严重程度[21]。此外,研究表明母乳中IgA可以保护婴儿免受NoV感染,且在较宽的年龄范围、不同种族的个体中抑制活性均不变[23-24]。IgG抗体在攻击后7 d开始产生,攻击后14 d所有感染个体会产生血清IgG免疫应答[25]。一项针对坦佩雷大学医院感染NoV住院儿童的研究发现,高特异性血清IgG滴度和阻断抗体与NoV感染的保护相关,且这种保护是基因特异性的[26]。进一步的研究表明,预先存在的高滴度基因特异性血清IgG与阻断VLP和HBGA受体的结合能力呈正相关[26]。其中一些抗体可能会阻止相同或相关毒株的再次感染,但鉴于交叉反应模式和基因组的多样性,由单个NoV感染产生的保护作用可能不会延伸到整个基因群,尤其是GⅡ型[27]。因此,即使在成人血清中发现预先存在的基因特异性IgG抗体,对NoV的感染也没有保护作用。与之相反,有研究表明感染NoV后病毒特异性IgG记忆B细胞与肠胃炎的保护作用相关[21]。感染后第180天IgG记忆B细胞仍具有持久性,表明这些细胞具有潜在的长期保护作用[28]。因此,分析记忆B细胞以增加针对NoV感染的长期保护的理解显得十分重要。在细胞免疫应答方面,关于NoV的研究以T细胞免疫为主。如图 1所示,NoV感染抗原呈递细胞(antigen presenting cells,APC)、上皮细胞或通过B细胞受体感染B细胞,从而产生细胞毒性。NoV抗原从感染的细胞中通过主要组织相容性复合物(MHC)I呈递给CD8+ T细胞,或通过APC和B细胞上的MHC Ⅱ呈递给CD4+ T细胞。CD4+ T细胞增殖并释放细胞因子,以增强APC活性。激活APC可以增加共刺激受体的呈递作用、释放响应各种刺激信号的细胞因子[25]。Newman等[29]证明感染者血清中Th1细胞因子(例如IFN-γ)、促炎性细胞因子(例如IL-1β、IL-6和IL-8)和Th2细胞因子(例如IL-4和IL-10)升高,促进了机体细胞免疫应答。除此以外,Tomov等[30]证明病毒特异性CD8+ T细胞能够降低RAG1基因敲除小鼠的病毒滴度,表明CD8+ T细胞是清除NoV感染的适应性免疫应答的另一个关键组成部分。CD4+和CD8+ T细胞在调节MNoV感染中也起着协同作用。缺乏CD4+ T细胞的小鼠表现出较高的病毒滴度,但病毒清除率正常,而缺乏CD8+ T细胞的小鼠表现出病毒清除延迟现象[31]。
|
| 图 1 诺如病毒感染宿主免疫应答原理 Figure 1 Schematic of Norovirus infection host and immune response. |
B细胞和T细胞在评估适应性免疫应答对清除NoV感染中十分重要。缺少任意一种或两种细胞类型都缺乏的Rag1–/–和Rag2–/–小鼠,都不能够有效清除MNoV感染[32]。
综上所述,先天性和适应性免疫应答在清除NoV感染方面有协同作用。前者在控制NoV感染方面至关重要。若NoV拮抗先天性免疫应答而发生感染,适应性免疫应答系统便会启动,该系统通过T细胞和B细胞的作用清除病毒感染,同时产生高度的免疫记忆。因此阐明免疫拮抗机制可以为设计有效的免疫平台提供关键基础。但由于目前对免疫机制的了解还不够完全以及抗原多样性等原因,有效NoV疫苗的开发仍有很大难度。此外,由于病毒的多样性,可能需要设计多价疫苗。这对于NoV免疫原性、不同基因型之间的交叉保护作用以及保护相关性的持续研究都对疫苗开发有重要启示,并有助于加速疫苗的研发。
3 诺如病毒疫苗的研究NoV衣壳蛋白在几种系统中的重组表达促进了候选亚单位疫苗VLP和P颗粒的产生。但是在疫苗研发方面,由于NoV基因多样且高度变异,因此迄今为止尚无有效的上市疫苗。二价VLP疫苗的动物试验和人体研究表明接种多价疫苗可能诱导针对新基因型和异源毒株广泛中和抗体的产生。未来的研究还需要解决的问题是:(1)目前的疫苗候选物能否对抗由异源NoV引起的疾病(即疫苗未包括的毒株),以及疫苗应答的广度和稳定性是否足以应对NoV基因型的多样性和循环性变化;(2)这些疫苗在不同年龄组和免疫力受损的人群中是否同样有效,以及从免疫力上证明所采用的疫苗是否合理。需要针对NoV感染的免疫保护相关性进行进一步研究[33]。表 1介绍了目前正处于不同研发阶段的NoV候选疫苗。
| Candidate vaccine | Investigators | Current status | References |
| GI.1/GⅡ.4 VLP recombinant vaccine | Takeda | Clinical phase | [34] |
| GI.1 recombinant adenovirus vaccine | Vaxart Inc | Clinical phase | [34] |
| Norovirus tetravalent vaccine | Institut Pasteur of Shanghai Chinese Academy of Sciences, Chongqing Zhifei Biological Products Co., Ltd. | Clinical phase | [35] |
| GI.3/GⅡ.4 VLP/rVP6 recombinant vaccine | University of Tampere, UMN Pharma | Pre-clinical | [36] |
| GⅡ.4 VLP/EV71 bivalent vaccine | Institut Pasteur of Shanghai Chinese Academy of Sciences | Pre-clinical | [37] |
| GⅡ.4 VLP | Arizona State University | Pre-clinical | [38] |
| GⅡ.4 VP1 recombinant adenovirus vaccine | Chinese Center for Disease Control and Prevention | Pre-clinica | [39] |
4 展望
NoV已成为全球引发急性胃肠炎的重要食源性病原。疫苗接种是预防传染病的最有效策略,迫切需要一种NoV疫苗来保护人群。迄今为止,尚无批准的NoV疫苗或抗病毒药物,尽管近年来HuNoV在体外培养领域取得巨大突破。例如Nicolas W. Cortes-Penfield等[33]证明了HuNoV能够在人肠上皮细胞中复制并产生感染性子代颗粒,随后用培养出的子代病毒颗粒证明经加热、辐射和含有HBGA阻断抗体的人血清处理可以灭活NoV。Karst等[40]报道了HuNoV可以在B细胞系中复制,且共生细菌可作为感染的辅助因子。虽然肠细胞系和B细胞系这两个系统支持HuNoV的复制,但其复制水平不足以产生高度纯化的病毒颗粒[41]。目前,van Dycke等[42]通过试验验证了NoV可以在斑马鱼幼虫体内进行复制,这将大大促进HuNoV生物学的研究和抗病毒策略的发展。基于VLP和P颗粒作为亚单位疫苗的免疫试验研究有助于了解NoV对宿主的免疫应答。NoV免疫学领域仍需不断创新和发现,从而有助于这一病原感染的预防和治疗。
| [1] | Bartsch SM, Lopman BA, Ozawa S, Hall AJ, Lee BY. Global economic burden of norovirus gastroenteritis. PLoS One, 2016, 11(4): e0151219. DOI:10.1371/journal.pone.0151219 |
| [2] | Xue L, Wu QP, Dong RM, Kou XX, Li YL, Zhang JM, Guo WP. Genetic analysis of noroviruses associated with sporadic gastroenteritis during winter in Guangzhou, China. Foodborne Pathogens and Disease, 2013, 10(10): 888-895. DOI:10.1089/fpd.2013.1521 |
| [3] | Xue L, Dong RM, Wu QP, Li YL, Cai WC, Kou XX, Zhang JM, Guo WP. Molecular epidemiology of noroviruses associated with sporadic gastroenteritis in Guangzhou, China, 2013-2015. Archives of Virology, 2016, 161(5): 1377-1384. DOI:10.1007/s00705-016-2784-0 |
| [4] | Xue L, Cai WC, Gao JS, Zhang L, Dong RM, Li YL, Wu HM, Chen MT, Zhang JM, Wang J, Wu QP. The resurgence of the norovirus GⅡ.4 variant associated with sporadic gastroenteritis in the post-GⅡ.17 period in South China, 2015 to 2017. BMC Infectious Diseases, 2019, 19(1): 696. DOI:10.1186/s12879-019-4331-6 |
| [5] | Tamminen K, Malm M, Vesikari T, Blazevic V. Immunological cross-reactivity of an ancestral and the most recent pandemic norovirus GⅡ.4 variant. Viruses, 2019, 11(2): 91. DOI:10.3390/v11020091 |
| [6] | Malm M, Diessner A, Tamminen K, Liebscher M, Vesikari T, Blazevic V. Rotavirus VP6 as an adjuvant for bivalent norovirus vaccine produced in Nicotiana benthamian. Pharmaceutics, 2019, 11(5): 229. DOI:10.3390/pharmaceutics11050229 |
| [7] | Tan M, Jiang X. Norovirus P particle:a subviral nanoparticle for vaccine development against norovirus, rotavirus and influenza virus. Nanomedicine, 2012, 7(6): 889-897. DOI:10.2217/nnm.12.62 |
| [8] | Chhabra P, de Graaf M, Parra GI, Chan MCW, Green K, Martella V, Wang QH, White PA, Katayama K, Vennema H, Koopmans MPG, Vinjé J. Updated classification of norovirus genogroups and genotypes. Journal of General Virology, 2019, 100(10): 1393-1406. DOI:10.1099/jgv.0.001318 |
| [9] | Villabruna N, Koopmans MPG, de Graaf M. Animals as reservoir for human norovirus. Viruses, 2019, 11(5): 478. DOI:10.3390/v11050478 |
| [10] | Xue L, Wu QP, Dong RM, Cai WC, Wu HM, Chen MT, Chen G, Wang J, Zhang JM. Comparative phylogenetic analyses of recombinant noroviruses based on different protein-encoding regions show the recombination-associated evolution pattern. Scientific Reports, 2017, 7(1): 4976. DOI:10.1038/s41598-017-01640-4 |
| [11] | Xue L, Wu QP, Kou XX, Cai WC, Zhang JM, Guo W. Genome characterization of a GⅡ.6 norovirus strain identified in China. Infection, Genetics and Evolution, 2015, 31: 110-117. DOI:10.1016/j.meegid.2015.01.027 |
| [12] | Xue L, Wu QP, Cai WC, Zhang JM, Guo WP. Molecular characterization of new emerging GⅡ.17 norovirus strains from South China. Infection, Genetics and Evolution, 2016, 40: 1-7. DOI:10.1016/j.meegid.2016.02.026 |
| [13] | Ettayebi K, Crawford SE, Murakami K, Broughman JR, Karandikar U, Tenge VR, Neill FH, Blutt SE, Zeng XL, Qu L, Kou BJ, Opekun AR, Burrin D, Graham DY, Ramani S, Atmar RL, Estes MK. Replication of human noroviruses in stem cell-derived human enteroids. Science, 2016, 353(6306): 1387-1393. DOI:10.1126/science.aaf5211 |
| [14] | Nordgren J, Sharma S, Kambhampati A, Lopman B, Svensson L. Innate resistance and susceptibility to norovirus infection. PLoS Pathogens, 2016, 12(4): e1005385. DOI:10.1371/journal.ppat.1005385 |
| [15] | Costantini VP, Cooper EM, Hardaker HL, Lee LE, Bierhoff M, Biggs C, Cieslak PR, Hall AJ, Vinjé J. Epidemiologic, virologic, and host genetic factors of norovirus outbreaks in long-term care facilities. Clinical Infectious Diseases, 2015, 62(1): 1-10. |
| [16] | Morozov V, Hanisch FG, Wegner KM, Schroten H. Pandemic GⅡ.4 sydney and epidemic GⅡ.17 Kawasaki308 noroviruses display distinct specificities for histo-blood group antigens leading to different transmission vector dynamics in pacific oysters. Frontiers in Microbiology, 2018, 9: 2826. DOI:10.3389/fmicb.2018.02826 |
| [17] | Newman KL, Leon JS. Norovirus immunology:of mice and mechanisms. European Journal of Immunology, 2015, 45(10): 2742-2757. DOI:10.1002/eji.201545512 |
| [18] | Nice TJ, Osborne LC, Tomov VT, Artis D, Wherry EJ, Virgin HW. Type Ⅰ interferon receptor deficiency in dendritic cells facilitates systemic murine norovirus persistence despite enhanced adaptive immunity. PLoS Pathogens, 2016, 12(6): e1005684. DOI:10.1371/journal.ppat.1005684 |
| [19] | Hassan E, Baldridge MT. Norovirus encounters in the gut:multifaceted interactions and disease outcomes. Mucosal Immunology, 2019, 12(6): 1259-1267. DOI:10.1038/s41385-019-0199-4 |
| [20] | Nice TJ, Baldridge MT, McCune BT, Norman JM, Lazear HM, Artyomov M, Diamond MS, Virgin HW. Interferon-λ cures persistent murine norovirus infection in the absence of adaptive immunity. Science, 2015, 347(6219): 269-273. DOI:10.1126/science.1258100 |
| [21] | Ramani S, Neill FH, Opekun AR, Gilger MA, Graham DY, Estes MK, Atmar RL. Mucosal and cellular immune responses to Norwalk virus. The Journal of Infectious Diseases, 2015, 212(3): 397-405. DOI:10.1093/infdis/jiv053 |
| [22] | Atmar RL, Opekun AR, Gilger MA, Estes MK, Crawford SE, Neill FH, Ramani S, Hill H, Ferreira J, Graham DY. Determination of the 50% human infectious dose for Norwalk virus. The Journal of Infectious Diseases, 2014, 209(7): 1016-1022. DOI:10.1093/infdis/jit620 |
| [23] | Newman KL, Moe CL, Kirby AE, Flanders WD, Parkos CA, Leon JS. Norovirus in symptomatic and asymptomatic individuals:cytokines and viral shedding. Clinical & Experimental Immunology, 2016, 184(3): 347-357. |
| [24] | Khodayar-Pardo P, Martínez-Costa C, Carmona-Vicente N, Buesa J. Norovirus GⅡ.4 antibodies in breast milk and serum samples:their role preventing virus-like particles binding to their receptors. The Pediatric Infectious Disease Journal, 2014, 33(6): 554-559. DOI:10.1097/INF.0000000000000207 |
| [25] | Donaldson B, Lateef Z, Walker GF, Young SL, Ward VK. Virus-like particle vaccines:immunology and formulation for clinical translation. Expert Review of Vaccines, 2018, 17(9): 833-849. DOI:10.1080/14760584.2018.1516552 |
| [26] | Malm M, Uusi-Kerttula H, Vesikari T, Blazevic V. High serum levels of norovirus genotype-specific blocking antibodies correlate with protection from infection in children. The Journal of Infectious Diseases, 2014, 210(11): 1755-1762. DOI:10.1093/infdis/jiu361 |
| [27] | Lindesmith LC, Donaldson E, Leon J, Moe CL, Frelinger JA, Johnston RE, Weber DJ, Baric RS. Heterotypic humoral and cellular immune responses following Norwalk virus infection. Journal of Virology, 2010, 84(4): 1800-1815. |
| [28] | Ramani S, Neill FH, Ferreira J, Treanor JJ, Frey SE, Topham DJ, Goodwin RR, Borkowski A, Baehner F, Mendelman PM, Estes MK, Atmar RL. B-Cell responses to intramuscular administration of a bivalent virus-like particle human norovirus vaccine. Clinical and Vaccine Immunology, 2017, 24(5): e00571-16. |
| [29] | Saito M, Goel-Apaza S, Espetia S, Velasquez D, Cabrera L, Loli S, Crabtree JE, Black RE, Kosek M, Checkley W, Zimic M, Bern C, Cama V, Gilman RH, for the Norovirus Working Group in Peru, Xiao L, Kelleher D, Windle HJ, van Doorn LJ, Varela M, Verastegui M, Calderon M, Alva A, Roman K. Multiple norovirus infections in a birth cohort in a Peruvian periurban community. Clinical Infectious Diseases, 2014, 58(4): 483-491. |
| [30] | Tomov VT, Osborne LC, Dolfi DV, Sonnenberg GF, Monticelli LA, Mansfield K, Virgin HW, Artis D, Wherry EJ. Persistent enteric murine norovirus infection is associated with functionally suboptimal virus-specific CD8 T cell responses. Journal of Virology, 2013, 87(12): 7015-7031. DOI:10.1128/JVI.03389-12 |
| [31] | Zhu S, Jones MK, Hickman D, Han S, Reeves W, Karst SM. Norovirus antagonism of B-cell antigen presentation results in impaired control of acute infection. Mucosal Immunology, 2016, 9(6): 1559-1570. DOI:10.1038/mi.2016.15 |
| [32] | Zhu S, Regev D, Watanabe M, Hickman D, Moussatche N, Jesus DM, Kahan SM, Napthine S, Brierley I, Hunter Ⅲ RN, Devabhaktuni D, Jones MK, Karst SM. Identification of immune and viral correlates of norovirus protective immunity through comparative study of intra-cluster norovirus strains. PLoS Pathogens, 2013, 9(9): e1003592. DOI:10.1371/journal.ppat.1003592 |
| [33] | Cortes-Penfield NW, Ramani S, Estes MK, Atmar RL. Prospects and challenges in the development of a norovirus vaccine. Clinical Therapeutics, 2017, 39(8): 1537-1549. DOI:10.1016/j.clinthera.2017.07.002 |
| [34] | Mattison CP, Cardemil CV, Hall AJ. Progress on norovirus vaccine research:public health considerations and future directions. Expert Review of Vaccines, 2018, 17(9): 773-784. DOI:10.1080/14760584.2018.1510327 |
| [35] |
People's Daily Online. Norovirus quadrivalent vaccine enters clinical research.[2019-10-28]. http://zj.people.com.cn/n2/2019/0605/c186327-33012990.html. (in Chinese) 人民网.诺如病毒四价疫苗进入临床研究.[2019-10-28]. http://zj.people.com.cn/n2/2019/0605/c186327-33012990.html. |
| [36] | Blazevic V, Lappalainen S, Nurminen K, Huhti L, Vesikari T. Norovirus VLPs and rotavirus VP6 protein as combined vaccine for childhood gastroenteritis. Vaccine, 2011, 29(45): 8126-8133. DOI:10.1016/j.vaccine.2011.08.026 |
| [37] | Wang XL, Ku ZQ, Dai WL, Chen T, Ye XH, Zhang C, Zhang YY, Liu QW, Jin X, Huang Z. A bivalent virus-like particle based vaccine induces a balanced antibody response against both enterovirus 71 and norovirus in mice. Vaccine, 2015, 33(43): 5779-5785. DOI:10.1016/j.vaccine.2015.09.043 |
| [38] | Huang Z, Chen Q, Hjelm B, Arntzen C, Mason H. A DNA replicon system for rapid high-level production of virus-like particles in plants. Biotechnology and Bioengineering, 2009, 103(4): 706-714. DOI:10.1002/bit.22299 |
| [39] | Guo L, Wang JW, Zhou HL, Si HL, Wang M, Song JD, Han BJ, Shu Y, Ren LL, Qu JG, Hung T. Intranasal administration of a recombinant adenovirus expressing the norovirus capsid protein stimulates specific humoral, mucosal, and cellular immune responses in mice. Vaccine, 2008, 26(4): 460-468. DOI:10.1016/j.vaccine.2007.11.039 |
| [40] | Karst SM. Identification of a novel cellular target and a co-factor for norovirus infection-B cells & commensal bacteria. Gut Microbes, 2015, 6(4): 266-271. DOI:10.1080/19490976.2015.1052211 |
| [41] | Bhar S, Jones MK. In vitro replication of human norovirus. Viruses, 2019, 11(6): 547. DOI:10.3390/v11060547 |
| [42] | van Dycke J, Ny A, Conceicao-Neto N, Maes J, Hosmillo M, Cuvry A, Goodfellow I, Nogueira TC, Verbeken E, Matthijnssens J, de Witte P, Neyts J, Rocha-Pereira J. A robust human norovirus replication model in zebrafish larvae. PLoS Pathogens, 2019, 15(9): e1008009. DOI:10.1371/journal.ppat.1008009 |
 2020, Vol. 60
2020, Vol. 60