中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张瑞丰, 范学锋, 韦杰, 张娜, 杨文香, 刘大群. 2020
- Ruifeng Zhang, Xuefeng Fan, Jie Wei, Na Zhang, Wenxiang Yang, Daqun Liu. 2020
- 小麦叶锈菌休眠与萌发夏孢子的差异表达
- Analysis of differently expressed genes between resting and germinated urediniospores of wheat leaf rust
- 微生物学报, 60(1): 81-94
- Acta Microbiologica Sinica, 60(1): 81-94
-
文章历史
- 收稿日期:2019-03-10
- 修回日期:2019-04-21
- 网络出版日期:2019-05-20
2. 中国农业科学院, 北京 100081
2. Chinese Academy of Agricultural Sciences(CAAS), Beijing 100081, China
小麦叶锈菌(Puccinia triticina,Pt)引起的小麦叶锈病是世界范围内对小麦安全生产严重威胁的小麦病害之一[1]。小麦叶锈菌主要通过夏孢子多次侵染来危害小麦叶片。叶锈菌夏孢子在其生命循环中占有重要的地位。在适宜条件下叶锈菌夏孢子萌发产生芽管,芽管穿透寄主气孔并在寄主细胞中形成吸器。夏孢子萌发是叶锈菌入侵寄主的第一步,因此开展对小麦叶锈菌夏孢子萌发过程中的差异基因筛选及其调控机理的研究对防治小麦叶锈菌具有重要的意义。
国际上开展了一些关于小麦叶锈菌基因或蛋白表达的研究,旨在揭示可能参与致病的机制。如Thara[2]首次通过抑制消减杂交技术构建感叶锈病小麦cDNA文库,共获得了104个差异表达基因,其中至少有69个基因是锈菌中的基因,这些诱导基因与已知的稻瘟病病原物、小麦秆锈菌及蚕豆锈菌等其他真菌的毒力基因具有同源性,这表明锈菌与其他寄生真菌具有相似性。Rampitsch等[3]用双向聚丙烯酰胺凝胶电泳(2D-PAGE)技术对感病小麦蛋白组与叶锈菌侵染9 d后的蛋白质组进行了鉴定,发现一些代谢酶、结构蛋白和14-3-3-类蛋白质等在不同阶段存在差异。Hu等[4]构建了休眠夏孢子阶段、萌发夏孢子阶段、附着胞形成阶段、吸器形成阶段及与非亲和互作后24 h的cDNA文库,揭示出在休眠孢子阶段与萌发阶段存在很多一致性基因,而差异表达基因较少。在孢子萌发与休眠夏孢子期间样品中筛选出160个差异基因,此期间的差异基因涉及能量代谢、硫代谢的负调节因子、脂类代谢等过程,并指出cAMP依赖性蛋白激酶和MAP激酶可能与致病有关。新一代高通量测序技术为研究小麦叶锈菌的基因表达提供了强有力的支持。Bruce等[5]将6种不同生理小种的小麦叶锈病分别接种于小麦感叶锈病品种Thatcher上,并在接种6 d后利用Illumina平台对严重发病的小麦叶片进行测序,获得了222571个锈菌中的序列,研究侧重于分泌蛋白,但并未侧重对差异基因的分析。张河山[6]利用RNA-seq方法分析了小麦叶锈菌感病植株接种6 d样品表达基因,基因功能主要涉及物质结合、水解、催化、物质转移、信号转导、物质合成和物质代谢等过程。上述研究更多地将研究集中于叶锈菌进入寄主之后的表现,关于与叶锈菌萌发、芽管形成等相关的研究并未见深入研究的报道。本研究利用小麦叶锈菌流行致病类型THTT的孢子时期样品及萌发8 h的夏孢子样品构建的cDNA文库,对基因表达量进行分析,旨在挖掘该阶段的差异表达基因,以期筛选小麦叶锈菌萌发过程中的重要基因,更好地理解小麦叶锈菌致病的分子机制。
1 材料和方法 1.1 材料与仪器单孢分离的小麦叶锈菌致病类型THTT及小麦感叶锈品种郑州5389均由河北农业大学植物保护学院分子植物病理学实验室提供。
试验使用仪器包括:Lightcycler 96罗氏实时荧光定量PCR仪、Thermo Nanodrop微量分光光度计、Eppendorf高速离心机Centrifuge 5415D、Nikon荧光显微镜等。
1.2 RNA的提取与文库构建参考杜冬冬[7]提取小麦锈菌夏孢子及萌发样品RNA方法,将新鲜夏孢子接种至固定在DEPC水琼脂培养基上的感病品种小麦叶片上,加无菌水使其萌发并黑暗保湿,取新鲜休眠夏孢子和新鲜夏孢子萌发处理后2、4、6、8、10 h的样品,显微观察孢子萌发情况并提取RNA,试验中设置3个生物学重复。
使用琼脂糖凝胶电泳检测RNA的质量,用Nanodrop微量分光光度计检测RNA纯度,用Qubit对RNA浓度进行精确定量。检测合格后将新鲜休眠夏孢子及新鲜孢子萌发8 h的RNA样品送诺和致源生物公司进行RNA-seq测序(诺和致源生物公司完成)。
1.3 基因表达水平分析采用Trinity等[8]的方法对clean reads进行拼接,用Corset等[9]方法比对到转录本的reads数和表达模式对转录本进行层次聚类(网站https://code.google.com/p/corset-project)。以Corset层次聚类后得到的最长Cluster序列进行后续分析。采用标准FPKM (Fragments per kilobase of transcript per million mapped reads)转换法计算基因表达量[10]。利用诺禾致源的Novofinder软件进行差异表达、富集分析。
1.4 差异基因的筛选及富集分析根据在萌发前后表达情况和在各阶段的功能差异,筛选萌发过程中差异表达的基因,并通过GO富集及KEGG注释对其功能进行预测。校正后P-padj≤0.05,同时考虑比较样品间的read count值。
1.5 实时定量分析差异Unigenes用反转录得到的休眠夏孢子和夏孢子萌发样品的cDNA为模板,以肌动蛋白Actin为内参,选择10个Unigenes序列应用LC96实时荧光定量仪进行荧光定量分析。其中Cluster-19789.97403参与氮化合物代谢过程;Cluster-19789.98017、Cluster-19789.92844和Cluster-19789.94438在SNARE蛋白在囊泡运输交流通路中差异表达;Cluster-19789.94898、Cluster-19789.97883、Cluster-19789.109888、Cluster-19789.94800和Cluster-19789.00701参与MAPK通路;Cluster-19789.97688涉及小GTPase介导的信号转导的调控。实时定量结果按照2–ΔCT的方法计算目标序列的相对表达量。实时定量引物设计如表 1所示。
| Unigenes ID | Primer sequence (5'→3') |
| 19789.94898 | F-ACAGAAAAGGAACAGGAT |
| 19789.94898 | R-CTCACAAACACACACGAA |
| 19789.97688 | F-CAAAGACTAGTAGAAAGC |
| 19789.97688 | R-GGTAATAAAGTGACCGTA |
| 19789.97883 | F-AAGAAGGGTGGTGGTAGA |
| 19789.97883 | R-AGGAAAAAAAGGAGACAG |
| 19789.109888 | F-AAGCCAGCTCCTTATTCT |
| 19789.109888 | R-GTAGTCCTTCTCCATCCC |
| 19789.94800 | F-ATCACCGACAACGACACA |
| 19789.94800 | R-CCTCATCCTTACCGACCC |
| 19789.00701 | F-ACGAAAGTATCGGCAATA |
| 19789.00701 | R-TTCACCGTGACGTAAAGC |
| 19789.98017 | F-TGTGAATGTGTGTGTGGG |
| 19789.98017 | R-TGTGCTAATCCTTGCCTC |
| 19789.92844 | F-AGAACAGTATCACTTCCG |
| 19789.92844 | R-ACGTTTAGACTCGACCAC |
| 19789.94438 | F-CTGGACTGATTGTCGTTG |
| 19789.94438 | R-ATTTATCTTCATTTGGCT |
| 19789.97403 | F-ATGCGCCACTGCCACTGT |
| 19789.97403 | R-GCCCTCATCTGGATTCAA |
2 结果和分析 2.1 孢子萌发情况显微观察结果
试验选择新鲜小麦叶锈菌夏孢子进行0、2、4、6、8、10 h的萌发处理,参考姚宏鹏[11]试验叶锈菌夏孢子萌发的方法,利用Nikon显微镜在10倍目镜、20倍物镜视野下进行观察,发现夏孢子在遇水4 h时开始陆续萌发,在遇水8 h时萌发率和芽管伸长长度与10 h相比无明显差异。因此选择萌发8 h样品送公司进行RNA-seq测序。对萌发不同时间样品进行的显微观察结果见图 1。

|
| 图 1 小麦叶锈菌遇水不同时间段显微观察结果 Figure 1 Microscopic observation results of Pt during different periods of time. A, B, C, D, E and F show the germination of urediniospores in water at 0, 2, 4, 6, 8 and 10 h, respectively (10×20). |
2.2 基因表达水平分析与差异表达基因筛选
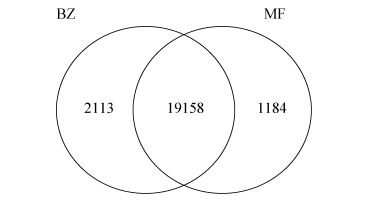
在获得较高质量文库的基础上(数据未显示),经拼接共获得22455个Unigenes,其中在孢子时期(记作BZ)表达的有21271个,在萌发时期(记作MF)表达的有20342个,孢子时期与萌发时期共同表达的有19158个,孢子时期特异表达为2113个,萌发时期特异表达为1184个(图 2)。获得孢子萌发阶段差异9725个,其中上调表达的有4400个,下调表达的有5325个。
|
| 图 2 小麦叶锈菌夏孢子孢子时期休眠与萌发时期unigenes韦恩图 Figure 2 Venn diagram of unigenes of resting and germinated urediniospores period. BZ represents the resting urediniospores; MF represents the germinated urediniospores. |
2.3 差异表达基因GO功能分析
用goseq方法对差异基因进行了GO富集分析[12],差异基因分布于GO数据库中生物学过程(Biological process,BP)、细胞组分(Cellular component,CC)和分子功能(Molecular Function,MF)。
夏孢子萌发时期与休眠夏孢子相比,上调表达的4400个基因中有2985个注释到GO数据库,共包括3791个GO功能;下调表达的5325个基因中有3767个基因注释到了GO数据库,包括4407个GO功能。选择三大类中各自富集程度较高的几类基因功能制作萌发时期相对孢子时期的上调及下调差异基因GO富集图(图 3)。

|
| 图 3 夏孢子萌发时期相比休眠夏孢子时期上调基因及下调基因的GO富集图 Figure 3 GO enrichment map of up-regulated and down-regulated unigenes that resting urediniospores compared with germinated urediniospores. BP: Biological process; CC: Cellular component; MF: Molecular function. Each classification is subdivided into different kinds of pathways. The vertical coordinates are the number of genes contained in each pathway. |
由图 3分析可知差异基因所占类别最高的过程有3个:单有机体过程(Single-organism process)、单有机体细胞过程(Single-organism cellular process)和氮化合物代谢过程(Nitrogen compound metabolic process)。相比休眠夏孢子时期,在萌发孢子时期的上调基因中,涉及单有机体过程的基因共有1476个,占所有上调基因的33.5%,单有机体细胞过程和氮化合物代谢过程序列分别为1255个和1170个,所占比例分别为28.5%和26.6%;下调基因中单有机体过程共有3426个被注释,占下调序列的64.3%,单有机体细胞过程和氮化合物代谢过程基因数分别为2860个和2744个,所占比例为53.7%和51.5%。
其他大量表达的上调基因涉及细胞组分(Cell part)、细胞质部分(Cytoplasmic part)、细胞进程(Cellular process)、有机物代谢过程(Organic substance metabolic process)、催化活性调节(Catalytic activity)、代谢过程(Metabolic process)、细胞代谢过程(Cellular metabolic process)、生物合成过程(Biosynthetic process)、水解酶活性(Hydrolase activity)、结合过程(Binding)、杂环代谢过程(Heterocycle metabolic process)等;其他大量表达的下调基因涉及有机物代谢过程(Organic substance metabolic process)、生物合成过程(Biosynthetic process)、水解酶活性(Hydrolase activity)、催化活性调节(Catalytic activity)、代谢过程(Metabolic process)、细胞代谢过程(Cellular metabolic process)、高分子代谢过程(Macromolecule metabolic process)、杂环化合物结合(Heterocyclic compound binding)等。
在萌发时期特异表达的1184个基因中,共有726个基因注释到1549个基因功能,涉及氨基酸合成过程(Amino acid biosynthetic process)、核糖体生物合成(Ribosome biogenesis)、Rho蛋白信号转导的调控(Regulation of Rho protein signal transduction)、DNA复制(DNA replication)、信号传导(Signal transduction)、转录因子活性(Transcription factor activity)等功能。
为了分析GO分类中的基因功能之间的关系,设计各自的有向无环图。注释到生物学过程(BP)中的上调表达的差异基因功能间的联系如图 4所示。

|
| 图 4 注释到生物学过程中的上调差异基因的DAG富集图 Figure 4 The DAG enrichment map of up-regulated differentially expressed genes in biological process. The darker the colour, the more significant. |
由图 4分析可知,在注释到生物学过程(BP)的上调差异基因中,富集程度较高的基因功能为信号传导过程、催化活性调节、小GTPase介导的信号转导及其调控过程。其中小GTPase介导的信号转导调控(Regulation of small GTPase mediated signal transduction)的富集程度最高。用相同的方法分析得出,在注释到细胞组分(CC)的上调差异基因富集程度较高的功能涉及细胞过程、核浆(Nucleoplasm)等。注释到分子功能(MF)的上调差异基因涉及ATP酶活性(ATPase activity)调节等功能;注释到生物学过程(BP)的下调差异基因涉及有机氮化合物代谢过程、小分子代谢过程(Small molecule metabolic process)等。在注释到细胞组分(CC)的下调差异基因主要涉及编码细胞质(Cytoplasm)、细胞内组分(Intracellular part)等。注释到分子功能(MF)的上调差异基因主要涉及辅助因子结合(Cofactor binding)、辅酶结合(Coenzyme binding)等功能。
综合GO数据库萌发时期与孢子时期转录组,差异基因中上调基因富集最显著的基因主要包括细胞过程、代谢过程、信号传导和催化酶活性等过程。而下调基因富集主要集中在有机物代谢过程、单有机体过程、催化酶活性、细胞代谢等过程。
2.4 差异基因KEGG注释和Pathway富集萌发时期与休眠孢子差异表达基因共参与109条通路,其中差异显著的有MAPK信号通路(Mitogen-activated protein kinase signaling pathway)、精氨酸生物合成(Arginine biosynthesis)、囊泡运输中的SNARE蛋白交流(SNARE interactions in vesicular transport)、缬氨酸、亮氨酸、异亮氨酸生物合成(Valine, leucine and isoleucine biosynthesis)、GPI锚定生物合成(Glycosylphosphatidylinositol-anchor biosynthesis)等过程。
从上述通路中筛选出可能与致病相关的2个代谢通路,分别为MAPK(丝裂原活化蛋白激酶)信号通路和囊泡运输中的SNARE蛋白交流。MAPK是信号从细胞表面传导到细胞核内部的重要传递者[13]。目前发现MAPK信号转导途径在植物病原真菌的生长、发育和致病性调节方面占有非常重要的地位,可能是普遍存在的一种细胞外信号转导途径[14]。本研究中发现参与MAPK信号传导通路的差异表达基因共82个,其中上调54个,下调28个。MAPK中细胞受到外界刺激可通过改变酶的表达量,经过层层磷酸化链传递,从而控制GDP转化GTP的效率来调控各个反应的进行。
囊泡运输是很多物质运输的重要方式,经囊泡运输过程加工、包装的蛋白才具有生物活性,才能发挥作用。SNARE蛋白质复合体(Soluble N-ethylmaleimide-sensitive factor attachment protein receptors)是囊泡运输的关键蛋白。SNARE假说认为在细胞内的运输小泡及靶膜上都存在着SNARE蛋白,它们互相识别结合,为物质的运输提供了特异性,保障了细胞正常生理活动的有序进行[15]。SNARE蛋白在细胞自噬中的物质运输以及膜与膜融合等过程发挥着重要作用[16]。本研究中共有12个差异基因与囊泡运输中SNARE蛋白交流有关(表 2)。
| Gene ID | Up or down | KOG ID | KO name | KOG description |
| Cluster-19789.94438 | Down | KOG0861 | YKT6 | Synaptobrevin homolog YKT6 |
| Cluster-19789.95340 | Up | KOG0859 | VAMP7 | Vesicle-associated membrane protein 7 |
| Cluster-19789.98017 | Up | KOG0860 | VAMP4 | Vesicle-associated membrane protein 4 |
| Cluster-19789.105491 | Down | KOG0812 | STX5 | Syntaxin 5 |
| Cluster-19789.95759 | Up | KOG0810 | STX1A | Syntaxin 1A |
| Cluster-19789.93377 | Up | KOG0810 | STX1A | Syntaxin 1A |
| Cluster-19789.100677 | Up | KOG0810 | STX1A | Syntaxin 1A |
| Cluster-19789.97096 | Up | KOG0810 | STX1A | Syntaxin 1A |
| Cluster-19789.100503 | Down | KOG0810 | STX1A | Syntaxin 1A |
| Cluster-19789.88051 | Down | KOG0809 | STX16 | Syntaxin 16 |
| Cluster-19789.108986 | Down | KOG0809 | STX16 | Syntaxin 16 |
| Cluster-19789.92844 | Down | KOG3251 | BOS1 | Golgi SNAP receptor complex member 2 |
2.5 差异基因荧光定量结果分析
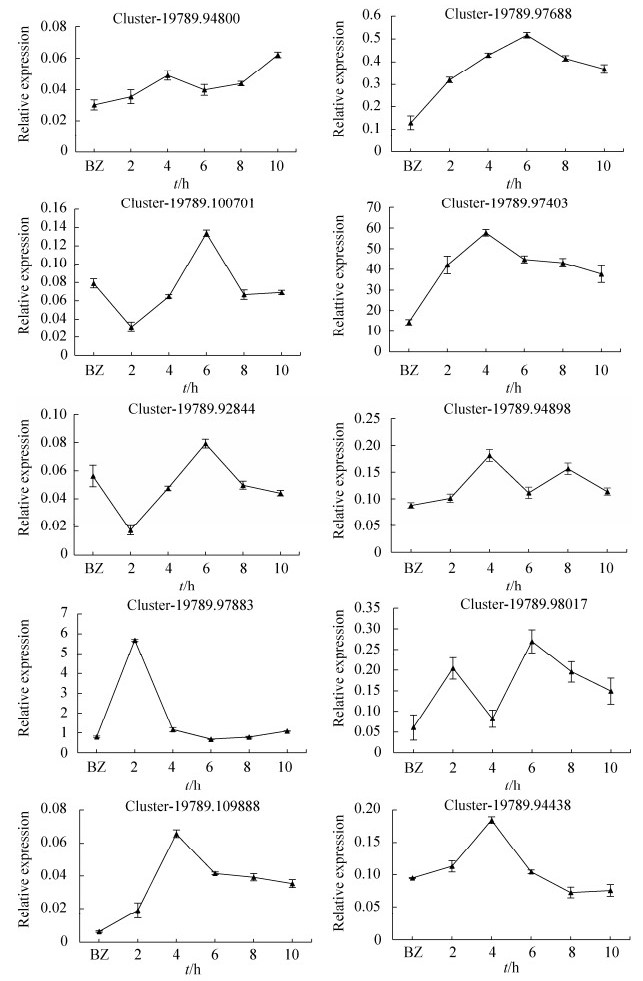
选取的10个Unigenes的实时荧光定量结果如下。RNA-seq结果显示Cluster-19789.94800、Cluster-19789.97688、Cluster-19789.97403、Cluster-19789.98017、Cluster-19789.94898、Cluster-19789.109888和在夏孢子萌发8 h时期与休眠夏孢子时期相比上调表达,其余4个基因下调表达,且参与氮化合物代谢的基因Cluster-19789.97403和其他基因相比表达量最高。实时定量结果与转录组测序结果趋势一致(图 5)。
|
| 图 5 10个unigenes的实时荧光定量分析 Figure 5 qRT-PCR analysis of 10 unigenes. BZ represents the resting urediniospores; Standard Error shows the average fluctuation among three repeats. |
3 讨论
本试验转录组数据经拼接总计获得22455个unigenes,其中萌发时期与休眠孢子阶段相比存在有9725个差异基因。萌发时期与孢子时期相比共有4400个上调基因,涉及细胞进程、有机物代谢、信号传导、催化酶活性和水解酶活性等功能,其中物质代谢差异基因极多,说明孢子萌发过程需要大量有机物代谢供给能量。上调基因中小GTPase参与的信号传导差异极显著。62个小GTPase参与的信号传导上调差异基因中,有45个涉及编码GTPase催化蛋白、FAD结合蛋白、Rho-GEF等蛋白的结构域;下调基因共5325个,主要集中在有机物代谢过程、单有机体过程、催化酶活性等。有1599个下调差异基因参与有机氮化合物代谢,其中1525个涉及编码组氨酸激酶A、醛脱氢酶家族、MutS家族、TrkA-N等蛋白的结构域。此外,显著差异基因中还有一部分编码小G蛋白,例如Ras鸟苷酸交换因子、Rho谷氨酸-核苷酸交换因子等。小G蛋白具有GTP酶活性,在多种细胞反应中具有开关作用,鸟苷酸交换因子、谷氨酸-核苷酸交换因子是细胞内专门控制小G蛋白活性的小G蛋白调节因子,可以增强其活性,提高信号传导的效率[17]。一些小G蛋白还能直接与胞吐体的亚基作用,对极性胞外分泌进行精确的时空调节[18]。本研究利用RNA-seq技术建立的cDNA文库比Hu等[4]构建的夏孢子与孢子萌发cDNA文库包含基因数目更多,基因功能预测更为精准,筛选研究的差异基因数量更多,涉及的功能更全面。前人研究更着重于叶锈菌与小麦互作时期的差异分析,而本研究发现叶锈菌孢子萌发与休眠夏孢子差异基因涉及有机物代谢过程、细胞组分、信号传导和酶活性等方面,证明小麦叶锈菌休眠夏孢子萌发是一个涉及物质代谢能量传导等极其复杂的过程。
张永红等[19]构建小麦条锈菌夏孢子萌发的cDNA文库,获得4798个有效的EST序列,鉴定出了包括细胞分裂与染色体结构、细胞信号与交流、物质合成代谢等8类重要的基因功能;胡文婕[20]通过RNA-seq技术研究向日葵锈菌夏孢子萌发差异基因得出4578个差异基因,基因功能分为生物合成、物质结合、催化活性、物质代谢等,并分析出氨基酸代谢等重要通路。本研究共获得22455个拼接后的unigenes,筛选出9725个小麦叶锈菌夏孢子萌发过程中的差异基因,这些差异基因涉及有机物代谢过程、细胞过程、信号传导和催化酶活性调节、有机物合成等过程,分布于MAPK信号通路、囊泡运输中SNARE蛋白交流、精氨酸生物合成、囊泡运输、缬氨酸、亮氨酸、异亮氨酸生物合成、GPI锚定生物合成等109条通路,并筛选出了两条致病相关的代谢通路。本研究比前人筛选出更多的关于锈菌萌发的差异基因及代谢通路,信息更为全面,这为更深入地研究锈菌萌发机制提供强有力的理论支撑。以上分析还证实小麦叶锈菌与小麦条锈菌及向日葵锈菌夏孢子萌发过程中具有一定相似性,但可能因为寄主及具体的侵染机理不同,各种锈菌间的萌发过程尚存在一定差异。
研究发现,部分通路对病原菌致病性有重要的作用,如精氨酸合成途径中包含26个差异基因,部分序列能编码催化酶,如转氨酶、ArgJ家族、谷氨酰胺合成酶、精氨酸酶等;GPI锚定生物合成途径包含19个差异基因,其中有15个涉及编码在锈菌生长发育中起重要作用的GPI转酰胺酶、I型磷酸二酯酶、N-乙酰氨基葡萄糖转移酶、磷脂酰肌醇聚糖等蛋白。真核生物的细胞膜或细胞壁上的多种GPI锚定蛋白,包括各种功能蛋白如细胞表面的酶、受体、粘附分子和特异性抗原等,在真核生物的生命活动中起着免疫识别、补体调节及跨膜信号转导等重要功能[21],某些GPI锚定蛋白仅在菌丝生成过程中表达[22]。上述结果表明小麦叶锈菌夏孢子萌发是一个极其复杂的过程,涉及众多差异基因和代谢通路,各个通路联络,各个基因协作才能保证叶锈菌正常萌发,获得侵染寄主能力。
叶锈菌休眠夏孢子遇利于萌发条件时,孢子内膜上的相关受体结合,把一系列信号传递给各个部位,整体活性开始提高,打破休眠状态,细胞开始利用各种有机物质代谢释放能量。Cluster-19789.97403参与氮化合物代谢过程,荧光实时定量分析其表达量先升高后降低,在6 h表达量最高,表明萌发6 h期间大量需求此基因参与氮化合物代谢释放的能量或代谢产物。
孢子经过物质代谢获得能量,开始极化形成芽管。芽管由新的营养细胞的胞壁突出生成,导致泡囊在细胞壁将出现区域聚集。泡囊内含有水解细胞壁必需的水解酶及蛋白激酶,以及芽管合成所需要的小分子物质。在叶锈菌夏孢子萌发期间细胞核生成的某些大分子物质由运输蛋白运输出来,在内质网-高尔基体分选与包装、加工过程中,编码高尔基SNAP受体的Cluster-19789.92844与编码突触融合蛋白Stx5的Cluster-19789.105491下调表达。进入到后高尔基体时编码突触融合蛋白STX16的两个基因下调表达,高尔基体形成突触小泡把加工的物质运出高尔基体。而后编码VAMP4的Cluster-19789.98017在小泡顶端质膜运输时上调表达。最后小泡运输至高尔基体,根据物质类别将囊泡包裹的产物分泌至胞外或运输至溶酶体。
许多植物病原真菌的生长、发育都受MAPK途径调控[23]。参与MAPK通路的差异表达的基因中有6个编码MAPK激酶(MAP kinase kinase,MKK)中的MAPK7亚族。MKK已被证实与玉米叶枯病[24]和小麦条锈病[25]等病原菌致病过程相关,在病原菌生长发育过程中发挥重要的作用。试验选择了5个MAPK通路相关差异基因进行定量分析。其中Cluster-19789.94898和Cluster-19789.94800负责编码细胞分裂调控相关蛋白cdc42,Cluster-19789.109888编码萌芽蛋白Bem1,均在4 h表达量达到最高值;Cluster-19789.100701编码MKK蛋白,在酵母模拟MAPK信号传导通路图中位于前三个基因的下游,实时荧光定量结果显示其在6 h表达量达到最高值,结合小麦叶锈菌萌发6 h产生芽管,以及朱晓果[25]报道的部分MKK蛋白参与条锈菌芽管与附着胞形成,推测基因可能与叶锈菌芽管形成有关;Cluster-19789.97883编码Ras同源蛋白Rho1,该蛋白在通路中负责GDP磷酸化作用,完成信号传导。Cluster-19789.97883表达量在2 h时期达到最高,4 h后表达量极少,推测其负责夏孢子萌发早期信号传导中的磷酸化,前人研究发现Ras信号通路是控制菌丝形态的主要途径之一[21],猜测此基因可能与叶锈菌菌丝生长过程中信号传递有关。
上调差异基因Cluster-19789.96401编码MAPK的P38亚族蛋白不仅在MAPK信号通路中激发能调控转录的转录因子锌指蛋白[26] MSN2/4的分泌,还能参与除此之外的其他通路,如鞘脂类信号通路、细胞衰老、细胞分化等,是一类重要的参与信号传导的激酶[27]。除此之外MAPK通路中还有编码14-3-3β蛋白家族、1-磷脂酰肌醇-4-磷酸5-激酶(PIP5K)家族、肌醇磷脂激酶(PI4K)家族的基因。14-3-3β蛋白作为调节蛋白,通过与多个靶蛋白结合可以把细胞内单一的信号传导变成众多的网络化信号传导,而且在不同细胞信号传导途径之间扮演不同角色[28],PI4-K在细胞生长调控过程起着重要作用[29]。
本次分析从GO富集与KEGG分析方面对休眠夏孢子时期及孢子萌发时期差异表达基因进行分析,筛选出大量的差异基因及重要的代谢通路,为研究小麦叶锈菌夏孢子萌发过程机理奠定基础。
| [1] | Huerta-Espino J, Singh RP, Germán S, McCallum BD, Park RF, Chen WQ, Bhardwaj SC, Goyeau H. Global status of wheat leaf rust caused by Puccinia triticina. Euphytica, 2011, 179(1): 143-160. DOI:10.1007/s10681-011-0361-x |
| [2] | Thara VK, Fellers JP, Zhou JM. In planta induced genes of Puccinia triticina. Molecular Plant Pathology, 2003, 4(1): 51-56. |
| [3] | Rampitsch C, Bykova NV, McCallum B, Beimcik E, Ens W. Analysis of the wheat and Puccinia triticina (leaf rust) proteomes during a susceptible host-pathogen interaction. Proteomics, 2006, 6(6): 1897-1907. DOI:10.1002/pmic.200500351 |
| [4] | Hu GG, Linning R, McCallum B, Banks T, Cloutier S, Butterfield Y, Liu J, Kirkpatrick R, Stott J, Yang G, Smailus D, Jones S, Marra M, Schein J, Bakkeren G. Generation of a wheat leaf rust, Puccinia triticina, EST database from stage-specific cDNA libraries. Molecular Plant Pathology, 2007, 8(4): 451-467. DOI:10.1111/j.1364-3703.2007.00406.x |
| [5] | Bruce M, Neugebauer KA, Joly DL, Migeon P, Cuomo CA, Wang SC, Akhunov E, Bakkeren G, Kolmer JA, Fellers JP. Using transcription of six Puccinia triticina races to identify the effective secretome during infection of wheat. Frontiers in Plant Science, 2014, 4: 520. |
| [6] | 张河山.两个不同毒力小麦叶锈菌菌株的转录组分析.河北农业大学硕士学位论文, 2014. http://cdmd.cnki.com.cn/article/cdmd-10086-1015515548.htm |
| [7] | 杜冬冬.两个不同致病类型小麦叶锈菌株差异表达分析及其分泌蛋白的筛选.河北农业大学硕士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10086-1015392905.htm |
| [8] | Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng QD, Chen ZH, Mauceli E, Hacohen N, Gnirke A, Rhind N, di Palma F, Birren BW, Nusbaum C, Lindblad-Toh K, Friedman N, Regev A. Full-length transcriptome assembly from RNA-Seq data without a reference genome. Nature Biotechnology, 2011, 29(7): 644-652. DOI:10.1038/nbt.1883 |
| [9] | Davidson NM, Oshlack A. Corset:enabling differential gene expression analysis for de novoassembled transcriptomes. Genome Biology, 2014, 15(7): 410. |
| [10] | Edman CF, Mehta P, Press R, Spargo CA, Walker GT, Nerenberg M. Pathogen analysis and genetic predisposition testing using microelectronic arrays and isothermal amplification. Journal of Investigative Medicine, 2000, 48(2): 93-101. |
| [11] |
Yao HP, Zhang HS, Du DD, Zhao S, Yan HF, Meng QF, Zhang N, Yang WX, Liu DQ. Effects of culture substrates and temperature on artificial germination of Puccinia triticina. Acta Agriculturae Boreali-Sinica, 2014, 29(S1): 125-128.
(in Chinese) 姚宏鹏, 张河山, 杜冬冬, 赵赛, 闫红飞, 孟庆芳, 张娜, 杨文香, 刘大群. 不同培养载体及温度对小麦叶锈菌夏孢子萌发的影响. 华北农学报, 2014, 29(S1): 125-128. |
| [12] | Young MD, Wakefield MJ, Smyth GK, Oshlack A. Gene ontology analysis for RNA-seq:accounting for selection bias. Genome Biology, 2010, 11(2): R14. DOI:10.1186/gb-2010-11-2-r14 |
| [13] | Seger R, Krebs EG. The MAPK signaling cascade. FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 1995, 9(9): 726-735. DOI:10.1096/fasebj.9.9.7601337 |
| [14] |
Fan YS, Liu YC, Gu SQ, Gui XM, Dong JG. Mitogen activated protein kinase genes and its functions in phytopathogenic fungus. Acta Microbiologica Sinica, 2004, 44(4): 547-551.
(in Chinese) 范永山, 刘颖超, 谷守芹, 桂秀梅, 董金皋. 植物病原真菌的MAPK基因及其功能. 微生物学报, 2004, 44(4): 547-551. DOI:10.3321/j.issn:0001-6209.2004.04.033 |
| [15] |
Chen YY, Chen HY, Lu DR. Molecular mechanisms of SNARE proteins in regulating autophagy. Hereditas(Beijing), 2014, 36(6): 547-551.
(in Chinese) 陈元渊, 陈红岩, 卢大儒. SNARE蛋白调控细胞自噬的分子机制. 遗传, 2014, 36(6): 547-551. |
| [16] | Moreau K, Renna M, Rubinsztein DC. Connections between SNAREs and autophagy. Trends in Biochemical Sciences, 2013, 38(2): 57-63. DOI:10.1016/j.tibs.2012.11.004 |
| [17] | 杨月明.拟南芥鸟苷酸交换因子-SWAP70的功能研究.兰州大学硕士学位论文, 2016. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_yxxxzz201613244 |
| [18] |
Hu XH, Wang K, Zhu TH. Advances in exocyst complex in filamentous fungi. Acta Microbiologica Sinica, 2018, 58(3): 372-379.
(in Chinese) 胡晓辉, 汪琨, 朱廷恒. 丝状真菌胞吐体的研究进展. 微生物学报, 2018, 58(3): 372-379. |
| [19] |
Zhang YH, Qu ZP, Zheng WM, Wang YF, Xu LS, Zhao J, Huang LL, Kang ZS. Construction and characterization of a cDNA library from germinated urediospores of Puccinia striiformis f. sp. tritici. Acta Phytopathologica Sinica, 2007, 37(5): 487-499.
(in Chinese) 张永红, 屈志鹏, 郑文明, 王艳飞, 徐亮胜, 赵杰, 黄丽丽, 康振生. 小麦条锈菌cDNA文库构建和表达序列标签(ESTs)分析. 植物病理学报, 2007, 37(5): 487-499. |
| [20] | 胡文婕.向日葵锈菌夏孢子萌发转录组学研究.内蒙古农业大学硕士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10129-1015427715.htm |
| [21] | 赵晶. GPI锚定蛋白生物合成抑制剂类新型抗真菌化合物设计合成与构效关系研究.福建中医药大学硕士学位论文, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10393-1016211133.htm |
| [22] | Jain P, Sethi SC, Pratyusha VA, Garai P, Naqvi N, Singh S, Pawar K, Puri N, Komath SS. Ras signaling activates glycosylphosphatidylinositol (GPI) anchor biosynthesis via the GPI-N-acetylglucosaminyltransferase (GPI-GnT) in Candida albicans. The Journal of Biological Chemistry, 2018, 293(31): 12222-12238. DOI:10.1074/jbc.RA117.001225 |
| [23] | Lengeler KB, Davidson RC, D'souza C, Harashima T, Shen WC, Wang P, Pan XW, Waugh M, Heitman J. Signal transduction cascades regulating fungal development and virulence. Microbiology and Molecular Biology Reviews, 2000, 64(4): 746-785. DOI:10.1128/MMBR.64.4.746-785.2000 |
| [24] | Gong XD, Feng SZ, Zhao J, Tang C, Tian L, Fan YS, Cao ZY, Hao ZM, Jia H, Zang JP, Zhang YF, Han JM, Gu SQ, Dong JG. StPBS2, a MAPK kinase gene, is involved in determining hyphal morphology, cell wall development, hypertonic stress reaction as well as the production of secondary metabolites in Northern Corn Leaf Blight pathogen Setosphaeria turcica. Microbiological Research, 2017, 201: 30-38. DOI:10.1016/j.micres.2017.04.009 |
| [25] | 朱晓果.小麦条锈菌MAPK信号通路介导的致病机理及其在抗锈育种中的应用.西北农林科技大学博士学位论文, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10712-1018037648.htm |
| [26] |
Li XB, Zhang JW. Structure and function of zinc finger proteins in eucaryon. Chinese Journal of Biochemistry and Molecular Biology, 2009, 25(3): 206-211.
(in Chinese) 李晓波, 张俊武. 真核生物中锌指蛋白的结构与功能. 中国生物化学与分子生物学报, 2009, 25(3): 206-211. |
| [27] | Ono K, Han JH. The p38 signal transduction pathway activation and function. Cellular Signalling, 2000, 12(1): 1-13. |
| [28] |
Xue MH, Gao SJ, Tian HM, Wu Y, Liu W. The expression and clinical significance of 14-3-3β protein in non-small cell lung cancer. Chinese Journal of Laboratory Diagnosis, 2010, 14(2): 204-207.
(in Chinese) 薛孟华, 高素君, 田慧敏, 吴勇, 刘伟. 14-3-3β蛋白在非小细胞肺癌中的表达及其临床意义. 中国实验诊断学, 2010, 14(2): 204-207. DOI:10.3969/j.issn.1007-4287.2010.02.017 |
| [29] |
Yue JC, Ouyang YS, Guo ZQ. Devolopment of the monoclonal antibody against type Ⅱ phosphatidylinositol 4-kinase from bovine cerebella cortex and its inhibitory effect on cell growth. Chinese Journal of Biochemistry and Molecular Biology, 2000, 16(2): 234-239.
(in Chinese) 乐加昌, 欧阳英石, 郭振泉. 肌醇磷脂激酶(P14-K)单克隆抗体的制备及其对细胞生长的抑制. 中国生物化学与分子生物学报, 2000, 16(2): 234-239. DOI:10.3969/j.issn.1007-7626.2000.02.017 |
 2020, Vol. 60
2020, Vol. 60