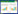中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 钱瑶, 潘园园, 李二伟, 贾慧慧, 魏艳敏, 刘钢. 2020
- Yao Qian, Yuanyuan Pan, Erwei Li, Huihui Jia, Yanmin Wei, Gang Liu. 2020
- 链霉菌IMS002的分类鉴定及其抗真菌活性物质解析
- Classification of Streptomyces sp. IMS002 and identification of its antifungal metabolite
- 微生物学报, 60(1): 60-68
- Acta Microbiologica Sinica, 60(1): 60-68
-
文章历史
- 收稿日期:2019-03-08
- 修回日期:2019-04-12
- 网络出版日期:2019-12-11
2. 中国科学院大学, 北京 100049;
3. 北京农学院植物科学技术学院, 北京 102206;
4. 中国科学院种子创新研究院, 北京 100864
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Department of Plant Science and Technology, Beijing University of Agriculture, Beijing 102206, China;
4. The Innovative Academy of Seed Design, Chinese Academy of Sciences, Beijing 100864, China
链霉菌不仅具有较为复杂的形态分化,而且能够产生种类繁多的次级代谢产物,目前临床上超过一半以上的药物都来自于链霉菌[1]。随着抗生素不断被发现与应用,人们在医用抗生素的基础上发展出了农用抗生素。Borrelidin是一种18元大环内酯类抗生素,可由多种链霉菌菌株产生[2]。它的药效十分广泛,研究人员发现Borrelidin对细菌、病毒、恶性疟原虫均有良好的抑制效果[3-6]。不仅如此,Borrelidin还因其抗血管生成活性的报道而倍受关注[7],因此具有成为抗肿瘤药物的潜力[8]。最近,Borrelidin的抗真菌活性开始受到关注,研究发现白色念珠菌(Candida albicans)、辣椒疫霉菌(Phytophthora capsici)、大豆疫霉菌(Phytophthora sojae)对Borrelidin敏感性较高[9-11]。由于Borrelidin对多种植物及人体病原真菌均具有良好的抑菌活性,说明其具有成为临床或农业药物的巨大潜力。尖孢镰刀菌(Fusarium oxysporum)是引起香蕉根部病变的一种土传性真菌病害,会引起香蕉枯萎病的发生[12]。自19世纪被发现以来,已成为香蕉主要的毁灭性病害之一[13]。该病害在田间极易传播,并且抗逆性强,可在土壤中存活30年,对香蕉等经济作物有着极强的危害性[14]。本文实验发现,实验室前期保存的一株链霉菌IMS002对尖孢镰刀菌具有良好的抑菌效果,对其发酵产物进一步分离提纯与鉴定证实其发酵液有机相中起到抑菌活性的物质为Borrelidin。
1 材料和方法 1.1 材料 1.1.1 菌种: 链霉菌IMS002分离自玉米根际土壤,于–20 ℃保存于本实验室。尖孢镰刀菌(Fusarium oxysporum) CGMCC3.2830,购买自中国普通微生物菌种保藏管理中心。 1.1.2 培养基: 链霉菌IMS002产孢培养基MS (甘露醇20 g/L,黄豆饼粉20 g/L,琼脂15 g/L),链霉菌液体培养基YEME (酵母粉3 g/L,大豆蛋白胨5 g/L,麦芽糖提取物3 g/L,蔗糖340 g/L,葡萄糖10 g/L),链霉菌发酵种子培养基(可溶性淀粉24 g/L,牛肉膏3 g/L,葡萄糖1 g/L,酵母粉5 g/L,大豆蛋白胨3 g/L,CaCO3 4 g/L,pH 7.0),链霉菌发酵培养基(黄豆饼粉20 g/L,大豆蛋白胨2 g/L,葡萄糖20 g/L,可溶性淀粉5 g/L,酵母粉2 g/L,NaCl 4 g/L,K2HPO3 0.5 g/L,MgSO4·H2O 0.5 g/L,CaCO3 2 g/L)[15]。PDA培养基(用于真菌固体培养)为土豆200 g/L,葡萄糖20 g/L,琼脂20 g/L;PDB培养基(用于真菌液体培养)为土豆200 g/L,葡萄糖20 g/L。用于链霉菌菌种鉴定的培养基包括:牛奶凝固胨化培养基,淀粉水解培养基,纤维素水解培养基,明胶液化培养基,硫化氢产生培养基[16]。 1.1.3 主要试剂和仪器: 光学显微镜(OLYMPUS),高分辨冷场发射扫描电子显微镜(日本Hitachi SU8010),硅胶柱层析(青岛海洋化工),凝胶柱层析(美国通用GE Sephadex LH-20),全自动制备型高效液相色谱仪(Agilent 1100 Series HPLC),AGILENT液质联用仪(AGILENT 1200HPLC/ 6520QTOFMS)、500 MHz超导高分辨核磁共振谱仪(Bruker AVANCE Ⅲ),圆二色光谱仪(英国Applied Photophysics Ltd),旋蒸蒸发仪(EYELA)。 1.2 菌株发酵接种链霉菌IMS002孢子于MS培养基上,28 ℃培养7 d。从该平板挖取直径为8 mm的圆形菌块接种于10 mL链霉菌发酵种子培养基,28 ℃、200 r/min振荡培养48 h,以2.5%的接种量接种到50 mL链霉菌发酵培养基中,28 ℃、200 r/min振荡培养直至168 h。
1.3 分子鉴定及形态学观察 1.3.1 多基因聚类分析: 接种链霉菌IMS002孢子于YEME培养基中,28 ℃振荡培养2 d,然后收集菌体进行链霉菌总DNA少量制备[17]。提取该菌株基因组DNA,并通过异丙醇进行沉淀。以该菌株基因组DNA为模板,采用表 1中的引物进行PCR扩增。将扩增产物送到金唯智生物科技公司(北京)进行测序,获得16S rDNA (MK583689)、ATP合酶b亚基基因(atpD)(MK607456)、DNA解旋酶基因(gyrB)(MK607457)、重组酶基因(recA) (MK607458)、RNA聚合酶b亚基基因(rpoB)(MK607459)、色氨酸合成酶b亚基基因(trpB) (MK607460),用于链霉菌种间的鉴定。对这些基因序列进行串联后,提交至NCBI中的GenBank数据库进行BLAST分析比对。利用MEGA 6.0对16S rDNA和5个不同基因(atpD,gyrB,recA,rpoB,trpB)串联序列进行多重序列比对分析,通过Neighbor-Joining法构建系统发育树。| Primers | Sequences (5′→3′) |
| 16S-F | AGAGTTTGATCCTGGCTCAG |
| 16S-R | CTACGGCTACCTTGTTACGA |
| atpD-F | ATGACCACCACTGTTGAGACCGCGA |
| atpD-R | TCAGGAGACGCCCAGCTCCTTGGCG |
| gyrB-F | GTGGCCGATTCCGGCAACCCCAACG |
| gyrB-R | TCAGATGTCGAGGAAGCGGACGTCC |
| recA-F | ATGGCAGGAACCGACCGCGAGAAGG |
| recA-R | TCAGCTCTTGGCCGCCGCGGCCTTG |
| rpoB-F | TTGGCCGCCTCGCGCAATGCCTCGA |
| rpoB-R | TCAGACCTCTTCGACGCTGCTCGGC |
| trpB-F | ATGCCCAGCAACTTCTTCGTCCCCG |
| trpB-R | TCACTTGACGTCCCCCTCGATCTCG |
1.3.2 扫描电镜观察: 接种链霉菌IMS002孢子于MS培养基上培养,选取生长72 h的菌体,随机挖取3个边长为5 mm的方形菌块,使用2.5%戊二醛进行样品的固定。将样品表面的固定液冲洗干净后,低温冷冻干燥2 h。对样品进行喷金处理后,利用高分辨冷场发射扫描电子显微镜(日本Hitachi SU8010)进行样品表面超微结构观察。 1.4 发酵产物对尖孢镰刀菌的抑菌活性检测
接种尖孢镰刀菌孢子于50 mL PDB培养基中,28 ℃、200 r/min振荡培养48 h后,与1%的PDA制成带菌平板,将链霉菌IMS002发酵液上清加入牛津杯中(100 μL/孔)。在28 ℃恒温培养条件下,对带菌平板进行培养,72 h后观察抑菌效果。通过十字交叉法测量抑菌圈直径,比较不同发酵液上清的抑菌活性[18]。
1.5 抑菌活性化合物的分离纯化和鉴定 1.5.1 抑菌活性物质的初步确定: 链霉菌IMS002发酵168 h后,保留上清液,用乙酸乙酯萃取2 d后,用旋转蒸发仪浓缩有机相,得到微量活性物质粗提物。用1 mL甲醇溶解上述粗提物,进行高效液相色谱法(High performance liquid chromatography,HPLC)分析。分析条件:分析型色谱柱为XBridgeTM C18 (4.6 mm×150 mm,5 μm),制备型色谱柱为ThermoHypersil GOLD aQ (250 mm× 10 mm,5 μm);流动相分别为0.1%的甲酸(A)与100%甲醇(B)。梯度洗脱程序:0–30 min (20%–100% B),30–40 min (100%B),40–45 min (100%–20% B);流速为1 mL/min,柱温为40 ℃,检测波长分别为254.16、210.8、230.16、280.16 nm。手动进样,进样体积为5 L。分峰接取样品:0–10 min、10–20 min、20–40 min分时间段进行分峰并收集馏分,对各馏分进行抑菌活性检测。对具有抑菌活性的各组馏分用旋转蒸发仪进行浓缩,再次进行活性测定,最终获得微量具有抑菌活性的化合物纯品。 1.5.2 活性物质的硅胶柱层析: 选用50 μm ODS反相填料(填充60 cm×2.6 cm玻璃层析柱,用2 mL甲醇溶解9 g活性粗提物,并与少量反相填料进行拌样,水浴加热至干粉状。使用30%甲醇平衡填充柱,准备进行梯度洗脱。将样品加到柱子中,用干净的ODS将之压平。梯度洗脱:以30%、40%、50%、60%、70%、80%、90%、100%的甲醇各400 mL,每个梯度分两份收集。用上步获取的微量纯品作为阳性对照进行HPLC分析。 1.5.3 活性物质的凝胶柱层析: 选用Sephadex LH-20进一步分离活性组分。以3 s一滴的速率进行,每收集5 mL作为一组馏分。一共收集了45组馏分,编号为1–45号瓶,以前文所述的微量纯品为对照,进行HPLC分析,确定6号与7号瓶的馏分为活性组分,且纯度高可用于结构鉴定。通过挥发掉甲醇,得到45 mg固体纯品。 1.5.4 活性物质的结构鉴定: 液相质谱分析选用orbitrap fusion的液质联用高分辨质谱仪,对6和7号瓶馏分进行分子量分析。用氘代丙酮对纯品进行重悬,采用AvanceⅢ的500 MHz核磁共振波谱仪。使用Chirascan的圆二色光谱仪对纯品的稀甲醇溶液进行比旋光分析。 2 结果和分析 2.1 多基因聚类分析我们通过16S rDNA进行初步聚类分析,发现链霉菌IMS002与娄彻氏链霉菌(Streptomyces rochei)和微小链霉菌(Streptomyces parvulus)亲缘关系都很近。为进一步确定IMS002的分类地位,我们将PCR扩增所得的IMS002的16S rDNA、atpD、gyrB、recA、rpoB、trpB序列首尾串联,并提交至NCBI中进行比对。在进行系统发育树构建时,我们以Borrelidin产生菌株娄彻氏链霉菌、灰色链霉菌(Streptomyces griseus)、Streptomyces albovinaceus、纯白链霉菌(Streptomyces candidus)、微小链霉菌、加州链霉菌(Streptomyces californicus)的相应序列作为对照[4, 19-23]。基于16S rDNA和5个不同基因(atpD,gyrB,recA,rpoB,trpB)串联比对分析结果进行系统发育树构建(图 1),发现链霉菌IMS002与产二素链霉菌(S. ambofaciens)归属于同一分支,同源性为95%。与此同时,其与娄彻氏链霉菌、灰色链霉菌、S. albovinaceus、纯白链霉菌、微小链霉菌、加州链霉菌的同源性分别为68%、68%、36%、30%、93%、46%。因此,链霉菌IMS002与产二素链霉菌(S. ambofaciens)在进化上更一致。同时发现该菌与目前已报道的Borrelidin产生菌株均没有聚到一个分支上。
|
| 图 1 基于16S rDNA和5个不同基因(atpD,gyrB,recA,rpoB,trpB)串联聚类分析构建的系统发育树 Figure 1 Phylogenetic NJ tree based on 16S rDNA sequence and five concatenated sequences (atpD, gyrB, recA, rpoB and trpB). Numbers at note present bootstrap percentages; Bar 0.02 nucleotide divergence; GenBank accession numbers are shown in parentheses. |
2.2 链霉菌IMS002菌丝及孢子形态观察
利用扫描电子显微镜对链霉菌IMS002在MS培养基培养72 h的气生菌丝、孢子链及单个孢子样品表面超微结构进行了观察。根据该扫描电镜结果,我们发现链霉菌IMS002的气生菌丝带有毛发状结构(图 2-A),这与绝大多数链霉菌气生菌丝呈现光滑的表面现象不同[24]。结合实验中我们发现的该株菌有极强的疏水现象,我们推测这种毛发状结构很可能为某些疏水蛋白的聚集体。此外,链霉菌IMS002孢子链呈直链状,表面也有密集的毛发状结构(图 2-B)。通过进一步放大观察,我们发现成熟孢子呈圆柱状,同时表面布满有规律的清晰格纹(图 2-C),这是在其他已知链霉菌中极其少见的,目前我们还无法得知该纹路产生的具体原因与作用。

|
| 图 2 链霉菌IMS002扫描电镜照片 Figure 2 Morphology of Streptomyces sp. IMS002 under scanning electron microscopy. A: aerial hyphae; B: spore chains; C: spores. |
2.3 生理生化实验分析
将在MS培养基上培养了5 d的链霉菌IMS002接种到六种生理生化鉴定培养基中,根据菌株在培养基中的培养情况,我们得到了该菌株的生理生化特性(表 2)。获得的实验结果与大多数链霉菌生理生化特性一致。
| Media | Cultivation situation |
| Milk solidified medium | No solidification |
| Nitrate reduction medium | Reduction |
| Starch hydrolysis medium | Growth and starch hydrolysis ability are weak |
| Cellulose hydrolysis medium | Cellulase production capacity is weak |
| Gelatin liquid medium | Liquidation |
| Hydrogen sulfide production medium | There is no blackening around the colony, and the strain cannot produce hydrogen sulfide |
2.4 IMS002发酵产物抑菌活性检测
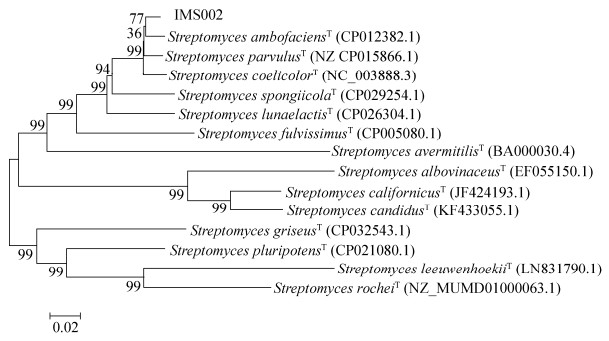
体外抗真菌活性实验表明,链霉菌IMS002发酵7 d后的上清液对尖孢镰刀菌具有抑菌活性。通过乙酸乙酯初步萃取,发现上清液中的抑菌活性物质在有机相以及水相中均有分布(图 3)。

|
| 图 3 链霉菌IMS002发酵液上清及其萃取物的抑菌活性检测 Figure 3 Antifungal activity of IMS002 fermentation filtrate and its extracts. 1: methyl alcohol; 2: extracts from aqueous phase; 3: 100× diluted methanol extract; 4: methanol extract; 5: fermentation filtrate. Fusarium oxysporum was used as indicator. |
我们通过HPLC对有机相中活性物质进行了分离纯化(图 4-A),并进行了分段回收。生物活性追踪显示,20–40 min的分段回收样品具有明显的抑菌活性(图 4-B)。从HPLC结果可见,该区段含有5个主要的峰(图 4-A)。我们进一步对该段回收样品中的A、B、C、D、E峰分别进行了回收。再次通过活性追踪检测,发现D峰具有同有机相类似的抑菌活性(图 4-C),暗示抑菌活性成分主要集中在D峰。根据D峰的峰形判断该峰中所含化合物较为单一。
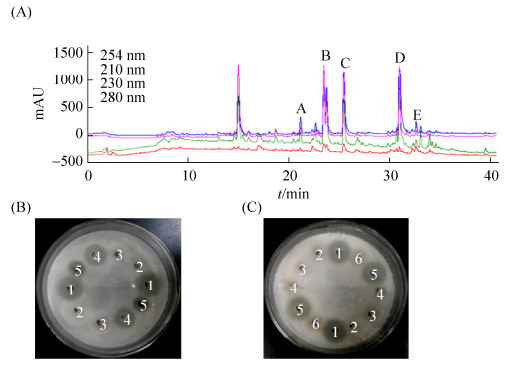
|
| 图 4 链霉菌IMS002发酵产物HPLC分析以及分段回收产物的抑菌活性检测 Figure 4 HPLC analysis of IMS002 fermentation extracts and bioactivity of different fractions from HPLC. A: HPLC analysis of IMS002 fermentation extracts. The absorbance of fermentation extracts was detected under 210–280 nm. B: Antifungal activity of different fractions. 1: methanol extract; 2: 0–10 min fraction from HPLC; 3: 10–20 min fraction from HPLC; 4: 20–40 min fraction from HPLC; 5: fermentation products. C: Antifungal activity of A–E in the 20–40 min fraction. 1: methanol extract; 2: A fraction; 3: B fraction; 4: C fraction; 5: D fraction; 6: E fraction. |
2.5 活性物质鉴定
我们以尖孢镰刀菌为指示菌,通过HPLC对链霉菌IMS002发酵液中含有D峰化合物的样品进行了分离纯化,获得了少量具有生物活性的纯品(图 5)。为获得足够量的纯品,我们通过扩大发酵,对8.5 L发酵液的萃取物进行了反相硅胶柱层析与凝胶柱层析,并以上述分离的少量纯品作为对照,通过HPLC分析以及分离纯化,获得了45 mg固体纯品。
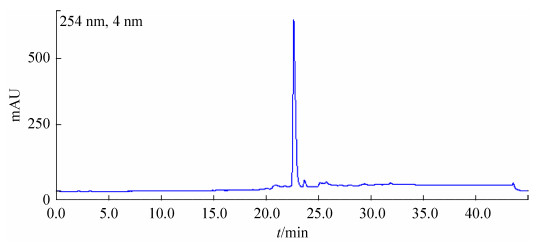
|
| 图 5 抗尖孢镰刀菌活性物质的纯化 Figure 5 Purification of the bioactive compound against Fusarium oxysporum. |
我们对获得的45 mg固体纯品进行液相质谱、核磁共振氢谱和碳谱分析以及圆二色光谱分析,综合获得的数据,得到以下结果:该化合物为淡黄色晶体,[α]25 D -29.0 (c 0.1, MeOH);HRESI-MS m/z 512.2989 [M+Na]+ (为C28H43NNaO6,相对分子质量为512.2983);1H NMR(acetone-d6): δ 6.90 (d, J=11.3 Hz), 6.60 (dd, J=14.8, 11.3 Hz), 6.38 (m, H-4), 4.96 (dt, J=10.5, 3.3 Hz), 4.24 (d, J=9.7 Hz), 3.89 (dd, J=10.5, 3.3 Hz), 2.68 (m), 2.56 (m), 2.54 (m), 2.47 (m), 2.37 (m), 2.27 (dd, J=16.1, 10.1 Hz), 2.09 (br s), 2.07 (m), 2.00 (m), 1.94 (m), 1.88 (m), 1.84 (m), 1.80 (m), 1.78 (m), 1.74 (m), 1.72 (m), 1.65 (m), 1.45 (m), 1.24 (m), 1.09 (1H, m), 1.04 (d, J=6.4 Hz), 0.99 (m), 0.95 (m), 0.84 (overlap), 0.83 (overlap), 0.82 (overlap), 0.72 (t, J=10.9 Hz); 13C NMR (acetone-d6): 177.7 (COOH), 172.4 (C-18), 144.2 (C-6), 139.3 (C-4), 128.4 (C-5), 119.5 (CN), 117.9 (C-7), 76.7 (C-2), 72.5 (C-8), 71.3 (C-16), 49.1 (C-1), 49.0 (C-12), 46.6 (C-2), 44.2 (C-14), 39.0 (C-17), 38.4 (C-10), 36.5 (C-3), 36.4 (C-15), 35.5 (C-9), 31.9 (C-5), 30.1 (C-3), 28.0 (C-13), 27.2 (C-11), 25.9 (C-4), 20.8 (C-20), 18.7 (C-22), 18.3 (C-21), 15.3 (C-19)。将上述结果与已公布的Borrelidin的结构进行比较,我们确定该活性物质为Borrelidin[3]。通过以上结果分析发现,该化合物为大环内酯类抗生素,具有环戊烷羧酸部分和丁腈部分,其结构如图 6所示。
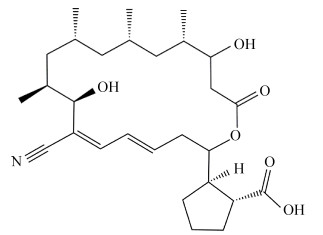
|
| 图 6 抗尖孢镰刀菌活性物质(Borrelidin)的化学结构 Figure 6 Structural of the bioactive compound (Borrelidin). |
3 讨论
Borrlidin最先发现于从土壤样本中分离得到的娄彻氏链霉菌(S. rochei),随后在灰色链霉菌(S. griseus) BS1325、纯白链霉(S. candidus) Y21007-2、S. albovinaceus、微小链霉菌(S. parvulus) Tü4055、加州链霉菌(S. californicus)、Streptomyces sp. C2989中陆续被分离得到[4, 19-23]。据我们所知,此前尚未有产二素链霉菌或其近缘菌株产生Borrelidin的报道。IMS002的发现为Borrelidin的工业生产提供了更多的参考菌株。产二素链霉菌最早被分离于上世纪50年代,是一类重要的工业生产菌株,主要用于生产大环内酯类化合物——螺旋霉素。螺旋霉素主要用于临床当中,以抵抗病原细菌以及弓形虫的感染[25]。产二素链霉菌还能产生环肽类抗生素刚果素,但由于刚果素的细胞毒性太强,不适用于临床治疗[26-27]。除此之外,产二素链霉菌还能产生吡喃酮多酮类化合物、安波毒素等多种化合物[28-29]。结合NCBI上已公布的产二素链霉菌的全基因组序列,我们发现产二素链霉菌有着产生丰富次级代谢产物的潜能。因此,通过调整不同的发酵条件、激活隐性基因簇等方式可能会使产二素链霉菌产生种类更为多样的次级代谢产物,并运用到生产生活当中。从链霉菌IMS002菌株的超微观结构观察,我们发现该链霉菌成熟的孢子表面有规律的格纹状结构,这很可能与该菌株能够产生特殊的表面疏水蛋白有关,也可能是由于周期性的基因表达而产生的规律型图案。根据文献的检索,这也是第一次报道有关Borrelidin对尖孢镰刀菌具有抑菌效果,这也拓展了Borrelidin的抗菌谱,为其进一步应用提供了基础。在活性物质追踪过程中,我们也发现水相中存在着抑菌活性物质,暗示产二霉素链霉菌发酵产物是通过几种化合物的共同作用来抑制尖孢镰刀菌的,并且多种化合物共同作用效果更好。
| [1] | Bérdy J. Thoughts and facts about antibiotics: where we are now and where we are heading. The Journal of Antibiotics, 2012, 65(8): 385-395. DOI:10.1038/ja.2012.27 |
| [2] | Keller-Schierlein W. Stoffwechselprodukte von mikroorganismen 55. Mitteilung[1] über die konstitution des borrelidins. Helvetica Chimica Acta, 1967, 50(3): 731-753. DOI:10.1002/hlca.19670500303 |
| [3] | Berger J, Jampolsky LM, Goldberg MW. Borrelidin, a new antibiotic with antiborrelia activity and penicillin enhancement properties. Archives of Biochemistry, 1949, 22(3): 476-478. |
| [4] | Singh SK, Gurusiddaiah S, Whalen JW. Treponemycin, a nitrile antibiotic active against Treponema hyodysenteriae. Antimicrobial Agents and Chemotherapy, 1985, 27(2): 239-245. DOI:10.1128/AAC.27.2.239 |
| [5] | Dickinson L, Griffiths AJ, Mason CG, Mills RFN. Anti-viral activity of two antibiotics isolated from a species of Streptomyces. Nature, 1965, 206(981): 265-268. |
| [6] | Otoguro K, Ui H, Ishiyama A, Kobayashi M, Togashi H, Takahashi Y, Masuma R, Tanaka H, Tomoda H, Yamada H, Omura S. In vitro and in vivo antimalarial activities of a non-glycosidic 18-membered macrolide antibiotic, borrelidin, against drug-resistant strains of Plasmodia. The Journal of Antibiotics, 2003, 56(8): 727-729. DOI:10.7164/antibiotics.56.727 |
| [7] | Wakabayashi T, Kageyama R, Naruse N, Tsukahara N, Funahashi Y, Kitoh K, Watanabet Y. Borrelidin is an angiogenesis inhibitor; disruption of angiogenic capillary vessels in a rat aorta matrix culture model. The Journal of Antibiotics, 1997, 50(8): 671-676. DOI:10.7164/antibiotics.50.671 |
| [8] | Duffey MO, LeTiran A, Morken JP. Enantioselective total synthesis of borrelidin. Journal of the American Chemical Society, 2003, 125(6): 1458-1459. DOI:10.1021/ja028941u |
| [9] | Hu C, Su H, Luo J, Han L, Liu Q, Wu W, Mu Y, Guan P, Sun T, Huang X. Design, synthesis and antifungal evaluation of borrelidin derivatives. Bioorganic & Medicinal Chemistry, 2018, 26(23-24): 6035-6049. |
| [10] | Chen YY, Chen PC, Tsay TT. The biocontrol efficacy and antibiotic activity of Streptomyces plicatus on the oomycete Phytophthora capsici. Biological Control, 2016, 98: 34-42. DOI:10.1016/j.biocontrol.2016.02.011 |
| [11] | Gao YM, Wang XJ, Zhang J, Li M, Liu CX, An J, Jiang L, Xiang WS. Borrelidin, a potent antifungal agent: insight into the antifungal mechanism against Phytophthora sojae. Journal of Agricultural and Food Chemistry, 2012, 60(39): 9874-9881. DOI:10.1021/jf302857x |
| [12] | Ploetz RC. Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporum f. sp. cubense. Phytopathology, 2006, 96(6): 653-656. DOI:10.1094/PHYTO-96-0653 |
| [13] | Molina AB, Fabregar E, Sinohin VG, Yi G, Viljoen A. Recent occurrence of Fusarium oxysporum f. sp. cubense tropical race 4 in Asia. Acta Horticulturae, 2007, 828: 109-116. |
| [14] | Ploetz RC. Fusarium wilt of banana. Phytopathology, 2015, 105(12): 1512-1521. DOI:10.1094/PHYTO-04-15-0101-RVW |
| [15] |
LiuLS. Screening and applying study of biocontrol strains of Streptomyces to control root-knot nematode. Master Dissertation of Nanjing Agricultural University, 2005. (in Chinese) 刘亮山.根结线虫病生防链霉菌的筛选及其应用研究.南京农业大学硕士学位论文, 2005. |
| [16] | 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册. 北京: 科学出版社, 1975. |
| [17] | Kieser T, Bibb MJ, Buttner MJ, Chater KF, Hopwood DA. Practical Streptomyces genetics: A Laboratory Manual. Norwich: The John Innes Foundation, 2000. |
| [18] |
Chinese Pharmacopoeia Commission. The people's Republic of China Pharmacopoeia. Beijing: Chemical Industry Press, 2005. (in Chinese) 国家药典委员会. 中华人民共和国药典. 北京: 化学工业出版社, 2005. |
| [19] | Shiang M, Kuo MY, Chu KC, Lee HP, Chang PC, Chang HY. Biologically pure culture of Streptomyces candidus Y21007-2 and its mutants or variants are used for production of fungicide borrelidin. Germany: DE19981035669. 1998-08-06. |
| [20] | Ming SA, Kuo MY, Chu KC, Chang PC, Chang HY, Lee HP. Strain of Streptomyces, and relevant uses thereof. US: 6193964.2001-02-27. |
| [21] | Lumb M, Macey PE, Spyvee J, Whitmarsh JM, Wright RD. Isolation of vivomycin and borrelidin, two antibiotics with anti-viral activity, from a species of Streptomyces (C2989). Nature, 1965, 206(981): 263-265. |
| [22] | Olano C, Moss SJ, Braña AF, Sheridan RM, Math V, Weston AJ, Méndez C, Leadlay PF, Wilkinson B, Salas JA. Biosynthesis of the angiogenesis inhibitor borrelidin by Streptomyces parvulus Tü4055: insights into nitrile formation. Molecular Microbiology, 2004, 52(6): 1745-1756. DOI:10.1111/j.1365-2958.2004.04090.x |
| [23] | Saisivam S, Bhikshapathi DVRN, Krishnaveni J, Kishan V. Isolation of borrelidin from Streptomyces californicus-an Indian soil isolate. Indian Journal of Biotechnology, 2008, 7(3): 349-355. |
| [24] |
Lu YY, Yan XC. Electron microscopic examination of spore surface structure in three Streptomyces groups. Acta Microbiologica Sinica, 1979, 19(1): 24-26.
(in Chinese) 卢运玉, 阎逊初. 三个链霉菌类群孢子表面结构的研究. 微生物学报, 1979, 19(1): 24-26. |
| [25] | Pinnert-Sindico S. A new species of Streptomyces producing antibiotics Streptomyces ambofaciens n. sp., cultural characteristics. Annales de l'Institut Pasteur (Paris), 1954, 87(6): 702-707. |
| [26] | Juguet M, Lautru S, FrancouFX, Nezbedová Š, Leblond P, Gondry M, Pernodet JL. An iterative nonribosomal peptide synthetase assembles the pyrrole-amide antibiotic congocidine in Streptomyces ambofaciens. Chemistry & Biology, 2009, 16(4): 421-431. |
| [27] | Lautru S, Song L, Demange L, Lombès T, Galons H, Challis GL, Pernodet JL. A sweet origin for the key congocidine precursor 4-acetamidopyrrole-2-carboxylate. Angewandte Chemie International Edition, 2012, 51(30): 7454-7458. DOI:10.1002/anie.201201445 |
| [28] | Rab E, Kekos D, Roussis V, Ioannou E. α-Pyronepolyketides from Streptomyces ambofaciens BI0048, an endophytic actinobacterial strain isolated from the Red Alga Laurencia glandulifera. Marine Drugs, 2017, 15(12): 389. DOI:10.3390/md15120389 |
| [29] | Wei SP, Zhang WH, Ji ZQ. Structure and antibacterial activity of ambobactin, a new telomycin-like cyclic depsipeptide antibiotic produced by Streptomyces ambofaciens F3. Molecules, 2015, 20(9): 16278-16289. DOI:10.3390/molecules200916278 |
 2020, Vol. 60
2020, Vol. 60