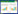中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 顾春涛, 王雅莹, 朱军莉, 胡婧. 2020
- Chuntao Gu, Yaying Wang, Junli Zhu, Jing Hu. 2020
- 顺反式肉桂醛对肉源隆德假单胞菌生物被膜和致腐性的抑制作用
- Inhibitory activity of trans-cinnamaldehyde and cinnamaldehyde on biofilm formation and spoilage of Pseudomonas lundensis
- 微生物学报, 60(1): 26-35
- Acta Microbiologica Sinica, 60(1): 26-35
-
文章历史
- 收稿日期:2018-12-02
- 修回日期:2019-03-30
- 网络出版日期:2019-05-13
隆德假单胞菌是一种与肉类和奶类等动物性产品腐败有关的革兰氏阴性细菌,且有较强的生物被膜形成能力[1]。在自然环境中,细菌在营养竞争、缺水等不利条件下生存,微生物会附着在固体表面,并形成生物被膜。生物被膜是一种在生物和非生物表面上建立的多细胞聚合物,生物被膜很难用物理方法清除,且通过降低渗透速度、螯合反应、酶降解等方法增强对消毒剂的抵抗能力,是保护细菌免受抗生素等物质伤害的有效途径[2]。食品加工设备容易形成细菌生物被膜,导致加工环境中持续和交叉污染,成为严重的食品安全问题。
植物精油具有抗氧化活性、抑菌或杀菌活性,在食品贮藏与保鲜方面能延长产品保质期,并提高其安全性,应用前景广泛。已发现肉桂、大蒜、向日葵精油与姜黄素制备的纳米乳液能显著抑制冷鲜鸡肉细菌、酵母、霉菌数,感官、理化指标改善显著,其中肉桂精油效果最好[3],肉桂精油主要成分为反式肉桂醛(50%–90%)[4]。研究已表明,醛类通过疏水性、降低氢离子浓度及ATP水平、下调调控细菌细胞分裂的FtsZ蛋白、降低多种细胞膜蛋白基因表达改变膜通透性、破坏线粒体功能、阻止细菌分裂和降低细菌跨膜运输能力,干扰其正常生理功能[5]。肉桂醛已被美国食品药品监督管理局批准用于食品,已显示肉桂醛能抑制荧光假单胞菌(Pseudomonas fluorescens)[6]的生物被膜,反式肉桂醛有效降低单核细胞增生李斯特菌(Listeria monocytogenes)[7]、阪崎肠杆菌(Enterobacter sakazakii)[8]的被膜。
目前研究对肉桂醛抑菌抗被膜的报道较多[6-8],然而仍缺乏对反式和顺式肉桂醛生物活性的详实比较。同时植物精油抑菌活性主要针对食源性致病菌,而对腐败菌的相关研究较少。鉴于此,本研究比较分析反式和顺式肉桂醛对牛肉优势腐败菌隆德假单胞菌抑菌、抗生物被膜、胞外酶的影响,采用荧光定量PCR (RT-PCR)检测相关基因表达量变化,旨在探寻抑制腐败菌生物被膜的理论依据。
1 材料和方法 1.1 材料 1.1.1 菌种与原料: 隆德假单胞菌(Pseudomonas lundensis)PS28分离于腐败牛肉,其16S rDNA的NCBI登录号为MK041549,细菌保存于–80 ℃甘油管中。将细菌接种于TSB培养基中28 ℃培养,在TSA琼脂和TSB肉汤二次活化后待用。牛肉购于杭州下沙高沙农贸市场,牛油购于深圳安达食品有限公司。 1.1.2 培养基: 胰蛋白胨大豆肉汤琼脂培养基(TSA),胰蛋白胨大豆肉汤培养基(TSB)购于青岛海博生物技术有限公司。 1.1.3 主要仪器和试剂: VICTOR X酶标仪(美国Perkin Elmer公司),Zeiss LSM 710共聚焦扫描显微镜(德国蔡氏公司),UV-1800紫外分光光度计(日本SHIMADZU公司),QuantStudioTM6Flex荧光定量PCR仪(美国Thermo Fisher Scientific公司)等。反式肉桂醛(Trans-cinnamicaldehyde,TC)、肉桂醛(Cinnamicaldehyde,CD)、DMSO (美国Sigma公司),SYTO9-PI、TRIzol、cDNA试剂盒、SYBR荧光染料(美国Thermo Fisher Scientific公司)等,引物由生工生物工程(上海)股份有限公司合成。 1.2 肉桂醛抑菌活性测定将供试的两种肉桂醛溶于DMSO配成浓度为100 mg/mL溶液,采用二倍稀释法测定最小抑制浓度(MIC)[9]。将过夜活化的细菌菌液以105–106 CFU/mL接种量接种于含有25、50、100、200 µg/mL反式肉桂醛及28、56、112、225 µg/mL顺式肉桂醛的TSB培养基,28 ℃静置培养,每4 h取样计数细菌浓度。
1.3 结晶紫法检测细菌生物被膜将1.2所述含有亚抑菌浓度肉桂醛的菌液每孔200 μL添加至96孔板中,28 ℃静置培养24 h后,根据Djordjevic等[10]的结晶紫染色方法测定生物被膜含量。
1.4 细菌粘附测定将1.2所述含有亚抑菌浓度肉桂醛的菌液每孔2 mL分装到24孔板中,加入不锈钢片(10 mm× 10 mm)在28 ℃静置培养24 h。参考Nguyen等[11]珠涡流法对粘附在不锈钢片表面的细菌进行计数。
1.5 共聚焦显微镜(CLSM)观察生物被膜结构将1.2所述含有亚抑菌浓度肉桂醛的菌液每孔3 mL分装到培养皿中,28 ℃静置培养24 h,SYTO9-PI染液处理后用CLSM观察生物被膜结构和被膜活菌/死菌。
1.6 细菌胞外酶活性测定提取无菌牛肉汁[1],将假单胞菌以105–106 CFU/mL接种量接种于含有不同浓度肉桂醛的无菌牛肉汁中,28 ℃静置培养24 h后,采用福林法测定蛋白酶活力[12]。在含4%牛油(W/V)的TSB培养基中添加不同浓度肉桂醛,将细菌菌液以105–106 CFU/mL接种量接种,参考Mauriello等[13]方法测定脂肪酶活性。
1.7 细菌运动性观察参考Li等[6]的方法,待含有不同浓度反式和顺氏肉桂醛的泳动琼脂培养基凝固后,将5 μL过夜培养的菌液滴在平板中心,无菌干燥后,移至28 ℃静置培养24 h。
1.8 荧光定量PCR检测将1.2所述含有亚抑菌浓度肉桂醛的细菌菌悬液28 ℃静置培养24 h后。按照TRIzol说明书步骤对细菌中总RNA进行提取。参照cDNA试剂盒说明书步骤进行反转录。使用16S rRNA作为内源性对照进行分析,检测定量粘附基因lapA、鞭毛基因fliC、蛋白酶基因aprX和脂肪酶基因lip扩增浓度,重复3次。具体引物见表 1。
| Primers | Sequence (5′→3′) | Size/bp |
| lapA F | CAGATGGTCAACGCTGTGC | 221 |
| lapA R | GTGTTAGCCATGCGGTTCC | |
| fliC F | AATGATGCGGGTATCTCGG | 95 |
| fliC R | GTGCCAGCTACAACCAAGT | |
| aprX F | TAACGAGCCGCAGACCCT | 83 |
| aprX R | AGCCATCAACCGCTACGC | |
| lip F | CGTATGGTCAACAACGACGAC | 101 |
| lip R | ATCACAAACAGCGAAGCGAGC | |
| 16S rDNA F | GCCCCCTGGACAAAGACTGAC | 88 |
| 16S rDNA R | CATCGTTTACGGCGTGGACTACC |
1.9 数据处理
实验均设计3个重复,采用Microsoft Excel 2010 (Microsoft公司)和Origin 9.0软件(OriginLab公司)进行数据处理和作图,并利用SPSS 19.0软件(IBM公司)的AVOVA进行方差分析,P < 0.05表示有统计学显著性差异,结果为平均值±标准差(mean±SD)。
2 结果和讨论 2.1 肉桂醛对隆德假单胞菌生长影响反式和顺式肉桂醛对隆德假单胞菌的最小抑制浓度(MIC)初步测定约为200 μg/mL,肉桂醛浓度对隆德假单胞菌生长的影响如图 1所示。隆德假单胞菌经12 h培养到达稳定初期,细菌浓度为8.72 Log10CFU/mL。添加肉桂醛能影响隆德假单胞菌的生长速度,其中50 μg/mL和100 μg/mL反式肉桂醛及56 μg/mL和112 μg/mL顺式肉桂醛处理组细菌4 h生长略缓慢(P > 0.05),之后逐渐恢复生长,而16 h后处理组与对照组菌体浓度无显著差异(P > 0.05)。而添加200 μg/mL反式肉桂醛和225 μg/mL顺式肉桂醛下菌体基本无生长。因此,这两种肉桂醛对隆德假单胞菌的MIC分别为200 μg/mL和225 μg/mL。
|
| 图 1 28 ℃下反式肉桂醛(A)和顺式肉桂醛(B)对假单胞菌PS28生长的影响 Figure 1 Effects of trans-cinnamicaldehyde (TA, A) and cinnamicaldehyde (CD, B) on the growth of PS28 at 28 ℃. |
2.2 肉桂醛对细菌生物被膜形成的影响
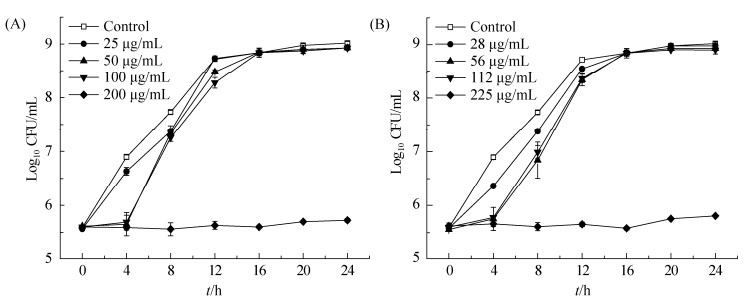
亚抑菌浓度肉桂醛对隆德假单胞菌生物被膜的影响如图 2所示。结果显示,隆德假单胞菌培养24 h的生物被膜量达到0.74 (OD590),添加肉桂醛能显著降低菌体生物被膜的形成(P < 0.05),1/8 MIC、1/4 MIC和1/2 MIC反式肉桂醛分别降低32.88%、47.95%和60.27%的结晶紫含量,而相近浓度的顺式肉桂醛则减少26.03%、41.10%和52.05%,1/4 MIC和1/8 MIC作用下被膜减少量无显著差异(P > 0.05)。
|
| 图 2 28 ℃下反式和顺式肉桂醛对假单胞菌PS28生物被膜的影响 Figure 2 Effects of TC and CD on the biofilm of PS28 at 28 ℃. |
2.3 肉桂醛对细菌粘附的影响
菌体粘附在生物被膜形成的初始附着起重要作用,肉桂醛对隆德假单胞菌的粘附影响如图 3所示。研究表明,隆德假单胞菌培养24 h菌体粘附量达到6.36 CFU/cm2,肉桂醛能显著降低隆德假单胞菌的粘附量,并随浓度增加而抑制效果增强,显示浓度依赖性。其中1/2 MIC反式和顺式肉桂醛对假单胞菌粘附表现出最强的抑制活性,分别为56.35%和61.10%,1/8 MIC、1/4 MIC的反式肉桂醛分别降低30.82%和39.74%的粘附量,而1/4 MIC、1/8 MIC的顺式肉桂醛无显著影响(P > 0.05)。结果显示,亚抑菌浓度的肉桂醛对隆德假单胞菌的粘附性表现为抑制,且反式肉桂醛对菌体粘附量表现更强的抑制活性。

|
| 图 3 28 ℃下反式和顺式肉桂醛对假单胞菌PS28粘附性的影响 Figure 3 Effects of TC and CD on the adhesion of PS28 at 28 ℃. |
2.4 CLSM观察生物被膜的结构
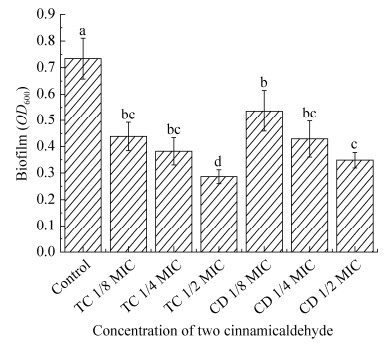
采用CLSM观察肉桂醛对隆德假单胞菌被膜结构的影响,如图 4所示。结果发现,隆德假单胞菌经24 h培养被膜较致密,厚度为40.67 μm。两种肉桂醛添加能显著降低菌体生物被膜的形成,其中添加1/8 MIC、1/4 MIC、1/2 MIC反式肉桂醛被膜厚度分别减少至25.33、17.67、10.50 μm,而顺式肉桂醛添加被膜厚度降低为25.52、18.67、14.00 μm。且从SYTO9-PI两种染料观察到,处理组生物被膜中红色荧光信号增强,表明肉桂醛处理能渗透至被膜内部,加速被膜菌体死亡,特别是1/2 MIC处理。相对于顺式肉桂醛,反式肉桂醛处理后隆德假单胞菌被膜厚度显著降低,且变得较稀疏,被膜菌中死细胞明显增多。
|
| 图 4 CLSM观察28 ℃下反式和顺式肉桂醛对隆德假单胞菌PS28生物被膜结构的影响 Figure 4 Effects of TC and CD on biofilm structures of PS28 by CLSM image at 28 ℃. |
2.5 肉桂醛对细菌运动性的影响
由鞭毛介导的运动性参与细菌与接触表面的粘附,增加粘附的效率。如图 5所示,隆德假单胞菌培养至24 h的泳动扩散直径为4.91 cm。随着肉桂醛浓度增加,菌体泳动直径逐步减少,与对照相比1/8 MIC、1/4 MIC和1/2 MIC反式和顺式肉桂醛分别降低泳动直径14.08%、23.18%、58.08%和16.64%、20.57%、42.29%。相似地发现,亚抑菌浓度下反式肉桂醛对运动性表现更强的抑制性。

|
| 图 5 28 ℃下反式和顺式肉桂醛对隆德假单胞菌PS28泳动性的影响 Figure 5 Effects of TC and CD on swimming motility of PS28 at 28 ℃. |
2.6 肉桂醛对细菌胞外蛋白酶和脂肪酶的影响
如图 6所示,分析肉桂醛对隆德假单胞菌两种胞外酶的影响。结果显示,亚抑菌浓度的肉桂醛对隆德假单胞菌胞外酶均表现抑制活性。隆德假单胞菌经培养后蛋白酶活性为0.74个活性单位,而培养后脂肪酶活性达到0.17个活性单位。亚抑菌浓度肉桂醛添加显著降低胞外酶活性(P < 0.05),其中反式肉桂醛1/8 MIC、1/4 MIC、1/2 MIC处理组蛋白酶活性分别降低11.90%、23.81%和61.90%,脂肪酶活性减少12.82%、23.08%和40.17%,而顺式肉桂醛在相似浓度处理蛋白酶活性减少2.38%、26.67%和76.19%,脂肪酶活性减少18.80%、29.06%和47.01%。

|
| 图 6 28 ℃下反式和顺式肉桂醛对隆德假单胞菌PS28蛋白酶(A)及脂肪酶活性(B)的影响 Figure 6 Effects of TC and CD on the proteinase activity (A) and lipolysis activity (B) of PS28 at 28 ℃. |
2.7 肉桂醛对细菌基因表达的影响
以16S rDNA作为内参基因,RT-PCR分析亚抑菌浓度肉桂醛对隆德假单胞菌的生物被膜和腐败相关基因的表达影响。如图 7所示,与对照组相比,肉桂醛处理组中隆德假单胞菌lapA、fliC、aprX和lip 4个基因表达出现明显下调(P < 0.05),反式肉桂醛1/8 MIC、1/4 MIC处理组4个基因表达量为对照组0.36–0.62和0.16–0.44倍,特别是1/2 MIC处理组表达量仅为对照组0.05–0.16倍,相似浓度顺式肉桂醛处理组表达量为对照组0.49–0.91、0.19–0.41和0.02–0.11倍,其中顺式肉桂醛1/8 MIC处理组的lapA与对照组无显著差异。

|
| 图 7 反式(A)和顺式(B)肉桂醛对隆德假单胞菌PS28生物被膜及致腐4个基因表达的影响 Figure 7 Effects of TC (A) and CD (B) on four gene expressions related with biofilm and spoilage in PS28. |
3 讨论
研究表明,冷鲜肉特定腐败菌隆德假单胞菌生物被膜形成能力较强[1]。肉桂是一种常见的香料和药用植物,反式肉桂醛是肉桂精油的主要生物活性成分,顺式肉桂醛与反式肉桂醛互为空间异构,两种天然化合物具有抗氧化、抗癌、抗菌作用[5]。本研究比较分析了亚抑菌浓度反式和顺式肉桂醛的抗生物被膜和抑制致腐,结果显示两种肉桂醛对隆德假单胞菌均表现较强的抑制作用,MIC分别为200 μg/mL和225 μg/mL。已报道顺式肉桂醛对荧光假单胞菌和鼠伤寒沙门氏菌(Salmonella typhimurium)的MIC浓度为125 μg/mL[6]和312 μg/mL[14],而反式肉桂醛对阪崎克罗诺肠杆菌的MIC为400 μg/mL[15]。由于不同研究中供试菌种和精油来源差异,导致报道的肉桂醛对不同菌株的MIC不完全相同。
生物被膜形成增强了细菌细胞对环境消毒剂和抗生素的抵抗能力,使细菌难以清除。结果表明两种肉桂醛均能降低生物被膜形成,并表现浓度依赖性,该结果与阪崎肠杆菌[6]和荧光假单胞菌[8]的报道类似。相对于顺式肉桂醛,反式肉桂醛对隆德假单胞菌生物被膜抑制作用更强,CLSM观察也证实反式肉桂醛不仅降低被膜的厚度,而且还能促进被膜菌的死亡。相似的报道顺式肉桂醛减低副溶血性弧菌生物被膜形成[16],而反式肉桂醛抑制李斯特菌生物被膜的形成,降低被膜厚度,还增多被膜中死细胞,破坏被膜结构[7]。
菌体运动性对生物被膜形成初期的微菌落及其发展起重要作用。亚抑菌浓度的顺式肉桂醛处理降低荧光假单胞菌[6]和副溶血性弧菌[16]的泳动能力。本研究也显示亚抑菌浓度肉桂醛抑制隆德假单胞菌泳动性,推测菌体泳动性降低与被膜减少有关。顺反式肉桂醛能抑制假单胞菌蛋白酶和脂肪酶等致腐性表型,其中碱性金属蛋白酶主要参与酪蛋白的水解[17],脂肪酶是一类水解酶,能催化水解、醇解、酸解等多种反应[18]。研究表明,相对于反式肉桂醛,顺式肉桂醛亚抑菌浓度下抑制隆德假单胞菌蛋白酶和脂肪酶效果更强。
假单胞菌外膜相关蛋白LapA影响粘附和被膜基质,从而促进微菌落形成和生物膜成熟[19],fliC编码鞭毛蛋白,调控细菌运动性,而假单胞菌aprX和lip基因分别编码碱性金属蛋白酶[17]和脂肪酶[18]。研究显示,外源添加反式肉桂醛和肉桂醛的导致隆德假单胞菌lapA、fliC、aprX和lip 4个基因呈现浓度依赖性下调,其中反式肉桂醛对lapA和fliC基因表达抑制更强,顺式肉桂醛抑制aprX和lip基因表达更明显,与表型相符。研究表明,荧光假单胞菌Pf-01环二鸟苷酸c-di-GMP可提高细胞表面黏附蛋白LapA表达,促进生物膜形成[20]。在亚抑菌浓度反式肉桂醛下调李斯特菌初期粘附(flaA、fliP、flgE、motA)和群体感应(degU)相关基因表达水平[7]。已发现c-di-GMP作为细菌第二信使是调节菌体生物被膜形成的重要胞内信号分子[21],推测肉桂醛影响隆德假单胞菌生物被膜的形成与其c-di-GMP的调控密切相关。Silva等[14]采用蛋白组学分析发现肉桂醛下调沙门氏菌过氧化物酶、ATP合成酶等能量代谢酶来抑制生物被膜形成。上述研究提示,培养环境中肉桂醛刺激可能导致隆德假单胞菌胞内形成氧化应激状态,减少c-di-GMP浓度,进而降低粘附素lapA、鞭毛fliC等表达和EPS胞外分泌物,从而抑制早期粘附和生物被膜形成。并且胞内c-di-GMP与群体感应通路内在相关[22],c-di-GMP如何影响群体感应介导的致腐性不清晰,其机制有待于进一步探究。
可见,反式和顺式肉桂醛能有效抑制致腐菌隆德假单胞菌生物被膜和致腐胞外酶活性,其中反式肉桂醛对生物被膜抑制作用较强,而顺式肉桂醛更有效地降低致腐胞外酶活性,研究为植物精油在食品保鲜和加工的应用提供了理论研究基础。
| [1] |
Liu YJ. Biofilm formation characteristics of specific spoilage bacteria from chilled pork and transcriptomics mechanism at low temperature. Master Dissertation of Shanghai Ocean University, 2016. (in Chinese) 刘永吉.冷却肉特定腐败菌的生物被膜特征与低温转录组学研究.上海海洋大学硕士学位论文, 2016. |
| [2] | Borges A, Abreu AC, Dias C, Saavedra MJ, Borges F, Simöes M. New perspectives on the use of phytochemicals as an emergent strategy to control bacterial infections including biofilms. Molecules, 2016, 21(7): 877. DOI:10.3390/molecules21070877 |
| [3] | Abdou ES, Galhoum GF, Mohamed EN. Curcumin loaded nanoemulsions/pectin coatings for refrigerated chicken fillets. Food Hydrocolloids, 2018, 83: 445-453. DOI:10.1016/j.foodhyd.2018.05.026 |
| [4] | Kim YG, Lee JH, Kim SI, Baek KH, Lee J. Cinnamon bark oil and its components inhibit biofilm formation and toxin production. International Journal of Food Microbiology, 2015, 195: 30-39. DOI:10.1016/j.ijfoodmicro.2014.11.028 |
| [5] | Vasconcelos NG, Croda J, Simionatto S. Antibacterial mechanisms of cinnamon and its constituents: a review. Microbial Pathogenesis, 2018, 120: 198-203. DOI:10.1016/j.micpath.2018.04.036 |
| [6] | Li TT, Wang DF, Liu N, Ma Y, Ding T, Mei YC, Li JR. Inhibition of quorum sensing-controlled virulence factors and biofilm formation in Pseudomonas fluorescens by cinnamaldehyde. International Journal of Food Microbiology, 2018, 269: 98-106. DOI:10.1016/j.ijfoodmicro.2018.01.023 |
| [7] | Upadhyay A, Upadhyaya I, Kollanoor-Johny A, Venkitanarayanan K. Antibiofilm effect of plant derived antimicrobials on Listeria monocytogenes. Food Microbiology, 2013, 36(1): 79-89. |
| [8] | Amalaradjou MAR, Venkitanarayanan K. Effect of trans-cinnamaldehyde on inhibition and inactivation of Cronobacter sakazakii biofilm on abiotic surfaces. Journal of Food Protection, 2011, 74(2): 200-208. DOI:10.4315/0362-028X.JFP-10-296 |
| [9] | Cetin-Karaca H, Newman MC. Antimicrobial efficacy of phytochemicals against Bacillus cereus in reconstituted infant rice cereal. Food Microbiology, 2018, 69: 189-195. DOI:10.1016/j.fm.2017.08.011 |
| [10] | Djordjevic D, Wiedmann M, McLandsborough LA. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Applied and Environmental Microbiology, 2002, 68(6): 2950-2958. DOI:10.1128/AEM.68.6.2950-2958.2002 |
| [11] | Nguyen HDN, Yang YS, Yuk HG. Biofilm formation of Salmonella Typhimurium on stainless steel and acrylic surfaces as affected by temperature and pH level. LWT-Food Science and Technology, 2014, 55(1): 383-388. |
| [12] |
Ge YY, Zhu JL, Liu L, Ren YJ. Spoilage phenotypic characterization and identification of Aeromonas isolated from spoiled Larimichthys crocea. Journal of Fisheries of China, 2017, 41(6): 861-869.
(in Chinese) 葛阳杨, 朱军莉, 刘丽, 任奕婧. 大黄鱼源气单胞菌的分离鉴定及致腐表型. 水产学报, 2017, 41(6): 861-869. |
| [13] | Mauriello G, Casaburi A, Blaiotta G, Villani F. Isolation and technological properties of coagulase negative staphylococci from fermented sausages of Southern Italy. Meat Science, 2004, 67(1): 149-158. DOI:10.1016/j.meatsci.2003.10.003 |
| [14] | Silva AF, Dos Santos AR, Trevisan DAC, Ribeiro AB, Campanerut PAZ, Kukolj C, De Souza EM, Cardoso RF, Svidzinski TIE, De Abreu Filho BA, Junior MM, Mikcha JMG. Cinnamaldehyde induces changes in the protein profile of Salmonella typhimurium biofilm. Research in Microbiology, 2018, 169(1): 33-43. DOI:10.1016/j.resmic.2017.09.007 |
| [15] |
Shi C, Guo D, Zhang WT, Guo KL, Wen QW, Guo X, Liu ZY, Yin SH, Yang BW, Xia XD. Inhibitory activity of trans-cinnamaldehyde against Cronobacter sakazakii. Modern Food Science and Technology, 2017, 33(10): 58-66.
(in Chinese) 石超, 郭都, 张文婷, 郭凯伦, 温啓吾, 郭晓, 刘志远, 尹术华, 杨保伟, 夏效东. 反式肉桂醛对阪崎克罗诺肠杆菌抑制作用的研究. 现代食品科技, 2017, 33(10): 58-66. |
| [16] | Banu SF, Rubini D, Murugan R, Vadivel V, Gowrishankar S, Pandian SK, Nithyan P. Exploring the antivirulent and sea food preservation efficacy of essential oil combined with DNase on Vibrio parahaemolyticus. LWT, 2018, 95: 107-115. DOI:10.1016/j.lwt.2018.04.070 |
| [17] | Andreani NA, Carraro L, Fasolato L, Balzan S, Lucchini R, Novelli E, Cardazzo B. Characterisation of the thermostable protease aprX in strains of Pseudomonas fluorescens and impact on the shelf-life of dairy products: preliminary results. Italian Journal of Food Safety, 2016, 5(4): 6175. |
| [18] | Lee JH, Ashby RD, Needleman DS, Lee KT, Solaiman DKY. Cloning, sequencing, and characterization of lipase genes from a polyhydroxyalkanoate (PHA)-synthesizing Pseudomonas resinovorans. Applied Microbiology and Biotechnology, 2012, 96(4): 993-1005. DOI:10.1007/s00253-012-4133-x |
| [19] | Gjermansen M, Nilsson M, Yang L, Tolker-Nielsen T. Characterization of starvation-induced dispersion in Pseudomonas putida biofilms: genetic elements and molecular mechanisms. Molecular Microbiology, 2010, 75(4): 815-826. |
| [20] | Newell PD, Yoshioka S, Hvorecny KL, Monds RD, O'Toole GA. Systematic analysis of diguanylate cyclases that promote biofilm formation by Pseudomonas fluorescens Pf0-1. Journal of Bacteriology, 2011, 193(18): 4685-4698. DOI:10.1128/JB.05483-11 |
| [21] | Simm R, Morr M, Kader A, Nimtz M, Römling U. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility. Molecular Microbiology, 2010, 53(4): 1123-1134. |
| [22] | Valentini M, Filloux A. Biofilms and cyclic di-GMP (c-di-GMP) signaling: lessons from Pseudomonas aeruginosa and other bacteria. Journal of Biological Chemistry, 2016, 291(24): 12547-12555. DOI:10.1074/jbc.R115.711507 |
 2020, Vol. 60
2020, Vol. 60