中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 郑帅, 朴春梅, 张芝, 刘婷婷, 王吉静, 王绿娅, 杜杰. 2019
- Shuai Zheng, Chunmei Piao, Zhi Zhang, Tingting Liu, Jijing Wang, Lvya Wang, Jie Du. 2019
- 强化玉米饮食对小鼠肠道菌群结构和功能的影响
- Influence of corn-rich diet on mice gut microbiota structure and function
- 微生物学报, 58(9): 1714-1722
- Acta Microbiologica Sinica, 58(9): 1714-1722
-
文章历史
- 收稿日期:2019-04-11
- 修回日期:2019-05-08
- 网络出版日期:2019-06-06
2. 心血管重塑相关疾病教育部重点实验室, 北京 100029;
3. 北京市心血管重大疾病协同创新中心, 北京 100029;
4. 首都医科大学基础医学院细胞生物学系, 北京 100069;
5. 河南省人民医院&郑州大学人民医院心功能科, 河南 郑州 450003;
6. 北京市心肺血管疾病研究所-首都医科大学附属北京安贞医院动脉粥样硬化研究室, 北京 100029
2. The Key Laboratory of Remodeling-Related Cardiovascular Diseases, Ministry of Education, Beijing 100029, China;
3. Beijing Collaborative Innovation Centre for Cardiovascular Disorders, Beijing 100029, China;
4. Department of Cell Biology, Basic Medicine Collage, Capital Medical University, Beijing 100069, China;
5. Department of Heart Function, Henan Province People's Hospital and The People's Hospital of Zhengzhou University, Zhengzhou 450003, Henan Province, China;
6. Department of Atherosclerosis, Beijing Anzhen Hospital, Capital Medical University and Beijing Institute of Heart Lung and Blood Vessel Diseases, Beijing 100029, China
玉米是世界各国的主要粮食产物之一。同时,根据中医“药食同源”观点,玉米是具备药用效果的食物之一。《中药大辞典》对玉米的描述“为健胃剂”,有“调中开胃”的作用,但是对玉米的药用机制目前尚不明确。
肠道菌群是定殖于宿主胃肠道的上千种不同细菌的集合体,近年来的研究证实,肠道菌群相当于人体的一个新的“器官”,参与调节宿主的多方面生理机能,包括消化、营养代谢、天然免疫系统成熟,等等,肠道菌群的失调则会导致多种疾病[1]。概括而言,肠道菌群可以利用宿主摄入的食物生成多种类型的代谢产物[2],比如生成短链脂肪酸(short-chain fatty acid,SCFA)和支链氨基酸(branched-chain amino acids,BCAAs),进而调节宿主从食物中摄入的能量[3],调控肠道和脂肪组织中的免疫平衡[4-5],以及影响宿主的胰岛素敏感性[6],由此影响宿主的代谢稳态;肠道菌群失调则与代谢性疾病如肥胖[7]和糖尿病[8]密切相关。另一方面,饮食是调控肠道菌群组成结构的主要因素之一,其影响既包括短期快速改变,也包括长期缓慢改变菌群结构[9-10],同时饮食成分的差异也会导致菌群产生的代谢物发生改变。因此饮食能够通过调节肠道菌群来影响宿主的健康,而强化玉米饮食很有可能也通过调控肠道菌群来发挥药食同源的作用,促进宿主的代谢。
目前关于强化玉米饮食对于肠道菌群的影响尚无详细的报道,部分原因是因为传统的微生物学研究技术存在局限性,无法提供准确而完整的菌群系统的变化信息。因此本研究采用Illumina二代测序技术,通过检测粪便样本宏基因组(元基因组) DNA,获得普通饮食与强化玉米饮食条件下的肠道菌群宏基因组信息,进而比较两组菌群种属丰度及功能基因丰度的差异,从而明确强化玉米饮食是否使肠道菌群结构变得更加有助于宿主代谢。
1 材料和方法 1.1 材料 1.1.1 实验动物: 动物实验方案遵照首都医科大学动物实验伦理委员会的相关规定制定和执行。实验使用普通清洁级8周龄雌性BALB/c背景的NF-κB反应元件-荧光素酶转基因小鼠[BALB/C-Tg (NFκB-RE-luc)-Xen,美国Caliper Life Sciences公司],购自南京模式动物研究所。实验小鼠在动物实验中心饲养,维持12 h明-暗循环饲养条件。 1.1.2 饲料: 小鼠随机分为普通饮食组(Ctrl)和强化玉米饮食组(Corn),每组10只小鼠。普通饮食组的小鼠给予正常小鼠饲料(北京华阜康生物科技股份有限公司的大小鼠维持饲料,产品编号为1032),强化玉米饮食组给予定制的混合饲料,混合饲料由玉米粉(品系编号:7610)与上述正常小鼠饲料粉按1:3混合后压制成型而制备(也由北京华阜康生物科技股份有限公司提供)。1032型正常小鼠饲料的成分如表 1所列。| Ingredients | Content |
| Water | ≤8.0% |
| Crude protein | ≥21.0% |
| Crude lipids | ≥5.0% |
| Crude fiber | ≤5.0% |
| Calcium | 1.3%–1.4% |
| Phosphorus | 0.9%–1.0% |
| Magnesium | ≥0.2% |
| Potassium | ≥0.5% |
| Sodium | ≥0.2% |
| Iron | ≥180.0 mg/kg |
| Manganese | ≥80.0 mg/kg |
| Copper | ≥15.0 mg/kg |
| Zinc | ≥80.0 mg/kg |
| Iodine | ≥0.5 mg/kg |
| Seledium | 0.1–0.2 mg/kg |
1.2 实验动物的处理
实验小鼠购得后,先使用普通饲料同笼喂养1周,以确保小鼠适应饲养环境,并达到相似的肠道菌群基础水平。之后将小鼠随机分为2组,按上述饲料处理方法分别喂食10周,然后采集每只小鼠的新鲜粪便样本。
1.3 粪便样本的采集对小鼠采用常规抓取、按摩腹部的方法,在洁净台中采集新鲜粪便颗粒到无菌Ep管中,采集后即刻冰浴,直至转入–80 ℃冰箱中待用。每只小鼠至少采集0.3 g粪便颗粒,一次采集不足量者,可以在同一天的多个时间点反复采集。
1.4 粪便样本DNA的提取使用粪便样本DNA提取试剂盒(CW2092,北京康为世纪生物科技有限公司,中国)提取每200 mg粪便样本中的总DNA,提取步骤按照试剂盒的说明书进行。获得的DNA溶液使用NanoDrop2000分光光度计来确定浓度,并用约1–2 μL DNA样本跑1%琼脂糖凝胶电泳鉴定DNA质量。若DNA样本的浓度大于5 µg/mL (总量至少有0.1 µg),OD260/280值在1.8–2.0之间,且电泳图像显示没有明显的DNA降解碎片,则该样本为合格样本。不合格的样本重新进行DNA提取,合格的样本保存在–80 ℃冰箱直至测序。
1.5 测序质量合格的DNA样本使用诺禾致源公司的Illumina Novaseq 6000高通量测序平台进行测序,按照其标准化程序进行。首先对样本DNA用Covaris超声波破碎仪随机打断成长度约为350 bp的片段,经末端修复、加A尾、加测序接头、纯化、PCR扩增等步骤完成整个文库制备。然后使用Qubit2.0进行初步定量,将文库稀释至2 ng/µL,随后使用Agilent 2100对文库的insert size进行检测,并使用Q-PCR方法对文库的有效浓度进行准确定量,最后把不同文库按照有效浓度及目标下机数据量的需求pooling后进行测序。
1.6 测序数据处理首先对下机数据进行质控,去除小于40 bp的reads,去除N碱基含量超过10 bp的reads,去除与测序接头序列overlap超过15 bp的reads,再采用Bowtie2软件比对小鼠数据库、过滤掉源自小鼠(宿主)的reads,得到有效数据(Clean Data)。质控获得的Clean Data,进一步使用SOAP denovo软件进行组装(K-mer设定为55),得到Scaffolds序列,再将Scaffolds序列从N连接处打断,得到不含N的Scaftigs序列(各样本的Clean Data序列用Bowtie2软件比对至该Scaftigs序列,找出未被利用上的reads,将这些reads进行混合组装,然后再进一步获得相应的Scaftigs序列),过滤掉500 bp以下的片段,余下的Scaftigs序列片段进一步用MetaGeneMark软件进行Open Reading Frame预测和过滤,并用CD-HIT软件进行去冗余。以去冗余得到的代表性片段为基准,用Clean Data结果去比对,获得各基因片段在各样本中的reads数,然后过滤掉reads数不超过2个的基因片段,余下的Clean Data片段,组成了Unigenes列表,用于计算基因丰度等信息,并比对KEGG数据库,进行代谢通路的功能注释和丰度分析。进一步采用DIAMOND软件,将Unigenes比对到NCBI的Microbe NR数据库,然后选取evalue≤最小evalue*10的比对结果,应用MEGAN软件的LCA算法,对各序列进行物种注释,结合Unigenes丰度,获得各样本在各种属层级上的丰度信息和基因数目信息,并作进一步统计分析。测序原始数据上传至NCBI的Sequence Read Archive (SRA)数据库,序列号SRP192980。
1.7 统计分析基于Unigenes列表中各基因在各样品中的丰度信息,进行基本信息统计、基因数目韦恩图分析。基于各样本在各个分类层级上的丰度,进行PCA分析,组间差异物种进行Metastat统计分析(以P < 0.05作为统计学显著性,以q < 0.05进行校正筛选)。其余指标进行双端非参数t检验,以P < 0.05作为统计学显著性。
2 结果和分析 2.1 小鼠及DNA样本情况两组小鼠的终末体重为:Ctrl组22.9±1.4 g vs. Corn组22.5±2.9 g (x±s,P=0.91),无显著差异。各小鼠的粪便DNA测序生成的原始数据量和滤过后的数据量如补充文档的表2所列,可见滤过后各样本的保留数据量比例均在99%以上。
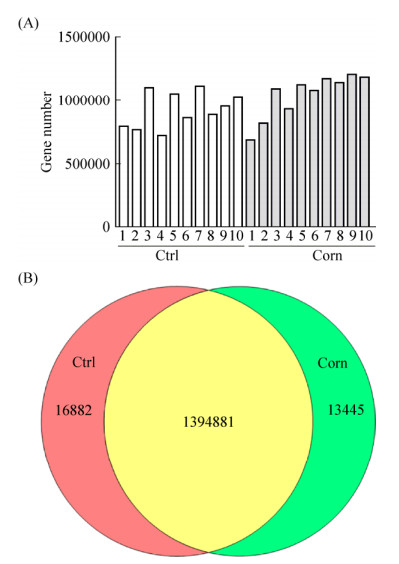
各样本的测序数据经过过滤拼接之后,具备的Unigene数目如图 1-A所示,两组的Unigene平均数目为Ctrl组928787±45566 vs. Corn组1046709±55641,未达到显著差异(x±s,P=0.075),强化玉米饮食组较高。两组相同的Unigene数目和各自特有的Unigene数目如图 1-B所示,可以看到组间相同的Unigene种类占组内Unigene总数的绝大部分。
|
| 图 1 Unigene数目在样本间和组间的分布 Figure 1 Unigene number distribution among samples and groups. A: Unigene number in each sample; B: Venn graph shows the number of common and unique Unigenes in two groups. |
2.2 肠道菌群的结构和丰度随着饮食差异而改变
我们首先比较了两组的菌群结构和丰度的差异,以观察不同饮食条件对于肠道菌群的生物多样性有何影响。两组各样本种级水平丰度排在前十的菌种及其丰度如图 2-A所示,其中Lachnospiraceae bacterium A4的平均丰度在对照组显著高于强化玉米组(0.0434±0.0062 vs. 0.0146±0.0026,x±s,P < 0.01)。各样本根据种级水平丰度进行主成分分析的结果如图 2-B所示,可以看到对照组样本主要集中在第三象限,强化玉米组样本主要集中在第二象限,表明经过10周不同饮食的喂养,两组小鼠的肠道菌群构成具有较大的区别。同时,两组均有2个样本点位于对方组的样本集中区域,提示这几个样本的菌群结构更接近另一组样本。

|
| 图 2 基于种级水平的相对丰度展示和主成分分析 Figure 2 Top 10 relative abundance and PCA analysis based on Species level. A: the top 10 highest abundant species and their abundances in each sample; B: PCA distribution of each sample. |
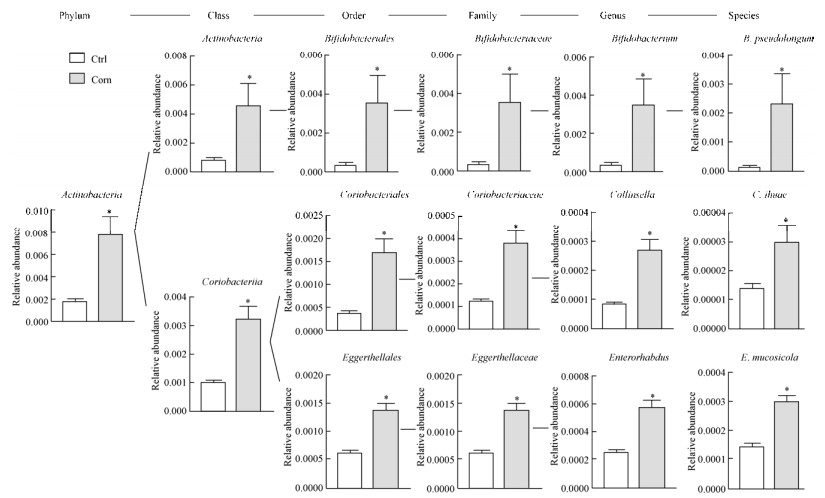
我们进一步比较普通饮食组和强化玉米饮食组从门级到种级的各类细菌的平均丰度,寻找丰度有显著组间差异的种属,Metastat统计结果中,丰度较大的显著差异菌如图 3所示,在强化玉米组,放线菌门下属的放线菌纲-双歧杆菌分支(具体到B. pseudolongum),和Coriobacteriia-柯林氏菌(Collinsella)/Enterorhabdus分支(分别具体到C. ihuae和E. mucosicola等菌种)的丰度均显著高于对照组,提示强化玉米饮食加强了小鼠肠道益生菌的作用(详见讨论部分)。
|
| 图 3 丰度在强化玉米组显著升高的肠道菌群种属 Figure 3 Gut flora strains which had significantly higher abundance in corn-rich diet group. *: P < 0.05. |
2.3 强化玉米饮食使肠道菌群代谢功能显著改变
鉴于放线菌门的一些菌种,包括B. pseudolongum、Coriobacterium glomerans、Eggerthella lenta、Adlercreutzia equolifaciens、Enterorhabdus caecimuris、Enterorhabdus mucosicola (图 3),其丰度均在强化玉米饮食组显著升高,而已知这些菌种含有多种促进糖代谢的酶,如EC 5.4.2.12等,它们的增加提示菌群糖代谢能力的增强。因此我们重点比较了菌群代谢基因和代谢通路的相对比例在2种饮食喂养组的差异。如图 4所示,我们发现,糖酵解的2个功能单元,M00001/2 (分别是Embden-Meyerhof pathway和core module involving three-carbon compounds),在强化玉米饮食组显著升高(图 4-A);涉及脂代谢的2个功能通路,ko00120/121(分别对应生成初级胆汁酸和次级胆汁酸)同样显示在强化玉米饮食组显著升高(图 4-B);具体到代谢基因,则糖酵解酶之一,磷酸甘油酸变位酶(EC 5.4.2.12,不依赖辅因子2, 3-二磷酸甘油酸型)的丰度在强化玉米饮食组显著升高(图 4-C),与菌种的丰度变化一致。这些结果提示,强化玉米饮食提高了肠道菌群代谢糖脂的能力。

|
| 图 4 比对KEGG找出丰度在强化玉米饮食组显著升高的功能模块、功能通路和酶基因 Figure 4 Functional modules, metabolic pathways, and enzyme genes which had significantly higher abundances in corn-rich diet group after annotation to KEGG database. A: Significantly changed modules; B: Significantly changed pathways; C: Significantly changed enzyme gene. *: P < 0.05. |
3 讨论
根据中医“药食同源”的理论,很多食物都同时具有药用效果,玉米就是其中一种,它被认为有“调中开胃”的作用,但是具体机制目前尚不明确。近年来,随着高通量测序技术的发展,有关肠道菌群的研究也取得了长足的发展,新的观点认为,肠道菌群可以视为人体的一个新的“器官”,其在维持人体健康和介导疾病发生方面发挥着重要的作用[1]。同时有多项研究表明,饮食是调节肠道菌群的主要因素之一,一周之内的素食-肉食切换可以快速改变肠道菌群结构[9],而饮食习惯的长期差别也会带来菌群结构的明显差异[10]。因此玉米的药食同源作用至少部分可能是通过调节肠道菌群而发挥的。鉴于目前玉米饮食对于肠道菌群的影响尚不清楚,我们在本研究中使用Illunima高通量测序仪检测强化玉米饮食对于小鼠的肠道菌群有何调节作用。
通过与喂养普通饮食的小鼠的肠道菌群比较,我们发现,强化玉米饮食喂养的小鼠,其宏基因组Unigene的总数与普通饮食对照组相似,同时两组共有的基因类型占各组Unigene总数的绝大部分。具体到各种属细菌的丰度变化,我们发现,强化玉米饮食组的菌群β多样性以及各级丰度最高的菌种含量,都与对照组有较明显的区别,尤其是放线菌门的3个目级分支(包括双歧杆菌)都在强化玉米饮食组显著升高,该显著性变化一直持续到种级的B. pseudolongum和属级的Collinsella/Enterorhabdus下面的多个菌种。根据文献报道,B. pseudolongum具有较强的酵解抗性淀粉的功能[11];而Collinsella则是公认的益生菌之一,参与全麦饮食条件下的胰岛素敏感性改善[12];Enterorhabdus则被报道与肠炎的严重程度负相关[13]。根据这些报道,可以认定,强化玉米饮食喂养10周导致的上述细菌种类丰度的升高,提示肠道菌群结构更有益于宿主的健康。相应的,功能基因和模式通路含量的比较分析发现,两种糖酵解功能单元(M00001/2)含量都在强化玉米饮食组显著升高,同时涉及脂代谢的初级和次级胆汁酸合成的代谢通路基因的含量也在强化玉米饮食组显著升高,尤其是参与糖酵解的磷酸甘油酸变位酶(EC 5.4.2.12)含量在强化玉米组显著增高、与含该基因的一系列菌种的丰度变化一致。这些结果进一步说明,强化玉米饮食可能促进了肠道菌群代谢碳水化合物和脂质的功能。
综上所述,我们的研究使用高通量测序技术,首次鉴定了强化玉米饮食对于肠道菌群的影响,我们的研究结果为从肠道菌群角度解释玉米对健康的促进作用提供了新的依据。
| [1] | Flint HJ, Scott KP, Louis P, Duncan SH. The role of the gut microbiota in nutrition and health. Nature Reviews Gastroenterology & Hepatology, 2012, 9(10): 577-589. |
| [2] | Donia MS, Fischbach MA. Small molecules from the human microbiota. Science, 2015, 349(6246): 1254766. DOI:10.1126/science.1254766 |
| [3] | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [4] | Sonnenburg JL, Bäckhed F. Diet-microbiota interactions as moderators of human metabolism. Nature, 2016, 535(7610): 56-64. DOI:10.1038/nature18846 |
| [5] | Thaiss CA, Zmora N, Levy M, Elinav E. The microbiome and innate immunity. Nature, 2016, 535(7610): 65-74. DOI:10.1038/nature18847 |
| [6] | Pedersen HK, Gudmundsdottir V, Nielsen HB, Hyotylainen T, Nielsen T, Jensen BA, Forslund K, Hildebrand F, Prifti E, Falony G, Le Chatelier E, Levenez F, Doré J, Mattila I, Plichta DR, Pöhö P, Hellgren LI, Arumugam M, Sunagawa S, Vieira-Silva S, Jørgensen T, Holm JB, Trošt K, Consortium MHIT, Kristiansen K, Brix S, Raes J, Wang J, Hansen T, Bork P, Brunak S, Oresic M, Ehrlich SD, Pedersen O. Human gut microbes impact host serum metabolome and insulin sensitivity. Nature, 2016, 535(7612): 376-381. DOI:10.1038/nature18646 |
| [7] | Bäckhed F, Manchester JK, Semenkovich CF, Gordon JI. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(3): 979-984. DOI:10.1073/pnas.0605374104 |
| [8] | Qin JJ, Li YR, Cai ZM, Li SH, Zhu JF, Zhang F, Liang SS, Zhang WW, Guan YL, Shen DQ, Peng YQ, Zhang DY, Jie ZY, Wu WX, Qin YW, Xue WB, Li JH, Han LC, Lu DH, Wu PX, Dai YL, Sun XJ, Li ZS, Tang AF, Zhong SL, Li XP, Chen WN, Xu R, Wang MB, Feng Q, Gong MH, Yu J, Zhang YY, Zhang M, Hansen T, Sanchez G, Raes J, Falony G, Okuda S, Almeida M, LeChatelier E, Renault P, Pons N, Batto JM, Zhang ZX, Chen H, Yang RF, Zheng WM, Li SG, Yang HM, Wang J, Ehrlich SD, Nielsen R, Pedersen O, Kristiansen K, Wang J. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 2012, 490(7418): 55-60. DOI:10.1038/nature11450 |
| [9] | David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature, 2014, 505(7484): 559-563. DOI:10.1038/nature12820 |
| [10] | Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, Bewtra M, Knights D, Walters WA, Knight R, Sinha R, Gilroy E, Gupta K, Baldassano R, Nessel L, Li HZ, Bushman FD, Lewis JD. Linking long-term dietary patterns with gut microbial enterotypes. Science, 2011, 334(6052): 105-108. DOI:10.1126/science.1208344 |
| [11] | Centanni M, Lawley B, Butts CA, Roy NC, Lee J, Kelly WJ, Tannock GW. Bifidobacterium pseudolongum in the ceca of rats fed hi-maize starch has characteristics of a keystone species in bifidobacterial blooms. Applied and Environmental Microbiology, 2018, 84(15): e00547-18. |
| [12] | Carlson JL, Erickson JM, Hess JM, Gould TJ, Slavin JL. Prebiotic dietary fiber and gut health:comparing the in vitro fermentations of beta-glucan, inulin and xylooligosaccharide. Nutrients, 2017, 9(12): E1361. DOI:10.3390/nu9121361 |
| [13] | Opstelten JL, Plassais J, van Mil SWC, Achouri E, Pichaud M, Siersema PD, Oldenburg B, Cervino ACL. Gut microbial diversity is reduced in smokers with crohn's disease. Inflammatory Bowel Diseases, 2016, 22(9): 2070-2077. DOI:10.1097/MIB.0000000000000875 |
 2019, Vol. 58
2019, Vol. 58