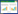中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 陈茜, 薛勇, 宋晓峰, 朱宝利. 2019
- Xi Chen, Yong Xue, Xiaofeng Song, Baoli Zhu. 2019
- 糖尿病及糖尿病心血管并发症患者肠道菌群的特征
- Gut microbiota in diabetic patients and diabetic patients with cardiovascular complications
- 微生物学报, 58(9): 1660-1673
- Acta Microbiologica Sinica, 58(9): 1660-1673
-
文章历史
- 收稿日期:2019-02-26
- 修回日期:2019-04-16
- 网络出版日期:2019-04-24
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
人体肠道菌群种类超过1000种,数量约有1×1014个,是人类细胞总数的10倍以上,其编码特异基因数目更是达到人体自身编码基因数目的300倍[1]。正常情况下,肠道菌群是个动态变化的系统,在肠黏膜表面形成天然的屏障,参与人体的消化吸收等重要活动,同时可调节免疫功能,防止致病菌以及条件致病菌的侵入,对人体健康起到极为重要的作用[2]。近年来,越来越多的证据表明肠道菌群的改变与2型糖尿病(Type 2 diabetes mellitus,T2DM)的发生、发展密切相关[3-4]。研究发现,健康人与T2DM人群的肠道菌群在门类和种属上有明显差异。T2DM患者肠道中变形菌门、拟杆菌门增高,厚壁菌门相对降低,厚壁菌门/拟杆菌门比值降低[5-6]。Qin等利用宏基因组研究(MGWAS)方法,对345人的肠道菌群进行深度基因测序,结果显示,T2DM人群以中度肠道菌群失调为特征,某些常见产丁酸盐细菌减少,各种条件致病菌增加[7]。Hartstra等研究发现,2型糖尿病患者罗斯氏菌(Roseburia)、霍氏真杆菌(Eubacterium halii)、普拉梭菌(Faecalibacterium prauznitzii)降低,加氏乳杆菌(Lactobacillus gasseri)、变形链球菌(Streptococcus mutans)、大肠埃希氏菌(Escherichia coli)增多[8-9]。肠道菌群失调参与了T2DM的发病,可引发机体慢性炎性反应、能量代谢失衡、免疫力下降等一系列问题,进而导致代谢失调、胰岛素抵抗,最终可促使T2DM的发生[10-12]。由于糖尿病长期处于高血糖状态,会引起氧化应激的增加,脂质、蛋白质功能与结构的改变,可导致过氧化反应及糖氧化反应,继而诱发糖尿病心血管并发症。大量研究证明,T2DM会增加患者的冠心病、脑卒中、缺血性心脏病等心脑血管疾病的发生率[13-14]。本研究通过对T2DM患者、糖尿病心血管并发症患者和健康对照人群粪便中肠道菌群结构、丰度及物种多样性的比较,以及肝肾功能、血脂、空腹血糖、胰岛素、超敏C反应蛋白和糖化血红蛋白等指标检测,以分析肠道菌群与血糖、血脂等指标之间的关联,探讨肠道菌群在T2DM、糖尿病心血管疾病发生发展中的可能作用,为通过调节患者肠道菌群构成,控制T2DM和糖尿病心血管并发症的发生发展提供理论依据。
1 材料和方法 1.1 研究对象选取2017年12月11日至2018年9月30日期间,在北京协和医院内分泌科就诊的健康人(无糖尿病和心血管疾病) 251人,记为D1组,糖尿病心血管并发症(2型糖尿病病史5年以上,有明确诊断的心血管疾病) 160人,记为D3组,T2DM患者(T2DM病史5年以上,无心血管疾病) 295人,记为D5组。纳入标准:(1)年龄35–70岁;(2)最近一个月未服用抗生素;(3)目前无急慢性胃肠疾病;(4)无肺结核、病毒性肝炎、艾滋病等感染性疾病史;(5)无肝、肾功能衰竭;(6)无精神疾病史。此项研究通过医院伦理委员会批准,所有纳入的研究对象均签署知情同意书。
1.2 血液样本采集随机抽取,D1组30人,D3组30人,D5组40人,共计100人作为研究对象。检测前禁食8 h。肘部静脉采血(糖化血红蛋白1 mL,其余指标2 mL),样本编号分组。3500 r/min离心15 min制备血清,分装,500 μL为一个单元,–80 ℃冰箱中冷冻备用待测。使用罗氏cobas c501全自动生化分析系统检测血清生化指标,西门子ADVIA Centaur XP全自动免疫分析系统检测血清空腹胰岛素。高效液相色谱法检测糖化血红蛋白。试剂盒购自德国罗氏和西门子公司,严格按说明书进行操作。
1.3 粪便样本DNA提取和meta测序 1.3.1 粪便样本采集: 在无菌采便袋中采集研究对象的新鲜粪便(不少于2勺),置于无菌采样管中送至实验室,–80 ℃保存待检。 1.3.2 基因组DNA的提取、PCR扩增及高通量测序: 粪便样品中的DNA提取采用的是PSP® Spin Stool DNA Plus Kit,每个样本取200 mg左右粪便,实验流程参照试剂盒说明书。琼脂糖凝胶电泳(AGE)分析DNA的纯度和完整性,Nanodrop (NanoDrop ND1000,美国)检测DNA的纯度,Qubit对DNA浓度进行精确定量。采用华睿康二代测序DNA文库构建试剂盒(Illumina)来PCR扩增,引物使用了正向引物(5′-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT-3′)和反向引物(5′-GATCGGAAGAGCACACGTCTGAACTCCAGTCAC(INDEX)ATCTCGTATGCCGTCTTCTGCTTG-3′)。PCR反应体系:2×HiFi PCR Mix 25 μL,Ligation DNA 25 μL,PCR Primer Mix 5 μL,无菌双蒸水补齐到50 μL。PCR反应条件:98 ℃ 2 min;98 ℃ 20 s,65℃ 30 s,72 ℃ 30 s,10个循环;72 ℃ 5 min;4 ℃保存。测序使用Illumina Hi Seq 2500 (美国Illumina公司)平台,测序工作在中国科学院微生物研究所生物计算平台完成,平均测序量14.6G±3.73。 1.4 生物信息学分析和统计学方法采用SoapAligner软件,过滤掉可能来源于宿主的reads,得到Clean Data。使用metaphlan2软件分析,获得不同分类层级的物种丰度表,再利用R语言对物种注释结果进行可视化展示。采用SPSS 21.0统计软件进行数据分析,计量资料用均数±标准差表示,组间均数比较采用单因素方差分析,相关性分析采用Spearman相关,以P < 0.05为差异有统计学意义。
2 结果和分析 2.1 糖尿病和糖尿病心血管并发症对血清生化指标的影响各组血清生化指标数据见表 1。与健康对照组比较,糖尿病心血管并发症组和T2DM组血清丙氨酸氨基转移酶、碱性磷酸酶、甘油三酯、空腹血糖、胰岛素、糖化血红蛋白指标显著升高(P < 0.05);糖尿病心血管并发症组血清尿素氮、尿酸值显著高于健康对照组(P < 0.05),说明蛋白质和糖代谢异常。T2DM组血清低密度脂蛋白胆固醇、载脂蛋白-B、超敏C反应蛋白显著高于健康对照组(P < 0.05),T2DM组血清总胆固醇、低密度脂蛋白胆固醇、载脂蛋白-B、超敏C反应蛋白显著高于糖尿病心血管并发症组,说明糖尿病和糖尿病心血管并发症患者存在明显的血脂代谢异常。
| Groups | D1 | D3 | D5 |
| Alanine aminotransferase, ALT/(U/L) | 14.96±6.89a | 21.73±16.26b | 21.84±10.01b |
| Aspertate aminotransferase, AST/(U/L) | 18.87±6.60 | 20.32±10.60 | 20.89±7.64 |
| Alkaline Phosphatase, ALP/(U/L) | 56.56±12.86a | 68.56±25.56b | 72.95±24.20b |
| Albumin, ALB/(g/L) | 42.08±2.03 | 43.18±2.80 | 48.28±3.26 |
| Urea Nitrogen, UN/(mmol/L) | 4.32±1.23a | 5.27±1.84b | 4.80±0.97ab |
| Creatinine, CREA/(μmol/L) | 55.03±15.18 | 57.03±14.95 | 58.39±15.78 |
| Uric Acid, UA/(μmol/L) | 267.32±45.62a | 316.20±52.79b | 284.71±69.94a |
| Total Cholesterol, TC/(mmol/L) | 4.47±0.46ab | 4.24±1.05a | 4.86±1.02b |
| Triglyceride, TG/(mmol/L) | 0.94±0.25a | 1.49±0.74b | 1.56±0.96b |
| High-Density Lipoprotein Cholesterol, HDL-C/(mmol/L) | 1.24±0.24 | 1.18±0.22 | 1.18±0.24 |
| Low Density Lipoprotein cholesterol, LDL-C/(mmol/L) | 2.61±0.38a | 2.53±0.91a | 3.04±0.91b |
| Apolipoprotein-A1, APOA1/(g/L) | 1.39±0.18 | 1.35±0.21 | 1.43±0.28 |
| Apolipoprotein-B, APOB/(g/L) | 0.72±0.09a | 0.73±0.21a | 0.89±0.25b |
| Fasting blood glucose, FBG/(mmol/L) | 4.72±1.51a | 8.30±1.65b | 8.56±0.63b |
| Insulinum, Ins/(pmol/L) | 44.67±24.84a | 88.97±49.00b | 88.42±45.38b |
| Glycated hemoglobin, HbA1c/% | 5.25±0.28a | 7.43±0.93b | 7.74±0.98b |
| High-sensitivity C-reactive protein, hsCRP/(mg/L) | 0.93±0.88a | 1.10±0.99a | 2.40±1.86b |
| Row data marked without the same superscripts differ significantly (P < 0.05). The same as follows. | |||
2.2 物种水平上α-多样性组间比较
利用QIIME软件计算Alpha多样性,反映单个样本微生物群落的丰度和多样性。计算Chaol指数(反映菌群丰度)和Shannon Wiener指数(评估样品中微生物多样性)。结果表明,D1组Shannon Wiener指数显著高于D3组和D5组,D3组和D5组之间无统计学差异,说明三组之间肠道微生物物种总数没有显著差异,但健康对照组肠道微生物多样性显著高于糖尿病组和糖尿病心血管病组(图 1)。
|
| 图 1 物种水平上α-多样性组间比较 Figure 1 The α-diversity comparison at species level. |
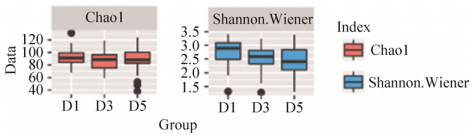
2.3 微生物种群组成及比较 2.3.1 三组菌群在门水平上的构成: 三组样本共包含13个门:绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、子囊菌门(Ascomycota)、异常球菌-栖热菌门(Deinococcus Thermus)、Candidatus Saccharibacteria菌门、广古菌门(Euryarchaeota)、梭杆菌门(Fusobacteria)、互养菌门(Synergistetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)(图 2)。所有样本中的优势菌门为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),分别在D1组中依次占53.41%、38.85%、3.22%、1.86%;在D3组中依次占46.37%、28.70%、12.77%、10.85%;D5组中依次占46.01%、30.01%、13.38%、8.86%。

|
| 图 2 门水平上粪便样本微生物种群分布 Figure 2 Microbial population distribution in fecal samples at the phylum level. The microflora structure of all samples are at the phylum classification level. The horizontal axis represents the sample number. D1: healthy control group; D3: diabetic cardiovascular complications group; D5: diabetes group. The vertical axis represents relative abundance. |
2.3.2 三组菌群在属水平上的构成: 三组100个样本中共发现138个菌属,其中,厚壁菌门55个属,变形菌门36个属,放线菌门19个属,拟杆菌门15个属,子囊菌门3个属,梭杆菌门、广古菌门各2个属,疣微菌门、互养菌门、酸杆菌门,Candidatus Saccharibacteria菌门、绿菌门、异常球菌-栖热菌门各1个属。菌群多样性最高的是厚壁菌门,有25个菌属在所有样本菌群总数中所占百分比 > 0.02%,其次是变形菌门、放线菌门和拟杆菌门,分别有21、12和10个菌属在所有样本菌群总数中所占百分比 > 0.02%(图 3)。
|
| 图 3 属水平上物种注释条形图 Figure 3 Microbial population distribution in fecal samples at generic level. The microflora structure of all samples are at the genus classification level. The horizontal axis represents the sample number. D1: healthy control group; D3: diabetic cardiovascular complications group; D5: diabetes group. The vertical axis represents relative abundance. |
D1组中大部分优势菌属来自拟杆菌门和厚壁菌门。丰度由高到低依次是:拟杆菌属(Bacteroides) 31.67%,普雷沃氏菌属(Prevotella) 9.30%、真杆菌属(Eubacterium) 8.01%、梭菌属(Faecalibacterium) 7.08%、另枝菌属(Alistipes) 6.26%、巨单胞菌属(Megamonas) 5.87%、罕见小球菌属(Subdoligranulum) 3.84%、副杆菌属(Parabacteroides) 3.62%、罗斯氏菌属(Roseburia) 3.03%、瘤胃球菌属(Ruminococcus) 2.81%、劳特氏菌属(Blautia) 1.48%、双歧杆菌属(Bifidobacterium) 1.28%、埃希氏菌属(Escherichia) 0.52%、克雷伯氏菌属(Klebsiella) 0.52%、韦荣球菌属(Veillonella) 0.49%。
D3组中大部分优势菌属来自拟杆菌门、放线菌门和变形菌门。丰度由高到低依次是:拟杆菌属24.73%、普雷沃氏菌属12.35%、双歧杆菌属9.65%、埃希氏菌属6.12%、梭菌属5.28%、真杆菌属4.76%、副杆菌属4.14%、克雷伯氏菌属4.01%、另枝菌属3.69%、韦荣球菌属2.47%、劳特氏菌属2.41%、罕见小球菌属1.42%、罗斯氏菌属1.42%、瘤胃球菌属1.22%、巨单胞菌属0.82%。
D5组中的大多数优势菌属属于拟杆菌门、变形菌门和放线菌门。丰度由高到低依次是:拟杆菌属29.54%、埃希氏菌属9.54%、双歧杆菌属8.22%、普雷沃氏菌属7.34%、真杆菌属4.96%、梭菌属4.46%、副杆菌属3.87%、另枝菌属3.76%、罕见小球菌属2.53%、劳特氏菌属2.39%、韦荣球菌属2.14%、瘤胃球菌属1.58%、罗斯氏菌属1.15%、克雷伯氏菌属0.70%、巨单胞菌属0.54%。
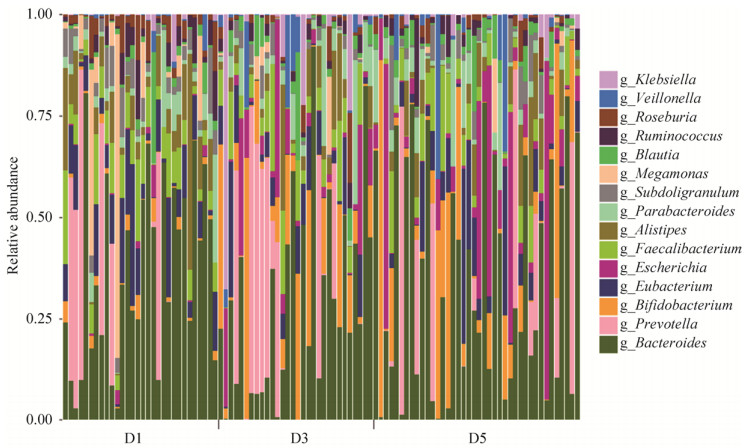
2.3.3 三组菌群在种水平上的构成: D1组中对群落结构影响较大的物种是:拟杆菌门的普氏菌(Prevotella copri)、粪便拟杆菌(Bacteroides stercoris)、单形拟杆菌(Bacteroides uniformis)、普通拟杆菌(Bacteroides vulgatus)、Alistipes putredinis、Bacteroides massiliensis、Bacteroides dorei、Bacteroides eggerthii、Bacteroides ovatus,占比34.61%,厚壁菌门的普拉梭菌(Faecalibacterium prausnitzii)、产气真杆菌(Eubacterium rectale)、Megamonas unclassified、Subdoligranulum unclassified,占比20.40% (图 4)。
|
| 图 4 种水平上物种注释条形图 Figure 4 Microbial population distribution in fecal samples at the species level. The microflora structure of all samples are at the species level. The horizontal axis represents the sample number. D1: healthy control group; D3: diabetic cardiovascular complications group; D5: diabetes group. The vertical axis represents relative abundance. |
D3组中对群落结构影响较大的物种是:拟杆菌门的普氏菌、Bacteroides ovatus、单形拟杆菌、普通拟杆菌、Bacteroides eggerthii、Alistipes putredinis、Bacteroides dorei、粪便拟杆菌,占比27.37%,厚壁菌门的普拉梭菌、产气真杆菌、Subdoligranulum unclassified,占比10.60%,放线菌门的长双歧杆菌(Bifidobacterium longum)占比5.39%,变形菌门的大肠埃希菌(Escherichia coli),占比4.58%。
D5组中对群落结构影响较大的物种是:拟杆菌门的粪便拟杆菌、普氏菌、普通拟杆菌、单形拟杆菌、Alistipes putredinis、Bacteroides ovatus,占比27.99%,厚壁菌门的普拉梭菌、产气真杆菌、Subdoligranulum unclassified,占比11.35%,变形菌门的大肠埃希菌占比7.70%,放线菌门的长双歧杆菌,占比4.79% (图 4)。
2.3.4 PCoA分析: 在属层面上,健康对照组和糖尿病心血管并发症患者组(P=0.002,R2=6.2%)、健康对照组和糖尿病患者组(P=0.004,R2=4.9%)具有显著差异,而糖尿病心血管并发症患者组和糖尿病患者组之间差异不显著(P=0.781,R2=0.9%) (图 5);在种层面上,健康对照组和糖尿病心血管并发症患者组(P < 0.001,R2=5.5%)、健康对照组和糖尿病患者组(P < 0.001,R2=4.5%)具有显著差异,而糖尿病心血管并发症患者组和糖尿病患者组之间差异不显著(P=0.309,R2=1.7%)(图 6)。
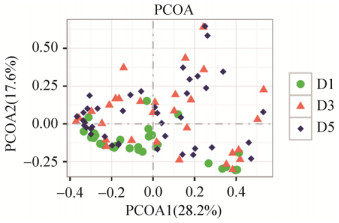
|
| 图 5 属层面上β多样性组间比较 Figure 5 Comparison of beta diversity among different groups at generic level. D1: healthy control group; D3: diabetic cardiovascular complications group; D5: diabetes group. |
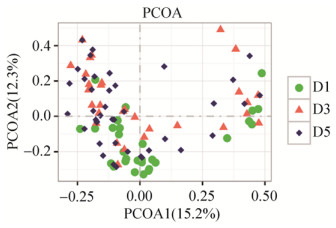
|
| 图 6 种层面上β多样性组间比较 Figure 6 Comparison of beta layer diversity among different groups at species level. D1: healthy control group; D3: diabetic cardiovascular complications group; D5: diabetes group. |
2.3.5 肠道菌群构成差异分析: 三组样本间肠道菌群显著性差异,在门水平上,厚壁菌门、变形菌门和放线菌门在三组存在显著差异。厚壁菌门在健康对照组、糖尿病心血管并发症组和T2DM组中丰度分别为(45.14±21.79)、(29.82±13.46)和(33.12±16.93),在T2DM组和糖尿病心血管并发症患者组的肠道菌群中丰度显著降低(P < 0.05);变形菌门、放线菌门在糖尿病患者和糖尿病心血管并发症患者肠道菌群中的丰度相比于健康人群显著增高(P < 0.05)。
在属水平上,与健康对照组相比,T2DM组、糖尿病心血管并发症患者组中,放线菌门双歧杆菌属的丰度显著升高,厚壁菌门的真杆菌属、巨单胞菌属、瘤胃球菌属、罗氏菌属和罕见小球菌属的丰度显著降低,变形菌门的埃希氏菌属的丰度显著升高(P < 0.05)。
在种水平上,T2DM组、糖尿病心血管并发症患者组中,厚壁菌门罕见小球菌属的Subdoligranulum unclassified菌、厚壁菌门巨单胞菌属Megamonas unclassified菌、拟杆菌门拟杆菌属的Bacteroides massiliensis菌,丰度与健康对照组相比显著降低(P < 0.05);放线菌门双歧杆菌属的长双歧杆菌、变形菌门埃希氏菌属的大肠埃希氏菌,丰度显著高于健康对照组(P < 0.05)。与健康对照组相比,糖尿病心血管并发症患者组中拟杆菌门拟杆菌属粪便拟杆菌的丰度显著降低(P < 0.05),而T2DM组粪便拟杆菌的丰度却显著升高(P < 0.05)(表 2)。
| Phylum | Genus | Species | Relative abundance/% | D3 compared with D1 | D5 compared with D1 | ||
| D1 | D3 | D5 | |||||
| Proteobacteria | / | / | 3.22 | 12.77 | 13.38 | ↑ | ↑ |
| Actinobacteria | / | / | 1.86 | 10.85 | 8.86 | ↑ | ↑ |
| Firmicutes | / | / | 38.85 | 28.70 | 30.01 | ↓ | ↓ |
| Actinobacteri | Bifidobacterium | / | 1.28 | 9.65 | 8.22 | ↑ | ↑ |
| Firmicutes | Subdoligranulum | / | 3.84 | 1.42 | 2.53 | ↓ | ↓ |
| Firmicutes | Megamonas | / | 5.87 | 0.82 | 0.54 | ↓ | ↓ |
| Firmicutes | Ruminococcus | / | 2.81 | 1.22 | 1.58 | ↓ | ↓ |
| Firmicutes | Roseburia | / | 3.03 | 1.42 | 1.15 | ↓ | ↓ |
| Firmicutes | Eubacterium | / | 8.01 | 4.76 | 4.96 | ↓ | ↓ |
| Proteobacteria | Escherichia | / | 0.52 | 6.12 | 9.54 | ↑ | ↑ |
| Firmicutes | Subdoligranulum | Subdoligranulum unclassified | 3.76 | 1.41 | 2.51 | ↓ | ↓ |
| Firmicutes | Megamonas | Megamonas unclassified | 4.21 | 0.66 | 0.35 | ↓ | ↓ |
| Bacteroidetes | Bacteroides | Bacteroides stercoris | 4.56 | 1.48 | 8.37 | ↓ | ↑ |
| Bacteroidetes | Bacteroides | Bacteroides massiliensis | 3.06 | 0.80 | 1.38 | ↓ | ↓ |
| Actinobacteri | Bifidobacterium | Bifidobacterium longum | 0.56 | 5.39 | 4.79 | ↑ | ↑ |
| Proteobacteria | Escherichia | Escherichia coli | 0.41 | 4.58 | 7.70 | ↑ | ↑ |
2.4 肠道菌群和血液指标的关联性分析
空腹血糖和黏膜乳杆菌(Lactobacillus mucosae)、大肠埃希氏菌(Escherichia coli)、脆弱拟杆菌(Bacteroides fragilis)呈正相关,细枝真杆菌(Eubacterium ramulus)、Roseburia inulinivorans、罗斯氏菌(Roseburia hominis)、挑剔真杆菌(Eubacterium eligens)、伶俐瘤胃球菌(Ruminococcus callidus)呈负相关;低密度脂蛋白胆固醇与嵴链球菌(Streptococcus cristatus)呈正相关,与Lachnospiraceae bacterium_6_1_63FAA和淀粉乳杆菌(Lactobacillus amylovorus)呈负相关;总胆固醇与血链球菌(Streptococcus sanguinis)呈正相关(P < 0.05)(图 7)。
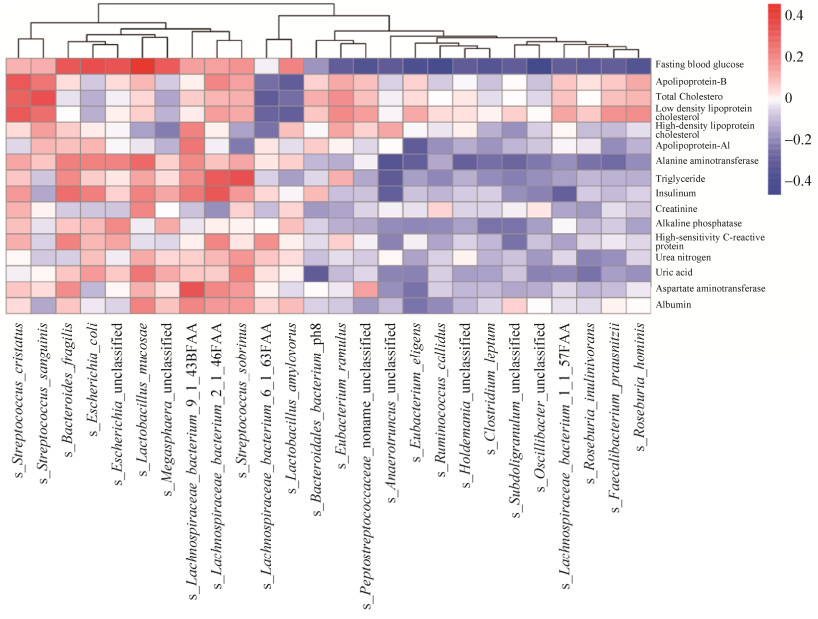
|
| 图 7 肠道菌群和血液指标的关联性分析 Figure 7 The analysis of correlation between intestinal flora and blood parameters. |
3 讨论
本研究通过对T2DM患者、糖尿病心血管并发症患者和健康对照人群粪便中肠道菌群结构、丰度及物种多样性的比较,发现T2DM患者组、糖尿病心血管并发症患者组和健康对照组人群在肠道菌群的多样性上均存在显著差异。T2DM患者组、糖尿病心血管并发症患者组的肠道菌群多样性明显降低,与健康人群相比结构失衡。
从门水平上,所有样本中的优势菌门为拟杆菌门、厚壁菌门、变形菌门和放线菌门。但健康对照组中大部分优势菌属来自拟杆菌门和厚壁菌门,而糖尿病心血管并发症患者组和T2DM患者组中大部分优势菌属则来自拟杆菌门、变形菌门和放线菌门。Larsen等采用实时定量PCR技术对36位受试者的粪便细菌组成进行了研究,与健康对照组相比,糖尿病患者肠道内厚壁菌门和厚壁菌门梭菌纲的比例明显下降;变形菌门比例明显上升,且与血浆葡萄糖浓度呈正相关;拟杆菌门比例上升,厚壁菌门与拟杆菌门比值和糖耐量减低呈负相关;放线菌门、疣微菌门无明显差异。本研究结果发现,与健康对照组相比较,糖尿病心血管并发症患者组和T2DM患者组中,厚壁菌门的比例明显下降,放线菌门和变形菌门的比例明显上升,与Larsen等的研究结果一致[15],提示肠道菌群结构与丰度的变化在T2DM的发生发展过程中起重要作用。
在3组所有样本中,拟杆菌门下的菌属丰度均处于最高水平,厚壁菌门下菌属的菌群多样性最高,有25个菌属在所有样本菌群总数中所占百分比 > 0.02%。其中,拟杆菌门的拟杆菌属、普雷沃氏菌属、另枝菌属和副杆菌属,厚壁菌门的真杆菌属、巨单胞菌属、梭菌属、罕见小球菌属、罗斯氏菌属、瘤胃球菌属、劳特氏菌属和韦荣球菌属,放线菌门的双歧杆菌属,变形菌门的埃希氏菌属和克雷伯氏菌属,在所有样本中均有检出,但无论在组内还是组间的个体丰度仍存在明显差异[16]。
从种的水平看,与健康对照组相比较,丰度显著升高的有放线菌门双歧杆菌属的长双歧杆菌、变形菌门埃希氏菌属大肠埃希氏菌(P˂0.05),丰度显著下降的有厚壁菌门罕见小球菌属的Subdoligranulum unclassified和巨单胞菌属的Megamonas unclassified、拟杆菌门拟杆菌属的Bacteroides massiliensis菌。拟杆菌门拟杆菌属粪便拟杆菌,T2DM患者组丰度显著高于健康对照组,而糖尿病心血管并发症患者组丰度则显著低于健康对照组。T2DM患者和糖尿病心血管并发症患者的肠道菌群相比健康人群出现结构和丰度紊乱,维持肠道正常代谢、免疫的有益菌如真杆菌属细菌丰度减少,常见的条件致病菌如大肠埃希氏菌丰度显著增高,林涵等的研究也取得了上述相似的结果[17-19]。真杆菌属细菌为产丁酸菌,丁酸可促进肠黏膜修复及其功能恢复,并且能抑制炎症细胞因子的形成,从而发挥抗炎作用[7]。而变形菌门细菌丰度的异常增多,致使脂多糖(LPS)产生加剧,慢性代谢性内毒素血症可导致肥胖、糖尿病和胰岛素抵抗[20-21]。
与健康对照组比较,糖尿病心血管并发症组和T2DM组血清丙氨酸氨基转移酶、碱性磷酸酶、甘油三酯、空腹血糖、糖化血红蛋白、胰岛素指标显著升高(P < 0.05),糖尿病心血管并发症组血清尿素氮、尿酸值显著高于健康对照组(P < 0.05),T2DM组血清低密度脂蛋白胆固醇、载脂蛋白-B、超敏C反应蛋白显著高于健康对照组(P < 0.05)。说明T2DM和糖尿病心血管并发症患者存在明显的蛋白质、糖和血脂代谢异常,这与陈严等的研究结果一致[22-24]。相关性研究发现,空腹血糖在种的水平上,与黏膜乳杆菌、大肠埃希氏菌、脆弱拟杆菌呈正相关,细枝真杆菌、Roseburia inulinivorans、Roseburia hominis、挑剔真杆菌、伶俐瘤胃球菌呈负相关;低密度脂蛋白胆固醇与嵴链球菌呈负相关,与Lachnospiraceae bacterium_6_1_63FAA和淀粉乳杆菌呈负相关;总胆固醇与血链球菌呈正相关。
已有临床研究发现,糖尿病患者的肠道菌群出现肠杆菌科细菌等有害菌的数量增加,而双歧杆菌等有益菌的数量下降[25]。双歧杆菌作为肠道共生菌群起着调节肠道微生态的有益作用,同时其产生的代谢产物也发挥着抑菌、调节免疫等重要益生功能[26-27],但本研究中T2DM患者组和糖尿病心血管并发症患者组双歧杆菌属含量显著高于健康对照人群,且与空腹血糖、胰岛素含量存在着显著相关关系,这可能是由于服用二甲双胍导致[28]。也有人认为,T2DM患者的机体在高血糖状态下,自身肠道菌群发生应激性改变,导致双歧杆菌属数量显著增加,以逆转机体慢性炎症反应状态,改善代谢性内毒素血症[29]。T2DM患者组和糖尿病心血管并发症患者组血清胰岛素含量显著高于健康对照组,说明患病后机体对胰岛素已经极度不敏感[30]。
综上所述,T2DM患者和糖尿病心血管并发症患者肠道菌群相比健康人群出现结构和丰度紊乱,维持肠道正常免疫和代谢的有益菌丰度减少,条件致病菌丰度显著增加,从而导致肠道免疫异常,慢性代谢性内毒素血症引起胰岛素抵抗和T2DM,进一步发展为糖尿病心血管并发症。通过益生菌与微生态制剂可能有助于肠道菌群构成和功能的恢复,但仍需更详实有力的实验数据支撑。
| [1] | Qin JJ, Li RQ, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li JH, Xu JM, Li SC, Li DF, Cao JJ, Wang B, Liang HQ, Zheng HS, Xie YL, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu HM, Yu C, Li ST, Jian M, Zhou Y, Li YR, Zhang XQ, Li SG, Qin N, Yang HM, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J, MetaHIT Consortium, Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [2] | Sonnenburg JL, Bäckhed F. Diet-microbiota interactions as moderators of human metabolism. Nature, 2016, 535(7610): 56-64. DOI:10.1038/nature18846 |
| [3] |
Wang YL, Zhang J, Su F, Ni J. Research progress on the relationship of intestinal flora and type 2 diabetes mellitus pathogenesis. Practical Journal of Medicine & Pharmacy, 2018, 35(1): 77-80.
(in Chinese) 王永磊, 张静, 苏峰, 倪军. 肠道菌群变化与2型糖尿病发病关系的研究进展. 实用医药杂志, 2018, 35(1): 77-80. |
| [4] |
Ma QL, Zhang F, Liu CQ, Wang TJ. Intestinal flora in type 2 diabetes:research progress. Chinese Journal of Microecology, 2018, 30(11): 1361-1364.
(in Chinese) 马巧灵, 张发, 刘朝芹, 王廷江. 2型糖尿病肠道菌群研究进展. 中国微生态学杂志, 2018, 30(11): 1361-1364. |
| [5] | Zhao LP. The tale of our other genome. Nature, 2010, 465(7300): 879-880. DOI:10.1038/465879a |
| [6] | Karlsson FH, Tremaroli V, Nookaew I, Bergström G, Behre CJ, Fagerberg B, Nielsen J, Bäckhed F. Gut metagenome in European women with normal, impaired and diabetic glucose control. Nature, 2013, 498(7452): 99-103. DOI:10.1038/nature12198 |
| [7] | Qin JJ, Li YR, Cai ZM, Li SH, Zhu JF, Zhang F, Liang SS, Zhang WW, Guan YL, Shen DQ, Peng YQ, Zhang DY, Jie ZY, Wu WX, Qin YW, Xue WB, Li JH, Han LC, Lu DH, Wu PX, Dai YL, Sun XJ, Li ZS, Tang AF, Zhong SL, Li XP, Chen WN, Xu R, Wang MB, Feng Q, Gong MH, Yu J, Zhang YY, Zhang M, Hansen T, Sanchez G, Raes J, Falony G, Okuda S, Almeida M, LeChatelier E, Renault P, Pons N, Batto JM, Zhang ZX, Chen H, Yang RF, Zheng WM, Li SG, Yang HM, Wang J, Ehrlich SD, Nielsen R, Pedersen O, Kristiansen K, Wang J. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 2012, 490(7418): 55-60. DOI:10.1038/nature11450 |
| [8] | Hartstra AV, Bouter KEC, Bäckhed F, Nieuwdorp M. Insights into the role of the microbiome in obesity and type 2 diabetes. Diabetes Care, 2014, 38(1): 159-165. |
| [9] | McLean MH, Dieguez Jr D, Miller LM, Young HA. Does the microbiota play a role in the pathogenesis of autoimmune diseases?. Gut, 2015, 64(2): 332-341. DOI:10.1136/gutjnl-2014-308514 |
| [10] |
Liao XF. Association of intestinal microecological environments with diabetes mellitus and the research progress. Chinese Journal of General Surgery, 2018, 27(4): 506-513.
(in Chinese) 廖孝枫. 肠道微生态与糖尿病的关系及研究进展. 中国普通外科杂志, 2018, 27(4): 506-513. |
| [11] |
Tian JX, Li M, Tong XL. Research progress on the relationship between gut microbiota and type 2 diabetes mellitus. Chinese Journal of Diabetes, 2018, 26(8): 688-691.
(in Chinese) 田佳星, 李敏, 仝小林. 肠道微生态与2型糖尿病关系的研究进展. 中国糖尿病杂志, 2018, 26(8): 688-691. DOI:10.3969/j.issn.1006-6187.2018.08.017 |
| [12] | Muñoz-Garach A, Diaz-Perdigones C, Tinahones FJ. Gut microbiota and type 2 diabetes mellitus. Endocrinología y Nutrición (English Edition), 2016, 63(10): 560-568. DOI:10.1016/j.endoen.2016.07.004 |
| [13] |
Yang C, Deng ZH, Jin LY, Zhang ZY, Chen GH, Si YL. Process and mechanism of mesenchymal stem cells in the treatment of diabetic cardiomyopathy. Progress in Modern Biomedicine, 2016, 16(25): 4992-4996.
(in Chinese) 杨晨, 邓子辉, 靳丽媛, 张泽宇, 陈光辉, 司艺玲. 间充质干细胞治疗糖尿病心脏病研究进展及其机制. 现代生物医学进展, 2016, 16(25): 4992-4996. |
| [14] | Miele L, Giorgio V, Alberelli MA, de Candia E, Gasbarrini A, Grieco A. Impact of gut microbiota on obesity, diabetes, and cardiovascular disease risk. Current Cardiology Reports, 2015, 17(12): 120. DOI:10.1007/s11886-015-0671-z |
| [15] | Larsen N, Vogensen FK, van den Berg FWJ, Nielsen DS, Andreasen AS, Pedersen BK, Al-Soud WA, Sørensen SJ, Hansen LH, Jakobsen M. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PLoS One, 2010, 5(2): e9085. DOI:10.1371/journal.pone.0009085 |
| [16] |
Zhang Q, Zhou ZK, Ren XC, Wang XF. Comparision of faecal microbiota in rats with type 2 diabetes and non-diabetic rats using miseq high-throughput sequencing. Journal of Chinese Institute of Food Science and Technology, 2017, 17(6): 232-239.
(in Chinese) 张芹, 周中凯, 任晓冲, 王晓凤. 高通量测序技术研究糖尿病大鼠与正常大鼠粪便菌群的结构差异. 中国食品学报, 2017, 17(6): 232-239. |
| [17] | 林涵.基于临床病例的2型糖尿病与肠道核心菌群相关性分析.中央民族大学硕士学位论文, 2017. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201702&filename=1017168073.nh&v=MjM3MTdJUjhlWDFMdXhZUzdEaDFUM3FUcldNMUZyQ1VSTE9mYnVadEZ5emxVNzdBVkYyNkdiSytGdEhMckpFYlA= |
| [18] |
Zhu YX. Changes of intestinal flora and gdf-15 levels in newly diagnosed type 2 diabetes mellitus patients. Chinese Journal of Modern Drug Application, 2017, 11(16): 39-40.
(in Chinese) 朱雅欣. 新诊断2型糖尿病患者肠道菌群及GDF-15水平的变化分析. 中国现代药物应用, 2017, 11(16): 39-40. |
| [19] | 曲玲.干酪乳杆菌发酵乳重塑大鼠肠道菌群结构改善Ⅱ型糖尿病.哈尔滨工业大学硕士学位论文, 2018. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201901&filename=1018893251.nh&v=MTM3MjhidVp0Rnl6bFU3M0tWRjI2RnJ1eEhkUEpycEViUElSOGVYMUx1eFlTN0RoMVQzcVRyV00xRnJDVVJMT2Y= |
| [20] | Cani PD, Delzenne NM. The role of the gut microbiota in energy metabolism and metabolic disease. Current Pharmaceutical Design, 2009, 15(13): 1546-1558. DOI:10.2174/138161209788168164 |
| [21] | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti JF, Gibson GR, Casteilla L, Delzenne NM, Alessi MC, Burcelin R. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes, 2007, 56(7): 1761-1772. DOI:10.2337/db06-1491 |
| [22] |
Chen Y, Lv J, Dong AA, Chen J. The role of apolipoprotein ApoB/ApoA1 ratio in the assessment of coronary artery lesion in patients with diabetes and coronary heart disease. Prevention and Treatment of Cardio-Cerebral-Vascular Disease, 2018, 18(5): 376-378, 384.
(in Chinese) 陈严, 吕晶, 董艾艾, 陈进. 载脂蛋白B/载脂蛋白A1比值在糖尿病合并冠心病患者冠状动脉病变评估中的作用. 心脑血管病防治, 2018, 18(5): 376-378, 384. DOI:10.3969/j.issn.1009-816x.2018.05.006 |
| [23] |
Huang XQ, Chen XH. Clinical significance of serum lipoprotein (a) detection in patients with type 2 diabetic nephropathy. Chinese Journal of Prevention and Control of Chronic Diseases, 2018, 26(8): 604-606.
(in Chinese) 黄晓琴, 陈秀花. 2型糖尿病肾病患者血清脂蛋白(a)检测的临床意义. 中国慢性病预防与控制, 2018, 26(8): 604-606. |
| [24] |
Liu WH, Bai JE, Zhang H. Relations of serum alanine aminotransferase and gamma-glutamyltransferase with type 2 diabetes mellitus. Laboratory Medicine, 2018, 33(1): 20-25.
(in Chinese) 刘文慧, 白金娥, 张慧. 血清丙氨酸氨基转移酶及γ-谷氨酰基转移酶水平与2型糖尿病的关系. 检验医学, 2018, 33(1): 20-25. |
| [25] | Musso G, Gambino R, Cassader M. Obesity, diabetes, and gut microbiota:the hygiene hypothesis expanded?. Diabetes Care, 2010, 33(10): 2277-2284. DOI:10.2337/dc10-0556 |
| [26] | Hur KY, Lee MS. Gut microbiota and metabolic disorders. Diabetes & Metabolism Journal, 2015, 39(3): 198-203. |
| [27] |
Sun Q, Wan XY. Research advances on the alleviation of hyperlipidemia and hyperglycemia by probiotics. Journal of Henan University of Technology (Natural Science Edition), 2018, 39(6): 125-132.
(in Chinese) 孙倩, 万向元. 益生菌缓解高血脂和高血糖的研究进展. 河南工业大学学报(自然科学版), 2018, 39(6): 125-132. DOI:10.3969/j.issn.1673-2383.2018.06.023 |
| [28] | Wu H, Esteve E, Tremaroli V, Khan MT, Caesar R, Mannerås-Holm L, Ståhlman M, Olsson LM, Serino M, Planas-Fèlix M, Xifra G, Mercader JM, Torrents D, Burcelin R, Ricart W, Perkins R, Fernàndez-Real JM, Bäckhed F. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug. Nature Medicine, 2017, 23(7): 850-858. DOI:10.1038/nm.4345 |
| [29] |
Jiang ML, Xu AG. The intestinal microbiota in type 2 diabetes patients. Guangdong Medical Journal, 2013, 34(13): 2006-2010.
(in Chinese) 江美玲, 许岸高. 2型糖尿患者肠道菌群特征分析. 广东医学, 2013, 34(13): 2006-2010. DOI:10.3969/j.issn.1001-9448.2013.13.022 |
| [30] |
Zhang Y, Li J, Hou LN, Chen ZH. Diabetes mellitus and insulin resistance. Journal of Chengde Medical College, 2013, 30(4): 335-338.
(in Chinese) 张艳, 李剑, 侯丽娜, 陈志宏. 糖尿病与胰岛素抵抗. 承德医学院学报, 2013, 30(4): 335-338. DOI:10.3969/j.issn.1004-6879.2013.04.033 |
 2019, Vol. 58
2019, Vol. 58