中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张川, 张悦, 丁啸虎, 李中媛, 宋亚囝, 罗学刚. 2019
- Chuan Zhang, Yue Zhang, Xiaohu Ding, Zhongyuan Li, Yajian Song, Xuegang Luo. 2019
- 多形拟杆菌肝素酶Ⅰ的SUMO融合表达及酶学特性分析
- SUMO-Fused expression and characterization of Heparinase Ⅰ from Bacteroides thetaiotaomicron
- 微生物学报, 59(7): 1318-1330
- Acta Microbiologica Sinica, 59(7): 1318-1330
-
文章历史
- 收稿日期:2018-09-05
- 修回日期:2018-11-11
- 网络出版日期:2018-11-30
2. 天津科技大学, 生物工程国家级实验教学示范中心, 天津 300457
2. National Demonstration Center for Experimental Bioengineering Education, Tianjin University of Science and Technology, Tianjin 300457, China
肝素(Heprain)是一种特异性质、多分散的混合硫酸化多糖,广泛分布于哺乳动物组织中,以共价键形式和蛋白质结合。目前商业肝素主要是从牛肺和猪小肠黏膜中提取[1],结构复杂且具有多种重要的生物学功能,一般在临床上用于血栓、心血管等疾病的治疗。低分子量肝素(Low molecular heparin,LMWH)是肝素通过某些物理化学方法裂解而产生的一小段肝素,与蛋白质或细胞结合的能力有所下降,但抗凝活性显著增加。与正常肝素相比,低分子肝素可降低抗因子IIa的活性,极大程度地减小了出血的危险性。目前,制备低分子肝素有物理、化学、生物和合成方法。其中,生物酶解法由于具备条件温和、选择性强、污染小等优点,现已成为一种新兴的方法。
肝素酶Ⅰ (Heparinase Ⅰ,L12534.1)是一类能够裂解肝素类结构物质、制备低分子肝素的多糖裂解酶,来源比较广泛,主要存在于原核生物肝素黄杆菌中,还包括一些拟杆菌和芽孢杆菌等[2-4]。肝素酶Ⅰ首先发现于肝素黄杆菌(Pedobacter heparinus)[5-6],可选择性地剪切硫酸化肝素聚糖中葡萄糖胺和糖醛酸之间α(1-4)糖苷键[7]。根据肝素酶Ⅰ的各个来源的氨基酸序列以及蛋白结构特点,肝素酶Ⅰ被划分为糖苷水解酶PLs的13家族。目前肝素酶Ⅰ主要应用于低分子肝素的制备、体外循环中肝素的消除、肝素确切结构的解析、以及在体外诊断试剂方面用于凝血试验和血小板实验[8-13]。
对于肝素酶Ⅰ的基因工程表达,以大肠杆菌为宿主异源表达研究最多。但结果表明,大肠杆菌的表达容易聚集成不溶性包涵体,很难再进行复性[14-16]。此外,许多融合表达策略已被用于改善肝素酶Ⅰ的生产。例如,Kapust等[17]将肝素酶Ⅰ与GST标签在大肠杆菌中进行融合表达,从而获得高产量的可溶性产物,促进一步纯化过程;Chen等[18]将MBP蛋白和肝素酶Ⅰ进行融合表达,得到90%的可溶性目的蛋白,并且能有效降解肝素。不过,目前的研究基本上都是以肝素黄杆菌来源的肝素酶Ⅰ (Fh-HepI)为研究对象,对于其他菌属来源的肝素酶Ⅰ的融合表达报道甚少。
SUMO标签蛋白是一种小分子泛素样修饰蛋白(Small ubiquitin-likemodifier),是泛素(ubiquitin)类多肽链超家族的重要成员之一。在一级结构上,SUMO与泛素只有18%的同源性,然而两者的三级结构及其生物学功能却十分相似。SUMO蛋白的分子量大约为12 kDa,整体结构主要由α螺旋和β折叠组成。SUMO标签蛋白除了具有一般传统融合标签的特点外,还具有分子量小、促进折叠能力强、提高目的蛋白的比酶活以及促溶等优点。Shaghayegh等[19]将成熟α-fuffin与SUMO标签进行融合表达,可以有效提高重组蛋白的溶解性;Li等[20]使用SUMO-Tag表达载体,对天然蛋白进行表达,提高了重组酶的活力、可溶性以及稳定性;Zhang等[21]通过将SAC与SUMO进行融合,成功构建重组酶SUMO-SAC的表达载体,提高了目标蛋白的溶解性及表达水平;Hartwig等[22]通过使用SUMO融合表达策略,实现了萜烯合成酶在大肠杆菌中的可溶性表达。因此本研究针对多形拟杆菌基因组中肝素酶Ⅰ的基因,利用分子生物学手段构建了表达载体pE-SUMO-Bt-HepI和pET-28a-Bt-HepI,并对其表达产物的比酶活、酶学性质进行了深入研究。为多形拟杆菌肝素酶Ⅰ的应用开发奠定基础。
1 材料和方法 1.1 菌种和载体菌株大肠杆菌DH5α和大肠杆菌Rosetta (DE3),保存于本实验室;pET-28a载体和pE-SUMO载体,保存于本实验室。pMD-19T载体购自宝生物工程有限公司。
1.2 主要试剂和酶DNA切胶回收试剂盒购自康为世纪生物科技有限公司(北京)、质粒小提试剂盒购自索莱宝科技有限公司(北京)、Bradford蛋白浓度定量试剂盒购自伯乐生命医学产品有限公司(USA)、肝素钠(185 USP units/mg)购自Sigma公司(USA);其他试剂均为国产分析纯。Fast Pfu DNA聚合酶、dNTPs均购自康为世纪生物科技公司(北京)、T4连接酶、限制性内切酶BamH Ⅰ、Xho Ⅰ、Nru Ⅰ、BsrG Ⅰ购自Thremo Scientific公司(USA)、PCR引物合成以及序列测序均由金唯智生物科技有限公司(苏州)完成。
1.3 多形拟杆菌肝素酶Ⅰ的基因扩增根据NCBI GenBank数据库中Bacteroides thetaiotaomicron VPI-5482编码Heparinase Ⅰ的氨基酸序列(GenBank: AAO79780.1),进行大肠杆菌的密码子优化,由基因公司合成构建pUC57-Bt-HepI质粒,使用软件Primer Premier 5设计引物,上游引物F:5′-CCGGATCCATGTTAAC CGCCCAGACC-3′,下游引物R:5′-CGACTCGAG TTAGCGCTCACTATAGCCGGCCAG-3′ (双划线的为保护碱基,单划线的为酶切位点),选用BamH Ⅰ、Xho Ⅰ作为上下游的酶切位点。提取pUC57-Bt-HepI质粒,作为模板进行PCR扩增,PCR反应条件为95 ℃ 5 min;95 ℃ 30 s,55 ℃ 50 s,72 ℃ 1.5 min,循环30次;72 ℃ 10 min。扩增产物进行1%琼脂糖凝胶电泳检测分离,DNA切胶回收。
1.4 表达载体的构建将回收的PCR产物与pET-28a和pE-SUMO质粒分别使用BamH Ⅰ、Xho Ⅰ双酶切,经琼脂糖凝胶电泳检测并回收,使用T4 DNA连接酶将酶切后的PCR产物和质粒16 ℃连接过夜,得重组质粒;再转化至大肠杆菌DH5α感受态,涂布于含有卡那霉素的LB平板培养12-16 h,分别挑取转化子进行菌落PCR验证,将正确的质粒送至测序公司,得到构建成功的重组质粒pET-28a-Bt-HepI和pE-SUMO-Bt-HepI。
1.5 重组肝素酶Ⅰ的外源表达、纯化和脱盐提取构建成功的重组表达质粒pET-28a-Bt-HepI和pE-SUMO-Bt-HepI,分别转化入E. coli Rosetta (DE3)感受态细胞。挑取单菌落于5 mL含卡那霉素(50 μg/mL)、氯霉素(34 μg/mL)的LB培养基中过夜培养,1%接种量接种于100 mL LB培养基的摇瓶中扩大培养,菌液浓度OD600约为0.6时加入IPTG至终浓度0.4 mmol/L,25 ℃诱导12 h。
诱导后的菌体,4 ℃、8000 r/min离心收集,用缓冲液(20 mmol/L Tris-HCl,200 mmol/L NaCl pH 7.4)洗涤2遍,再将其悬于40 mL缓冲液中,超声破碎细胞,12000 r/min、4 ℃离心20 min,收集上清,使用Co-NTA亲和层析进行纯化,Co柱使用10 mL的平衡缓冲液(20 mmol/L Tris-HCl,300 mmol/L NaCl pH 7.4)平衡后上样,并使用10 mL结合缓冲液(20 mmol/L Tris-HCl,300 mmol/L NaCl,5 mmol/L咪唑)冲洗除掉非特异性结合蛋白,使用3 mL洗脱缓冲液(20 mmol/L Tris-HCl,300 mmol/L NaCl,150 mmol/L咪唑)洗脱重组目的蛋白,收集洗脱液即为纯化后的重组酶。使用PD-10预装脱盐柱对纯化后的酶进行脱盐处理。使用25 mL的平衡缓冲液(20 mmol/L Tris-HCl,200 mmol/L NaCl pH 7.4)平衡后上样2.5 mL,3.5 mL缓冲液洗脱,从上样开始收集2.5-6.0 mL的洗脱液为脱盐后的酶液。
将表达、纯化和脱盐后的蛋白进行SDS-PAGE,分析重组蛋白的表达水平、纯化和脱盐情况以及分子量,浓缩胶电压为80 V,分离胶电压为120 V。蛋白含量的测定使用Bradford法,具体操作参照试剂盒说明书。
1.6 酶活力的测定以肝素钠为底物测定肝素酶Ⅰ活性,一个酶活力单位(1 IU)指在最适条件下,1 min内产生1 μmol的△4, 5不饱和糖醛酸所需的酶量。反应体系为:1.5 mL的Ep管中加入100 μL的底物缓冲液(50 mmol/L醋酸钠,5 mmol/L醋酸钙,5 mmol/L肝素钠),金属浴中40 ℃恒温孵育10 min,加入适当稀释纯化脱盐后的酶液10 μL,反应10 min,立即加入0.06 mol/L盐酸1 mL终止反应。在12000 r/min条件下离心5 min,取上清液测定其在232 nm的吸光值[23]。
1.7 重组肝素酶Ⅰ的酶学特性研究 1.7.1 重组酶的最适pH及pH稳定性测定: 在37 ℃,不同pH 4-13条件下测定重组肝素酶Ⅰ的酶活,得出其最适pH;在4 ℃下把纯化脱盐后的酶在不同pH值(2-12)的缓冲液中保存2 h,测定剩余酶活。 1.7.2 重组酶的最适温度及温度稳定性测定: 在最适pH,不同温度的条件下,测定重组肝素酶Ⅰ的酶活,得出其最适反应温度;最适pH条件下把纯化脱盐后的酶在不同温度(30、40、50、60 ℃)下孵育一定时间(1、2、10 min),测定剩余酶活。并且在30 ℃和40 ℃下测定了更长时间的稳定性(3 h)。 1.7.3 二价金属离子对酶活的影响: 二价金属离子对重组肝素酶Ⅰ酶活影响的分析过程:在上述标准酶活缓冲液中,分别加入5 mmol/L的二价金属离子(MnSO4,MgCl2,CaCl2,CuCl2,ZnSO4,FeSO4),标准条件下(最适pH、温度,反应10 min)进行酶活分析。把筛选出来的Ca2+和Mg2+,设置一系列不同浓度(0.5、1.0、5.0、10.0、15.0、50.0、100.0 mmol/L)进行最适离子浓度的研究。将最优的Ca2+和Mg2+的浓度复配测定其酶活。将重组酶分别在最优的Ca2+和Mg2+的浓度下孵育饱和后,再添加不同浓度的另一个离子测定其酶活。进而深入研究金属离子对重组酶活性的影响。 2 结果和分析 2.1 重组酶表达载体的构建对Bt-HepI基因进行大肠杆菌的密码子优化,构建2个表达载体质粒pET-28a-Bt-HepI和pE-SUMO-Bt-HepI如图 1-A所示。质粒通过Nru Ⅰ、BsrG Ⅰ双酶切,如图 1-B所示,分别得到4288 bp、2178 bp和4512 bp、2182 bp两条条带,符合预期,将测序正确的转化子用于下一步试验。

|
| 图 1 肝素酶Ⅰ表达载体的构建 Figure 1 Construction of recombinant expression vector for HepI. A: Schematic representation of plasmids for pET-28a-Bt-HepI and pE-SUMO-Bt-HepI; B: Enzyme digestion analysis using Nru Ⅰ, BsrG Ⅰ; M: Marker. |
2.2 重组酶的表达、纯化和脱盐
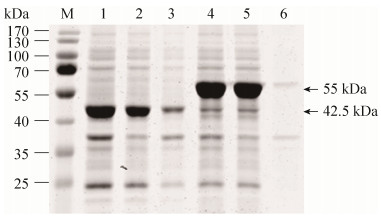
重组大肠杆菌在25 ℃下,经IPTG诱导12 h,超声裂解菌体,将得到的超声裂解液上清、Co-NTA纯化后的目的蛋白、PD-10脱盐柱脱盐后的目的蛋白进行SDS-PAGE分析,结果如图 2所示。可以发现IPTG诱导后Bt-HepI和SUMO-Bt- HepI分子量分别是42.5 kDa和55 kDa左右,分子量与理论值相一致。由图可明显看到纯化后的目的蛋白可以达到胶纯的效果,并且脱盐的效果也很理想。将分别得到的Bt-HepI和SUMO-Bt- HepI的总蛋白、可溶性蛋白以及不可溶部分进行SDS-PAGE分析,结果如图 3所示。可以发现与Bt-HepI相比,融合SUMO标签后极大地促进了目的蛋白的溶解性,使95%以上的目的蛋白以可溶性形式表达。

|
| 图 2 重组酶的SDS-PAGE分析 Figure 2 SDS-PAGE of recombinant proteins of HepI. M: marker; lane 1: the expression products of pE-SUMO-Bt-HepI; lane 2: 5 mmol/L imidazole elution of SUMO-Bt-HepI; lane 3: 150 mmol/L imidazole elution of SUMO-Bt-HepI; lane 4: desalting of SUMO-Bt-HepI; lane 5: the expression products of pET-28a-Bt-HepI; lane 6: 5 mmol/L imidazole elution of Bt-HepI; lane 7: 150 mmol/L imidazole elution of Bt-HepI; lane 8: desalting of Bt-HepI. |
|
| 图 3 重组酶的可溶性表达SDS-PAGE分析 Figure 3 Soluble expression of recombinants by SDS-PAGE. M: marker; lane 1: the total protein of the expression products of pET-28a-Bt-HepI; lane 2: the soluble fractions of the expression products of pET-28a-Bt-HepI; lane 3: the insoluble fractions of the expression products of pET-28a-Bt-HepI; lane 4: the total protein of the expression products of pE-SUMO-Bt-HepI; lane 5: the soluble fractions of the expression products of pE-SUMO-Bt-HepI; lane 6: the insoluble fractions of the expression products of pE-SUMO-Bt-HepI. |
2.3 重组Bt-HepI和SUMO-Bt-HepI的比酶活分析
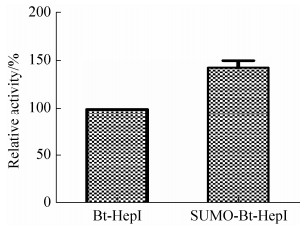
将分别转入pET-28a-Bt-HepI、pE-SUMO-Bt- HepI的重组菌进行诱导表达,表达产物Bt-HepI和SUMO-Bt-HepI纯化脱盐后在标准酶活测定条件下进行测定,图 4结果显示,与pET-28a-Bt-HepI质粒表达得到的Bt-HepI相比,SUMO融合后的SUMO-Bt-HepI的比酶活提高了48.9%。表 1结果显示融合SUMO-tag标签后,不仅提高了比酶活,而且提高了目的蛋白的产量,是原来的1.25倍。
|
| 图 4 重组产物Bt-HepI和SUMO-Bt-HepI的比酶活分析 Figure 4 Comparison of specific enzyme activities of Bt-HepI and SUMO-Bt-HepI. |
| Enzyme | Reference | TP*/ (mg/mL) |
TEA*/ (IU/mL) |
SA*/ (IU/mg) |
| Bt-HepI | This work | 0.25 | 33.50 | 133.98 |
| SUMO-Bt-HepI | This work | 0.313 | 62.44 | 199.50 |
| IF2-Fh-HepI | [24] | ND | ND | 151.00 |
| GST-Fh-HepI | [24] | ND | ND | 143.00 |
| MBP-Fh-HepI | [18] | ND | ND | 20.60 |
| MBP-Fh-HepI | [24] | ND | ND | 23.60 |
| ChBD-Fh-HepI | [25] | ND | 2.44 | ND |
| ChBD-SUMO-Fh-HepI | [25] | ND | 6.92 | ND |
| *TP means total protein; TEA means total enzyme activity; SA means specific activity. ND indicates no data. | ||||
2.4 重组表达产物的酶学特性研究 2.4.1 重组表达产物的最适pH及pH稳定性测定: 在不同的pH条件下测定Bt-HepI和SUMO-Bt-HepI的酶活,发现两者的最适pH都为9 (图 5)。融合SUMO标签后并未改变其最适pH。将这两种重组酶分别在不同pH缓冲液中4 ℃保存2 h,分别测定剩余酶活(图 6-A:SUMO-Bt- HepI;图 6-B:Bt-HepI)。

|
| 图 5 重组酶SUMO-Bt-HepI和Bt-HepI的最适pH曲线 Figure 5 Optimum pH curves of two kinds of recombinase of SUMO-Bt-HepI and Bt-HepI. |

|
| 图 6 重组酶SUMO-Bt-HepI和Bt-HepI的pH稳定性曲线 Figure 6 pH stability curves of recombinase SUMO-Bt-HepI and Bt-HepI. A: purified of recombinase SUMO-Bt-HepI; B: purified of recombinase Bt-HepI. |
从pH稳定性曲线可以看出,两种重组酶在中性附近较为稳定,在pH 5-9的缓冲液中保存2 h,两者的剩余酶活都在80%以上。在偏酸和偏碱时,SUMO-Bt-HepI的耐受性相对较好。SUMO-Bt-HepI的最佳保存pH为8,而Bt-HepI的最佳保存pH为7,可能是因为融合SUMO标签之后,目的蛋白带有更多的碱性氨基酸,使其成为弱碱性酶。在pH 12时两者几乎均失去活性。
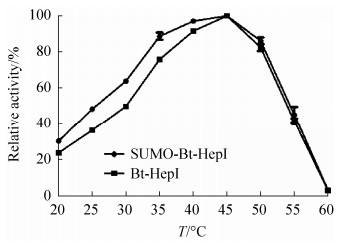
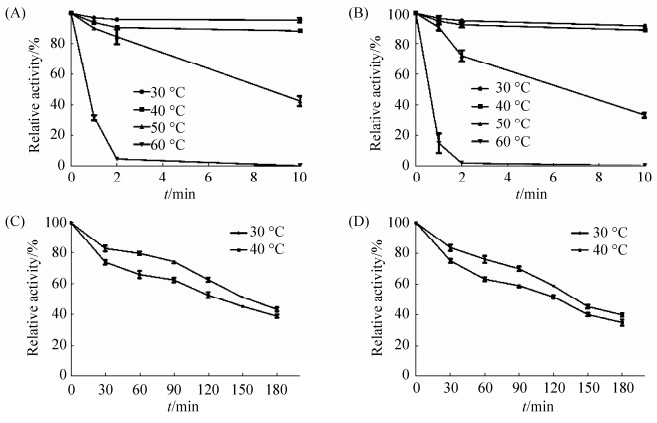
2.4.2 重组表达产物的最适温度及温度稳定性测定: 在最适pH,不同温度下测定SUMO-Bt-HepI和Bt-HepI的酶活,发现两者的最适温度均为45 ℃ (图 7)。将上述两种重组酶分别在最适pH不同温度条件孵育一定时间,测定剩余酶活(图 8-A、C:SUMO-Bt-HepI;图 8-B、 D:Bt-HepI)。
|
| 图 7 2种重组肝素酶Ⅰ的最适温度曲线 Figure 7 Optimum temperature curves of two kinds of recombine Heparinase Ⅰ. |
|
| 图 8 重组酶SUMO-Bt-HepI和Bt-HepI温度稳定性曲线 Figure 8 Thermostability curves of recombinase SUMO-Bt-HepI and Bt-HepI. A and C: purified enzyme of recombinase SUMO-Bt-HepI; B and D: purified of recombinase Bt-HepI. |
从温度稳定性曲线可以看出,SUMO-Bt-HepI和Bt-HepI对较高温度(50、60 ℃)的耐受性都比较差,在60 ℃下保温10 min后二者酶活甚至几乎完全损失,不过它们对于较低温度(30、40 ℃)的耐受性都相对较好(10 min内几乎无变化),且SUMO融合可以提高酶的耐受能力。SUMO-Bt-HepI在50 ℃下保温2 min剩余酶活约89.46%,在30 ℃和40 ℃下孵育时的半衰期分别约为180 min和150 min,而未经SUMO融合的Bt-HepI在耐受同等温度处理方面的能力则要低于SUMO-Bt-HepI,其在50 ℃下保温2 min后剩余酶活约75.75%,在30 ℃和40 ℃下孵育时的半衰期分别约为140 min和120 min。
2.4.3 金属离子对酶活的影响: 研究了不同二价金属离子对SUMO-Bt-HepI和Bt-HepI的酶活影响(图 9-A)。结果发现,Ca2+和Mg2+对二者酶活均有促进作用,Cu2+、Mn2+、Zn2+都表现出了明显的抑制作用,尤其是Cu2+和Zn2+几乎使酶失活。研究了Ca2+和Mg2+的最佳浓度(图 9-B:SUMO-Bt-HepI、图 9-C:Bt-HepI)。结果表明,2个重组酶的最佳Ca2+和Mg2+浓度均为10 mmol/L和50 mmol/L。在最佳Ca2+和Mg2+浓度下,SUMO-Bt-HepI的酶活分别提高了71.11%和95.46%,Bt-HepI的酶活分别提高了56.12%和81.84%。对Ca2+和Mg2+复合添加对酶活的影响进行了探索(图 9-D)。由图可得,Ca2+和Mg2+的促进作用可以相互叠加。分别在Ca2+和Mg2+浓度饱和的情况下,另一个离子的影响(图 9-E:10 mmol/L Ca2+饱和、图 9-F:50 mmol/L Mg2+饱和)。结果表明,Ca2+和Mg2+的促进作用是相互独立的,两者之间互不影响。

|
| 图 9 金属离子对酶活的影响 Figure 9 Effects of metal ions on enzyme activity. A: Effect of different metal ions (5 mmol/L) on enzyme activity; B: Effect of different concentration of Ca2+ and Mg2+ on SUMO-Bt-HepI; C: Effect of different concentration of Ca2+ and Mg2+ on Bt-HepI; D: Effect of Compound Ca2+ and Mg2+ on enzyme activity; E: Effect of Mg2+ on enzyme activity under 10 mmol/L Ca2+ saturation; F: Effect of Ca2+ on enzyme activity under 10 mmol/L Mg2+ saturation. |
3 讨论
目前肝素类药物的市场需求日益增多,2016年肝素原料药的需求达到44.30万亿单位,全球肝素类药物市场已达到125.8亿美元,市场巨大,并且持续增加。肝素类药物的发展方向趋向于低分子肝素和超低分子肝素,目前对于低分子肝素的制备,大都采用化学裂解法,但是此方法存在组分单一性差、分离成本高、三废污染、纯度差等缺点,越来越不适合绿色环保的理念。而酶解法条件温和,对肝素本身的结构特征不造成影响,且没有副反应发生,得率较高;反应一步完成,比较容易实现生产;反应没有产生不纯物,比较利于下游的分离纯化,其中以肝素酶Ⅰ的酶解应用最为广泛。目前市场上肝素酶Ⅰ的价格极其昂贵,并且其本身的酶活性以及稳定性都较差,很难适应工业化生产的要求。因此针对肝素酶Ⅰ的表达产量、酶活性以及稳定的研究显得尤为重要。
目前,肝素酶Ⅰ的研究与应用主要集中在肝素黄杆菌(Pedobacter heparinus)的肝素酶Ⅰ,而对多形拟杆菌(Bacteroides thetaiotaomicron)等其他来源的肝素酶Ⅰ的研究却并不多见。多形拟杆菌是人类肠道中数量最大的细菌之一,能够根据食物来源的变化,将自身四分之一以上的基因调节到活跃状态,分解人体本身无法消化的多糖;是一种优秀的可降解碳水化合物的细菌,能够将许多植物类食品中的大分子碳水化合物降解为葡萄糖和其他易消化的小分子糖类[26]。虽然研究者们已经对多形拟杆菌肝素酶Ⅰ的基因进行了克隆,但是对其酶学性质的研究(最优pH与温度,pH与热稳定性,金属离子对酶活的影响,等等)较少[27-28]。并且,尚未有多形拟杆菌来源的肝素酶Ⅰ与SUMO标签融合的研究报道。
本研究运用基因工程手段,把来源于多形拟杆菌的肝素酶Ⅰ基因和SUMO标签进行N端融合,并且在大肠杆菌Rosetta (DE3)中实现异源表达,成功获得能够表达SUMO-Bt-HepI和Bt-HepI的重组基因工程菌株。本文研究表明,N端融合SUMO标签的SUMO-Bt-HepI比Bt-HepI的比酶活提高了48.9%。这是因为酶的活性体现需要正确的空间构象,而SUMO标签具有使目的蛋白正确折叠的功能,可以使表达的目的蛋白具有更加正确的空间构象,因此在N端融合SUMO标签可以提高SUMO-Bt-HepI的比酶活。此外SUMO标签具有很好的促溶效果,融合标签后使可溶性表达达到95%以上。并且,融合前后未改变其最适温度和最适pH,说明SUMO标签没有对其性质产生大的影响。在温度≤40 ℃时,SUMO-Bt-HepI和Bt-HepI均比较稳定,当温度≥50 ℃时,SUMO-Bt- HepI和Bt-HepI的稳定性均较差(图 8-A、B);通过在30 ℃和40 ℃下将两者孵育更长时间测定剩余酶活发现,SUMO-Bt-HepI在30 ℃和40 ℃下的半衰期大约为180 min和150 min;Bt-HepI在30 ℃和40 ℃下的半衰期大约为140 min和120 min (图 8-C、D)。融合SUMO标签后,热稳定性表现出一定的提高。
众所周知,金属离子可以促进或抑制酶的活性。本研究发现:Ca2+和Mg2+促进了肝素酶Ⅰ的活性;相反,Cu2+、Mn2+、Zn2+抑制酶活性。对于Ca2+提高肝素酶Ⅰ活性的研究报道很多,如Han等[28]解析了多形拟杆菌肝素酶Ⅰ可以和Ca2+进行结合,稳定肝素酶Ⅰ的结构,提高肝素酶Ⅰ的活性;Ma等[29]通过研究肝素黄杆菌肝素酶Ⅰ发现Ca2+对其有促进作用,通过实验确定的最佳浓度为10 mmol/L,与本研究的最佳浓度一致。而Mg2+的相关研究报道还很少。本研究中还发现Mg2+对促进酶活具有很大影响,最佳浓度为50 mmol/L (图 9-B、C)。将Ca2+和Mg2+进行复配后,通过酶活测定发现Ca2+和Mg2+的促进效果可以叠加(图 9-D)。现有研究已报道多形拟杆菌肝素酶Ⅰ中存在Ca2+的结合位点,但未报道存在Mg2+的结合位点。本研究将重组酶在最佳Ca2+浓度下进行孵育饱和后,再添加不同浓度的Mg2+,探究Mg2+对酶活性的影响,同理研究Ca2+对酶活的影响(图 9-E、F)。结果表明,Ca2+和Mg2+的促进作用互不影响,推测可能在多形拟杆菌肝素酶Ⅰ的晶体结构中也存在Mg2+的结合位点。
截止目前为止,只解析了多形拟杆菌肝素酶Ⅰ的晶体结构,序列比对结果表明,Bt-HepI的氨基酸残基序列与Ph-HepI的相似度为62.5%,具有很高的结构相似性。本研究室前期研究数据显示,与Ph-HepI相比,Bt-HepI具有更高的酶活性以及更好的稳定性,蛋白晶体结构的存在为后续更加深入的研究Bt-HepI的比酶活以及稳定性提供坚实的理论基础。本研究构建的融合SUMO标签的SUMO-Bt-HepI,表现出了更高的酶活力、更强的溶解性,使其具有工业化生产的潜力。同时也将拓宽人们对多形拟杆菌来源肝素酶Ⅰ的认识,为其深入研究以及应用开发提供指导。
| [1] | Witczak ZJ, Nieforth KA. Carbohydrates in drug design. European Journal of Medicinal Chemistry, 1997, 32(11): 842. |
| [2] | Galliher PM, Cooney CL, Langer R, Linhardt RJ. Heparinase production by Flavobacterium heparinum. Applied and Environmental Microbiology, 1981, 41(2): 360-365. |
| [3] | Kim BT, Kim WS, Kim YS, Linhardt RJ, Kim DH. Purification and characterization of a novel heparinase from Bacteroides stercoris HJ-15. The Journal of Biochemistry, 2000, 128(2): 323-328. DOI:10.1093/oxfordjournals.jbchem.a022756 |
| [4] | Yoshida E, Sakai K, Tokuyama S, Miyazono H, Maruyama H, Morikawa K. Purification and characterization of heparinase that degrades both heparin and heparan sulfate from Bacillus circulans. Bioscience, Biotechnology, and Biochemistry, 2002, 66(5): 1181-1184. DOI:10.1271/bbb.66.1181 |
| [5] | Yang VC, Linhardt RJ, Bernstein H, Cooney CL, Langer R. Purification and characterization of heparinase from Flavobacterium heparinum. Journal of Biological Chemistry, 1985, 260(3): 1849-1857. |
| [6] | Sasisekharan R, Moses MA, Nugent MA, Cooney CL, Langer R. Heparinase inhibits neovascularization. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(4): 1524-1528. DOI:10.1073/pnas.91.4.1524 |
| [7] | Ernst S, Venkataraman G, Winkler S, Godavarti R, Langer R, Cooney CL, Sasisekharan R. Expression in Escherichia coli, purification and characterization of heparinase Ⅰ from Flavobacterium heparinum. Biochemical Journal, 1996, 315(2): 589-597. DOI:10.1042/bj3150589 |
| [8] | Hirsh J, Warkentin TE, Shaughnessy SG, Anand SS, Halperin JL, Raschke R, Granger C, Ohman EM, Dalen JE. Heparin and low-molecular-weight heparin mechanisms of action, pharmacokinetics, dosing, monitoring, efficacy, and safety. Chest, 2001, 119(1): 64S-94S. DOI:10.1378/chest.119.1_suppl.64S |
| [9] | Qureshi A, Perera A. Low molecular weight heparin versus unfractionated heparin in the management of cerebral venous thrombosis: A systematic review and meta-analysis. Annals of Medicine and Surgery, 2017, 17: 22-26. DOI:10.1016/j.amsu.2017.03.016 |
| [10] | Welsby IJ, Newman MF, Phillips-Bute B, Messier RH, Kakkis ED, Stafford-Smith M. Hemodynamic changes after protamine administration: association with mortality after coronary artery bypass surgery. Anesthesiology, 2005, 102(2): 308-314. DOI:10.1097/00000542-200502000-00011 |
| [11] | Guerrini M, Beccati D, Shriver Z, Naggi A, Viswanathan K, Bisio A, Capila I, Lansing JC, Guglieri S, Fraser B, Al-Hakim A, Gunay NS, Zhang ZQ, Robinson L, Buhse L, Nasr M, Woodcock J, Langer R, Venkataraman G, Linhardt RJ, Casu B, Torri G, Sasisekharan R. Oversulfated chondroitin sulfate is a contaminant in heparin associated with adverse clinical events. Nature Biotechnology, 2008, 26(6): 669-675. DOI:10.1038/nbt1407 |
| [12] | Aich U, Shriver Z, Tharakaraman K, Raman R, Sasisekharan R. Competitive inhibition of heparinase by persulfonated glycosaminoglycans: a tool to detect heparin contamination. Analytical Chemistry, 2011, 83(20): 7815-7822. DOI:10.1021/ac201498a |
| [13] | Ameer GA, Harmon W, Sasisekharan R, Langer R. Investigation of a whole blood fluidized bed Taylor-Couette flow device for enzymatic heparin neutralization. Biotechnology and Bioengineering, 1999, 62(5): 602-608. DOI:10.1002/(ISSN)1097-0290 |
| [14] | Sasisekharan R, Bulmer M, Moremen KW, Cooney CL, Langer R. Cloning and expression of heparinase Ⅰ gene from Flavobacterium heparinum. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(8): 3660-3664. DOI:10.1073/pnas.90.8.3660 |
| [15] | Shpigel E, Goldlust A, Efroni G, Avraham A, Eshel A, Dekel M, Shoseyov O. Immobilization of recombinant heparinase Ⅰ fused to cellulose-binding domain. Biotechnology and Bioengineering, 1999, 65(1): 17-23. |
| [16] | Ling CF, Zhang JY, Lin DQ, Tao AL. Approaches for the generation of active papain-like cysteine proteases from inclusion bodies of Escherichia coli. World Journal of Microbiology and Biotechnology, 2015, 31(5): 681-690. DOI:10.1007/s11274-015-1804-7 |
| [17] | Kapust RB, Waugh DS. Escherichia coli maltose-binding protein is uncommonly effective at promoting the solubility of polypeptides to which it is fused. Protein Science, 1999, 8(8): 1668-1674. DOI:10.1110/(ISSN)1469-896X |
| [18] | Chen Y, Xing XH, Ye FC, Kuang Y, Luo MF. Production of MBP-HepA fusion protein in recombinant Escherichia coli by optimization of culture medium. Biochemical Engineering Journal, 2007, 34(2): 114-121. |
| [19] | Namvar S, Barkhordari F, Raigani M, Jahandar H, Nematollahi L, Davami F. Cloning and soluble expression of mature α-luffin from Luffa cylindrica in E. coli using SUMO fusion protein. Turkish Journal of Biology, 2018, 42: 23-32. DOI:10.3906/biy-1708-12 |
| [20] | Li JH, Han QX, Zhang T, Du J, Sun QQ, Pang YL. Expression of soluble native protein in Escherichia coli using a cold-shock SUMO tag-fused expression vector. Biotechnology Reports, 2018, 19: e00261. DOI:10.1016/j.btre.2018.e00261 |
| [21] | Zhang J, Sun AY, Dong YG, Wei DZ. Recombinant production and characterization of SAC, the core domain of Par-4, by SUMO fusion system. Applied Biochemistry and Biotechnology, 2018, 184(4): 1155-1167. DOI:10.1007/s12010-017-2599-9 |
| [22] | Hartwig S, Frister T, Alemdar S, Li Z, Scheper T, Beutel S. SUMO-fusion, purification, and characterization of a (+)-zizaene synthase from Chrysopogon zizanioides. Biochemical and Biophysical Research Communications, 2015, 458(4): 883-889. DOI:10.1016/j.bbrc.2015.02.053 |
| [23] | Bernstein H, Yang VC, Cooney CL, Langer R. Immobilized heparin lyase system for blood deheparinization. Methods in Enzymology, 1988, 137: 515-529. DOI:10.1016/0076-6879(88)37048-5 |
| [24] | Huang J, Cao L, Guo WH, Yuan RX, Jia ZJ, Huang KH. Enhanced soluble expression of recombinant Flavobacterium heparinum heparinase Ⅰ in Escherichia coli by fusing it with various soluble partners. Protein Expression and Purification, 2012, 83(2): 169-176. DOI:10.1016/j.pep.2012.03.016 |
| [25] |
Xu SQ, Zhang XY, Qiu ML, Chen JH. Design and expression of recombinant heparanase Ⅰ fused to chitin binding domain and SUMO-Tag. Chemical Industry and Engineering Progress, 2016, 35(S2): 315-318.
(in Chinese) 许淑琴, 张轩月, 邱美玲, 陈敬华. ChBD和SUMO双功能融合肝素酶Ⅰ的设计与表达. 化学进展, 2016, 35(S2): 315-318. |
| [26] | Xu J, Bjursell MK, Himrod J, Deng S, Carmichael LK, Chiang HC, Hooper LV, Gordon JI. A genomic view of the human-Bacteroides thetaiotaomicron symbiosis. Science, 2003, 229(5615): 2074-2076. |
| [27] | Luo YD, Huang XQ, McKeehan WL. High yield, purity and activity of soluble recombinant Bacteroides thetaiotaomicron GST-heparinase Ⅰ from Escherichia coli. Archives of Biochemistry and Biophysics, 2007, 460(1): 17-24. DOI:10.1016/j.abb.2007.01.029 |
| [28] | Han YH, Garron ML, Kim HY, Kim WS, Zhang ZQ, Ryu KS, Shaya D, Xiao ZP, Cheong C, Kim YS, Linhardt RJ, Jeon YH, Cygler M. Structural snapshots of heparin depolymerization by heparin lyase I. Journal of Biological Chemistry, 2009, 284(49): 34019-34027. DOI:10.1074/jbc.M109.025338 |
| [29] | Ma XL, Wang ZS, Li SX, Shen Q, Yuan QS. Effect of CaCl2 as activity stabilizer on purification of heparinase Ⅰ from Flavobacterium heparinum. Journal of Chromatography B, 2006, 843(2): 209-215. DOI:10.1016/j.jchromb.2006.06.015 |
 2019, Vol. 59
2019, Vol. 59




