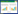中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 胡小丽, 张蔚, 刘邓, 邱轩, 王红梅. 2019
- Xiaoli Hu, Wei Zhang, Deng Liu, Xuan Qiu, Hongmei Wang. 2019
- 油藏嗜热菌与膨润土的相互作用及其对储层防膨的意义
- Effect of interaction between pristine thermophilic bacteria and bentonite on anti-swelling of oil reservoir
- 微生物学报, 59(6): 1197-1208
- Acta Microbiologica Sinica, 59(6): 1197-1208
-
文章历史
- 收稿日期:2019-02-22
- 修回日期:2019-03-19
- 网络出版日期:2019-04-04
2. 中国地质大学(武汉)生物地质与环境地质国家重点实验室, 湖北 武汉 430074
2. State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences, Wuhan 430074, Hubei Province, China
水驱采油是我国石油开采过程中的重要手段之一[1],该技术主要依托地面注水设备将低矿化度水人为地注入油藏,进而保持或提高油藏压力,以此达到提高原油采收率的效果[2-4]。然而,水驱采油会普遍引发油藏储层的水敏性损害,即储层中水敏性黏土矿物(譬如蒙皂石)遇水膨胀,堵塞采油孔喉,从而造成开采后期采油率的急剧锐减[5-6]。经历多年的注水开采,我国大部分油田已经步入高含水阶段[7],原油产量降低,而我国对原油的需求却日益增加,因此造成了严重的原油需求缺口[8]。突破油田储层防膨技术的瓶颈,实现强水敏性地层的增产与稳产,能在一定程度上缓解原油供应不足的现状,具有重要的现实意义。
自20世纪30年代以来,储层防膨研究已经得到重视,采用的主要措施是向油藏中添加正电荷化合物,常见储层防膨剂可分为无机盐类、阳离子表面活性剂和有机阳离子聚合物等三类[9-10]。这些化合物表面携带的正电荷能与储层中带有负电荷的黏土晶片结合,形成憎水复合体系,可降低黏土膨胀性和运移性[11],从而达到防膨的效果。然而常规的防膨技术存在使用浓度高、易被其他离子替换、价格偏高等问题,急需寻找新的防膨技术,来解决储层的水敏性问题。就石油储层本身而言,它是微生物、孔隙水、原油和矿物四相共存的系统,它们之间存在着密切的相互作用,而油藏微生物已被证实可将高密度原油降解转化为低密度和低黏度油或气体,增强石油的流动性,从而提高微生物驱油的效率[12]。但油藏内源微生物与储层矿物之间的相互作用则鲜有报道,是否可以通过激活油藏内源微生物来促进膨胀性的黏土矿物向非膨胀性的矿物转变还不得而知。
事实上,微生物与黏土矿物相互作用的研究已经是地质微生物领域的热点研究方向之一。前人的工作表明,一些厌氧菌可以将水敏性黏土矿物蒙皂石中的结构Fe(Ⅲ)还原为Fe(Ⅱ),从而导致蒙皂石溶解破坏,并且在一定水化学条件下可催化形成一些非膨胀性或弱膨胀性次生矿物(如伊利石、长石、滑石和非晶SiO2等)[13-15]。以上室内模拟研究表明微生物具备作为黏土矿物防膨剂的潜力。需要指明的是,这些铁还原菌株多分离于湖泊[16]、海洋[13]、陆地热泉沉积物中[15]或为油藏常温菌[17]。油藏是厌氧嗜热微生物的天然栖息地[18],然而目前对油藏内源嗜热微生物中是否具备还原蒙皂石结构铁的能力,继而充当储层防膨剂的认识还极为薄弱。
针对以上问题,本文以我国胜利油田沾3区块的高温油藏为研究对象,尝试分离厌氧铁还原菌,评估菌株对膨润土(以蒙皂石为主)的缩膨效能。这一研究对高含水、高温油田的开采具有重要的理论和实际指导意义。
1 材料和方法 1.1 样品采集与处理胜利油田位于山东东营市黄河三角洲,是我国重要的石油工业基地和第二大高产油田。自1961年发现并勘探以来,已在胜利油田发现81个油气田,累积生产原油12亿t,为推动我国经济发展提供了有力支撑[7]。
用于嗜热菌分离的油井采出液于2016年12月采集于胜利油田沾3区块,油藏温度为60 ℃,属于高温油藏。用无菌桶收集采出液20 L,用于后续嗜热菌的室内分离。待样品运抵实验室后,将采出液静置分离成油层与水层。其中,将油层样品小心转移至500 mL离心瓶中,再以异辛烷为萃取剂纯化油样。最后,对混合液进行离心处理(5000 r/min,6 min,Allegra X-30R,美国Beckman公司),重复数次并收集沉淀,用于后续油相微生物的分离和培养。
1.2 嗜热菌的分离鉴定及系统发育分析配制液体培养基用于分离采出液油相样品中的嗜热菌,其成分为(每升含):NaNO3 (2 g),K2HPO4 (0.5 g),KH2PO4 (1 g),MgSO4 (0.05 g),CaCl2 (0.01 g),NaCl (10 g),FeSO4·7H2O (0.01 g),酵母提取物(2.5 g),C36正构烷烃(0.01 g),乳化剂吐温80 (15 mL)。调节培养液pH至7.0。待高温灭菌并冷却后,按5% (W/V)的比例将油相离心收集的沉淀物转接至上述新鲜培养液中,置于60 ℃恒温避光培养。培养3 d后,将0.1 mL培养液涂布至固体平板上,60 ℃培养以便分离获得纯培养菌株。培养2周后,成功获得单菌落。挑取单菌落扩大培养,取菌液进行染色,在光学显微镜(Motic B SERIES)下观察染色结果。
好氧生长:待高温灭菌的培养基冷却后,按照5% (W/V)比例接种油相离心沉淀物至新鲜培养基中。无菌对照组和含菌实验组均设置3个平行。培养物于60 ℃ 150 r/min条件下培养11 d,每48 h取样,用分光光度计(UV-8000A,上海元析仪器有限公司)于600 nm波段读取吸光度值,绘制好氧条件下的生长曲线。
厌氧生长:将配置好的培养基分装至150 mL血清瓶中,通入高纯氮除氧并密封。高温灭菌冷却后,将血清瓶转移至厌氧手套箱内(COY Lab,美国)。将有氧条件下生长至对数中后期的菌液转移至厌氧手套箱(含98% N2及2% H2),离心(5000 r/min,6 min)收集菌体,用0.8%生理盐水洗涤3次转接到血清瓶中,设置无菌对照组和含菌实验组各3组平行,于60 ℃静止培养11 d,间隔48 h取样,用分光光度计(UV-8000A,上海元析仪器有限公司)于600 nm波段读取吸光度值,绘制嗜热菌的厌氧生长曲线。
利用扫描电镜(SEM)和透射电镜(TEM)观察菌体形貌。其中,SEM样品经固定、脱水、临界点干燥、镀金等步骤处理再放置于SEM(TESCAN VEGA3 LMU/XMU)下观察。SEM的工作条件为:加速电压为10 kV,激发电子束为2 mA。TEM样品经固定、脱水、包埋和切片处理,再用TEM (Hitachi H-700FA,加速电压100 kV)观察切片形貌。
采用FastDNA®试剂盒(QIAGEN)提取纯菌株总DNA,并利用细菌通用引物(27F/1492R)[19]进行16S rRNA的扩增,将PCR产物送至武汉天一辉远生物科技有限公司进行测序。将测得的16S rRNA序列(序列号:MK622844)在GenBank进行比对,对获得的同源序列进行分析。采用Mega软件中的Neighbor-Joining法构建进化树。
1.3 嗜热菌与膨润土相互作用为了验证获得的纯菌株是否具备在厌氧条件下还原黏土矿物结构铁的能力,将该菌株接种至预先灭菌和除氧处理的矿物悬浊液中。该矿物悬浊液的组成如下(每升含):NaNO3 (2 g),K2HPO4 (0.5 g),KH2PO4 (1 g),MgSO4 (0.05 g),CaCl2 (0.01 g),NaCl (10 g),酵母提取物(2.5 g)以及膨润土(5 g),其中膨润土样品由中石化胜利油田分公司采油工艺研究院提供,该样品来源于胜利油田沾3区块储层。
矿物悬浊液的处理过程如下所述:小心研磨膨润土,按照5 g/L浓度称取样品至上述培养液中,磁力搅拌1 d以上,确保矿物均匀悬浮在培养液中,并调节pH=7。将上述矿物悬浊液分装至150 mL厌氧瓶中,通入高纯氮除氧并密封。为了避免高温灭菌对矿物结构的破坏,本实验采用巴斯德消毒法对矿物悬浊液灭菌处理,即在70 ℃水浴锅进行低温灭菌(重复3 d,每天处理0.5 h)[20]。待矿物悬液冷却后,将血清瓶转移至厌氧手套箱内(COY Lab,美国)。将有氧条件下生长至对数中后期的菌液转移至厌氧手套箱(含98% N2及2% H2),离心(5000 r/min,6 min)收集菌体,用0.8%生理盐水洗涤3次转接到矿物悬浊液中,建立无菌对照组和含菌实验组,且每组均设置3个平行,培养物于60 ℃静止培养11 d,间隔48 h取样检测体系中蛋白和可溶性Fe2+的浓度变化。实验结束后,对比观察微生物作用前后矿物物相组成和形貌变化。
1.4 分析方法 1.4.1 蛋白质浓度检测: 用于检测微生物在添加了膨润土的实验体系中的生长情况。首先建立蛋白质浓度标准曲线,具体步骤如下:准备不同浓度梯度的牛血清溶液(用纯水配制),且各浓度条件下设置2个平行样,利用分光光度计在波长为595 nm检测其吸光度值,获得的标准曲线中吸光度值与已知的蛋白浓度呈线性关系。本实验建立的标准方程为y(吸光度值)=0.0106x(蛋白浓度)–0.0088,其中R2=0.9995。样品蛋白质浓度的检测:取0.1 mL 0.2 mol/L NaOH溶液加入0.9 mL菌-矿悬浊液中,100 ℃下加热10 min裂解细胞。待充分冷却后,离心悬浊液,取0.8 mL上清组分与0.2 mL Bradford反应液(Sigma公司)混合,利用分光光度计于595 nm波段读取吸光度值,依据标准曲线计算样品中蛋白质的浓度。
1.4.2 可溶性Fe2+浓度检测: 首先建立Fe2+标准曲线,即配制不同浓度梯度的柠檬酸亚铁溶液,且各浓度条件下设置2个平行样,利用分光光度计在510 nm的条件下读取器吸光度值,获得的标准曲线中吸光度值与已知的Fe2+浓度呈线性关系。本实验建立的标准方程为y(吸光度值)=0.1881x (Fe2+浓度)–0.0038,其中R2=0.9996。样品Fe2+浓度的测定:在厌氧手套箱中,用1 mL一次性无菌注射器移取0.2 mL菌-矿悬浊液,注入0.48 mL 1.8 mol/L H2SO4溶液中,然后加入0.04 mL 48% HF溶液及0.08 mL邻菲罗啉显色剂(1, 10-phenanthroline),混匀后在100 ℃恒温条件下加热30 min。冷却后,向待测样品加入0.4 mL H3BO3溶液中和多余HF。摇匀样品,移取0.1 mL加入1 mL 1%柠檬酸钠溶液中,待显色充分后用紫外分光光度计检测Fe2+浓度,检测波长为510 nm。
1.4.3 矿物相的鉴定及形貌特征分析: 实验结束后,取矿物悬液,进行SEM前处理。采用不同浓度梯度的乙醇对微生物-矿物复合体进行脱水,再用临界点干燥仪(Quorum K850,英国)去除乙醇。干燥完毕后的样品经上桩粘接和喷金处理,用于矿物及微生物细胞的形貌扫描电镜观察(SEM,TESCAN VEGA3 LMU/XMU)。SEM工作条件为:加速电压10 kV,激发电子束为2 mA。将微生物作用前后的膨润土悬液用乙二醇蒸汽饱和法进行前处理[21-22]。利用X射线衍射仪(XRD,Scintag X1 Cu Kα)检测其物相组成,工作条件为:Cu Kα,管压40 kV,管流40 mA,扫描速度为2°/min,扫描范围5°–65° 2θ。 1.4.4 矿物膨胀性能分析: 精确称取0.5 g微生物作用前后的膨润土干重粉末分别装入10 mL量筒内,加入4.5 mL的蒸馏水,并设置3个平行样,待96 h后观察样品在量筒中的固液界面变化。读取各量筒界面处刻度,即各样品的自由膨胀体积。将反应后产物膨胀终点时的固液界面刻度记为V1,原始膨润土在水中的自由膨胀时固液界面高度记为V0,利用公式(1)计算反应后产物的缩膨率[21-24]。

|
公式(1) |
生长曲线结果显示,SL-1在厌氧与好氧条件下均能生长,为兼性厌氧菌,且好氧和厌氧条件下SL-1生长曲线趋势相同,均在前3 d显著上升,第3天达到最高值,之后则缓慢下降(图 1)。

|
| 图 1 好氧和厌氧条件下SL-1的生长曲线 Figure 1 Growth curves of SL-1 under aerobic and anaerobic conditions |
2.2 菌株鉴定及系统发育分析
基于16S rRNA系统发育树可知,本实验分离的菌株隶属于Geobacillus属,并且与G. icigianus亲缘最为接近(相似系数为100%)(图 2),因此将该菌株命名为G. icigianus SL-1。菌株SL-1形态为长杆状(图 3-A),对数及对数后期具芽孢(图 3-B)。
|
| 图 2 rRNA构建的单菌株SL-1邻接法系统发育树 Figure 2 Neighbor-Jointing phylogenetic tree of SL-1 based on 16S rRNA |

|
| 图 3 扫描电镜(A)和透射电镜(B)下菌株SL-1的形态 Figure 3 SEM (A) and TEM (B) images of SL-1 |
2.3 嗜热菌SL-1还原蒙皂石结构铁
实验所用膨润土的主要矿物成分为蒙皂石,含量高达70.4% (表 1)。在接种了SL-1的实验组中,菌株SL-1能够以酵母提取物作为碳源,在厌氧条件下进行生长。其蛋白质含量在前3 d显著上升,第3天达到最高值(20.22 μg/L),之后则缓慢下降(图 4-A)。与之对应的是实验体系中的可溶Fe2+浓度在前3 d也快速升高,第3天达到最高值(0.109 mmol/L),之后含量缓慢下降(图 4-B)。与实验组相对的是,无菌对照体系中,蛋白质及Fe2+浓度无明显变化(图 4)。

|
| 图 4 蛋白质浓度(A)和Fe2+浓度(B)随培养时间的变化 Figure 4 Variation of protein concentration (A) and Fe2+ concentration (B) with time |
| Sample | Cells | Smectite/% | Illite/% | Kaolinite/% | Mixed-layer illite-smectite/% |
| Pristine bentonite | 70.4 | 19.8 | 9.7 | n.d | |
| After treatments | without cells | 70.4 | 19.8 | 9.7 | n.d |
| with cells | 47.7 | 29.1 | 17 | 6.2 |
2.4 微生物作用下矿物相的转变
SEM结果显示,对照组中蒙皂石样品为不规则薄片状,断口处花瓣卷曲磷片状、棉絮状,轮廓不清楚(图 5-A);经过微生物作用后,除典型蒙皂石薄片外,还有一些不规则板状物质的出现,板状物质放大图呈蜂窝状、半蜂窝状(图 5-C)。EDS分析结果可知(图 5-B,D),相对原始样品,实验体系含有较高的Al/Si比值,且铁含量由1.25%降低为0.63%,钾含量由0.47%增加为2.17% (表 2)。

|
| 图 5 对照组扫描电镜形貌图(A)及能谱图(B)和实验组扫描电镜形貌图(C)及能谱图(D) Figure 5 SEM images (A, C) and energy spectrums (B, D) of samples after experiments without microbes (A, B) and with microbe (C, D) |
| Sample | Al/Si | Fe/% | K/% |
| Without cells | 0.5 | 1.3 | 0.5 |
| With cells | 0.4 | 0.6 | 2.2 |
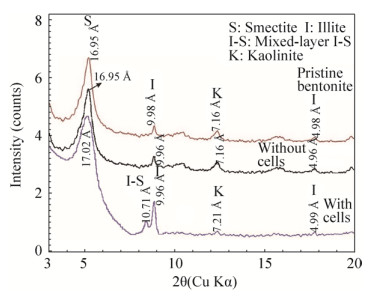
实验中所用的膨润土的主要成分有蒙皂石、伊利石和高岭石(图 6,表 1),三者的含量分别为70.4%、19.8%和9.7%(表 1)。微生物作用后,膨润土样品中出现了伊-蒙混层矿物(图 6),体系中蒙皂石含量下降至47.7%,而伊利石和高岭石的含量分别增加至29.1%和17%,伊-蒙混层矿物的含量为6.2% (表 1)。而对照组和实验前样品中,矿物相及其百分含量均未发生变化。
|
| 图 6 实验前和实验后样品XRD图谱 Figure 6 XRD spectrums of samples before and after experiments |
2.5 微生物作用后矿物膨胀性能的变化
实验结束后,对照组0.5 g固体样品在4.5 mL去离子水溶液中静置96 h后,液面上升至8.64 mL;而同等条件下实验组0.5 g固体样品对应的液面高度则为6.40 mL (表 3)。按文中给出的公式(1)计算,经微生物作用后,实验所用的膨润土的缩膨率达到25.9%。
| Sample | Triplicate 1 | Triplicate 2 | Triplicate 3 | Average | Swelling inhibition/% |
| Without cells (V1) | 6.34 mL | 6.40 mL | 6.46 mL | 6.40 mL | 25.9 |
| With cells (V0) | 8.72 mL | 8.60 mL | 8.60 mL | 8.64 mL |
3 讨论
微生物对矿物结构铁的还原作用早在1998年就被发现,目前为止,已有多种微生物被证实可以通过胞外呼吸或发酵等方式进行铁还原,这些微生物包括典型异化铁还原菌(如Geobacter和Shewanella)、硫酸盐还原菌和产甲烷菌等[15-25]。其中,异化铁还原菌被认为是自然界铁还原途径的主要驱动力[26-27]。在还原铁的过程中,大多伴随着次生矿物的形成和矿物相的转变。
3.1 SL-1介导的矿物相的转变及其对矿物膨胀性的影响研究发现,伴随着铁还原菌对含铁矿物晶格Fe3+的还原,可溶性Fe2+离子浓度在前期快速升高。随后,Fe2+离子浓度进入平稳阶段,之后逐渐降低[25]。上述铁还原反应后期Fe2+离子浓度降低现象是由矿物对Fe2+的吸附或次生含铁矿物的生成所导致[25]。微生物对黏土矿物结构铁进行异化还原的过程中可形成多种含铁的次生矿物,如伊利石、磁铁矿、菱铁矿、蓝铁矿以及绿锈等[28]。本研究中微生物作用后,在固态物质的XRD图谱中检测到了过渡态的伊-蒙混层矿物(图 6),部分蒙脱石转化为伊蒙混层矿物,证实了微生物作用下发生了矿物相的转变,产生了次生的伊利石,该结果与实验中可溶性Fe2+浓度在实验后期的降低相吻合。SEM-EDS结果也证实了实验组体系中铁元素和钾元素含量发生明显变化(表 2),出现典型蜂窝状的伊利石(图 5),该形貌特征与前人研究结果一致[24-29]。
由于蒙皂石与伊利石矿物结构的差异,导致它们的膨胀性能不同,蒙皂石遇水膨胀,而伊利石遇水不膨胀。因此微生物作用导致的蒙皂石向伊利石转化,理论上能够降低样品的膨胀性,有利于解决油田储层的水敏性问题。本研究膨胀性能检测结果也证实了这一点,相对于原始样品,微生物作用后矿物缩膨率达到25.9%。与从中温油藏分离得到的四种不同微生物的作用相比,本研究中微生物作用后矿物缩膨率较低,前者作用后缩膨率可达48.5%[17]。该差异可能与实验所用的样品中矿物的原始含量不同有关。与Cui等用的纯化后的蒙皂石样品相比[17],本研究中蒙皂石含量为仅为70.4%,并且原始样品中含有一定量的伊利石(19.8%),伊利石的存在一定程度上可能影响了蒙皂石向伊利石转化的发生。尽管如此,由于本实验所用的膨润土来自于油藏本身,它与微生物相互作用实验的结果应该更加接近自然状况,证实油藏微生物确实能够与储层中的黏土矿物发生反应,并导致矿物相的转变。如能对实验条件加以控制,则可能实现矿物相转变的定向调控,从而降低矿物的膨胀性能,改善储层的物性,达到水敏储层防膨效果,有利于注水油藏的进一步开发。
3.2 SL-1与含铁蒙皂石相互作用机制探讨对微生物异化铁还原机制的认识目前主要包括直接接触机制、螯合促溶机制、电子穿梭机制和纳米导线辅助机制[20, 30-31]。另外,根据异化铁还原菌的呼吸方式可将其分为呼吸型铁还原菌和发酵型铁还原菌[32],以希瓦氏菌属(Shewanella)为代表的呼吸型铁还原菌主要利用氢气或小分子有机酸作为电子供体,还原胞外Fe(Ⅲ)[19]。而发酵型铁还原菌能利用大分子有机酸或糖类等作为底物,营发酵作用进行铁还原。目前来看这类通过发酵进行铁还原的细菌所占比例较少。
本研究以酵母提取物作为电子供体,蒙皂石结构中的Fe(Ⅲ)为电子受体,SL-1不具有菌毛、性毛等结构,且体系中并不存在NTA、EDTA和多磷酸盐等螯合剂,加上在缺氧条件下该属菌株主要依靠发酵作用获得能量维持细胞生长等信息[33],推测SL-1应为发酵型铁还原菌,通过直接接触方式对蒙皂石中的结构铁进行还原(图 7)。蒙皂石作为唯一的电子受体,微生物细胞可直接接触黏土矿物通过释放促进结构铁溶解的有机酸或螯合剂来促进铁还原[34, 35]。微生物代谢过程中释放的有机酸溶解少量蒙皂石,可能会导致黏土矿物总量下降、伊利石含量相对增加。与Warr等888 h的研究不同[36],本研究中微生物在第3天就已达到对数期,电镜下并未观察到明显的腐蚀坑,说明蒙脱石溶解程度较低。同时,微生物的作用可影响黏土的粒度和沉降性能以及渗透性和水力传导性[37],因此膨胀性能的降低同样受到微生物代谢产物的影响。在高温油藏环境下,SL-1主要依靠厌氧发酵作用获得能量维持生长。以酵母提取物作为电子供体,部分电子转移至蒙皂石,使得蒙皂石晶格结构中的Fe(Ⅲ)发生还原,进而导致蒙皂石电荷失衡。电荷失衡的蒙皂石具有更强的阳离子吸附属性[14]。因而,当溶液中存在较高浓度的K+,该离子会被蒙皂石吸附至晶体层间域[14-23]。蒙皂石的铁还原反应还往往伴随着结构中心阳离子(Al3+和Si4+)的重排和释放[14-38]。经历以上反应,蒙皂石趋向转变为伊利石(图 7)。与蒙皂石相比,伊利石层间域主要富含K+,因此层间作用力并不是范德华力,而是更强的静电引力。由于上述层间作用力的差异,伊利石呈现非膨胀特征,而蒙皂石则为典型的水敏膨胀矿物。SL-1还原蒙皂石结构铁改变了矿物物性,导致膨胀性高的蒙皂石转化为遇水不膨胀的伊利石。此外,微生物在生长代谢过程中往往释放大量的胞外多糖,这些有机质会团聚黏土矿物,进一步降低膨润土的膨胀性能[39]。

|
| 图 7 蒙皂石向伊利石转化机理示意图 Figure 7 Conversion mechanism of smectite to illite T: tetrahedron; O: octahedron. |
4 结论
从山东省胜利油田沾3区块高温油藏采出液油相样本中分离得到一株嗜热的异化铁还原菌G. icgianus SL-1,该菌株能以酵母提取物为电子供体,在厌氧条件下对蒙皂石晶格结构中的Fe(Ⅲ)进行发酵还原,并将样品中部分蒙皂石转化成伊利石,缩膨率达到25.9%。这为后续定向调控油藏原位微生物群落,改善水敏性储层的物性,提高水驱采油率具有重要的理论指导意义。
| [1] |
Gang QL. A dissertation on Chinese tertiary recovery technology. Petroleum Geology and Recovery Efficiency, 1998, 5(4): 1-7.
(in Chinese) 冈秦麟. 论我国的三次采油技术. 油气地质与采收率, 1998, 5(4): 1-7. |
| [2] | Al-Saedi HN, Alhuraishawy AK, Flori R, Brady PV. Sequential injection mode of high-salinity/low-salinity water in sandstone reservoirs:oil recovery and surface reactivity tests. Journal of Petroleum Exploration and Production Technology, 2019, 9(1): 261-270. DOI:10.1007/s13202-018-0466-z |
| [3] | Kiani S, Zadeh MM, Khodabakhshi S, Rashidi A, Moghadasi J. Newly prepared nano gamma alumina and its application in enhanced oil recovery:an approach to low-salinity waterflooding. Energy & Fuels, 2016, 30(5): 3791-3797. |
| [4] | Piñerez Torrijos ID, Puntervold T, Strand S, Austad T, Bleivik TH, Abdullah HI. An experimental study of the low salinity smart water-polymer hybrid EOR effect in sandstone material. Journal of Petroleum Science and Engineering, 2018, 164: 219-229. DOI:10.1016/j.petrol.2018.01.031 |
| [5] |
Liu SL, Xu B, Yin ZZ. Experimental study of expansion influencing expansive soil strength. Journal of Henan Institute of Science and Technology (Natural Science Edition), 2018, 46(2): 72-78.
(in Chinese) 刘述丽, 徐彬, 殷宗泽. 膨胀性对膨胀土强度影响的试验研究. 河南科技学院学报(自然科学版), 2018, 46(2): 72-78. DOI:10.3969/j.issn.1008-7516.2018.02.013 |
| [6] | Kang M, Jiang HQ, Li JJ, Lin Z. Experimental study on the micro alkali sensitivity damage mechanism in low-permeability reservoirs using QEMSCAN. Journal of Natural Gas Science and Engineering, 2016, 36: 1004-1017. DOI:10.1016/j.jngse.2016.06.056 |
| [7] |
Wang CJ, Hong L, Gao RM, Wang W, Zhang ZL, Duan JJ, Miao XL. Status-quo and challenges of enhanced oil recovery in low permeability reservoirs. Unconventional Oil & Gas, 2018, 5(3): 102-108.
(in Chinese) 王成俊, 洪玲, 高瑞民, 王伟, 张忠林, 段景杰, 苗小龙. 低渗透油藏提高采收率技术现状与挑战. 非常规油气, 2018, 5(3): 102-108. DOI:10.3969/j.issn.2095-8471.2018.03.018 |
| [8] | Lu XQ. China's crude oil production from 2011 to 2016(10, 000 tons). China Oil & Gas, 2017(3): 56. |
| [9] |
Wang GM, Jiang HD, Wang Y, Zheng CY, Guo ZL, Wang ZM. Influence and measures of Luoma lake sand on ready-mixed concrete. China Concrete and Cement Products, 2017(2): 24-28.
(in Chinese) 王高明, 姜海东, 王毅, 郑春扬, 郭兆来, 王子明. 骆马湖砂对预拌混凝土的影响及应对措施. 混凝土与水泥制品, 2017(2): 24-28. DOI:10.3969/j.issn.1000-4637.2017.02.005 |
| [10] |
Xing XJ, Wang S, He S, Feng H. Study on anti-swelling technical of injection for strong water sensitive formation. Inner Mongolia Petrochemical Industry, 2015(12): 95-97.
(in Chinese) 邢希金, 王珊, 何松, 冯桓. 适用于强水储层的注水防膨技术研究. 内蒙古石油化工, 2015(12): 95-97. DOI:10.3969/j.issn.1006-7981.2015.12.038 |
| [11] |
Feng PY, Wang G, Hu HF, Rong XM, Wang CL. Evaluation of a novel bisquats clay stabilizer/sanding inhibiter and discussion on its mechanisms. China Offshore Oil and Gas, 2017, 29(3): 73-77.
(in Chinese) 冯浦涌, 王贵, 胡红福, 荣新明, 王春林. 新型双季铵盐抑砂防膨剂性能评价及作用机理探讨. 中国海上油气, 2017, 29(3): 73-77. |
| [12] | Kryachko Y. Novel approaches to microbial enhancement of oil recovery. Journal of Biotechnology, 2018, 266: 118-123. DOI:10.1016/j.jbiotec.2017.12.019 |
| [13] | Liu D, Dong HL, Agrawal A, Singh R, Zhang J, Wang HM. Inhibitory effect of clay mineral on methanogenesis by Methanosarcina mazei and Methanothermobacter thermautotrophicus. Applied Clay Science, 2016, 126: 25-32. DOI:10.1016/j.clay.2016.02.030 |
| [14] | Liu D, Dong HL, Wang HM, Zhao LD. Low-temperature feldspar and illite formation through bioreduction of Fe(Ⅲ)-bearing smectite by an alkaliphilic bacterium. Chemical Geology, 2015, 406: 25-33. DOI:10.1016/j.chemgeo.2015.04.019 |
| [15] | Huang LQ, Feng C, Jiang HC, Dong HL, Liu ZZ, Zeng Q, Wang X, Zhang L. Reduction of structural Fe(Ⅲ) in nontronite by thermophilic microbial consortia enriched from hot springs in Tengchong, Yunnan province, China. Chemical Geology, 2018, 479: 47-57. DOI:10.1016/j.chemgeo.2017.12.028 |
| [16] | Kim J, Dong HL, Seabaugh J, Newell SW, Eberl DD. Role of microbes in the smectite-to-illite reaction. Science, 2004, 303(5659): 830-832. DOI:10.1126/science.1093245 |
| [17] | Cui K, Sun SS, Xiao M, Liu TJ, Xu QS, Dong HH, Wang D, Gong YJ, Sha T, Hou JR, Zhang ZZ, Fu PC. Microbial mineral illization of montmorillonite in low-permeability oil reservoirs for microbial enhanced oil recovery. Applied and Environmental Microbiology, 2018, 84(14): e00176-18. |
| [18] | Chakraborty A, Ellefson E, Li C, Gittins D, Brooks JM, Bernard BB, Hubert CRJ. Thermophilic endospores associated with migrated thermogenic hydrocarbons in deep gulf of mexico marine sediments. The ISME Journal, 2018, 12(8): 1895-1906. DOI:10.1038/s41396-018-0108-y |
| [19] | Adesina TD, Nwinyi OC, De N, Omonigbehin EA. First detection of Proteus cibarius sp. of clinical significance. IOP Conference Series:Earth and Environmental Science, 2018, 210(1): 012001. |
| [20] | Meng Y, Zhao ZW, Burgos WD, Li Y, Zhang B, Wang YH, Liu WB, Sun LJ, Lin LM, Luan FB. Iron(Ⅲ) minerals and anthraquinone-2, 6-disulfonate (aqds) synergistically enhance bioreduction of hexavalent chromium by Shewanella oneidensis MR-1. Science of the Total Environment, 2018, 640-641: 591-598. DOI:10.1016/j.scitotenv.2018.05.331 |
| [21] | Baron F, Petit S, Tertre E, Decarreau A. Influence of aqueous Si and Fe speciation on tetrahedral Fe(Ⅲ) substitutions in nontronites:a clay synthesis approach. Clays and Clay Minerals, 2016, 64(3): 230-244. DOI:10.1346/CCMN.2016.0640309 |
| [22] | Neumann A, Olson TL, Scherer MM. Spectroscopic evidence for Fe(Ⅱ)-Fe(Ⅲ) electron transfer at clay mineral edge and basal sites. Environmental Science & Technology, 2013, 47(13): 6969-6977. |
| [23] | Gates WP, Wilkinson HT, Stucki JW. Swelling properties of microbially reduced ferruginous smectite. Clays and Clay Minerals, 1993, 41(3): 360-364. DOI:10.1346/CCMN |
| [24] | Mikhail RS, Guindy NM. Rates of low-temperature dehydration of montmorillonite and illite. Journal of Applied Chemistry and Biotechnology, 1971, 21(4): 113-116. |
| [25] | Liu D, Wang FP, Dong HL, Wang HM, Zhao LD, Huang LQ, Wu LL. Biological reduction of structural Fe(Ⅲ) in smectites by a marine bacterium at 0.1 and 20 MPa. Chemical Geology, 2016, 438: 1-10. DOI:10.1016/j.chemgeo.2016.05.020 |
| [26] | Walker JCG. Was the archaean biosphere upside down?. Nature, 1987, 329(6141): 710-712. DOI:10.1038/329710a0 |
| [27] | Vargas M, Kashefi K, Blunt-Harris EL, Lovley DR. Microbiological evidence for Fe(Ⅲ) reduction on early earth. Nature, 1998, 395(6697): 65-67. DOI:10.1038/25720 |
| [28] | Yan Z, Joshi P, Gorski CA, Ferry JG. A biochemical framework for anaerobic oxidation of methane driven by Fe(Ⅲ)-dependent respiration. Nature Communications, 2018, 9(1): 1642. DOI:10.1038/s41467-018-04097-9 |
| [29] | Xiao QL, Amrani A, Sun YG, He S, Cai CF, Liu JZ, Said-Ahmad W, Zhu CS, Chen ZL. The effects of selected minerals on laboratory simulated thermochemical sulfate reduction. Organic Geochemistry, 2018, 122: 41-51. DOI:10.1016/j.orggeochem.2018.04.004 |
| [30] | Su JF, Cheng C, Huang TL, Fang M, Lu JS, Shao SC. Novel simultaneous Fe(Ⅲ) reduction and ammonium oxidation of Klebsiella sp. FC61 under the anaerobic conditions. RSC Advances, 2016, 6(15): 12584-12591. DOI:10.1039/C5RA25507D |
| [31] |
Liu JC, Wang OM, Li JJ, Liu FH. Mechanisms of extracellular electron transfer in the biogeochemical manganese cycle. Acta Microbiologica Sinica, 2018, 58(4): 546-559.
(in Chinese) 刘进超, 王欧美, 李佳佳, 刘芳华. 生物地球化学锰循环中的微生物胞外电子传递机制. 微生物学报, 2018, 58(4): 546-559. |
| [32] | Lovley DR, Holmes DE, Nevin KP. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction. Advances in Microbial Physiology, 2004, 49: 219-286. DOI:10.1016/S0065-2911(04)49005-5 |
| [33] | Bryanskaya AV, Rozanov AS, Slynko NM, Shekhovtsov SV, Peltek SE. Geobacillus icigianus sp. Nov., a thermophilic bacterium isolated from a hot spring. International Journal of Systematic and Evolutionary Microbiology, 2015, 65: 864-869. DOI:10.1099/ijs.0.000029 |
| [34] | Lovley DR. Microbial Fe(Ⅲ) reduction in subsurface environments. FEMS Microbiology Reviews, 1997, 20(3/4): 305-313. |
| [35] | Dong HL, Kukkadapu RK, Fredrickson JK, Zachara JM, Kennedy DW, Kostandarithes HM. Microbial reduction of structural Fe(Ⅲ) in illite and goethite. Environmental Science & Technology, 2003, 37(7): 1268-1276. |
| [36] | Warr LN, Schlüter M, Schauer F, Olson GM, Basirico LM, Portier RJ. Nontronite-enhanced biodegradation of deepwater horizon crude oil by Alcanivorax borkumensis. Applied Clay Science, 2018, 158: 11-20. DOI:10.1016/j.clay.2018.03.011 |
| [37] | Shen SY, Stucki JW, Boast CW. Effects of structural iron reduction on the hydraulic conductivity of Na-smectite. Clays and Clay Minerals, 1992, 40(4): 381-386. DOI:10.1346/CCMN |
| [38] | Kostka JE, Wu J, Nealson KH, Stucki JW. The impact of structural Fe(Ⅲ) reduction by bacteria on the surface chemistry of smectite clay minerals. Geochimica et Cosmochimica Acta, 1999, 63(22): 3705-3713. DOI:10.1016/S0016-7037(99)00199-4 |
| [39] | Jaisi DP, Dong HL, Kim J, He ZQ, Morton JP. Nontronite particle aggregation induced by microbial Fe(Ⅲ) reduction and exopolysaccharide production. Clays and Clay Minerals, 2007, 55(1): 96-107. DOI:10.1346/CCMN.2007.0550108 |
 2019, Vol. 59
2019, Vol. 59