中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 孙晶晶, 余诚峰, 付紫玉, 连宾. 2019
- Jingjing Sun, Chengfeng Yu, Ziyu Fu, Bin Lian. 2019
- 过表达Na, K-ATPase基因增强了黑曲霉对硅灰石的风化能力
- Overexpression of Na, K-ATPase gene enhanced the weathering ability of Aspergillus niger to wollastonite
- 微生物学报, 59(6): 1164-1173
- Acta Microbiologica Sinica, 59(6): 1164-1173
-
文章历史
- 收稿日期:2018-08-02
- 修回日期:2018-10-29
- 网络出版日期:2018-11-29
硅酸盐矿物(如长石、云母和辉石)是构成地壳和地幔的主要矿物,是土壤矿物的重要组成部分[1]。硅酸盐矿物风化包括物理风化作用、化学风化作用以及生物风化作用,通常表现为多种因子的综合效应[2-4]。硅酸盐矿物的风化会伴随碱性离子的溶出,以及大气CO2的固定[1, 5-6]。因此,硅酸盐矿物风化作用对大气CO2浓度乃至地表环境有重要影响[7-8]。微生物能适应地球表面的多种环境,对地表矿物的风化广泛发生[9-10],地表岩石和矿物的微生物风化作用在促进土壤形成和演化、提高农作物产量、环境废弃物利用以及生物冶金等都有重要利用价值[11]。然而,硅酸盐矿物的风化作用进程缓慢,如何加速矿物风化是迫切需要研究解决的科学问题。目前,微生物风化硅酸盐矿物的研究已有诸多报道[12-15],但绝大部分都处在细胞水平上,例如微生物通过分泌酸性物质、多糖和有机螯合物等促进矿物溶解释放矿质离子,真菌还能通过其菌丝体的穿插和包裹作用破坏矿物晶体结构等。但是,很多问题并不能得到很好地解释,例如,有哪些基因参与了微生物的生长代谢活动,通过何种途径参与到矿物风化的过程中。这些问题需要在基因表达与代谢调控水平上来展开研究解决。目前已有学者开始关注矿物风化过程中微生物基因表达与代谢调控,尝试从分子水平解析微生物与矿物相互作用的过程和机理,从而能利用基因操作方法提高微生物对矿物的风化效率。例如,微生物的碳酸酐酶参与对碳酸盐矿物和硅酸盐矿物的风化[16-18];黑曲霉在风化含钾硅酸盐矿物的过程中漆酶和半胱氨酸酶等相应基因的表达会提高[19-20];风化含钾矿物过程中,烟曲霉的金属离子结合蛋白(如锌指类蛋白和钙调磷酸酶结合蛋白等)基因表达提高[21],且漆酶的高表达,直接或间接提高了黑曲霉对矿物的风化作用。然而,涉及微生物风化矿物的分子调控机制研究仍有待进一步深入。
Wang等[2]通过RT-qPCR发现黑曲霉在风化含钾硅酸盐矿物过程中NKA α1基因表达量显著上调,是正常培养环境下(含K+条件下)的447.6倍。钠钾ATP酶(NKA),即钠钾泵,存在于真核细胞膜脂质双分子层中,具有离子通道载体和生物酶特性,将ATP释放的能量转化为跨膜电化学势,逆浓度将2个K+泵入和3个Na+泵出细胞,调节细胞膜内外离子浓度差和细胞渗透压,维持细胞的体积和外形。该酶主要由α和β亚基形成异源二聚体。其中,α亚基主要参与ATP催化反应,释放能量促进钠和钾的运输,β亚基发挥调节作用,它从内质网运输至质膜,稳定α亚基蛋白质构型,调节其活性[22-25]。黑曲霉已被证实对多种硅酸盐矿物都有显著的风化效果[18, 26-28],但黑曲霉NKA对硅酸盐矿物风化的机理研究尚未见报道。
硅灰石是含钙硅酸盐矿物,自然界产出的硅灰石一般为针状,呈纤维状或放射状集合体。其热稳定性及尺寸稳定性良好,耐化学腐蚀,且纯度高,硬度适中,在中性水中的溶解度极低[29]。因此硅灰石较为适合代表硅酸盐矿物应用于黑曲霉风化研究。
本文通过构建黑曲霉NKA α1基因过表达菌株,用其风化硅灰石,并与野生型菌株作比较,分析论证黑曲霉NKA α1基因是否能增强对硅酸盐矿物的风化作用,进一步丰富和完善硅酸盐矿物微生物风化理论,从而为农业生产和工业实践提供理论基础。
1 材料和方法 1.1 菌种及矿物材料 1.1.1 菌种及培养基: 黑曲霉菌株,从中国普通微生物菌种保藏管理中心购买,保藏号3.3928。培养黑曲霉产孢采用YAG培养基(1 L):Glucose 20 g,Yeast extract 5 g,Trace elements 1 mL,(固体添加Agar powder 20 g),加超纯水充分溶解至1 L。培养大肠杆菌采用LB培养基(1 L):Tryptone 10 g,Yeast extract 5 g,NaCl 10 g,加1 L超纯水充分溶解,调整pH值至7.0。筛选含重组质粒的黑曲霉采用SMM培养基(1 L):Glucose 10 g,20×Nitrate salts 50 mL,Trace elements 1 mL,Sorbitol 218.6 g,Yeast extract 1 g (固体添加Agar powder 16 g),加1 L超纯水充分溶解,pH值调至6.5。风化所用液体培养基采用查氏培养基(1 L)[30],即:Sucrose 30 g,NaNO3 3 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,KCl 0.5 g,K2HPO4·H2O 1 g。添加50 mmol/L的Maltose诱导基因过表达,加1 L超纯水充分溶解后调整pH值为6.5。 1.1.2 供试矿物: 硅灰石样品由中国科学院地球化学研究所提供,其化学式为Ca3Si3O9,呈白色,XRD分析该矿物试样,主要为硅灰石。X-ray fluorescence (XRF)分析其化学组成:SiO2 50.71%,CaO 47.61%,MgO 1.20%,TFe2O3 0.36%,P2O5 0.05%,SrO 0.04%,MnO 0.02%,ZnO 0.01%。硅灰石矿粉试样研磨过100–200目筛,用超纯水和无水乙醇清洗去除矿物表面吸附的杂质,烘干备用。 1.2 黑曲霉NKA α1基因过表达菌的构建、筛选和鉴定 1.2.1 NKA α1基因过表达载体构建: 过表达载体为丝状真菌常用表达载体pAN7-1,其中含有氨苄青霉素抗性基因和潮霉素抗性基因,分别用作大肠杆菌和黑曲霉转化菌株的筛选标记。采用葡萄糖淀粉酶基因(glaA)启动子,为诱导型强启动子,在有麦芽糖为碳源的培养条件下过量表达[31]。具体操作如下:(1)构建含glaA启动子的载体:以黑曲霉基因组为模板,PglaA-F,PglaA-R为引物(表 1),PCR获得glaA基因上游2000 bp启动子序列,然后通过酶切位点XbaⅠ和HindⅢ将glaA片段克隆至线性化的pAN7-1质粒,获得含glaA片段的线性质粒。(2)构建含目的基因的重组质粒:用柱式真菌Total RNA抽提纯化试剂盒(Vazyme, China)抽提该菌在查氏培养基液中的菌丝总RNA,OD值检测合格后,用1.5%琼脂糖凝胶电泳检测总RNA的完整性和降解情况,再用HiScript®ⅡQ RT SuperMix for qPCR (+gDNA wiper)试剂盒(Vazyme, China)进行反转录获得黑曲霉的cDNA。根据GenBank (NCBI)黑曲霉NKA α1基因cDNA为模板,设计引物NKA-F、NKA-R (表 1),以黑曲霉cDNA为模板,PCR扩增NKA α1亚基基因。最后利用同源重组酶(ClonExpressTM Ⅱ, Vazyme,China)连接NKA α1亚基基因片段与线性质粒形成重组质粒PglaA-NKA。构建好的载体转入大肠杆菌,在含有氨苄青霉素的LB培养基上生长。挑选正常生长的转化子进行菌落PCR和测序验证,将基因正确连接且没有突变的载体保存作后续实验。| Name | Sequence (5′→3′) |
| NKA-F | ACACCTCAGCACCCAAGCTTATGGACGCGAAGTCAGGCG |
| NKA-R | CGACGGCCAGTGCCAAGCTTCTACCAAGCAAACCTATCCAACAC |
| PglaA-F | CCCAAGCTTGGGTGCTGAG'GTGTAATGATGCTGG |
| PglaA-R | TGGGTGCTGAGGTGTAATGATGCTATGTATCCCTTTCAATTCGG |
| QNKA-F | CGATTCCACGGATGACAACTAC |
| QNKA-R | CAGTCCTTTCTTGGGTTCGC |
| QGAPDH-F | ACAAGGACTGGCGTGGTG |
| QGAPDH-R | ACCGTTCAGGTCGGAGGAG |
1.2.2 转化和筛选: 制备野生型黑曲霉原生质体,参照PEG-原生质体转化法[32]将PglaA-NKA重组质粒转入原生质体,并在含100 μg/mL潮霉素的SMM固体培养基上筛选出正常生长的转化子。 1.2.3 过表达转化子与WT的生理特征比较: (1) 检测高表达转化子和WT菌株的NKA α1基因表达量:分别接等量(108个/mL)高表达NKA α1基因转化子和WT菌株孢子悬液到含麦芽糖查氏培养基中,28 ℃、150 r/min摇床培养2 d,收集菌丝体,去除水分后迅速投入液氮冻存,提RNA并反转录为cDNA,以GAPDH为内参基因(引物见表 1),利用RT-qPCR检测其基因表达量,以WT菌株的该基因表达量为1,比较各过表达转化子相对WT的基因表达量的增加情况。(2)检测高表达转化子和WT菌株的NKA酶活:同时称取0.1 g新鲜干菌丝到匀浆管,加入0.9 mL PBS缓冲液(浓度为10 mmol/L,pH值7.4),用细胞破碎仪破碎,4 ℃、10000 r/min离心20 min,收集0.5 mL上清液,利用NKA酶联免疫试剂盒(Mbbiology,China)测定NKA酶活水平。取NKA α1基因表达量和酶活性均相对较高的菌株,PCR和测序验证基因序列的正确转入,将此转化子记作oeNKA,作后续风化实验。(3)菌落表型对比:分别接等量oeNKA和WT的孢子悬液至固体平板,28 ℃培养2 d,观察菌落表型,以确定NKA α1基因的高表达对菌落表型的影响。 1.3 黑曲霉与硅灰石风化 1.3.1 培养条件: 取oeNKA和WT菌种分别在YAG固体平板上划线扩培,28 ℃培养3 d,用无菌去离子水使孢子悬浮,12000 r/min离心1 min弃上清。以上方法清洗孢子3遍。计数调整两种孢子悬液浓度使其达到一致:血球计数板计数3次,调整孢子悬液浓度为1×108个/mL;平板计数法对两种孢子悬液计数。在250 mL的三角瓶中添加含1 g硅灰石矿物的液体查氏培养基100 mL,115 ℃灭菌20 min。分别接入1 mL oeNKA和WT孢子悬液,对照不接菌。实验组和对照组分别作3个平行。28 ℃ 150 r/min摇床培养,在培养0、2、4、6 d分别取样作后续检测分析。 1.3.2 培养液中黑曲霉与硅灰石相互作用及分析: (1) pH值的测定:利用pH计测定培养不同时间培养液的pH值。(2)生物量测定:用布氏漏斗抽滤,收集菌丝体70 ℃烘干至恒重,称重,质量记为A1,用HNO3和H2O2消解菌丝,8000 r/min离心10 min收集余下矿物,利用烘箱70 ℃烘干至恒重,称重保存,其质量记为A2,菌丝体干重A=A1–A2。(3)上清液和菌丝内不同离子浓度的测定:培养液8000 r/min离心20 min,收集上清液;收集菌丝球,利用烘箱70 ℃烘干至恒重,充分研磨,利用100 mL 1 mol/L EDTA-CH3COONH4溶液超声振荡30 min,8000 r/min离心20 min,取上清[33]。利用火焰原子吸收仪(AA-6300C,Shimadzu)检测上清液和菌丝球内的Ca2+浓度,分别记为B1和B2,培养体系中Ca2+浓度B=B1+B2。(4)原矿和风化后矿物的XRD (BTX-526, Olympus, America)分析:用超纯水清洗硅灰石矿物残渣3次,去除矿物表面可溶性杂质,65 ℃烘干,过100目筛后用于XRD分析。 2 结果和讨论 2.1 黑曲霉NKA α1基因过表达菌株的特征
高表达转化子的NKA α1基因相对表达量和酶活检测结果如图 1所示,筛选所得8个转化子中NKA α1基因表达量与酶活和WT相比均有不同程度的提高。其中,NKA2、NKA6、NKA8转化子中NKA α1基因表达量分别为WT菌株的71、103、131倍(图 1-A)。NKA2、NKA6、NKA8转化子中的NKA酶活分别是WT菌株的1.36、1.76、1.42倍,其中NKA6过表达转化株NKA酶活性均高于WT和其他过表达转化子的酶活(图 1-B),因此选取NKA6转化子作后续风化实验,记作oeNKA。oeNKA和WT在固体平板上的菌落形态相似(图 1-C),说明NKA α1基因高表达不影响菌落形态。

|
| 图 1 NKA α1基因过表达转化子的特征 Figure 1 Overexpression transformants characters of NKA α1 A: Relative expression of NKA α1; B: Enzyme activity; C: Colonial morphology. Data represent the mean±standard deviation (SD) of three independent experiments. |
2.2 硅灰石风化过程中黑曲霉生物量的变化
如图 2所示,黑曲霉在风化硅灰石6 d过程中,生物量不断增高,在0–4 d菌丝生长迅速,4–6 d逐渐变缓到最后保持不变或略有下降。两个菌株WT和oeNKA风化硅灰石时的生物量在不同时期有一定差异。测得oeNKA和WT在2 d的菌丝体质量分别为(0.38±0.02) g和(0.87±0.01) g,oeNKA的菌丝体生物质量显著低于WT,说明此时oeNKA的菌丝体对硅灰石的生物风化作用小于WT。随着时间推移两组的菌丝体生物量差异逐渐缩小,风化6 d后,oeNKA的菌丝体生物量(1.79±0.10) g与WT (1.83±0.08) g相比差异值达到最低。因此,在风化硅灰石的过程中,NKA α1基因的高表达对黑曲霉菌丝体在含硅灰石的查氏培养基中的生长有一定的抑制作用,并且作用强度随着时间推移慢慢减小。NKA α1基因的高表达在代谢调控方面对菌丝生物量影响的研究有待进一步深入。

|
| 图 2 硅灰石风化过程中生物量变化 Figure 2 Biomass changes during wollastonite weathering process Data represent the mean±standard deviation (SD) of three independent experiments. |
2.3 硅灰石风化过程中培养液的pH值
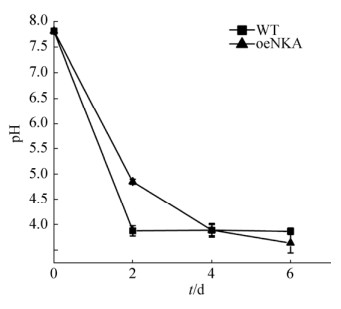
oeNKA与WT菌株风化硅灰石在不同时间的培养液pH值变化情况如图 3所示。含硅灰石的培养液在高温灭菌过后的pH值为7.81。可能是因为前期的高温灭菌导致硅灰石少量溶解释放碱性离子,造成pH值上升。由图 3可知,黑曲霉在含硅灰石矿物的查氏培养基内生长,两组pH值的变化趋势相同,pH值在0–2 d迅速降低,且WT降低趋势较oeNKA更显著,2 d时oeNKA培养液pH值高于WT培养液,可能此时oeNKA菌丝体生物量较低,释放的酸性物质量较少所致;2–4 d,WT变化趋于平稳,oeNKA降低幅度变缓;4–6 d,oeNKA和WT的pH值变化量分别为0.25和0.02,差异值较低,体系逐渐稳定,说明NKA α1基因的高表达对黑曲霉的产酸情况影响不大。oeNKA和WT在前期生长过程中分泌大量酸性物质如草酸、柠檬酸、琥珀酸等,降低培养环境pH值[34]。
|
| 图 3 硅灰石风化过程中培养液的pH值变化 Figure 3 pH changes in culture medium during wollastonite weathering process Data represent the mean±standard deviation (SD) of three independent experiments. |
2.4 硅灰石风化过程中培养体系中的Ca2+浓度
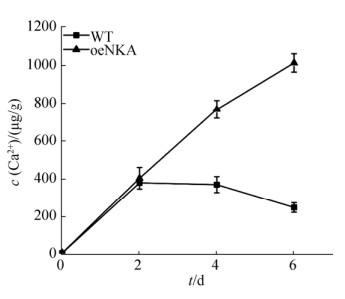
如图 4所示,oeNKA和WT在含硅灰石的查氏培养基中生长6 d,随时间推移风化所释放的Ca2+浓度有不同程度提高(图 4),而pH值迅速降低是造成生物风化释放大量矿质离子的重要因素。oeNKA菌株风化硅灰石释放的Ca2+浓度普遍高于WT菌株,且随着试验的进行,浓度差异越来越明显。第2天测得oeNKA和WT风化硅灰石释放Ca2+总浓度分别为404.28±57.10 μg/g和379.96±13.45 μg/g,没有显著差异。结合图 2可发现,2 d时oeNKA的菌丝体生物量显著低于WT,说明oeNKA对硅灰石的生物风化作用更明显。第4天和第6天oeNKA风化硅灰石释放的Ca2+浓度均显著高于WT,到第6天时oeNKA风化硅灰石释放的Ca2+总浓度是1011.36±47.78 μg/g,约为WT (248.30±25.21 μg/g)的4.07倍。oeNKA在生物量相同或更低,pH值相同的情况下,风化硅灰石释放更多的Ca2+。这说明NKA α1基因的高表达显著提高了对硅灰石的风化能力,并且不是通过物理风化增强和产酸量增加的方式提高的。NKA α1基因的高表达可能直接导致风化能力的提高,或者间接影响其他的某种代谢通路,造成黑曲霉对硅灰石的更强的风化作用。
|
| 图 4 硅灰石风化过程中体系中Ca2+浓度变化 Figure 4 Changes of Ca2+ concentration during wollastonite weathering process Data represent the mean±standard deviation (SD) of three independent experiments. |
在风化硅灰石的过程中,随着培养时间推移,WT培养体系中Ca2+浓度逐渐下降。可能是由于培养体系中Ca2+沉淀形成少量的次生矿物结晶,而oeNKA培养体系中Ca2+浓度依然不断上升,这可能是Ca2+释放速率大于次生矿物的形成速率。黑曲霉作用含钙矿物形成次生矿物草酸钙的研究已有报道[35]。因此,基因工程菌诱导成矿的研究有待进一步深入。
2.5 XRD检测硅灰石风化后成分用XRD分析原始矿物(original)及经过oeNKA和WT风化6 d后的矿物残渣成分后,发现原矿中主要成分为硅灰石(PCPDF号75-1396),纯度高且衍射峰强度大(图 5)。经oeNKA和WT风化后的矿物仍为硅灰石,矿物组成没有明显变化,但风化后硅灰石残渣的主要衍射峰的强度相对original均降低,峰强度大小为original > WT > oeNKA,其中,oeNKA组的衍射峰中部分峰冠几乎消失,说明oeNKA和WT对硅灰石均有一定的风化作用,且oeNKA相较于WT更强。

|
| 图 5 风化后硅灰石残渣和原矿的XRD检测图谱 Figure 5 The detection and analysis of wollastonite and residue after weathering by XRD The arrow express that the peak intensity has obviously decreased or disappeared in the figure. |
硅灰石经WT和oeNKA风化后几乎没有新的峰出现,可能是由于黑曲霉与矿物相互作用产生的新矿物比例较低,或者为无定型矿物,不能被XRD检测到,并且黑曲霉在查氏培养基生长过程中产生酸性物质(图 3),新产生的矿物被溶液中H+攻击而大量消耗又转化为矿质离子。
在风化过程中,NKA α1基因的高表达虽然在一定程度上提高了黑曲霉风化硅灰石的效果,释放更多矿质离子(图 4,5),但相对于WT,整体风化效果没有得到很大提高。这也与连宾等[3-4]指出微生物风化硅酸盐矿物有多种因素综合作用相符合,单独提高一个生物酶基因对整个风化机制的影响可能较小,导致风化效果没有显著提高。因此,探索发现微生物风化新途径,以及研究多种途径在硅酸盐矿物风化中的相互协调作用十分必要。
3 结论本研究构建了黑曲霉NKA α1基因高表达菌株oeNKA,其NKA α1基因表达量和酶活相较于WT均有显著提高。在相同的培养条件下,oeNKA与WT的菌丝体生物量和pH值变化趋势相同。其中2 d的oeNKA的菌丝体生物量显著小于WT,可能导致oeNKA产酸量减少,pH值相对较高。在2–6 d菌丝体生物量差异逐渐缩小,培养体系中pH值也趋于稳定。比较oeNKA和WT风化硅灰石的作用效果,oeNKA风化硅灰石相比WT均释放出更多的矿质离子。XRD图谱显示硅灰石经过oeNKA和WT风化后其矿物成分不变,但衍射峰强度下降,其中oeNKA对硅灰石的风化能力更强。本文研究结果为进一步研究真菌与硅酸盐矿物的相互作用分子机理提供了新的资料。
| [1] | Gadikota G, Fricker K, Jang SH, Park AHA. Carbonation of silicate minerals and industrial wastes and their potential use as sustainable construction materials. ACS Symposium Series, 2015, 1194: 295-322. DOI:10.1021/symposium |
| [2] | Wang WY, Lian B, Pan L. An RNA-sequencing study of the genes and metabolic pathways involved in Aspergillus niger weathering of potassium feldspar. Geomicrobiology Journal, 2015, 32(8): 689-700. DOI:10.1080/01490451.2014.991812 |
| [3] | Lian B, Wang B, Pan M, Liu CQ, Teng HH. Microbial release of potassium from K-bearing minerals by thermophilic fungus Aspergillus fumigatus. Geochimica et Cosmochimica Acta, 2008, 72(1): 87-98. DOI:10.1016/j.gca.2007.10.005 |
| [4] |
Lian B, Fu PQ, Mo DM, Liu CQ. A comprehensive review of the mechanism of potassium releasing by silicate bacteria. Acta Mineralogica Sinica, 2002, 22(2): 179-183.
(in Chinese) 连宾, 傅平秋, 莫德明, 刘丛强. 硅酸盐细菌解钾作用机理的综合效应. 矿物学报, 2002, 22(2): 179-183. DOI:10.3321/j.issn:1000-4734.2002.02.014 |
| [5] | Manning DAC, Renforthc P. Passive sequestration of atmospheric CO2 through coupled plant-mineral reactions in urban soils. Environmental Science & Technology, 2013, 47(1): 135-141. |
| [6] | Montserrat F, Renforth P, Hartmann J, Leermakers M, Knops P, Meysman FJR. Olivine dissolution in seawater:implications for CO2 sequestration through enhanced weathering in coastal environments. Environmental Science & Technology, 2017, 51(7): 3960-3972. |
| [7] | Medaris LG, Driese SG, Stinchcomb GE, Fournelle JH, Lee S, Xu HF, Dipietro L, Gopon P, Stewart EK. Anatomy of a sub-cambrian paleosol in Wisconsin:Mass fluxes of chemical weathering and climatic conditions in North America during formation of the Cambrian great unconformity. Journal of Geology, 2018, 126(3): 261-283. DOI:10.1086/697037 |
| [8] | Hayes SM, Webb SM, Bargar JR, O'Day PA, Maier RM, Chorover J. Geochemical weathering increases lead bioaccessibility in semi-arid mine tailings. Environmental Science & Technology, 2012, 46(11): 5834-5841. |
| [9] | Gorbushina AA. Life on the rocks. Environmental Microbiology, 2007, 9(7): 1613-1631. DOI:10.1111/j.1462-2920.2007.01301.x |
| [10] | Santelli CM, Bach W, Edwards KJ. Microorganisms and the weathering of ocean crust at the seafloor. Geochimica et Cosmochimica Acta, 2006, 70(18): A556. |
| [11] | Wang WY, Sun JJ, Dong CL, Lian B. Biotite weathering by Aspergillus niger and its potential utilisation. Journal of Soils and Sediments, 2016, 16(7): 1901-1910. DOI:10.1007/s11368-016-1388-3 |
| [12] |
Wu T, Chen J, Lian B. Advance in studies on the function of microbes to the weathering of silicate minerals. Bulletin of Mineralogy, Petrology and Geochemistry, 2007, 26(3): 263-268, 275.
(in Chinese) 吴涛, 陈骏, 连宾. 微生物对硅酸盐矿物风化作用研究进展. 矿物岩石地球化学通报, 2007, 26(3): 263-268, 275. DOI:10.3969/j.issn.1007-2802.2007.03.013 |
| [13] | Lian B, Xiao LL, Sun QB. Ecological effects of the microbial weathering of silicate minerals. Acta Geologica Sinica (English Edition), 2017, 91(S1): 150-152. DOI:10.1111/acgs.2017.91.issue-s1 |
| [14] |
Li FC, Li S, Yang YZ, Cheng LJ. Advances in the study of weathering products of primary silicate minerals, exemplified by mica and feldspar. Acta Petrologica et Mineralogica, 2006, 25(5): 440-448.
(in Chinese) 李福春, 李莎, 杨用钊, 程良娟. 原生硅酸盐矿物风化产物的研究进展——以云母和长石为例. 岩石矿物学杂志, 2006, 25(5): 440-448. DOI:10.3969/j.issn.1000-6524.2006.05.008 |
| [15] | Bennett PC, Rogers JR, Choi WJ, Hiebert FK. Silicates, silicate weathering, and microbial ecology. Geomicrobiology Journal, 2001, 18(1): 3-19. DOI:10.1080/01490450151079734 |
| [16] | Xiao LL, Lian B, Hao JC, Liu CQ, Wang SJ. Effect of carbonic anhydrase on silicate weathering and carbonate formation at present day CO2 concentrations compared to primordial values. Scientific Reports, 2015, 5: 7733. DOI:10.1038/srep07733 |
| [17] | Xiao LL, Lian B, Dong CL, Liu FH. The selective expression of carbonic anhydrase genes of Aspergillus nidulans in response to changes in mineral nutrition and CO2 concentration. Microbiologyopen, 2016, 5(1): 60-69. DOI:10.1002/mbo3.2016.5.issue-1 |
| [18] |
Hu J, Lian B, Yu JP, Hu X. Formation of Aspergillus niger-mineral aggregation and characterization of polysaccharide from aggregation. Acta Microbiologica Sinica, 2011, 51(6): 756-763.
(in Chinese) 胡婕, 连宾, 郁建平, 胡星. 黑曲霉-矿物聚集体的形成及其分泌的多糖特性. 微生物学报, 2011, 51(6): 756-763. |
| [19] | Wang WY, Sun QB, Lian B. Redox of fungal multicopper oxidase:A potential driving factor for the silicate mineral weathering. Geomicrobiology Journal, 2018, 35(10): 879-886. DOI:10.1080/01490451.2018.1485065 |
| [20] |
Sun LL, Xiao LL, Xiao B, Wang WY, Pan C, Wang SJ, Lian B. Differences in the gene expressive quantities of carbonic anhydrase and cysteine synthase in the weathering of potassium-bearing minerals by Aspergillus niger. Science China Earth Sciences, 2013, 43(11): 1828-1833.
(in Chinese) 孙蕾蕾, 肖雷雷, 肖波, 王伟英, 潘辰, 王世杰, 连宾. 黑曲霉风化含钾矿石过程中碳酸酐酶和半胱氨酸合成酶基因表达量的差异. 中国科学:地球科学, 2013, 43(11): 1828-1833. |
| [21] | Xiao B, Lian B, Sun LL, Shao WL. Gene transcription response to weathering of K-bearing minerals by Aspergillus fumigatus. Chemical Geology, 2012, 306-307: 1-9. DOI:10.1016/j.chemgeo.2012.02.014 |
| [22] | Mao H, Ferguson TS, Cibulsky SM, Holmqvist M, Ding CM, Fei H, Levitan IB. MONaKA, a novel modulator of the plasma membrane Na, K-ATPase. Journal of Neuroscience, 2005, 25(35): 7934-7943. DOI:10.1523/JNEUROSCI.0635-05.2005 |
| [23] | Xie ZJ, Cai T. Na+-K+-ATPase-mediated signal transduction:from protein interaction to cellular function. Molecular Interventions, 2003, 3(3): 157-168. DOI:10.1124/mi.3.3.157 |
| [24] | Jørgensen PL. Mechanism of the Na+, K+ pump protein structure and conformations of the pure (Na++K+)-ATPase. Biochimica et Biophysica Acta, 1982, 694(1): 27-68. DOI:10.1016/0304-4157(82)90013-2 |
| [25] | Lingrel JB, Williams MT, Vorhees CV, Moseley AE. Na, K-ATPase and the role of α isoforms in behavior. Journal of Bioenergetics and Biomembranes, 2007, 39(5/6): 385-389. |
| [26] | Wucherpfennig T, Lakowitz A, Driouch H, Krull R, Wittmann C. Customization of Aspergillus niger morphology through addition of talc micro particles. Journal of Visualized Experiments, 2012(61): 4023. |
| [27] |
Tan Y, Dong FQ, Dai QW. Study on leaching of cobalt and nickel from tail-serpentine by Aspergillus niger. Journal of Mineralogy and Petrology, 2009, 29(3): 115-119.
(in Chinese) 谭媛, 董发勤, 代群威. 黑曲霉菌浸出蛇纹石尾矿中钴和镍的实验研究. 矿物岩石, 2009, 29(3): 115-119. DOI:10.3969/j.issn.1001-6872.2009.03.017 |
| [28] |
Chen S, Liu CQ, Lian B. Effect of a strain of Aspergillis niger on weathering of phosphorite. Acta Mineralogica Sinica, 2009, 29(1): 103-108.
(in Chinese) 谌书, 刘丛强, 连宾. 一株黑曲霉对磷矿石的风化作用. 矿物学报, 2009, 29(1): 103-108. DOI:10.3321/j.issn:1000-4734.2009.01.017 |
| [29] |
Xu WC. Study on several plastics of reinforcing modification by inorganic filler wollastonite. Journal of East China Geological Institute, 1994, 17(1): 46-50.
(in Chinese) 徐伟昌. 无机填料硅灰石对几种塑料的增强改性研究. 华东地质学院学报, 1994, 17(1): 46-50. |
| [30] |
Ma F, Zhang S, Shan D. Optimization of the medium composition for culturing of mycelia pellet of Aspergillus niger Y3. China Environmental Science, 2008, 28(11): 989-993.
(in Chinese) 马放, 张斯, 山丹. 黑曲霉Y3菌丝球培养基成分优化. 中国环境科学, 2008, 28(11): 989-993. DOI:10.3321/j.issn:1000-6923.2008.11.006 |
| [31] | Ganzlin M, Rinas U. In-depth analysis of the Aspergillus niger glucoamylase (glaA) promoter performance using high-throughput screening and controlled bioreactor cultivation techniques. Journal of Biotechnology, 2008, 135(3): 266-271. |
| [32] | Osmani SA, May GS, Morris NR. Regulation of the mRNA levels of nimA, a gene required for the G2-M transition in Aspergillus nidulans. Journal of Cell Biology, 1987, 104(6): 1495-1504. DOI:10.1083/jcb.104.6.1495 |
| [33] |
Zhang YG, Xiao M, Dong YH, Jiang Y. Determination of soil exchangeable base cations by using atomic absorption spectrophotometer and extraction with ammonium acetate. Spectroscopy and Spectral Analysis, 2012, 32(8): 2242-2245.
(in Chinese) 张玉革, 肖敏, 董怡华, 姜勇. 乙酸铵浸提原子吸收光谱法同时测定土壤交换性盐基离子组成. 光谱学与光谱分析, 2012, 32(8): 2242-2245. DOI:10.3964/j.issn.1000-0593(2012)08-2242-04 |
| [34] |
Huang XJ, Diao NN, Zhang JG. Review on the formation of Aspergillus niger pellets and its application. Food and Fermentation Industries, 2014, 40(11): 171-176.
(in Chinese) 黄勋娟, 刁宁宁, 张建国. 黑曲霉菌丝球的形成及应用研究综述. 食品与发酵工业, 2014, 40(11): 171-176. |
| [35] |
Chen S, Zheng HY. The role of microorganism in the weathering of phosphorite rock:A case study of Aspergillus niger strain. Ecology and Environment, 2007, 16(3): 1007-1013.
(in Chinese) 谌书, 郑厚义. 磷矿石的微生物风化作用——以一株黑曲霉(Aspergillus niger)为例. 生态环境学报, 2007, 16(3): 1007-1013. DOI:10.3969/j.issn.1674-5906.2007.03.059 |
 2019, Vol. 59
2019, Vol. 59