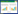中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李学恭, 张维佳, 周丽红, 蔡凤海, 吴龙飞. 2019
- Xuegong Li, Weijia Zhang, Lihong Zhou, Fenghai Cai, Longfei Wu. 2019
- 不同降压过程对深海海水中可培养细菌群落组成的影响
- Effect of different depressurization process on cultivable bacterial community composition of deep-sea water
- 微生物学报, 59(6): 1026-1035
- Acta Microbiologica Sinica, 59(6): 1026-1035
-
文章历史
- 收稿日期:2018-07-25
- 修回日期:2018-09-17
- 网络出版日期:2018-10-19
2. 中国科学院深海科学与工程研究所, 中科院深海极端环境模拟重点实验室, 海南 三亚 572000;
3. 中-法趋磁多细胞生物进化与发育联合实验室, 法国 马赛 13402/中国 海南 三亚 57200;
4. 中国科学院深海科学与工程研究所工程实验室, 海南 三亚 572000;
5. Aix-Marseille Université, CNRS, Marseille 13402, France
2. CAS Key Laboratory for Experimental Study under Deep-sea Extreme Conditions, Institute of Deep-sea Science and Engineering, Chinese Academy of Sciences, Sanya 572000, Hainan Province, China;
3. International Associated Laboratory of Evolution and Development of Magnetotactic Multicellular Organisms, CNRS-Marseille 13402 France, CAS, Sanya 572000, Hainan Province, China;
4. Engineering Laboratory of Engineering Department, Institute of Deep-sea Science and Engineering, Chinese Academy of Sciences, Sanya, 572000, Hainan Province, China;
5. Aix-Marseille Université, CNRS, Marseille 13402, France
深海是典型的高静水压环境,压力随水深增加而逐渐增高。深海平均压力约为380 bar,其最深处的压力可达1100 bar[1-2]。研究发现,深海生物圈中蕴含丰富的微生物资源,其生物量约为2.9×1029 cells,几乎可以和陆地环境的样品相媲美[3]。而且,深海微生物在适应深海极端环境的过程中,有可能进化出独特的适应策略,例如深海微生物在高压条件下细胞膜的不饱和脂肪酸含量增加、具有感受压力变化的OmpH/OmpL调控系统、在不同压力下使用不同的呼吸系统和鞭毛系统[4-5]。深海微生物在与环境协同演化过程中,还产生了特殊的次级代谢产物,具有潜在的利用价值,如表现出良好的抗肿瘤、抗菌以及抗细胞纤维化等活性[6]。此外,深海微生物还是海洋生态环境的生产者和分解者,在海洋环境中的物质、能量代谢以及生物地球化学循环中发挥着重要的作用[7-8]。因此,开展深海极端微生物的研究,具有重要的科学意义。
通过改进培养和筛选方法已经从深海环境中获得了大量的可培养微生物,其中已分离到的嗜压细菌主要分布在γ-变形菌类群中的Shewanella、Psychromonas、Photobacterium、Colwellia、Thioprofundum及Moritella等属,以及部分δ-变形菌类群和α-变形菌类群中;深海高温嗜压古菌主要分离自Pyrococcus、Thermococcus和Methanococcus等属[8]。尽管对培养和筛选方法进行了改进,用于获得新种属的海洋微生物,但是效果并不理想。无法在实验室模拟深海极端环境参数,可能是造成该局面的原因之一。近年来,国内外的科学家通过高压富集和高压分离的方法,从4200 m水深的深海热液喷口[9]以及10898 m水深的马里亚纳海沟挑战者深渊[10]获得了严格依赖于高压生长的深海嗜压微生物,这也意味着通过模拟深海高压环境,有助于深海微生物的获取。
深海样品的获取是研究深海微生物的前提条件。通常通过Niskin采水瓶、Pushcore采样器、箱式采样器、多管采样器以及重力柱等常规手段来获取样品[11]。这些深海采样技术具有2个共同的局限性:第一,这些采样器未预先进行无菌处理,例如Niskin采水瓶保持开启状态直到指定深度关闭,因而所得样品并非都是来自于所设计的位点,上述情况会影响基于PCR扩增的微生物分析;第二,样品从海底回收至甲板的过程中,经历了长期、缓慢的压力降低过程。而生存于深海高压环境中的微生物,已经适应了该极端高压环境,压力降低会对其细胞膜功能、生物大分子结构及功能、基因的转录及翻译等过程产生不利影响[5]。因此,为了获得高质量的深海样品,则必须要求采样过程中尽量减少压力波动,避免压力变化对样品中微生物生理特性的影响。近年来,用于保压采水和采集沉积物的保压采样器已逐步应用于深海科考中。保压采样器通常搭载载人/无人潜水器或者CTD采水器进行水下作业,在回收至甲板的过程中,保压采样器自带的压力补偿器使样品维持稳定的原位压力[12-14],避免了压力波动对样品的影响,极大地提高了深海样品的研究价值。
相较于常规采样手段,保压采样方式获得的样品可以更真实地反映原位条件下的细胞状态。Tamburini等[12]分析了压力变化对深海海水样品中微生物氨肽酶和磷酸酶活性的影响,发现保压采集的样品的酶活力要高于常规非保压方式采集的样品。Edgcomb等[15]利用微生物原位富集固定装置获得原位固定后的微生物样品,并与非保压的Niskin采水瓶获得的样品进行比较,发现原位固定的样品中不同COG (Cluster of orthologous groups of proteins)类群的基因表达量均高于非保压的样品。这些结果说明,不同采样方式造成的压力变化影响了样品中微生物细胞的酶活力和基因表达。因此,我们推测常规不保压采样方式,也可能会对样品中可培养微生物的多样性产生影响。
TMAO既是微生物常用的能源物质,还是1种渗透压保护剂[16-18]。已有研究发现,多种海洋来源的细菌可以利用TMAO作为电子受体,通过厌氧呼吸获得能量进行生长[19-20]。而且,对于部分菌株而言,TMAO还提升了其压力耐受性[21]。TMAO还原成TMA(Trimethylamine)的代谢过程,已被证实可以提升细菌的压力耐受性[21]。
本文利用保压采水器从马里亚纳海沟挑战者深渊北坡6001 m深度采集保压海水样品,通过保压转移和可控速降压装置在实验室中模拟常规非保压以及保压2种样品采集过程中的压力变化,分析不同压力变化过程对深海样品中可培养细菌多样性的影响。此外,也分析了添加TMAO对不同降压样品中可培养细菌多样性的影响。
1 材料和方法 1.1 采样位点在2016年“探索一号”马里亚纳海沟深海装备海试及科考航次期间,利用船载CTD采水设备搭载深海原位保压采水器(TOP INDUSTRIE),在马里亚纳海沟挑战者深渊北坡(经纬度:141°30.00ʹE,11°24.00ʹN,采样深度6001 m,站位水深6964 m)获得了500 mL原位保压海水样品。
1.2 样品的保压转移分析不同降压过程对样品中微生物组成的影响,要求样品从采集、保存及富集过程均要维持原位压力。为此在实验室搭建了一套保压转移装置,通过加压泵和限压阀控制整个系统的压力以及转移速率(图 1-A)。具体过程如下:在进行保压转移之前,先将高压釜加压至与保压采水瓶相同的压力,同时设定限压阀的阈值压力与保压采水瓶相同。保压转移时,在加压泵的增压作用下,加压泵到保压采水瓶活塞前端之间管路的压力逐渐升高,高于保压海水的压力后推动活塞运动。同时,引起活塞后端至限压阀之间管路的压力升高,并触发限压阀开启,排出液体维持系统的压力稳定在设定值。在加压泵的持续推动下,样品从保压采水瓶转移到高压釜中,而且转移过程中维持了采样时的压力(图 1-B)。限压阀排出水的体积反映了被转移海水样品的体积。当达到欲转移的体积时,停止加压。关闭保压采水瓶和高压釜的阀门,完成保压转移。
|
| 图 1 保压转移系统(A)及工作原理示意图(B) Figure 1 Pressure-retaining transfer system (A) and operation schematic diagram (B) |
通过上述保压转移装置进行保压转移。在外部高压泵的压力推动下,分别向装有2216E以及2216E+TMAO (0.1%)培养基的高压釜中转移15 mL海水样品。转移过程中,实时监测样品压力变化,保持整个系统压力稳定在600 bar左右,在1 min时间内,由保压采水瓶向高压釜中转移了约15 mL的样品。
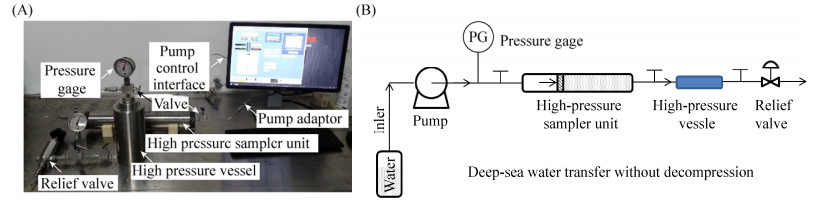
1.3 样品不同降压速率处理为了分析不同的降压过程对微生物多样性的影响,将上述样品分为两组,其中一组模拟保压采水器回收至实验室取样时样品所经历的压力变化过程,直接打开高压釜阀门,进行短时间快速降压;另外一组模拟非保压采水装置(如Niskin采水瓶)的压力变化过程,将高压釜与限压阀连接(图 2-A),设定压力降低速率为–6 bar/min (相当于CTD采水器按照1 m/s速度回收时的压力变化速率)。在实验中,实时监测记录样品压力的变化情况。如图 2-B所示,短时间快速降压时,样品在较短时间内压力由600 bar快速降低至1 bar;而长时间缓慢降压时,样品按照设定速率,在100 min时间内,压力由600 bar稳定降至1 bar。

|
| 图 2 深海水样的降压处理原理图(A)和降压曲线图(B) Figure 2 Deep-sea water depressurized with different rates. A: operation schematic diagram; B: curve of sample depressurization process |
1.4 深海水样的平板涂布与培养
降压处理的样品经过室温条件富集后,分别取200 μL涂布2216E (Dfico, USA)和2216E+ TMAO (Sigma,美国) (0.1%,W/V)固体培养基平板[22],20 ℃培养3 d,每个样品涂布3个平板。观察平板中菌落形态,对菌落大小、颜色、边缘特征、透明度等方面进行描述。
1.5 菌株的分离、纯化及保藏根据形态特征,挑取平板中不同形态的单菌落,在相应的2216E和2216E+TMAO培养基中划线分离纯化,接种2216E液体培养基,用含20%的甘油冻存管–80 ℃保藏。
1.6 16S rRNA基因扩增及分离菌株鉴定采用煮沸法提取菌株的基因组DNA,选择27F/1492R通用引物(27F:5′-AGAGTTTGATCCT GGCTCAG-3′;1492R:5′-TACGGTTACCTTGTTA CGACTT-3′),扩增菌株的16S rRNA基因(PCR程序:98 ℃预变性30 s;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸1.5 min,30个循环;72 ℃继续延伸10 min,于4 ℃保存),PCR产物进行琼脂糖凝胶电泳后,送往生工生物工程(上海)股份有限公司进行测序。所得16S rRNA基因序列在NCBI数据库中进行BLAST比对分析。
2 结果和分析 2.1 不同降压速率对可培养细菌群落组成的影响深海水样品经过不同降压速率处理后,其中可培养细菌的丰度及其种群多样性均有差别。短时间快速降压的样品中,可培养细菌的平均丰度为437 CFU/mL,而长时间慢速降压的样品中可培养细菌平均的丰度为190 CFU/mL,短时间快速降压处理的样品中可培养细菌的平均丰度明显高于长时间慢速降压处理的样品。可培养细菌的多样性在2种降压方式处理的样品中,也有明显差异。短时间快速降压后的样品中有5种菌落形态(表 1,E1–E5),包括4个属的细菌(图 3),分别为Bacillus kochii (占总菌落数的24.4%)、Achromobacter xylosoxidans (24.4%)、Microbacterium sp. RA11 (34.4%)以及Pseudomonas stutzeri (13.7%) (表 1)。而长时间慢速降压样品中,尽管有7种不同的菌落形态(表 1,E3-E9),但主要以Bacillus属细菌为主(图 3),约占总菌落数的96%,Bacillus oceanisediminis为其主要类群(表 1)。
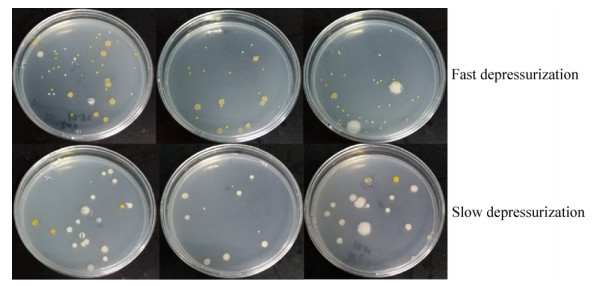
|
| 图 3 不同降压过程处理后深海水样中的微生物菌落 Figure 3 Bacterial colonies from deep-sea water sample with different depressurization process |
| No.* | Colony characteristics | Gram -staining | 16S rRNA gene sequence analysis** |
Fast decompression/ (CFU/mL) |
Slow decompression/ (CFU/mL) |
|||||||
| Color | Shape | Size | Edge | (+/–) | ||||||||
| E1 | Pink | Round | Small | Smooth | + | Bacillus kochii (99%) | 110 | 130 | 80 | – | – | – |
| E2 | Milky white | Round | Small | Smooth | – | Achromobacter xylosoxidans (99%) | 50 | 170 | 100 | – | – | – |
| E3 | Bright yellow | Round | Small | Smooth | + | Microbacterium sp. RA11 (100%) | 150 | 110 | 190 | 10 | 0 | 0 |
| E4 | Orange | Irregular | Large | Wrinkle | – | Pseudomonas stutzeri (100%) | 80 | 80 | 20 | 0 | 0 | 10 |
| E5 | Milky white | Irregular | Large | Villiform | + | Bacillus sp. J2-13 (99%) | 20 | 0 | 20 | 10 | 0 | 40 |
| E6 | Milky white | Round | Large | Smooth | + | Bacillus oceanisediminis (99%) | – | – | – | 70 | 150 | 140 |
| E7 | Milky white | Round | Middle | Smooth | + | Bacillus niabensis (99%) | – | – | – | 20 | 30 | 10 |
| E8 | Light yellow | Round | Large | Smooth | + | Bacillus horikoshii (99%) | – | – | – | 30 | 0 | 10 |
| E9 | Milky white | Round | Small | Smooth | + | Bacillus firmus (100%) | – | – | – | 10 | 20 | 10 |
| “*”: E indicated that the bacteria strain isolated from 2216E media. “**”: the percentage showed the identity value of 16S rRNA gene by alignment with NCBI database. | ||||||||||||
比较2种降压方式处理的样品,发现可培养细菌类群与降压方式有一定的相关性(表 1)。Bacillus kochii和Achromobacter xylosoxidans仅在短时间快速降压样品中出现。而Bacillus oceanisediminis、Bacillus niabensis、Bacillus horikoshii和Bacillus firmus仅在长时间降压样品中出现。此外,Microbacterium sp. RA11、Pseudomonas stutzeri以及Bacillus sp. J2-13则在2种方式降压样品中均有出现,其中Microbacterium sp. RA11和Pseudomonas stutzeri主要出现在短时间快速降压样品中,Bacillus sp. J2-13在2种样品中均少量存在。
2.2 TMAO对不同降压速率样品中可培养细菌组成的影响添加TMAO后,长时间慢速降压的样品中可培养细菌的平均丰度为203 CFU/mL,短时间快速降压的样品中可培养细菌的平均丰度为473 CFU/mL。与2216E培养基相比,二者可培养细菌的丰度没有显著变化(P > 0.1)。
然而,添加TMAO改变了2种方式降压样品中可培养细菌的群落组成(图 4,表 2)。对于短时间快速降压样品,添加TMAO后,Brevundimonas diminuta丰度增加,成为其中的主要类群之一;但在TMAO培养基中,未检测到Achromobacter xylosoxidans细菌。而对于长时间慢速降压样品,添加TMAO后,其中的优势类群则由Bacillus oceanisediminis变为Bacillus firmus (表 2)。此外,添加TMAO使得样品中可培养细菌由4个属增加至6个属,如Agrococcus属和Paenibacillus属细菌得到了富集(表 2)。添加TMAO还对部分菌株的丰度产生了明显的影响。如添加TMAO后,Bacillus firmus菌株的数量由平均13.3 CFU/mL增加为110 CFU/mL (P < 0.005)。相反地,Bacillus oceanisediminis菌株的则在TMAO培养基中没有检测到。
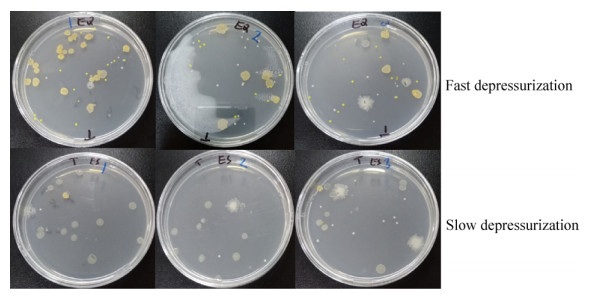
|
| 图 4 添加TMAO后不同降压速率样品中可培养细菌菌落形态 Figure 4 Bacterial colonies from deep-sea water sample added TMAO with different depressurization process |
| No.* | Colony characteristics | Gram -staining | 16S rRNA sequence analysis** |
Fast decompression/ (CFU/mL) |
Slow decompression/ (CFU/mL) |
|||||||
| Color | Shape | Size | Edge | |||||||||
| T1 | Bright yellow | Round | Small | Smooth | + | Microbacterium sp. RA11(99%) |
140 | 120 | 180 | – | – | – |
| T2 | Pink | Round | Small | Smooth | + | Bacillus kochii | 80 | 50 | 10 | – | – | – |
| T3 | Milky white | Irregular | Large | Smooth | + | Bacillus sp. J2-13(99%) | 10 | 0 | 10 | – | – | – |
| T4 | Greyish white | Round | Large | Radial | + | Bacillus oceanisediminis (100%) |
0 | 0 | 10 | – | – | – |
| T5 | Light white | Round | Small | Smooth | – | Brevundimonas diminuta (100%) |
90 | 260 | 150 | 30 | 20 | 90 |
| T6 | Orange | Irregular | Large | Wrinkle | – | Pseudomonas stutzeri (100%) |
210 | 60 | 30 | 10 | 0 | 10 |
| T7 | Light white | Irregular | Small | Smooth | + | Bacillus sp. CU040510-015 (99%) |
10 | 0 | 0 | 10 | 20 | 20 |
| T8 | Greyish white | Round | Large | Smooth | + | Bacillus firmus (100%) | – | – | – | 110 | 130 | 90 |
| T9 | Milky white | Irregular | Large | Smooth | + | Bacillus sp. BJ-21(99%) | – | – | – | 10 | 10 | 20 |
| T10 | Light yellow | Round | Small | Smooth | + | Agrococcus sp. PLB098 (99%) |
– | – | – | 10 | 0 | 10 |
| T11 | White | Round | Middle | Smooth | + | Paenibacillus sp. CIFT MFB 4537(99%) |
– | – | – | 10 | 0 | 0 |
| “*”: T indicated that the bacteria strain isolated from 2216E plus TMAO media. “**”: the percentage showed the identity value of 16S rRNA gene by alignment with NCBI database. | ||||||||||||
3 讨论
本实验中采用原位保压采水器获得了无污染、高保真的海水样品,从样品采集、运输到实验室的保压转移分装,均没有经历大的压力波动,这为后续分析采样方式不同造成的压力波动对微生物多样性的影响提供了可能。通过在实验室模拟不同采样方式产生的压力变化情况,我们发现短时间快速降压处理的样品相对于长时间慢速降压处理的样品具有更高的可培养细菌丰度以及种群多样性,这也表明利用原位保压采水器进行采样,更有利于获得不同种类的深海细菌。
长期生存于深海环境下的细菌,其细胞膜脂组成、基因的转录、蛋白的表达更适应于高静水压环境,压力的降低可能会影响细胞的生理状态[5]。如来源于深海的Shewanella benthica在50 MPa的压力条件下可以正常进行分裂,而随着压力的降低,细胞停止分裂,变为细长的丝状结构[11]。我们发现不同的降压方式处理后,样品中微生物群落结构有较大的差异。慢速降压处理后,样品中绝大部分为革兰氏阳性菌,占到了可培养细菌的98%以上。而快速降压处理的样品中,革兰氏阳性细菌的平均比例约为61%。革兰氏阴性细菌和阳性细菌的细胞壁的组分存在较大的差异,革兰氏阳性细菌细胞壁较厚,含有致密交联的肽聚糖层,而且与细胞膜的外层紧密相连;而革兰氏阴性细菌细胞壁较薄,肽聚糖层薄且交联度差。这种差异使得革兰氏阳性菌的细胞壁刚性要强于革兰氏阴性菌,这可能导致了革兰氏阳性菌比革兰氏阴性菌对压力的变化具有更强的耐受性。
深海虽然是一个相对寡营养的环境,但是深海鱼类组织中含有较高浓度的TMAO,鱼死亡后可以提供局部的高浓度TMAO环境[16, 23]。具有利用TMAO能力的细菌,则具有更好的生存竞争力[19, 21]。本文研究发现在培养基中添加TMAO后,增加了可培养细菌的多样性。如未添加TMAO的样品经长时间降压后,共分离到3个属的细菌,而且96%为Bacillus属细菌;而添加TMAO以后,可培养细菌多样性增加到5个属,而且Bacillus属细菌所占的比例下降为68.9%,其他属细菌的量明显增加。而且,本文还发现添加TMAO后,Brevundimonas diminuta细菌的生存能力大幅提升,由原来的难以分离增加到167 CFU/mL。Bacillus firmus菌株的数量由平均13.3 CFU/mL增加为110 CFU/mL,具有显著性差异(P < 0.005)。这也进一步表明,在深海细菌的分离过程中,通过添加以TMAO为代表的底物,可以提高特定种群的分离效率。
深海细菌的分离对于研究细菌高压适应机制以及开发利用深海细菌资源具有重要的意义。本研究利用保压采样、保压转移以及模拟降压的方法,探讨了不同采样方式造成的压力变化对深海水样中可培养细菌多样性的影响。考虑到深海是典型的高压环境,我们认为利用原位保压采水装置获得高保真的深海海水样品,并且减少样品经历的压力变化时间,有助于提升深海细菌的获取效率。本文为高效的分离获得深海细菌提供了新的思路。
| [1] | Fang JS, Zhang L, Bazylinski DA. Deep-sea piezosphere and piezophiles:geomicrobiology and biogeochemistry. Trends in Microbiology, 2010, 18(9): 413-422. DOI:10.1016/j.tim.2010.06.006 |
| [2] | Abe F, Kato C, Horikoshi K. Pressure-regulated metabolism in microorganisms. Trends in Microbiology, 1999, 7(11): 447-453. DOI:10.1016/S0966-842X(99)01608-X |
| [3] | Orcutt BN, Sylvan JB, Knab NJ, Edwards KJ. Microbial ecology of the dark ocean above, at, and below the seafloor. Microbiology and Molecular Biology Reviews, 2011, 75(2): 361-422. DOI:10.1128/MMBR.00039-10 |
| [4] | Simonato F, Campanaro S, Lauro FM, Vezzi A, D'Angelo M, Vitulo N, Valle G, Bartlett DH. Piezophilic adaptation:a genomic point of view. Journal of Biotechnology, 2006, 126(1): 11-25. |
| [5] | Oger PM, Jebbar M. The many ways of coping with pressure. Research in Microbiology, 2010, 161(10): 799-809. DOI:10.1016/j.resmic.2010.09.017 |
| [6] | Kamjam M, Sivalingam P, Deng ZX, Hong K. Deep sea actinomycetes and their secondary metabolites. Frontiers in Microbiology, 2017, 8: 760. DOI:10.3389/fmicb.2017.00760 |
| [7] | Azam F, Malfatti F. Microbial structuring of marine ecosystems. Nature Reviews Microbiology, 2007, 5(10): 782-791. DOI:10.1038/nrmicro1747 |
| [8] |
Li XG, Xu J, Xiao X. High pressure adaptation of deep-sea microorganisms and biogeochemical cycles. Microbiology China, 2013, 40(1): 59-70.
(in Chinese) 李学恭, 徐俊, 肖湘. 深海微生物高压适应与生物地球化学循环. 微生物学通报, 2013, 40(1): 59-70. |
| [9] | Zeng X, Birrien JL, Fouquet Y, Cherkashov G, Jebbar M, Querellou J, Oger P, Cambon-Bonavita MA, Xiao X, Prieur D. Pyrococcus CH1, an obligate piezophilic hyperthermophile:extending the upper pressure-temperature limits for life. The ISME Journal, 2009, 3(7): 873-876. DOI:10.1038/ismej.2009.21 |
| [10] | Kato C, Li L, Nogi Y, Nakamura Y, Tamaoka J, Horikoshi K. Extremely barophilic bacteria isolated from the Mariana Trench, Challenger Deep, at a depth of 11, 000 meters. Applied and Environmental Microbiology, 1998, 64(4): 1510-1513. |
| [11] | Kim S-J, Kato C. Sampling, isolation, cultivation, and characterization of piezophilic microbes//Timmis KN. Handbook of Hydrocarbon and Lipid Microbiology. Berlin, Heidelberg: Springer, 2010: 3869-3881. |
| [12] | Tamburini C, Garcin J, Ragot M, Bianchi A. Biopolymer hydrolysis and bacterial production under ambient hydrostatic pressure through a 2000 m water column in the NW Mediterranean. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2002, 49(11): 2109-2123. DOI:10.1016/S0967-0645(02)00030-9 |
| [13] | Parkes RJ, Martin D, Amann H, Anders E, Holland M, Schultheiss PJ, Wang XW, Dotchev K. Technology for high-pressure sampling and analysis of deep-sea sediments, associated gas hydrates, and deep-biosphere processes//Collett T, Johnson A, Knapp C, Boswell R. Natural Gas Hydrates-Energy Resource Potential and Associated Geologic Hazards. AAPG Memoir, 2009. |
| [14] | Song W, Zhu SQ. Design of hydraulic system for autonomous sampler at deep-sea//Proceedings of 2015 International Conference on Fluid Power and Mechatronics (FPM). Harbin, China:IEEE, 2015: 643-648. |
| [15] | Edgcomb VP, Taylor C, Pachiadaki MG, Honjo S, Engstrom I, Yakimov M. Comparison of Niskin vs. in situ approaches for analysis of gene expression in deep Mediterranean Sea water samples. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2016, 129: 213-222. DOI:10.1016/j.dsr2.2014.10.020 |
| [16] | Petrov E, Rohde PR, Cornell B, Martinac B. The protective effect of osmoprotectant TMAO on bacterial mechanosensitive channels of small conductance MscS/MscK under high hydrostatic pressure. Channels, 2012, 6(4): 262-271. |
| [17] | He HL, Chen XL, Zhang XY, Sun CY, Zou BC, Zhang YZ. Novel use for the osmolyte trimethylamine N-oxide:retaining the psychrophilic characters of cold-adapted protease deseasin MCP-01 and simultaneously improving its thermostability. Marine Biotechnology, 2009, 11(6): 710-716. DOI:10.1007/s10126-009-9185-2 |
| [18] | Saad-Nehme J, Silva JL, Meyer-Fernandes JR. Osmolytes protect mitochondrial F0F1-ATPase complex against pressure inactivation. Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology, 2001, 1546(1): 164-170. DOI:10.1016/S0167-4838(01)00137-6 |
| [19] | Zhang SD, Santini CL, Zhang WJ, Barbe V, Mangenot S, Guyomar C, Garel M, Chen HT, Li XG, Yin QJ, Zhao Y, Armengaud J, Gaillard JC, Martini S, Pradel N, Vidaud C, Alberto F, Médigue C, Tamburini C, Wu LF. Genomic and physiological analysis reveals versatile metabolic capacity of deep-sea Photobacterium phosphoreum ANT-2200. Extremophiles, 2016, 20(3): 301-310. DOI:10.1007/s00792-016-0822-1 |
| [20] | Barrett EL, Kwan HS. Bacterial reduction of Trimethylamine oxide. Annual Review of Microbiology, 1985, 39: 131-149. DOI:10.1146/annurev.mi.39.100185.001023 |
| [21] | Yin QJ, Zhang WJ, Qi XQ, Zhang SD, Jiang T, Li XG, Chen Y, Santini CL, Zhou H, Chou IM, Wu LF. High hydrostatic pressure inducible trimethylamine N-oxide reductase improves the pressure tolerance of piezosensitive bacteria Vibrio fluvialis. Frontiers in Microbiology, 2018, 8: 2646. DOI:10.3389/fmicb.2017.02646 |
| [22] | Yin QJ, Zhang WJ, Li XG, Zhou LH, Qi XQ, Zhang C, Wu LF. Contribution of trimethylamine N-oxide on the growth and pressure tolerance of deep-sea bacteria. CJOL, 2018, 1(2). |
| [23] | Yancey PH, Gerringer ME, Drazen JC, Rowden AA, Jamieson A. Marine fish may be biochemically constrained from inhabiting the deepest ocean depths. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(12): 4461-4465. DOI:10.1073/pnas.1322003111 |
 2019, Vol. 59
2019, Vol. 59