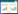中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王智荣, 梅小飞, 杜木英, 江孟遥, 张洪新, 汪开拓, ZsoltZalán, FerencHegyi, 阚建全. 2019
- Zhirong Wang, Xiaofei Mei, Muying Du, Mengyao Jiang, Hongxin Zhang, Kaituo Wang, Zsolt Zalán, Ferenc Hegyi, Jianquan Kan. 2019
- 荧光假单胞菌ZX对采后锦橙绿霉病的防治及其抑菌机制
- Biocontrol of green mold decay in Jincheng citrus fruits by Pseudomonas fluorescens ZX
- 微生物学报, 59(5): 950-964
- Acta Microbiologica Sinica, 59(5): 950-964
-
文章历史
- 收稿日期:2018-10-31
- 修回日期:2019-01-09
- 网络出版日期:2019-03-08
2. 中匈食品科学联合研究中心, 重庆 400715;
3. 农业部农产品贮藏保鲜质量安全风险评估实验室(重庆), 重庆 400715;
4. 重庆三峡学院生命科学与工程学院, 重庆 404100;
5. 匈牙利国家农业研究和创新中心食品科学研究所, 匈牙利 布达佩斯 H-1022
2. Chinese-Hungarian Cooperative Research Centre for Food Science, Chongqing 400715, China;
3. Laboratory of Quality & Safety Risk Assessment for Agro-Products on Storage and Preservation(Chongqing), Ministry of Agriculture, Chongqing 400715, China;
4. College of Life Science and Engineering, Chongqing Three Gorges University, Chongqing 404100, China;
5. Food Science Research Institute of National Agricultural Research and Innovation Center, Budapest H-1022, Hungary
柑橘(Citrus)属芸香科植物,在全球热带、亚热带及其中间型的气候地区均有广泛种植。据统计,世界柑橘年产量已达到1.2亿t,超过苹果、葡萄和香蕉等大宗水果,位居所有水果之首[1]。但柑橘是典型的非跃变型果实,采摘时已接近生理成熟,自身抗病能力较弱,因此柑橘在贮运期间极易受到病原真菌的侵染而暴发大面积的采后病害,其中,由指状青霉(Penicillium digitatum)引起的绿霉病腐烂最为严重,占整个柑橘采后腐烂损失的60%–80%[2-3]。传统控制采后果蔬病害主要依赖于化学杀菌剂,如噻苯咪唑、多菌灵和抑霉唑等,但长期大量使用合成杀菌剂可能导致化学残留、病原菌耐药性增强、环境污染等问题,甚至会降低食品的安全性[4-5]。生物防治,即利用有益微生物或微生物的代谢产物来抑制病原物的生长繁殖,达到防治病害的目的,因其具有安全有效、绿色环保等特点,被认为是最有希望替代化学杀菌剂的方法之一[6-7]。荧光假单胞菌(Pseudomonas fluorescens)广泛分布于植物根际土壤和果蔬表面,施用方便,对人和环境无害,是最具应用价值的一类生防菌[6, 8]。因此,研究P. fluorescens对采后柑橘绿霉病的控制效果,探究P. fluorescens对P. digitatum的作用机制,有助于提高其生防效力,对扩展微生物源杀菌剂途径也具有重要意义。
国内外对P. fluorescens生物防治的研究主要集中在其根际促生作用和对植物病害的防治上,如Ei-Gamal等[9]报道P. fluorescens能分泌大量几丁质酶(chitinase,CHI)、β-1, 3-葡聚糖酶(β-1, 3-glucanase,GLU)和纤维素酶,能强有力地控制马铃薯根腐病;Grobkinsky等[10]研究发现,丧失细胞分裂素合成基因的P. fluorescens G20-18对Pseudomonas syringae的生防效果降低,表明P. fluorescens G20-18产生的细胞分裂素不仅能促进植物生长发育,还能增强生防效力;Prabhukarthikeyan等[11]使用P. fluorescens FP7菌液浸泡姜黄根茎、淋洗土壤,显著提高了姜黄防御酶的活性,有效抑制了根茎腐烂病并促进了姜黄的生长和增产。近年来,一些学者用P. fluorescens成功防治了草莓[12]、番茄[13]、苹果[6, 14]和香蕉[15]等多种果蔬的采后病害,极大地扩展了P. fluorescens的应用范围。
目前,利用P. fluorescens防治柑橘采后病害鲜有报道,我们先期研究发现,P. fluorescens ZX能显著抑制P. digitatum菌丝扩展、孢子萌芽和芽管伸长,有效降低采后柑橘绿霉病的发病率和病斑直径[16],但现阶段有关P. fluorescens ZX处理抑制P. digitatum的作用机制尚不明确。因此,本研究以锦橙“北碚447”为试材,比较不同处理模式下P. fluorescens ZX对锦橙绿霉病的控制效果,着重分析P. fluorescens ZX对P. digitatum可能存在的作用模式,初步探讨P. fluorescens ZX控制锦橙P. digitatum发病的机制,为进一步开发P. fluorescens ZX保鲜方案提供一定的理论参考。
1 材料和方法 1.1 材料、菌种、培养基、试剂和仪器 1.1.1 供试果实: 锦橙北碚447(Citrus sinensis Osbeck,Jinchengbeibei 447),于2017年12月3日采自重庆市北碚区歇马镇有机果园,商业成熟,采后立即运回实验室,摊开自然风预冷,剔除病、伤果,挑选饱满圆润、色泽光亮、大小一致的健康果实为试验材料。 1.1.2 拮抗菌: Pseudomonas fluorescens ZX,由匈牙利国家农业研究和创新中心食品科学研究所高通量筛选得到,经分子生物学技术鉴定为细菌域变形菌门变形菌纲假单胞菌目假单胞菌科假单胞菌属(Pseudomonae)的荧光假单胞菌(Pseudomonas fluorescens)。拮抗菌活化[17]后,按以下步骤制备各种处理液[16-17],现配现用。(1)滤液:将培养12 h后的菌液(记为培养液)移入无菌离心管中,6000 r/min,离心10 min,取上清液,用0.22 μm聚碳酸酯膜过滤,即得;(2)原液:移取拮抗菌培养液,以NB为参照,用细菌浊度仪测定菌液浊度,并用滤液调节浓度至1×108 CFU/mL,待用;(3)热杀死液:原液在121 ℃下高压灭菌20 min;(4)菌悬液:将培养液移入无菌离心管中,6000 r/min,离心10 min,倒去上清,收集菌体,用无菌水(sterile distilled water,SDW)洗涤菌体2次,最后加入SDW,调节至所需浓度,待用;(5) SDW:蒸馏水在121 ℃下高压灭菌20 min。 1.1.3 病原菌: 实验室从腐烂的柑橘果实上分离得到,经分子生物学技术鉴定为指状青霉(Penicillium digitatum)。接种处理前,制备病原菌孢子悬浮液[16-17],现配现用。 1.1.4 马铃薯葡萄糖培养基(PDA): 200 g去皮马铃薯提取物,葡萄糖20.0 g,琼脂15.0 g,蒸馏水1000 mL。 1.1.5 柑橘皮固体培养基(CPA): 称取200 g新鲜柑橘皮,切碎,加适量蒸馏水煮沸1 h,4层纱布过滤,滤液经6000 r/min离心10 min,弃去残渣,合并上清液,用蒸馏水定容至1000 mL,加入15.0 g琼脂,121 ℃下高压灭菌20 min,待冷却至60 ℃左右,倒入培养皿,制作柑橘皮培养基平板;不加琼脂的柑橘皮液体培养基记为2×CPB。 1.1.6 营养肉汤培养基(NA): 蛋白胨10.0 g,牛肉浸出粉3.0 g,氯化钠5.0 g,蒸馏水1000 mL,调节pH为7.4±0.2,琼脂15.0 g。磺基水杨酸(分析纯),成都市科隆化学品有限公司;乳酸酚棉蓝染色液、结晶紫,北京索莱宝科技有限公司;17种氨基酸混合标品(色谱纯),美国Sigma公司;抑霉唑(水乳剂,有效成分含量20%),一帆生物科技集团有限公司;140620型插入式细胞培养皿,美国Thermo公司。
LRHS-150-Ⅱ型恒温恒湿培养箱,上海跃进医疗器械有限公司;WZT-1M型细菌浊度仪,上海劲佳科学仪器有限公司;LC-20A型高效液相色谱仪,日本岛津公司;L-8900型全自动氨基酸分析仪,日本日立公司;SYNERGYH1MG型全波长酶标仪,美国基因公司。
1.2 拮抗菌各种处理液对锦橙采后绿霉病的防治效果果实预处理后,随机分成6组,沿果实赤道用灭菌铁钉刺4个5 mm(宽)×4 mm(深)的孔,先分别接种20 μL拮抗菌原液、滤液、菌悬液和热杀死液,自然风干2 h后接种20 μL病原菌孢子悬浮液(1×104 spores/mL),SDW和农药抑霉唑(1000倍稀释液,商业建议用量)处理作对照,逐果袋封,置于恒温恒湿培养箱(20 ℃,90%相对湿度)中培养8 d后,测定果实的发病率和病斑直径。每个处理30个果实,整个试验重复3次。
1.3 平板抑菌试验 1.3.1 中心混合培养[16-17]: 在CPA平板正中央打洞,同时接入20 μL拮抗菌各种处理液和病原菌孢子悬浮液(1×106 spores/mL),以SDW处理为对照,室温培养7 d。 1.3.2 划线对峙培养[16-17]: 在CPA平板正中央打洞,接入20 μL病原菌孢子悬浮液(1×106 spores/mL),距离平板中心25 mm处,对称划线(约30 mm)接种拮抗菌各种处理液,以SDW处理为对照,室温培养7 d;均采用十字交叉法测定病斑直径,按公式(1)计算相对抑菌率。

|
公式(1) |
依次向试管中加入14 mL 2×CPB、4 mL病原菌孢子悬浮液(5×106 spores/mL)和2 mL拮抗菌各种处理液,28 ℃、150 r/min恒温振荡培养,每隔4 h观察一次孢子的出芽情况[16-17]。
1.5 拮抗菌挥发性次生代谢产物(volatile organic compounds,VOCs)的抑菌作用分析参照王友升[18]和Raza等[19]的方法并作适当修改研究拮抗菌产生的VOCs对病原菌的抑制效果、拮抗菌不同接种浓度对产生VOCs的影响、VOCs对病原菌菌落扩展和产孢量的影响、VOCs在PDA上的滞留情况以及解除共培养后病原菌活力的恢复情况。其中,在研究VOCs对病原菌的抑制效果时,拮抗菌菌悬液在NA平板上涂布后,分成两组,一组不作处理,另一组用无菌手术刀在平板中央开槽,小心移入1.0 g活性炭,所有平板30 ℃恒温培养2 d后,另取PDA平板,中央打洞,接入30 μL病原菌孢子悬浮液,两板对扣密封,室温培养7 d,测定病原菌落直径。
按1.2所述方法,将接种病原菌孢子悬浮液后的锦橙果实分别置于底部盛有0.25、0.50、1.00、2.00 L拮抗菌原液的沥水篮(长×宽×高=430 mm× 290 mm×220 mm)中,以不含拮抗菌细胞的液体培养基NB(配方同NA但不加琼脂)为对照,盖上盖子后用封口膜密封,20 ℃恒温培养8 d后,测定果实的发病率和病斑直径。每个处理12个果实,整个试验重复3次。
1.6 拮抗菌对病原菌的营养竞争作用分析参照Janisiewicz等[20]和罗丽[21]的方法并作适当修改研究拮抗菌同病原菌在不同浓度CPB中的营养竞争作用,其中,拮抗菌终浓度为1×107 CFU/mL,病原菌孢子终浓度为1×105 spores/mL。
将拮抗菌菌悬液和病原菌孢子悬浮液加入同一板孔作为对照,分别测定培养前后CPB中葡萄糖、果糖、蔗糖的含量变化[17]以及游离氨基酸的含量变化[22],进一步确定拮抗菌与病原菌之间竞争的营养物质。
1.7 拮抗菌生长曲线绘制按体积分数1%将拮抗菌菌悬液接入NB中,30 ℃、150 r/min恒温振荡培养,每隔2 h取样,测定菌液的OD600值,绘制生长曲线;对生长曲线进行Logistic方程拟合处理,并对得到的模型参数进行微分计算,绘制比生长速率曲线[23]。
1.8 拮抗菌生物膜检测 1.8.1 生物膜定性检测[24]: 按体积分数1%将拮抗菌菌悬液接入装有5 mL NB的玻璃管中,30 ℃恒温培养24 h,移去菌液,用5 mL磷酸盐缓冲液(phosphate buffer solution,PBS)清洗3次,加入同等体积的结晶紫染液(1 g/L)染色30 min,移去染液,再用PBS清洗3次,晾干试管,观察试管周围是否有一圈紫色物质。 1.8.2 生物膜半定量检测[25]: 体积分数1%将拮抗菌菌悬液接入NB中,移取1.0 mL加入24孔细菌培养板中,30 ℃恒温培养6、12、24、48、96 h,除去菌液,用等体积的PBS清洗3次后,加入1.0 mL甲醇,置于60 ℃干燥箱中固定2.5 h,加入1.0 mL结晶紫染液染色20 min,移去染液,用无菌PBS清洗3次,再次置于干燥箱直至完全干燥,之后加入等体积95%乙醇脱色15 min,最后测定脱色液的OD570值。 1.9 数据处理采用SPSS 19.0软件进行数据处理分析,用Tukey多重比较方法进行差异显著性分析,采用Origin 9.0软件进行绘图。
2 结果和分析 2.1 荧光假单胞菌ZX各种处理液对锦橙采后绿霉病的防治效果从图 1可以看出,P. fluorescens ZX对P. digitatum的防控效果明显弱于农药抑霉唑,但P. fluorescens ZX处理有效减缓了采后锦橙绿霉病的病害进程。P. fluorescens各处理液中,菌悬液(1×108 CFU/mL)的防治效果最好,果实的发病率最低,病斑直径最小;原液也有较高的生防效力,但其防治效果显著弱于同等浓度的菌悬液;滤液和热杀死液处理之间没有显著差异,其对病害的抑制作用很不明显。

|
| 图 1 荧光假单胞菌ZX各种处理液对采后锦橙绿霉病的抑制效果 Figure 1 The inhibitory of various treatments of Pseudomonas fluorescens ZX to green mold on Jincheng orange, to the disease incidence (A), to the lesion diameter (B). Ⅰ: Sterile distilled water; Ⅱ: bacterial fluid; Ⅲ: culture filtrate; Ⅳ: bacterial suspension; Ⅴ: autoclaved cultures; Ⅵ: Imazalil. Letters indicate significant differences between the different treatments. The same as below |
2.2 平板抑菌试验
由表 1可知,在CPA平板上,P. fluorescens ZX各种处理液都对P. digitatum有显著的抑制作用,热杀死液和滤液的抑菌效果相近,但其相对抑菌率远远低于菌悬液和原液;菌悬液和原液都具有较好的抑菌效果,中心混合培养时,其相对抑菌率都超过40%;划线对峙培养时,对P. digitatum的抑制作用也都超过了35%。
| Treatments | Relative inhibition rate/% | |
| Plate central mixed culture | Plate confrontation culture | |
| Sterile distilled water | 0.00±0.00e | 0.00±0.00d |
| Autoclaved cultures | 17.03±1.63d | 15.50±1.21c |
| Culture filtrate | 23.63±0.96c | 17.51±1.79c |
| Bacterial suspension | 45.52±0.90a | 41.41±1.24a |
| Bacterial fluid | 41.57±1.13b | 35.64±0.97b |
| Letters indicate significant differences between the different treatments. The same as below | ||
2.3 荧光假单胞菌ZX对病原菌孢子出芽情况的影响
从表 2可以看出,P. fluorescens ZX各种处理液都能显著抑制P. digitatum的孢子发芽和芽管伸长,其中,菌悬液和原液的作用效果较好,与孢子悬浮液共培养时,孢子的发芽率和芽管长度远远低于热杀死液和滤液处理组,尤其是原液处理组的孢子发芽率仅为13.33%,芽管长度仅为8.55 μm;P. fluorescens ZX活细胞浓度显著影响菌悬液的抑菌效果,浓度越高,抑菌作用越强,当培养体系中的菌悬液终浓度为1×108 CFU/mL时,对孢子发芽的抑制率高达80%左右。
| Treatments | Spore germination/% | Germ tube length/μm |
| Spore suspension | 82.67±2.49a | 33.84±4.20a |
| Autoclaved cultures | 70.33±3.30b | 29.33±3.37b |
| Culture filtrate | 68.67±2.87b | 27.69±3.32c |
| Bacterial suspension (1×106 CFU/mL) | 54.00±2.83c | 26.25±3.97c |
| Bacterial suspension (1×107 CFU/mL) | 47.00±2.16d | 19.17±3.82d |
| Bacterial suspension (1×108 CFU/mL) | 20.00±2.45e | 14.08±2.95e |
| Bacterial fluid | 13.33±2.87f | 8.55±2.48f |
2.4 拮抗菌产生的VOCs对病原菌的抑制作用 2.4.1 拮抗菌产生的VOCs对病原菌在PDA平板上的抑制作用: 由图 2可知,SDW、P. fluorescens ZX和P. fluorescens ZX+活性炭熏蒸处理对P. digitatum孢子发芽和菌丝生长具有显著影响(图 2-A),表明P. fluorescens ZX产生的VOCs具有较高的抑菌作用,接种浓度即初始接种量对其产生VOCs几乎没有影响(图 2-B);同时,与P. fluorescens ZX共培养后,P. digitatum的菌落扩展受到显著抑制(图 2-C),菌落的单位面积产孢量也大为减少(图 2-D);P. digitatum菌丝块在P. fluorescens ZX处理后的PDA平板上形成的菌落直径显著小于对照,但P. fluorescens ZX处理2 d和3 d对P. digitatum菌落直径没有显著影响(图 2-E);与P. fluorescens ZX共培养7 d后的P. digitatum菌丝块重新转接到新鲜PDA平板上,能重新生长,形成菌落,但在生长过程中其菌丝扩展速度和形成的菌落直径明显低于对照(图 2-F)。

|
| 图 2 荧光假单胞菌ZX产生的VOCs对指状青霉的抑制效果 Figure 2 The inhibitory of VOCs produced by Pseudomonas fluorescens ZX to Penicillium digitatum. A: conidial germination; B: antifungal activity of VOCs with different inoculation concentrations; C: the mycelial growth of P. digitatum; D: the sporulation intensity of P. digitatum; E: the colony diameter of P. digitatum on PDA plates treated by VOCs; F: the colony diameter of P. digitatum on the fresh PDA plates after co-culturing with P. fluorescens ZX. Ⅰ–Ⅴ: 0, 1×106, 1×107, 1×108, 1×109 CFU/mL |
2.4.2 拮抗菌产生的VOCs对采后锦橙绿霉病的防治效果: 由图 3可知,在20℃下恒温培养8 d后,对照组锦橙绿霉病发病严重,发病率高达87.9%,平均病斑直径也超过了3.50 cm,而P. fluorescens ZX产生的VOCs能有效减缓采后锦橙的病害进程,经VOCs熏蒸处理的锦橙果实,和对照相比,发病率和病斑直径显著降低,且随着拮抗菌原液体积的增加,对采后锦橙病害的控制效果逐渐增强,但当原液体积达到0.50 L后,原液体积对果实病害的控制效果没有显著影响。
|
| 图 3 荧光假单胞菌ZX产生的VOCs对采后锦橙绿霉病的防治效果 Figure 3 The inhibitory of VOCs produced by Pseudomonas fluorescens ZX to green mold on Jincheng orange, to the disease incidence (A), to the lesion diameter (B) |
2.5 拮抗菌对病原菌的营养竞争作用 2.5.1 拮抗菌在不同浓度CPB中对病原菌孢子出芽情况的影响: 由表 3可知,P. digitatum孢子的发芽率随CPB浓度的升高而增大,与P. fluorescens ZX共培养时P. digitatum孢子发芽受到显著抑制,但随着CPB浓度的增大,孢子发芽率显著提高,P. fluorescens ZX的抑制作用减弱;与P. fluorescens ZX共培养过的P. digitatum孢子转移至对应浓度的新鲜CPB中再培养2 d后,发芽率显著上升,1×CPB中P. digitatum孢子发芽率超过80%。
| Treatments | Germ tube length grade | Number | Spore germination/% | |||||||
| ≤1×D | ≤2×D | ≤3×D | ≤4×D | ≤5×D | > 5×D | Observation No. | Germination No. | |||
| 1.00×CPB | 106 | 34 | 24 | 32 | 46 | 58 | 3×100 | 194 | 64.67±1.70a | |
| 0.50×CPB | 195 | 24 | 20 | 20 | 18 | 23 | 3×100 | 105 | 35.00±2.94b | |
| 0.25×CPB | 222 | 15 | 14 | 18 | 21 | 10 | 3×100 | 78 | 26.00±2.16c | |
| SDW | 288 | 2 | 3 | 4 | 2 | 1 | 3×100 | 12 | 4.00±1.41d | |
| 1.00×CPB+P. fluorescens | 166 | 42 | 30 | 25 | 20 | 17 | 3×100 | 134 | 44.67±3.30a | |
| 0.50×CPB+P. fluorescens | 248 | 12 | 11 | 14 | 7 | 8 | 3×100 | 52 | 17.33±1.89b | |
| 0.25×CPB+P. fluorescens | 274 | 4 | 4 | 10 | 2 | 6 | 3×100 | 26 | 8.67±0.47c | |
| SDW+P. fluorescens | 294 | 3 | 0 | 2 | 1 | 0 | 3×100 | 6 | 2.00±0.82d | |
| 1.00×CPB for another 2 d | 50 | 34 | 36 | 48 | 66 | 66 | 3×100 | 250 | 83.33±3.68a | |
| 0.50×CPB for another 2 d | 136 | 22 | 28 | 46 | 36 | 32 | 3×100 | 164 | 54.67±2.87b | |
| 0.25×CPB for another 2 d | 178 | 26 | 26 | 24 | 22 | 24 | 3×100 | 122 | 40.67±2.36c | |
| SDW for another 2 d | 289 | 5 | 3 | 0 | 3 | 0 | 3×100 | 11 | 3.67±0.94d | |
| SDW indicated sterile distilled water. | ||||||||||
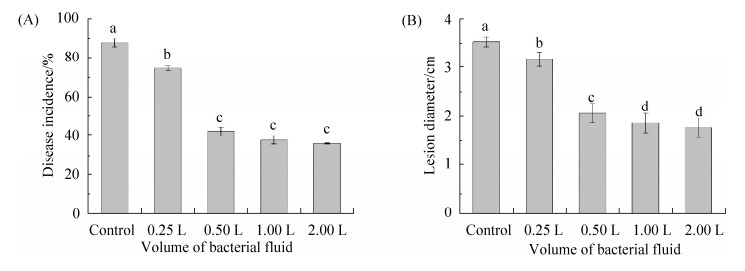
2.5.2 拮抗菌在不同浓度CPB中的生长量及其对病原菌的营养竞争作用: 从图 4可以看出,P. fluorescens ZX在低浓度CPB中生长缓慢,在0.25×CPB和0.5×CPB中培养48 h,P. fluorescens ZX浓度仅分别为初始浓度的2.05倍和5.37倍;但在1×CPB中,P. fluorescens ZX繁殖迅速,其浓度达到了9.5×107 CFU/mL,为初始浓度的18.69倍。
|
| 图 4 荧光假单胞菌ZX在不同浓度CPB中的生长量 Figure 4 Growth of Pseudomonas fluorescens ZX in CPB of different concentration. SDW indicated sterile distilled water |
从图 5可以看出,CPB中果糖含量最高,但P. fluorescens ZX和P. digitatum都最先利用葡萄糖作为碳源生长繁殖,培养24 h后,各处理组板孔中的葡萄糖都被完全消耗;各处理组的蔗糖和果糖含量差异显著,单独培养P. fluorescens ZX后的CPB中蔗糖和果糖含量显著低于其他处理组,说明P. fluorescens ZX比P. digitatum更快速高效地利用蔗糖和果糖。

|
| 图 5 培养前后CPB中果糖、葡萄糖、蔗糖的含量 Figure 5 The content of fructose, glucose and sucrose in CPB both before and after culturing |
由表 4可知,CPB中天冬氨酸、丙氨酸和脯氨酸含量较高,没有检测到半胱氨酸、蛋氨酸、异亮氨酸、酪氨酸、苯丙氨酸和组氨酸;除谷氨酸外,P. fluorescens ZX能迅速消耗CPB中其余所有的游离氨基酸;而P. digitatum消耗游离氨基酸的速度明显比P. fluorescens ZX慢,且只能利用天冬氨酸、苏氨酸、丝氨酸、亮氨酸、精氨酸和脯氨酸等有限的几种氨基酸。
| Amino acid/(μg/mL) | Abbreviation | 1×CPB | P. fluorescens | P. digitatum | P. fluorescens+ P. digitatum | P. fluorescens/PTFE/ P. digitatum |
| Aspartic acid | Asp | 2.469±0.126a | NDd | 1.650±0.053b | 0.299±0.060c | NDd |
| Threonine | Thr | 0.578±0.030a | NDe | 0.089±0.018d | 0.250±0.036b | 0.179±0.048c |
| Serine | Ser | 1.056±0.058a | NDc | 0.694±0.063b | NDc | NDc |
| Glutamate | Glu | 0.647±0.015d | 0.566±0.037e | 4.965±0.037a | 1.949±0.213b | 1.280±0.044c |
| Glycine | Gly | 0.161±0.019b | NDc | 0.312±0.041a | NDc | NDc |
| Alanine | Ala | 2.067±0.116b | NDc | 2.655±0.213a | NDc | NDc |
| Valine | Val | 1.131±0.052a | NDb | 1.049±0.088a | NDb | NDb |
| Leucine | Leu | 0.676±0.033a | NDb | NDb | NDb | NDb |
| Lysine | Lys | 0.197±0.036a | NDc | 0.022±0.001b | NDc | NDc |
| Arginine | Arg | 0.165±0.026a | NDb | NDb | NDb | NDb |
| Proline | Pro | 23.308±0.311a | NDc | 10.537±0.190b | NDc | NDc |
| Total | 32.460±0.687a | 0.566±0.037e | 21.973±0.253b | 2.500±0.309c | 1.458±0.0.004d | |
| PTFE indicated polytetrafluoroethylene membrane; ND indicated that no detection was obtained; cysteine, methionine, isoleucine, tyrosine, phenylalanine and histidine were not detected in all treatment groups. | ||||||
2.6 拮抗菌的生长曲线
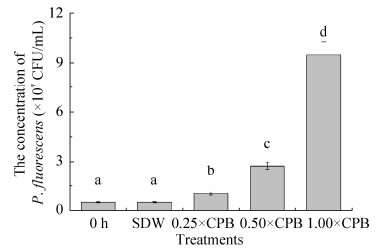
P. fluorescens ZX的生长曲线如图 6所示,对曲线进行拟合处理,得其Logistic方程(公式2)。
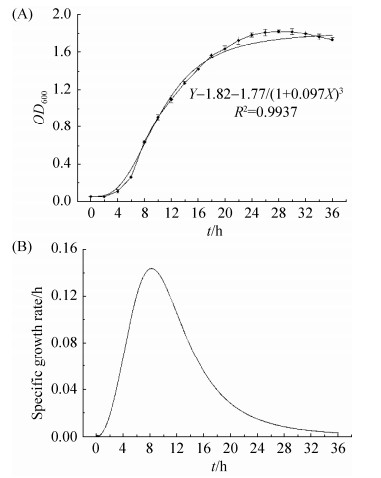
|
| 图 6 荧光假单胞菌ZX的生长曲线(A)和比生长速率曲线(B) Figure 6 The growth curve (A) and specific growth rate curve (B) of Pseudomonas fluorescens ZX. Each value is the mean of 3 replicates±standard error |

|
公式(2) |
由图 6-A可知,P. fluorescens ZX在0–4 h内处于延滞期,之后进入对数生长期;大约培养8 h后,P. fluorescens ZX比生长速率达到最大值(图 6-B),此时P. fluorescens ZX快速生长繁殖,一直维持到将近24 h左右,随后P. fluorescens ZX进入生长稳定期,30 h以后,OD600值出现回落(图 6-A),比生长速率也开始趋向于零(图 6-B),表明P. fluorescens ZX生长停滞,进入生长衰亡期。
2.7 拮抗菌生物膜定性检测和半定量检测采用结晶紫染色对P. fluorescens ZX生物膜进行定性检测,试管菌液周围出现一轮清晰的紫色晕圈,表明该P. fluorescens ZX菌株具有较强的生物膜形成能力;采用乙醇洗脱结晶紫并测定570 nm下洗脱液的OD值对P. fluorescens ZX生物膜进行半定量检测,随着培养时间的延长,OD570值逐渐增大,当培养时间为24 h时,生物膜成熟,OD570值达至最大值,之后进入扩散期,生物膜逐渐脱落分离,OD570值逐渐降低(图 7)。

|
| 图 7 荧光假单胞菌ZX生物膜的半定量检测 Figure 7 Semi quantitative detection of biofilm of Pseudomonas fluorescens ZX |
3 讨论
P. fluorescens在自然界广泛存在,能通过营养与空间竞争、产生次级抗性代谢物质、诱导宿主系统抗性等方式抑制病原物生长,国内外利用P. fluorescens防治多种植物及采后果蔬病虫害[26]。本实验中,不论是在离体条件下还是在活体试验中,P. fluorescens ZX原液和菌悬液都能显著抑制P. digitatum的生长繁殖,有效控制锦橙绿霉病的发生,延缓病害进程;滤液和热杀死液也有一定的防治作用,但其效力远远低于原液和菌悬液,说明P. fluorescens ZX在生长过程中可能产生一些抑菌物质,但不是其主要的作用方式。产生抗生素,干扰病原物的新陈代谢,进而抑制病原物的生长繁殖,这是P. fluorescens最早被确定的拮抗机制。Peeran等[15]成功将能产2, 4-二乙酰基间苯三酚(2, 4-diac-etylphloroglucinol,DAPG)的P. fluorescens FP7用于防治香蕉炭疽病;Arseneault等[27]报道,P. fluorescens LBUM223防控马铃薯赤霉病主要就是依赖产生酚嗪-1-羧酸(phenazin-e-1-carboxylicacid,PCA)实现的。但抗生素抑制病原物的作用机制尚未完全清楚,且抗生素的使用会引发公众对食品安全、病原菌抗性等问题的担忧,因而在筛选应用于防治采后果蔬病害的拮抗菌时,应重点关注和推广使用不具备产抗生素能力的拮抗微生物[28]。除抗生素外,P. fluorescens还能产生CHI、GLU、生物活性剂等多种抗菌物质[9, 29-30]。本实验所用P. fluorescens ZX菌株由匈牙利国家农业研究和创新中心食品科学研究所高通量筛选获得,前期分析结果表明,该菌株能产生嗜铁素和蛋白酶,不能分泌CHI、葡聚糖酶或纤维素酶,不具有PCA、DAPG、藤黄绿菌素、硝咯吡菌素等抗生素或氢化氰的合成基因[17]。大量研究表明,分泌嗜铁素,螯合环境中微量的铁元素,使病原物得不到充足的铁元素营养,这是P. fluorescens重要的抑菌机制之一[6, 26];同时,蛋白酶可能对病原物的生长繁殖也有一定的抑制作用[6]。
采用两板对扣法使得P. fluorescens ZX和P. digitatum同步培养但彼此不接触,结果表明P. fluorescens ZX产生的VOCs具有较强抑菌作用,能显著抑制P. digitatum的菌丝生长和菌落扩展(图 2),这与Wallace[6]的研究结果一致。经VOCs熏蒸处理后的果实,发病率和病斑直径显著降低(图 3),但当拮抗菌原液体积达到一定量后,增加拮抗菌原液体积对VOCs的防治效力增幅不大,在数理统计上没有显著差异(图 3),这也和VOCs在PDA平板上的抑菌效果一致(图 2-B)。王友升[18]也发现拮抗酵母Cryptococcus albidus、Cryptococcus laurentii、Rhodotorula glutinis的不同接种浓度对其产生的VOCs没有显著影响。Park等[31]联用顶空固相微萃取和气相色谱-质谱联用仪,确定P. fluorescens SS101能产生11种VOCs;Hernández- León等[32]报道P. fluorescens UM16、UM240、UM256、UM270均能产生VOCs,其主要成分是小分子的乙醛、酮和醇等,而主要的抑菌(Botrytis cinerea)成分可能是含硫化合物。供试菌株P. fluorescens ZX产生哪些种类的VOCs以及哪些VOCs起主要抑菌作用,还需进一步研究。由于利用拮抗菌VOCs进行生物熏蒸来防治病害,可适用于大多数产品的不同贮存和运输阶段,也可用于那些因太脆弱而无法进行液态杀菌剂处理的产品,且拮抗菌与产品不直接接触,完全不会引起消费者对食品安全性的担忧,因而具有广泛的研究和应用前景[33]。
我们先期研究表明,P. fluorescens ZX能在锦橙伤口处迅速生长繁殖,消耗营养,抢占生态位点,从而使P. digitatum无法获得足够的营养和空间进行正常的生命活动[16]。现在普遍认为,与病原物进行营养物质与空间位点竞争是P. fluorescens防治病害最主要的作用机制之一。长期以来,在研究方法上,营养竞争和空间竞争一直无法分开单独研究。2000年,Janisiewicz等[20]设计出插入式细胞培养皿,单独研究拮抗酵母菌和Penicillium expansum对苹果汁中有限营养的竞争,排除了空间竞争的干扰。我们参照该方法并进一步试验确定P. fluorescens ZX和P. digitatum之间可能竞争的营养物质。同时,与大多数学者的研究体系不同,为更真实地反映实际情况,我们采用柑橘皮制作培养基。结果表明,与P. fluorescens ZX不接触共培养时,P. digitatum孢子发芽受到显著抑制,但随着CPB浓度的提高,P. fluorescens ZX的抑制作用减弱(表 3);对培养前后CPB中的营养物质含量分析后发现,P. fluorescens ZX能更快速有效地利用柑橘皮中的糖类和游离氨基酸,并和P. digitatum竞争葡萄糖、果糖、蔗糖、天冬氨酸、苏氨酸、丝氨酸、亮氨酸、精氨酸和脯氨酸等营养物质(图 5和表 4)。此外,单独培养P. digitatum后的CPB中谷氨酸、甘氨酸、丙氨酸含量显著上升,表明P. digitatum可能在生长繁殖过程中能合成这几种氨基酸(表 4)。
生物膜是由细菌或真菌附着在生物或非生物体表面,被自身分泌的胞外聚合物所包裹,形成具有一定结构和功能的细胞群体[34]。生物膜能通过减低宿主免疫应答反应、抑制吞噬细胞等方式发挥对膜内细菌的保护作用,极大增强膜内细菌的稳定性[6, 34]。Wallace[6]报道,P. fluorescens 1-112、4-6和2-28能在苹果伤口处形成致密的生物膜,阻碍P. expansum接触、利用苹果伤口处的营养物质;Allen等[35]也发现,P. fluorescens PCL1701具有较强的生物膜形成能力,且其在低浓度营养下形成的生物膜较其他处理条件下的明显更稳定。此外,生物膜形成能力与菌株在自然环境中的定殖和对环境胁迫的抗性密切相关[6, 24, 34]。本试验中,供试菌株P. fluorescens ZX培养4 h后就开始进入对数生长期(图 6),而后菌体迅速生长繁殖,相互聚集堆积,培养约24 h后形成成熟的生物膜(图 7),表明P. fluorescens ZX具有较强的生命力和环境适应力,同时进一步反映了营养与空间竞争在P. fluorescens ZX拮抗P. digitatum中发挥的重要作用。
此外,P. fluorescens ZX处理能显著提高锦橙果皮CHI和GLU的活性,并能诱导提前GLU、过氧化物酶、苯丙氨酸解氨酶活性高峰的到来,有效提高采后锦橙果实的抗病性[16-17]。然而,拮抗菌、病原菌和宿主之间的互作效应十分复杂,P. fluorescens ZX对P. digitatum是否还存在其他的作用模式,还需更深入地研究。
4 结论本实验研究结果表明:(1) P. fluorescens ZX及其产生的VOCs都能显著抑制P. digitatum的孢子萌发、芽管伸长和菌丝扩展,从而有效降低锦橙采后绿霉病的发病率和病斑直径;(2)营养与空间竞争是P. fluorescens ZX防治锦橙绿霉病的重要机制之一,P. fluorescens ZX能和P. digitatum竞争锦橙果皮中的葡萄糖、果糖、蔗糖、天冬氨酸、苏氨酸、丝氨酸、亮氨酸、精氨酸和脯氨酸等营养物质;(3) P. fluorescens ZX具有较强的生命力,能迅速生长繁殖,24 h内形成成熟稳定的生物膜。
| [1] | 邓秀新, 彭抒昂. 柑橘学. 北京: 中国农业出版社, 2013. |
| [2] | Ballester AR, Lafuente MT, Forment J, Gadea J, de Vos RCH, Bovy AG, González-Candelas L. Transcriptomic profiling of citrus fruit peel tissues reveals fundamental effects of phenylpropanoids and ethylene on induced resistance. Molecular Plant Pathology, 2011, 12(9): 879-897. DOI:10.1111/j.1364-3703.2011.00721.x |
| [3] | 路来风.海洋拮抗酵母Rhodosporidium paludigenum对柑橘果实抗性的增强效应及其生物学机理研究.浙江大学博士学位论文, 2015. |
| [4] | 毕阳. 果蔬采后病害:原理与控制. 北京: 科学出版社, 2016. |
| [5] | Sánchez-Torres P, Tuset JJ. Molecular insights into fungicide resistance in sensitive and resistant Penicillium digitatum strains infecting citrus. Postharvest Biology and Technology, 2011, 59(2): 159-165. DOI:10.1016/j.postharvbio.2010.08.017 |
| [6] | Wallace RL. Biological control of common postharvest diseases of apples with Pseudomonas fluorescens and potential modes of action. Doctor Dissertation of The University of British Columbia, 2018. |
| [7] | 王一非.海洋拮抗酵母Rhodosporidium paludigenum对果实采后病害生物防治的研究.浙江大学博士学位论文, 2008. |
| [8] |
Sun GZ, Yao T, Zhao GQ, Lu H, Ma WB. Research progress and prospects for controlling plant diseases using Pseudomonas fluorescens. Acta Prataculturae Sinica, 2015, 24(4): 174-190.
(in Chinese) 孙广正, 姚拓, 赵桂琴, 卢虎, 马文彬. 荧光假单胞菌防治植物病害研究现状与展望. 草业学报, 2015, 24(4): 174-190. DOI:10.11686/cyxb20150421 |
| [9] | El-Gamal NG, Shehata AN, Hamed ER, Shehata HS. Improvement of lytic enzymes producing Pseudomonas fluorescens and Bacillus subtilis isolates for enhancing their biocontrol potential against root rot disease in tomato plants. Research Journal of Pharmaceutical, Biological and Chemical Sciences, 2016, 7(1): 1393-1400. |
| [10] | Groβkinsky DK, Tafner R, Moreno MV, Stenglein SA, de Salamone IEG, Nelson LM, Novák O, Strnad M, van der Graaff E, Roitsch T. Cytokinin production by Pseudomonas fluorescens G20-18 determines biocontrol activity against Pseudomonas syringae in Arabidopsis. Scientific Reports, 2016, 6: 23310. DOI:10.1038/srep23310 |
| [11] | Prabhukarthikeyan SR, Keerthana U, Raguchander T. Antibiotic-producing Pseudomonas fluorescens mediates rhizome rot disease resistance and promotes plant growth in turmeric plants. Microbiological Research, 2018, 210: 65-73. DOI:10.1016/j.micres.2018.03.009 |
| [12] | Ilhan K, Karabulut OA. Efficacy and population monitoring of bacterial antagonists for gray mold (Botrytis cinerea Pers. ex. Fr.) infecting strawberries. BioControl, 2013, 58(4): 457-470. DOI:10.1007/s10526-012-9503-x |
| [13] | Ghazanfar MU, Hussain M, Hamid MI, Ansari SU. Utilization of biological control agents for the management of postharvest pathogens of tomato. Pakistan Journal of Botany, 2016, 48(5): 2093-2100. |
| [14] | Mostafavi HA, Mirmajlessi SM, Fathollahi H, Shahbazi S, Mirjalili SM. Integrated effect of gamma radiation and biocontrol agent on quality parameters of apple fruit: An innovative commercial preservation method. Radiation Physics and Chemistry, 2013, 91: 193-199. DOI:10.1016/j.radphyschem.2013.02.020 |
| [15] | Peeran MF, Krishnan N, Thangamani PR, Gandhi K, Thiruvengadam R, Kuppusamy P. Development and evaluation of water-in-oil formulation of Pseudomonas fluorescens (FP7) against Colletotrichum musae incitant of anthracnose disease in banana. European Journal of Plant Pathology, 2014, 138(1): 167-180. DOI:10.1007/s10658-013-0320-6 |
| [16] | Wang ZR, Jiang MY, Chen KW, Wang KT, Du MY, Zalán Z, Hegyi F, Kan JQ. Biocontrol of Penicillium digitatum on postharvest citrus fruits by Pseudomonas fluorescens. Journal of Food Quality, 2018, 2018: 2910481. |
| [17] |
Wang ZR, Jiang MY, Du MY, Wang KT, Zalán Z, Hegyi F, Kan JQ. Investigation on effects of treatments with Pseudomonas fluorescens on controlling blue mold caused by Penicillium italicum and storage quality in Jincheng citrus fruits. Food and Fermentation Industries, 2018, 44(11): 176-184.
(in Chinese) 王智荣, 江孟遥, 杜木英, 汪开拓, Zalán Z, Hegyi F, 阚建全. 荧光假单胞菌对采后锦橙青霉病的防治和贮藏品质的影响. 食品与发酵工业, 2018, 44(11): 176-184. DOI:10.13995/j.cnki.11-1802/ts.017668 |
| [18] | 王友升. 拮抗酵母菌与果蔬采后病害防治. 北京: 知识产权出版社, 2012. |
| [19] | Raza W, Ling N, Liu DY, Wei Z, Huang QW, Shen QR. Volatile organic compounds produced by Pseudomonas fluorescens WR-1 restrict the growth and virulence traits of Ralstonia solanacearum. Microbiological Research, 2016, 192: 103-113. DOI:10.1016/j.micres.2016.05.014 |
| [20] | Janisiewicz WJ, Tworkoski TJ, Sharer C. Characterizing the mechanism of biological control of postharvest diseases on fruits with a simple method to study competition for nutrients. Biological Control, 2000, 90(11): 1196-1200. DOI:10.1094/PHYTO.2000.90.11.1196 |
| [21] | 罗丽.柠檬形克勒克酵母(34-9)对柑橘意大利青霉抑菌机理的研究.华中农业大学硕士学位论文, 2010. |
| [22] | 周雅涵.水杨酸、膜醭毕赤酵母、壳寡糖诱导柑橘果实抗病性及其生物学机制研究.西南大学博士学位论文, 2017. |
| [23] |
Fu Q, Cheng LK, Miao LZ, Wang Y, He C, Shen ZQ. Determination of growth curve and screening of medium for A type Naso trachea. China Poultry, 2017, 39(11): 60-63.
(in Chinese) 付强, 程立坤, 苗立中, 王艳, 何诚, 沈志强. A型鼻气管鸟杆菌生长曲线的测定和培养基筛选. 中国家禽, 2017, 39(11): 60-63. |
| [24] | 刘正强.利用核糖体工程技术提高荧光假单胞菌Pf-5菌株活性次级代谢产物产量.湖南师范大学硕士学位论文, 2016. |
| [25] | Wei HL, Zhang LQ. Quorum-sensing system influences root colonization and biological control ability in Pseudomonas fluorescens 2P24. Antonie van Leeuwenhoek, 2006, 89(2): 267-280. DOI:10.1007/s10482-005-9028-8 |
| [26] | Sahu B, Singh J, Shankar G, Pradhan A. Pseudomonas fluorescens PGPR bacteria as well as biocontrol agent: A review. International Journal of Chemical Studies, 2018, 6(2): 1-7. |
| [27] | Arseneault T, Goyer C, Filion M. Biocontrol of potato common scab is associated with high Pseudomonas fluorescens LBUM223 populations and phenazine-1- carboxylic acid biosynthetic transcript accumulation in the potato geocaulosphere. Phytopathology, 2016, 106(9): 963-970. DOI:10.1094/PHYTO-01-16-0019-R |
| [28] | Dukare AS, Paul S, Nambi VE, Gupta RK, Singh R, Sharma K, Vishwakarma RK. Exploitation of microbial antagonists for the control of postharvest diseases of fruits: A review. Critical Reviews in Food Science and Nutrition, 2018, 2: 1-16. |
| [29] | Peekate PL, Abu GO. Optimizing C: N ratio, C: P ratio, and pH for biosurfactant production by Pseudomonas fluorescens. Journal of Advances in Microbiology, 2017, 7(2): JAMB.38199. |
| [30] | Peekate PL, Abu GO, Ogugbue CJ. Investigating the effectiveness between using Pseudomonas fluorescens and its biosurfactant in bioremediation of petroleum hydrocarbon contaminated soil. Asian Journal of Biotechnology and Bioresource Technology, 2018, 3(2): AJB2T.40528, doi: 10.9734/AJB2T/2018/40528. |
| [31] | Park YS, Dutta S, Ann M, Raaijmakers JM, Park K. Promotion of plant growth by Pseudomonas fluorescens strain SS101 via novel volatile organic compounds. Biochemical and Biophysical Research Communications, 2015, 461(2): 361-365. DOI:10.1016/j.bbrc.2015.04.039 |
| [32] | Hernández-León R, Rojas-Solís D, Contreras-Pérez M, Orozco-Mosqueda MDC, Macías-Rodríguez LI, Reyes-de la Cruz H, Valencia-Cantero E, Santoyo G. Characterization of the antifungal and plant growth-promoting effects of diffusible and volatile organic compounds produced by Pseudomonas fluorescens strains. Biological Control, 2015, 81: 83-92. DOI:10.1016/j.biocontrol.2014.11.011 |
| [33] |
Sapers GM, Gorny JR, Yousef AE. 果蔬微生物学.陈卫, 田丰伟, 译.北京: 中国轻工业出版社, 2011. |
| [34] | 黄迅辰. 荧光假单胞菌分离鉴定、生物膜形成及免疫磁珠检测技术的研究. 中国计量学院硕士学位论文, 2015. |
| [35] | Allen A, Habimana O, Casey E. The effects of extrinsic factors on the structural and mechanical properties of Pseudomonas fluorescens biofilms: A combined study of nutrient concentrations and shear conditions. Colloids and Surfaces B: Biointerfaces, 2018, 165: 127-134. DOI:10.1016/j.colsurfb.2018.02.035 |
 2019, Vol. 59
2019, Vol. 59