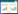中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王相洪, 张婷, 涂飞, 史梦婷, 王卉, 杨梦华. 2019
- Xianghong Wang, Ting Zhang, Fei Tu, Mengting Shi, Hui Wang, Menghua Yang. 2019
- 霍乱弧菌ToxS蛋白间的互作增强ToxR蛋白诱导毒力基因的表达
- ToxS homodimerization enhances ToxR acitivating virulence gene expression in Vibrio cholerae
- 微生物学报, 59(5): 832-840
- Acta Microbiologica Sinica, 59(5): 832-840
-
文章历史
- 收稿日期:2018-07-13
- 修回日期:2018-09-11
- 网络出版日期:2018-12-01
2. 浙江农林大学动物科技学院, 浙江 杭州 311300
2. College of Animal Science and Technology, Zhejiang Agricultural and Forestry University, Hangzhou 311300, Zhejiang Province, China
霍乱弧菌(Vibrio cholerae)是一种引起霍乱的革兰氏阴性细菌。而霍乱是一种烈性肠道传染病,被列为我国传染病防治法规定的两种甲类传染病之一,也是国际3种检疫传染性疾病中危害最为严重的一种[1-2]。研究发现霍乱弧菌毒力基因的表达一方面受到细胞内级联调控系统的控制,另一方面受到体外环境信号因子的诱导[3-4]。许多研究表明环境中温度、pH值、氧气浓度、胆汁酸分子、钙离子以及某些营养元素的浓度等,对霍乱毒力基因的表达有不同的影响[5-8]。而霍乱弧菌本身的基因转录调控蛋白通过改变蛋白的构象对环境因子作出应答,从而在不同的生存环境中调控不同的基因的表达,以便最好地适应其生存环境[8]。
ToxR蛋白是霍乱弧菌重要的基因转录调控蛋白,除了调控与毒力基因相关的toxT基因以外,还调控一系列与霍乱弧菌生理和致病相关的基因[9-10]。ToxS是在霍乱弧菌基因组中与ToxR处于同一个转录操纵子与ToxR共转录的一个跨膜蛋白,ToxR的蛋白活性依赖于ToxS[11],有研究指出在霍乱弧菌生长至稳定期,ToxS可帮助ToxR免受蛋白酶的降解[12-13]。然而ToxS究竟如何增强ToxR的蛋白活性,具体的分子机制目前还不是很清楚。
ToxR与另一个毒力表达调控蛋白TcpP都是细胞内膜调控蛋白,跨膜调控蛋白很可能通过感知外界环境信号的改变对蛋白功能进行调控,从而使得细菌适应不同的生存环境[14]。前期研究发现,TcpP周质空间结构域的两个半胱氨酸残基是霍乱弧菌对肠道信号因子胆汁酸分子作出应答的重要调控位点,通过改变这两个氨基酸残基的氧还状态从而调控TcpP蛋白的活性[15-16]。然而,ToxR是通过什么样的分子机制感知外界环境信号从而对蛋白功能进行调控,目前还不清楚。ToxR蛋白的周质空间结构域也含有两个半胱氨酸残基C236和C293,那么这两个半胱氨酸残基在ToxR的蛋白功能中发挥怎么样的作用呢?DsbA蛋白是位于革兰氏阴性细菌的周质空间的二硫键氧还蛋白,协助分泌到周质空间含有半胱氨酸残基的蛋白质形成二硫键,从而折叠成正确的蛋白构象[17]。位于周质空间的半胱氨酸残基很可能受到DsbA蛋白的氧化催化作用。因此,本研究通过检测DsbA蛋白对ToxR与ToxS蛋白的功能及蛋白之间相互作用的影响,结合基因定点突变的方法,确定霍乱弧菌ToxR蛋白的氧还状态对ToxR蛋白功能的作用,初步探讨ToxR蛋白应答环境因子进行功能调控的分子机制,从而为进一步阐明霍乱弧菌毒力基因表达调控的分子机制提供理论依据。
1 材料和方法 1.1 材料 1.1.1 菌株、质粒和培养条件: 霍乱弧菌C6706 (野生型菌株,由南京农业大学朱军老师实验室馈赠,本实验室保存)、toxRS突变株、dsbA基因缺失突变株(dsbA–)、E. coli DH5α、重组质粒toxR:: pBAD24和PctxAB:: pBBR-lux,PompT:: pBBR-lux均由本实验室保存。所用到的菌株于37 ℃在LB培养基中培养。抗生素使用浓度分别为:氨苄青霉素(Ap) 100 μg/mL,氯霉素(Cm) 20 μg/mL。本实验室是病原微生物二级实验室,可进行涉及第一类、第二类动物病原微生物有关实验活动。 1.1.2 主要试剂: PCR扩增酶:KOD-Plus-Neo,Taq酶等,购自TOYOBO公司。限制性内切酶:Nco Ⅰ-HF,Hind Ⅲ-HF,EcoR Ⅰ-HF,Pst Ⅰ-HF,T4连接酶等,购自NEB公司。DNA Ladder,Prestained Protein ladder等均购自宝生物工程(大连)有限公司。质粒小提试剂盒,PCR产物或凝胶回收试剂盒,购自天根生物。引物由苏州金唯智公司合成。AMS (4-Acetamido-4ʹ-Maleimidylstilbene-2, 2ʹ-Disulfonic Acid, Disodium Salt)购自赛默飞世尔公司(Thermo- Fisher)。ToxR抗体由金斯瑞公司合成。 1.2 ToxR蛋白的氧还状态分析利用巯基捕获的方法[18]验证ToxR蛋白周质空间结构域的两个半胱氨酸残基能否被DsbA氧化形成二硫键。简述如下,把ToxR蛋白重组表达质粒转入大肠杆菌或霍乱弧菌dsbA基因缺失株,在37 ℃下振荡培养细菌至对数生长期(OD600≈0.5),然后加入阿拉伯糖诱导剂,诱导蛋白表达2 h后,用终浓度为10%的三氯乙酸(TCA)沉淀蛋白,在4 ℃放置8 h或冰上放置2 h。蛋白经12000 r/min离心收集后,弃掉上清液,蛋白沉淀用冰预冷的丙酮洗涤沉淀3次,然后用含有或不含有10 mmol/L AMS的Tris-SDS缓冲液溶解蛋白,在37 ℃孵育30 min,蛋白样品经SDS-PAGE和Western Blotting分析ToxR蛋白氧还状态。
1.3 荧光素酶报告基因表达分析为了研究ToxR对下游基因ctxAB和ompT表达的影响,将含有ctxAB和ompT启动子与荧光素酶基因融合表达质粒分别转入含有ToxR重组表达质粒的大肠杆菌菌株中,将菌株分别稀释接种至96孔板,在37 ℃静置培养。用酶标仪分别检测600 nm和420 nm吸光值,计算单位荧光值(OD420/OD600)。
1.4 细菌双杂交系统验证ToxR蛋白之间的相互作用细菌双杂交系统是检验细胞体内蛋白之间相互作用的重要遗传工具,尤其是对于膜蛋白胞内互作的研究。本方法主要参考Euromedex公司的细菌双杂交系统试剂盒说明书(Cat N°: EUK001)。简述如下,利用基因克隆的方法,把ToxR蛋白分别与大肠杆菌腺苷酰环化酶两个功能结构域的羧基端进行融合表达的质粒转入大肠杆菌检测菌株BTH101[19],细菌在含有0.5 mmol/L IPTG的LB培养基中,在30 ℃下培养8 h,通过测定β-半乳糖苷酶活性确定蛋白互作的强弱。
2 结果和分析 2.1 霍乱弧菌ToxR蛋白可以被DsbA氧化利用巯基捕获的方法,分别检测大肠杆菌和霍乱弧菌DsbA蛋白对ToxR蛋白氧还状态的影响,结果发现无论是在大肠杆菌或霍乱弧菌中,当有DsbA存在时,ToxR都是以氧化态的形式存在,而在dsbA基因缺失突变株(EcdsbA-和VcdsbA-)中,ToxR蛋白主要以还原态的形式存在(图 1)。因此,ToxR蛋白周质空间的半胱氨酸残基主要被DsbA蛋白氧化形成二硫键。

|
| 图 1 ToxR蛋白氧还状态分析 Figure 1 ToxR redox status assay. A: Expression of ToxR was induced before AMS trapping. Reduced ToxR shows a 1 kDa upshift on SDS-PAGE. ToxR was detected by Western blotting using anti-ToxR antibody. Blot shown is representative of at least three separate experiments. B: Quantification of band intensities from blot shown in panel A was performed using ImageJ software. Graph represents percentages of reduced ToxR. Data shown are averages of three independent experiments. R: reduced ToxR; O: oxidized ToxR. |
2.2 DsbA对ToxR蛋白功能的影响
ToxR蛋白的氧还状态受DsbA蛋白的氧化催化,为了研究ToxR蛋白的氧还状态对其蛋白功能的影响,在大肠杆菌DH5α菌株和dsbA基因缺失突变株中检测ToxR蛋白对霍乱弧菌毒素基因ctxAB的诱导调控功能。结果发现在大肠杆菌的dsbA基因缺失突变株中,在ToxR与ToxS共表达的条件下,ToxR激活ctxAB的表达显著增强(图 2)。这表明在有ToxS存在的条件下,DsbA会抑制ToxR诱导下游基因的表达。
|
| 图 2 大肠杆菌中ToxR诱导ctxAB表达分析 Figure 2 ctxAB expression assay in E. coli activating by ToxR. E. coli strains DH5α and dsbA– containing PctxAB-lux transcriptional fusion plasmids and PBAD vector control (vector) or PBAD-ToxRS (ToxRS) were grown in LB with 0.01% arabinose at 37 ℃ until OD600≈0.2. Luminescence was measured and reported as light units/OD600. Data are the means±SD (n=3). ***, P < 0.0001. |
2.3 ToxRC236/293S诱导下游基因表达的功能分析
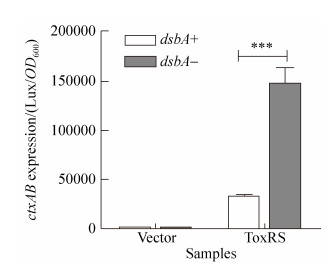
根据ToxR在大肠杆菌dsbA基因缺失突变株中诱导ctxAB表达的活性增强(图 2),我们推测还原态的ToxR蛋白可能具有更强的诱导活性。因此,利用定点突变的方法,把ToxR蛋白周质空间结构域的2个半胱氨酸残基都突变为丝氨酸,得到ToxRC236/293S,在与ToxS共表达的条件下,通过检测ToxRC236/293S诱导ctxAB的转录水平,结果却发现在dsbA+和dsbA-菌株中,ToxRC236/293S(M)诱导ctxAB转录表达的活性与ToxRWT(WT)的活性没有显著区别(图 3-A)。在霍乱弧菌中检测ToxR对ompT的调控作用中也发现同样的表型,当ToxR与ToxS共转录表达时,在霍乱弧菌dsbA基因缺失突变株中,ToxR抑制ompT表达的活性增强,然而不管是否有DsbA存在,ToxRWT与ToxRC236/293S对ompT具有相似的抑制活性(图 3-B)。
|
| 图 3 大肠杆菌中ToxRWT与ToxRC236/293S诱导ctxAB和ompT的表达分析 Figure 3 ctxAB or ompT expression assay activating by ToxRWT or ToxRC236/293S. A and D: E. coli strains DH5α and dsbA-containing PctxAB-lux transcriptional fusion plasmids and PBAD vector control (V) or PBAD-ToxRWT (WT) or PBAD-ToxRC236/293S (M) were grown in LB with 0.01% arabinose at 37 ℃ until OD600≈0.2. Luminescence was measured and reported as light units/OD600. B: V. cholerae strains toxRS-or toxRS-/dsbA-containing PompT-lux transcriptional fusion plasmids and PBAD vector control (V) or PBAD-ToxRSWT (WT) or PBAD-ToxRSC236/293S (M) were grown in LB with 0.01% arabinose at 37 ℃ until OD600≈0.2. Luminescence was measured and reported as light units/OD600. C: E. coli strains DH5α containing PctxAB-lux transcriptional fusion plasmids and PBAD vector control (V) or PBAD-ToxRS (RS) or PBAD-ToxR (R) were grown in LB with 0.01% arabinose at 37 ℃ until OD600≈0.2. Luminescence was measured and reported as light units/OD600. Data are the means±SD (n=3). NS, non-significant; ***, P < 0.0001. |
在这些检测体系中,ToxR与ToxS是在同一个重组质粒上共转录表达的,为了分析在没有ToxS的条件下ToxR诱导ctxAB表达的活性,构建了单独表达ToxR蛋白的重组质粒,分析在没有ToxS蛋白的条件下,ToxR对ctxAB转录的激活作用。结果表明在没有ToxS的条件下,ToxR诱导下游基因的表达活性显著降低(图 3-C)。比较ToxRWT在dsbA+和dsbA-菌株中的活性发现,在没有ToxS蛋白存在的条件下,DsbA对ToxR的功能几乎没有影响(图 3-D)。
这些结果表明ToxS对ToxR诱导ctxAB基因转录表达的活性具有重要作用,而ToxR蛋白本身的氧还状态对其蛋白功能并没有太大的影响,而只有当ToxR与ToxS共同转录表达的条件下,DsbA很可能通过影响ToxR与ToxS的相互作用,从而影响ToxR的功能。
2.4 ToxR与ToxS蛋白之间的相互作用为了进一步探究DsbA如何通过影响ToxR与ToxS的相互作用从而影响ToxR的功能,我们首先把toxRS (VC0983-VC0984)基因、单独的toxR (VC0984)基因以及单独的toxS (VC0983)与细菌双杂交系统的2个检测质粒融合表达,通过在dsbA+和dsbA-菌株中检测菌体的β-半乳糖苷酶活性。结果发现在ToxS与ToxR共转录的情况下,ToxR蛋白之间有很强烈的相互作用(图 4-A白色柱),而且在dsbA-突变株中,ToxR的互作更强。然而,当没有ToxS蛋白存在的条件下,ToxR蛋白之间的互作要弱得多(图 4-A灰色柱),而且DsbA对ToxR的互作影响不大,这说明ToxS蛋白可增强ToxR蛋白之间的相互作用。而且ToxRC236/293S的互作与ToxRWT相当,这说明ToxR蛋白本身的氧还状态对蛋白的相互作用没有影响。

|
| 图 4 利用细菌双杂交系统分析ToxR与ToxS蛋白互作 Figure 4 ToxR or ToxS protein interaction assay in bacterial two-hybrid system. Full length ToxR or ToxS was fused with the T25 and T18 domains of adenylate cyclase (CyaA) from Bordetella pertussis, respectively, and the T25, T18 fusion pairs were introduced into E. coli cyaA mutants[19] or cyaA/dsbA double mutants[20]. Cultures were grown in LB medium with 0.5 mmol/L IPTG at 30 ℃ for 8 h without shaking and β-galactosidase activity was measured and reported as Miller Units[21]. Data are means±SD (n=3). ***, P < 0.0001. RS: ToxRWT and ToxRWT interaction with co-transcribed ToxS; R: ToxRWT and ToxRWT interaction without ToxS; RccS: ToxRC236/293S and ToxRC236/293S interaction with co-transcribed ToxS; Rcc: ToxR C236/293S and ToxR C236/293S interaction without ToxS; S: ToxS and ToxS interaction; R-S: ToxRWT and ToxS interaction; Rcc-S: ToxR C236/293S and ToxS interaction. |
把ToxS(VC0983)与细菌双杂交系统的2个检测质粒融合表达,通过在dsbA+和dsbA-菌株中检测菌体的β-半乳糖苷酶活性,发现在dsbA-突变株中,ToxS之间的相互作用显著增强(图 4-B白色柱),ToxS的互作使得β-半乳糖苷酶活性在dsbA-突变株中比dsbA+增加4倍以上。而ToxR与ToxS的相互作用在dsbA-突变株与dsbA+菌株中也有约2倍的差异(图 4-B灰色柱),而ToxR的氧还状态对ToxR与ToxS的互作没有显著的影响。这些结果表明,DsbA主要通过抑制ToxS蛋白之间的相互作用,从而抑制ToxR蛋白之间的互作,进而影响ToxR蛋白的功能。
3 讨论本研究发现,ToxR蛋白周质空间结构域的半胱氨酸残基可被DsbA蛋白氧化,然而,ToxR蛋白本身的氧还状态对其诱导毒力基因ctxAB的转录表达没有影响。ToxS蛋白通过增强ToxR蛋白形成二聚体,从而促进ToxR诱导下游毒力基因的表达。而DsbA蛋白通过抑制ToxS蛋白之间的相互作用从而影响ToxR蛋白的调控功能。研究发现ToxR蛋白是霍乱弧菌中诱导多种基因表达的重要调控因子,包括与致病性相关的毒力基因、与生物被膜合成相关的基因、外膜蛋白OmpT和OmpU基因等[10, 22-23]。在霍乱弧菌toxR基因缺失突变株中,这些基因的表达会发生显著的变化,然而在霍乱弧菌中,ToxR通常不是单独激活这些基因的表达,而往往是与其他一些调控因子共同调控下游基因的表达。因此,ToxR蛋白对下游基因的调控功能在霍乱弧菌中显得更为复杂[10]。如在霍乱弧菌中ToxR与另一个膜蛋白TcpP共同调控ToxT的表达,ToxT进而激活霍乱弧菌与致病相关的一系列毒力基因的表达,如毒素协同菌毛(Toxin cooperative pilus, TCP)、霍乱毒素(Cholera toxin, CTX)、黏附因子等[24]。在霍乱弧菌中ToxT是直接激活CTX基因表达的调控因子,而ToxR是通过激活ToxT的表达从而诱导CTX的表达。然而,在大肠杆菌中ToxR蛋白可以直接激活CTX的表达,因此,通过在大肠杆菌中检测ToxR诱导CTX的表达,可以直接确定ToxR蛋白对下游基因的转录调控功能[25]。本研究主要是通过检测在大肠杆菌中ToxR诱导CTX的表达活性,研究ToxR蛋白的氧还状态对其蛋白功能的影响,从而确定环境信号因子是否可通过影响ToxR蛋白的氧还状态从而影响ToxR蛋白的调控功能。
霍乱弧菌生活环境复杂多变,要适应不同的生境就需要调控不同的基因的表达,细菌体内的基因转录调控蛋白通过感知外界环境信号因子,改变蛋白的功能,从而使得细菌最好地适应生存环境[4, 26]。作为霍乱弧菌最重要的基因表达调控蛋白之一的ToxR蛋白的功能也需要根据外界环境的变化对自身的功能进行调控,从而诱导或抑制不同的基因的表达。前期研究发现,霍乱弧菌TcpP蛋白的氧还状态对蛋白的转录调控功能具有重要的影响[16]。而本研究却发现ToxR蛋白本身的氧还状态对蛋白功能的影响不大(图 3),然而,细胞周质空间的二硫键氧还蛋白DsbA却对ToxR的转录调控功能具有抑制作用(图 2)。这些结果表明ToxR蛋白很可能通过一种未知的分子机制感知周质空间氧还状态的变化,从而对其蛋白功能进行调控。本研究初步探讨了ToxR蛋白功能受DsbA蛋白调控的分子机制,发现DsbA很可能间接通过调控ToxS的互作从而影响ToxR蛋白的功能。然而ToxS蛋白本身并不含有半胱氨酸残基,而DsbA是二硫键氧还蛋白,那么DsbA究竟是如何影响ToxS蛋白的相互作用呢?我们推测,DsbA很可能通过周质空间或细胞膜上其他的调控因子影响ToxS的蛋白互作。另外,我们前期研究发现,肠道中的胆汁酸分子会抑制DsbA蛋白被DsbB蛋白再氧化[15],那么胆汁酸分子是否可通过抑制DsbA蛋白的功能从而促进ToxR蛋白诱导霍乱弧菌毒力基因表达的活性呢?我们将在本研究的基础上对这些问题进行更深入的探讨,这必将有助于我们更清楚地阐明霍乱弧菌毒力基因表达调控的分子机制。因此,本研究的结果为进一步研究霍乱弧菌的致病机制提供重要的理论依据。
| [1] | Davies HG, Bowman C, Luby SP. Cholera - management and prevention. Journal of Infection, 2017, 74(Suppl 1): S66-S73. |
| [2] | Hall RH. Curbing cholera. Science Translational Medicine, 2018, 10(445): eaat9483. DOI:10.1126/scitranslmed.aat9483 |
| [3] | Krukonis ES, DiRita VJ. From motility to virulence: sensing and responding to environmental signals in Vibrio cholerae. Current Opinion in Microbiology, 2013, 6(2): 186-190. |
| [4] | Matson JS, Withey JH, DiRita VJ. Regulatory networks controlling Vibrio cholerae virulence gene expression. Infection and Immunity, 2007, 75(12): 5542-5549. |
| [5] | Hung DT, Mekalanos JJ. Bile acids induce cholera toxin expression in Vibrio cholerae in a ToxT-independent manner. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(8): 3028-3033. |
| [6] | Taylor JL, de Silva RS, Kovacikova G, Lin W, Taylor RK, Skorupski K, Kull FJ. The crystal structure of AphB, a virulence gene activator from Vibrio cholerae, reveals residues that influence its response to oxygen and pH. Molecular Microbiology, 2012, 83(3): 457-470. |
| [7] | Mazumdar S, Bhattacharyya S, Ghosh S, Majumdar S, Ganguly NK. The role of a heat shock protein from V. cholerae 0139 in the gut immune response. Molecular and Cellular Biochemistry, 2007, 297(1/2): 9-19. |
| [8] | Spagnuolo AM, Dirita V, Kirschner D. A model for Vibrio cholerae colonization of the human intestine. Journal of Theoretical Biology, 2011, 289: 247-258. |
| [9] | Morgan SJ, Felek S, Gadwal S, Koropatkin NM, Perry JW, Bryson AB, Krukonis ES. The two faces of ToxR: activator of ompU, co-regulator of toxT in Vibrio cholerae. Molecular Microbiology, 2011, 81(1): 113-128. |
| [10] | Kazi MI, Conrado AR, Mey AR, Payne SM, Davies BW. Toxr antagonizes H-NS regulation of horizontally acquired genes to drive host colonization. PLoS Pathogens, 2016, 12(4): e1005570. |
| [11] | DiRita VJ, Mekalanos JJ. Periplasmic interaction between two membrane regulatory proteins, ToxR and ToxS, results in signal transduction and transcriptional activation. Cell, 1991, 64(1): 29-37. |
| [12] | Midgett CR, Almagro-Moreno S, Pellegrini M, Taylor RK, Skorupski K, Kull FJ. Bile salts and alkaline pH reciprocally modulate the interaction between the periplasmic domains of Vibrio cholerae ToxR and ToxS. Molecular Microbiology, 2017, 105(2): 258-272. |
| [13] | Almagro-Moreno S, Root MZ, Taylor RK. Role of ToxS in the proteolytic cascade of virulence regulator ToxR in Vibrio cholerae. Molecular Microbiology, 2015, 98(5): 963-976. DOI:10.1111/mmi.13170 |
| [14] | Peterson KM. Expression of Vibrio cholerae virulence genes in response to environmental signals. Current Issues in Intestinal Microbiology, 2002, 3(2): 29-38. |
| [15] | Xue YY, Tu F, Shi MT, Wu CQ, Ren GP, Wang XJ, Fang WH, Song HH, Yang MH. Redox pathway sensing bile salts activates virulence gene expression in Vibrio cholerae. Molecular Microbiology, 2016, 102(5): 909-924. |
| [16] | Yang MH, Liu Z, Hughes C, Stern AM, Wang H, Zhong ZT, Kan B, Fenical W, Zhu J. Bile salt-induced intermolecular disulfide bond formation activates Vibrio cholerae virulence. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(6): 2348-2353. |
| [17] | Heras B, Shouldice SR, Totsika M, Scanlon MJ, Schembri MA, Martin JL. DSB proteins and bacterial pathogenicity. Nature Reviews Microbiology, 2009, 7(3): 215-225. |
| [18] | Ren GP, Champion MM, Huntley JF. Identification of disulfide bond isomerase substrates reveals bacterial virulence factors. Molecular Microbiology, 2014, 94(4): 926-944. |
| [19] | Karimova G, Pidoux J, Ullmann A, Ladant D. A bacterial two-hybrid system based on a reconstituted signal transduction pathway. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(10): 5752-5756. |
| [20] | Lippa AM, Goulian M. Perturbation of the oxidizing environment of the periplasm stimulates the PhoQ/PhoP system in Escherichia coli. Journal of Bacteriology, 2012, 194(6): 1457-1463. |
| [21] | Miller J. Experiments in Molecular Genetics. Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press, 1972. |
| [22] | Herrington DA, Hall RH, Losonsky G, Mekalanos JJ, Taylor RK, Levine MM. Toxin, toxin-coregulated pili, and the toxR regulon are essential for Vibrio cholerae pathogenesis in humans. The Journal of Experimental Medicine, 1988, 168(4): 1487-1492. |
| [23] | Miller VL, Taylor RK, Mekalanos JJ. Cholera toxin transcriptional activator toxR is a transmembrane DNA binding protein. Cell, 1987, 48(2): 271-279. DOI:10.1016/0092-8674(87)90430-2 |
| [24] | Goss TJ, Seaborn CP, Gray MD, Krukonis ES. Identification of the TcpP-binding site in the toxT promoter of Vibrio cholerae and the role of ToxR in TcpP-mediated activation. Infection and Immunity, 2010, 78(10): 4122-4133. DOI:10.1128/IAI.00566-10 |
| [25] | Champion GA, Neely MN, Brennan MA, DiRita VJ. A branch in the ToxR regulatory cascade of Vibrio cholerae revealed by characterization of toxT mutant strains. Molecular Microbiology, 1997, 23(2): 323-331. |
| [26] |
Wang QM, Ma Y, Liu LJ, Zhu J, Liu Z. Biofilm development and environmental determinants in Vibrio cholerae. Chinese Journal of Biotechnology, 2017, 33(9): 1533-1546.
(in Chinese) 王全民, 马遥, 刘丽钧, 朱军, 刘智. 霍乱弧菌生物被膜发育与环境调控. 生物工程学报, 2017, 33(9): 1533-1546. |
 2019, Vol. 59
2019, Vol. 59