中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 康晓平, 李裕昌, 吴晓燕, 魏婧靖, 郝淮杰, 姜涛. 2019
- Xiaoping Kang, Yuchang Li, Xiaoyan Wu, Jingjing Wei, Huaijie Hao, Tao Jiang. 2019
- 蜱传脑炎病毒跨过血脑屏障的体外实验
- In vitro experiment for tick borne encephalitis virus transmitting across the blood brain barrier
- 微生物学报, 59(3): 578-586
- Acta Microbiologica Sinica, 59(3): 578-586
-
文章历史
- 收稿日期:2018-05-13
- 修回日期:2018-09-14
- 网络出版日期:2018-11-28
Tao Jiang, Tel:+86-10-66948610, E-mail: jiang_tao@126.com
蜱传脑炎病毒(Tick-borne encephalitis virus,TBEV)属于黄病毒科黄病毒属,单股负链RNA病毒,主要通过蜱虫叮咬传播,可引起重症脑炎和脑膜炎。TBEV流行于多个地区,包括中国北部、日本、俄罗斯及欧洲。TBEV包括3种亚型:远东亚型、西伯利亚亚型及欧洲亚型。3个亚型中,远东亚型感染性和致死率最高,可达25%。我国所流行的TBEV即为远东亚型[1-3]。
TBEV首先通过蜱虫叮咬进入机体,可在血液、脾、淋巴结、肾脏等多种器官中复制增殖,并造成机能失调,进而感染神经系统,造成神经系统损伤。患者常出现严重的脑炎和脑膜炎症状,即使愈后,患者也常出现严重的神经系统后遗症。在TBEV感染过程中,病毒跨过血脑屏障进而侵入中枢神经系统,是引发重症脑炎的关键环节[4-5],目前,TBEV跨过血脑屏障的机制尚不清楚,研究TBEV跨血脑屏障的机制,对于阐释TBEV的感染机制,研发有效的防治手段,具有重要意义。
本研究利用人脑微血管内皮细胞,构建了体外血脑屏障模型。首先研究了TBEV在人脑微血管中的复制增殖情况;进而将TBEV加入体外血脑屏障模型上层微孔中,通过检测下层孔中的病毒量,确定TBEV是否可直接跨过血脑屏障;进而将TBEV感染人单核细胞THP-1,将单核细胞携带的TBEV加入血脑屏障上层孔中,通过检测下层孔中的病毒量,确定TBEV是否可在免疫细胞的协助下跨过血脑屏障。
1 材料和方法 1.1 细胞及病毒株蜱传脑炎病毒森张株由军事医学研究院微生物流行病研究所毒种库提供。人脑微血管内皮细胞hCMEC/D3由军事医学研究院微生物流行病研究所提供,细胞在常规条件下利用含5%胎牛血清(FBS)的EBM-2培养基进行培养。单核细胞THP-1由军事医学研究院微生物流行病研究所细胞库提供,细胞在常规条件下利用含10%胎牛血清(FBS)的1640培养基进行培养。
1.2 TBEV的培养及空斑滴定用含10% FBS的DMEM培养BHK-21细胞至铺面单层,TBEV感染后培养液换为含2% FBS的DMEM,在37 ℃二氧化碳培养箱中培养3–4 d,至细胞病变后,收集上清,用空斑试验进行病毒滴定。
空斑滴定实验的步骤如下:BHK-1细胞传至6孔板内,继续培养至80%–90%时用于感染。将待测病毒液用2% FBS的DMEM完全培养基将病毒作10倍稀释,将病毒稀释液按1 mL/孔感染六孔板内BHK-1细胞,同时设置不加病毒液的阴性对照,37 ℃吸附1 h,期间每隔15 min晃动六孔板;待病毒吸附完成后,移除病毒液,将预热至56 ℃的2.5%低熔点琼脂糖和2×MEM培养基等体积混匀,按2 mL/孔加入六孔板各孔;室温放置3–5 min,待其凝固后,置于37 ℃培养箱继续培养。
然后培养3 d待细胞病变时进行蚀斑染色。将预热至56 ℃的2.5%低熔点琼脂糖和2×MEM培养基等体积混匀,加入20%中性红溶液,按1 mL/孔加入六孔板各孔;室温静置30 min;待其凝固后,置于37 ℃培养箱继续培养。逐日观察中性红染色结果,待六孔板中出现清晰可见的蚀斑时,通过计算蚀斑数量计算病毒滴度。
1.3 hCMEC/D3细胞的培养首先用鼠胶原包被细胞培养瓶/培养板,然后将hCMEC/D3细胞传至细胞培养瓶/培养板中培养。培养液为含5%胎牛血清(FBS)的EBM-2完全培养液。
1.4 体外血脑屏障模型的制备在24孔细胞培养孔中放入Transwell装置(孔径5.0 μmol/L),然后将1×105个/mL的hCMEC/D3细胞传至Transwell上层微孔中,100 μL/孔,下层微孔中加入细胞培养液。待细胞铺满单层,然后将孔中培养液换为含1% FBS的EBM-2完全培养液,在CO2培养箱中继续培养10–15 d,待细胞长为完全致密的单层。然后用伊文思蓝染色法测定细胞的渗透率,具体如下:首先吸除上层孔中液体,并用PBS冲洗1遍。然后在上层孔中加入0.5%伊文斯蓝溶液,200 μL/孔,下层孔中换成PBS,1 mL/孔,37 ℃孵育,分别在孵育0、10、20、30、40、50 min后,取下层孔中液体,加入酶联板中,用化学发光酶联仪测定620 nm发光值。同时将0.5%伊文斯蓝溶液进行对倍稀释,读数,作为标准对照。以时间为横坐标,伊文思蓝荧光强度为纵坐标,分别绘制对照组曲线和实验组曲线。分别计算出对照组曲线的斜率(mf)和实验组曲线的斜率(me)。然后根据以下公式计算血脑屏障的渗透率。1/PS=1/me–1/mf;Pe=PS/s:transwell微孔的底面积,Pe:渗透率系数[6]。
待细胞长至渗透率Pe < 0.02,证明该细胞生长已足够致密,已达到血脑屏障研究的要求。
1.5 TBEV对hCMEC/D3细胞的感染实验hCMEC/D3细胞传至96孔培养板中,采用含5% FBS的EBM-2完全培养液于37 ℃、5% CO2条件下培养,当细胞长至80%–90%后用于病毒感染。将TBEV接种至铺满hCMEC/D3的96孔培养板中,细胞计数后,按照感染复数为1接种病毒,100 μL/孔,同时设未感染病毒的正常细胞对照。取感染后的不同时间点2、4、6、12、24、48、72、96 h,将细胞刮下,吸取细胞及培养上清,同时,显微镜下观察照相。
1.6 TBEV跨血脑屏障实验分别收集在BHK-21细胞中培养的TBE病毒和感染TBEV的THP-1细胞,进行跨血脑屏障研究。将感染复数为1的病毒液100 μL加入铺满hCMEC/D3细胞已符合血脑屏障模型的Transwell微孔中,每组3个复孔,于感染后的不同时间点2、4、6、12、24、48、72、96、120 h分别吸取下层孔中液体,用空斑检测和荧光定量PCR方法进行病毒滴度测定[6-7]。
1.7 实时荧光定量PCR检测TBEV病毒核酸将不同时间点的细胞培养上清进行RNA提取,同时提取已知滴度的TBEV核酸(1×106 PFU/mL)作为核酸标准品,以绘制标准曲线。采用PureLink RNA Mini Kit试剂盒提取RNA:取100 μL上清,加入100 μL含1% β-巯基乙醇的Lysis buffer,于EP管中混匀,再加入100 μL无水乙醇,于振荡器上混匀振荡10–15 s;把以上混合物转移到柱子中(柱子最大容量为700 μL),12000 r/min离心15 s,弃上清;加入700 μL Wash Buffer I到柱子中,12000 r/min离心15 s,弃上清,并把柱子转移到一个新的接收管中;加入500 μL Wash BufferⅡ到柱子中,12000 r/min离心15 s,弃上清;重复上一步骤1次;12000 r/min空管离心1–2 min;扔掉接收管,换一个新的EP接收管;加入30–100 μL RNase-free水,注意要垂直加入到柱子中央;静置1 min;≥12000 r/min离心2 min;扔掉柱子,Ep管中收集的液体即为提取的DNA,标记,冻存于-70 ℃冰箱中。
所用的荧光定量PCR上游引物5′-GGGCGGT TCTTGTTCTCC-3′,下游引物5′-ACACATCACCT CCTTGTCAGACT-3′,探针序列5′-FAM-TGAGCC ACCATCACCCAGACACA-TAMRA-3′ [8],用TaKaRa公司生产的One step real time RT-PCR kit (DRR064A)进行扩增,具体扩增条件按说明书要求进行。
1.8 血脑屏障细胞渗透率变化测定以伊文思蓝偶联的BSA (Evens-BSA)作为指示剂,通过检测Evens-BSA从上层孔中穿过脑微血管内皮细胞层进入下层孔中的百分比,确定血脑屏障渗透率变化情况。在TBEV病毒加入transwell微孔中后,分别在1–3 d后对未长细胞的transwell孔、正常细胞对照组、BHK-21培养的TBEV组、THP-1培养的TBEV组中的下层孔中收集培养液,测OD620值确定血脑屏障细胞渗透率的变化。以未生长细胞的transwell孔作为空白组,渗透率为100%,未加病毒的细胞组作为对照组,实验组的渗透率变化计算公式如下:
渗透率变化(%)=(OD620试验组-OD620对照组)/ (OD620空白组-OD620对照组)×%
2 结果和分析 2.1 TBEV不能在hCMEC/D3细胞中复制增殖TBEV直接感染hCMEC/D3细胞,感染后的不同时间点吸取细胞及培养上清,提取RNA后,进行RT-PCR检测,结果如图 1所示。同时,显微镜下观察照相,结果如图 2所示。在感染后的不同时间点,虽检测到了病毒核酸的存在,但未检测到明显的病毒核酸复制增殖;显微镜观察,与正常细胞组相同,TBEV感染后,hCMEC/D3没有出现细胞病变现象,结果表明TBEV不能感染hCMEC/D3细胞,也不能在hCMEC/D3细胞中复制增殖。

|
| 图 1 TBEV在hCMEC/D3细胞中的增殖动力学 Figure 1 Proliferation kinetics of TBEV in hDMEC/D3 cells. |

|
| 图 2 TBEV感染hCMEC/D3细胞3 d后的显微镜观察 Figure 2 Observation of hCMEC/D3 cells 3 days post infection of TBEV using microscope. A: Normal cells; B: Cells infected with TBEV. |
2.2 BHK-21培养的TBEV不能跨过体外血脑屏障模型
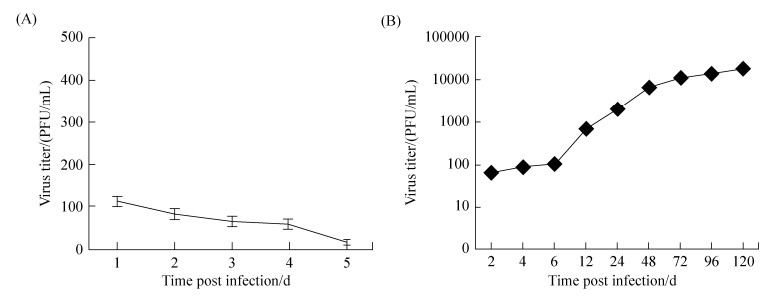
TBEV感染接种至transwell微孔的hCMEC/D3细胞,感染后的不同时间点吸取下层孔中液体,提取RNA后,进行RT-PCR检测,结果如图 3-A所示,在下层孔中检测到了病毒核酸,但随着时间的变化,未检测到明显的病毒核酸增多。表明有少量病毒的核酸片段穿过了hCMEC/D3细胞之间的微小缝隙,进入到了下层孔中。为了确定是否有活病毒穿过血脑屏障进入下层孔中,本研究进一步用空斑检测方法检测下层孔中的病毒滴度。与正常细胞组相同,感染TBEV组没有出现病毒蚀斑现象;CPE观察也发现,感染TEBV组中,BHK-21细胞未出现病变现象,表明TBEV未通过致密的hCMEC/D3细胞层进入下层孔中(图 4-B)。
|
| 图 3 TBEV跨过血脑屏障的病毒滴度测定 Figure 3 Detection of TBEV transmitted across the vitro blood brain barrier. A: TBEV cultured from BHK-21 cells; B: TBEV cultured from THP-1 cells. |

|
| 图 4 跨过体外血脑屏障的TBEV引起的病变效应观察 Figure 4 Visualization of the cytopathology effect caused by TBEV transmitted across the vitro blood brain barrier. A: Normal cells; B: Cells infected with TBEV from BHK-21; C: Cells infected with TBEV from THP-1. |
2.3 THP-1细胞中培养的TBEV可跨过体外血脑屏障模型
TBEV感染THP-1细胞24 h后,收集THP-1细胞,加入铺满hCMEC/D3细胞已符合血脑屏障模型的Transwell微孔中,103细胞/孔,感染后的不同时间点,观察单核细胞的渗漏情况,但未观测到有单核细胞渗透入下层孔中;并于感染后2、4、6、12、24、48、72、96、120 h,分别吸取下层孔中液体,提取RNA,进行RT-PCR检测。结果如图 5所示,感染病毒后12 h,可在下层孔中检测到病毒核酸显著增多,随着时间的变化,病毒核酸也逐渐增加(图 3-B)。
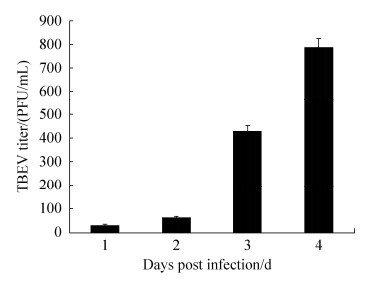
|
| 图 5 噬斑检测跨过血脑屏障的TBEV滴度 Figure 5 TBEV titer transmitting across the BBB by plaque assay. |
为了验证下层孔中检测到的是否为活病毒,采用CPE观察实验验证,将TBEV+THP-1细胞组和正常THP-1细胞组,各组在1–4 d取下层孔中液体作10倍梯度稀释,感染BHK-21细胞,观察细胞病变情况。由于CPE观察实验分析了各时间点不同稀释度的样品,结果较多,此处只列出其中两组作比较,如图 4-C所示,与正常细胞组相比,病毒组中,BHK-21细胞变圆脱落,出现了明显的细胞病变现象,空斑检测结果表明,至感染后第4天,下层孔中的病毒滴度可达到7×102 PFU/mL,表明THP-1细胞中培养的TBEV可穿过hCMEC/D3致密细胞层(图 5)。但下层孔中未观测到单核细胞,表明单核细胞不能直接携带TBEV跨过血脑屏障。
2.4 TBEV跨血脑屏障过程中可引起细胞渗透率变化为了确定在TBEV跨血脑屏障过程中血脑屏障细胞渗透率的变化,本研究以伊文思蓝偶联的BSA作为指示剂,通过检测Evens-BSA从上层孔中穿过脑微血管内皮细胞层进入下层孔中的百分比,确定血脑屏障渗透率变化情况。结果如图 6所示。来自BHK-21细胞的TBEV培养上清未引起细胞渗透率发生明显变化,而感染TBEV的THP-1细胞组,感染3 d后,细胞的渗透率已增高50%,至第4天,细胞渗透率已增高90%。表明THP-1细胞感染TBEV后,培养上清可造成血脑屏障渗透率的增高,从而利于病毒跨过血脑屏障进入中枢神经系统中。

|
| 图 6 血脑屏障渗透率变化 Figure 6 Permeability damage of BBB. Group 1: THP-1 cells infected with TBEV; Group 2: TBEV group; Group 3: Normal cells. |
3 讨论
病毒在感染机体过程中,跨过血脑屏障是进入中枢神经系统从而引发重症感染的关键环节。病毒进入中枢神经系统的途径,通常包括以下3种[9-12]:(1)受体介导的跨细胞途径。病毒通过与细胞表面受体结合进入内皮细胞,并在内皮细胞中复制增殖,进而侵入CNS。如西尼罗病毒、日本乙型脑炎等病原体。(2)通过内皮细胞间隙进入CNS。机体在受到感染过程中,免疫系统可分泌多种免疫因子,从而发挥免疫保护作用,但过度的免疫反应则可造成免疫系统的损伤[13]。如IL-1ß、TNFα等先天免疫相关因子可促进金属蛋白酶(matrix metalloproteinase,MMPs)的产生,而MMPs的高表达可造成内皮细胞细胞间紧密连接蛋白的降解,从而造成血脑屏障通透性的增高,病原体可从细胞间隙进入CNS。(3)免疫细胞介导的木马机制。病原体通过感染免疫细胞而进入CNS,如李斯特菌、HIV等。已有研究表明李斯特菌、日本乙型脑炎病毒(JEV)可直接感染单核细胞及巨噬细胞,并可由单核细胞携带进入中枢神经系统[14-15]。
目前对病毒跨血脑屏障研究,通常采用体外模型进行研究。将人脑微血管内皮细胞培养在含有上下两层微孔的装置中,待细胞长成致密的单细胞层、渗透率足够低时,进行病毒跨血脑屏障实验。通过检测病毒的复制增殖、血脑屏障细胞层渗透率的变化、跨膜病毒的滴度,确定病毒的跨膜途径及机制。
本研究首先进行了TBEV感染hCMEC/D3细胞的实验,结果表明TBEV不能在hCMEC/D3细胞内复制增殖。进而利用人脑微血管内皮细胞hCMEC/D3制备了体外血脑屏障模型。同样TBEV无法跨过由hCMEC/D3细胞组成的体外血脑屏障模型。
TBEV可在多种靶细胞中复制增殖,包括神经细胞、肾细胞、淋巴细胞等[5, 8, 16-18]。本课题组在前期工作中,检测到TBEV可在单核细胞中复制增殖,于感染后1 d,即有30%以上的THP-1细胞感染病毒,并且细胞的生长活性保持良好[16]。为了进一步探索TBEV是否可由淋巴细胞携带跨过血脑屏障,本研究取TBEV感染1 d后的THP-1细胞进行跨血脑屏障实验,结果表明,虽然单核细胞未进入下层孔中,但却有大量病毒跨过血脑屏障,并且可造成血脑屏障渗透率的增高。表明单核细胞对于TBEV跨过血脑屏障,可发挥重要作用。
淋巴细胞感染病毒后,常会出现细胞因子风暴[13, 19]。在前期工作中,本课题组收集了多例TBEV感染病人的脑脊液临床样本,检测到在TBEV病人脑脊液中出现IL-6、IL-1β、MMP-9的高表达,且MMP-9的表达升高与病人疾病的严重程度密切相关[20]。MMP-9是一种与血脑屏障密切相关的因子,其高表达可造成内皮细胞细胞间紧密连接蛋白的降解,从而造成血脑屏障通透性的增高。本研究检测到单核细胞并未直接携带TBEV跨过血脑屏障,TBEV是伴随血脑屏障的破坏进入下层孔中。推测单核细胞感染TBEV后,其产生的某些因子造成了血脑屏障渗透率的增高。在下一步工作中,本研究拟进一步研究THP-1感染病毒后所分泌的细胞因子及MMP-9等分子的表达变化,及与血脑屏障渗透率变化之间的关系,这对于揭示TBEV跨血脑屏障的分子机制,将具有重要意义。
| [1] | Mansfield KL, Johnson N, Phipps LP, Stephenson JR, Fooks AR, Solomon T. Tick-borne encephalitis virus-a review of an emerging zoonosis. Journal of General Virology, 2009, 90(8): 1781-1794. DOI:10.1099/vir.0.011437-0 |
| [2] | Kreil TR, Burger I, Bachmann M, Fraiss S, Eibl MM. Antibodies protect mice against challenge with tick-borne encephalitis virus (TBEV)-infected macrophages. Clinical & Experimental Immunology, 1997, 110(3): 358-361. |
| [3] | Hayasaka D, Nagata N, Fujii Y, Hasegawa H, Sata T, Suzuki R, Gould EA, Takashima I, Koike S. Mortality following peripheral infection with tick-borne encephalitis virus results from a combination of central nervous system pathology, systemic inflammatory and stress responses. Virology, 2009, 390(1): 139-150. |
| [4] | Kaufmann B, Rossmann MG. Molecular mechanisms involved in the early steps of flavivirus cell entry. Microbes and Infection, 2011, 13(1): 1-9. DOI:10.1016/j.micinf.2010.09.005 |
| [5] | Dörrbecker B, Dobler G, Spiegel M, Hufert FT. Tick-borne encephalitis virus and the immune response of the mammalian host. Travel Medicine and Infectious Disease, 2010, 8(4): 213-222. DOI:10.1016/j.tmaid.2010.05.010 |
| [6] | Roe K, Kumar M, Lum S, Orillo B, Nerurkar VR, Verma S. West Nile virus-induced disruption of the blood-brain barrier in mice is characterized by the degradation of the junctional complex proteins and increase in multiple matrix metalloproteinases. Journal of General Virology, 2012, 93(6): 1193-1203. |
| [7] | Al-Obaidi MMJ, Bahadoran A, Har LS, Mui WS, Rajarajeswaran J, Zandi K, Manikam R, Sekaran SD. Japanese encephalitis virus disrupts blood-brain barrier and modulates apoptosis proteins in THBMEC cells. Virus Research, 2017, 233: 17-28. DOI:10.1016/j.virusres.2017.02.012 |
| [8] | Růžek D, Vancová M, Tesařová M, Ahantarig A, Kopecký J, Grubhoffer L. Morphological changes in human neural cells following tick-borne encephalitis virus infection. Journal of General Virology, 2009, 90(7): 1649-1658. DOI:10.1099/vir.0.010058-0 |
| [9] | Labuda M, Austyn JM, Zuffova E, Kozuch O, Fuchsberger N, Lysy J, Nuttall PA. Importance of localized skin infection in tick-borne encephalitis virus transmission. Virology, 1996, 219(2): 357-366. DOI:10.1006/viro.1996.0261 |
| [10] | Cerovic V, McDonald V, Nassar MA, Paulin SM, MacPherson GG, Milling SWF. New insights into the roles of dendritic cells in intestinal immunity and tolerance. International Review of Cell and Molecular Biology, 2008, 272: 33-105. DOI:10.1016/S1937-6448(08)01602-X |
| [11] | Nathan C. Neutrophils and immunity:challenges and opportunities. Nature Reviews Immunology, 2006, 6(3): 173-182. DOI:10.1038/nri1785 |
| [12] | Gupta N, Lomash V, Rao PVL. Expression profile of Japanese encephalitis virus induced neuroinflammation and its implication in disease severity. Journal of Clinical Virology, 2010, 49(1): 4-10. DOI:10.1016/j.jcv.2010.06.009 |
| [13] | Grygorczuk S, Parczewski M, Świerzbińska R, Czupryna P, Moniuszko A, Dunaj J, Kondrusik M, Pancewicz S. The increased concentration of macrophage migration inhibitory factor in serum and cerebrospinal fluid of patients with tick-borne encephalitis. Journal of Neuroinflammation, 2017, 14(1): 126. DOI:10.1186/s12974-017-0898-2 |
| [14] | Michalicová A, Bhide K, Bhide M, Kováč A. How viruses infiltrate the central nervous system. Acta Virologica, 2017, 61(4): 393-400. DOI:10.4149/av_2017_401 |
| [15] | Yang KD, Yeh WT, Chen RF, Chuon HL, Tsai HP, Yao CW, Shaio MF. A model to study neurotropism and persistency of Japanese encephalitis virus infection in human neuroblastoma cells and leukocytes. Journal of General Virology, 2004, 85(3): 635-642. DOI:10.1099/vir.0.19426-0 |
| [16] |
Wei JJ, Kang XP, Li YC, Wu XY, Zhang Y, Yang YH. Pathogenicity of tick-borne encephalitis virus to monocytes. Acta Microbiologica Sinica, 2013, 53(11): 1221-1225.
(in Chinese) 魏婧靖, 康晓平, 李裕昌, 吴晓燕, 张雨, 杨银辉. 蜱传脑炎病毒对人单核细胞的致病性. 微生物学报, 2013, 53(11): 1221-1225. |
| [17] |
Wei JJ, Li YC, Wu XY, Si BY, Zhang Y, Li J, Hu Y, Zhu QY, Yang YH, Kang XP. Studying the pathogenicity of TBEV to human neuroblastoma tumor cells. Chinese Journal of Microbiology and Immunology, 2012, 32(5): 415-418.
(in Chinese) 魏婧靖, 李裕昌, 吴晓燕, 司炳银, 张雨, 李靖, 户义, 祝庆余, 杨银辉, 康晓平. TBEV对人神经细胞致病性的实验研究. 中华微生物学和免疫学杂志, 2012, 32(5): 415-418. DOI:10.3760/cma.j.issn.0254-5101.2012.05.008 |
| [18] | Ahantarig A, Růžek D, Vancová M, Janowitz A, Št'astná H, Tesařová M, Grubhoffer L. Tick-borne encephalitis virus infection of cultured mouse macrophages. Intervirology, 2009, 52(5): 283-290. DOI:10.1159/000235741 |
| [19] | van Marle G, Antony J, Ostermann H, Dunham C, Hunt T, Halliday W, Maingat F, Urbanowski MD, Hobman T, Peeling J, Power C. West nile virus-induced neuroinflammation:glial infection and capsid protein-mediated neurovirulence. Journal of Virology, 2007, 81(20): 10933-10949. DOI:10.1128/JVI.02422-06 |
| [20] | Kang XP, Li YC, Wei JJ, Zhang Y, Bian C, Wang K, Wu XY, Hu Y, Li J, Yang YH. Elevation of matrix metalloproteinase-9 level in cerebrospinal fluid of tick-borne encephalitis patients is associated with IgG extravassation and disease severity. PLoS ONE, 2013, 8(11): e77427. DOI:10.1371/journal.pone.0077427 |
 2019, Vol. 59
2019, Vol. 59