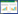中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 单凯, 王春蕾, 方志军, 穆春华, 许艳蕊, 黄晓文, 郝鲁江. 2019
- Kai Shan, Chunlei Wang, Zhijun Fang, Chunhua Mu, Yanrui Xu, Xiaowen Huang, Lujiang Hao. 2019
- “使它隆”对玉米根部不同微生环境细菌群落多样性的影响
- Effects of "starane" on the diversity of bacterial communities in different micro-environment of maize roots
- 微生物学报, 59(3): 510-522
- Acta Microbiologica Sinica, 59(3): 510-522
-
文章历史
- 收稿日期:2018-04-27
- 修回日期:2018-07-30
- 网络出版日期:2018-11-20
2. 齐鲁工业大学(山东省科学院)能源研究所, 山东 济南 250014;
3. 山东省农业科学院玉米研究所, 山东 济南 250100
2. Energy Research Institute, Qilu University of Technology(Shandong Academy of Sciences), Jinan 250014, Shandong Province, China;
3. Maize Research Institute, Shandong Academic of Agricultural Sciences, Jinan 250100, Shandong Province, China
玉米作为重要的粮食作物,在山东省农业生产、经济发展中占有重要地位。玉米田杂草发生种类多,数量大,发生期长,危害重,是影响玉米高产优质的主要障碍[1]。除草剂具有省时、省力、高效、增产等优点,在农业上被广泛使用。但除草剂能够改变土壤微生物的群落结构和活性,影响微生物种群和数量[2],对玉米根系内生菌也会产生影响。微生物是生态系统中有机物的主要分解者,在生态系统中具有非常重要的地位。植物内生菌和土壤微生物作为与生产者植物最为密切的生物,对植物的生长有重要的影响,反过来植物对于内生菌和土壤微生物的群落结构和组成也有一定的影响[3]。
使它隆,学名氯氟吡氧乙酸(4-氨基-3, 5-二氯-6-氟-2-吡啶氧乙酸),与2, 4-D都属于激素型除草剂,对控制出苗后阔叶草极为有效,和吲哚乙酸一样,均是控制植物的生长与发育过程,影响调节植物基因的表达,它通过活化敏感植物内的代谢过程,导致乙烯积累,从而造成异常症状,如茎弯曲、组织肿胀、叶片杯状、生长与光合作用受抑制,最终导致植株死亡[4]。许艳蕊等和王春蕾等前期研究发现使它隆对玉米土壤细菌多样性产生一定影响,喷施使它隆能降低玉米根系内生菌的多样性,并使内生菌的组成比例发生变化[5-6]。
本研究利用第二代高可信度[7]的Illumina Miseq测序技术,分析玉米不同生长期喷施使它隆除草剂对玉米土壤细菌及根系内生菌群落结构和多样性的影响,进而探索更加科学低污染的玉米栽培技术。
1 材料和方法 1.1 实验材料 1.1.1 供药试剂:由江苏辉丰农化有限公司生产的供试药剂“使它隆”。
1.1.2 玉米品种:由山东省农业科学院玉米研究所选育的玉米品种鲁单818。
1.2 样品的采集2016年6月(苗期)、8月(花期)、9月(成熟期)分别于山东省农科院玉米研究所龙山试验基地,在同一玉米田随机采集健康生长且状况一致的玉米,挖取其带有完整毛细根系的根系、根际土壤和非根际土壤样品,非根际土壤取自玉米根际投影范围外距离根系5 cm的土样。将采集后的样品低温保存带回,置于–80 ℃冰箱备用。试验于玉米3–5叶期时施药,药剂用量参照说明书。经使它隆处理过的非根际、根际和根系样品分别标记为LSH、LS、LR8,对照组样品标记为LSHCK、LSCK、LR8CK。由于使它隆属于内吸传导型苗后除草剂,因此在苗期未作施药处理,所采集15个样品信息如表 1所示。
| Number | Starane treatment | Collection period | Collection dat |
| LSH1CK | - | Seedling stage | 2016.6.24 |
| LSH2 | + | Flowering stage | 2016.8.24 |
| LSH2CK | - | Flowering stage | 2016.8.24 |
| LSH3 | + | Maturation stage | 2016.9.17 |
| LSH3CK | - | Maturation stage | 2016.9.17 |
| LS1CK | + | Seedling stage | 2016.6.24 |
| LS2 | - | Flowering stage | 2016.8.24 |
| LS2CK | + | Flowering stage | 2016.8.24 |
| LS3 | - | Maturation stage | 2016.9.17 |
| LS3CK | + | Maturation stage | 2016.9.17 |
| LR81CK | - | Seedling stage | 2016.6.24 |
| LR82 | + | Flowering stage | 2016.8.24 |
| LR82CK | - | Flowering stage | 2016.8.24 |
| LR83 | + | Maturation stage | 2016.9.17 |
| LR83CK | - | Maturation stage | 2016.9.17 |
| +: maize with spraying starane; –: maize without spraying starane. | |||
1.3 样品的处理
为了获得玉米根系、根际土和非根际土的微生物群落,采集的样品需要进行分步处理。
1.3.1 根系样品:将根系先用无菌水冲洗后自然晾干,每个样品采用多点取样,用无菌剪刀于根尖端部剪取2–3 cm,混合均匀后,先后用70%乙醇、0.53%次氯酸钠和70%乙醇分别浸泡5 min、10 min和30 s,再用无菌水冲洗30 s左右,重复5–7次,结束后用无菌滤纸吸干。
1.3.2 根际土样品:轻轻晃动将根系表面的散土抖落,把依旧附着在表面的粘土洗下,高速离心得到根际土。
1.3.3 非根际土样品:用研钵将块状土研碎混合均匀后备用。
1.4 试验方法 1.4.1 基因组DNA的提取:采用细菌基因组DNA快速抽提盒(生工生物工程股份有限公司,上海),参照说明书,对不同处理下的玉米非根际土、根际土及玉米根系内生菌的总DNA进行提取。将提取的DNA用0.8%琼脂糖凝胶进行电泳,用紫外分光光度计检测其质量和浓度。
1.4.2 PCR扩增:选用引物530F (5'-GTGCCAGC MGCCGCGGTAA-3')和907R (5'-CCGTCAATTC MTTTRAGTTT-3'),对16S rRNA基因的V4–V5区进行扩增,扩增产物通过2%琼脂糖凝胶电泳进行检测,采用AXYGEN公司的凝胶回收试剂盒对目标片段进行切胶回收。利用TruSeq Nano DNA LT Library Prep Kit试剂盒构建克隆文库,委托上海派森诺生物科技有限公司,在Agilent Bioanalyzer上将构建好的文库质检,合格后用Illumina Miseq上机测序。
1.5 数据分析采用Illumina MiSeq平台对群落DNA片段进行双端(Paired-end)测序,测序原始数据经质量筛查,利用FLASH软件[8]进行配对连接,将连接后的序列识别分配入对应样本,从而获得每个样本的有效序列。运用QIIME软件[9]识别疑问序列,通过QIIME软件检查并剔除嵌合体序列,统计高质量序列数,调用UCLUST[10]这一序列比对工具对获得的高质量序列按97%的序列相似度进行归并和OTU划分,使用R软件计算各样本共有OTU的数量,通过Venn图呈现各样本所共有和独有OTU所占的比例,在R软件中编写脚本绘制各样本的丰度等级曲线。应用Mothur软件计算生物多样性指数,以对群落结构的Alpha多样性进行分析。对丰度前50位的属进行聚类分析绘制热图并对属水平上的分类及物种丰度进行主成分分析PCA[11],绘制PCA图,得到微生物群落结构组成。不同分组的UniFrac距离值差异可以通过箱线图进行展示,结合统计检验结果,有助于更全面地描述组内和组间的菌群结构差异大小,分别在门和属水平进行群落结构的分类学组成分析,得到群落样本的主要分布特征。采用PICRUSt方法[12]将现有的16S rRNA基因测序数据与KEGG数据库对比,比较功能基因在生物代谢通路上的丰度差异,从而分析喷施除草剂使它隆对玉米根部相关细菌新陈代谢的影响。
2 结果和分析 2.1 测序结果本研究对15个样品进行了Illumina MiSeq高通量测序分析,原始数据经拼接后得到544393条有效序列,过滤后得到333565条优质序列。通常在97%的相似水平下对序列进行OTU的聚类,统计得到所有样品在不同OTUs中的丰度信息。样品的优质序列长度主要分布在393–400 bp之间,在394 bp的序列数最多为142266条(图 1)。细菌16S rRNA V4–V5区的长度为400 bp左右,从序列长度的分布来看,与16S rRNA V4–V5区序列长度大致吻合。

|
| 图 1 优质序列长度分布图 Figure 1 Length distribution of high quality sequences |
2.2 多样本共有OTU分析
根据Venn图可知(图 2),非根际土壤中包含共有5152个OTUs,根际土壤包含共有5266个OTUs,根系内生菌包含共有2667个OTUs,这说明根际土壤样品的物种种类最多。有1687个OTUs均出现在非根际土、根际土和根系中。非根际土和根际土样品中共有的OTUs共4866个,分别占94.4%和92.4%。根际土和根系内生菌样品中共有的OTUs有1888个,分别占35.9%和70.8%。非根际土和根系内生菌样品共有的OTUs有1806个,分别占35.1%和67.7%。这些数据表明,非根际土壤和根际土壤群落结构更为相似。

|
| 图 2 Venn图 Figure 2 Venn diagrams |
2.3 丰度等级曲线
丰度等级曲线将每个样本中的OTU按其丰度大小沿横坐标依次排列,并以各自的丰度值为纵坐标,用折线或曲线将各OTU互相连接,从而反映各样本中OTU丰度的分布规律,对于微生物群落样本,该曲线可以直观地反映群落中高丰度和稀有OTU的数量。
如图 3所示,根际土壤样品曲线跨度最大,且各时期与非根际土壤样品各时期曲线重合较多,而根系内生菌样品曲线各时期曲线跨度小,少有重合,说明根际土壤样品和非根际土壤样品群落的丰富度和均匀度较高,而玉米根系内生菌样品群落的丰富度和均匀度都比较低。同时,成熟期的玉米根系内生菌样品群落的丰富度,在施用除草剂使它隆后下降比较剧烈,其他组虽有下降,但差异并不明显,说明除草剂对成熟期玉米根系内生菌的影响较大。
|
| 图 3 丰度等级曲线图 Figure 3 The rank abundance curve |
2.4 Alpha多样性指数计算
Alpha多样性分析是指一个特定生态系统的多样性,常用的度量指数包括群落丰富度指数和群落多样性指数。细菌群落丰富度用Chao1指数和ACE指数表示,其值越高表明群落物种的丰富度越高;细菌群落多样性程度用Shannon指数和Simpson指数表示,Shannon指数和Simpson指数越大,说明群落多样性越高。
Alpha多样性结果如表 2所示,玉米根部3个生长时期内相关细菌的Chao1、ACE、Simpson、Shannon值都是在根际土样品中最高,其次是非根际土样品,最后是根系内生菌样品,说明根际土壤群落丰富度和多样性是最高的,与图 3结果相一致。对根际土样品进行分析可知,在花期,处理组LS2的Chao1和ACE指数低于对照组,另一个用于评价多样性的指数Simpson和Shannon值也呈现此规律,说明使它隆处理后,在花期样品群落的丰富度和多样性降低;在成熟期,处理组LS3的Chao1和ACE指数与对照组相比降低,说明使它隆处理后,在成熟期样品群落的丰富度降低,Simpson、Shannon指数与对照相比相差不大,说明使它隆处理后,在成熟期样品的群落多样性会慢慢恢复,逐渐恢复到原有水平。
| Sample | Chao1 | ACE | Simpson | Shannon | |
| Non-rhizosphere | LSH1CK | 4634 | 5043 | 0.9957 | 9.83 |
| LSH2 | 4398 | 4694 | 0.9947 | 9.70 | |
| LSH2CK | 4395 | 4717 | 0.9966 | 9.86 | |
| LSH3 | 4548 | 4835 | 0.9967 | 9.93 | |
| LSH3CK | 4570 | 4908 | 0.9971 | 10.01 | |
| Rhizosphere | LS1CK | 4395 | 4731 | 0.9967 | 9.92 |
| LS2 | 4550 | 4917 | 0.9967 | 9.88 | |
| LS2CK | 5061 | 5269 | 0.9971 | 10.04 | |
| LS3 | 4641 | 4854 | 0.9974 | 10.13 | |
| LS3CK | 4760 | 5041 | 0.9972 | 10.13 | |
| Endophyte | LR81CK | 888 | 935 | 0.6033 | 2.47 |
| LR82 | 1055 | 1069 | 0.9576 | 6.11 | |
| LR82CK | 1134 | 1128 | 0.9645 | 6.655 | |
| LR83 | 969 | 972 | 0.9292 | 5.566 | |
| LR83CK | 2576 | 2593 | 0.9620 | 7.10 | |
对玉米鲁单818根系内生菌样品进行分析可知,在花期,处理组LR82的Chao1、ACE、Simpson和Shannon都降低,说明使它隆处理后,在花期样品群落的丰富度和多样性降低;在成熟期,处理组LR83的Chao1、ACE、Simpson和Shannon显著降低,说明使它隆的使用对成熟期根系内生菌群落的丰富度和多样性影响比较明显。
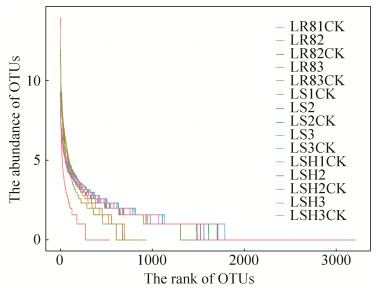
2.5 Beta多样性分析 2.5.1 PCA主成分分析:PCA中每1个点代表 1个样本,相同颜色的点来自同一个分组,2点之间距离越近表明两者的群落构成差异越小。如图 4所示,第一轴的解释量为70.99%,第二轴的解释量为21.75%,2轴的累积贡献率达到92.74%,能较为全面地反映样本信息。根际土样品和非根际土样品的点较为集中,说明根际土和非根际土土壤群落相似度比较高。而根系内生菌样品各点的距离差异比较大,说明各时期的根系内生菌群落差异性显著。
|
| 图 4 PCA分析的样本二维排序图 Figure 4 Two-dimensional sorting graph of PCA analysis |
2.5.2 基于UniFrac距离的多组比较箱线图:
通过对原始数据样本进行分析,获得箱线图对样品组间和组内差异进行比较分析,可以直接体现组间和组内的菌群结构差异大小。本研究将15个样品根据部位不同分成3组,进行组间和组内差异性比较,并且每2组之间相互比较,结果如图 5所示,不同组间的差异性较为明显,2组与其他各组间差异较大;各组内向比较而言,1、2组差异并不明显,3组差异最大,该结果表明生长时期对根际和非根际土壤群落结构影响较小,对根系内生菌群落结构影响较大。

|
| 图 5 多组比较箱线图 Figure 5 Multiple groups of comparative box-plot. 1: non-rhizosphere samples; 2: rhizosphere samples; 3: endophyte samples |
2.6 细菌群落组成分析 2.6.1 细菌在门水平上的群落组成:
在门的分类水平上,15个样品共检测到39个细菌门。如图 6所示,对门水平上相对丰度前20位的细菌门分析,在非根际土和根际土中主要的优势菌门有变形菌门(Proteobacteria)、酸酐菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)、泉古菌门(Crenarchaeota)、芽单胞菌门(Gemmatimonadetes)和拟杆菌门(Bacteroidetes),最优势菌门是变形菌门,其次是放线菌门。玉米鲁单818根系中主要的优势细菌门有变形菌门、放线菌门、蓝藻细菌门(Cyanobacteria)、拟杆菌门、厚壁菌门(Firmicutes),最优势菌门是变形菌门,其次是厚壁菌门。同一微生环境不同生长时期各个门所占比例也有所变化,使它隆处理后的非根际土样品中,随着成熟期的到来,泉古菌门、酸酐菌门、放线菌门、绿弯菌门,芽单胞菌门比例增高,变形菌门、浮霉菌门、拟杆菌门、硝化螺旋菌门比例降低。使它隆处理的根际样品中,成熟期放线菌门、拟杆菌门、绿弯菌门、变形菌门比例增加,其他菌门比例降低。而在根系样品中,成熟期比例增加的是变形菌门和厚壁菌门,但放线菌门、拟杆菌门、蓝细菌门比例降低。

|
| 图 6 门水平的微生物组成丰度图 Figure 6 Phylum-level taxonomic composition of the bacterial community |
2.6.2 细菌在属水平上群落构成:
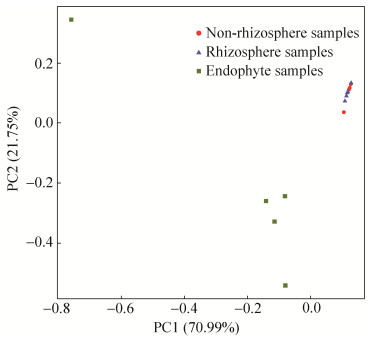
在属的分类水平上,如图 7所示,对相对丰度前20位的细菌属分析,在非根际土和根际土中主要菌属有Nitrososphaera、Arthrobacter、Rhodoplanes、Steroidobacter、Nitrospira、Bacillus、Planctomyces。其中Nitrososphaera、Arthrobacter和Rhodoplanes是优势菌种。在非根际土样品中使它隆处理后,在花期,Nitrososphaera和Rhodoplanes的比例减少,Arthrobacter比例增加;在成熟期,处理组Nitrososphaera升高,Arthrobacter、Rhodoplanes降低。在根际土样品中,使它隆处理后,在花期Nitrososphaera和Nitrospira的比例增加;在成熟期,Nitrososphaera和Arthrobacter的比例降低。在根系样品中主要的细菌属有Lactococcus、Nocardiopsis、Acinetobacter、Agrobacterium、Sediminibacterium、Geobacillus、Pseudomonas、Rhodococcus、Sporosarcina、Rhodanobacter、Streptococcus、Paucibacter,其中主要的优势菌属是Lactococcus、Nocardiopsis、Acinetobacter、Agrobacterium和Sediminibacterium。使它隆处理后,在花期各优势菌属比例都增加,Acinetobacter比例增加最大;在成熟期,Lactococcus的比例显著增加,由10.3%增加到18.6%;Acinetobacter和Agrobacterium的比例显著降低,分别由11.5%降低到4.7%,8.6%降到2.1%。
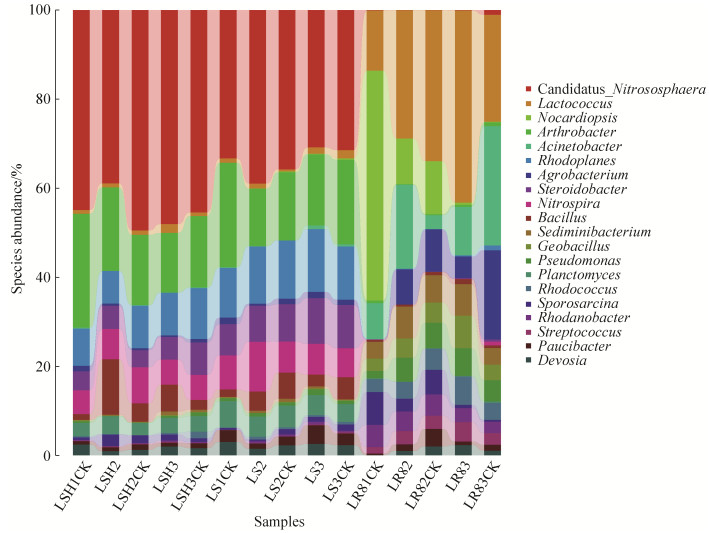
|
| 图 7 属水平的微生物组成丰度图 Figure 7 Genus-level taxonomic composition of the bacterial community |
2.6.3 Heatmap聚类分析:
本研究在属水平分别进行聚类分析,其热图可以反映多个样品在分类水平上群落组成的相似性和差异性。通过图 8可知,15个样品明显地分成两大类,5个根系样品细菌群落结构较接近,聚为一支,10个土壤样品细菌群落结构较接近,聚为一支。说明根系的群落组成和非根际土、根际土的群落组成有明显的差异,根际土壤和非根际土壤的群落组成具有相似性。这一结果表明,玉米相关细菌群落组成差异与它所处的微生境有关,生长时期对它影响较小。

|
| 图 8 属水平群落组成热图 Figure 8 Heatmap analysis at genus level |
2.7 菌群代谢功能预测
如图 9所示,本研究在玉米样本中检测出6大类功能基因:细胞过程(cellular processes)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病(human diseases)、新陈代谢(metabolism)和生物体系统(organismal systems)。这6大类功能基因共包括36种功能基因,在生物体生命活动的各方面发挥着作用。

|
| 图 9 群落样本的代谢功能预测图 Figure 9 Community metabolic function prediction |
研究检测出有3种功能基因与细胞进程(cellular processes)相关,其中,细胞运动(cell motility)在各样本中含量最高,且该基因根际土壤样品中含量最高,在各样品中另外2种基因含量相近,样品组内的差异也比较小,因为细胞运动、细胞生长与凋亡(cell growth and death)和细胞通讯(cell communication)这类基因属于在微生物细胞中稳定表达的一类组成型基因,除草剂等环境因素对其含量影响较小;有3种功能基因与环境信息处理(environmental information processing)相关,关于膜运输(membrane transport)相关基因在各样本中含量最高,其中,该基因在根系样品中含量最高;4种功能基因与遗传信息处理(genetic information processing)相关,含量最高的是复制和修复(replication and repair)相关的基因,其次为与翻译(translation)相关的基因。这是由于这类基因是维持细胞基本生命活动所必需的,所以该类基因的丰度也比较高。有6种功能基因被检测出来与人类疾病(human diseases)相关,但是该类基因在所有样品中的丰度很低,说明该类微生物的数量很少。共有12个功能基因与新陈代谢(metabolism)相关,其含量和丰度都比较高,说明该类基因对完成机体的生命活动是必不可少的,其中含量最高的是氨基酸代谢(amino acid metabolism)和碳水化合物代谢(carbohydrate metabolism)相关的基因,各样品组内差异性较小,从侧面反映出施用除草剂使它隆后对玉米土壤相关细菌代谢活动有影响,需要耗费较多的能量生存;发现有8个功能基因与生物体系统(organismal systems)相关,该类基因在土壤中的丰度很低。
3 讨论和结论本研究采用Illumina Miseq高通量测序技术分析不同生长时期喷施除草剂使它隆对玉米土壤细菌及根系内生菌群落结构和多样性的影响。结果显示根系的群落组成和非根际土、根际土的群落组成有明显的差异,根际土壤和非根际土壤的群落组成具有一定的相似性,在一定程度上说明玉米根部相关细菌的定殖具有选择性并且是从根际到根系逐步专一化的,这种定殖规律是与多种因素有关(如温度、湿度、pH、盐分、氧气含量等),方圆等[13]对草甸草原微生物群落分析表明,土壤含水量、土壤总碳和土壤总氮可能影响草甸草原土壤微生物群落组成。相关研究发现植物根内生细菌主要来源于根际土壤的细菌[14]。
高通量测序结果表明,在门水平上,非根际土和根际土样品中最优势菌门为变形菌门,其次是放线菌门,根系内生菌样品中最优势菌门是变形菌门。王秀呈[15]利用高通量测序技术研究不同绿肥处理下的稻田根际微生物群落组成,显示在门水平上水稻根相关细菌的最优势类群为变形菌门;崔尹赡[16]通过高通量测序分析三七根际群落结构时发现,变形菌门在各个样本细菌群落中占主导地位,变形菌门细菌为最优势菌群。由此可以推测,变形菌门细菌在植物根部具有明显的优势。
本次研究还发现,除草剂使它隆使用后会降低玉米花期根际土壤细菌群落的丰富度和多样性,至成熟期其多样性和丰富度又逐渐恢复。通过对门水平和属水平的群落组成分析发现,非根际土样品和根际土样品在施用除草剂前后群落组成虽有变化但是差异较小,说明除草剂使它隆对玉米根部土壤微生物无显著影响,究其原因,可能与使它隆施用方式有关。本实验对杂草进行茎叶喷施使它隆,施用后除草剂不能立即进入土壤,残存在土壤中的除草剂浓度较小,因此对根际微生物群落影响较小。有研究显示,农药很少对微生物总量有持久影响,当除草剂在土壤中被降解后,对能表征土壤环境生态效应的生物学指标的影响随之降低[17]。孙淑清等[18]研究莠去津和烟嘧磺隆在玉米田施用后,对土壤微生物的数量具有一定影响,但经过一定时间后,随着土壤中除草剂含量的减少,微生物量能够逐渐恢复。
研究结果表明,使它隆对玉米成熟期根系内生菌样品的影响最为显著,群落多样性降低尤为明显。同时还发现有少量杂草生长的玉米植株生长状态优于使用除草剂后的植株,对施用使它隆处理后的成熟期玉米的属水平群落结构分析发现,土壤杆菌属(Agrobacterium)的比例显著降低,该菌属微生物具有分泌吲哚-3-乙酸(IAA)的能力,而IAA是最早发现的类生长素,在细胞伸长、分裂和组织分化等方面都具有非常重要的作用[14]。相关研究发现,植物内生细菌可以促进植物的生长,在增加植物的株高、杆重以及增强植株的生长势等方面均有促进作用。内生细菌产生植物生长素、赤霉素以及细胞激动素,或诱导寄主植物产生植物激素以及增加植物对矿质元素的吸收,改变寄主植物对霜冻等有害环境条件及有害病原生物的敏感性从而促进植物的生长[19]。由此可见,使它隆主要影响玉米根系内生菌相关群落结构进而影响玉米生长。
对菌群代谢功能预测结果表明,研究所采集的15份样品中所含有的功能基因的种类大致相同,说明玉米根部相关细菌群的功能基因具有一定相似性。但是,比较同一功能基因发现,不同样品中丰度差异显著。结合图 9信息可以发现,随着玉米的生长,用于新陈代谢、环境和遗传信息处理的功能基因的丰度增加,这说明从苗期到成熟期,相关微生物的生长压力加大,加之除草剂对成熟期玉米影响较大,需要消耗更多的能量用于新陈代谢和环境适应。
| [1] |
Bu B, Yang JZ, Gong GS, Zhang M, Liu W, Song XY. Effect of plastic film mulch and herbicides on weeds and maize growth in a summer field. Weed Science, 2013, 31(3): 40-43.
(in Chinese) 补彬, 杨继芝, 龚国淑, 张敏, 刘武, 宋小宇. 地膜覆盖和除草剂对夏玉米田杂草及玉米生长发育的影响. 杂草学报, 2013, 31(3): 40-43. DOI:10.3969/j.issn.1003-935X.2013.03.009 |
| [2] |
Wang NN. The study of the community structures of endophytes within common plant species and soil microorganisms in Inner Mongolia grassland. Master Dissertation of Jiangxi Agricultural University, 2013.
(in Chinese) 王纳纳. 内蒙古草原典型植物内生菌和土壤微生物群落结构的研究. 江西农业大学硕士学位论文, 2013. |
| [3] |
Sheng Y. Effects of herbicide chlorimuron-ethyl on soil microbial ecology. Master Dissertation of Northeast Agricultural University, 2011.
(in Chinese) 盛宇. 长残留除草剂氯嘧磺隆对土壤微生物生态的影响. 东北农业大学硕士学位论文, 2011. |
| [4] |
Song XD. The study of safety and weed control effect of hormone herbicide on the naked oats. Master Dissertation of Gansu Agricultural University, 2015.
(in Chinese) 宋旭东. 激素型除草剂对裸燕麦的安全性及其除草效果研究. 甘肃农业大学硕士学位论文, 2015. |
| [5] |
Xu YR, Fang ZJ, Lu XP, Hao LJ. Effects of starane on maize soil bacterial diversity analyzed by high-throughput sequencing technology. Acta Microbiologica Sinica, 2017, 57(7): 985-993.
(in Chinese) 许艳蕊, 方志军, 卢晓平, 郝鲁江. 基于高通量测序技术分析使它隆对玉米土壤细菌多样性的影响. 微生物学报, 2017, 57(7): 985-993. |
| [6] |
Wang CL, Fang ZJ, Xu YR, Lu XP, Mu CH, Shan K, Hao LJ. Effects of starane on the community diversity of maize root endophytes analyzed using high-throughput sequencing technology. Crops, 2018(1): 160-165.
(in Chinese) 王春蕾, 方志军, 许艳蕊, 卢晓平, 穆春华, 单凯, 郝鲁江. 基于高通量测序技术分析使它隆对玉米根系内生菌多样性的影响. 作物杂志, 2018(1): 160-165. |
| [7] |
Zhao F, Zhao MZ, Wang Y, Pang FH. Biodiversity of bacteria and fungi in rhizosphere of strawberry with different continuous cropping years. Microbiology China, 2017, 44(6): 1377-1386.
(in Chinese) 赵帆, 赵密珍, 王钰, 庞夫花. 不同连作年限草莓根际细菌和真菌多样性变化. 微生物学通报, 2017, 44(6): 1377-1386. |
| [8] | Magoč T, Salzberg SL. FLASH:fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [9] | Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Peña AG, Goodrich JK, Gordon JI, Huttley GA, Kelley ST, Knights D, Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [10] | Edgar RC. Search and clustering orders of magnitude faster than BLAST. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [11] | Langille MGI, Zaneveld J, Caporaso JG, McDonald D, Knights D, Reyes JA, Clemente JC, Burkepile DE, Thurber RLV, Knight R, Beiko RG, Huttenhower C. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology, 2013, 31(9): 814-821. DOI:10.1038/nbt.2676 |
| [12] | Ramette A. Multivariate analyses in microbial ecology. FEMS Microbiology Ecology, 2007, 62(2): 142-160. DOI:10.1111/fem.2007.62.issue-2 |
| [13] |
Fang Y, Wang W, Yao XD, Peng XQ. Soil microbial community composition and environmental controls in northern temperate steppe of China. Acta Scientiarum Naturalium Universitatis Pekinensis, 2017, 53(1): 142-150.
(in Chinese) 方圆, 王娓, 姚晓东, 彭晓茜. 我国北方温带草地土壤微生物群落组成及其环境影响因素. 北京大学学报(自然科学版), 2017, 53(1): 142-150. |
| [14] |
Yu J. Diversity of root endophytic bacteria and identification of promoting growth bacteria in corn and soybean. Doctor Dissertation of Northeast Agricultural University, 2016.
(in Chinese) 喻江. 玉米和大豆根内生细菌多样性及促生细菌鉴定评价. 东北农业大学博士学位论文, 2016. |
| [15] |
Wang XC. The influence of long term rice-rice-green manure rotation on rice bulk soil and root-associated bacteria. Master Dissertation of Chinese Academy of Agricultural Sciences, 2015.
(in Chinese) 王秀呈. 稻-稻-绿肥长期轮作对水稻土壤及根系细菌群落的影响. 中国农业科学院硕士学位论文, 2015. |
| [16] |
Cui YS. Bacterial community structure and function in rhizospheric soil of Panax notoginseng. Master Dissertation of Kunming University of Science and Technology, 2017.
(in Chinese) 崔尹赡. 三七根际土壤细菌的群落结构与功能研究. 昆明理工大学硕士学位论文, 2017. |
| [17] |
Yao B, Zhang CL. Effect of three herbicides on microbial biomass C, N and respiration in paddy soil. Ecology and Environment, 2008, 17(2): 580-583.
(in Chinese) 姚斌, 张超兰. 除草剂对土壤微生物生物量碳、氮及呼吸的影响. 生态环境, 2008, 17(2): 580-583. DOI:10.3969/j.issn.1674-5906.2008.02.024 |
| [18] |
Sun SQ, Liu X, Yao Y, Gao ZG, Sun YQ, Li A. Effects of atrazine and nicosulfuron on soil microorganism. Agrochemicals, 2014, 53(4): 276-279.
(in Chinese) 孙淑清, 刘限, 姚远, 高增贵, 孙艳秋, 李安. 莠去津和烟嘧磺隆对玉米田土壤微生物的影响. 农药, 2014, 53(4): 276-279. |
| [19] |
Li X, Zhang JY, Zhang MM, Ju CM, Zheng GY, Zhang HH, Cai DJ, Hu JW, Sun GY. Effects of chemical herbicide at different spraying ways on the carbon source metabolism of soil microbial community in alfalfa rhizosphere. Acta Agrestia Sinica, 2014, 22(1): 57-64.
(in Chinese) 李鑫, 张景云, 张萌萌, 鞠成梅, 郑桂英, 张会慧, 蔡敦江, 胡举伟, 孙广玉. 化学除草剂不同施用方法对紫花苜蓿根际土壤微生物群落碳源利用的影响. 草地学报, 2014, 22(1): 57-64. |
 2019, Vol. 59
2019, Vol. 59