中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 于艳霞, 佀再勇, 曾小波, 李友国. 2019
- Yanxia Yu, Zaiyong Si, Xiaobo Zeng, Youguo Li. 2019
- 华癸中慢生根瘤菌7653R MCHK-3535基因在自生和与紫云英共生中的功能
- Role of Mesorhizobium huakuii 7653R MCHK-3535 gene in the free living condition and symbiosis with Astragalus sinicus
- 微生物学报, 59(3): 499-509
- Acta Microbiologica Sinica, 59(3): 499-509
-
文章历史
- 收稿日期:2018-04-27
- 修回日期:2018-05-22
- 网络出版日期:2018-05-26
华癸中慢生根瘤菌7653R (Mesorhizobium huakuii 7653R)属于α-变形菌纲,是一种窄宿主范围根瘤菌,豆科植物对人类社会是必不可少的,它们提供了重要的燃料、纤维素和富含蛋白的食物。在自然界中,根瘤菌可与豆科植物紫云英(Astragalus sinicus)建立共生固氮关系,根瘤菌把空气中的氮气转化为植物可以利用的氨,弥补土壤中的低氮环境[1],同时,植物为根瘤菌提供生活所必需的碳源[2],根瘤菌-豆科植物共生固氮体系每年大约固定2亿t的氮元素[3],解决了氮肥过量使用所导致的一系列环境污染问题[4]。植物能感应周边环境的变化,在植物营养缺乏时,在根际周围分泌类黄酮,根瘤菌吸附在根毛细胞顶端,从而形成共生固氮关系[5-7]。
环二鸟苷酸(c-di-GMP)是广泛存在于细菌中的第二信使分子[8],在生物膜的形成、胞外多糖的合成、Ⅲ型分泌系统及致病因子调控中发挥重要作用。在Rhizobium etli和R. leguminosarum中,异源表达DGCs时,胞内c-di-GMP浓度升高,导致EPS产量、生物膜形成及根瘤菌附着到植物根部能力均增加,运动性降低[9]。此外,c-di-GMP可能在根瘤菌和植物共生过程中发挥调节作用[10]。细胞内存在两种与c-di-GMP合成与降解相关的酶,他们分别是二鸟苷酸环化酶(DGCs)和磷酸二酯酶(PDE)。DGCs通常含有GGDEF结构域,能把2分子GTP转化为1分子的c-di-GMP;PDE含有EAL或者HD-GYP结构域,可将c-di-GMP降解为GMP或者pGpG[11]。胞内存在多种响应c-di-GMP浓度变化的效应蛋白,包括含有PilZ或GIL结构域的蛋白、退化的GGDEF结构域、核糖体开关等[12-16],从而调控下游基因的表达,影响细胞生命进程[17]。
在大豆慢生型根瘤菌Bradyrhizobium japonicum基因组中存在55个与c-di-GMP信号相关蛋白,苜蓿中慢生根瘤菌S. meliloti Rm1021中含有20个c-di-GMP信号蛋白[18],本室前期研究表明,在Mesorhizobium huakuii 7653R中存在36个与c-di-GMP信号相关蛋白,预测它们可能具有DGC、PDE活性,参与c-di-GMP的代谢过程[19]。在共生条件下,7653R MCHK-3535基因上调表达10倍,因此本实验为探究7653R MCHK-3535基因在共生固氮过程中的功能,分别构建了7653R MCHK-3535基因突变体(Δ3535)、超表达(OV3535)和互补菌株(C3535),研究各菌株在自生及共生条件下的功能。
1 材料和方法 1.1 材料 1.1.1 菌株、质粒和培养基:所用菌株和质粒见表 1。根瘤菌(Mesorhizobium huakuii 7653R)采用TY培养基,筛选突变体时采用AMS培养基,培养条件是28 ℃;大肠杆菌(Escherichia coli,E. coli)采用LB培养基,培养条件是37 ℃。
| Strains/Plasmids | Functions/Antibiotics | Source |
| E. coli DH5α | Host of recombinant plasmids | This lab |
| E. coli S17-1 | The helper strain used for conjugation | This lab |
| M. huakuii 7653R | Wide type of Mesorhizobium huakuii, Strr | This lab |
| Δ3535 | In frame deletion of MCHK-3535 from 7653R, kanr | This study |
| OV3535 | 7653R pBBR1MCS5-MCHK-3535, Gmr | This study |
| C3535 | 7653RΔMCHK-3535pBBR1MCS5-MCHK-3535, Gmr | This study |
| pMD19-T (simple) | TA cloning vector, Ampr | TaKaRa |
| pK19 mob | Mutant strains construction vector, Kanr | This lab |
| pK19-MCHK-3535 | pK19 plasimid containing MCHK-3535 gene fragment, Kanr | This study |
| pRG960 | Promoter expression vector, Sper | This lab |
| pRG960-PMCHK-3535 | pRG960 vector containing the promoter of MCHK-3535, Sper | This study |
1.1.2 植物材料:
紫云英(Astragalus sinicus)种子是信紫一号,购自河南省信阳市。
1.1.3 主要试剂和仪器:限制性内切酶、反转录酶、RNase inhibitor购自Fermentas公司,pMD19-T (simple)、DNA连接酶购自TaRaKa公司,PCR反应相关试剂、琼脂糖凝胶电泳Marker购自东盛公司;抗生素、培养基相关等分子生物学试剂均购自中国国药集团。本研究所用PCR引物的合成和DNA的测序工作由武汉天一辉远有限公司进行;荧光定量PCR仪为ABI Step One,气相色谱仪GC4000A。
1.1.4 引物:研究所用引物见表 2,引物均用Primer 5.0软件设计。
| Primers | Sequences (5'→3') | Restriction sites |
| MCHK-3535-F | GCCTTCAAGCGGTTCTACTACG | Hind Ⅲ |
| MCHK-3535-R | CCGGAATTCGCGGTGCGGACGTTCTTCT | EcoR Ⅰ |
| MCHK-3535-y-F | CCGCATCCGGTCCAAAC | |
| MCHK-3535-y-R | CCGATCTTGGAATAGACGCTTT | |
| MCHK-3535-ORF-F | CCCAAGCTTTCGGATCCATTTGATTTCTC | EcoR Ⅰ |
| MCHK-3535-ORF-R | GGAATTCCTATGCTTGCGTTTCGC | BamH Ⅰ |
| MCHK-3535-p-F | AACTGCAGGTGAATGCAGGTTGGATGGA | Pst Ⅰ |
| MCHK-3535-p-R | GGAATTCTCATGAAGTCCGCCCGG | EcoR Ⅰ |
| MCHK-3535-q-F | CACAACTGCACGCCTATTACGG | |
| MCHK-3535-q-R | GCGGTGCGGACGTTCTTCT | |
| M13-F | GAGCGGATAACAATTTCACACAGG | |
| M13-R | CGCCAGGGTTTTCCCAGTCACGAC |
1.2 生物信息学分析
利用NCBI网站查找目的基因序列,然后通过identify Conserved Domain网页分析靶蛋白的保守结构域并预测靶蛋白的功能;通过BLAST比对查找同源蛋白,挑选不同种属的同源蛋白序列,利用MEGA软件构建系统发育树。
1.3 qRT-PCR检测目的基因在自生及共生下的表达量紫云英种子经表面消毒灭菌后,平铺于素琼脂平板上,置于22 ℃光照室培养3 d,将紫云英幼苗移栽到无菌沙子中,待幼苗长出第一片真叶时,接菌华癸中慢生根瘤菌7653R,分别收取接菌后12、15、20、25、30、35、40、45、50 d的根瘤组织,抽提以上各组根瘤及自生条件下7653R中的RNA,并反转录成cDNA,以得到的cDNA为模板,以rnpB为内参基因做荧光定量PCR。qRT-PCR反应程序如下:95 ℃ 5 min;94 ℃ 30 s,60 ℃ 20 s,72 ℃ 20 s;40个循环,72 ℃ 5 min。信号检测染料使用SYBR Green,分析相对表达量采用ΔΔCT值的方法。
1.4 启动子组织表达定位分析 1.4.1 MCHK-3535启动子-GUS融合表达载体的构建:从NCBI数据库获取MCHK-3535启动子序列,以7653R总DNA为模板,经引物MCHK-3535- P-F/R PCR扩增目的片段,经连接到pMD19-T (simple)、测序、酶连等步骤,将目的片段连接到载体pRG960,构建融合表达载体pRG960-MCHK- 3535,再电转化到宿主菌7653R。
1.4.2 GUS染色显微观察:挑选紫云英种子,表面灭菌后,平铺于素琼脂平板,22 ℃光照培养2 d,将紫云英幼苗移植于无菌沙中,待长出第一片真叶时,接菌7653R (pRG960-MCHK-3535),分别收取接菌3、7、9、14、21、28 d的植物根部组织,GUS染色3–4 h后,在显微镜下观察并拍照。
1.5 MCHK-3535基因缺失突变体、超表达及互补菌株的构建 1.5.1 Δ3535突变体的筛选与鉴定:利用pK19 mob单交换插入失活的方法[20],构建MCHK-3535基因缺失突变体。以7653R基因组DNA为模板,采用MCHK-3535 F/R引物,扩增MCHK-3535同源交换臂,将产物连接到载体pMD19-T (simple),测序正确后经过双酶切后与消化的pK19载体连接,得到质粒pK19-MCHK-3535;转化E. coli S17-1,经两亲本结合转移,稀释涂布于AMS+Str+Neo平板上,经引物MCHK-3535-y-F/R及M13F/R筛选转化子,进行PCR验证突变体。
1.5.2 超表达OV3535及互补C3535菌株的构建:以华癸根瘤菌7653R基因组DNA为模板,用MCHK-3535-ORF-F/R引物,扩增得到MCHK-3535基因完整的开放阅读框,经酶切回收后与同样双酶切的载体pBBR1MCS-5酶连,构建重组表达载体pBBR5-MCHK-3535,测序正确后进行两亲本接合转移,分别将重组载体导入野生型7653R及突变体7653RΔMCHK-3535中,稀释涂布于含有相应抗性的平板上,倒置于28 ℃培养箱中,培养3–4 d后,以M13-F/R为引物,PCR验证阳性转化子。
1.6 植物盆栽实验挑选紫云英种子,表面灭菌后平铺于素琼脂平板上,置于22 ℃光照培养箱中倒置培养2 d,将幼苗移植到无菌沙子中,待紫云英长出第一片真叶时,分别接野生型7653R、突变体菌株Δ3535、超表达菌株OV3535及互补菌株C3535,以不接菌为空白对照,收取接菌后25 d植物,分别统计野生型和突变体植物的地上部分鲜重、根瘤数量、根瘤重量及固氮酶活变化。
1.7 细菌生长曲线、运动性及生物膜生成的测定平板活化野生型7653R、突变体Δ3535、超表达OV3535、互补菌株C3535,接菌于含有TY培养基的PA瓶中,28 ℃摇床振荡培养2–3 d后,按1%接种量转接到含50 mL TY培养基中,28 ℃、200 r/min摇菌,每4 h取样检测,测定λ600处的OD值,记录数据并作图分析。
运动性检测方法参考文献[21]。当菌液OD600约为0.5时,取2 μL菌液点板于20% TY半固体培养基(含0.3%琼脂),每次作3个重复,将平板置于28 ℃培养箱培养3 d,对平板拍照记录,图像处理软件GIMP version 2测量运动圈直径。
生物膜形成检测方法参考文献[22]。测定菌液浓度,用30% MM培养基稀释OD值至0.2,取100 μL接种于聚乙烯材质的96孔板中,28 ℃静置培养3 d。弃培养液并用ddH2O清洗2遍,缓慢加入1% 200 μL结晶紫溶液,静置30 min后弃上清,用去离子水冲洗3次96孔板洗去未结合生物膜的结晶紫溶液。加100 μL的80%无水乙醇-20%丙酮溶解,测定A570,计算比值A570/OD600。
2 结果和分析 2.1 生物信息学分析生物信息学分析表明,MCHK-3535基因全长1542 bp,编码513个氨基酸,包含HD-GYP、HTH-LuxR和DUF3391三个结构域(图 1)。其中HD-GYP结构域属于Ⅱ型c-di-GMP磷酸水解酶,主要参与c-di-GMP的降解;HTH-luxR结构域属于转录调控因子,两者均可以调控毒性因子合成,在细菌与植物的共生或联合共生中起到重要作用;DUF3391超家族目前功能未知。

|
| 图 1 MCHK-3535蛋白保守结构域分析 Figure 1 Putative conserved domains of MCHK-3535 protein |
分别用BLASTp和BLASTn检索,我们发现MCHK-3535的同源蛋白几乎只存在于中慢生根瘤菌(Mesorhizobium)中,且相似度较高(>90%),但没有检索到该同源蛋白在其他根瘤菌属中的存在。同时,结果显示,该同源蛋白在大量非根瘤菌中存在,但相似度较低(< 40%),如Streptacidiphilus jeojiense和Rhodococcus aetherivorans等。这些同源蛋白都标注为含HD-GYP结构域蛋白(HD domain-containing protein)。
利用MEGA 7.0软件构建系统进化树(图 2),结果显示,MCHK-3535的同源蛋白分为两簇,一簇为相似度较高的中慢生根瘤菌属(Mesorhizobium),且与百脉根根瘤菌的同源关系最近;另一簇为相似度较低的非根瘤菌属。因此,MCHK-3535同源蛋白在中慢生根瘤菌中保守性较高。

|
| 图 2 MCHK-3535同源蛋白的系统发育进化树 Figure 2 Neighbour-joining phylogenetic tree of MCHK-3535 homologue proteins.Numbers in bracket represent the sequences accession number in GenBank. The number at each branch points is the percentage supported by bootstrap. Bar, 0.05 sequence divergence |
2.2 根瘤发育过程中的基因动态表达特征
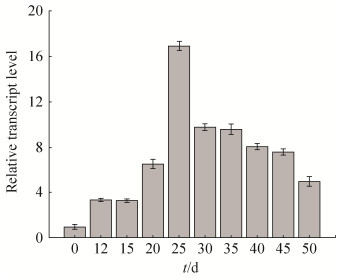
由图 3可知,7653R MCHK-3535基因在固氮时期均可表达,其中在25 d表达量最高,是自生条件的16倍,这与前期转录组数据是一致的,随后表达量逐渐下降,并趋于稳定。说明MCHK-3535基因在共生固氮的过程中发挥重要功能。
|
| 图 3 7653R MCHK-3535基因自生及共生不同时期动态表达 Figure 3 Transcript expression level during different periods.Data presented are means±standard deviations of three independent experiments |
2.3 MCHK-3535基因启动子组织表达定位
从NCBI中得到MCHK-3535基因的启动子序列,构建启动子融合载体。将启动子融合载体电转入7653R感受态中,获得菌株7653R (pRG-960- MCHK-3535)。种紫云英植物盆栽,接菌7653R (pRG-960-MCHK-3535),分别取不同接菌天数的植物根部,GUS染色,染色3–5 h,显微观察(图 4)。结果显示:MCHK-3535基因在早期侵染过程不表达(图片未展示),在第7天根瘤中开始少量表达,第9天后开始大量表达,在根瘤的侵染区、过渡区及固氮区均可观察到较高的GUS酶活性,表达持续整个固氮期,与同源基因表达谱预测结果相一致。

|
| 图 4 MCHK-3535启动子组织表达定位分析 Figure 4 Spatial pattern of MCHK-3535 gene expression in nodules.A and E: nodules of 7 d for GUS staining observation; B and F: nodules of 9 d for GUS staining observation; C and G: nodules of 15 d for GUS staining observation; D and H: nodules of 28 d for GUS staining observation. D and H: Bar=500 μm; A–C, E–G: Bar=50 μm |
2.4 共生固氮表型检测和分析
为了研究7653R MCHK-3535基因对共生固氮是否有影响,本文构建了MCHK-3535基因单交换插入突变体7653RΔMCHK-3535,同时构建了超表达OV3535及互补C3535菌株,并考察各菌株与紫云英的共生表型。结果表明(图 5),空白对照(不接菌)植物叶片黄色、长势矮小,接菌野生型7653R的紫云英叶片发绿、长势正常、根瘤粉红色,接种突变体的紫云英植株长势较高,叶片绿色,根瘤为粉红色、较大且有畸形现象,接种超表达的紫云英与野生型相比长势无明显差异,接种互补菌株的紫云英植物表型介于野生型与突变体之间,可部分恢复到野生型表型。

|
| 图 5 植物盆栽共生表型 Figure 5 Symbiotic phenotype induced by strains tested on Astragalus sinicus. A, B, C: from left to right are plants inoculated with CK, 7653R, Δ3535, OV3535 and C3535 |
分别统计野生型、突变体、超表达及互补菌植物的地上部分鲜重、根瘤数量、根瘤重量及固氮酶活。由表 3可知,与野生型7653R植株相比,突变体植株地上部分鲜重及固氮酶活性显著性升高(P < 0.05,n=9),根瘤数量及重量没有明显变化;超表达与野生型相比没有显著性差异,互补菌株各数据介于野生型和突变体之间,可部分恢复至野生型性状。
| Strains | Fresh weight of plant/(g/plant) | Number of nodules/plant | Fresh weight of nodules/(g/plant) | Nitrogen fixation activity/[μmol/(g·h)] |
| CK | 0.123c±0.090 | 0 | 0 | 0 |
| 7653R | 0.561b±0.035 | 27.780b±3.901 | 0. 039b±0.006 | 15.650b±0.869 |
| Δ3535 | 0.682a±0.060 | 22.778b±3.150 | 0.0373b±0.003 | 23.460a±0.798 |
| OV3535 | 0.522b±0.110 | 28.789b±2.030 | 0.031a±0.002 | 15.660b±1.265 |
| C3535 | 0.561b±0.110 | 31.667b±2.080 | 0.035b±0.004 | 16.560b±1.747 |
| *: The date is average of three replicates. a, b, c values in each column followed by the same letter are not significance difference (P < 0.05). | ||||
2.5 MCHK-3535基因对细胞生长及生物膜形成的影响
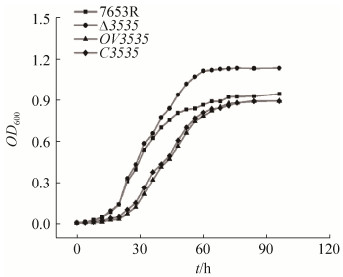
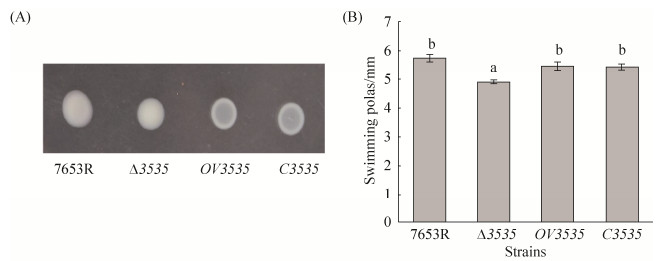
根据文献[20],本文分别测定了7653R、Δ3535、OV3535和C3535菌株的生长曲线、运动性及生物膜生成,来探究MCHK-3535基因对菌自身生长是否有影响,相对于野生型7653R,生长曲线测定结果表明(图 6),Δ3535在约40 h后进入对数生长期,生长速度略快,在稳定期的生物量增加了约30%,而超表达及互补菌株的生物量则无明显变化(前期生长速度略慢,可能是加入了抗生素的影响),说明MCHK-3535基因突变提高了菌株自身的生长速率;生物膜及运动性测定结果表明(图 7和图 8),Δ3535菌株的生物膜形成能力显著增强、运动性显著性降低(P < 0.05,n=6),互补菌株均可部分回补到野生型表型,超表达菌株无显著性变化,猜测可能是MCHK-3535基因缺失突变后,菌体的胞外基质分泌减少,从而降低了菌株的运动性。
|
| 图 6 MCHK-3535基因对菌株生长的影响 Figure 6 The impact of MCHK-3535 gene on cell growth |

|
| 图 7 MCHK-3535基因对菌株生物膜形成的影响 Figure 7 The impact of MCHK-3535 gene on biofilm formation. The date is average of three replicate. a, b, c values in each column followed by the same letter are significant difference (P < 0.05) |
|
| 图 8 MCHK-3535基因对菌株运动性的影响 Figure 8 The impact of MCHK-3535 gene on swimming ability. A: the impact of MCHK-3535 gene on the phenotype of strains; B: Analysis of halo sizes of strains. The date is average of three replicate. a, b values in each column followed by the same letter are significant difference (P < 0.05) |
3 讨论
本课题通过构建M. huakuii 7653R的MCHK-3535基因突变体,研究了该基因对紫云英- 7653R共生固氮的影响。MCHK-3535基因的缺失导致植株固氮酶活显著上升。qRT-PCR的结果显示,MCHK-3535在自生条件下仅少量表达,而在共生条件下表达量显著性升高(图 3)。此外,利用启动子-报告基因(PMCHK-3535-GUS)融合的方法,发现MCHK-3535基因在根瘤形成早期便开始表达,且一直持续到根瘤衰老阶段。由此,我们推测MCHK-3535蛋白可能通过直接或间接抑制胞内某些蛋白的活性,进而对共生固氮过程进行负调控。宿主植物与根瘤菌共生体的形成是两者分子对话和相互制约的结果。已有实验表明,根瘤菌对自身负调控确实存在于共生过程中,如SM1021中的CLR蛋白可以通过识别由植物信号诱导产生的第二信使(cAMP),抑制下游基因的表达(如SMc2178),进而减少侵染线的形成;而Clr的失活会出现侵染线显著增多的表型,但对最终的结瘤数量和固氮酶活没有影响;但是该植物信号的成分和诱导方式尚不清楚[23]。MCHK-3535也有可能是受到某种植物信号诱导,参与根瘤发育过程或者影响固氮酶活。
利用生物信息学数据,我们分析了MCHK-3535的结构与功能的保守性。MCHK-3535编码的蛋白包含3个保守结构域,其中,HD-GYP结构域蛋白属于磷酸水解酶HD家族,可将c-di-GMP降解为两分子的GMP,目前已在植物病原菌中鉴定出多个HD-GYP结构域蛋白,例如甘蓝黑腐病菌RpfG是一种磷酸二酯酶,可降解c-di-GMP及调控病原菌毒性[24],目前已经解析出HD-GYP结构域的晶体结构,发现该蛋白发挥催化活性需要金属离子的参与[25]。然而,检索数据显示,MCHK-3535同源蛋白并没有出现在除了Mesorhizobium以外的其他根瘤菌属中,却在相当数量的非根瘤菌中检索到该同源蛋白的存在(尽管保守性不高),如存在于Mycobacterium sp.中的同源蛋白,与病原菌的致病性相关[26]。根据MCHK-3535基因在根瘤菌中的分布局限及其在不同微生物中的相似序列的保守性,我们推测该基因可能是通过基因水平转移获得。
此外,本文还探究了MCHK-3535的失活对M. huakuii 7653R自生状态的影响。生长曲线测定结果表明,突变体提前到达对数期,在稳定期的生物量明显增加(约30%)。且菌体运动性降低,生物膜生成增加(约17%,图 7)。说明在野生型的7653R中,MCHK-3535可以抑制宿主的生长速率和生物量,同时抑制生物膜的形成。研究表明,菌体内高浓度的c-di-GMP,通过调控生物膜形成相关组分如纤维素的表达,促进生物膜的形成;另一方面通过促进纤毛表达,提高菌体之间的附着能力,抑制菌株运动性[27],这与本文实验结果是一致的。
因此,我们推测MCHK-3535蛋白所含的HD-GYP结构域可能参与宿主细胞中c-di-GMP的浓度调节,进而通过级联反应影响下游基因的表达。在7653R与紫云英共生过程中,MCHK-3535的负调控作用会降低根瘤菌运动性,在共生过程中也可以更有效地吸附到根毛表面,提高根瘤菌早期侵染效率,最终调控共生固氮期的固氮酶活。但是,这些表型变化是单一还是协同效应还有待深入研究。根据目前结果显示MCHK-3535蛋白在共生固氮体系中的功能并不是单一的,以后可从降解c-di-GMP或者作为转录调控因子调控固氮相关基因,来探究c-di-GMP在根瘤菌侵染、根瘤形成过程中的作用机制。这是首次在Mesorhizobium huakuii 7653R中研究与c-di-GMP相关的基因,为深入了解c-di-GMP在生物固氮体系中如何进行信号传导提供理论支持。
| [1] | Mylona P, Pawlowski K, Bisseling T. Symbiotic nitrogen fixation. The Plant Cell, 1995, 7(7): 869-885. DOI:10.1105/tpc.7.7.869 |
| [2] | Desbrosses GJ, Stougaard J. Root nodulation:a paradigm for how plant-microbe symbiosis influences host developmental pathways. Cell Host & Microbe, 2011, 10(4): 348-358. |
| [3] | Ferguson BJ, Indrasumunar A, Hayashi S, Lin MH, Lin YH, Reid DE, Gresshoff PM. Molecular analysis of legume nodule development and autoregulation. Journal of Integrative Plant Biology, 2010, 52(1): 61-76. DOI:10.1111/jipb.2010.52.issue-1 |
| [4] | Gupta S, Gajbhiye VT, Gupta RK. Effect of light on the degradation of two neonicotinoids viz acetamiprid and thiacloprid in soil. Bulletin of Environmental Contamination and Toxicology, 2008, 81(2): 185-189. DOI:10.1007/s00128-008-9405-x |
| [5] | Zipfel C, Oldroyd GED. Plant signalling in symbiosis and immunity. Nature, 2017, 543(7645): 328-336. DOI:10.1038/nature22009 |
| [6] | Müller DB, Vogel C, Bai Y, Vorholt JA. The plant microbiota:systems-level insights and perspectives. Annual Review of Genetics, 2016, 50: 211-234. DOI:10.1146/annurev-genet-120215-034952 |
| [7] | Cook DE, Mesarich CH, Thomma BPHJ. Understanding plant immunity as a surveillance system to detect invasion. Annual Review of Phytopathology, 2015, 53: 541-563. DOI:10.1146/annurev-phyto-080614-120114 |
| [8] | Hengge R. Principles of c-di-GMP signalling in bacteria. Nature Reviews Microbiology, 2009, 7(4): 263-273. DOI:10.1038/nrmicro2109 |
| [9] | Pérez-Mendoza D, Aragón IM, Prada-Ramírez HA, Romero-Jiménez L, Ramos C, Gallegos MT, Sanjuán J. Responses to elevated c-di-GMP levels in mutualistic and pathogenic plant-interacting bacteria. PLoS ONE, 2014, 9(3): e91645. DOI:10.1371/journal.pone.0091645 |
| [10] | Wang YW, Xu J, Chen AM, Wang YZ, Zhu JB, Yu GQ, Xu L, Luo L. GGDEF and EAL proteins play different roles in the control of Sinorhizobium meliloti growth, motility, exopolysaccharide production, and competitive nodulation on host alfalfa. Acta Biochimica et Biophysica Sinica, 2010, 42(6): 410-417. DOI:10.1093/abbs/gmq034 |
| [11] | Hengge R, Grundling A, Jenal U, Ryan R, Yildiz F. Bacterial signal transduction by cyclic di-GMP and other nucleotide second messengers. Journal of Bacteriology, 2016, 198(1): 15-26. DOI:10.1128/JB.00331-15 |
| [12] | Newell PD, Monds RD, O'Toole GA. LapD is a bis-(3', 5')-cyclic dimeric GMP-binding protein that regulates surface attachment by Pseudomonas fluorescens Pf0-1. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3461-3466. DOI:10.1073/pnas.0808933106 |
| [13] | Amikam D, Galperin MY. PilZ domain is part of the bacterial c-di-GMP binding protein. Bioinformatics, 2005, 22(1): 3-6. |
| [14] | Sudarsan N, Lee ER, Weinberg Z, Moy RH, Kim JN, Link KH, Breaker RR. Riboswitches in eubacteria sense the second messenger cyclic di-GMP. Science, 2008, 321(5887): 411-413. DOI:10.1126/science.1159519 |
| [15] | Fang X, Ahmad I, Blanka A, Schottkowski M, Cimdins A, Galperin MY, Romling U, Gomelsky M. GIL, a new c-di-GMP-binding protein domain involved in regulation of cellulose synthesis in enterobacteria. Molecular Microbiology, 2014, 93(3): 439-452. DOI:10.1111/mmi.12672 |
| [16] | Duerig A, Abel S, Folcher M, Nicollier M, Schwede T, Amiot N, Giese B, Jenal U. Second messenger-mediated spatiotemporal control of protein degradation regulates bacterial cell cycle progression. Genes & Development, 2009, 23(1): 93-104. |
| [17] | Conner JG, Zamorano-Sánchez D, Park JH, Sondermann H, Yildiz FH. The ins and outs of cyclic di-GMP signaling in Vibrio cholerae. Current Opinion in Microbiology, 2017, 36: 20-29. DOI:10.1016/j.mib.2017.01.002 |
| [18] | Chou SH, Galperin MY. Diversity of cyclic Di-GMP-binding proteins and mechanisms. Journal of Bacteriology, 2016, 198(1): 32-46. DOI:10.1128/JB.00333-15 |
| [19] | Peng JL, Hao BH, Liu L, Wang SM, Ma BG, Yang Y, Xie FL, Li YG. RNA-Seq and microarrays analyses reveal global differential transcriptomes of Mesorhizobium huakuii 7653R between bacteroids and free-living cells. PLoS One, 2014, 9(4): e93626. DOI:10.1371/journal.pone.0093626 |
| [20] | Abd-El-Karem Y, Elbers T, Reichelt R, Steinbüchel A. Heterologous expression of Anabaena sp. PCC7120 cyanophycin metabolism genes cphA1and cphB1 in Sinorhizobium (Ensifer) meliloti 1021. Applied Microbiology and Biotechnology, 2010, 89(4): 1177-1192. |
| [21] | Schäper S, Krol E, Skotnicka D, Kaever V, Hilker R, Søgaard-Andersen L, Becker A. Cyclic di-GMP regulates multiple cellular functions in the symbiotic Alphaproteobacterium Sinorhizobium meliloti. Journal of Bacteriology, 2015, 198(3): 521-535. |
| [22] | Robledo M, Rivera L, Jiménez-Zurdo JI, Rivas R, Dazzo F, Velázquez E, Martínez-Molina, Hirsch AM, Mateos PF. Role of Rhizobium endoglucanase CelC2 in cellulose biosynthesis and biofilm formation on plant roots and abiotic surfaces. Microbial Cell Factories, 2012, 11: 125. DOI:10.1186/1475-2859-11-125 |
| [23] | Tian CF, Garnerone AM, Mathieu-Demazière C, Masson-Boivin C, Batut J. Plant-activated bacterial receptor adenylate cyclases modulate epidermal infection in the Sinorhizobium meliloti-Medicago symbiosis. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(17): 6751-6756. DOI:10.1073/pnas.1120260109 |
| [24] | Zhang YB, Wei C, Jiang WD, Wang L, Li CR, Wang YY, Dow JM, Sun WX. The HD-GYP domain protein RpfG of Xanthomonas oryzae pv. oryzicola regulates synthesis of extracellular polysaccharides that contribute to biofilm formation and virulence on rice. PLoS ONE, 2013, 8(3): e59428. DOI:10.1371/journal.pone.0059428 |
| [25] | Lovering AL, Capeness MJ, Lambert C, Hobley L, Sockett RE. The structure of an unconventional HD-GYP protein from Bdellovibrio reveals the roles of conserved residues in this class of cyclic-di-GMP phosphodiesterases. mBio, 2011, 2(5): e00163-11. |
| [26] | Zhang Y, Kitajima M, Whittle AJ, Liu WT. Benefits of genomic insights and CRISPR-Cas signatures to monitor potential pathogens across drinking water production and distribution systems. Frontiers in Microbiology, 2017, 8: 2036. DOI:10.3389/fmicb.2017.02036 |
| [27] | Gao T, Meng Q, Gao HC. Thioesterase YbgC affects motility by modulating c-di-GMP levels in Shewanella oneidensis. Scientific Reports, 2017, 7: 3932. DOI:10.1038/s41598-017-04285-5 |
 2019, Vol. 59
2019, Vol. 59