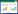中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王栋, 王少辉, 张焕容, 刘新, 许漩, 易正飞, 田明星, 丁铲, 于圣青. 2019
- Dong Wang, Shaohui Wang, Huanrong Zhang, Xin Liu, Xuan Xu, Zhengfei Yi, Mingxing Tian, Chan Ding, Shengqing Yu. 2019
- 双组分系统rcsC基因影响禽致病性大肠杆菌的致病性及相关生物学特性
- Two-component system rcsC gene affects pathogenicity and associated biological characteristics of avian pathogenic Escherichia coli
- 微生物学报, 59(3): 468-477
- Acta Microbiologica Sinica, 59(3): 468-477
-
文章历史
- 收稿日期:2018-04-17
- 修回日期:2018-06-12
- 网络出版日期:2018-07-30
2. 西南民族大学生命科学与技术学院, 四川 成都 610041
2. College of Life Science and Technology, University of Southwest Nationalities, Chengdu 610041, Sichuan Province, China
Shengqing Yu, Tel:+86-21-34293461. E-mail:yus@shvri.ac.cn
禽致病性大肠杆菌(APEC)可引起鸡、火鸡及其他禽类的大肠杆菌病,其临床症状以气囊炎、心包炎、关节滑膜炎、输卵管炎、腹膜炎和败血症为主要特征。由于APEC复杂的血清型及广泛的耐药性,严重制约禽大肠杆菌病的防控,给养禽业造成了巨大的经济损失[1]。另外,由于APEC和人源肠道外致病性大肠杆菌(extraintestinal pathogenic E.coli,ExPEC)具有共同的毒力因子及类似的致病机制,因此,APEC可通过禽类及其产品传播给人类,对人类健康及公共卫生造成潜在威胁[2-4]。
细菌进化出多种分子调控系统调整细菌的营养代谢等,从而应对外界环境变化等不利条件。其中,双组分系统(two-component system,TCS)作为细菌的中枢信号传导途径,广泛存在于细菌、古生菌和真菌,其参与压力应激、耐药性及致病力等其他信号转导途径相关基因的表达。典型的TCS由位于跨膜区作为传感器的组氨酸蛋白激酶(histidine kinase,HK)和相应的位于细胞质的反应调节蛋白(response regulator,RR)组成。另外,许多TCS还含有额外的调控辅助蛋白,在蛋白磷酸化等过程发挥作用。组氨酸激酶的传感器结构能够感应各种环境变化,并将信号传递给反应调节蛋白使其活化,从而调控靶基因的转录表达[5-6]。Rcs双组分系统广泛存在于肠杆菌科细菌中,其最初被鉴定为cps操纵子的调节因子,调控合成荚膜多糖可拉酸。Rcs是一个非典型的双组分系统,包括3个蛋白:传感器激酶RcsC (杂合激酶)、RcsD (包含组氨酸磷酸转移区域)和反应调控蛋白RcsB。研究表明,RcsC能够感受环境变化等信号,如高渗环境、膜不完整等,然后通过级联反应激活RcsB,调控靶基因的转录及表达,从而对环境的改变做出迅速适应性的调整。研究表明,Rcs双组分系统调控的靶基因主要与细菌细胞膜结构相关,表明Rcs磷酸化有助于细胞表面结构的修饰以应对外界环境的变化。Rcs双组分系统主要影响细菌的运动性、细胞分裂、生物膜形成。另外,Rcs双组分系统可以调控毒力基因的表达,在沙门菌的系统性感染过程中发挥重要作用[7-10]。然而,APEC中Rcs双组分系统的作用尚不清楚。
因此,本文利用Red同源重组系统及互补质粒构建rcsC基因缺失株及互补株,并探讨Rcs双组分系统传感器激酶RcsC对APEC相关生物学特性及致病性的影响,为进一步了解RcsC在APEC生存及致病过程中的作用以及APEC的致病机理提供参考。
1 材料和方法 1.1 菌株、质粒、细胞和实验动物菌株DE719为本实验室分离鉴定的APEC临床分离株,属于O2血清型,动物试验表明该菌株对鸡、鸭均具有致病性[11]。Red同源重组系统质粒pKD46、pKD3、pCP20及互补质粒pSTV28由本实验室保存。鸡成纤维细胞DF-1由本实验室保存。1日龄樱桃谷鸭购自江苏省江阴市某肉鸭养殖合作社。
1.2 主要试剂和仪器2×PCR Mix、DNA Marker购自北京康为世纪生物科技有限公司;高保真Taq酶购自大连宝生物(TaKaRa)工程有限公司。质粒提取试剂盒购自天根生化科技(北京)有限公司;L-阿拉伯糖,购自Sigma公司;DMEM细胞培养基、胎牛血清购自Gibco公司。PCR仪购自ABI公司;电转化仪购自Bio-Rad公司;核酸电泳仪及全自动凝胶成像系统购自上海天能科技有限公司。
1.3 引物设计根据rcsC基因及其上下游基因序列,结合Red同源重组原理设计rcsC基因缺失引物、缺失鉴定引物;根据互补质粒pSTV28设计互补引物(表 1),由英潍捷基(上海)贸易有限公司合成。
| Primer | Sequence (5'→3') | Product size/bp |
| rcsCMuUP-F | AGAGTCGAGAGGCCATCGGT | 915 |
| rcsCMuUP-R | GAAGCAGCTCCAGCCTACACCGCCAATGCTCTGAACATGT | |
| rcsCMupKD-F | ACATGTTCAGAGCATTGGCGGTGTAGGCTGGAGCTGCTTC | 1014 |
| rcsCMupKD-R | ACGATTCCCGCGATTTCCTGCATATGAATATCCTCCTTAG | |
| rcsCMuDown-F | CTAAGGAGGATATTCATATGCAGGAAATCGCGGGAATCGT | 848 |
| rcsCMuDown-R | GCCGATGACCATCCGATAGTC | |
| rcsC-F | CTGGATGCAGGAACGCTCCTG | 1885 |
| rcsC-R | CAACGTCAGTCCCAACTGACG | |
| rcsCOut-F | GCCAGTGATGACTTCTGCTGC | 4873/3085 |
| rcsCOut-R | GCAGTTATGTGAAACGCTGG | |
| rcsCCo-F | GGCGAATTCCGTAGGTGATTATCGCATCC | 3359 |
| rcsCCo-R | TATGGATCCCGATTCCCGCGATTTCCTGA | |
| dnaERT-F | GATTGAGCGTTATGTCGGAGGC | 80 |
| dnaERT-R | GCCCCGCAGCCGTGAT | |
| ompART-F | TCCAGAGCAGCCTGACCTTC | 152 |
| ompART-R | GCTGAGCCTGGGTGTTTCCT | |
| fimCRT-F | GCCGATGGTGTAAAGGATGG | 127 |
| fimCRT-R | AACTTTCCCGATCCTGTGGC | |
| aatART-F | CCGTACCCGTGTCGCTGTTAC | 98 |
| aatART-R | CAGCATTATCAGCATTGCCACT | |
| tshRT-F | GCACGAACTGGGAAGTATGGA | 118 |
| tshRT-R | GGCATAGAAACCACCACCCC | |
| fyuART-F | TTGGCGACCAGGGTAAGAGC | 145 |
| fyuART-R | AGACCCGCAGTAGGCACGAT | |
| luxSRT-F | ACGCCATTACCGTTAAGATG | 81 |
| luxSRT-R | AGTGATGCCAGAAAGAGGGA |
1.4 基因缺失株及互补株构建
根据Red同源重组系统原理及方法[12],通过扩增含有rcsC基因同源臂的氯霉素抗性片段,然后将其电转化入野生株DE719感受态细胞中,涂布氯霉素抗性平板筛选基因缺失株。挑取单克隆,采用PCR及测序鉴定rcsC基因缺失株。
以DE719的基因组DNA为模板,利用互补引物扩增rcsC基因,并构建互补质粒pSTV28-rcsC。测序正确后电转化入缺失株DE719ΔrcsC中,构建基因互补株DE719CΔrcsC。
1.5 生长曲线及运动性测定培养野生株DE719、基因缺失株DE719ΔrcsC、基因互补株DE719CΔrcsC至对数生长期,然后调整至OD600=1.0,按1:100接种于LB培养基,于37℃、200 r/min振荡培养,每小时取样并测定菌液的OD600吸光值,记录并绘制细菌生长曲线。
分别将5 μL调整至OD600=1.0的菌液点样于运动性平板(0.5%琼脂LB平板)上,37℃静置培养12 h,然后测定细菌菌圈直径。
1.6 生物被膜形成能力测定根据文献[13]方法采用96孔微孔板法测定细菌的生物被膜形成能力。培养野生株DE719、基因缺失株DE719ΔrcsC、基因互补株DE719CΔrcsC至对数生长期,然后调整至OD600=1.0,按1:100稀释于LB+0.5%葡萄糖培养基中,并加入96孔聚丙烯板中,每孔200 μL,以无菌培养基作为对照组,每组6个重复,37℃培养24 h。用无菌PBS洗涤后加入结晶紫溶液染色30 min。洗涤风干后加入95%乙醇,测定OD595吸光值。
1.7 细菌凝集沉降试验参考文献[13]方法通过测定沉降速度分析野生株、基因缺失株及互补株的凝集能力。培养野生株DE719、基因缺失株DE719ΔrcsC、基因互补株DE719CΔrcsC至对数生长期,然后调整至OD600=1.0,冰浴10 min后静置于室温,每隔30 min从菌液表面取100 μL样品,测定OD600吸光值。记录结果,绘制各菌的沉降速度曲线。
1.8 细胞黏附与侵袭试验鸡成纤维细胞DF-1细胞黏附及入侵试验参考文献[11]方法进行,培养野生株DE719、基因缺失株DE719ΔrcsC、基因互补株DE719CΔrcsC至对数生长期,用无菌PBS洗涤后以DMEM重悬,按100个感染复数(multiplicity of infection,MOI)感染DF-1细胞,于37℃、5% CO2条件下作用2 h。以无菌PBS洗涤细胞,然后用0.5% Triton-X 100裂解细胞并倍比稀释后,涂平板,菌落计数。
细胞侵袭试验与细胞黏附试验的感染方式相同,感染细胞2 h后以无菌PBS洗涤3次,用含有庆大霉素(100 μg/mL)的DMEM,于37℃、5% CO2条件下作用1 h杀死胞外细菌。然后用0.5% Triton-X 100裂解细胞并倍比稀释后,涂平板,进行菌落计数。
1.9 致病性测定参照文献[14]方法,培养野生株DE719、基因缺失株DE719ΔrcsC、基因互补株DE719CΔrcsC至对数生长期,无菌PBS洗涤、重悬,以1×105 CFU/只剂量腿部肌肉攻毒7日龄樱桃谷鸭,每组10只,攻毒后连续观察7 d,记录发病死亡情况,计算致死率。
1.10 荧光定量PCR检测毒力基因转录水平参照文献[15-16],分别提取野生株DE719、基因缺失株DE719ΔrcsC、基因互补株DE719CΔrcsC的mRNA,利用反转录试剂盒反转录为cDNA。进行荧光定量PCR检测,反应体系为20 μL:SYBRGreen PCR Master Mix 10 μL,上下游引物(表 1)各1 μL,cDNA模板为2 μL,补足ddH2O至20 μL。反应条件为:95℃ 2 min;95℃ 5 s,60℃ 10 s,40个循环。采用ΔΔCT (Livak)法[17]分析毒力基因转录水平。
2 结果和分析 2.1 基因缺失株、互补株的构建及鉴定利用Red同源重组系统及互补质粒pSTV28分别构建基因缺失株和互补株,分别挑取疑似单菌落,利用引物rcsC-F/R进行PCR鉴定,结果显示缺失株无法扩增出rcsC基因片段,而野生株和互补株可以扩增到rcsC基因目的条带(图 1)。以引物rcsCOut-F/R为引物进行PCR扩增并测序,结果表明rcsC基因缺失株及互补株构建成功。
|
| 图 1 基因缺失株、互补株的PCR鉴定 Figure 1 Identification of mutant and complementation strains by PCR.Lane 1:Wild-type strain DE719;lane 2:Mutant strain DE719ΔrcsC; lane 3:Complementation strain DE719CΔrcsC; lane 4:Negative control; M:DNA marker DM5000 |
2.2 生长曲线和运动性检测
生长曲线分析结果显示,野生株、缺失株和互补株的生长速度基本保持一致,无显著差异(图 2-A),表明rcsC基因不影响DE719的生长速度。然而,运动性结果显示基因缺失株的运动性显著高于野生株,且互补株的运动性恢复至野生株水平(P < 0.05)(图 2-B)。

|
| 图 2 不同菌株的生长曲线和运动性检测 Figure 2 Bacterial growth kinetics and motility of each strain.A:Growth curves, the values represent the average data of three experiments and the standard deviations were shown; B:Motility diameter of wild-type, mutant and complementation strains.Difference between mutant and wild-type, complementation strains were statistically significant with a P < 0.05 |
2.3 rcsC基因缺失影响生物被膜的形成
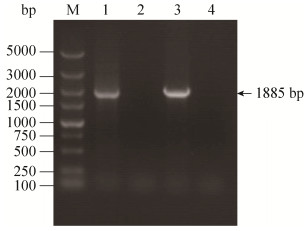
生物被膜形成能力测定结果显示,缺失rcsC基因导致APEC的生物被膜形成能力显著降低,而互补株的生物被膜形成能力得以恢复(P < 0.001;P < 0.01),表明RcsC可以抑制APEC DE719生物被膜的形成(图 3)。
|
| 图 3 生物被膜生成能力测定 Figure 3 Determination of the bacterial biofilm formation.The columns represent the mean±standard deviation of the data.Asterisks indicate statistically significant differences (**, P < 0.01;***, P < 0.001) |
2.4 rcsC基因影响APEC的凝集沉降
如图 4所示,缺失株DE719ΔrcsC的沉降速度明显高于野生株,而互补株则恢复了APEC的沉降速度及凝集能力,结果表明,rcsC基因抑制APEC的凝集及沉降。

|
| 图 4 野生株、缺失株及互补株的沉降速度 Figure 4 Settling rate of the wild-type, mutant and complementation strains.The data was represent the mean±standard deviation of the data |
2.5 细胞黏附侵袭试验
细胞黏附侵袭结果(图 5)显示,野生株、基因缺失株、互补株对DF-1细胞的黏附能力无明显差异(P>0.05);然而,基因缺失株对DF-1细胞的侵袭能力显著低于野生株,互补株的黏附能力回复至野生株水平(P < 0.001;P < 0.01),表明rcsC基因在APEC侵袭DF-1细胞过程中发挥作用。

|
| 图 5 禽致病性大肠杆菌菌株对DF-1细胞的黏附及侵袭能力 Figure 5 Adhesion and invasion capacity of APEC strains to DF-1 cells.A:Relative adhesion rate to DF-1 cells of APEC strains; B:Relative invasion rate to DF-1 cells of APEC strains.The data was represent the mean±standard deviation of the data.Asterisks indicate statistically significant differences (**, P < 0.01;***, P < 0.001) |
2.6 致病力测定
分别以1×105 CFU/只剂量的野生株DE719、缺失株DE719ΔrcsC、互补株DE719CΔrcsC感染雏鸭, 结果显示野生株、缺失株和互补株对7日龄樱桃谷鸭的致死率分别为50%(5/10)、30%(3/10)和50%(5/10)。另外, 缺失株感染组樱桃谷鸭死亡晚于野生株和互补株感染组樱桃谷鸭, 结果表明rcsC基因缺失导致APEC致病力下降。
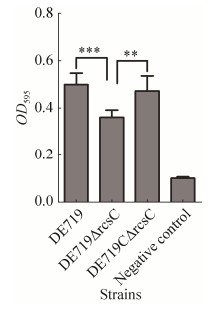
2.7 毒力基因转录水平对野生株、缺失株和互补株的毒力相关基因的转录水平分析表明,rcsC基因缺失导致ompA、aatA、fyuA和luxS基因的转录水平均显著降低(P < 0.001),而fimC和tsh基因的转录水平显著升高(P < 0.001)(图 6)。
|
| 图 6 毒力相关基因转录水平分析 Figure 6 Analysis for the transcription levels of virulence genes.Asterisks indicate statistically significant differences (***, P < 0.001). |
3 讨论
在自然环境中,细菌往往面临着环境的剧烈变化等不利条件。细菌通过多种不同的调控系统控制基因的转录表达,进而调整其营养代谢、表面结构,从而迅速适应不同环境。另外,致病菌可以通过复杂的调控网络迅速改变其毒力基因的转录表达,进而迅速适应宿主环境并导致疾病[18]。在后基因组时代,需要系统认识细菌的复杂调控网络,深入阐述细菌的调控机制,为疾病防控提供理论基础。TCS广泛存在于细菌中,其可以感应外界环境变化,如养分、渗透压力和抗生素等,通过双组分蛋白的磷酸化和去磷酸化调节细胞信号传导途径,从而调控细菌的生理代谢、压力应激、生物被膜及致病性等方面[5-6]。
APEC不仅可以引起禽大肠杆菌病,给养禽业造成严重的经济损失,而且作为人类ExPEC的毒力基因储库,严重危害人类健康及公共卫生安全[2-4]。多种毒力因子共同参与APEC感染过程,从而引起发病,目前公认的APEC的毒力因子主要包括黏附素、侵袭素、抗血清存活因子、铁摄取系统、分泌系统、TCS等。目前,已有研究表明TCS RstA/RstB和PhoP/PhoQ在APEC致病过程中发挥作用[19-20]。虽然国外研究表明Rcs双组分系统广泛存在于肠杆菌科细菌中,其主要参与细菌的运动性、荚膜合成、生物被膜形成及致病性等方面[7-10],然而,APEC中Rcs双组分系统的作用尚不清楚。因此,本研究构建Rcs双组分系统感受激酶编码基因rcsC的缺失株及互补株,并探讨RcsC对APEC生物学特性及致病性的影响。
本研究结果表明rcsC基因缺失不影响APEC的生长速度,但可以显著增强细菌的运动性。与此相同,Rcs双组分系统可以抑制大肠杆菌、沙门菌及奇异变形杆菌的泳动及丛动,这是由于Rcs双组分系统可以抑制flhDC操纵子的转录,从而负调控鞭毛的合成[21-22]。生物被膜是细菌为适应环境、增强生存能力而形成的一种膜样结构,其可提高细菌对抗生素及宿主免疫杀菌的抵抗力。研究表明,Rcs双组分系统可以调控生物被膜形成的不同过程,包括从最初的细菌附着于活组织或无活力的组织表面到生物被膜成熟为三维结构膜。Rcs双组分系统可以抑制鞭毛、抗原Ag43和卷毛等的表达,从而使细菌吸附于组织表面的能力下降。然而,Rcs双组分系统则正向调控细菌荚膜多糖的合成,其有利于生物被膜的成熟[23-25]。因此,rcsC基因缺失株的生物被膜形成能力显著降低,与大肠杆菌K12、沙门菌和奇异变形杆菌的结果一致。凝集沉降结果表明rcsC基因缺失增强了APEC的凝集沉降能力,其可能是因为rcsC缺失后鞭毛、抗原Ag43的表达增强[10],这些细菌表面结构有助于大肠杆菌的凝集。
病原菌的黏附及侵袭能力对其定殖及抵抗宿主细胞清除至关重要[26]。细胞黏附侵袭试验结果表明基因缺失株对DF-1的黏附能力无显著变化,然而缺失株比野生株的细胞侵袭能力显著降低。研究表明,荚膜在新生儿脑膜炎大肠杆菌侵袭脑血管内皮细胞过程中发挥重要作用,而rcsC缺失株的荚膜合成降低,其可能引起APEC侵袭能力下降,从而导致其对雏鸭的致病力降低。而互补株的侵袭能力及致病力恢复至野生株水平,表明RcsC在APEC的致病过程中发挥作用。另外,荧光定量PCR结果显示毒力基因ompA、aatA、fyuA和luxS基因的转录水平均显著降低,其可能是基因缺失株毒力降低的原因之一。然而,基因缺失株中fimC和tsh基因的转录水平上调,与致病力结果不一致,这可能由于细菌感染过程是由多个毒力因子共同发挥作用。并且,研究表明TCS RstA/RstB和PhoP/PhoQ也通过调控APEC的毒力基因参与调控感染及致病过程[19-20]。另外,Rcs双组分系统也参与沙门菌、耶尔森菌、肠出血性大肠杆菌等的毒力调控。通过转录组学分析发现Rcs双组分系统通过调控沙门菌毒力岛1(SPI-1)和毒力岛2(SPI-2)的表达,有助于沙门菌侵袭细胞及扩散[9, 27]。然而,Rcs双组分系统反应蛋白RcsB则通过不同方式对肠出血性大肠杆菌的LEE毒力岛发挥正调控或者负调控作用,在不同时期发挥作用。在EHEC感染的早期,RcsB通过转录调控因子GrvA上调LEE毒力岛的表达及功能,另外RcsB也可通过转录调节因子PchA抑制LEE的表达[28]。
本文通过分析RcsC对APEC的生物学特性和致病性,发现RcsC能够抑制APEC的运动能力及凝集沉降,但能够促进生物被膜的形成及致病力,为深入了解RcsC对APEC的致病作用提供参考。由于TCS广泛存在于细菌中,而未在动物和人类中发现;且TCS通过调控细菌的生长代谢,从而参与致病过程。因此,可以通过筛选鉴定TCS的抑制因子或者缺失TCS,控制病原菌的致病性,为细菌病的防控及新药研发提供理论依据[29]。
| [1] | Dou XH, Gong JS, Han XG, Xu M, Shen HY, Zhang D, Zhuang LL, Liu JS, Zou JM. Characterization of avian pathogenic Escherichia coli isolated in eastern China. Gene, 2016, 576(1 Pt 2): 244-248. |
| [2] | Bergeron CR, Prussing C, Boerlin P, Daignault D, Dutil L, Reid-Smith RJ, Zhanel GG, Manges AR. Chicken as reservoir for extraintestinal pathogenic Escherichia coli in humans, Canada. Emerging Infectious Diseases, 2012, 18(3): 415-421. |
| [3] | Tivendale KA, Logue CM, Kariyawasam S, Jordan D, Hussein A, Li GW, Wannemuehler Y, Nolan LK. Avian-pathogenic Escherichia coli strains are similar to neonatal meningitis E.coli strains and are able to cause meningitis in the rat model of human disease. Infection and Immunity, 2010, 78(8): 3412-3419. DOI:10.1128/IAI.00347-10 |
| [4] | Mora A, Viso S, López C, Alonso MP, García-Garrote F, Dabhi G, Mamani R, Herrera A, Marzoa J, Blanco M, Blanco JE, Moulin-Schouleur M, Schouler C, Blanco J. Poultry as reservoir for extraintestinal pathogenic Escherichia coli O45:K1:H7-B2-ST95 in humans. Veterinary Microbiology, 2013, 167(3/4): 506-512. |
| [5] | Stock AM, Robinson VL, Goudreau PN. Two-component signal transduction. Annual Review of Biochemistry, 2000, 69(1): 183-215. DOI:10.1146/annurev.biochem.69.1.183 |
| [6] | Koretke KK, Lupas AN, Warren PV, Rosenberg M, Brown JR. Evolution of two-component signal transduction. Molecular Biology and Evolution, 2000, 17(12): 1956-1970. DOI:10.1093/oxfordjournals.molbev.a026297 |
| [7] | Hinchliffe SJ, Howard SL, Huang YH, Clarke DJ, Wren BW. The importance of the Rcs phosphorelay in the survival and pathogenesis of the enteropathogenic yersiniae. Microbiology, 2008, 154(4): 1117-1131. DOI:10.1099/mic.0.2007/012534-0 |
| [8] | Majdalani N, Gottesman S. The Rcs phosphorelay:a complex signal transduction system. Annual Review of Biochemistry, 2005, 59: 379-405. |
| [9] | Erickson KD, Detweiler CS. The Rcs phosphorelay system is specific to enteric pathogens/commensals and activates ydeI, a gene important for persistent Salmonella infection of mice. Molecular Microbiology, 2006, 62(3): 883-894. DOI:10.1111/mmi.2006.62.issue-3 |
| [10] | Huang YH, Ferrières L, Clarke DJ. The role of the Rcs phosphorelay in Enterobacteriaceae. Research in Microbiology, 2006, 157(3): 206-212. |
| [11] | Wang SH, Dai JJ, Meng QM, Han XG, Han Y, Zhao YC, Yang DH, Ding C, Yu SQ. DotU expression is highly induced during in vivo infection and responsible for virulence and Hcp1 secretion in avian pathogenic Escherichia coli. Frontiers in Microbiology, 2014, 5: 588. |
| [12] | Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12): 6640-6645. DOI:10.1073/pnas.120163297 |
| [13] | Wang SH, Xia YJ, Dai JJ, Shi ZY, Kou YH, Li HQ, Bao YL, Lu CP. Novel roles for autotransporter adhesin AatA of avian pathogenic Escherichia coli:colonization during infection and cell aggregation. FEMS Immunology and Medical Microbiology, 2011, 63(3): 328-338. DOI:10.1111/j.1574-695X.2011.00862.x |
| [14] |
Wang D, Wang SH, Xu F, Meng QM, Liu X, Xu X, Yang DH, Han XG, Ding C, Zhang HR, Yu SQ. Effects of type Ⅵ secretion system 2 core component ClpB on the biological characteristics and virulence of avian pathogenic Escherichia coli. Chinese Veterinary Science, 2016, 46(7): 834-840.
(in Chinese) 王栋, 王少辉, 徐凤, 孟庆美, 刘新, 许漩, 杨登辉, 韩先干, 丁铲, 张焕容, 于圣青. Ⅵ型分泌系统2核心组分ClpB对禽致病性大肠杆菌生物学特性及致病性的影响. 中国兽医科学, 2016, 46(7): 834-840. |
| [15] | Wang SH, Niu CL, Shi ZY, Xia YJ, Yaqoob M, Dai JJ, Lu CP. Effects of ibeA deletion on virulence and biofilm formation of avian pathogenic Escherichia coli. Infection and Immunity, 2011, 79(1): 279-287. DOI:10.1128/IAI.00821-10 |
| [16] | Han XG, Bai H, Liu L, Dong HL, Liu R, Song J, Ding C, Qi KZ, Liu HW, Yu SQ. The luxS gene functions in the pathogenesis of avian pathogenic Escherichia coli. Microbial Pathogenesis, 2013, 55: 21-27. DOI:10.1016/j.micpath.2012.09.008 |
| [17] | Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative CT method. Nature Protocols, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [18] | Ishihama A. Prokaryotic genome regulation:multifactor promoters, multitarget regulators and hierarchic networks. FEMS Microbiology Reviews, 2010, 34(5): 628-645. DOI:10.1111/j.1574-6976.2010.00227.x |
| [19] | Gao QQ, Ye ZQ, Wang XB, Mu XH, Gao S, Liu XF. RstA is required for the virulence of an avian pathogenic Escherichia coli O2 strain E058. Infection, Genetics and Evolution, 2015, 29: 180-188. DOI:10.1016/j.meegid.2014.11.022 |
| [20] |
Li CX, Zhang YX, Qi KZ, Han XG, Tu J, Xue T, Zhou XH. The role of phoP/Q two-component system in virulence of avian pathogenic Escherichia coli. Acta Veterinaria et Zootechnica Sinica, 2016, 47(1): 157-164.
(in Chinese) 李春晓, 张宇曦, 祁克宗, 韩先干, 涂健, 薛挺, 周秀红. phoP/Q双组分系统对禽致病性大肠杆菌的毒力调控作用. 畜牧兽医学报, 2016, 47(1): 157-164. |
| [21] | Francez-Charlot A, Laugel B, van Gemert A, Dubarry N, Wiorowski F, Castanié-Cornet MP, Gutierrez C, Cam K. RcsCDB His-Asp phosphorelay system negatively regulates the flhDC operon in Escherichia coli. Molecular Microbiology, 2003, 49(3): 823-832. |
| [22] | Wang QF, Zhao YF, McClelland M, Harshey RM. The RcsCDB signaling system and swarming motility in Salmonella enterica serovar typhimurium:dual regulation of flagellar and SPI-2 virulence genes. Journal of Bacteriology, 2007, 189(23): 8447-8457. DOI:10.1128/JB.01198-07 |
| [23] | Ferrières L, Clarke DJ. The RcsC sensor kinase is required for normal biofilm formation in Escherichia coli K-12 and controls the expression of a regulon in response to growth on a solid surface. Molecular Microbiology, 2003, 50(5): 1665-1682. DOI:10.1046/j.1365-2958.2003.03815.x |
| [24] | Prigent-Combaret C, Prensier G, Le Thi TT, Vidal O, Lejeune P, Dorel C. Developmental pathway for biofilm formation in curli-producing Escherichia coli strains:role of flagella, curli and colanic acid. Environmental Microbiology, 2000, 2(4): 450-464. DOI:10.1046/j.1462-2920.2000.00128.x |
| [25] | Oropeza R, Salgado-Bravo R, Calva E. Deletion analysis of RcsC reveals a novel signalling pathway controlling poly-N-acetylglucosamine synthesis and biofilm formation in Escherichia coli. Microbiology, 2015, 161(4): 903-913. DOI:10.1099/mic.0.000050 |
| [26] | Finlay BB, Falkow S. Common themes in microbial pathogenicity revisited. Microbiology and Molecular Biology Reviews, 1997, 61(2): 136-169. |
| [27] | Mouslim C, Delgado M, Groisman EA. Activation of the RcsC/YojN/RcsB phosphorelay system attenuates Salmonella virulence. Molecular Microbiology, 2004, 54(2): 386-395. DOI:10.1111/j.1365-2958.2004.04293.x |
| [28] | Tobe T, Ando H, Ishikawa H, Abe H, Tashiro K, Hayashi T, Kuhara S, Sugimoto N. Dual regulatory pathways integrating the RcsC-RcsD-RcsB signalling system control enterohaemorrhagic Escherichia coli pathogenicity. Molecular Microbiology, 2005, 58(1): 320-333. DOI:10.1111/j.1365-2958.2005.04828.x |
| [29] | Gotoh Y, Eguchi Y, Watanabe T, Okamoto S, Doi A, Utsumi R. Two-component signal transduction as potential drug targets in pathogenic bacteria. Current Opinion in Microbiology, 2010, 13(2): 232-239. DOI:10.1016/j.mib.2010.01.008 |
 2019, Vol. 59
2019, Vol. 59