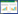中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 范玉凤, 刘广锦. 2019
- Yufeng Fan, Guangjin Liu. 2019
- 链球菌神经氨酸酶的作用机制及酶活性的测定技术
- Research Progress in production and measurement of neuraminidase from Streptococci spp.
- 微生物学报, 59(3): 433-441
- Acta Microbiologica Sinica, 59(3): 433-441
-
文章历史
- 收稿日期:2018-05-12
- 修回日期:2018-09-17
- 网络出版日期:2018-12-01
神经氨酸是一种九碳糖酸,在真核细胞和原核细胞中用于修饰细胞分子,通常位于糖结合物如糖蛋白、糖脂的末端,这些糖结合物在真核细胞表面、血清及唾液中普遍存在。细菌和流感病毒均产生神经氨酸酶。细菌的神经氨酸酶是一种水解酶,可以选择性地水解糖结合物末端的残基,从而获得游离的神经氨酸[1]。流感病毒的神经氨酸酶(Neuraminidase,NA)位于病毒囊膜表面,是同源四聚体Ⅱ型糖蛋白[2]。NA的第1个功能是糖苷外切酶,催化裂解存在于唾液酸末端、N-乙酰基神经氨酸及相邻糖基间的酮苷连接,从而破坏子代病毒颗粒血凝素与宿主细胞唾液酸的结合,使子代病毒顺利释放[3]。NA的第2个功能是作为重要抗原,在病毒感染宿主细胞时,识别细胞表面的流感病毒受体,促进病毒进入靶细胞内[4]。NA的第3个功能是免疫活性,可活化潜在的转化生长因子β,通过提高该细胞因子水平引起细胞凋亡。在病毒与细菌共感染时,NA改变另一种表面糖蛋白血凝素的糖基部分,增强一些菌株的毒力。
链球菌属的细菌种类繁多,在自然界广泛分布,多种链球菌对人畜有致病性,并且在多种链球菌中均检测出神经氨酸酶。研究表明,链球菌利用神经氨酸酶分解人和动物细胞表面、组织之间的神经氨酸,暴露宿主细胞或组织的受体位点,利于细菌黏附、定殖或穿透深入;同时,分解产生的游离神经氨酸参与链球菌营养供给,维持细菌生长。故神经氨酸酶是链球菌重要的毒力因子。本文着重对各种链球菌神经氨酸酶的作用机制、与毒力关系以及测定链球菌神经氨酸酶活性的方法作一综述,同时为细菌神经氨酸酶与流感病毒NA的区分提供了信息。
1 不同链球菌来源的神经氨酸酶的作用机制、与细菌毒力的关系 1.1 肺炎链球菌(Streptococcus pneumoniae)肺炎链球菌共产生3种不同的神经氨酸酶作为毒力蛋白,其中神经氨酸酶A (Neuraminidase A,NanA)和神经氨酸酶B (Neuraminidase B,NanB)在所有肺炎链球菌均可见,神经氨酸酶C (Neuraminidase C,NanC)仅存在于51%的菌株中[5]。生物信息学分析显示,NanA、NanB和NanC都是由多个结构域组成的大分子,分子量分别为114、77、82 kDa;3个蛋白的N端都有一个信号肽结构域[6]。三种神经氨酸酶维持细菌毒力的作用方式不同。
NanA锚定在肺炎链球菌细胞壁上,其发挥毒力作用的方式分为酶催化作用和非酶作用两类。NanA作为酶时,专一性较弱、底物范围广,可分解多种细胞表面或体液中的多糖、糖蛋白、低聚糖上的唾液酸残基[7],继而暴露鼻咽部细胞表面的黏附受体,促进细菌黏附,为肺炎链球菌的早期定植创造必要条件[8]。当使用酶抑制剂或敲除nanA基因后,细菌黏附上皮细胞的能力明显下降[9]。同时,NanA持续发挥分解唾液酸的作用,帮助肺炎链球菌从鼻咽部向下呼吸道转移[10]。当NanA不依赖酶活基团发挥作用时,一种方式是NanA促进肺炎链球菌生物被膜的形成,增强肺炎链球菌对抗菌药物和机体免疫系统的抵抗力,实验表明流感病毒神经氨酸酶抑制剂奥塞米韦等,对NanA的这种功能没有抑制效果[11];另一种方式是NanA促进脑血管内皮细胞活化产生炎症因子,使肺炎链球菌顺利穿过活化的内皮细胞进入脑内[12],这一功能通过NanA蛋白的非酶结构域LamG实现。此外,NanA引发败血症[10, 13],当细菌与流感等病毒共存时,协同加重病毒的感染。综合NanA的性质,该蛋白具有作为载体蛋白或细胞因子融合蛋白的潜力,本身也可以作为疫苗蛋白,是肺炎链球菌疫苗研发的重点[6, 14]。
NanB被分泌到细菌胞外以游离蛋白形式发挥作用,其结构是反式神经氨酸酶,专一性分解α-2, 3唾液酸产生2, 7-N乙酰神经氨酸酐[15],故NanB的作用是参与唾液酸的分解[16],保证肺炎链球菌在无葡萄糖的黏膜表面可以利用黏膜上皮细胞的神经氨酸作为自身碳源[17]。
NanC对底物的亲和力与NanA、NanB不同,NanC对α-2, 3-唾液酸乙酰乳糖胺的催化效率较高,而该底物是人类脑神经节的成分,因此NanC主要见于对脑部有侵袭力的肺炎链球菌中,辅助细菌进入脑脊液。NanC的另一个作用是分解神经氨酸酶抑制剂2-脱氧-2, 3-脱氢-N-乙酰神经氨酸(2-deoxy-2, 3-didehydro-Nacetylneuraminic acid,Neu5Ac2en),使之转化为NanA、NanB的底物N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac)。有趣的是,NanC催化的初产物就是Neu5Ac2en,当底物耗尽后,NanC转而以Neu5Ac2en为底物产生Neu5Ac[15, 18]。
肺炎链球菌神经氨酸酶的表达量受到多种因素调控。操纵子nanAB除了包含编码NanA和NanB的核苷酸序列,还包括ABC转运体、葡萄糖胺(神经氨酸代谢中间产物)摄取系统。研究发现肺炎链球菌NanA的表达量和NanB的分泌量受到唾液酸酸及代谢中间产物的调控[19],细菌生长环境中的葡萄糖会抑制NanA和NanB的表达[20]。而肺炎链球菌神经氨酸酶水解释放的游离唾液酸,又可作为促进细菌生长和扩散的信号分子,影响细菌增殖周期。NanC的操纵子独立于nanAB,在基因组上单独存在,但目前对于NanC操纵子的研究较少,其调控机制尚待阐明。
1.2 B群链球菌(无乳链球菌Streptococcus agalactiae)在兰氏分群中的B族链球菌,又称无乳链球菌(S. agalactiae),是一种可感染人、牛和鱼类等多宿主的致病菌。部分早期的B群链球菌中存在外分泌的神经氨酸酶[21],但随着时间推移,该酶作为B群链球菌毒力因子的功能逐渐弱化。对人源和牛源B群链球菌神经氨酸酶的检测表明,47.1%的人源菌和90.9%的牛源菌可在培养液上清中检出神经氨酸酶[22]。对无神经氨酸酶的B群链球菌的荚膜研究发现,这种B群链球菌的荚膜含有Neu5Ac,同时人类细胞表面的多糖抗原有且只有Neu5Ac,其他哺乳动物细胞表面有Neu5Ac和N-羟基乙酰神经氨酸(N-glycolylneuraminicacid,Neu5Gc)两种,因此无神经氨酸酶的B群链球菌感染人后可以借此成功躲避人类免疫系统的识别,利于细菌在人体内长期存活[23-24]。在B群链球菌中强制表达神经氨酸酶,反而造成细菌荚膜破坏,在血液和脑部存活时间缩短[25]。相比之下肺炎链球菌荚膜不含Neu5Ac,这从结构上解释了神经氨酸酶是肺炎链球菌普遍存在的重要毒力因子,但大部分B群链球菌人源株不产生神经氨酸酶。笔者对B群链球菌的两株强弱毒株进行比较基因组学分析,发现它们的基因组相似性可达到99%[26],但对小鼠的毒力差异明显,随后转录组测序分析强毒株的神经氨酸酶(Neul)转录水平明显低于弱毒株(P=0.00058),说明B群链球菌通过降低神经氨酸酶的表达量,来躲避机体免疫系统的识别,利于细菌的存活和毒力的发挥(尚未发表)。氨基酸序列比对表明(图 1),B群链球菌人源株(如A909)神经氨酸酶(Neul)和肺炎链球菌NanA的酶活区域有57%的相似度,但缺乏类凝集素序列LamG和膜锚定模体序列LPXTG,因此B群链球菌神经氨酸酶(Neul)丧失了类似于肺炎链球菌NanA非酶结构域的功能[25]。

|
| 图 1 肺炎链球菌、无乳链球菌和猪链球菌NanA氨基酸结构域比较 Figure 1 Schematic illustration of NanA domains in S. pneumonia, S. agalactiae and S. suis. |
有学者提出B群链球菌用透明质酸酶代替神经氨酸酶,通过破坏宿主的透明质酸实现侵袭[27],笔者所在团队也证实透明质酸酶有助于B群链球菌在动物及巨噬细胞内的存活,同时影响巨噬细胞促炎性细胞因子的表达,在B群链球菌的致病过程中发挥重要作用[28]。透明质酸酶的化学成分有N-乙酰葡萄糖胺,裂解细胞基质的透明质酸产生不饱和双糖[29];神经氨酸酶的化学成分有N-乙酰甘露糖胺,裂解细胞膜的糖链产生唾液酸,两者均为细菌自身提供生长和增殖必需的碳源和能量,并通过降解宿主组织成分,有助于细菌对宿主生物学屏障的侵袭。综上,在选择压力下B群链球菌的神经氨酸酶基因逐渐失去功能,为适应这一变化细菌可能以透明质酸酶作为毒力因子,同时利用与宿主细胞表面相同或相似的荚膜Neu5Ac实现免疫逃避。
1.3 A群链球菌(化脓链球菌S. pyogenes)和C、G、L群链球菌A群链球菌分泌少量的神经氨酸酶[30],以M4和M22两种血清型的产量最高[31]。A群链球菌神经氨酸酶对唾液类黏蛋白的催化活性最强,却无法分解与糖链相连的N-乙酰神经氨酸,这一点与肺炎链球菌和B群链球菌不同[30-31];对牛下颌腺黏蛋白也无催化活性。在C、G、L群链球菌也检测出神经氨酸酶,底物偏好、最适pH等酶学性质与A群链球菌的酶相似[32]。在毒力方面,A群链球菌的神经氨酸酶可以裂解人类免疫球蛋白上的神经氨酸,造成免疫球蛋白结构改变成为冷沉淀球蛋白,引发肾炎等疾病[33];对C、G、L群链球菌的神经氨酸酶尚无致病机理的报道。
1.4 其他群链球菌(猪链球菌,K群链球菌,口腔链球菌等)猪链球菌(S. suis)与B群链球菌类似,其荚膜成分中含有N-乙酰神经氨酸(Neu5Ac),且已有文献报道证实Neu5Ac是猪链球菌重要的毒力因子之一[34],Neu5Ac有助于2型猪链球菌黏附到巨噬细胞、单核细胞上,并随着免疫细胞透过血脑屏障[35-36]。目前,对猪链球菌的神经氨酸酶尚未有研究报道,笔者对猪链球菌基因组分析,发现有个别猪链球菌含有神经氨酸酶结构域的蛋白序列(WP_105109195.1),和肺炎链球菌NanA的酶活区域有57%的相似度,还具有2个类凝集素序列LamG (图 1),但其是否发挥神经氨酸酶的功能尚不明确。因此,我们推测猪链球菌以神经氨酸为毒力因子,与B群链球菌(同样在荚膜中含有神经氨酸)类似,神经氨酸酶在进化中逐渐失去功能。
K群链球菌(S. salivarius)的神经氨酸酶(K-salidase)大部分分泌到细菌外,少量存在于细菌内;当环境中葡萄糖过量时,K-salidase的分泌受到抑制。K-salidase的底物与A群链球菌不同,可以分解糖链相连的N-乙酰神经氨酸,如牛初乳中的N-乙酰神经氨酸乳糖;还可以催化牛下颌腺黏蛋白[37]。在人类血清中广泛存在K-salidase抗体[38],但这与链球菌病的关系尚不清楚。
口腔链球菌(S. oralis)的基因组含nanA基因、初始黏附相关基因srtA,二者共同影响口腔链球菌神经氨酸酶NanA的活性[39-40]。NanA酶裂解血小板表面的唾液酸暴露β-1, 4-半乳糖,利用口腔链球菌富含丝氨酸的黏附素使细菌黏附至血小板上,继而引起亚急性传染性心内膜炎[41]。
血链球菌(S. sanguis)与草绿色链球菌(S. viridans)的神经氨酸酶具有较强的酰基神经氨酸裂解酶活性,可破坏多种血液蛋白的神经氨酸链(如巨球蛋白、转铁蛋白、珠蛋白等),在链球菌性败血症中发挥作用[42]。综上可见,不同链球菌神经氨酸酶的催化底物与链球菌的定殖部位密切相关,链球菌的神经氨酸酶的功能各有不同(表 1),神经氨酸酶是链球菌重要的毒力因子之一。
| Source | Function |
| S. pneumoniae | Nan A: Catalysing the dissolution of sialic residue, promoting the formation of biofilm and stimulating the production of inflammatory factor; Nan B: Catalysing the sialic residue to provide the bacteria with carbon source; Nan C: Facilitating the invasion of bacteria into the brain, providing substrates for Nan A and Nan B |
| S. agalactiae | Evolutionary inactivation of neuraminidase activity in human-derived strains |
| S. pyogenes | Catalytic activity for saliva mucin and neuraminic acid of human immunoglobin |
| S. suis | Lack of research report |
| S. salivarius | Catalytic activity for glycan-linked N-acetylneuraminic acid |
| S. oralis | Catalytic activity for sialic acid on thrombocyte |
| S. sanguis and S. viridans | Catalytic activity for acetylneuraminic acid and neuraminic on plasma protein |
2 链球菌神经氨酸酶活性的测定 2.1 硫代巴比妥酸法
这是测定酶活性的早期方法[43],原理是游离的神经氨酸与硫代巴比妥酸结合形成粉色物质,可用分光光度计定量分析,主要用于测定链球菌外分泌神经氨酸酶活性。基本操作包括:培养链球菌获得上清,以N-乙酰神经氨酸乳糖等含神经氨酸链的物质为底物,菌液上清与底物孵育适当时间并以过碘酸终止反应,以亚砷酸除去过量的过碘酸后,加入硫代巴比妥酸显色并用光度计读数。操作时应设置有阳性对照与空白对照[22, 31]。
2.2 荧光底物法原理是荧光基团与神经氨酸形成的复合物作为底物,被链球菌神经氨酸酶分解释放荧光基团。一种操作方式为,以2-甲基伞形酮-α-D-N-乙酰神经氨酸(4-Methyl-Umbelliferyl-NeuAc,4MU-Neu5Ac)为底物,将该底物与链球菌培养液混合,选取4MU-Neu5Ac分解反应开始前、反应结束后2个时间点,测量底物和菌液混合物的荧光强度,根据荧光强度差和反应过程持续时间,得出荧光变化速率,以此判断酶活性[20]。另一种方式为底物与链球菌培养液反应后,加入终止物结束反应,测定荧光强度数值从而评价酶活性[44]。
2.3 吸光度测量法原理是酶促反应动力学。一种方式为设置适宜的波长,设置多组不同底物浓度、酶浓度、不同孵育时间的反应体系,测量含神经氨酸的复合物被链球菌酶分解过程中体系吸光度变化,利用动力学算式测算酶活性[45]。另外,也可以分别测量反应前、反应后的体系吸光值,根据差值测算酶活[46]。
3 小结本文综述了链球菌来源的神经氨酸酶的种类、性质、作用机制的研究进展,并对神经氨酸酶活性的检测方法作了简要介绍。
肺炎链球菌以神经氨酸酶作为毒力因子的机制研究得最为完善:NanA起致病作用,作为细菌侵袭、扩散的主要毒力因子;NanB、NanC起辅助作用,NanB为细菌提供碳源,NanC为NanB、NanC提供底物;对NanA、NanB共同的操纵子的研究也较为深入。B群链球菌和猪链球菌在进化过程中,菌体的荚膜成分中含有的神经氨酸是它们实现免疫逃避的方式之一,推测它们的神经氨酸酶作为毒力因子的作用逐渐丧失。对NanA氨基酸序列比对表明(图 1),相比肺炎链球菌,无乳链球菌的NanA缺失了类凝集素序列LamG和膜锚定模体序列LPXTG,猪链球菌缺失LPXTG,这些缺失可能导致这两种细菌神经氨酸酶无生物学活性。对于这些荚膜中含有神经氨酸成分的链球菌,其神经氨酸酶的功能如何在进化中发生转变,主要的选择压力有哪些,值得开展相关的分析研究,为链球菌与宿主间的相互作用加以补充。在血链球菌和口腔链球菌中,神经氨酸酶有助于细菌在血液中扩散。在A、C、G、L、K群链球菌中,已有的研究确认这些细菌产生有催化活性的神经氨酸酶,但对神经氨酸酶的基因调控、致病机制的研究较少,建议以肺炎链球菌神经氨酸酶的研究为参考,从链球菌的主要定植部位入手,对上述细菌的神经氨酸酶与宿主组织相互作用开展深入研究,使得链球菌神经氨酸酶的作用机制、转录调控的研究更加完善。
测定神经氨酸酶活性,早期的方法是使用分光光度计,测定酶解产生的游离神经氨酸与硫代巴比妥酸产生的有色物质。随着技术进步,目前有荧光底物分解法、紫外-可见分光光度计测定吸光度变化、液相色谱等方法,荧光底物分解法、吸光度变化测定这两种方法便于在一般实验室实现,因此在实验研究中使用较多。在实际操作中可尽可能地提高酶的纯度、增加检测的次数、设置预实验优化波长等,以提高测定结果的稳定性和准确性。
| [1] | Ketterer MR, Rice PA, Gulati S, Kiel S, Byerly L, Fortenberry JD, Soper DE, Apicella MA. Desialylation of Neisseria gonorrhoeae lipooligosaccharide by cervicovaginal microbiome sialidases: the potential for enhancing infectivity in men. The Journal of Infectious Diseases, 2016, 214(11): 1621-1628. DOI:10.1093/infdis/jiw329 |
| [2] | Saito T, Taylor G, Webster RG. Steps in maturation of influenza a virus neuraminidase. Journal of Virology, 1995, 69(8): 5011-5017. |
| [3] |
Wang QY, Qiao CL, Shen ZY. The structure and biology function of avian influenza virus neuraminidase. Progress in Veterinary Medicine, 2005, 26(12): 40-43.
(in Chinese) 王全英, 乔传玲, 申之义. 禽流感病毒神经氨酸酶的结构及其生物学功能. 动物医学进展, 2005, 26(12): 40-43. DOI:10.3969/j.issn.1007-5038.2005.12.009 |
| [4] | Horimoto T, Kawaoka Y. Pandemic threat posed by avian influenza a viruses. Clinical Microbiology Reviews, 2001, 14(1): 129-149. DOI:10.1128/CMR.14.1.129-149.2001 |
| [5] | Pettigrew MM, Fennie KP, York MP, Daniels J, Ghaffar F. Variation in the presence of neuraminidase genes among Streptococcus pneumoniae isolates with identical sequence types. Infection and Immunity, 2006, 74(6): 3360-3365. DOI:10.1128/IAI.01442-05 |
| [6] |
Chen QH, Huang HC, Li ZN, Xu GG. Study on the key virulence factor neuraminidase Nan A in Streptococcus pneumoniae. China Journal of Modern Medicine, 2014, 24(8): 22-25.
(in Chinese) 陈乾华, 黄汉琮, 李泽年, 徐国纲. 肺炎链球菌主要毒力蛋白神经氨酸酶Nan A的基本特性研究. 中国现代医学杂志, 2014, 24(8): 22-25. DOI:10.3969/j.issn.1005-8982.2014.08.005 |
| [7] | Williamson YM, Gowrisankar R, Longo DL, Facklam R, Gipson IK, Ades EP, Carlone GM, Sampson JS. Adherence of nontypeable Streptococcus pneumoniae to human conjunctival epithelial cells. Microbial Pathogenesis, 2008, 44(3): 175-185. DOI:10.1016/j.micpath.2007.08.016 |
| [8] | Kadioglu A, Weiser JN, Paton JC, Andrew PW. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nature Reviews Microbiology, 2008, 6(4): 288-301. DOI:10.1038/nrmicro1871 |
| [9] | Wren JT, Blevins LK, Pang B, Basu Roy A, Oliver MB, Reimche JL, Wozniak JE, Alexander-Miller MA, Swords WE. Pneumococcal neuraminidase a (NanA) promotes biofilm formation and synergizes with influenza a virus in nasal colonization and middle ear infection. Infection and Immunity, 2017, 85(4): e01044-16. DOI:10.1128/IAI.01044-16 |
| [10] | Manco S, Hernon F, Yesilkaya H, Paton JC, Andrew PW, Kadioglu A. Pneumococcal neuraminidases A and B both have essential roles during infection of the respiratory tract and sepsis. Infection and Immunity, 2006, 74(7): 4014-4020. DOI:10.1128/IAI.01237-05 |
| [11] | Walther E, Richter M, Xu Z, Kramer C, von Grafenstein S, Kirchmair J, Grienke U, Rollinger JM, Liedl KR, Slevogt H, Sauerbrei A, Saluz HP, Pfister W, Schmidtke M. Antipneumococcal activity of neuraminidase inhibiting artocarpin. International Journal of Medical Microbiology, 2015, 305(3): 289-297. DOI:10.1016/j.ijmm.2014.12.004 |
| [12] | Banerjee A, van Sorge NM, Sheen TR, Uchiyama S, Mitchell TJ, Doran KS. Activation of brain endothelium by pneumococcal neuraminidase NanA promotes bacterial internalization. Cellular Microbiology, 2010, 12(11): 1576-1588. |
| [13] | Yesilkaya H, Manco S, Kadioglu A, Terra VS, Andrew PW. The ability to utilize mucin affects the regulation of virulence gene expression in Streptococcus pneumoniae. FEMS Microbiology Letters, 2008, 278(2): 231-235. DOI:10.1111/fml.2008.278.issue-2 |
| [14] |
Li MJ, Cao J, Min X, Cai YY, Yin YB, Zhang XM, Wang H. Prokaryotic expression, purification and protective effects of nanA protein of Streptococcus pneumonia. Chinese Journal of Biologicals, 2015, 28(7): 688-692.
(in Chinese) 黎美君, 曹炬, 闵讯, 蔡莺莺, 尹一兵, 张雪梅, 王虹. 肺炎链球菌神经氨酸酶nanA蛋白的原核表达、纯化及其免疫保护效果. 中国生物制品学杂志, 2015, 28(7): 688-692. |
| [15] | Xu GG, Kiefel MJ, Wilson JC, Andrew PW, Oggioni MR, Taylor GL. Three Streptococcus pneumoniae sialidases: three different products. Journal of the American Chemical Society, 2011, 133(6): 1718-1721. DOI:10.1021/ja110733q |
| [16] | Xu H, Sullivan TJ, Sekiguchi JI, Kirikae T, Ojima I, Stratton CF, Mao WM, Rock FL, Alley MRK, Johnson F, Walker SG, Tonge PJ. Mechanism and inhibition of saFabI, the enoyl reductase from Staphylococcus aureus. Biochemistry, 2008, 47(14): 4228-4236. DOI:10.1021/bi800023a |
| [17] | Marion C, Burnaugh AM, Woodiga SA, King SJ. Sialic acid transport contributes to pneumococcal colonization. Infection and Immunity, 2011, 79(3): 1262-1269. DOI:10.1128/IAI.00832-10 |
| [18] | Owen CD, Lukacik P, Potter JA, Sleator O, Taylor GL, Walsh MA. Streptococcus Pneumoniae NanC: structural insights into the specificity and mechanism of a sialidase that produces a sialidase inhibitor. The Journal of Biological Chemistry, 2015, 290(46): 27736-27748. DOI:10.1074/jbc.M115.673632 |
| [19] | Chang YC, Uchiyama S, Varki A, Nizet V. Leukocyte inflammatory responses provoked by pneumococcal sialidase. mBio, 2012, 3(1): e00220-11. DOI:10.1128/mBio.00220-11 |
| [20] | Gualdi L, Hayre JK, Gerlini A, Bidossi A, Colomba L, Trappetti C, Pozzi G, Docquier JD, Andrew P, Ricci S, Oggioni MR. Regulation of neuraminidase expression in Streptococcus pneumoniae. BMC Microbiology, 2012, 12: 200. DOI:10.1186/1471-2180-12-200 |
| [21] | Milligan TW, Straus DC, Mattingly SJ. Extracellular neuraminidase production by group B Streptococci. Infection and Immunity, 1977, 18(1): 189-195. |
| [22] | Ekin IH, Gurturk K, Ilhan Z, Ekin S, Borum AE, Arabaci C, Yesilova A. Detection and comparison of neuraminidase activities in human and bovine group B Streptococci. APMIS, 2016, 124(12): 1093-1098. DOI:10.1111/apm.2016.124.issue-12 |
| [23] | Varki A. Multiple changes in sialic acid biology during human evolution. Glycoconjugate Journal, 2009, 26(3): 231-245. DOI:10.1007/s10719-008-9183-z |
| [24] | Chang YC, Nizet V. The interplay between Siglecs and sialylated pathogens. Glycobiology, 2014, 24(9): 818-825. DOI:10.1093/glycob/cwu067 |
| [25] | Yamaguchi M, Hirose Y, Nakata M, Uchiyama S, Yamaguchi Y, Goto K, Sumitomo T, Lewis AL, Kawabata S, Nizet V. Evolutionary inactivation of a sialidase in group B Streptococcus. Scientific Reports, 2016, 6: 28852. DOI:10.1038/srep28852 |
| [26] | Liu GJ, Zhang W, Lu CP. Comparative genomics analysis of Streptococcus agalactiae reveals that isolates from cultured tilapia in China are closely related to the human strain A909. BMC Genomics, 2013, 14: 775. DOI:10.1186/1471-2164-14-775 |
| [27] |
Wang Y. The neuraminidase B in group B streptococcus is actually a hyaluronidase. Foreign Medicine (Microbiology Section), 1994, 17(3): 137.
(in Chinese) 王云. B群链球菌神经氨酸酶实际上是一种透明质酸酶. 国外医学(微生物学分册), 1994, 17(3): 137. |
| [28] | Wang ZF, Guo CM, Xu YN, Liu GJ, Lu CP, Liu YJ. Two novel functions of hyaluronidase from Streptococcus agalactiae are enhanced intracellular survival and inhibition of proinflammatory cytokine expression. Infection and Immunity, 2014, 82(6): 2615-2625. DOI:10.1128/IAI.00022-14 |
| [29] |
Wang ZF. Construction and characterization of hylb and MP deleted mutant srain in piscine streptococcus agalactiae. Master Dissertation of Nanjing Agricultural University, 2014. (in Chinese) 王兆飞.鱼源无乳链球菌透明质酸酶和金属蛋白酶基因缺失株构建及特性分析.南京农业大学硕士学位论文, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016038636.htm |
| [30] | Hayano S, Tanaka A, Okuyama Y. Distribution and serological specificity of sialidase produced by various groups of streptococci. Journal of Bacteriology, 1969, 100(1): 354-357. |
| [31] | Davis L, Baig MM, Ayoub EM. Properties of extracellular neuraminidase produced by group A Streptococcus. Infection and Immunity, 1979, 24(3): 780-786. |
| [32] | Hayano S, Tanaka A. Sialidase-like enzymes produced by group A, B, C, G, and L streptococci and by Streptococcus sanguis. Journal of Bacteriology, 1969, 97(3): 1328-1333. |
| [33] | Griswold WR, McIntosh JR, Weil Ⅲ R, McIntosh RM. Neuraminidase treated homologous IgG and immune deposit renal disease in inbred rats. Experimental Biology and Medicine, 1975, 148(4): 1018-1024. DOI:10.3181/00379727-148-38680 |
| [34] |
Dong RP. Studies on the pathogenic roles of sialic acid in streptococcus suis serotype 2. Master Dissertation of Nanjing Medical University, 2009. (in Chinese) 董瑞萍.唾液酸与2型猪链球菌致病性关系的研究.南京医科大学硕士学位论文, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10312-1010011307.htm |
| [35] | Segura M, Gottschalk M. Streptococcus suis interactions with the murine macrophage cell line J774: adhesion and cytotoxicity. Infection and Immunity, 2002, 70(8): 4312-4322. DOI:10.1128/IAI.70.8.4312-4322.2002 |
| [36] | Gottschalk M, Segura M. The pathogenesis of the meningitis caused by Streptococcus suis: the unresolved questions. Veterinary Microbiology, 2000, 76(3): 259-272. DOI:10.1016/S0378-1135(00)00250-9 |
| [37] | Hayano S, Tanaka A. Streptococcal sialidase Ⅰ. isolation and properties of sialidase produced by group K Streptococcus. Journal of Bacteriology, 1967, 93(6): 1753-1757. |
| [38] | Hayano S, Tanaka A. Streptococcal sialidase Ⅱ. Kinetic and immunological studies of sialidase produced by group K streptococcus. Journal of Bacteriology, 1968, 95(5): 1551-1554. |
| [39] | Reichmann P, Nuhn M, Denapaite D, Brückner R, Henrich B, Maurer P, Rieger M, Klages S, Reinhard R, Hakenbeck R. Genome of Streptococcus oralis strain Uo5. Journal of Bacteriology, 2011, 193(11): 2888-2889. DOI:10.1128/JB.00321-11 |
| [40] | Beighton D, Whiley RA. Sialidase activity of the "Streptococcus milleri group" and other viridans group streptococci. Journal of Clinical Microbiology, 1990, 28(6): 1431-1433. |
| [41] | Singh AK, Woodiga SA, Grau MA, King SJ. Streptococcus oralis neuraminidase modulates adherence to multiple carbohydrates on platelets. Infection and Immunity, 2017, 85(3): e00774-16. DOI:10.1128/IAI.00774-16 |
| [42] | Muller HE. Neuraminidase activity in Streptococcus sanguis and in the viridans group, and occurrence of acylneuraminate lyase in viridans organisms isolated from patients with septicemia. Infection and Immunity, 1974, 9(2): 323-328. |
| [43] | Aminoff D. Methods for the quantitative estimation of N-acetylneuraminic acid and their application to hydrolysates of sialomucoids. Biochemical Journal, 1961, 81(2): 384-392. DOI:10.1042/bj0810384 |
| [44] | Xu GG, Potter JA, Russell RJM, Oggioni MR, Andrew PW, Taylor GL. Crystal structure of the NanB sialidase from Streptococcus pneumoniae. Journal of Molecular Biology, 2008, 384(2): 436-449. |
| [45] | Hayre JK, Xu GG, Borgianni L, Taylor GL, Andrew PW, Docquier JD, Oggioni MR. Optimization of a direct spectrophotometric method to investigate the kinetics and inhibition of sialidases. BMC Biochemistry, 2012, 13: 19. DOI:10.1186/1471-2091-13-19 |
| [46] | Xu G, Li X, Andrew PW, Taylor GL. Structure of the catalytic domain of Streptococcus pneumoniae sialidase NanA. Acta Crystallographica Section F: Structural Biology Communications, 2008, 64(9): 772-775. DOI:10.1107/S1744309108024044 |
 2019, Vol. 59
2019, Vol. 59